Modulbeschreibung
Werbung
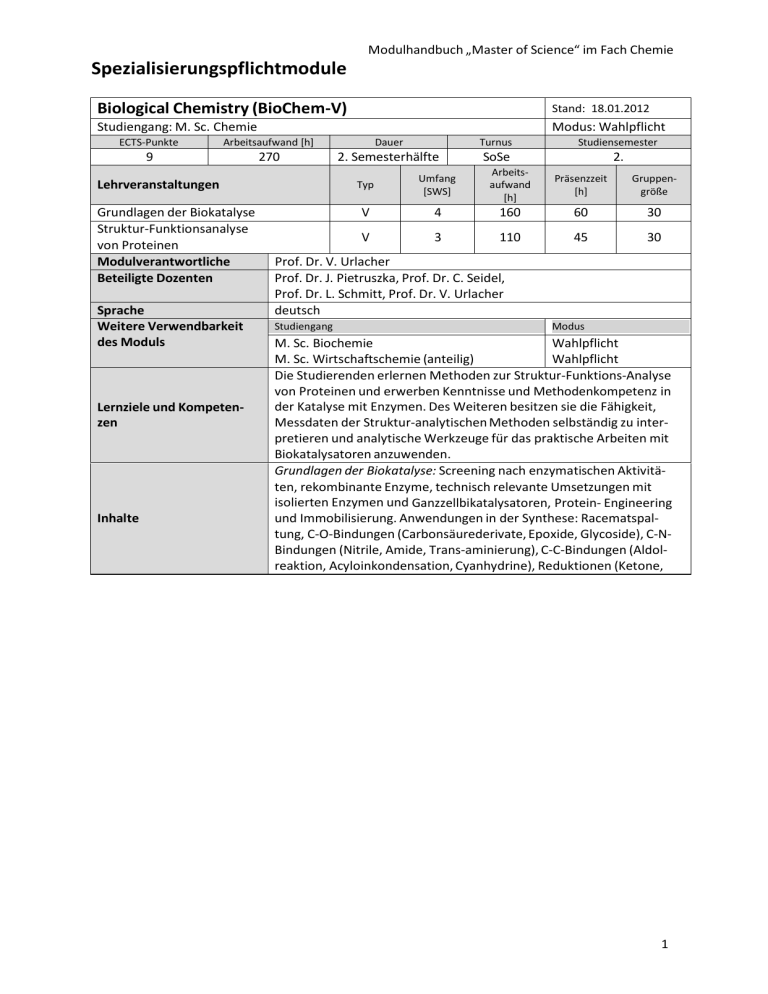
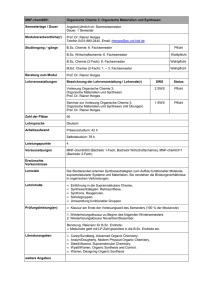
Spezialisierungspflichtmodule Modulhandbuch „Master of Science“ im Fach Chemie Biological Chemistry (BioChem‐V) Stand: 18.01.2012 Studiengang: M. Sc. Chemie ECTS‐Punkte 9 Arbeitsaufwand [h] 270 Lehrveranstaltungen Grundlagen der Biokatalyse Struktur‐Funktionsanalyse von Proteinen Modulverantwortliche Beteiligte Dozenten Sprache Weitere Verwendbarkeit des Moduls Lernziele und Kompeten‐ zen Inhalte Modus: Wahlpflicht Dauer 2. Semesterhälfte Typ Umfang [SWS] V 4 V 3 Turnus SoSe Studiensemester 2. Arbeits‐ aufwand [h] Präsenzzeit [h] Gruppen‐ größe 160 60 30 110 45 30 Prof. Dr. V. Urlacher Prof. Dr. J. Pietruszka, Prof. Dr. C. Seidel, Prof. Dr. L. Schmitt, Prof. Dr. V. Urlacher deutsch Studiengang Modus M. Sc. Biochemie Wahlpflicht M. Sc. Wirtschaftschemie (anteilig) Wahlpflicht Die Studierenden erlernen Methoden zur Struktur‐Funktions‐Analyse von Proteinen und erwerben Kenntnisse und Methodenkompetenz in der Katalyse mit Enzymen. Des Weiteren besitzen sie die Fähigkeit, Messdaten der Struktur‐analytischen Methoden selbständig zu inter‐ pretieren und analytische Werkzeuge für das praktische Arbeiten mit Biokatalysatoren anzuwenden. Grundlagen der Biokatalyse: Screening nach enzymatischen Aktivitä‐ ten, rekombinante Enzyme, technisch relevante Umsetzungen mit isolierten Enzymen und Ganzzellbikatalysatoren, Protein‐ Engineering und Immobilisierung. Anwendungen in der Synthese: Racematspal‐ tung, C‐O‐Bindungen (Carbonsäurederivate, Epoxide, Glycoside), C‐N‐ Bindungen (Nitrile, Amide, Trans‐aminierung), C‐C‐Bindungen (Aldol‐ reaktion, Acyloinkondensation, Cyanhydrine), Reduktionen (Ketone, 1 Imine) und Oxidationen (C‐H‐ und C=C‐Bindungen, Alkohole, Amine, Modulhandbuch „Master of Science“ im Fach Chemie Carbonyle). Struktur‐Funktionsanalyse von Proteinen: Grundlagen von Protein‐ strukturen; Strukturbildende Elemente (Primär‐, Sekundär‐, Tertiär‐, Quartärstruktur); an Hand ausgewählter Proteinfamilien (Proteasen, Nukleotid‐bindende Proteine, Immunglobuline) soll durch die dreidi‐ mensionale Struktur die Funktion und auch die Bedeutung von Muta‐ tionen auf die Aktivität analysiert werden. An Hand dieser Strukturen sollen auch die unterschiedlichen Liganden‐Erkennungsmechanismen erläutert werden. Biophysikalische Grundlagen der Strukturbildung, Dynamik, und Stabi‐ lität von insbesondere Proteinen und Nukleinsäuren, Überblick über die spektroskopischen Methoden zur Strukturanalyse und Kinetik. Arten der intramolekularen Wechselwirkungen und Einfluss äußerer Faktoren. Modelle, Vorhersagen. Teilnahmevoraussetzungen Studienleistungen (u.a. als Zulassungsvoraussetzung zur Modulprüfung) Prüfungen Grundkenntnisse in der Biochemie und Synthesechemie Aktive und regelmäßige Teilnahme an den Modulveranstaltungen. Prüfungsform Dauer [min] Klausur zum Gesamtmodul 120 Stellenwert der Note für die Endnote Medienformen Tafel, Projektor http://www.chemie.uni‐duesseldorf.de/Faecher/Biochemie Webseite Literatur benotet/unbenotet benotet 16/135 K. Faber, Biotransformations in Organic Chemistry, Springer, 2004; R.D Schmid, Taschenatlas „Biotechnologie und Gentechnik“, Wiley‐VCH, 2006; Branden und Toze ‚Introduction to protein structure’ Garland Publisher, 1999; Charles R. Cantor, Paul R. Schimmel; Biophysical Chemistry, Freeman, New York 1998 2 Modulhandbuch „Master of Science“ im Fach Chemie Biological Chemistry (BioChem‐P) Stand: 18.01.2012 Studiengang: M. Sc. Chemie ECTS‐Punkte 7 Arbeitsaufwand [h] 210 2. Semesterhälfte Lehrveranstaltungen BioChem‐Praktikum BioChem‐Seminar Modulverantwortliche Beteiligte Dozenten Sprache Weitere Verwendbarkeit des Moduls Lernziele und Kompeten‐ zen Inhalte Teilnahmevoraussetzungen Studienleistungen (u.a. als Zulassungsvoraussetzung zur Modulprüfung) Prüfungen Modus: Wahlpflicht Dauer Typ Umfang [SWS] Turnus Studiensemester SoSe Arbeits‐ aufwand [h] 2. Präsenzzeit [h] Gruppen‐ größe 105 30 15 30 PExp 7 150 Sem 2 60 Prof. Dr. V. Urlacher Prof. Dr. J. Pietruszka, Prof. Dr. C. Seidel, Prof. Dr. L. Schmitt, Prof. Dr. V. Urlacher deutsch Studiengang Modus M. Sc. Biochemie Wahlpflicht M. Sc. Wirtschaftschemie (anteilig) Wahlpflicht Die Studierenden erlernen Methoden zur Struktur‐Funktions‐Analyse von Proteinen und erwerben Kenntnisse und Methodenkompetenz in der Katalyse mit Enzymen. Desweiteren besitzen sie die Fähigkeit, Messdaten der Struktur‐analytischen Methoden selbständig zu inter‐ pretieren und analytische Werkzeuge für das praktische Arbeiten mit Biokatalysatoren anzuwenden. Praktikum einschl. Übungen und Seminar Angewandte Proteinbiochemie. Herstellung von rekombinanten Prote‐ inen, Durchführung enzymatischer Reaktionen im einphasigen und im zweiphasigen System, Vergleich von Reaktionen mit Ganzzellbiokataly‐ satoren und isolierten Enzymen. Synthesen von nichtnatürlichen Sub‐ straten für die Enzymkatalyse, Produktcharakterisierung mit Hilfe von Vergleichssubstanzen, Enantiomerenanalytik, enzymatische Umset‐ zung. An einem ausgewählten Beispiel soll der Einfluss einer Mutation auf die katalytische Aktivität eines Enzyms bestimmt werden. Hierzu ist die Anzucht von Bakterien, die Aufreinigung des Proteins und die Bestim‐ mung seiner enzymatischen Aktivität nötig. Messung, Bearbeitung und Darstellung von biomolekularen Struktu‐ ren, Beschreibung und Messung von Bindungsisothermen. Grundkenntnisse in der Biochemie und Synthesechemie Vortrag der Teilnehmer zum Stoff der Vorlesung unter Nutzung von Büchern und Originalarbeiten (Vortragssprache Deutsch oder Englisch nach Wahl); Protokoll zum Praktikum Prüfungsform Dauer [min] Stellenwert der Note für die Endnote Medienformen Tafel, Projektor http://www.chemie.uni‐duesseldorf.de/Faecher/Biochemie Webseite Literatur benotet/unbenotet unbenotet Skript zum Praktikum; McMurry, Begley ‘Organische Chemie der biologischen Stoffwechselwege’, Spektrum Akademischer Verlag, 2006; Kensal E. van Holde, W. Curtis Johnson, P. Shing Ho, Principles of Physical Biochemis‐ try, Prentice Hall 1998. 3