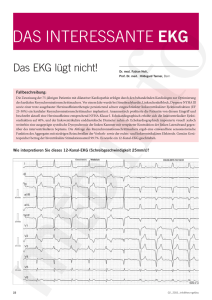
Spezifität und Sensitivität elektrokardiographischer Veränderungen
Werbung

Aus der Medizinischen Klinik II des Marienhospitals Herne Universitätsklinik der Ruhr-Universität Bochum Direktor: Prof. Dr. med. H.-J. Trappe Spezifität und Sensitivität elektrokardiographischer Veränderungen bei Patienten mit mittels der kardiovaskulären Magnetresonanztomographie nachgewiesenem nicht-transmuralen und transmuralen chronischen Myokardinfarkt Inaugural – Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Binu Sebastian John-Puthenveettil aus Paderborn 2007 Dekan: Referent: Prof. Dr. med. G. Muhr Prof. Dr. med. H.-J. Trappe Koreferent: Prof. Dr. med. Dieter Horstkotte Tag der mündlichen Prüfung: 25.10.2007 2 Meinen Eltern und meiner Tante Maria gewidmet. 3 ABSTRACT John-Puthenveettil Binu Sebastian Spezifität und kardiovaskulären Sensitivität elektrokardiographischer Magnetresonanztomographie Veränderungen nachgewiesenem bei Patienten nicht-transmuralen mit und mittels der transmuralen chronischen Myokardinfarkt. Problem: Das 12-Kanal-Elektrokardiogramm (EKG) ermöglicht im klinischen Alltag die Diagnose von Myokardinfarkten und deren Lokalisation im Bereich des Herzens. Allein durch das EKG ist die Unterscheidung zwischen nicht-transmuralen (nt) und transmuralen (t) Myokardinfarkten schwierig. Q-Zacken werden zur Detektion von chronischen Infarkten eingesetzt. Durch die kontrastmittelverstärkte kardiovaskuläre Magnetresonanztomographie (K-CMR) ist es möglich, die transmurale Ausdehnung eines Myokardinfarktes exakt zu bestimmen. Ferner kann die Lokalisation des Infarktes und die Berechnung der infarzierten Myokardmasse durchgeführt werden. Wir evaluierten erstmals in vivo das EKG hinsichtlich der Unterscheidung zwischen t- und nt-Infarkten sowie der Bestimmung der Infarktlokalisation und untersuchten die Sensitivität von Q-Zacken bezüglich Präsenz und Transmuralität der chronischen Myokardinfarkte. Die Kontrast-CMR diente als Goldstandard. Methode: 90 Patienten (64.6 ±11.1 Jahre) mit stattgehabtem Infarkt in der Vorgeschichte (Infarktalter 7.4 ±3.6 Monate) wurden im Rahmen einer prospektiv angelegten Studie mittels der K-CMR (1,5 Tesla Scanner, Magnetom, Siemens, Erlangen, Deutschland) untersucht. Bilder im horizontalen und vertikalen Längsachsenschnitt sowie in 3 Kurzachsenschnitten wurden mit einer Gradienten-Echo-Sequenz (segmented FLASH) 15 Min nach Gabe von 0,15 mmol pro kg Körpergewicht Gadolinium-DTPA (Firma Schering, Deutschland) akquiriert. Bei allen Patienten wurde vor der K-CMR ein 12-Kanal-EKG (Marquette MAC 1200, Marquette Hellige, Freiburg) abgeleitet. Bei einer Untergruppe von 41 Patienten (61.3 ± 11.4 Jahre) wurde zusätzlich die Infarktmasse nach der Formel Infarktfläche (cm²) x Schichtdicke (cm) x 1.05 g/cm berechnet. Ergebnis: 45 Patienten wiesen einen t-Infarkt, 45 Patienten einen nt-Infarkt auf. Die Häufigkeit von Q-Zacken ist bei transmuralen und nicht-transmuralen Myokardinfarkten nicht signifikant unterschiedlich (p=0.183). Die Sensitivität des EKG bezüglich der Infarktlokalisation war bei inferioren Infarkten am höchsten (61,9%), die Spezifität bei lateralen Infarkten (96,1%). Kappa als Maß zur Übereinstimmung war im lateralen sowie anterolateralen Segment am größten (Kappa 0.55). In der Untergruppe hatten 18 von 41 Patienten einen t-Infarkt und 23 einen nt-Infarkt. Es zeigte sich keine signifikante Korrelation zwischen Q-Zacke im EKG und der Transmuralität des Infarktes. Infarkte mit Q-Zacken im EKG hatten eine größere Infarktmasse als Infarkte ohne Q-Zacke (Median 6,1 versus 4 g, p= 0,0348). Die Sensitivität der Q-Zacken im EKG betrug für die Präsenz eines Infarktes 37% und für die Transmuralität eines Infarktes 39%. Diskussion: T-Infarkte können von nt-Infarkten mittels des EKG nicht unterschieden werden. Die Häufigkeit von Q-Zacken in transmuralen und nicht-transmuralen chronischen Myokardinfarkten unterscheidet sich nicht signifikant. Die Sensitivität des EKG zur Lokalisation von inferioren Infarkten ist am höchsten, die Spezifität ist für laterale Infarkte am höchsten. Insgesamt werden anterolaterale und laterale Infarkte im EKG am genauesten erkannt. K-CMR dient der exakten Lokalisierung des Infarktes und Beurteilung der transmuralen Ausdehnung. Die Sensitivität von Q-Zacken im EKG hinsichtlich des Vorhandenseins und der Transmuralität von Infarkten ist gering. Q-Zacken im EKG sind mit einer größeren Infarktmasse assoziiert, ungeachtet der Transmuralität des Infarktes. 4 Inhaltsverzeichnis Abkürzungsverzeichnis ................................................................................... 8 1. Einleitung .................................................................................................... 10 1.1. Das physiologische Herz ........................................................................ 11 1.1.1. Anatomie........................................................................................... 11 1.1.2. Koronararterien................................................................................. 14 1.1.3. Erregungsbildungs- und Erregungsleitungssystem........................... 16 1.2. Das pathologische Herz.......................................................................... 19 1.2.1. Definition der KHK ............................................................................ 19 1.2.2. Prädilektionsstellen der KHK ............................................................ 20 1.2.3. Atherosklerose.................................................................................. 21 1.2.4. Stabile Angina pectoris ..................................................................... 22 1.2.5. Instabile Angina pectoris................................................................... 22 1.2.6. Stunned myocardium und hibernating myocardium.......................... 22 1.2.7. Myokardinfarkt .................................................................................. 24 1.2.7.1. Definition..................................................................................... 24 1.2.7.2. Pathogenese............................................................................... 25 1.2.7.3. Traditionelle Einteilung der Myokardinfarkte ............................... 26 1.2.7.4. Einteilung der Myokardinfarkte in der heutigen Praxis ................ 27 1.2.7.5. Die Myokardinfarktnarbe............................................................. 28 1.3. Kardiovaskuläre Magnetresonanztomographie....................................... 29 1.3.1. Einführung ........................................................................................ 29 1.3.2. Geschichte der Magnetresonanztomographie .................................. 31 1.3.3. Geschichte der kardiovaskulären Kernspintomographie................... 34 1.3.4. Physikalische Grundlagen ................................................................ 36 1.3.4.1. Kernmagnetische Resonanz....................................................... 36 5 1.3.4.2. Relaxationsmechanismen........................................................... 40 1.3.4.3. Gewebskontraste und Signalintensitäten.................................... 41 1.3.4.4. Ortskodierung ............................................................................. 42 1.3.5. Kontrastmittel.................................................................................... 44 1.3.6. Infarktdiagnostik mittels Magnetresonanztomographie..................... 46 1.3.6.1. Late enhancement ...................................................................... 46 1.3.7. Bestimmung der Myokardmasse ...................................................... 47 1.4. Elektrokardiogramm................................................................................ 48 1.4.1. Definition........................................................................................... 48 1.4.2. Geschichte der Elektrokardiographie ................................................ 49 1.4.3. Elektrophysiologie des Herzens........................................................ 52 1.4.4. Myokardinfarktdiagnostik im EKG..................................................... 56 1.4.5. EKG-Zeichen eines abgelaufenen Infarktes ..................................... 58 1.4.5.1. Q-Zacken oder Q-Waves ............................................................ 58 1.4.5.2. R-Verlust und R-Minderung ........................................................ 58 1.4.5.3. Horizontale ST-Senkung und deszendierende ST-Senkung....... 59 1.4.5.4. Präterminal negatives T .............................................................. 60 2. Ziel der Arbeit.............................................................................................. 61 3. Material und Methoden............................................................................... 62 3.1. Patienten................................................................................................. 62 3.1.1. Patientenvorbereitung....................................................................... 64 3.2. Kardiovaskuläre Magnetresonanztomographie....................................... 65 3.2.1. Bildakquisition................................................................................... 65 3.2.2. Localizer und Untersuchungsprotokoll.............................................. 67 3.2.3. EKG bei Untersuchung ..................................................................... 70 3.2.4. Oberflächenspule.............................................................................. 71 3.2.5. Bildanalyse ....................................................................................... 72 6 3.2.6. Patienten der Untergruppe „Infarktmasse“........................................ 74 3.2.7. Bildanalyse der Untergruppe „Infarktmasse“..................................... 75 3.3. Elektrokardiographie ............................................................................... 76 3.3.1. Erstellung des Ruhe-EKG................................................................. 76 3.3.2. EKG-Analyse .................................................................................... 79 3.4. Statistische Auswertung.......................................................................... 80 4. Ergebnisse .................................................................................................. 81 4.1. Infarktlokalisation .................................................................................... 81 4.2. EKG-Veränderungen bei chronischen Infarkten ..................................... 86 4.3. Sensitivität der Q-Zacke in Bezug auf die Infarktmasse.......................... 87 4.4. Beispiele für Untersuchungsbefunde ...................................................... 89 5. Diskussion................................................................................................... 95 5.1. Gesamtkollektiv ...................................................................................... 95 5.2. Rolle der kardiovaskulären Magnetresonanztomographie...................... 96 5.3. Detektion der Infarktlokalisation.............................................................. 97 5.4. EKG beim transmuralen und nicht-transmuralen Myokardinfarkt............ 99 5.5. Sensitivität der Q-Zacke und Infarktmasse ........................................... 104 5.6. Limitationen .......................................................................................... 105 5.7. Schlussfolgerung .................................................................................. 107 6. Zusammenfassung ................................................................................... 108 7. Literaturverzeichnis.................................................................................. 109 8. Anhang ...................................................................................................... 125 9. Danksagung .............................................................................................. 129 10. Lebenslauf............................................................................................... 130 7 Abkürzungsverzeichnis A. Arteria Abb. Abbildung AV atrioventricular bzw. beziehungsweise ca. circa Cm Zentimeter CMR Kardiovaskuläre Magnetresonanztomographie d.h. das heißt DTPA Diethylentriaminpentaessigsäure EKG Elektrokardiogramm engl. englisch Gd Gadolinium H Stunde HF Hochfrequenz i.v. intravenös KHK Koronare Herzkrankheit kontrastverstärkte kardiovaskuläre K-CMR Magnetresonanztomographie LDL Low densitiy Lipoproteine LVOT linksventrikulärer Ausflusstrakt Min Minute Mm Millimeter MR Magnetresonanz MRT Magnetresonanztomographie mV Millivolt NSTEMI Non ST Myocardial Infarction PDGF platelet derived growth factor R. Ramus RCA rechte Koronararterie RCX Ramus circumflexus RIVA Ramus interventricularis anterior S Sekunde SA Short axis = Kurzachse sog. so genannt TE Echozeit TR Repetitionszeit V. Vena Vv. Venae WHO World Health Organization z.B. zum Beispiel 9 1. Einleitung Im Falle einer kardialen klinischen Fragestellung ist die große klinische Bedeutung des 12-Kanal-Oberflächen-Elektrokardiogramms (EKG) unbestritten. Es ist eine obligatorische und wertvolle diagnostische Maßnahme. Die Leistungsfähigkeit des EKG darf auf der anderen Seite jedoch nicht überschätzt werden [22]. Bei abgelaufenem Myokardinfarkt (transmural wie nicht-transmural) zeigen sich unterschiedliche Veränderungen im EKG. Einen transmuralen von einem nicht-transmuralen Herzinfarkt ausschließlich durch das EKG zu unterscheiden ist jedoch schwierig [3, 123] . Mit der kardiovaskulären Magnetresonanztomographie (CMR) steht eine neue Methode mit exzellenter räumlicher Auflösung zur Verfügung. Die kardiovaskuläre Kontrast-Magnetresonanztomographie (K-CMR) ist mit Hilfe des Kontrastmittels Gadolinium-DTPA derzeit anderen bildgebenden Verfahren überlegen, da sie eine präzise Evaluation der Wandbewegungsstörungen ermöglicht und die Ausdehnung und Lokalisation der Infarktareale erlaubt [1, 38, 57, 78, 119, 139]. Sie ermöglicht somit eine Form der Vitalitätsdiagnostik und Identifizierung von ischämischen und infarzierten Arealen des Myokards nach Kontrastmittelgabe und hat hierdurch einen wichtigen Stellenwert in der Diagnostik und der Therapie der koronaren Herzerkrankung [61]. Von entscheidender Bedeutung ist dabei, dass im K-CMR ohne große Schwierigkeiten transmurale von nicht-transmuralen (subendokardialen und endokardialen) Infarkten unterschieden werden können [1, 38, 57, 78, 119, 139]. 10 1.1. Das physiologische Herz 1.1.1. Anatomie Die Kenntnis des Erregungsleitungssystems und der Anatomie des Herzens ist die Voraussetzung für das Verstehen des Elektrokardiogramms [39, 80]. Im Jahre 1628 gab William Harvey, Arzt, Anatom und Physiologe, eine genaue Darstellung der Funktion des Kreislaufsystems und des Herzens [46]. Er zeigte, dass das Herz eine Pumpe ist, welche das Blut durch den Kreislauf befördert. Das Herz besteht aus vier Hohlräumen. Scheidewände, auch Septen genannt, unterteilen das Herz in eine rechte und linke Herzhälfte. 11 Diese beiden Herzhälften wiederum bestehen aus je einem Vorhof (Atrium) und einer Kammer (Ventrikel). Unterschieden werden folglich vier Holhräume: Rechter Vorhof (Atrium dextrum), Rechte Kammer (Ventriculus dexter), Linker Vorhof (Atrium sinistrum) und Linke Kammer (Ventriculus sinister). Abbildung 1: Vorhöfe, Ventrikel sowie das Interventrikuläre Septum mit Darstellung der Schnittebene - aus [90]. Die rechte und linke Herzhälfte unterscheiden sich anatomisch und funktionell. Der rechte Vorhof enthält Blut aus der Vena cava inferior und superior, also dem venösen System des Körpers, und pumpt dieses sauerstoffarme Blut durch die Trikuspidalklappe in die getrennte rechte Herzkammer. Das Blut gelangt von dort durch die Pulmonalklappe in die Lunge. Dort wird das Blut mit Sauerstoff angereichert und erreicht durch die paarigen Vv. pulmonales superiores und inferiores den linken Vorhof. Durch die Mitralklappe fließt das Blut in die linke Kammer und wird dort durch die Aortenklappe in die Aorta ascendens gepumpt. 12 Die Kammerscheidewand wird Septum interventriculare genannt. Sie trennt linke und rechte Kammer voneinander. Das Septum interatriale trennt entsprechend den rechten vom linken Vorhof. Da der Gesamtwiderstand im Körperkreislauf größer ist als der im Lungenkreislauf, weist die linke Herzkammer eine größere Wanddicke auf als die rechte um die höhere Druckarbeit aufbringen zu können. Mikroskopisch unterscheidet das Herz drei Schichten: Endokard, Myokard und Epikard. Das Endokard bildet die Herzinnenhaut. Es überzieht alle Schichten der Herzinnenräume. Aus dieser Schicht gehen auch die Herzklappen hervor. Das Endokard besteht aus einem einschichtigen Plattenepithel, dem Endothel. Die Sauerstoffversorgung des Endokards erfolgt durch ein subendokardiales Kapillarnetz sowie durch das im linken Ventrikel befindliche arterielle Blut in Ermangelung eigener Gefäße. Das Myokard bildet den größten Wandanteil des Herzens und ist zwischen Endokard und Epikard lokalisiert. Das Myokard ist die eigentliche Arbeitsmuskulatur des Herzens. Hier findet sich neben dem Koronarienführenden Bindegewebe auch ein spezifisches Muskelgewebe, welches als „Erregungsleitungssystem“ bezeichnet wird. Das Myokard im Kammerbereich ist kräftiger und mehrschichtiger als im Vorhofbereich. Im mikroskopischen Bild zeigen sich quergestreifte Muskelfasern, die netzartig miteinander verflochten sind. Das Epikard ist mit der äußersten Schicht des Herzens verwachsen und gleichzeitig der innere Teil des Perikards [39, 80]. 13 1.1.2. Koronararterien Abbildung 2: Koronararterien des Herzens - aus [122]. Die Blutversorgung des Myokards erfolgt über Äste der rechten und linken Koronararterie. Die rechte und die linke Kranzarterie entspringen im Sinus aortae im Bereich der rechten bzw. linken Taschenklappe der Aorta. Sie verlaufen im Sulcus coronarius und teilen sich dann netzwerkartig auf. Die rechte Koronararterie versorgt die Hinterwand des Herzens, den Sinusknoten, Vorhof, Vorderwand des rechten Ventrikels, die seitlichen Randbereiche des rechten Ventrikels sowie die hinteren Ventrikelseptumbereiche. Außerdem werden von ihr der AV-Knoten und die Hinterseitenwand des rechten Vetrikels versorgt. Die linke Koronararterie zieht zur Vorderseite und zur linken Seitenwand des Herzens. Die A. coronaria sinistra zieht in der vorderen Längsfurche zwischen A. pulmonalis und linkem Herzohr hindurch und teilt sich dann in den R. interventricularis anterior sowie in den Ramus circumflexus. 14 Versorgungsgebiete der A. coronaria sinistra sind der Conus arteriosus, die Vorderwand des linken Ventrikels und der vordere Kammerseptumbereich. Der R. circumflexus versorgt die Seitenwand des linken Ventrikels, die Hinterwand des linken Ventrikels und Teile des AV-Knotens. Die Aufzweigung der Arterien erfolgt zu stetig kleiner werdenden Arteriolen und schließlich zu Kapillaren. Diese „Haargefäße“ versorgen die Arbeitsmuskulatur des Herzens mit Blut. Die Ausprägung der Koronarterien kann variieren. Je nach bevorzugter Ausprägung der rechten oder linken Koronararterie werden verschiedene Versorgngstypen unterteilt. [39, 80]. Beim Rechtsversorungstyp ist die rechte Kranzarterie stärker ausgeprägt als die linke, beim Linksversorgungstyp ist die linke Kranzarterie stärker ausgeprägt als die rechte. Der ausgeglichene Versorgungstyp ist mit 75% am häufigsten. Es folgt der koronare Rechtsversorgungstyp mit 14% und der koronare Linksversorgungstyp mit 11% [118]. Die Blutversorgung des Herzens erfolgt in der Phase der Diastole. Während der Systole werden die Koronarien durch die Muskelkontraktion des Herzens leergepresst. Das venöse Blut des Herzens sammelt sich über die Herzvenen und fließt durch den Sinus coronarius zurück in den rechten Vorhof [39, 80]. 15 1.1.3. Erregungsbildungs- und Erregungsleitungssystem Im Myokard gibt es spezifische Muskelfasern, die sich durch Bau und Funktion von denen der Arbeitsmuskulatur unterscheiden. Funktionell zeichnen sie sich durch die Fähigkeit zur spontanen, rhythmischen Erregungsbildung und -fortleitung aus. Sie werden in ihrer Gesamtheit als Erregungsbildungs- und Erregungsleitungssystem oder Systema conducens cordis bezeichnet. Damit das Herz genügend Druck entwickeln kann, um das Blut in die Lunge und vor allem in den Körperkreislauf zu pumpen, ist eine koordinierte Kontraktion und Entspannung der Herzmuskelzellen notwendig. Die Herzmuskelzellen werden zu diesem Zwecke von den Zellen des Erregungsleitungssystems rhythmisch erregt. Abbildung 3: Schematische Darstellung des Erregungsleitungssystems des Herzens - Lage und Struktur im Herzen - aus [100]. Die Strukturen des Erregungsleitungssystems: Der Sinusknoten oder Nodus sinu-atrialis ist der physiologische Schrittmacher des Herzens - liegt im Bereich des Sinus venarum cavarum zwischen der Mündung der oberen Hohlvene und dem rechten Herzohr im rechten Vorhof. 16 Unabhängig vom vegetativen Nervensystem erzeugt er rhythmisch autonom ca. 60-80 Impulse pro Minute. Das vegetative Nervensystem reguliert durch Aktivierung von Sympathicus oder Parasympathicus die Schlagfrequenz und Kontraktionsstärke. Der auch Keith-Flack-Knoten genannte Sinusknoten besitzt unter dem Epikard kaudalwärts ziehende Fasern, welche die erzeugten Impulse durch den Vorhof an den AV-Knoten weiterleiten Der AV-Knoten (Atrioventrikularknoten, Nodus atrioventricularis) liegt in der Vorhofscheidewand unter dem Endokard zwischen der Mündung des Sinus coronarius und der Trikuspidalklappe. Er hat als Ventilfunktion die Verzögerung der Erregungsüberleitung auf die Kammern um etwa 0,1 s, bis deren Füllung abgeschlossen ist. Auch der AV-Knoten bildet rhythmische Erregungen. Seine Eigenfrequenz ist jedoch nur halb so hoch wie die des Sinusknotens. Normalerweise wird die Eigenerregung des AV-Knotens nicht bemerkt, da die höherfrequente Sinuserregung am AV-Knoten eintrifft, bevor die langsame Eigenerregung wirksam wird. Fällt jedoch der Sinusknoten aus, so schlagen die Kammern in einem AV- Rhythmus von etwa 40 / Min. An der Vorhof-KammerGrenze kann die Erregung nicht auf die Kammern überspringen, weil Vorhof und Kammermuskulatur durch das Herzskelett scharf voneinander geschieden sind. Lediglich im rechten Faserdreieck (Trigonum fibrosum dextrum) ist eine Lücke für das Erregungsleitungssystem gelassen. Aus dem AV-Knoten gehen Reizleitungsfasern für die Erregung der Kammermuskulatur hervor, das sog. Hissche Bündel. Das Hissche-Bündel, Fasciculus atrioventricularis, besitzt einen bis zu 4 mm dicken Stamm, Truncus fasciculi atrioventricularis, welcher die Vorhöfe und Kammern durch die Lücke im Herzskelett, Trigonum fibrosum dextrum, verbindet. Der Truncus zieht dann noch ein kleines Stück an der rechten Seite des membranösen Teils der Kammerscheidewand weiter. Er teilt sich dort in die zwei Kammerschenkel. Je ein Schenkel zieht rechts und einer links in den muskulösen Teil der Kammerscheidewand in Richtung Herzspitze. Die Purkinje-Fasern sind die Ausläufer dieser Kammerschenkel. Sie sind in das Myokard eingebettet und unterscheiden sich makroskopisch nur noch wenig von der Arbeitsmuskulatur. 17 Zusammenfassend ist zu sagen, dass die im Sinusknoten gebildeten Erregungen entweder über die Arbeitsmuskulatur der Vorhöfe oder über eigene Faserbündel mit höherer Leitungsgeschwindigkeit zum AV-Knoten gelangen. Hier erfolgt dann zunächst eine Verzögerung, die verhindert, dass sich die Kammern bereits kontrahieren, während sie noch durch die Kontraktion der Vorhofmuskulatur gefüllt werden. Anschließend wird die Erregung über das Hissche Bündel und seine Ausläufer zur Kammermuskulatur weitergeleitet [39, 80]. 18 1.2. Das pathologische Herz 1.2.1. Definition der KHK Unter der koronaren Herzkrankheit (KHK) versteht man die Manifestation der Artherosklerose an einem oder mehreren Herzkranzgefässen. Atherosklerose steht für die von der WHO vorgeschlagene Bezeichnung der Arterienverkalkung und ist definiert als variable Kombination von Intimaveränderungen, bestehend aus herdförmigen Ansammlungen von Lipiden, komplexen Kohlehydraten, Blut- und Blutbestandteilen, Bindegewebe und Calciumablagerungen, verbunden mit Veränderungen der Arterienmedia. Bei der KHK handelt es sich um eine multiätiologische Erkrankung, welche eine Koronarinsuffizienz zu Folge hat. Dies meint ein Missverhältnis zwischen Sauerstoffangebot und - bedarf im Herzmuskel. Eine KHK ist mit einem erhöhten Morbiditäts- und Mortalitätsrisiko verbunden und kann sich auf unterschiedliche Weise manifestieren. In den Frühstadien der Erkrankung sind in der Regel keine klinischen Symptome vorhanden, obwohl bereits Störungen der endothelialen Funktion und Lipideinlagerungen in der Gefäßwand vorliegen. Im fortgeschrittenen Stadium tritt mit zunehmender Einengung der Gefäße eine Unterversorgung des abhängigen Herzmuskelgewebes auf, die sich klinisch meist als stabile Anginga pectoris äußert. Krisenhafte akute Myokardischämien in Ruhe sind Folge einer Plaqueruptur bzw. Plaqueerosion mit nachfolgender Bildung eines Thrombus, der das betroffene Gefäß ganz verschließt (akuter Myokardinfarkt) oder zu einer hochgradigen Reduktion des Blutflusses führen kann (instabile Angina pectoris). Neben der Plaqueruptur können Vasospasmen und koronare Entzündungsvorgänge eine myokardiale Ischämie triggern. Klinisch äußern sich diese pathophysiologischen Vorgänge als sog. akutes Koronarsyndrom. 19 Linksherzinsuffizienz und Herzrhythmusstörungen können Folge einer akuten Myokardischämie sein und zum plötzlichen Herztod führen [27, 36, 103]. 1.2.2. Prädilektionsstellen der KHK Das Koronarsystem weist bestimmte Prädilektionsstellen auf, an denen die atherosklerotischen Veränderungen vorwiegend auftreten. In der rechten Koronararterie (RCA) sind dies der Abgang des Ramus ventricularis dexter, die Crux cordis und das Areal unterhalb der Konusarterie. Im Bereich des linken Herzkranzgefässes sind vor allem der Hauptstamm, das Areal zwischen dem ersten und zweiten Septalast des Ramus interventricularis anterior (RIVA) und die Anfangsstelle des Ramus marginalis sinister und Ramus posterolateralis des Ramus circumflexus (RCX) betroffen [44]. Je nach Anzahl der verengten Hauptstellen (RCA, RIVA und RCX) unterscheidet man zwischen 1-Gefäß, 2-Gefäß- und 3-Gefäßerkrankungen. 20 1.2.3. Atherosklerose Es gibt Hypothesen zur Entstehung der Atherosklerose. Eine der verbreitetsten ist die „reaction to injury“ Hypothese [13]. Im Zentrum dieser Hypothese steht eine endotheliale Läsion bzw. Dysfunktion. Diese kann durch Bluthochdruck, Nikotinabusus, Immunmechanismen, hämodynamische Faktoren und eine Hyperlipidämie verursacht werden. Hierdurch kommt es zu einem Lipoprotein-Einstrom in die Intima, vor allem von LDL. Dieses wird beim Endotheleintritt oxidiert. Die Störung der Endothelfunktion und / oder die endotheliale Expression von Adhäsionsmolekülen begünstigen die Einwanderung von Monozyten in die Arterienintima. Sie inkorporieren nun über den sog. Scavenger-Rezeptor die LDL-gebundenen Cholesterinester. Dadurch entstehen die fettgefüllten Schaumzellen. Sie vermehren sich ständig, so dass der atherosklerotische Plaque wächst. Dadurch kann es zu einer zusätzlichen mechanischen Schädigung von Endothel und/oder Intima kommen. Dies begünstigt die Adhäsion von Thrombozyten, welchen einen besonderen Wachstumsfaktor, den PDGF (platelet derived growth factor) sezernieren. Zusammen Wachstumsfaktoren mit stimuliert von PDGF den die Markophagen glatten gebildeten Muskelzellen in der Arterienintima nun zu erhöhter Profliferation. Die proliferierenden glatten Muskelzellen wandeln sich jetzt in aktive Grundsubstanz synthetisierende Zellen um. Insbesondere werden Kollagene, Proteoglykane und elastische Fasern gebildet, die zu einer Fibrosierung und Hyalinisierung der Plaques führen. Die Plaques wachsen so kontinuierlich weiter und es kommt histologisch zur Ausbildung von sog. Komplexen Läsionen. Sie besitzen eine atheromatöse Nekrose aus Zelldetritus, Lipiden, Cholesterinkristallen und einer lumenseitigen kollagenreichen fibrinösen Kappe. Zusätzlich können sich Kalksalze ablagern [13]. So entsteht das Vollbild der Atherosklerose. 21 1.2.4. Stabile Angina pectoris Leitsymptom der stabilen Angina pectoris ist ein belastungsabhängiges thorakales Druckgefühl / Brennen. Die Beschwerden können in linke Schulter, Innenseite des linken Arms, Oberbauch, Hals und Unterkiefer oder Rücken ausstrahlen. Provokationssituationen mit Erhöhung des myokardialen Sauerstoffverbrauchs sind körperliche Anstrengung, emotionale Belastung, Kälte oder große Mahlzeiten. Die Dauer der Beschwerden beträgt wenige Minuten und geht nach Beendigung der Belastung bzw. nach Gabe von Nitroglyzerin rasch zurück [47]. 1.2.5. Instabile Angina pectoris Die instabile Angina pectoris gehört zu den akuten Koronarsyndromen ohne persistierende ST-Streckenhebungen im EKG. Leitsymptom ist der Brustschmerz in Ruhe oder bei geringer Belastung. Es kommt zu einem Auftreten von Angina pectoris in körperlicher Ruhe, welche oft länger als 2 min anhält. Die instabile Angina pectoris kann auch als neu (de novo) auftretende ausgeprägte Angina pectoris mit mindestens einer Klasse III der Canadian Cardiovascular Society Classification in Erscheinung treten. Auch aus einer zuvor stabilen Angina pectoris kann eine instabile Angina pectoris entstehen. Die stabile Angina pectoris kann häufiger, länger anhaltend und bei geringer Belastung auftreten (Zunahme auf zumindest Klasse III der Canadian Cardiovascular Society Classification). 1.2.6. Stunned myocardium und hibernating myocardium Bis vor wenigen Jahren bestand die Vorstellung, dass eine Funktionsstörung des Myokards im Sinne einer Hypo- oder Akinesie entweder reversibel durch passagere Durchblutungsstörungen bedingt sei, oder aber irreversibel durch einen bleibenden Myokardschaden infolge Nekrotisierung und Vernarbung des Myokards auftritt. Es hat sich jedoch in den letzten Jahren gezeigt, dass zwischen diesen beiden extremen Zuständen noch andere Arten von 22 Kontraktilitätsstörungen anzutreffen sind, die nicht mit einem irreversiblen Schaden gleichzusetzen sind und in noch viablem Myokard auftreten. Eine schwere Funktionsstörung kann durch eine stumme Ischämie bedingt sein und über längere Zeitabschnitte vorliegen. Das Stunning stellt einen Zustand von länger anhaltender kontraktiler Dysfunktion nach Ischämieperfusion dar. Beim "stunned myocardium" ist die Durchblutung zum Zeitpunkt der Untersuchung zwar wieder in Ordnung, eine nachhinkende Unterfunktion des Myokards kann für Minuten, Stunden oder Tage kann jedoch vorhanden sein [28]. Als hibernierend (engl.: „to hibernate“ = „Winterschlaf halten“) wird ein reversibler Zustand kontraktiler Dysfunktion bezeichnet, der im Verlauf einer chronischen Ischämie mit reduzierter Koronardurchblutung, reduziertem Myokardstoffwechsel und kontraktiler Funktion einhergeht und über einen längeren Zeitraum bestehen bleibt (Tage, Wochen oder sogar Monate). Beim "hybernating Myocardium" kann eine über einen langen Zeitraum vorhandene Funktionsstörung die Anpassung an chronisch mangelhafte Durchblutung sein, auch hier liegt noch lebensfähiges Myokard vor [107]. 23 1.2.7. Myokardinfarkt Der Myokardinfarkt kann aus verschiedenen Perspektiven betrachtet werden: klinisch, elektrokardigraphisch, pathologisch und bildgebend [40]. 1.2.7.1. Definition Der akute Infarkt ist durch eine Myokardnekrose mit Verlust von kontraktilem Gewebe gekennzeichnet. Er repräsentiert die gravierende Manifestation des akuten Koronarsyndroms, zu dem instabile Angina pectoris und der sich entwickelnde Myokardinfarkt gehören [56]. Das entscheidende morphologische Kriterium eines Herzinfarktes ist der irreversible Untergang von Herzmuskelzellen, der erst nach dem Überschreiten der Wiederbelebungszeit des Myokards beginnt. Die Zelluntergänge beginnen im Myokard an jenen Stellen, die von den zuführenden Arterien am weitesten entfernt sind, im Subendokard. Von dessen Zentrum breiten sie sich langsam in die seitlichen subendokardialen Partien und senkrecht ins Myokard in Richtung zum Epikard aus. Jedoch liegt einem Infarkt nicht immer ein vollständiger Gefäßverschluss zugrunde, es genügt bereits eine „überkritische Drosselung“ der Blutzufuhr [51]. 24 1.2.7.2. Pathogenese Ursache eines akuten Koronarsyndroms ist zumeist ein Einriss der fibrinösen Deckplatte einer lidpidreichen atheromatösen Plaque. Mechanische Ursachen und entzündliche Prozesse sind an der Plaqueruptur und der daraus resultierenden Entstehung von akuten thrombotischen Komplikationen beteiligt [74]. Bei einer Plaqueruptur oder Erosion führt die Freilegung von extrazellulärer Matrix zur Kontaktaktivierung der intrinsischen Gerinnungskaskade. Das dadurch gebildete Thrombin stimuliert auch die Adhäsion und Aggregation von Thrombozyten und Leukozyten. Folge ist ein intrakoronarer Thrombus wechselnder Ausbildung, der zunächst noch durch den Blutstrom freigespült werden kann. Durch Embolisation von Thrombus oder Plaquematerial nach distal, sowie durch lokale Freisetzung von vasokonstringierenden Substanzen können arterielle Endäste verschlossen und myokardiale Mikroinfarkte ausgelöst werden. Bei subokklusivem bzw. intermittierend okklusivem Koronarthrombus kommt es je nach Dauer der Ischämie zu einer wechselnd ausgeprägten Imbalance zwischen Sauerstoffzufuhr und myokardialem Sauerstoffbedarf mit entsprechender klinischer Symptomatik und Myokardzellnekrosen. Wird ein kompletter thrombotischer Gefäßverschluss durch Fibrin stabilisiert, so kommt es zum Vollbild des akuten Myokardinfarktes [107]. 25 1.2.7.3. Traditionelle Einteilung der Myokardinfarkte Traditionell wurden zwei Arten von Myokardinfarkten beschrieben: der „transmurale“ Infarkt und der „nicht-transmurale“ Infarkt, der auch als subendokardialer Infarkt bezeichnet wurde. In der klinischen Praxis traf man diese Unterscheidung aufgrund vom Entstehen von abnormalen Q-Zacken im 12-Kanal-Oberflächen-Elektrokardiogramm. Infarkte, die neue Q-Zacken zeigten, wurden als transmural bezeichnet wohingegen Infarkte mit ST-Streckenveränderungen oder T-Wellen- Veränderungen als nicht-transmural deklariert wurden. Diese Terminologie beinhaltet den Gebrauch von pathologischen Definitionen, um eine klinische Erscheinung zu beschreiben. Aus pathologischer Sicht handelt es sich beim transmuralen Herzinfarkt um einen mehrere Zentimeter großen nekrotischen Herzwandabschnitt. Die Infarzierung umfasst hierbei alle drei Wandschichten. Beim nicht-transmuralen Innenschichtinfarkt findet man multiple, im inneren Drittel der Ventrikelwand gelegene Nekroseherde, die 0,5 – 1,5 cm im Durchmesser groß und unregelmäßig verteilt sind [102]. In den frühen 1980er Jahren zeigten verschiedene Autoren eine mangelnde Übereinstimmung zwischen den klinischen Begriffen und den pathologischen Befunden. Autoptische Studien haben gezeigt, dass pathologische Q-Wellen auch in nicht-transmuralen Infarkten gefunden wurden sowie bei transmuralen Infarkten nicht vorkommen. Aus diesen Grund wurde empfohlen, dass die Bezeichnungen transmural und nicht-transmural abgeschafft werden sollte und gegen die adäquatere Bezeichnung „Q-wave“ und „non-Q-Wave“ Myokardinfarkt ausgetauscht werden sollten [41, 102, 125]. 26 1.2.7.4. Einteilung der Myokardinfarkte in der heutigen Praxis In der heutigen klinischen Praxis erfolgt die Einteilung von akuten Myokardinfarkten in Nicht-ST-Hebungsinfarkte und ST-Hebungsinfarkte im Rahmen eines akuten Koronarsyndroms [2]. Der Begriff „akutes Koronarsyndrom“ umfasst alle klinischen Erscheinungsformen der akuten Myokardischämie. Ihnen liegt in der Regel ein gemeinsamer Pathomechanismus in Form von Ruptur oder Erosion einer atheromatösen Plaque zugrunde. In der klinischen Praxis sind dies vor allem die instabile Angina pectoris, der akute Myokardinfarkt und der plötzliche Herztod. Da die Übergänge dieser klinischen Formen fließend sind, hat es sich in den letzten Jahren etabliert, Patienten anhand des EKG in Gruppen mit und ohne ST-Streckenhebung zu unterteilen, denen unterschiedliche therapeutische Maßnahmen zuteil werden [45]. Nicht-ST-Hebungsinfarkt Akute Koronarsyndrome ohne ST-Hebung aber mit Anstieg von biochemischen Nekrosemarker werden als Nicht-ST-Hebungsinfarkt bezeichnet (NSTEMI). Das pathologisch-anatomische Substrat ist eine Plaqueruptur oder -erosion mit nicht lumenverschließender sekundärer Thrombusbildung. Eine Weiterentwicklung zu einem akuten ST-Hebungsinfarkt ist jederzeit möglich. ST-Hebungsinfarkte Akute Koronarsyndrome mit ST-Hebung und im weiteren Verlauf häufig mit Anstieg der Nekrosemarker sind ST-Hebungsinfarkte (STEMI), die sich meistens zu Q-Zacken-Infarkten fortentwickeln. Pathologisch-anatomisches Substrat ist hierbei eine Plaqueruptur oder - erosion mit lumenverschließender Thrombusbildung [107]. 27 Abbildung 4 - Einteilung der akuten Koronarsyndrome nach EKG – Manifestation - aus [2]. 1.2.7.5. Die Myokardinfarktnarbe Vier bis sechs Stunden nach dem Infarktgeschehen kommt es zu einer Koagulationsnekrose mit irreversibler Veränderung der Myofibrillen. Durch die Schädigung der Herzmuskelzellen werden Entzündungsmediatoren aktiviert und führen nach 10-24 h zum Einwandern von Entzündungszellen. Makroskopisch ist der Herzinfarkt zu diesem Zeitpunkt als lehmfarbene Nekrose sichtbar. Ab dem 4. Tag beginnt die Bildung von Granulationsgewebe. Aus dem erhaltenen Gewebe am Rande der Nekrose sprießt eine zunehmende Zahl von Kapillaren. Die Makrophagen des Granulationsgewebes bauen die Myokardnekrose ab. Fibroblasten synthetisieren am Ende der 2. Woche zunehmend Kollagenfasern. Nach etwa 6 Wochen ist die Nekrose durch kollagenes Bindegewebe ersetzt. Die entstandene Myokardinfarktnarbe ist makroskopisch als grauweiße Schwiele erkennbar. Der Herzmuskel zählt zu den Dauergeweben – es findet keine nennenswerte Regeneration statt. Das restliche Parenchym ist einer vermehrten Belastung ausgesetzt [14]. 28 1.3. Kardiovaskuläre Magnetresonanztomographie 1.3.1. Einführung Die kardiovaskuläre Magnetresonanztomographie ermöglicht eine Form der Vitalitätsdiagnostik und Identifizierung von ischämischen und infarzierten Arealen des Myokards nach Kontrastmittelgabe und hat hierdurch einen wichtigen Stellenwert in der Diagnostik und der Therapie der koronaren Herzerkrankung [61]. Es handelt sich bei Magnetresonanztomographie der = Kernspintomographie MRT) um ein (Synonym: nicht-invasives Schnittbildverfahren für die medizinische Diagnostik und verwendet keine den Patienten schädigende Strahlung. Das MRT zeichnet sich durch ein hohes Auflösungsvermögen des Weichteilgewebes aus. Dies ist eine Überlegenheit im Vergleich mit konventioneller Röntgendiagnostik. Ein Kernspintomograph setzt sich im Wesentlichen aus drei Elementen zusammen: einem starken Permanentmagneten, einer Hochfrequenzspule und einer Antenne [137]. Stark vereinfacht kann eine MRT-Untersuchung wie folgt beschrieben werden: Der Patient wird in einen starken in der Regel röhrenförmigen Magneten gebracht, eine elektromagnetische Radiowelle wird eingestrahlt und kurz darauf wieder ausgeschaltet. Hierdurch sendet der Patient bzw. das untersuchte Organ Signale aus, aus welchen mit Hilfe eines Computers ein Bild konstruiert werden kann [109]. 29 Abbildung 5: Kernspintomograph des Marienhospitals Herne, Magnetom Sonata, Siemens, Erlangen, Deutschland. Diese MRT-Bilder basieren auf der unterschiedlichen Zusammensetzung der untersuchten Gewebe. Die biochemische Zusammensetzung der Gewebe hat einen Einfluss auf die Bildqualität und den Bildkontrast. Die MRT-Bilder werden durch so genannte Spinecho- und GradientenechoSequenzen erzeugt. Die Aufnahmezeit für eine solche Sequenz beträgt nur eine bis zwei Minuten. Eine vollständige Untersuchung besteht aus der Wiederholung der Sequenzen in verschiedenen Schichten der zu untersuchenden Region. Dadurch kann sie 20 Minuten oder länger dauern [109]. 30 1.3.2. Geschichte der Magnetresonanztomographie Im Jahr 1900 beschreibt Nikola Tesla die Entstehung und die Wirkung von Magnetfeldern. Der „Vater der Magnetfelder“ wurde zum Namensgeber für die internationale Einheit, welche die Stärke von Magnetfeldern angibt [106]. 1946 führten zwei Wissenschaftler in den Vereinigten Staaten von Amerika unabhängig voneinander die ersten Experimente mit nuklearer Magnetresonanz durch. Der Schweizer Felix Bloch (Stanford University) und Edward Purcell (Harvard University) fanden heraus, dass bestimmte Atomkerne in einem externen Magnetfeld in der Lage sind, die Energie von hochfrequenten Radiowellen zu absorbieren und wieder abzugeben, sobald sie wieder in ihren Ausgangszustand zurückkehren. Voraussetzung hierfür ist allerdings, dass die Frequenz der eingestrahlten Hochfrequenz (HF)-Pulse mit der Eigenfrequenz der Atomkerne übereinstimmt. Diese Frequenz wurde durch den Irischen Physiker Sir Joseph Larmor entdeckt und wird als Larmorfrequenz (f0) bezeichnet. Im Jahre 1952 erhielten Bloch und Purcell für diese Entdeckung den Nobelpreis für Physik [4, 117]. Abbildung 6: Felix Bloch (links) & Edward Mills Purcell (rechts) Begründer der Magnetresonanz und Nobelpreisträger für Physik des Jahres 1952 - aus [104]. 31 Das als NMR bezeichnete Verfahren verbreitete sich sehr schnell in den Bereichen der Physik und Chemie und wurde zu einer analytischen Methode bei der Untersuchung von chemischen Zusammensetzungen. In den späten ’60er und frühen ’70er Jahren des 20. Jahrhunderts entdeckte Raymond Damadian, ein Arzt der State University (Brooklyn, New York), anhand von in-vitro Versuchen, dass sich Protonenrelaxationszeiten von malignen Tumoren und normalen Geweben unterscheiden. Damadian nutzte die neue Technik jedoch nicht, um Schnittbilder zu erzeugen, sondern um mit seiner sogenannten „FONAR“-Technik eindimensionale Relaxationszeiten in unterschiedlichen Geweben zu bestimmen mit dem Ziel, verschiedene Gewebe zu charakterisieren. Im Jahr 1974 gelang es Damadian in Aberdeen/Schottland, die erste Abbildung eines Tumors an einem lebenden Tier zu präsentieren [23-25]. Paul Lauterbur, ein Chemieprofessor an der State University of New York zeigte 1973 im Journal flüssigkeitsgefüllten “Nature” die Modells erste [73]. ortsauflösende Lauterbur Abbildung hatte die eines Idee, Magnetfeldgradienten in allen drei Dimensionen zu schalten, um zwei- oder dreidimensionale Bilder zu erzeugen. Die Idee kam ihm, als er zum ersten Mal Computertomographie-Bilder sah. Einige Jahre später ist es wieder Raymond Damadian, dem es gelang, das erste Bild eines menschlichen Körpers anzufertigen. Der von ihm erstellte Thorax-Querschnitt ist zum damaligen Zeitpunkt eine technische Sensation, allerdings reicht die Ortsauflösung bei weitem nicht aus, um das Bild diagnostisch zu verwenden. Die Aufnahmezeit des Bildes betrug mehrere Stunden und war daher nicht für die praktische Anwendung geeignet [23-25]. 1978 gelang es Peter Mansfield in Nottingham das Problem der langen Bildakquisition zu beheben. Mansfield ließ eine ganze Bildzeile anstelle eines einzigen Bildpunktes auslesen. Erst diese erheblich verkürzte Aufnahmezeit bietet die Aussicht auf eine klinische Anwendung [83]. 32 Die ersten Magnetresonanztomographen enthielten einen zirkulären Permanentmagneten, welcher aus ferromagnetischem Material bestand. Diese wogen oftmals weit über 100 Tonnen. Wiederstandsmagneten wurden alternativ verwendet, hatten allerdings den Nachteil eines hohen Kühlbedarfs, da sich die enthaltene Spule erwärmte, um eine Feldstärke von bis zu 0.3 Tesla (T) zu erreichen. Durchgesetzt haben sich supraleitende Magneten, welche Feldstärken auch deutlich über 1 T erlauben [127]. Die Schering AG in Berlin hinterlegte im Jahre 1981 das erste Patent für ein durch Dr. Weinmann entwickeltes MRT-Kontrastmittel. Der Klinische Einsatz des Gd-DTPA (Magnevist®) erfolgte erstmalig Mitte der ’80er Jahre. Das intravenös applizierbare Kontrastmittel dient der Kontrastverstärkung im MRT und ähnelt in seiner Verteilung den jodhaltigen Röntgenkontrastmitteln. Die Verträglichkeit ist hierbei jedoch deutlich besser [71]. Ein gegenwärtiger Höhepunkt der Geschichte der Kernspintomographie ereignete sich 2003. Paul Lauterbur und Sir Peter Mansfield erhalten für Ihre Forschungen und Entwicklungen, welche entscheidend zur Entwicklung der Magnetresonanztomographie beigetragen haben, den Nobelpreis für Medizin [116]. Abbildung 7: Paul Lauterbur (links) & Sir Peter Mansfield (rechts) Nobelpreisträger für Medizin des Jahres 2003 - aus [105]. 33 1.3.3. Geschichte der kardiovaskulären Kernspintomographie Im Jahr 1983 untersuchten Herfkens et al. im Rahmen einer klinischen Studie das kardiovaskuläre System von 244 Patienten mit einem 0,35 T Scanner. Sie ermittelten mit Hilfe von Spin-Echo-Sequenzen anatomische Strukturen des Herz- und Gefäßsystems [48]. Im gleichen Jahr beschrieb Goldman die Fähigkeit der Kernspintomographie, in zwei- oder dreidimensionaler Form die anatomischen Strukturen des Herzens noninvasiv darzustellen. Dadurch ist sie insbesondere dazu geeignet, Kinder mit Herzkrankheiten zu untersuchen [42]. Im Jahr 1984 beschrieb McNamara eine neue Aufnahmetechnik in der Magnetresonanztomographie. Durch die Kopplung des MRT an das EKG des untersuchten Patienten erhielt er qualitativ gute Bilder der kardialen Strukturen [85]. Auch Lieberman et al. verwandten 1984 EKG-gekoppelte Aufnahmen und erhielten wesentlich bessere Aufnahmen als bei nicht-EKG-gekoppelter Aufnahmetechnik. Es gelangen, die gute Darstellung der anatomischen Strukturen des Herzens, einer Aortenstenose und Atherosklerose der Aorta abdominalis. Eine Bildgebung von atherosklerotischen Veränderungen der Koronarien gelang jedoch nicht [75]. Für die kardiale Diagnostik gewann die EKG-gekoppelte Magnetresonanztomographie immer mehr Bedeutung. Die Aufnahmezeit für transversale Schnitte des gesamten linken Ventrikels verkürzt sich auf ca. 6 Minuten. Dies machte die Magnetresonanztomographie zu einer praktischen bildgebenden Modalität [49]. 1985 unterschieden Revel und Higgins zwischen infarziertes und normales Myokard durch den Gebrauch von Relaxationszeiten und der sich daraus ergebenden Signalintensität [101]. 34 1987 beschrieb der Deutsche Kardiologe Udo Sechtem die Anwendung der neuen CINE-Technik zur Messung der kardialen Funktion. Sie ermöglicht durch die schnelle Aufnahme von Frames, also Einzelaufnahmen, die Darstellung eines gesamten Herzschlagzyklus. Hierdurch wurde eine Messung der ventrikulären Volumina und der Ejektionsfraktion möglich gemacht [114]. Schouman-Claeys et al. zeigten 1988 infarzierte Bereich in Form eines „Hypersignals“. Im Rahmen eines Tierversuches injizierten Sie das paramagnetische Kontrastmittel Gadolinium-DOTA und schlussfolgerten, dass hierdurch eine bessere Abgrenzung der Infarktareale ermöglicht wird [111]. In den ’90er Jahren wurden zahlreiche Studien in Bezug auf die MRTDiagnostik des Myokardinfarktes veröffentlicht. Krauss et al. von der Universität Leiden in den Niederlanden korrelierten CMRBefunde mit enzymatischen, angiographischen und nukelarmedizinischen Befunden. Sie zeigten, dass die Spin-Echo-Magnetresonanztomographie im Bezug auf den akuten Myokardinfarkt mit allen etablierten Modalitäten vergleichbar ist [66]. Die Kontrast-CMR Myokardinfarkte (K-CMR) zu wurde identifizieren zur und gängigen Untersuchung, quantifizieren. Die um schnellen Bildsequenzen der MRT dienen mehr und mehr zur Bestimmung der Myokardperfusion. Die MRT ermöglicht eine Evaluation der regionalen Perfusion und kontraktilen Funktion sowie die Unterscheidung zwischen normalem und geschädigtem Myokard. Die MRT ist in der Lage Infarktareale zu identifizieren, sowie Bereiche von „stunned“ oder „hibernating“ Myokard. Die Stress-MRT verwendet Dobutamin und Dipyridamol und erweitert dadurch die Exaktheit der MRT [93]. Joao A.C. Lima beschrieb 2004 in seinem State of the Art Paper, dass die MRT die komplexeste und sich am schnellsten entwickelnde Untersuchungsmethode bei Patienten mit verschiedenen kardiovaskulären Erkrankungen sei. Sie zähle zu den dominierenden bildgebenden Verfahren in den meisten Bereichen der klinischen Kardiologie [77]. 35 1.3.4. Physikalische Grundlagen 1.3.4.1. Kernmagnetische Resonanz Der menschliche Körper besteht zu mehr als 60% aus Wasser. Damit ist Wasser das häufigste Molekül in unserem Körper, bestehend aus Wasserstoff und Sauerstoff [67]. In der medizinischen Diagnostik wird das Resonanzsignal des Wasserstoffkerns zur Bildgebung benutzt. Der Kern des Wasserstoffs besteht aus nur einem Teilchen, dem positiv geladenen Proton. Durch Eigenrotationen (den sog. Spin) erzeugt das Proton ein Magnetfeld, das dem einer stromdurchflossenen Spule bzw. einem Stabmagneten ähnelt. Abbildung 8: schematische Darstellung a) eines Protons mit Spin, b) einer stromdurchflossenen Spule und c) eines Stabmagneten - aus [37]. In biologischem Gewebe haben diese Magnetfelder normalerweise beliebige, zufällig verteilte Richtungen, so dass nach außen keine magnetische Wirkung auftritt. In einem äußeren Magnetfeld (B0) richten sich diese Magnetfelder jedoch wie Kompassnadeln parallel zu diesem Feld aus [89]. 36 Abbildung 9: a) zufällig verteilte Ausrichtung der Magnetfelder b) parallele Ausrichtung der Magnetfelder zum äußeren Magnetfeld B0 aus [37]. Das Proton führt bei der Einwirkung einer solchen äußeren Kraft eine kreisende Bewegung aus, die als Präzession bezeichnet wird. Hierunter versteht man die Lageveränderung der Rotationsachse eines Kreisels, sobald äußere Kräfte auf ihn wirken. Vergleichbar ist dies mit einem rotierenden Kreisel, der angestoßen wurde. Die Anzahl solcher Präzessionsbewegungen um die Achse des Protons pro Sekunde wird als Präzessionsfrequenz bezeichnet. Diese Frequenz wird auch Larmorfrequenz genannt und ist proportional zur Stärke des Magnetfeldes B0. Errechnet wird sie durch die Larmor-Gleichung: ω0=γΒ0 ω = Präzessionsfrequenz (in Hz/Mhz) B0= Stärke des Magnetfeldes ( in T) γ = gyromagnetisches Verhältnis (für Protonen 42,5 Mhz / T). Das gyromagnetische Verhältnis ist eine Konstante, die für das chemische Element „H“, also für Wasserstoff 42.5 MHz / T beträgt [137]. 37 Die Mehrzahl der Protonen richtet sich in B0 parallel zur Richtung des Feldes aus. Die geringere Anzahl der Protonen richtet sich entgegengesetzt (=antiparallel) aus. Dies ist der Grundzustand [67]. Die antiparallelen Ausrichtungen weisen ein höheres Engergieniveau auf. Die energieärmere, parallele Ausrichtung wird von den Kernen bevorzugt, so dass die Kerne parallel zum externen Magnetfeld, in Z-Richtung überwiegen. Es entsteht ein messbares magnetisches Summationsmoment, da die magnetischen Kräfte sich in dieser Richtung addieren. Die Magnetisierung entlang des externen Magnetfeldes bezeichnet man als Longitudinalmagnetisierung, die Magnetisierung quer zum externen Magnetfeld in der XY-Ebene als Transversal- oder Quermagnetisierung [130]. Bei MR-Systemen dienen spezielle Aufnahmespulen zum Empfang des Signals, das von den Protonen aus dem menschlichen Körper zurückgesendet wird. Diese Signale sind die Rohdaten für die Berechnung des MR-Bildes. Die Aufnahmespulen der MR-Systeme liegen quer zu B0 in der xy-Ebene, daraus induziert die Längsmagnetisierung kein Signal [67]. Eine kurzzeitige Einstrahlung eines Hochfrequenzimpulses (HF-Impuls) wird als Anregung bezeichnet. Der Impuls in Form einer elektromagnetischen Welle hat die gleiche Frequenz wie die Larmorfrequenz der Protonen. Dies wird als „Resonanzbedingung“ bezeichnet. Es bedeutet, dass der Impuls Energie auf die Protonen überträgt. Der Ausdruck Phase bezeichnet den Winkel, um den ein magnetischer Vektor eines präzedierenden Spins ein zweiter Vektor voraus- oder hinterherläuft. Durch Einsstrahlung des HF-Impulses werden die präzedierenden und dadurch in unterschiedliche Richtungen weisenden Protonen synchronisiert und somit „in Phase“ gebracht. Dies wird auch als Phasenkohärenz bezeichnet [109, 137]. Die Magnetisierung wird um einen bestimmten Winkel aus ihrer feldparallelen Lage gedreht. Der gedrehte Magnetisierungsvektor kann nun in eine longitudinale Komponente Mz in Richtung des Magnetfeldes und in eine 38 transversale Komponente Mxy quer zum Magnetfeld in der xy-Ebene zerlegt werden. Erzeugt ein HF-Impuls α die Kippung des magnetischen Vektors um 90°, so spricht man auch von einem 90° Impuls. Abbildung 10: Schematische Darstellung der Kippung des magnetischen Vektors durch Hochfrequenzimpuls α um 90° in die xy-Ebene - Entstehung der Transversalmagnetisierung [37]. Dieser neue Vektor steht natürlich auch nicht still, sondern bewegt sich ebenfalls mit der Präzessionsfrequenz der Protonen. Durch ihre Rotation erzeugen die Protonen in einer Empfangsspule eine messbare Spannung - das MR-Signal [89]. Abbildung 11: Rückkehr der Gewebsmagnetisierung in den Gleichgewichtszustand erzeugt einen Strom in Empfangsspule. Verstärkung in Radiofrequenzverstärker - Entstehung des Ausgangssignals des MR Bildes - aus [37]. 39 1.3.4.2. Relaxationsmechanismen Direkt nach der Anregung beginnt die Relaxation, bei der die Protonen den angeregten Zustand verlassen und in den Grundzustand zurückkehren [130]. Für die Abnahme des MR-Signals sind zwei unabhängige Relaxationsprozesse verantwortlich. Der erste Prozess beruht darauf, dass die Kerne die bei der Anregung aufgenommene Energie wieder an ihre Umgebung abgeben. Die Längsmagnetisierung Mz baut sich wieder auf. Dieser Prozess wird als SpinGitter-Relaxation bezeichnet. Die Längs- oder Spin-Gitter-Relaxationszeit T1 beschreibt die Zeitkonstante der Rückkehr der Z-Kompomente des Summenmagnetisierungsvektors zum Ausgangswert. Abbildung 12: T1 Relaxation mit schematischer Darstellung der Rückkehr der Magnetfeldvektoren in B0 – Richtung - aus [81, 92]. Die bei der Anregung aufgenommene Energie wird wieder abgegeben, wobei die Geschwindigkeit von der Beweglichkeit des angeregten Kernes innerhalb des Gitters, d.h. des Molekülverbandes, abhängt. Daher unterscheiden sich die T1-Relaxationszeiten der Gewebe. In Geweben mit einer langen T1-Zeit läuft die Relaxation langsam ab. In Geweben mit einer kurzen T1-Zeit läuft die Relaxation schnell ab. 40 Die Quer- oder Spin-Spin-Relaxationszeit T2 ist die Zeitkonstante des exponentiellen Abfalls des Magnetismus in XY-Richtung. Abbildung 13: T2-Relaxation mit schematischer Darstellung der Phasenbeziehung der einzelnen Magnetfeldvektoren in der XY-Ebene aus [81, 92]. Hier präzedieren die Spins zunächst synchron, phasenkohärent, in einem Winkel (Phase) der XY-Ebene. Augrund von Wechselwirkungen der atomaren Dipole kommt es zunehmend zu Phasendifferenzen. Dadurch entsteht eine Reduktion des MR-Signals, da sich die Magnetvektoren gegenseitig aufheben, anstatt sich zu addieren. Zusätzlich wird diese Phasenverschiebung noch durch Inhomogenitäten des Magnetfeldes, verursacht durch das MR-Gerät und das untersuchte Gewebe, beschleunigt. Die Kombination dieser Dephasierungen verursacht einem beschleunigten Zerfall des Signals mit der Zeitkonstante T2* [72, 81, 89, 130]. 1.3.4.3. Gewebskontraste und Signalintensitäten Das Kontrastverhalten der MR-Bildgebung ist sehr viel komplexer, als das anderer bildgebender Verfahren. Die Relaxationszeiten haben einen wesentlichen Einfluss auf die Signalintensitäten und Bildkontraste, wobei die starke Gewebeabhängigkeit der Relaxationszeiten den ausgezeichneten Gewebekontrast vieler MRT-Aufnahmen erklärt. In vielen Fällen sind daher 41 unterschiedliche Weichteilstrukturen bereits ohne Kontrastmittel schon voneinander abgrenzbar. Aufnahmen mit einem hohen Anteil an T1-relaxationsbedingtem Bildkontrast werden auch als T1-gewichtete Aufnahmen bezeichnet. Auf T1-gewichteten Aufnahmen haben Strukturen mit kurzen T1-Relaxationszeiten (z.B. Fett, kontrastmittelangereichertes Gewebe), eine hohe Signalintensität und umgekehrt haben Stoffe mit langen T1-Relaxationszeiten (z.B. Wasser, Liquor) eine niedrige Signalintensität. Bei Aufnahmen mit hohem Anteil an T2-relaxationszeitbedingtem Bildkontrast wird von T2-gewichteten Aufnahmen gesprochen. Gewebe mit kurzen T2Relaxationszeiten (z.B. Hirn) haben eine niedrige Signalintensität, wogegen Strukturen mit langen T2-Relaxationszeiten (z.B. Wasser) eine hohe Signalintensität aufweisen [137]. Da der von den Protonen bei Längsrelaxation ausgehende magnetische Impuls sehr klein ist, werden die Protonen mehrmals angeregt und die gemessenen Signale elektronisch gemittelt (Averaging). Die magnetischen Impulse werden messbar. Eine Folge von mehreren HF-Impulsen bezeichnet man als (Puls-) Sequenz. Die Zeit zwischen zwei Anregungen heißt Repetitionszeit (TR), die Zeit zwischen Anregung und Signalaufnahme ist die Echozeit (TE) [52]. 1.3.4.4. Ortskodierung Zur Ortskodierung magnetischer Impulse überlagert man das Magnetfeld durch zusätzliche Magnetfelder, die Gradientenfelder. Dies dient der eindeutigen Zuordnung der Signale eines dreidimensionalen Objektes zu ihrem Ursprungsort. Die drei Gradientenfelder stehen orthogonal zueinander und überlagern während der Messung nacheinander das magnetische Hauptfeld. Ein Gradient beschreibt in diesem Fall eine definierte Magnetflußdichtezu- oder abnahme pro Längeneinheit. Ein HF-Impuls in einer bestimmten Lamorfrequenz regt dann nur Protonen einer schmalen Schicht an. So entsprich die Frequenz einem Ort im Gradientenfeld. 42 Nach Aufnahme der Datensätze mit den Frequenz- und Phaseninformationen für jede Schicht werden die Bilder durch eine spezielle Rechenoperation, die Fournier-Transformation, aus den gemessenen Signalen rekonstruiert [52, 130]. 43 1.3.5. Kontrastmittel Die Signalintensitätsdifferenz zweier Gewebe bestimmt in der MRT den Bildkontrast. Er ist abhängig von den intrinsischen Faktoren der verschiedenen Gewebe und von extrinsischen (gerätespezifischen) Faktoren, insbesondere der verwendeten Pulssequenz. MR-Kontrastmittel sind Pharmazeutika, welche zur Verbesserung der diagnostischen Information, die Signalintensitätsdifferenz erhöhen. Sie verändern die intrinsischen Eigenschaften der Gewebe. [137] Die für die MRT verwendeten Kontrastmittel sind chemische Verbindungen mit unpaaren Elektronen. Die unpaaren Elektronen sind bei Anlage eines externen Magnetfeldes ursächlich für die Magnetisierung des Stoffes, da sie eine wahre Ladung im Molekül darstellen, im Gegensatz zu einer partiellen Ladung. Kontrastmittel basieren auf sog. seltenen Erden, also Transitionsmetallen oder Lanthaniden, weil viele dieser Metalle eine hohe Anzahl unpaarer Elektronen enthalten. Allerdings sind diese Metalle toxisch und müssen in einem Chelatkomplex einschlossen werden, um den Körper zu schützen, in den sie injiziert werden. In der klinischen Anwendung kommen routinemäßig Gadodiamide und Gadolinium-Diethylentriaminpentaessigsäure (Gd-DTPA) zum Einsatz. Abbildung 14: Strukturformel des Gd-DTPA - aus [50]. 44 Sie sind auf der Basis von Gadolinium zusammengesetzt. Gadolinium in dieser Form hat sieben unpaare Elektronen, die eine koordinative Bindung innerhalb des Chelatkomplexes darstellen. Obwohl das Chelat bis zu einem gewissen Grad den Zugang zu den paramagnetischen Zentren der Zusammensetzung blockiert, wird immer noch eine sehr große Relaxation erreicht. Dadurch beeinflusst das Kontrastmittel das Magnetfeld in seiner Umgebung und bewirkt eine Änderung der Signalintensität durch Verkürzung der T1- und T2-Relaxation [89]. Das Kontrastmittel beschleunigt die Relaxation der es umgebenden Protonen dadurch, dass es ihnen in der T1-Wichtung die überschüssige Energie entzieht. Aufgrund der schnelleren Relaxation der Spins nimmt das Signal im MR-Bild zu. Es handelt sich daher um ein positive Kontrastmittel. Ebenso erfolgt in der T2Wichtung aufgrund von Spin-Spin-Effekten eine raschere Dephasierung und somit eine Beschleunigung der Relaxation (T2-Reduktion) [137]. Gewebe, die paramagnetisches Kontrastmittel enthalten, erscheinen in T2-oder T2*-gewichteten Bildern hypointens, in T1-gewichteten hyperintens [89]. In denen der vorliegenden Arbeit zugrundeliegenden Untersuchungen wurde als Kontrastmittel Gadolinium-DTPA (Magnevist®, Schering AG, Berlin, Deutschland) i.v. appliziert. 45 1.3.6. Infarktdiagnostik mittels Magnetresonanztomographie Myokardinfarkte können durch kontrastmittelverstärkte Aufnahmen mit der MRT dargestellt werden (K-CMR). Gadolinium-Verbindungen wie Gd-DTPA verteilen sich frei im Intravasalraum und diffundieren schnell in den Extrazellulärraum (Interstitium). Bei der kontrastmittelverstärkten Darstellung von infarzierten Myokardarealen wird der T1-verkürzende Effekt von Gadolinium-DTPA ausgenutzt. Gd-DTPA reichert sich in myokardialen Narben an und führt zur Signalanhebung in T1gewichteten Sequenzen, wobei man durch einen Inversionsvorpuls das Signal des nichtinfarzierten Myokards (längere T1-Relaxationszeit) weiter unterdrückt. Nach Kontrastmittelgabe kann im Gleichgewichtszustand im chronischen Infarktstadium ein hyperintenses Signal im Bereich der Infarktnarbe gesehen werden [58, 78]. 1.3.6.1. Late enhancement Optimaler Kontrast zwischen der hyperintensen Infarktzone und normalem Myokard wird erzielt, wenn die Bildgebung erst zehn Minuten nach der Kontrastmittelgabe stattfindet, so dass ein Auswaschen des Kontrastmittels aus dem Blut erfolgen kann. Diese auch als „late enhancement“ bezeichnete Technik eignet sich aufgrund der hohen räumlichen Auflösung hervorragend zur Bestimmung von Lokalisation und Ausmaß (z.B. Volumen) eines Myokardinfarktes. Kim et. al. nutzten diese Technik, um Myokardregionen mit reversibler Dysfunktion (kein Zelltod, jedoch Bestehen einer Wandbewegungsstörung) zu identifizieren und somit den Erfolg einer Revaskularisationsmaßnahme vorherzusagen [58]. Das Hyperenhancement chronischer Infarkte wird auf die größere interstitielle Matrix der kollagenen Fasern des Narben- bzw. Bindegewebes zurückgeführt, die zu einem größeren Verteilungsvolumen für Gd-DTPA führt. Im Gegensatz dazu finden sich im normalen Myokard dicht gepackte Myozyten. Der dem Hyperenhancement zugrundeliegende zelluläre Mechanismus ist jedoch bis heute noch nicht vollständig geklärt [129]. 46 Die kontrastmittelverstärkten Bilder enthalten Informationen über die Lokalisation und Ausdehnung von irreversibel geschädigten Myokardarealen, die sich hyperintens darstellen [89]. 1.3.7. Bestimmung der Myokardmasse Die Bestimmung der linksventrikulären Myokardmasse und Wanddicke erfolgt durch Planimetrie der endo- und epikardialen Konturen in mehreren Schichten mit anschließender Berechnung der Wanddicke durch Subtraktion der endound epikardialen Abschnitte unter Berücksichtigung der Schichtdicke, des Schichtabstands und der Anzahl der Schnitte. Das spezifische Gewicht von Myokard beträgt ca. 1,05 g/cm³ [89, 128]. 47 1.4. Elektrokardiogramm 1.4.1. Definition Das Elektrokardiogramm diagnostisches Verfahren, (EKG) ist welches ein in einfaches Klinik und und nichtinvasives Praxis mittlerweile unverzichtbar geworden ist. Das EKG ist eine Aufzeichnung elektrischer Potentialdifferenzen zwischen zwei verschiedenen Punkten der Körperoberfläche im Ablauf der Herzaktion [131]. Das Oberflächen-Elektrokardiogramm repräsentiert die intrakardiale Ausbreitung und Rückbildung elektrischer Impulse, die vom Sinusknoten gebildet, über die Vorhöfe, AV-Knoten und His-Bündel auf die Kammern übergeleitet werden, und sich in den Kammern über Reizleitungsschenkel und Purkinje-Faser-System ausbreiten. Jeder elektrische Teilvorgang ist im Elektrokardiogramm direkt repräsentiert mit Ausnahme der Impulsbildung im Sinusknoten und der sinuatrialen Erregungsüberleitung [112]. Abbildung 15: Die entsprechenden Abschnitte des normalen menschlichen EKG - modifiziert nach [110]. Der Kurvenverlauf des normalen menschlichen EKGs zeigt charakteristische Zacken, die seit Einthoven mit den Buchstaben P,Q,R,S,T benannt werden [22]. 48 1.4.2. Geschichte der Elektrokardiographie Im Jahr 1789 entdeckte der italienische Anatom Luigi Galvani zufällig an einem Froschschenkel den Zusammenhang zwischen elektrischen Strömen und Muskelkontraktion. Hierdurch wurde Galvani der Begründer einer neuen Wissenschaft, der Elektrophysiologie [95]. Im Jahr 1843 beobacht Carlo Mateucci, Physikprofessor der Universität Pisa, dass auch die Herztätigkeit auf elektrischen Strömen basiert. Er hatte Tierversuche mit Taubenherzen durchgeführt und die gewonnenen Erkenntnisse wurden von anderen Forschern erweitert und vertieft [88]. Im Jahr 1887 zeichnete der Britische Physiologe Augustus D. Waller der St. Mary’s Medical School, London, das erste menschliche EKG auf. Er verwendete hierfür ein Mercury Kapillar-Elektrometer [135]. Abbildung 16: Augustus Desiré Waller (1856 – 1922) zeichnet 1887 das erste menschliche EKG auf - aus [53]. Nachdem der niederländische Physiologe Willem Einthoven im Jahre 1889 auf einem Kongress beobachtete, wie A. Waller sein neues Verfahren vorstellte, entwickelte er ein neues Elektrometer und verwendete 1893 zum ersten Mal den Begriff “Elektrokardiogramm” [30]. 49 Einthoven benutzte ein verbessertes Elektrometer und verwendet Korrekturformeln. Er beobachtete 5 Phasen welche er P, Q, R, S und T nannte [31]. In Anlehnung an ein Empfangs- und Verstärkerinstrument der Überseetelegraphie entwickelt Einthoven das Saitengalvanometer. Er nutzte es zu elektrokardiographischen Zwecken und etablierte das EKG als ein klinisches, diagnostisches Hilfsmittel [32]. Einthoven stellt sich vor, dass die vom Herzen stammenden elektromagnetischen Kräfte durch einen Einzelvektor (Dipol) in der Mitte eines gleichseitigen Dreiecks dargestellt werden können. Das „Einthoven-Dreieck“ wird durch die drei Standardableitungen I, II, III gebildet [33]. Einthoven gilt als Erfinder der Elektrokardiographie und erhielt im Jahre 1924 “Für seine Entdeckung des Mechanismus des Elektrokardiogramms” den Nobelpreis. Noch heute werden die von ihm entwickelten Ableitungen und die Bezeichnung der einzelnen Zacken (P,Q,R,S,T) verwendet [10]. Abbildung 17: Willem Einthoven (1860- 1927), Nobelpreisträger 1924 für die Entdeckung des EKG-Mechanismus - aus [96]. 50 Harold Ensign Bennet Pardee gilt als Pionier der Diagnostik von Myokardischämie und Myokardinfarkt mittels der Elektrokardiographie. Der Arzt der New York Hospital Medical Clinic beschrieb im Jahr 1920 erstmalig die Entstehung von EKG-Veränderungen im Rahmen eines Myokardinfarktes am Menschen. Er zeigt die klare ST-Elevation im Laufe eines akuten Infarktes und die symmetrische T-Negativierung in späteren Phasen des Myokardinfarktes [62, 91]. Abbildung 18: Harold Ensign Bennet Pardee (1886 – 1973), Internist und Pionier im Bereich der Ischämiediagnostik mittels des EKG - aus [62]. Frank Wilson entwickelte die Konzepte Einthovens weiter und verwendete eine „indifferente Elektrode“, die später als Null- oder Zentralelektrode bezeichnet wird. Wilson entwickelte die unipolaren Ableitungen VR, VL und VF [138]. Emanuel Goldberger entwickelte die verstärkten (englisch = augmented) unipolaren Ableitungen aVR, aVF und aVL. Zusammen mit den drei EinthovenAbleitungen und den sechs Brustwandableitungen erhalten wir das 12-Kanal Oberflächen-EKG, welches heutzutage verwendet wird [54]. 51 1.4.3. Elektrophysiologie des Herzens Die Herzmuskulatur ist ein erregbares Gewebe. Das bedeutet, dass bioelektrische Vorgänge bei der Herztätigkeit eine entscheidende Rolle spielen. Sowohl die rhythmische Auslösung der Herzschläge als auch die Reihenfolge und zeitliche Latenz, mit der Vorhöfe und Kammern nacheinander in Aktion treten, wird durch den Erregungsablauf bestimmt. Die Herzmuskelfasern bilden ein funktionelles Synzytium - ein verzweigtes Netzwerk, in dem sich die Erregung ungehindert ausbreiten und eine Kontraktion auslösen kann [8]. Jede Muskelfaser ist in Ruhe polarisiert. Dabei entsteht eine Potentialdifferenz zwischen intrazellulärem (negativ) und extrazellulärem (positiv) Raum. Dieses sogenannte Membranpotential beträgt ca. -90 mV [121]. Bei der Entstehung des EKG spielen nur solche Potentialdifferenzen eine Rolle, die im Außenmedium der Herzmuskelfasern längs der Faserachse auftreten. Die Einzelfaser verhält sich dabei wie ein elektrischer Dipol, d.h. wie zwei räumlich getrennte, entgegengesetzt gleiche Punktladungen. Dieser Dipol wird durch den Dipolvektor dargestellt, welcher in Richtung des Faserverlaufs von minus (erregt) nach plus (unerregt) weist. Ruhende oder gleichmäßig erregte Fasern erzeugen keinen Dipolvektor [8]. Die Umladung der Zelle durch einen elektrischen Reizimpuls führt über eine Depolarisation zur Kontraktion [79]. Wird die Myokardfaser erregt, so wird das Ruhepotential über den Schwellenwert angehoben und es kommt zur plötzlichen Depolarisation mit überschießender Umladung der Membran, der so genannten Umpolarisation. Die Membranoberfläche wird gegenüber dem Zellinneren elektrisch negativ. Daran schließt sich die Erregungsrückbildungsphase an. Während dieser Repolarisation wird das negative Ruhepotential wieder aufgebaut. Die aufeinander folgenden Phasen der Depolarisation, Umpolarisation und Repolarisation bilden das monophasische Aktionspotential [43]. 52 Der Dipolvektor an der Erregungsfront (Depolarisationsvektor) zeigt in Richtung der Erregungsausbreitung. Die starken Aufzweigungen des Erregungsleitungssystems bewirken, dass jeweils nur kurze Abschnitte der Kammermuskulatur kontinuierlich von der Erregung passiert werden. Die fortschreitende Erregungswelle ist daher immer nur in kurzen Abschnitten tatsächlich präsent [8]. Die über das Myokard laufende Welle der Depolarisation führt zu einer fortlaufenden Kontraktion [79]. Zu jedem Zeitpunkt der Herzerregung summieren sich die Dipolvektoren zu einem räumlichen Integralvektor, der die Form der EKG-Kurve bestimmt. Die Größe und Richtung der EKG-Ausschläge ergibt sich aus der Größe des entsprechenden Integralvektors und seiner Projektion auf die Abgriffsrichtung. Das Fehlen einer Auslenkung im EKG (Nullinienverlauf) kann verursacht sein durch das Verschwinden des Integralvektors oder durch die Einstellung des Vektors senkrecht zur Abgriffrichtung. Das EKG entsteht durch Stromschleifen, die während der Erregung des Herzens an die Körperoberfläche gelangen. In den EKG-Kurven werden zeitliche Spannungsänderungen zwischen definierten Stellen der Körperoberfläche dargestellt. Die einzelnen Ausschläge enthalten Informationen über den kardialen Erregungsablauf [8]. Wenn eine depolarisierende Welle (Erregung) in Richtung auf eine positive Hautelektrode verläuft, so entsteht im EKG eine positive, nach oben gerichtete Zacke [79]. 53 Abbildung 19: Zeitliche Zuordnung der Phasen der Herzerregung zum EKG mit momentanen Integralvektoren darstellt als roter Pfeil - aus [64]. Die obige Abbildung zeigt eine zeitliche Zuordnung zwischen einzelnen Phasen der Herzerregung und entsprechenden Abschnitten des EKGs. P-Welle: Erregungsausbreitung über die Vorhöfe QRS-Komplex: Erregungsausbreitung über die Kammern T-Welle: Erregungsrückbildung in den Kammern [8]. Die Erregungsausbreitung in der Ventrikelmuskulatur lässt sich in drei Zeitabschnitte aufteilen, die bestimmten Teilen der Kammeranfangsgruppe des Elektrokardiogramms entsprechen. Während des ersten Zeitabschnittes erfolgt die Erregung des Kammerseptums, während des zweiten die Erregung der freien Wand beider Ventrikel und während des dritten die Erregung posterolateraler Anteile des linken Ventrikels und der Ausflussbahn des rechten Ventrikels. Die Erregungsausbreitung im Septum benötigt etwa 10-15 ms und beginnt im mittleren Drittel des Septums. 54 Die Erregung der freien Wand beider Ventrikel ergreift zunächst die spitzennahen Anteile beider Kammern. Die Erregung dringt von den Innenschichten zu den Außenschichten vor, ihre Erregungsausbreitung beträgt ca. 20-30 ms. Schließlich greift die Erregung auf die hinteren und diaphragmalen Partien beider Ventrikel über. Dieser letzte Teil der Erregungsausbreitung benötigt etwa 40 ms. Die Muskulatur der Kammern ist nun unter gleichzeitiger Kontraktion der Ventrikel vollständig erregt. Die Erregungsrückbildung beginnt zunächst in den Außenschichten der Spitzengegend und der freien Wand beider Ventrikel. Sie schreitet von den Außen- zu den Innenschichten fort [43]. 55 1.4.4. Myokardinfarktdiagnostik im EKG Neben der Diagnose eines Myokardinfarktes erlaubt das Elektrokardiogramm eine Abschätzung von Infarktstadium, Infarktgröße und Lokalisation des Infarktareals [112]. Das EKG zeigt beim Herzinfarkt prinzipiell folgende Veränderungen: Deutliche Hebung der ST-Strecke im EKG als sog. Monophasische Deformierung beim akuten Herzinfarkt. Beim alten Herzinfarkt ist die STStrecke nicht mehr angehoben. Die Q-Zacke ist jedoch auffällig groß, verbreitert und tief. Elektrokardiographisch kann der Herzinfarkt bezüglich der Q-Zacke (engl. Q-Wave) in zwei Gruppen eingeteilt werden. Die eine ist der Herzinfarkt mit Erscheinen von Q-Zacken und die andere ist der Herzinfarkt ohne Q-Zacke [120]. Geht man bei einem Infarkt vom Zentrum der Nekrose aus auf deren Rand zu, gelangt man vom Myokard mit deutlicher anatomischer Schädigung (Läsion) zunächst in Myokard mit nur funktioneller Störung (Ischämie) und schließlich in gesundes Myokard [43]. Abbildung 20: EKG bei Infarzierung mit den Bereichen Nekrose, Läsion, Ischämie und gesundem Myokard - modifiziert nach [43]. 56 Durch die infarzierte Gegend können keine elektrischen Impulse mehr geleitet werden, da dieses Gewebe elektrisch tot ist und nicht mehr auf normale Weise depolarisiert werden kann. Die Infarktgegend ist eine Lücke während der elektrischen Erregungsausbreitung; im übrigen Herzen, das normal durchblutet ist, läuft die Erregung normal ab [79]. Im Jahre 1954 berichteten Prinzmetal et al. über Ihre Versuche an einem Tiermodell. Sie zeigten, dass Q-Wave Myokardinfarkte transmural seien und Non-q-wave Infarkte nicht transmural seien [98]. Seit ungefähr 50 Jahren gehörte diese EKG-basierte Unterscheidung der Infarkte zur klinischen Praxis. Die Bedeutung dieser Unterscheidung bleibt jedoch unklar. Verschiedene Studien unter Einschluss von Autopsien am menschlichen Herzen haben jedoch gezeigt, dass die Beziehung zwischen Q-Zacken und der transmuralen Ausdehnung zufällig ist. In der heutigen Infarktdiagnostik wird der akute Myokardinfarkt in einen STSegmenthebungs- und einen nicht-ST-Segmenthebungs-Infarkt eingeteilt. Hierbei entsprechen die ST-Hebungsinfarkte den Q-Wave-Infarkten und die non-ST-Hebungsinfarkte den Non-q-wave-Infarkten [87]. In klinischen Leitfäden und in der Forschung wird jedoch auch heute noch weitestgehend das Vorhandensein von Q-Waves für die EKG-Diagnose von alten Infarkten verwendet [16, 29, 108]. 57 1.4.5. EKG-Zeichen eines abgelaufenen Infarktes Das Endstadium eines Myokardinfarktes geht mit der Konsolidierung der Infarktnarbe einher und ist im Elektrokardiogramm lebenslang nachzuweisen. Das Endstadium ist gekennzeichnet durch pathologische Befunde des QRSKomplexes und fakultativ auch der ST-Strecke bzw. der T-Welle [113]. 1.4.5.1. Q-Zacken oder Q-Waves Die Q-Zacke (engl. Q-Wave) ist die erste nach unten gerichtete Zacke des QRS-Komplexes, der keine andere Zacke des Kammerkomplexes vorausgeht. Eine signifikante oder auch pathologische Q-Zacke dauert 0,04 s und ist bei einer Registrierungsgeschwindigkeit von 50 mm/s gewöhnlich 2mm breit. Ein anderes Kriterium für die Signifikanz einer Q-Zacke ist ihre Größe bzw. ihre Höhe: die signifikante Q-Zacke hat die Größe von einem Drittel des genannten QRS-Komplexes. In bestimmten Ableitungen können normalerweise sehr kleine Q-Zacken auftreten. Diese kleinen q-Zacken werden als insignifikante Q-Zacken bezeichnet [79]. Der nekrotische Bezirk fällt elektrisch aus, da die abgestorbenen Myokardzellen bei erloschenem Ruhepotential keine Aktionspotentiale mehr bilden können. Die dem nekrotischen Gebiet entsprechenden Vektoren fehlen, so dass die Vektoren der übrigen intakten Kammerwand, die vom Infarkt wegzeigen, überwiegen. Hierdurch wird die Vektorschleife der Erregungsausbreitungsphase vom infarzierten Gebiet weggelenkt [43]. 1.4.5.2. R-Verlust und R-Minderung Die erste nach oben gerichtete Zacke der QRS-Komplexes ist die R-Zacke [79]. Normalerweise nimmt die Größe der R-Zacken von V1 – V6 zu. Dieser RZuwachs ist um so schneller, je steiler die Herzachse ist, je weiter die Herzachse nach links dreht, desto langsamer ist der R-Zuwachs. Liegt statt eines regelmäßigen, adäquaten R-Zuwachses ein R-Verlust von einer 58 Brustwandableitung zur nächsten vor, so ist dies ein Infarktzeichen, desgleichen eine Reduktion der R-Höhe [63]. Bei großen Infarkten ist die gesamte Vektorschleife so hochgradig vom Infarkt weggedreht, dass in Brustwandableitungen mit direktem Abgriff die R-Zacke verwindet und an ihre Stelle eine rein negative Kammeranfangsgruppe tritt: RVerlust [43]. 1.4.5.3. Horizontale ST-Senkung und deszendierende ST-Senkung Auf den QRS-Komplex folgt eine Pause. Diese Erregungspause nennt man die ST-Strecke. Diese isoelektrische Strecke verläuft im normalen EKG als Grundlinie zwischen QRS-Komplex und T-Welle. Sie entspricht dem kurzen Zeitraum, in dem beide Kammern gleich erregt sind [79]. Als weitgehend sicheren Hinweis auf eine Ischämie der Innenschichten des linksventrikulären Myokards gilt eine Senkung der ST-Strecke um wenigstens 0,05 – 0,1 mV (0,5-1 mm) in mindestens einer Extremitätenableitung bzw. um wenigstens 0,1 – 0,2 mV (1-2 mm) in einer Brustwandableitung, bei einem horizontal gestreckten oder abfallenden deszendierenden Verlauf. Als Messpunkt der ST-Senkung gilt die ST-Absenkung 0,08 s nach dem JPunkt (Ende der Kammeranfangsgruppe, Wendepunkt vom aufsteigenden Schenkel der S-Zacke zur ST-Strecke). Die Deszension der ST-Strecke stellt eine unspezifische Veränderung der Erregungsrückbildung dar. Sie kann Ausdruck einer pathologischen Veränderung sein. Die deszendierende ST-Strecke kann primär durch eine Minderdurchblutung des Herzmuskels bedingt sein. Verläuft die ST-Strecke horizontal gesenkt oder überhöht, so liegt eine sog. Läsion vor. Bedeutsam ist eine solche Verlagerung der ST-Strecke erst, wenn sie mehr als 0,1 mV bzw. mehr als 1 mm auf dem Papier beträgt [63]. 59 1.4.5.4. Präterminal negatives T Die T-Welle schließt sich der ST-Strecke an und beschreibt die Depolarisation der Ventrikel. Während der Repolarisation werden die Herzmuskelzellen wieder umgeladen, erst dann können sie wieder depolarisiert werden [79]. Die präterminal negative T-Welle hat einen zweizeitigen Verlauf. Der erste Anteil, liegt präterminal (vor dem Ende), unterhalb der isoelektrischen Linie, also im negativen Bereich. Der zweite Anteil, der terminale (Schlussteil), liegt oberhalb der isoelektrischen Linie, also im positiven Bereich. Die Winkelhalbierende durch die Spitze der TWelle zeigt in Richtung auf den zugehörigen QRS-Komplex [63]. Als Folge einer Schädigung der Kammerinnenwandschichten werde diese weniger stark erregbar, die Erregung erfolgt hier abgeschwächt und verkürzt. Dadurch beginnt in den Innenschichten im Anschluss an die verkürzte Erregungsausbreitung die Erregungsrückbildung vorzeitig, wogegen normalerweise die Außenschichten mit der Erregungsrückbildung beginnen. Bei Schädigung der Innenschicht herrscht gleich nach der Erregungsausbreitung die elektrische Negativität der Außenschichten vor. Hierdurch zeigen die Einzelvektoren schon zu ST-Beginn und während der weiteren Erregungsrückbildung von der Außen- zur Innenschicht. Der Hauptvektor der Erregungsrückbildung verläuft nun in entgegengesetzter Richtung zum Hauptvektor der Erregungsausbreitung. Die Hauptauschlagsrichtung des Kammerendteils wird diskordant zu der Kammeranfangsgruppe. In den für den linken Ventrikel charakteristischen Ableitungen kommt es zu einer T-Negativierung [43]. 60 2. Ziel der Arbeit Patienten mit abgelaufenem Myokardinfarkt haben je nach Infarktausdehnung (transmural – nicht transmural) und Lokalisation des Infarktareals unterschiedliche Veränderungen im 12-Kanal-Oberflächen-EKG. Mit der kardiovaskulären Kernspintomographie steht eine neue Methode mit exzellenter zeitlicher und räumlicher Auflösung zur Verfügung, die nicht nur die Beurteilung von Wandbewegungsstörungen, sondern auch, im Kontrastbild (nach Gabe eines Kontrastmittels, Gadolinium-DTPA), die exakte Abgrenzung und somit Lokalisation des Infarktareals erlaubt. Von entscheidender Bedeutung ist dabei, dass im Kontrast-CMR ohne große Schwierigkeit transmurale von nicht-transmuralen (subendokardialen und endokardialen) Infarkten unterschieden werden können. Damit ist die kardiovaskuläre Magnetresonanztomographie ein optimales Verfahren, um EKG-Veränderungen auf ihre Spezifität zu untersuchen. Bezüglich der Infarktausdehnung stellt sich die Frage, inwieweit Non-Q-WaveInfarkte wirklich nicht-transmural und Q-Wave-Infarkte wirklich transmural sind. Bezüglich der Infarktlokalisation stellt sich die Frage, wie exakt man unter Berufung auf das EKG die Infarktlokalisation voraussagen kann. Im Klinikalltag werden Q-Zacken im EKG zur Detektion von abgelaufenen bzw. chronischen Myokardinfarkten verwendet. Es stellt sich die Frage nach der Sensitivität der Q-Zacke. Die kardiovaskuläre Magnetresonanztomographie dient auch hier als Verfahren, um die Sensitivität von Q-Zacken im EKG bezüglich der Präsenz und Transmuralität chronischer Myokardinfarkte zu untersuchen. Ziel der vorliegenden Arbeit ist somit der Versuch, der genauen Abschätzung der Folgeerscheinung des abgelaufenen, chronischen Myokardinfarktes in Form einer myokardialen Narbe mittels des 12-Kanal-Oberflächen EKG und der CMR. 61 3. Material und Methoden 3.1. Patienten Untersucht wurden 90 Patienten (64.6 ± 11.1 Jahre) mit einem vorausgegangenen Infarktgeschehen (7.4 ± 3.6 Monate vor Untersuchung). Diese Evaluation basiert auf einer im Vorfeld sorgfältig erhobenen Anamnese, Feststellung der Krankengeschichte und nach Einsicht in die entsprechenden Patientenakten. Es wurden 69 Männer (76.7%) und 21 Frauen (23.3%) untersucht. Tabelle 1: Alter in Jahren des Gesamtkollektivs nach Geschlecht unterteilt gültige N Mittelwert+SA Median Minimum-Max Frauen 21 65.5+12.8 66 28-83 Männer 69 64.3+10.6 65 36-81 insgesamt 90 64.6+11.1 66 28-83 Die kardiovaskuläre Magnetresonanztomographie wurde im Rahmen einer klinischen Untersuchung oder aber zu wisschenschaftlichen Zwecken in Rahmen einer prospektiven Studie angefertigt. 45 Patienten (65.3 ± 11.6 Jahre) hatten einen transmuralen Herzinfarkt während 45 Patienten (63.8 ± 10.6 Jahre) einen nicht-transmuralen Herzinfarkt aufwiesen. Tabelle 2: Alter in Jahren des Gesamtkollektivs nach Art des Infarktes unterteilt gültige N Mittelwert+SA Median Minimum-Max nontransmural 45 63.8+10.6 64 36-83 transmural 45 65.3+11.6 67 28-83 Insgesamt 90 64.6+11.1 66 28-83 62 Um die Spezifität und den prädiktiven Wert der Ergebnisse bestimmen zu können, wurden EKG und kardiovaskuläre Magnetresonanztomographie an einer Kontrollgruppe von 45 herzgesunden Patienten durchgeführt. Diese hatten keinerlei Herzbeschwerden, keine Veränderungen des 12- Kanal Oberflächen-EKG und keinerlei Auffälligkeiten bzw. kein „late enhancement“ im Rahmen der Kontrastmittel verstärkten kardiovaskulären CMR. Die Ausschlusskriterien waren das Vorhandensein von allen kardialen Erkrankungen, die möglicherweise eine Q-Zacke verursachen könnten wie beispielsweise: Hypertrophe Kardiomyopathie, WPW-Syndrom oder eine dilatative Kardiomyopathie. Außerdem wurden Patienten mit den Kontraindikationen für die K-CMR ausgeschlossen: Die Untersuchung war absolut Herzschrittmachern, Defibrillatoren, Herzklapppen Typ (vom kontraindiziert bei Patienten Neurostimulatoren, Starr-Edwards), Clips nach mit speziellen Gefäß- oder neurochirurgischen OP’s, Insulinpumpen, Metallsplitter, Ohrimplantate, schwere Ruhedyspnoe (pulmonale Hypertonie, schwere Herzinsuffizienz) sowie ein instabiler Zustand des Patienten. Relative Kontraindikationen waren Klaustrophobie und Adipositas per magna. Patienten mit Links- oder Rechtsschenkelblock wurden nicht mit in die Studie eingeschlossen, da dies die korrekte Interpretation des QRS-Komplexes und der Kammerendteile nicht zulässt [87]. Unruhe des Patienten, Rückenschmerzen, Juckreiz, Pollakisurie im Rahmen einer Diuretikatherapie sowie Vorhofflimmern verursachten erschwerte Untersuchungsbedingungen. Untersuchungsbefunde mit schlechter Bildqualität wurden nicht ausgeschlossen. Kein Patient wurde innerhalb des Zeitraums von einer Woche 63 nach einem Infarktgeschehen mit in die Studie eingeschlossen. In dieser Zeit eines akuten Infarktes kann eine Q-Zacke dynamisch sein [60, 84]. Die Studie wurde gemäß der Deklaration von Helsinki durchgeführt. 3.1.1. Patientenvorbereitung Vor dem Tag der geplanten Untersuchung wurden die Patienten über die Art und den Ablauf der Untersuchung aufgeklärt. Eine Einverständniserklärung des Patienten wurde in schriftlicher Form eingeholt. Wenn Kontraindikationen vorhanden waren, wurden die Patienten im Voraus von der geplanten Untersuchung ausgeschlossen. Am Tag der Untersuchung wird der bis auf die Unterwäsche entkleidete Patient in Rückenlage mit dem Kopf in Richtung des Kernspintomographen auf den Untersuchungstisch positioniert. Auf Wunsch des Patienten wurden bei Bedarf (Unruhe, Angst) 20 Tropfen Prometazin per os zur Beruhigung verabreicht. 64 3.2. Kardiovaskuläre Magnetresonanztomographie 3.2.1. Bildakquisition Die Bilder wurden aufgenommen von einem Siemens 1.5 Tesla MRT (Magnetom, Sonata, Erlangen, Deutschland) mit einer vorder- und rückseitigen Oberflächenspule und einer prospektiven EKG-Triggerung. Abbildung 21: Siemens 1.5 Tesla MRT (Magnetom, Sonata, Erlangen, Deutschland) mit Patientenliege, Sende- und Empfangsspule und Gehörschutz. Verwendet wurde die Gradienten-Echo-Sequenz TrueFISP, eine schnelle Bildsequenz mit steady-state free precision. Auf der Basis von sog. „Scout images“ - also Orientierungsbildern wurden cineBilder erstellt in der kurzen, der vertikalen und der vertikalen langen Achse. 65 Kurzachsen-Bilder wurden unter Atemanhalten in der Endexspiration aufgenommen von der Herzbasis (AV-Ring) bis zur Herzspitze mit einer Schichtdicke von 10 mm. Eine Schicht wurde pro Atemanhaltephase aufgenommen. Die Anzahl der Einzelbilder pro Schicht betrug 80-90% eines RR-Intervalls, dem Intervall zwischen zwei R-Zacken, geteilt durch die TR. Folgende Parameter wurden verwendet: TR (repetition Time): 3,2 msec TE (echo Time): 1,6 msec Schichtdicke: 10 mm Flip-Winkel: 60° In-plane Pixel size: 2,3 x 1,4 mm Akquirierungszeit: 12 Herzschläge 15 Minuten nach intravenöser Gabe eines Gadolinium-basierten Kontrastmittels (gadopenat dimeglumin oder gadoteridol; 0,15 mmol/kg) wurde die kardiovaskuläre Kontrast-CMR in den gleichen Achsen der cine-Bilder erstellt. Hierbei wurde eine segmentierte Gradienten-Echo-Sequenz verwendet. Das Inversions-delay betrug 230-300 ms an die typische Voxelgröße 1.9 x 1.4 x 6.0 mm. 66 3.2.2. Localizer und Untersuchungsprotokoll Zu Beginn der Untersuchung erfolgte die Anfertigung eines ersten Übersichtsscans (Scout), d.h. mit einer Abbildung des Thorax in geringer räumlicher Auflösung mit transversaler, koronarer und sagittaler Schnittführung zur Orientierung sowie zur Festlegung der Herzhauptachse und evtl. abweichender Anatomie. Danach wurde ein zweiter Scout angefertigt. Dafür wurde in der transversalen Schnittführung des ersten Scouts die Schnittebene durch die Spitze des linken Ventrikels und durch die Mitte der Mitralklappe gelegt. In diesem Scout kann der linke Ventrikel in seiner maximalen Längsausdehnung abgebildet werden. Dieser zweite Scout sollte bereits in maximaler Endexspiration aufgenommen werden, ebenso wie die späteren Kurzachsenaufnahmen. Ferner fertigten wir noch einen dritten Scout an, der senkrecht auf dem zuvor angefertigtem Scout stehen sollte. Anhand dieses nun angefertigten, dritten Scouts konnten die Kurzachsenschnitte (engl.: short axis = SA) geplant werden. Nun wurden die sog. Kurzachsenschnitte (SA) angefertigt, die jeweils den kreisrunden linken Ventrikel sowie den ihm benachbarten entrundeten, muskelschwächeren rechten Ventrikel abbilden sollten. Sie wurden im 3. Scout geplant, indem wir dort die Schnittebene senkrecht zum interventrikulären Septum durch den rechten und den linken Ventrikel legten. 67 Abbildung 22: Beispiel für einen Kurzachsenschnitt (SA) mit kreisrundem linken und muskelschwächerem rechten Ventrikel Für unsere Zwecke haben wir bei unseren Untersuchungen den kompletten linken und rechten Ventrikel von der AV-Klappenebene bis zum Apex des linken Ventrikels mit einer Schichtdicke von 10 mm und einer Lücke von 3 mm zwischen den Schnitten in Endexpiration abgebildet, wofür wir insgesamt 7 – 11 Kurzachsenschnitte benötigten. Danach wurde, ausgehend von einem medialen Kurzachsenschnitt, ein sog. Vierkammerblick geplant (engl.: 4-chamber = 4-CH). Er zeigt die beiden Ventrikel und beide Vorhöfe in maximaler Längsausdehnung. Die einzustellende Schnittebene verläuft durch zwei Orientierungspunkte, von denen einer in der lateralen Spitze des rechten Ventrikels und der andere Orientierungspunkt im linken Ventrikel ventral des hinteren Papillarmuskels liegt. So verläuft die Schnittebene also nicht genau parallel zur dorsalen Hinterwand des Herzens. Als nächstes wurde der sog. Zweikammerblick (2-CH) eingestellt, welcher den linken Vorhof und den linken Ventrikel in der maximalen Längsausdehnung zeigt. Hierzu wurde im Vierkammerblick die Schnittebene durch den Apex des linken Ventrikels und durch die Mitte der Mitralklappe gelegt. 68 Abbildung 23: Beispiel für einen 4-Kammerblick und einen 2-Kammerblick Die letzte einzustellende Ebene ist der sog. Dreikammerblick (3-CH), auf dem der linksventrikuläre Ausflusstrakt (LVOT), die Aortenklappe und die Aorta ascendens dargestellt sind. Um die Ebene einzustellen, wählten wir einen basal gelegenen Kurzachsenschnitt, auf dem bereits LVOT und Aorta ascendens zu sehen sind. Abbildung 24: Darstellung des linksventrikulären Ausflusstraktes und der Aorta ascendes 69 Hier legte man die Schnittebene längs durch den LVOT und die Aorta ascendens. Nach Abschluß der Planung der gewünschten Kurz- und Längsachsenschnitte für die Wandbewegungsanalyse wurde das Kontrastmittel (Gadolinium-DTPA, Schering, Deutschland) als Bolus von 0,15 mmol/kg Körpergewicht über eine periphere Vene injiziert. Daraufhin blieb ein Zeitfenster von 10-15 Minuten um die Wandbewegung in Ruhe darzustellen. Anschließend wurde der gesamte linke Ventrikel mit einer T1-gewichteten Gradienten-Echo-Sequenz in Kurzachsenschnitten (z.B. 20 Schichten à 5 mm) durchgeschichtet. Dies geschah mit Mehrschichtaufnahmen in Atemanhaltetechnik. Optimaler Kontrast wurde durch einen Vorpuls-Delay zwischen 220 und 250 ms erzielt. 3.2.3. EKG bei Untersuchung Das EKG hat bei Herzuntersuchungen den höchsten Stellenwert. Es dient der Patientenüberwachung und der Darstellung des Herzzyklus. Um die Herzbewegung auszugleichen, werden nahezu alle Untersuchungen des Herzens EKG-gesteuert erstellt. Dabei kommen verschiedene Trigger- und Gating-Techniken zur Anwendung, die oft mit Techniken zur Unterdrückung der Atembewegung kombiniert werden [89]. Hierbei wird jede Anregung durch die R-Zacke ausgelöst, sodass jede Messung an genau der gleichen Stelle des Herzzyklus erfolgt. Damit werden die Bewegungsartefakte durch die Herzaktion eliminiert [137]. 70 3.2.4. Oberflächenspule Die Oberflächenspulen werden benutzt, um oberflächennahe Organe und Strukturen darzustellen. Sie dienen als Sende- und Empfangs-Spulen, deren Aufgabe es ist, Hochfrequenz-Impulse einzustrahlen, um die Wasserstoffprotonen im Körper anzuregen und das erzeugte Signal zu empfangen. Oberflächenspulen liegen direkt auf dem Körper, woraus sich ein gutes Signal-Rausch-Verhältnis ergibt [89]. Abbildung 25: Exemplarische Anlage einer Oberflächenspule bei einem Patienten vor der Untersuchung. 71 3.2.5. Bildanalyse Die Bilder wurden ausgewertet mit dem kommerziell erhältlichen ComputerSoftware-Programm Argus (Siemens) von zwei unabhängigen Untersuchern. Die Kontrastmittelanreicherung wurde mit Hilfe eines 17-Segment-Modells lokalisiert [18]. Abbildung 26: 17- Segment-Modell des linken Ventrikels im Kurzachsenschnitt und in der vertikalen Längsachse zur Lokalisation der Kontrastmittelanreicherung - modifiziert nach [18]. 72 Das Gebiet der Kontrastmittelanreicherung wurde in jeder Schicht abgegrenzt und einem Segment bzw. mehreren entsprechenden Segmenten zugeordnet. Abbildung 27: Abgrenzung eines durch late enhancement identifizierten transmuralen Infarktareals – anterolaterales, laterales, inferolaterales und inferiores late enhancement. Der Myokardinfarkt wurde als transmural definiert, wenn in der gesamten Myokarddicke eine Kontrastmittelanreicherung präsent war. Nicht-transmural war ein Infarkt, sobald sich eine Kontrastmittelanreicherung von weniger als 75 % der Myokarddicke zeigte [139]. Infarkte mit einer Kontrastmittelanreicherung von 75-99% der Wanddicke wurden aus der Studie ausgeschlossen um sicherzugehen, dass eine klare Unterscheidung zwischen transmuralen und nicht-transmuralen Infarkten gegeben ist. 73 3.2.6. Patienten der Untergruppe „Infarktmasse“ In einer Untergruppe von 41 Patienten (61.3 ± 11.4 Jahre) wurde die Masse der Infarkte berechnet. Die Patienten hatten einen dokumentierten chronischen Myokardinfarkt mit einem Infarktalter von 8.5 ± 2.6 Monaten. Darunter befanden sich 34 Männer (83%) und 7 Frauen (17%). 18 Patienten (59.8 + 12.9 Jahre) hatten einen transmuralen und 23 (62.5 + 10.2 Jahre) einen nicht-transmuralen Infarkt. EKG und kardiovaskuläre Magnetresonanztomographie wurden an einer Kontrollgruppe von 10 herzgesunden Probanden durchgeführt. Diese hatten keinerlei Herzbeschwerden, somit keine Veränderungen des 12- Kanal Oberflächen EKG und keinerlei Auffälligkeiten bzw. kein Late enhancement im Rahmen der Kontrastmittel verstärkten kardiovaskulären Magnetresonanztomographie. 74 3.2.7. Bildanalyse der Untergruppe „Infarktmasse“ Die im K-CMR kontrastmittelverstärkte Fläche (hyperenhancement) wurde in jeder Schicht abgegrenzt und die infarzierte Fläche in cm² pro Segment sowie die transmurale Ausdehnung berechnet. Hierfür wurden durch eine TrueFISP-Sequenz alle Schichten lückenlos in der kurzen Herzachse von der Herzbasis bis zum Apex angefertigt. Das linksventrikuläre Kavum wurde durch spezielle Nachbearbeitungssoftware entlang der Endokardkonturen manuell segmentiert. Im weiteren erfolgte eine manuelle Segmentierung entlang der Epikardkonturen. Abbildung 28: Kurzachsenschnitt mit Markierung des Endokards (grün), des Epikards (gelb), der Papillarmuskeln (weiß) und des infarzierten Areals (rot) bei einem Patienten mit inferiorem Myokardinfarkt modifiziert nach [128]. Die Myokardmasse berechnet sich dann aus der Subtraktion der endo- und epikardialen Abschnitte unter Berücksichtigung der Schichtdicke, des Schichtabstands und der Anzahl der Schnitte. Das spezifische Gewicht des Myokards beträgt 1.05 g/cm³ und wird zur Massenberechnung benötigt [89]. Die Infarktmasse wurde nach folgender Formel errechnet: Infarktfläche (cm²) x Schichtdicke (cm) x 1.05 g/cm³. Die errechnete Infarktmasse in Gramm (g) pro Schicht wurde addiert und somit die totale Infarktmasse in Gramm (g) errechnet. 75 3.3. Elektrokardiographie 3.3.1. Erstellung des Ruhe-EKG Vor jeder K-CMR-Untersuchung wurde bei allen Patienten ein 12-KanalOberflächen-Elektrokardiogramm erstellt. Das hierfür genutzte Gerät war ein Marquette MAC 1200 (Marquette Hellige, Freiburg, Deutschland). Vor Beginn der EKG-Ableitung wurden die Unterschenkel, die Brust sowie die Arme des Patienten von Kleidung befreit und der Patient gebeten, sich auf eine bereitstehende Liege zu legen, sofern er sich nicht schon in liegender Position befand. Zur Reduktion des Kontaktwiderstandes der Haut wurde ein Kontaktspray (Contact Spray, GE Medical Systems Information Technologies GmbH, Freiburg, Deutschland) zur Befeuchtung auf die entsprechenden Elektrodenanlagestellen gesprüht. Die Saugelektroden wurden daraufhin auf der Haut über der Muskulatur angebracht. Die zwölf EKG-Ableitungen beim Standard-12-Kanal-EKG setzen sich aus Extremitätenableitungen und Brustwandableitungen zusammen. Die Saugelektroden sind farblich gekennzeichnet und werden wie folgt plaziert: Extremitätenableitungen: 1. Elektrode (rotes Kabel) rechter Arm 2. Elektrode (gelbes Kabel) linker Arm 3. Elektrode (grünes Kabel) linkes Bein 4. Elektrode (schwarzes Kabel) rechtes Bein 76 Brustwandableitungen: V1: 4. ICR rechts parasternal V2: 4. ICR links parasternal V3: 5. Rippe zwischen V2 und V4 V4: 5. ICR linke Medioklavikularlinie V5: 5. ICR vordere, linke Axillarlinie V6: 5. ICR mittlere, linke Axillarlinie Abbildung 29: Marquette MAC 1200, Marquette Hellige, Freiburg, Deutschland, wurde zur Aufzeichnung des 12-Kanal-Oberflächen-EKG verwendet. 77 Nach Anlage der Elektroden wurde der Patient aufgefordert ruhig liegen zu bleiben, nicht zu sprechen und keine Bewegungen mehr auszuführen. Abbildung 30: Die Plazierung der Elektroden am liegenden Patienten Auf Knopfdruck erfolgten die Aufzeichnung und die Ausgabe des EKG auf zwei separaten Seiten. Durch einen weiteren Knopfdruck lösen sich alle angebrachten Saugelektroden und die Untersuchung ist beendet. Die Gesamtdauer der Untersuchung betrug durchschnittlich ca. 2 Minuten. 78 3.3.2. EKG-Analyse Die 12-Kanal-Oberflächen-Elektrokardiogramme wurden von zwei Untersuchern in Anlehnung an den Minnesota Code 1.1.1 - 1.2.8 und 1.3.1 - 1.3.6 ausgewertet [12]. Beide Untersucher hatten keine Kenntnis über den Befund der K-CMR. Die Untersucher, welche die K-CMR Bildanalyse durchführten, hatten entsprechend keine Kenntnisse über die Befunde der Elektrokardiogramme. Es erfolgte die Anwendung der „Q-Wave / non-Q-Wave“ - Myokardinfarktdefinition der „Thrombolysis in Myocardial Infarction (TIMI) Gruppe sowie den Minnesota Code 1.1.1-1.2.8 und 1.3.1-1.3.6 zur primären Auswertung der Elektrokardiogramme. Der Q-Wellen-Infarkt wird wie folgt definiert: Pathologische Q-Zacke (>30 ms) in zwei benachbarten Ableitungen [7, 12]. Die EKG-Zeichen Q (großes Q), q (kleines q), R-Minderung, R-Verlust, horizontale ST-Senkung, deszendierende ST-Senkung und T-Negativierung wurden in den entsprechenden Ableitungen aufgesucht. Anhand der EKG-Zeichen wurden die Infarkte lokalisiert, wobei folgende 6 Lokalisationen der Infarzierung betrachtet wurden: Anterior: V2-V6, I, avL Inferior: II,III,avF Anterolateral: V2-V5, I, aVL Anteroseptal: V1-V4 Lateral: I, aVL, V5, V6 Inferolateral: II,III,avF, V4-V6 [22, 113]. 79 3.4. Statistische Auswertung Die Auswertungen kategorialer Merkmale erfolgte durch die Angabe von absoluten und relativen Häufigkeiten (Prozent). Zur Deskription metrischer Merkmale wurden Mittelwert+Standardabweichung (SA) angegeben. Der Mittelwert ist eine Funktion aus der Summe aller Messwerte dividiert durch deren Anzahl n. Die Standardabweichung misst die Abweichung der Messwerte vom Mittelwert [69]. Der exakte Fishertest wurde benutzt, um die Nullhypothese der Unabhängigkeit von EKG-Veränderung und transmuraler Ausdehnung der Infarzierung (transmural oder nicht-transmural) gegen die Alternative der Abhängigkeit zu testen. Zum Vergleich der Infarktmasse bei Patienten mit transmuralen und nicht-transmuralen Infarkten bzw. bei Infarkten mit und ohne Q-Zacke wurde der Mann-Whitney-U-Test verwendet. Getestet wurde jeweils die Nullhypothese, dass die Infarktmasse in beiden Gruppen identisch verteilt ist. Alle statistischen Tests erfolgten zweiseitig zum Signifikanzniveau 0.05. Der pWert gibt die Wahrscheinlichkeit an, die Nullhypothese abzulehnen, obwohl die Nullhypothese richtig ist [70]. Zur Beurteilung der diagnostischen Güte des EKG hinsichtlich der Bestimmung der Infarktlokalisation im Vergleich mit den Befunden der Kardiovaskulären Magnetresonanztomographie wurden Sensitivität, Spezifität sowie positiver und negativer prädiktiver Wert (PPV, NPV) berechnet. Die Interobservervarianz wurde mit der Kappa-Statsitik quantifiziert. Dieses Maß misst den Grad der Übereinstimmung zweier (oder mehrerer) Observer bei der Beurteilung eines kategorialen Merkmals [132]. 80 4. Ergebnisse Kein Patient der Kontrollgruppe zeigte EKG-Veränderungen oder Kontrastmittelanreicherungen in der kardiovaskulären MRT (Spezifität 100%, negativ prädiktiver Wert 100%). Die kardiovaskuläre Magnetresonanztomographie zeigte transmurales late enhancement in 45 Fällen und nicht-transmurales late enhancement in 45 Fällen der untersuchten Patienten. 19 (42,2%) der Patienten mit transmuraler Kontrastmittelanreicherung zeigten Q-Wave-Infarkte im EKG, während 26 einen Non-Q-Wave Infarkt zeigten. 12 (26,7%) der Patienten mit nicht-transmuralem late enhancement zeigten einen Q-Wave-Infarkt, 33 einen Non-Q-Wave-Infarkt. 4.1. Infarktlokalisation Die Infarktlokalisation wurde im EKG und im K-CMR (Goldstandard) bestimmt. Die Diagnose transmural bzw. nicht-transmural wurde durch das K-CMR bestimmt. Tabelle 3: Infarktlokalisation MRT vs. EKG transmural (n=45) MRT nicht-transmural (n=45) EKG MRT insgesamt (n=90) EKG MRT EKG N % n % n % n % n % n % anterolateral 4 8.9 4 8.9 8 17.8 7 15.6 12 13.3 11 12.2 anterior 11 24.4 10 22.2 7 15.6 5 11.1 18 20.0 15 16.7 anteroseptal 13 28.9 8 17.8 10 22.2 5 11.1 23 25.6 13 14.4 lateral 6 13.3 4 8.9 7 15.6 6 13.3 13 14.4 10 11.1 inferior 18 40.0 16 35.6 24 53.3 17 37.8 42 46.7 33 36.7 inferolateral 17 37.8 15 33.3 16 35.6 15 33.3 33 36.7 30 33.3 inferoseptal 10 22.2 0 0.0 12 26.7 - - 22 24.4 - - septal 9 20.0 - - 7 15.6 - - 16 17.8 - - 81 Die Sensitivität, Spezifität und der prädiktive Wert der EKG-Zeichen im Hinblick auf die Lokalisation der transmuralen und nicht-transmuralen Narbe wurden bestimmt. Tabelle 4: Sensitivität, Spezifität und der prädiktive Wert der EKG – Zeichen in Bezug auf die Lokalisation des Infarktareals % der Gesamtkollektiv Kappa Fälle mit Sensitivität Spezifität (%) (%) PPV (%) NPV(%) gleicher Angabe Anterolateral 90.0 0.55 58.3 94.9 63.4 93.7 Anterior 83.3 0.44 50.0 91.7 60.0 88.0 Anteroseptal 82.2 0.46 43.5 95.5 76.9 83.1 Lateral 90.0 0.55 53.9 96.1 70.0 92.5 Inferior 74.4 0.48 61.9 85.4 78.8 71.9 Inferolateral 72.2 0.39 57.6 80.7 63.3 76.7 Inferoseptal - - - - - - Septal - - - - - - Die höchste Sensitivität fand sich mit 61,9 % im inferioren Segment. Die Spezifität war am höchsten im lateralen Segment (96,1%). Der positiv prädiktive Wert war inferior am höchsten und der höchste negativ prädiktive Wert fand sich anterolateral. 82 inferiore Infarkte 100% 90% EKG: 14.6 80% 70% 61.9 Infarkt kein Infarkt 60% 50% 40% 85,4 30% 20% 38,1 10% 0% kein Infarkt (n=48) Infarkt (n=42) MRT Abbildung 31: Sensitivität und Spezifität bei inferioren Infarkten. anterolaterale Infarkte 100% 5,1 EKG: 90% 80% 58,3 70% Infarkt kein Infarkt 60% 50% 94,9 40% 30% 41,7 20% 10% 0% kein Infarkt (n=78) Infarkt (n=12) MRT Abbildung 32: Sensitivität und Spezifität bei anterolateralen Infarkten. 83 anteriore Infarkte 100% 8,3 EKG: 90% 80% 50,0 70% Infarkt kein Infarkt 60% 50% 91,7 40% 30% 50,0 20% 10% 0% kein Infarkt (n=72) Infarkt (n=18) MRT Abbildung 33: Sensitivität und Spezifität bei anterioren Infarkten. anteroseptale Infarkte 100% 4,5 EKG: 90% 80% 43,5 Infarkt kein Infarkt 70% 60% 50% 95,5 40% 30% 56,5 20% 10% 0% kein Infarkt (n=67) Infarkt (n=23) MRT Abbildung 34: Sensitivität und Spezifität bei anteroseptalen Infarkten. 84 laterale Infarkte 100% 3,9 EKG: 90% 80% 53,8 70% Infarkt kein Infarkt 60% 50% 96,1 40% 30% 46,2 20% 10% 0% kein Infarkt (n=77) Infarkt (n=13) MRT Abbildung 35: Sensitivität und Spezifität bei lateralen Infarkten. inferolaterale Infarkte 100% EKG: 90% 19,3 80% 57,6 70% Infarkt kein Infarkt 60% 50% 40% 80,7 30% 42,4 20% 10% 0% kein Infarkt (n=57) Infarkt (n=33) MRT Abbildung 36: Sensitivität und Spezifität bei inferolateralen Infarkten. 85 4.2. EKG-Veränderungen bei chronischen Infarkten Die Häufigkeit von individuellen EKG-Veränderungen in chronischen transmuralen und nicht-transmuralen Infarkten sind in folgender Tabelle 5 wiedergegeben. Dabei wurde die K-CMR als Goldstandard verwendet. Die Diagnose nicht-transmual und transmural wurde durch die K-CMR gestellt. Tabelle 5: EKG-Veränderungen bei transmuralen und nicht-transmuralen Infarkten nicht-transmural transmural insgesamt (n=45) (n=45) (n=90) präterminal negatives T 35 (77.8%) 35 (77.8%) 70 (77.8%) 1.000 Q 12 (26.7%) 19 (42.2%) 31 (34.4%) 0.183 q 7 (15.6%) 13 (28.9%) 20 (22.2) 0.204 R-Verlust 8 (17.8%) 10 (22.2%) 18 (20.0%) 0.793 R-Minderung 14 (31.1%) 18 (40.0%) 32 (35.6%) 0.509 1 (2.2%) 1 (2.2%) 2 (2.2%) 1.000 1 (2.2%) 2 (4.4%) 3 (3.3%) 1.000 desc. ST p-Wert Senkung horiz. ST Senkung Q-Zacken, q-Zacken, R-Verluste, R-Minderungen und horizontale ST- Senkungen kommen in absoluten Zahlen gemessen häufiger bei transmuralen Infarkten vor. Die präterminal negativen T-Wellen und deszendierenden ST-Senkungen kommen bei beiden Infarktformen gleich häufig vor. Keiner der Unterschiede in den EKG-Parametern zwischen transmuralen und nicht-transmuralen Infarkten war statistisch signifikant. 86 4.3. Sensitivität der Q-Zacke in Bezug auf die Infarktmasse In einer Untergruppe von 41 Patienten wurde die Masse des jeweiligen Infarkts berechnet. Bei keinem der 10 herzgesunden Probanden wurden EKG-Veränderungen oder späte Kontrastmittelanreicherungen in den K-CMR-Bildern diagnostiziert (Spezifität 100%). Es zeigten sich bei 18 Patienten transmurale Infarkte, bei 23 Patienten nicht-transmurale Infarkte. Q-Zacken zeigten sich im Rahmen der nicht-transmuralen Infarkte in 35% der Fälle und bei 39% der transmuralen Infarkte. Tabelle 6: Q-Zacke in transmuralen und nicht-transmuralen Infarkten sowie entsprechende Infarktmasse Nicht-Transmural Transmural Total (n=23) (n=18) (n=41) Q-wave 8 (35%) 7 (39%) 15 (37%) Non-Q-wave 15 (65%) 11 (61%) 26 (63%) 4.3+2.7 7.2+4.4 5.6+3.8 Masse (g) P-Wert 1.000 0.0239 87 Die Sensitivität der Q-Zacken im EKG betrug für die Präsenz eines Infarktes 37%, für die Transmuralität eines Infarktes 39%. Es wurden weiterhin Infarkte mit Q-Zacke hinsichtlich der bestimmten Myokardmasse in Gramm (g) betrachtet. Infarkte ohne Q-Zacke hatten im Mittel eine Infarktmasse von 5.1 g (Median: 4 g); Infarkte mit Q-Zacke hatten im Mittel eine Infarktmasse von 6.5 g (Median 6.1g). Dieser Unterschied zeigte eine statistische Signifikanz (p=0.0348). Tabelle 7: Relation Q-Zacke zu Infarktmasse (g). Infarktmasse gültige Mittelwert+SA Median N Minimum P-Wert - Max Q-Zacke Nicht vorhanden 26 5.1+4.1 4 0.6-18 vorhanden 15 6.5+3.1 6.1 0.9-13.4 0.0348 Infarktmasse Infarktmasse [g/cm2] 20 15 10 5 0 nicht vorhanden (n=26) vorhanden (n=15) Q-wave Abbildung 37: Box-Plot der Infarktmasse (g) gegen Q-wave. 88 4.4. Beispiele für Untersuchungsbefunde Abbildung 38: Transmuraler Myokardinfarkt ohne Q-Zacken. Die Kontrastanreicherung im CMR zeigt einen inferolateralen, inferioren und inferoseptalen transmuralen Myokardinfarkt in der vertikal longitudinalen Achse und in zwei Kurzachsenschnitten (siehe weiße Pfeile). Obschon der Infarkt transmural ist, zeigt das entsprechende EKG keine pathologischen Q-Zacken. 89 Abbildung 39: Transmuraler Infarkt mit nicht pathologischen q-Zacken. Das Bild zeigt einen transmuralen Infarkt mit anteriorer, anterolateraler, anteroseptaler und septaler Ausdehnung ( weiße Pfeile) in der vertikal longitudinalen Achse sowie in drei Kurzachsenschnitten von der Basis bis zur Herzspitze. Das entsprechende 12-Kanal-Oberflächen-EKG zeigt nicht pathologische q-Zacken (gepunktete Pfeile) und T-Negativierungen (schwarze Pfeile) in den Ableitungen I und aVL. In den Ableitungen V2 bis V6 finden sich eine Reduktion der R-Zacke und fehlende R-Progression. 90 Abbildung 40: Nicht-transmuraler Infarkt mit tiefen T-Wellen. Die K-CMR zeigt einen inferioren nicht-transmuralen Infarkt in verschiedenen Kurzachsenschnitten (weiße Pfeile). Das korrespondierende EKG zeigt tiefe TWellen in den Ableitungen II, III, aVF und V4-V6 (schwarze Pfeile). Die verminderte R-Progression ist in den Ableitungen V4-V6 zu beobachten. 91 Abbildung 41: Nicht-transmuraler Infarkt mit Q-Zacken. Die K-CMR zeigt eine midventrikuläre, inferoseptale und apikale bis inferoseptale nicht-transmurale Infarzierung in zwei unterschiedlichen Kurzachsenschnitten (weiße Pfeile). Das EKG zeigt pathologische Q-Wellen (schwarze Pfeile) und T-Negativierungen in den Ableitungen II, III und aVF sowie deszendierende ST-Senkungen mit T-Negativierungen in den Brustwandableitungen V4-V6. 92 Abbildung 42: Nicht-transmuraler Infarkt mit Infarktmasse von 11,77 g zeigt deutliches Q in III. In der kontrastverstärkten kardiovasulären Magnetresonanztomographie zeigt sich ein nicht-transmuraler Infarkt inferoseptal, inferior und inferolateral (weiße Pfeile). Die Infarktmasse wurde in jeder einzelnen der drei Schichten bestimmt und addiert. Es ergab sich ein Wert von 11,7 g. Es zeigt sich ein deutliches Q in Ableitung III des 12-Kanal-Oberflächen EKG (schwarze Pfeile). 93 Abbildung 43: Transmuraler inferiorer Infarkt mit EKG-Veränderungen in II,III und aVF. Die kardiovaskuläre Kernspintomographie zeigt ein transmurales late enhancement im inferioren Segment (weiße Pfeile). Das 12-Kanal-EKG zeigt tiefe T-Negativierungen in den Ableitungen II, III und aVF (schwarze Pfeile). 94 5. Diskussion Ziel der vorliegenden Arbeit war zu klären, ob es anhand des 12-KanalElektrokardiogramms möglich ist, transmurale von nicht-transmuralen chronischen Myokardinfarkten zu unterscheiden. Ferner hinterfragte die vorliegende Arbeit die Exaktheit des Elektrokardiogramms hinsichtlich der Bestimmung der Infarktlokalisation. Die Sensitivität der Q-Zacke im Hinblick auf die Präsenz und Transmuralität von chronischen Infarkten konnte durch Untersuchung einer Untergruppe des gesamten Studienkollektivs ermittelt werden. 5.1. Gesamtkollektiv Im Zeitraum zwischen Januar 2001 und Mai 2005 wurden insgesamt 90 Patienten untersucht. Es wurden 69 Männer (79.7%) und 21 Frauen (23.3%) untersucht. Die weiblichen Patienten waren im Durchschnitt 65.5 ± 12.8 Jahre alt, die männlichen 64.3 ± 10.6 Jahre alt. Insgesamt betrug das Durchschnittsalter der untersuchten Patienten 64.6 ±11.1 Jahre. Männliche und weibliche Patienten unterscheiden sich nicht signifikant hinsichtlich des Alters (p=0,593). Es zeigte sich ein signifikanter Unterschied hinsichtlich der Geschlechtsverteilung, die koronare Herzerkrankung wird als eine Erkrankung des männlichen Geschlechts angesehen [86]. Frauen besitzen während der Adoleszenz ein niedrigeres Risiko, kardiale Erkrankungen zu erleiden. Dieser Vorteil relativiert sich jedoch nach der Menopause [126]. Dies erklärt die deutlich höhere Anzahl der männlichen Patienten einerseits, andererseits auch den fehlenden Altersunterschied der männlichen und weiblichen Patienten. Die Studie wurde so konzipiert, dass 45 Patienten mit einem transmuralen und 45 Patienten mit einem nicht-transmuralen Infarktgeschehen untersucht wurden. 95 Patienten mit nicht-transmuralem Infarkt waren im Durchschnitt 63.8 ±10.6 Jahre alt, Patienten mit transmuralem Infarkt im Durchschnitt 65.3 ±11.6 Jahre. Statistisch zeigt sich somit kein signifikanter Unterschied hinsichtlich des Alters und des entsprechenden Infarktes (p = 0.674). 5.2. Rolle der kardiovaskulären Magnetresonanztomographie Die koronare Herzkrankheit ist in den westlichen Industrieländern die häufigste Todesursache und für 30% aller Todesfälle im Alter zwischen 35 und 64 Jahren verantwortlich. In Deutschland fallen ihr jährlich über eine Viertelmillion Menschen zum Opfer. Das entspricht 336 Sterbefällen an ischämischer Herzkrankheit und akutem Myokardinfarkt auf 100000 Einwohner. Moderne Therapiestrategien verfolgen eine möglichst unverzügliche Reperfusion des betroffenen Myokardareals nach einem Myokardinfarkt. Für die Planung einer adäquaten Therapie ist eine frühzeitige Diagnostik des myokardialen Infarktes mit einer präzisen Darstellung, Charakterisierung und Vitalitätsbeurteilung des geschädigten Myokards von grundlegender Bedeutung [59]. Die kardiovaskuläre Magnetresonanztomographie zur Diagnose von kardialen Erkrankungen gewinnt immer mehr an Bedeutung. Die kontrastmittelverstärkte Magnetresonanzbildgebung wird nach Gabe von paramagnetischen Kontrastmitteln durchgeführt. Hierbei erscheint myokardiales Narbengewebe als ein Bereich von hoher Signalintensität welche typischerweise eine subendokardiale Ausdehnung oder eine transmurale Ausdehnung zeigt [133]. Daher ist die kardiovaskuläre Magnetresonanztomographie momentan der Goldstandard, die Methode der Wahl zur Lokalisation und Quantifizierung einer Myokardnekrose [35, 87, 115, 139]. 96 5.3. Detektion der Infarktlokalisation Die kontrastmittelverstärkte kardiovaskuläre Magnetresonanztomographie mit Spätaufnahmen (late enhancement) erlaubt die präzise in vivo Detektion der gesamten Infarktgröße, der Lokalisation und der transmuralen Ausdehnung eines Myokardinfarktes [139]. Myers et al. linksventrikulären haben vor über fünfzig Myokardinfarkten Jahren untersucht. die Lokalisation Hierbei von wurden elektrokardiographische Ergebnisse mit pathologischen makroskopischen Befunden korreliert und im Verlauf durch weitere Studien bestätigt. Nach den Arbeiten von Myers et. al wurde konstatiert, dass der Nachweis von signifikanten Q-Zacken im EKG in den Ableitungen V1-V2 mit einem septalen Myokardinfarkt korrespondierte, Q-Zacken in den Ableitungen V3,V4 mit einem anterioren Myokardinfarkt einhergehen und Q-Zacken in den Ableitungen V5,V6, I und aVL zu einem lateralen Myokardinfarkt gehören. Ein Q in den Ableitungen II, III und aVF korrespondierte mit einem inferioren Myokardinfarkt [11]. Die vorliegende Arbeit hat sich bei der Auswertung der vorliegenden Elektrokardiogramme an klinischen Leitfäden und Standardwerken orientiert, welche, abgesehen von diskreten Modifikationen, mit den Erkenntnissen von Myers et al. übereinstimmen [22, 113]. Die Überprüfung dieser Korrelation ist nicht nur aus akademischer Sicht nützlich, sondern besitzt auch für den klinischen Alltag Bedeutung. Die genaue Ermittlung des infarzierten Myokardareals durch vorgegebene EKG-Muster führt zu wichtigen klinischen, diagnostischen Folgerungen und erweitert die Information zur Quantifizierung der infarzierten Myokardmasse [21]. In der vorliegenden Arbeit wurden die Sensitivität und Spezifität der EKGZeichen in Bezug auf die Lokalisation des Infarktareals bestimmt. Hierbei fand sich die höchste Sensitivität mit 61,9 % im inferioren Segment. Die Spezifität war mit 96,1% am höchsten im lateralen Segment. Der positiv prädiktive Wert 97 war inferior am höchsten und der höchste negativ prädiktive Wert fand sich anterolateral. Zusätzlich wurde Kappa als Maß zur Beurteilung der Übereinstimmung bestimmt. Hierbei zeigte sich, dass die Konkordanz zwischen kardiovaskulärer Magnetresonanztomographie und Elektrokardiographie im anterolateralen Segment (Kappa 0.55) wie auch im lateralen Segment (Kappa 0.55) am größten ist. Bayes de Luna et al. untersuchten 2006 in ihrer Studie die Konkordanz von elektrokardiographischen Veränderungen und der Lokalisation von chronischen Myokardinfarkten, welche durch die K-CMR detektiert wurden [11]. Aus der gleichen Arbeitsgruppe veröffentlichten Cino et al. ebenfalls 2006 eine Studie, welche mit Hilfe der K-CMR die Wahrscheinlichkeit untersuchte, dass ein Myokardinfarkt eine typische EKG-Veränderung erzeugt. Bayes de Luna et al. beobachteten EKG-Veränderungen wie Q-Zacken, RVerluste und R-Minderungen bei 51 Probanden mit akutem Koronarsyndrom. Bayes de Luna et al. sowie auch Cino et al. definierten im Vorfeld sieben verschiedene EKG-Muster, also EKG-Veränderungen in definierten Ableitungen, und ordneten vier EKG-Muster der anteroseptalen Zone und drei EKG-Muster der inferolateralen Zone des Herzens zu. Diese prädefinierten EKG-Muster wurde durch die Autoren erstellt, da sie die strikte Klassifikation von Myers et al. in Frage stellten und Einschränkungen nachweisen konnten. Es sei schwierig, die präkordialen Ableitungen mit den entsprechenden betroffenen Herzwänden zu korrelieren. Häufig seien die präkordialen Elektroden nicht gut platziert. Außerdem seien die Veränderungen der präkordialen Ableitungen abhängig vom entsprechenden Körperbau des Patienten [11, 21]. 98 Bayes de Luna et al. konnten nachweisen, dass die prädefinierten EKG-Muster sehr gut mit der entsprechenden Magnetresonanztomographie durch die nachgewiesenen kardiovaskuläre Infarktlokalisation übereinstimmten. Bei Anwendung von eigenen EKG-Mustern konnte eine globale Konkordanz (Kappa) von 86% gezeigt werden. Die Definition von eigenen EKG-Mustern stellt einen Unterschied zur vorliegenden Arbeit dar. Bayes de Luna et al. sowie Cino et al. nutzen die eigenen Definitionen der EKG-Veränderungen im Hinblick auf die Berücksichtigung von technischen Aspekten und vom Körperbau des Patienten. Außerdem erfassen ihre EKG-Muster Areale des Herzens wie das Septum. Ziel der vorliegenden Arbeit war es die klinische Relevanz des 12-KanalElektrokardigramms zu prüfen. Hierbei wurde auf die vorherige Definition von speziellen EKG-Mustern bewusst verzichtet, sondern die im klinischen Alltag gängigen Standardwerke und Leitfäden verwendet. Dies erklärt die unterschiedlichen Ergebnisse der Studien. 5.4. EKG beim transmuralen und nicht-transmuralen Myokardinfarkt Das 12-Kanal-Elektrokardiogramm ist ein entscheidendes Hilfsmittel bei der Behandlung des Myokardinfarktes [140]. Es ist eine simple, schnelle und günstige kardiale Untersuchungsmethode [26]. Bis zu den ’80er Jahren wurde in der Literatur eine anatomische Beschreibung verwendet, welche auf Veränderungen des 12-Kanal-EKG transmurale Myokardinfarkte bezeichnet, während wurden transmurale basierte. als Subendokardiale, nicht- Nicht-Q-Zacken-Myokardinfarkt Myokardinfarkte als Q-Zacken- Myokardinfarkte bezeichnet wurden [65]. Diese Erkenntnisse gehen auf eine tierexperimentelle Studie von Prinzmetal et al. aus dem Jahre 1954 zurück, welche zeigte, dass Q-Zacken-Myokardinfarkte transmurale Ausdehnung hatten und Nicht-Q-Zacken-Myokardinfarkte eine subendokardiale Ausdehnung hatten [98]. 99 Bereits in den ’80er Jahren berichteten Spodick und Phipps [94], dass pathologische Q-Zacken im EKG nicht mit der transmuralen Ausbreitung des Infarktes korrelieren. Sie empfahlen, dass Q-Wave-Infarkte nicht mehr länger als transmural und Non-Q-Wave-Infarkte nicht mehr länger als nicht-transmural interpretiert werden sollten. Stattdessen schlugen sie vor lediglich zwischen QWave-Infarkten und Non-Q-Wave-Infarkten zu unterscheiden [124]. Die Unterscheidung beider Infarktformen war relevant für die längerfristigen therapeutischen Konsequenzen des entsprechenden Patienten. Einem Q-Wave Myokardinfarkt wurde eine höhere Kurzzeitsterblichkeit zugesprochen, einem Non-Q-Wave-Infarkt eine schlechtere Langzeitprognose [76]. Da allerdings die Entscheidung über die Anwendung einer systemischen Thrombolyse oder Akutintervention in der Akutphase gefällt werden muss und diese in der Regel vor der Entstehung von Q-Zacken fällt [76], ist die Unterscheidung zwischen ST-Hebungsinfarkt (ST-elevation myocardial infarction; STEMI) und Nicht-ST-Hebungsinfarkt (non-ST-elevation myocardial infarction; NSTEMI) in den Vordergrund gerückt. Hierbei entwickelt sich der STHebungsinfarkt zu einem Q-Wave-Infarkt bzw. der Nicht-ST-Hebungsinfarkt zu einem Nicht-Q-Wave-Infarkt [6, 87]. Verschiedene Klinische Leitfäden verwenden jedoch weiterhin das Vorhandensein von signifikanten Q-Zacken als Kriterium zur Diagnose von alten Myokardinfarkten [16, 29, 108]. Pathologische Q-Zacken, die in Bezug auf den Minnesota Code 1.1.1 bis 1.2.8 definiert werden, wurden in einer Vielzahl von Studien als möglicher Indikator eines entweder transmuralen oder nicht-transmuralen Herzinfarktes gefunden. 100 Lediglich Baer et. al. fanden eine Korrelation zwischen dem EKG und den Befunden aus cine-K-CMR Untersuchungen [9]. Durch Messung der segmentalen systolischen Wanddickenzunahme mit einer Gradienten-Echo cine-Sequenz haben sie transmurale von nicht-transmuralen Infarkten unterschieden. Sie fanden häufiger pathologische Q-Zacken bei Patienten mit transmuralem Myokardinfarkt als bei Patienten mit nicht-transmuralem Infarkt. Allerdings waren sie nicht in der Lage, eine klare Korrelation zwischen dem Vorhandensein von pathologischen Q-Zacken und der transmuralen Ausdehnung des Infarktes zu zeigen. Allein auf cine-Sequenzen basierend ist es häufig schwierig, zwischen transmuralen und nicht-transmuralen Infarkten zu unterscheiden - selbst wenn die systolische ventrikuläre Wanddickenzunahme gemessen wurde. Daher waren Baer et al. nicht in der Lage, ventrikuläre Wandbewegungsstörungen, durch „hibernating“ Myokard mit Gewissheit auszuschließen [99, 134]. Die Unterscheidung ermöglicht eine Untersuchung unter Stress, wie im Falle der Stress-Echokardiographie oder der Stress-MRT [19, 20, 136], da hier durch „stunned“ Myokard verursachte ventrikuläre Wandbewegungsstörungen in Infarkten die älter als vier Monate sind, ausgeschlossen werden können [15, 17, 34, 97]. Eine Studie von Wu et al. zeigte ebenfalls, dass pathologische Q-Zacken nicht ausschließlich bei transmuralen Infarkten gefunden werden, sondern auch in nicht-transmuralen Infarkten. Andere EKG-Zeichen wurden in dieser Studie nicht in Betracht gezogen. Jedoch war das Ziel der Studie, die Sensitivität der K-CMR an verschiedenen Zeitpunkten nach Myokardinfarkten zu bewerten und nicht etwa der Vergleich von EKG-Veränderungen mit der durch das K-CMR ermittelten Größe des Infarktes. 101 In zwei Tierversuchen wurde versucht die Häufigkeit von pathologischen QZacken im EKG zu testen [5, 82]. Antalozy et al. [5] fanden in 67% von 100 untersuchten Fällen pathologische QZacken bei transmuralen Herzinfarkten und in 30% der Fälle bei nichttransmuralen Infarkten. Die EKG-Befunde korrespondierten allerdings nicht mit den pathologischen Befunden. In der vorliegenden Arbeit zeigten sich pathologische Q-Zacken bei 19 von 45 (42,2%) transmuralen Herzinfarkten und bei 12 von 45 (26,7%) nichttransmuralen Herzinfarkten. Allerdings muss gesagt werden, dass Antalozy et al. in ihrer Studie im Gegensatz zur vorliegenden Studie lediglich akute Myokardinfarkte untersuchten. Maeda et al. [82] untersuchten die Rolle von T-Negativierungen bei Patienten mit stattgehabten Infarkten und fanden heraus, dass 7 von 8 Patienten mit persistierender T-Negativierung und pathologischen Q-Zacken einen transmuralen Infarkt hatten. 6 von 9 Patienten mit pathologischen Q-Zacken und positiven T-Wellen hatten nicht-transmurale Infarkte. Diese Ergebnisse stehen nicht in Übereinstimmung mit unseren Ergebnissen, da wir nicht in der Lage waren, die transmurale Ausdehnung des Infarktes auf Basis der T-Wellen im EKG zu identifizieren. Der Grund hierfür beinhaltet mitunter das längere Zeitintervall nach dem Infarkt (> 1 Jahr nach dem Infarkt) und die kleinere Patientenzahl in der Studie (n=18) von Maeda et al. In unserer Studie konnten wir durch das K-CMR bei 45 Patienten einen nichttransmuralen, subendokardialen Myokardinfarkt nachweisen. Hierbei fanden sich jedoch bei 12 Patienten (26,7%) pathologische Q-Zacken. Bei 45 Patienten mit nachgewiesenem transmuralen Myokardinfarkt zeigten 19 Elektrokardiogramme (42,2%) eine pathologische Q-Zacke. Damit kann festgestellt werden, dass ein durch das 12-Kanal- Elektrokardiogramm diagnostizierter transmuraler (Q-Zacken) Myokardinfarkt durchaus eine entsprechend nicht-transmurale nicht-transmuraler Ausdehnung besitzen (Nicht-Q-Zacken) kann und Myokardinfarkt ein eine transmurale Ausdehnung einnehmen kann. 102 In der vorliegenden Arbeit unterscheiden sich die Häufigkeiten für das Auftreten von Q-Zacken bei transmuralen und nicht-transmuralen Myokardinfarkten nicht signifikant (p=0.183). Diese Feststellung wird durch die Ergebnisse von Moon et al. untermauert. Sie fanden bei 99% der Patienten mit Q-Wave-Infarkt letztlich einen Anteil der Infarzierung mit nicht-transmuraler Ausdehnung. 28% der untersuchten Patienten hatten einen Non-Q-Wave-Infarkt, mit Regionen transmuraler Ausdehnung [87]. In den vergangenen Jahren ist der Myokardinfarkt redefiniert worden [2]. Der wesentliche Bestandteil dieser neuen Definition besteht darin, dass bereits beim Nachweis von kleinsten myokardialen Nekrosen, welche durch spezifische Marker wie Troponin I oder Troponin T bestimmt werden können, von einem Myokardinfarkt gesprochen wird. Hierbei werden alle Akutmanifestationen einer koronaren Herzkrankheit als akute Koronarsyndrome zusammengefasst und initial eine Einteilung in akutes ST-Hebungs- bzw. akutes Nicht-ST-HebungsKoronarsyndrom. Erst nachfolgend wird eine Einteilung in Q-ZackenMyokardinfarkt bzw. nicht-Q-Zacken-Myokardinfarkt vorgenommen, falls myokardiale Enzymerhöhungen nachweisbar sind [2, 68]. Arai und Hirsch stellten sich die Frage, welche Rolle die Q-Waves in den aktuellen klinischen Algorithmen spielen. Es gilt festzustellen, dass die Q-Wave sich erst nach einiger Verzögerung entwickelt, oftmals nachdem die wichtige initiale Diagnostik und therapeutische Intervention stattgefunden hat. Daher spielt die Q-Welle keine Rolle im akuten Management des Myokardinfarkts. Die Q-Welle zählt während der chronischen Phase des Myokardinfarkts zu den spezifischeren EKG-Zeichen, welche auf einen Myokardinfarkt hindeuten. Die Autoren kamen zum Schluss, dass die Unterscheidung zwischen Q-Wave- und Non-Q-Wave-Infarkt immer noch klinische Bedeutung besitzt [76]. 103 5.5. Sensitivität der Q-Zacke und Infarktmasse In der vorliegenden Arbeit wurde in einer Untergruppe die Sensitivität der QZacke untersucht. Die Interpretation der Q-Zacke im Rahmen eines chronischen Myokardinfarktes zählt zu den kontroversen elektrokardiographischen Zeichen. In dieser Arbeit konnte nachgewiesen werden, dass die Q-Zacke im 12-Kanal-Elektrokardiogramm kein sicheres Zeichen für einen transmuralen Myokardinfarkt darstellt. Die vorliegende Arbeit untersuchte in einer Untergruppe des Gesamtkollektivs 41 Patienten (61.3 ± 11.4 Jahre). Es erfolgte die Berechnung der myokardialen Infarktmasse in Gramm. Die Patienten hatten einen dokumentierten chronischen Myokardinfarkt mit einem Infarktalter von 8.5 ± 2.6 Monaten. Darunter befanden sich 34 Männer (83%) und 7 Frauen (17%). Es konnte nachgewiesen werden, dass keine signifikante Korrelation zwischen der Q-Zacke im EKG und der Transmuralität des Infarktes besteht (p=1.000). Jedoch konnte gezeigt werden, dass die Infarkte mit Q-Zacke im EKG eine größere Masse aufweisen, als Infarkte ohne Q-Zacke. (Median 6.1g versus 4 g, p=0.0348). Die Sensitivität der Q-Zacke für die Transmuralität eines Infarktes betrug 39%. Moon et al. belegten mit ihrer Studie [87] die klinische Bedeutung der Unterscheidung in Q-Wave- und Non-Q-Wave-Infarkte. Es wurde demonstriert, dass die Präsenz einer Q-Wave hauptsächlich von der Infarktgröße abhängt, weniger von der transmuralen Ausdehnung des Infarktes. Q-Wave-Myokardinfarkte waren größer als Non-Q-Wave-Infarkte (anterior: 54% versus 29% des Gebietes infarziert, P <0,0001; inferior: 34% versus 22% des Gebietes infarziert, P = 0,007). Moon et al. wählten zur Quantifizierung der Infarktgröße eine Sechs-PunkteSkala und drückten die Infarktgröße prozentual zur linksventrikulären Größe aus. Wir verwendeten eine exakte Bestimmung der Infarktmasse in Gramm (g). 104 Dennoch muss gesagt werden, dass die Ergebnisse aus der Studie von Moon et al. mit der vorliegenden Arbeit übereinstimmen. Auch hier fanden sich häufiger Q-Waves in Infarkten mit größerer Masse als in Infarkten mit kleiner Masse. Kaandorp et al. konnten in ihrer Studie ebenfalls zeigen, dass die Präsenz oder die Absenz einer Q-Zacke im EKG nur mit der Infarktgröße bzw. der räumlichen Ausdehnung des Infarktes, weniger mit der Transmuralität des Infarktes korreliert. Der prozentuale Anteil infarzierten Gewebes war signifikant höher bei Patienten mit Q-Wave-Infarkt (P<0.05) [55]. Auch hier findet sich eine Übereinstimmung mit unseren Ergebnissen obschon Kaandorp et al. die Infarktnarbe im Gegensatz zu unserer Studie mit einem Score-System quantifizieren und keine Angaben zur Infarktmasse machen. Zusammenfassend lässt sich also sagen, dass Q-Zacken im EKG nicht zwischen transmural und nicht-transmural unterscheiden können, dass aber der Nachweis einer Q-Zacke auf größere Infarktnarben hindeutet. 5.6. Limitationen Die vorliegende Studie weist noch zu benennende Einschränkungen auf: Die vorliegende Studie betrachtete Patienten mit einem einzigen Myokardinfarkt in der Vorgeschichte, um eine homogene Studienpopulation zu erhalten. Die Beobachtungen dieser Studie können also womöglich nicht für Patienten gelten, die multiple Infarkte erlitten haben. In diese Studie wurden Patienten mit chronischem Infarkt (7.4 ± 3.6 Monate vor Untersuchung) eingeschlossen. Somit bleibt es fraglich, ob die vorliegenden Ergebnisse ebenfalls auf Patienten mit akutem Infarktgeschehen zutreffen. Das EKG ermöglicht die Lokalisation eines Infarktes aufgrund von EKGVeränderungen in entsprechenden Ableitungen. Hierbei finden sich unterschiedliche Angaben in der aktuellen Literatur. Diese Studie orientierte 105 sich am Minnesota Code sowie an einer im klinischen Alltag verwendeten Zuordnung [22, 113]. In Abhängigkeit der verwendeten Einteilung können sich bei der Infarktlokalisation mittels des EKG bei anderen Studien unterschiedliche Ergebnisse einstellen. Die kardiovaskuläre Magnetresonanztomographie ist momentan die Methode der Wahl zur Lokalisation und zur Quantifizierung einer Myokardnekrose [35, 87, 115, 139]. Es ist hierbei aber wichtig zu erkennen, dass die Kontrastmittelanreicherung in der K-CMR nicht spezifisch ist für einen Myokardinfarkt. Verschiedene kardiale Erkrankungen infektiöser oder entzündlicher Genese, Kardiomyopathien, kardiale Neoplasmen wie auch kongenitale oder genetische kardiale Erkrankungen können ebenfalls zu einem late enhancement führen [133]. Die Unterscheidung zwischen akuten und chronischen Myokardinfarkten ist mit den Methoden der kardiovaskulären Magnetresonanztomographie alleine schwierig. Beide Myokardinfarktformen zeigen eine hohe Signalintensität beim late enhancement. Generell ist zu sagen, dass chronische und transmurale Myokardinfarkte ein atrophisches, dünneres Myokard aufweisen. Die Myokarddicke im Rahmen des akuten Infarkts ist normal. Chronische subendokardiale Myokardinfarkte haben mitunter auch eine normale Myokarddicke. Hieraus ergibt sich die Wichtigkeit der in dieser Studie durchgeführten sorgfältigen Anamnese, um den erhaltenen Befund richtig interpretieren zu können [133]. Die theoretische Möglichkeit, dass das erhaltende late enhancement nicht unbedingt einem Myokardinfarkt zuzuordnen ist, bleibt jedoch bestehen. 106 5.7. Schlussfolgerung Aufgrund der Ergebnisse dieser Arbeit läßt sich schlussfolgern, dass durch das EKG nicht zwischen einem transmuralen und nicht-transmuralen Myokardinfarkt unterschieden und auch nicht exakt die Infarktlokalisation bestimmt werden kann. Die Sensitivität höchsten bei des der 12-Kanal-Oberflächen-Elektrokardiogramms Detektion von inferior lokalisierten ist am chronischen Myokardinfarkten. Die Spezifität war am höchsten im lateralen Segment (96,1%). Die Konkordanz zwischen kardiovaskulärer Magnetresonanztomographie und Elektrokardiographie war insgesamt im anterolateralen und lateralen Segment am größten. Die Sensitivität der Q-Zacke hinsichtlich der Transmuralität eines Infarktes ist gering. Q-Zacken im EKG sind mit einer größeren Infarktmasse assoziiert, ungeachtet der Transmuralität des Infarktes. Nach den vorliegenden Informationen ist dies die erste in vivo Studie ihrer Art gewesen, welche K-CMR genutzt hat um gezielt zu evaluieren, ob mittels des EKG zwischen transmuralen und nicht transmuralen Infarkten unterscheiden werden kann. 107 6. Zusammenfassung In der vorgestellten Arbeit wurden die Sensitivität und Spezifität von elektrokardiographischen Veränderungen im Rahmen eines chronischen Myokardinfarktes untersucht. Die kardiovaskuläre Magnetresonanztomographie diente als Goldstandard zur exakten Bestimmung der Infarktlokalisation und zur Bestimmung der transmuralen respektive der nicht-transmuralen Infarktausdehnung. Im Rahmen einer prospektiv angelegten Studie wurden 90 Patienten im Zeitraum von 2001 bis 2005 untersucht. Bei allen Patienten erfolgte die Anfertigung eines 12-Kanal-Oberflächen-Elektrokardiogramms. Die Durchführung der kardiovaskulären Magnetresonanztomographie erfolgte mit Applikation von paramagnetischem Kontrastmittel. 45 Patienten hatten einen transmuralen Myokardinfarkt und 45 Patienten einen nicht-transmuralen Myokardinfarkt. Die Häufigkeit für das Auftreten von QZacken war bei transmuralen und nicht-transmuralen Myokardinfarkten nicht signifikant unterschiedlich (p=0.183). Hinsichtlich der Lokalisation der Myokardinfarkte fand sich die höchste Sensitivität bei inferioren Infarkten (61,9%). Die Spezifität war bei lateralen Infarkten am höchsten (96,1%). Kappa als Maß der Übereinstimmung wurde bestimmt und war bei lateralen und anterolateralen Infarkten am höchsten. Im Rahmen der Studie wurde eine Untergruppe mit 41 Patienten untersucht und mittels der kardiovaskulären Magnetresonanztomographie die Infarktmasse berechnet. Auch hier zeigte sich keine signifikante Korrelation zwischen QZacke im EKG und der Transmuralität des Infarktes (p=1.000). Jedoch konnte gezeigt werden, dass die Infarkte mit Q-Zacke im EKG eine größere Masse aufweisen als Infarkte ohne Q-Zacke. (Median 6.1g versus 4 g, p=0.0348). Die Sensitivität der Q-Zacke für die Transmuralität eines Infarktes betrug 39% und für die Präsenz eines Infarktes 37%. Insgesamt ist festzustellen, dass das 12-Kanal-Oberflächen-EKG nicht zwischen transmuralen und nicht-transmuralen Infarkten unterscheiden kann. Die Präsenz von Q-Zacken im Elektrokardiogramm gibt einen Hinweis auf eine größere Infarktmasse ungeachtet der Transmuralität des Myokardinfarktes. 108 7. Literaturverzeichnis [1] Akins, E. W., Hill, J. A., Sievers, K. W., and Conti, C. R. (1987). Assessment of left ventricular wall thickness in healed myocardial infarction by magnetic resonance imaging. Am J Cardiol, 59, (1) 24-8. [2] Alpert, J. S., Thygesen, K., Antman, E., and Bassand, J. P. (2000). Myocardial infarction redefined--a consensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the redefinition of myocardial infarction. J Am Coll Cardiol, 36, (3) 959-69. [3] Andre-Fouet, X., Pillot, M., Leizorovicz, A., Finet, G., Gayet, C., and Milon, H. (1989). "Non-Q wave," alias "nontransmural," myocardial infarction: a specific entity. Am Heart J, 117, (4) 892-902. [4] Andrew, E. R. (1997). Edward Purcell. Magn Reson Med, 38, (2) 177-8. [5] Antaloczy, Z., Barcsak, J., and Magyar, E. (1988). Correlation of electrocardiologic and pathologic findings in 100 cases of Q wave and non-Q wave myocardial infarction. J Electrocardiol, 21, (4) 331-5. [6] Antman, E. (1997). Acute myocardial infarction. In: Heart Disease: A Textbook of Cardiovascular Medicine, (E Braunwald, Ed.), WB Saunders, Philadelphia, 1187. [7] Antman, E. M., McCabe, C. H., Gurfinkel, E. P., Turpie, A. G., Bernink, P. J., Salein, D., Bayes De Luna, A., Fox, K., Lablanche, J. M., Radley, D., Premmereur, J., and Braunwald, E. (1999). Enoxaparin prevents death and cardiac ischemic events in unstable angina/non-Q-wave myocardial infarction. Results of the thrombolysis in myocardial infarction (TIMI) 11B trial. Circulation, 100, (15) 1593-601. [8] Antoni, H. (1995). Elektrophysiologie des Herzens. In: Physiologie des Menschen, (R Schmidt, and G Thews, Eds.), Springer, Berlin, Heidelberg, New York, 472-493. 109 [9] Baer, F. M., Theissen, P., Voth, E., Schneider, C. A., Schicha, H., and Sechtem, U. (1994). Morphologic correlate of pathologic Q waves as assessed by gradient-echo magnetic resonance imaging. Am J Cardiol, 74, (5) 430-4. [10] Barold, S. S. (2003). Willem Einthoven and the birth of clinical electrocardiography a hundred years ago. Card Electrophysiol Rev, 7, (1) 99-104. [11] Bayes de Luna, A., Cino, J. M., Pujadas, S., Cygankiewicz, I., Carreras, F., Garcia-Moll, X., Noguero, M., Fiol, M., Elosua, R., Cinca, J., and Pons-Llado, G. (2006). Concordance of electrocardiographic patterns and healed myocardial infarction location detected by cardiovascular magnetic resonance. Am J Cardiol, 97, (4) 443-51. [12] Blackburn, H. (1969). Classification of the electrocardiogram for population studies: Minnesota Code. J Electrocardiol, 2, (3) 305-10. [13] Böcker, W., Denk, H., and Heitz, U. (1997). Atherosklerose. In: Lehrbuch der Pathologie, Urban und Schwarzenberg, München; Wien; Baltimore. [14] Böcker, W., Denk, H., and Heitz, U. (1997). Myokardinfarkt. In: Lehrbuch der Pathologie, Urban & Schwarzenberg, München, Wien, Baltimore, 426. [15] Bolli, R., Patel, B. S., Hartley, C. J., Thornby, J. I., Jeroudi, M. O., and Roberts, R. (1989). Nonuniform transmural recovery of contractile function in stunned myocardium. Am J Physiol, 257, (2 Pt 2) H375-85. [16] Braunwald, E., Antman, E. M., Beasley, J. W., Califf, R. M., Cheitlin, M. D., Hochman, J. S., Jones, R. H., Kereiakes, D., Kupersmith, J., Levin, T. N., Pepine, C. J., Schaeffer, J. W., Smith, E. E., 3rd, Steward, D. E., Theroux, P., Gibbons, R. J., Alpert, J. S., Faxon, D. P., Fuster, V., Gregoratos, G., Hiratzka, L. F., Jacobs, A. K., and Smith, S. C., Jr. (2002). ACC/AHA 2002 guideline update for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction--summary article: a report of the American College of 110 Cardiology/American Heart Association task force on practice guidelines (Committee on the Management of Patients With Unstable Angina). J Am Coll Cardiol, 40, (7) 1366-74. [17] Braunwald, E., and Kloner, R. A. (1982). The stunned myocardium: prolonged, postischemic ventricular dysfunction. Circulation, 66, (6) 1146-9. [18] Cerqueira, M. D., Weissman, N. J., Dilsizian, V., Jacobs, A. K., Kaul, S., Laskey, W. K., Pennell, D. J., Rumberger, J. A., Ryan, T., and Verani, M. S. (2002). Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart: a statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation, 105, (4) 539-42. [19] Cho, S., and McConnell, M. V. (2002). Echocardiographic and magnetic resonance methods for diagnosing hibernating myocardium. Nucl Med Commun, 23, (4) 331-9. [20] Cigarroa, C. G., deFilippi, C. R., Brickner, M. E., Alvarez, L. G., Wait, M. A., and Grayburn, P. A. (1993). Dobutamine stress echocardiography identifies hibernating myocardium and predicts recovery of left ventricular function after coronary revascularization. Circulation, 88, (2) 430-6. [21] Cino, J. M., Pujadas, S., Carreras, F., Cygankiewicz, I., Leta, R., Noguero, M., Garcia-Moll, X., Bayes Genis, T., Pons-Llado, G., and Bayes De Luna, A. (2006). Utility of Contrast-Enhaced Cardiovascular Magnetic Resonance (CE-CMR) to assess how likely is an infarct to produce a typical ECG-Pattern. Journal of Cardiovascular Magnetic Resonance, 8, 335-244. [22] Csapo, G., and Kalusche, D. (2004). Elektrokardiographie. In: Herzkrankheiten: Pathophysiologie, Diagnostik, Therapie, (H Roskamm, Ed.), Springer, Berlin, Heidelberg, New York, 182, 188. 111 [23] Damadian, R. (1971). Tumor detection by nuclear magnetic resonance. Science, 171, (976) 1151-3. [24] Damadian, R., Minkoff, L., Goldsmith, M., Stanford, M., and Koutcher, J. (1976). Field focusing nuclear magnetic resonance (FONAR): visualization of a tumor in a live animal. Science, 194, (4272) 1430-2. [25] Damadian, R., Minkoff, L., Goldsmith, M., Stanford, M., and Koutcher, J. (1976). Tumor imaging in a live animal by focusing NMR (FONAR). Physiol Chem Phys, 8, (1) 61-5. [26] de Micheli, A., Medrano, G. A., and Iturralde, P. (2003). [On the clinical value of electrocardiogram]. Arch Cardiol Mex, 73, (1) 38-45. [27] Dietz, R., and Rauch, B. (2003). [Guidelines for diagnosis and treatment of chronic coronary heart disease. Issued by the executive committee of the German Society of Cardiology--Heart Circulation Research in cooperation with the German Society for Prevention and Rehabilitation of Cardiac Diseases and the German Society for Thoracic and Cardiovascular Surgery]. Z Kardiol, 92, (6) 501-21. [28] Duncker, D. J., Schulz, R., Ferrari, R., Garcia-Dorado, D., Guarnieri, C., Heusch, G., and Verdouw, P. D. (1998). "Myocardial stunning" remaining questions. Cardiovasc Res, 38, (3) 549-58. [29] Eagle, K. A., Berger, P. B., Calkins, H., Chaitman, B. R., Ewy, G. A., Fleischmann, K. E., Fleisher, L. A., Froehlich, J. B., Gusberg, R. J., Leppo, J. A., Ryan, T., Schlant, R. C., Winters, W. L., Jr., Gibbons, R. J., Antman, E. M., Alpert, J. S., Faxon, D. P., Fuster, V., Gregoratos, G., Jacobs, A. K., Hiratzka, L. F., Russell, R. O., and Smith, S. C., Jr. (2002). ACC/AHA guideline update for perioperative cardiovascular evaluation for noncardiac surgery--executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1996 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery). J Am Coll Cardiol, 39, (3) 542-53. 112 [30] Einthoven, W. (1893). New methods for clinical investigation. Ned T Geneesk, 29, (II) 263-286. [31] Einthoven, W. (1895). Ueber die Form des menschlichen Electrocardiogramms. Arch f d Ges Physiol, 60, 101-123. [32] Einthoven, W. (1901). Un nouveau galvanometre. Arch Neerl Sc Ex Nat, 6, 625-633. [33] Einthoven, W. (1912). The different forms of the human electrocardiogram and their signification. Lancet, 1, 853-861. [34] Ellis, S. G., Henschke, C. I., Sandor, T., Wynne, J., Braunwald, E., and Kloner, R. A. (1983). Time course of functional and biochemical recovery of myocardium salvaged by reperfusion. J Am Coll Cardiol, 1, (4) 104755. [35] Engblom, H., Wagner, G. S., Setser, R. M., Selvester, R. H., Billgren, T., Kasper, J. M., Maynard, C., Pahlm, O., Arheden, H., and White, R. D. (2003). Quantitative clinical assessment of chronic anterior myocardial infarction with delayed enhancement magnetic resonance imaging and QRS scoring. Am Heart J, 146, (2) 359-66. [36] Erdmann, E. (2000). Klinische Kardiologie. Springer-Verlag, London, Paris, Singapur, Tokio. [37] Essdorn, H. (2001). Methodenentwicklung zur nicht-invasiven Diagnostik angeborener Herzfehler mit der Magnetresonanz. Eine Studie am Beispiel des Vorhofseptumdefektes (ASD II). Klinik für Angeborene Herzfehler des Herz- und Diabeteszentrum NRW - Universitätsklinik-. Ruhr-Universität Bochum. [38] Fieno, D. S., Kim, R. J., Chen, E. L., Lomasney, J. W., Klocke, F. J., and Judd, R. M. (2000). Contrast-enhanced magnetic resonance imaging of myocardium at risk: distinction between reversible and irreversible injury throughout infarct healing. J Am Coll Cardiol, 36, (6) 1985-91. 113 [39] Fleischhauer, K. (1994). Das Herz. In: Anatomie: makroskopische Anatomie, Embryologie und Histologie des Menschen / Benninghoff., (D Drenckhahn, and W Zenker, Eds.), Urban und Schwarzenberg, München; Wien; Baltimore, 623-31. [40] French, J. K., and White, H. D. (2004). Clinical implications of the new definition of myocardial infarction. Heart, 90, (1) 99-106. [41] Gibson, R. S. (1989). Non-Q-wave myocardial infarction: pathophysiology, prognosis, and therapeutic strategy. Annu Rev Med, 40, 395-410. [42] Goldman, M. R., and Pohost, G. M. (1983). Nuclear magnetic resonance imaging. The potential for cardiac evaluation of the pediatric patient. Cardiol Clin, 1, (3) 521-5. [43] Gonska, B. D., and Heinecker, R. (1999). EKG in Klinik und Praxis: das Referenzwerk zur elektrokardiographischen Diagnostik. In, Thieme, Stuttgart, New York, 2-4, 18, 185-186, 368. [44] Gross, R., Gerok, W., and Schölmerich, P. (1996). Die Innere Medizin. Schattauer Verlag, Stuttgart, New York. [45] Hamm, C. W. (2004). [Guidelines: acute coronary syndrome (ACS). 1: ACS without persistent ST segment elevations]. Z Kardiol, 93, (1) 72-90. [46] Harvey, W. (1628). Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus. [47] Hausmann, D., Mügge, A., and Daniel, W. (1999). Koronare Herzkrankheit. In: Thiemes Innere Medizin:TIM, (K Alexander, W Daniel, H Diener, M Freund, H Köhler, S Matern, H Maurer, B Michel, D Nowak, T Risler, A Schaffner, W Scherbaum, G Sybrecht, G Wolfram, and M Zeitz, Eds.), Thieme, Stuttgart;New York, 1100, 1001. [48] Herfkens, R. J., Higgins, C. B., Hricak, H., Lipton, M. J., Crooks, L. E., Lanzer, P., Botvinick, E., Brundage, B., Sheldon, P. E., and Kaufman, L. 114 (1983). Nuclear magnetic resonance imaging of the cardiovascular system: normal and pathologic findings. Radiology, 147, (3) 749-59. [49] Higgins, C. B., Byrd, B. F., 2nd, McNamara, M. T., Lanzer, P., Lipton, M. J., Botvinick, E., Schiller, N. B., Crooks, L. E., and Kaufman, L. (1985). Magnetic resonance imaging of the heart: a review of the experience in 172 subjects. Radiology, 155, (3) 671-9. [50] Hornak, J. P. The Basics of MRI - Advanced Imaging Techniques (Zugriff am 21.12.2005). http://www.cis.rit.edu/htbooks/mri/chap-12/images/gddtpa.gif [51] Hort, W. (2001). [Pathology of acute myocardial infarction]. Internist (Berl), 42, (5) 631-40. [52] Hünerbein, R. (2004). Radiologische Verfahren. In: Duale Reihe Radiologie, (M Reiser, FP Kuhn, and J Debus, Eds.), Thieme, Stuttgart, 85. [53] Hurst, J. W. (1991). Ventricular Electrocardiography. Gower Medical Publishing. [54] Jenkins, D. ECG timeline - History of the electorcardiogram (Zugriff am 27.09.2005). http://www.ecglibrary.com/ecghist.html [55] Kaandorp, T. A., Bax, J. J., Lamb, H. J., Viergever, E. P., Boersma, E., Poldermans, D., van der Wall, E. E., and de Roos, A. (2005). Which parameters on magnetic resonance imaging determine Q waves on the electrocardiogram? Am J Cardiol, 95, (8) 925-9. [56] Kelm, M., and Strauer, B. E. (2001). [Interventional therapy of the acute cardiac infarct]. Internist (Berl), 42, (5) 686-98. [57] Kim, R. J., Fieno, D. S., Parrish, T. B., Harris, K., Chen, E. L., Simonetti, O., Bundy, J., Finn, J. P., Klocke, F. J., and Judd, R. M. (1999). Relationship of MRI delayed contrast enhancement to irreversible injury, infarct age, and contractile function. Circulation, 100, (19) 1992-2002. 115 [58] Kim, R. J., Wu, E., Rafael, A., Chen, E. L., Parker, M. A., Simonetti, O., Klocke, F. J., Bonow, R. O., and Judd, R. M. (2000). The use of contrastenhanced magnetic resonance imaging to identify reversible myocardial dysfunction. N Engl J Med, 343, (20) 1445-53. [59] Kivelitz, D. E., Taupitz, M., and Hamm, B. (1999). [Diagnostic assessment after myocardial infarction: What is the role of magnetic resonance imaging?]. Rofo, 171, (5) 349-58. [60] Kleiger, R. E., Boden, W. E., Schechtman, K. B., Gibson, R. S., Schwartz, D. J., Geiger, B. J., Capone, R. J., and Roberts, R. (1990). Frequency and significance of late evolution of Q waves in patients with initial non-Q-wave acute myocardial infarction. Diltiazem Reinfarction Study Group. Am J Cardiol, 65, (1) 23-7. [61] Klein, C., Nekolla, S. G., Bengel, F. M., Momose, M., Sammer, A., Haas, F., Schnackenburg, B., Delius, W., Mudra, H., Wolfram, D., and Schwaiger, M. (2002). Assessment of myocardial viability with contrastenhanced magnetic resonance imaging: comparison with positron emission tomography. Circulation, 105, (2) 162-7. [62] Kligfield, P. (2005). Harold Ensign Bennet Pardee. Clin Cardiol, 28, (8) 396-8. [63] Klinge, R. (1997). Das Elektrokardiogramm: Leitfaden für die Ausbildung und Praxis. Thieme, Stuttgart, New York. [64] Klinke, R., and Silbernagl, S. (2001). Lehrbuch der Physiologie. Thieme, Stuttgart, New York. [65] Kovacevic, B., Stajnic, M., Cemerlic-Adic, N., and Dejanovic, J. (2002). [Terminology and diagnostic criteria for non-Q wave myocardial infarct]. Med Pregl, 55, (1-2) 28-33. [66] Krauss, X. H., van der Wall, E. E., van der Laarse, A., Doornbos, J., Matheijssen, N. A., de Roos, A., Blokland, J. A., van Voorthuisen, A. E., and Bruschke, A. V. (1991). Magnetic resonance imaging of myocardial 116 infarction: correlation with enzymatic, angiographic, and radionuclide findings. Am Heart J, 122, (5) 1274-83. [67] Kreisler, P., and Trümmler, K. H. (1998). Moderne Bildgebung: Physik, Gerätetechnik, Bildbearbeitung und -kommunikation, Strahlenschutz, Qualitätskontrolle. In: (K Ewen, Ed.), Thieme, Stuttgart, New York, 171, 172-173. [68] Kuch, B., Löwel, H., and von Scheidt, W. (2003). Einteilung des akuten Herzinfarktes nach EKG-morphologischen Kriterien -epidemiologische Daten und prognostische Implikationen. J Kardiol, 10, 103-6. [69] Lange, S., and Bender, R. (2001). Median oder Mittelwert? Dtsch. Med. Wschr., 126, 25-26. [70] Lange, S., and Bender, R. (2001). Was ist der p-Wert? Dtsch. Med. Wschr., 126, 39-40. [71] Laniado, M., Weinmann, H. J., Schorner, W., Felix, R., and Speck, U. (1984). First use of GdDTPA/dimeglumine in man. Physiol Chem Phys Med NMR, 16, (2) 157-65. [72] Laubenberger, T. (1990). Technik der medizinischen Radiologie. Deutscher Ärzteverlag, Köln. [73] Lauterbur, P. (1973). Image Formation by Induced Local Interactions: Examples Employing Nuclear Magnetic Resonance. Nature, 242, 190191. [74] Libby, P. (2001). What have we learned about the biology of atherosclerosis? The role of inflammation. Am J Cardiol, 88, (7B) 3J-6J. [75] Lieberman, J. M., Alfidi, R. J., Nelson, A. D., Botti, R. E., Moir, T. W., Haaga, J. R., Kopiwoda, S., Miraldi, F. D., Cohen, A. M., Butler, H. E., and et al. (1984). Gated magnetic resonance imaging of the normal and diseased heart. Radiology, 152, (2) 465-70. 117 [76] Liebson, P. R., and Klein, L. W. (1997). The non-Q wave myocardial infarction revisited: 10 years later. Prog Cardiovasc Dis, 39, (5) 399-444. [77] Lima, J. A., and Desai, M. Y. (2004). Cardiovascular magnetic resonance imaging: current and emerging applications. J Am Coll Cardiol, 44, (6) 1164-71. [78] Lima, J. A., Judd, R. M., Bazille, A., Schulman, S. P., Atalar, E., and Zerhouni, E. A. (1995). Regional heterogeneity of human myocardial infarcts demonstrated by contrast-enhanced MRI. Potential mechanisms. Circulation, 92, (5) 1117-25. [79] Lindner, U. K. (1999). Schnellinterpretation des EKG: ein programmierter Kurs. In, Springer, Berlin, Heidelberg, New York, 3-6, 10, 24, 25, 30-31, 279-280, 315, 326-329, 332,. [80] Lippert, H. (1996). Lehrbuch Anatomie. Urban und Schwarzenberg, München; Wien; Baltimore. [81] Lissner, M., and Seiderer, M. (1990). Klinische Kernspintomographie. Ferdinand Enke Verlag, Stuttgart. [82] Maeda, S., Imai, T., Kuboki, K., Chida, K., Watanabe, C., and Ohkawa, S. (1996). Pathologic implications of restored positive T waves and persistent negative T waves after Q wave myocardial infarction. J Am Coll Cardiol, 28, (6) 1514-8. [83] Mansfield, P., Pykett, I. L., and Morris, P. G. (1978). Human whole body line-scan imaging by NMR. Br J Radiol, 51, (611) 921-2. [84] Matetzky, S., Barabash, G. I., Rabinowitz, B., Rath, S., Zahav, Y. H., Agranat, O., Kaplinsky, E., and Hod, H. (1995). Q wave and Non-Q wave myocardial infarction after thrombolysis. J Am Coll Cardiol, 26, (6) 144551. [85] McNamara, M. T., and Higgins, C. B. (1984). Cardiovascular applications of magnetic resonance imaging. Magn Reson Imaging, 2, (3) 167-83. 118 [86] Mikhail, G. W. (2006). Coronary revascularisation in women. Heart, 92 Suppl 3, iii19-23. [87] Moon, J. C., De Arenaza, D. P., Elkington, A. G., Taneja, A. K., John, A. S., Wang, D., Janardhanan, R., Senior, R., Lahiri, A., Poole-Wilson, P. A., and Pennell, D. J. (2004). The pathologic basis of Q-wave and nonQ-wave myocardial infarction: a cardiovascular magnetic resonance study. J Am Coll Cardiol, 44, (3) 554-60. [88] Moruzzi, G. (1996). The electrophysiological work of Carlo Matteucci. 1964. Brain Res Bull, 40, (2) 69-91. [89] Nagel, E., van Rossum, C., and Fleck, E. (2002). Kardiovaskuläre Magnetresonanztomographie. Steinkopff Verlag, Darmstadt. [90] Netter, F. (1995). Tafel 212. In: Interactive Atlas of Human Anatomy, (A Dalley, and J Myers, Eds.), Ciba Medical Educations & Publications. [91] Pardee, H. (1920). An electrocardiographic sign of coronary artery obstruction. Arch Intern Med, 26, 244–257. [92] Partain, C. L., Prince, R. R., Patton, J. A., Kulkarni, M. V., and James, A. E. (1988). Magnetic Resonance Imaging. W. B. Saunders Company. [93] Pattynama, P. M., and de Roos, A. (1995). MR evaluation of myocardial ischemia and infarction. Top Magn Reson Imaging, 7, (4) 218-31. [94] Phibbs, B. (1984). Transmural versus Q wave infarction. J Am Coll Cardiol, 4, (6) 1332. [95] Piccolino, M. (1997). Luigi Galvani and animal electricity: two centuries after the foundation of electrophysiology. Trends Neurosci, 20, (10) 4438. [96] Poppe, C., and Kurnaz, E. Willem Einthoven (Zugriff am: 21.12.2005). http://www.nobelpreis.org/medizin/images/einthoven.jpg 119 [97] Preuss, K. C., Gross, G. J., Brooks, H. L., and Warltier, D. C. (1987). Time course of recovery of "stunned" myocardium following variable periods of ischemia in conscious and anesthetized dogs. Am Heart J, 114, (4 Pt 1) 696-703. [98] Prinzmetal, M., Shaw, C. M., Jr., Maxwell, M. H., Flamm, E. J., Goldman, A., Kimura, N., Rakita, L., Borduas, J. L., Rothman, S., and Kennamer, R. (1954). Studies on the mechanism of ventricular activity. VI. The depolarization complex in pure subendocardial infarction; role of the subendocardial region in the normal electrocardiogram. Am J Med, 16, (4) 469-89. [99] Rahimtoola, S. H. (1989). The hibernating myocardium. Am Heart J, 117, (1) 211-21. [100] Reiche, D. (2003). Roche Lexikon Medizin. Elsevier GmbH, Urban & Fischer Verlag, München, Jena. [101] Revel, D., and Higgins, C. B. (1985). Magnetic resonance imaging of ischemic heart disease. Radiol Clin North Am, 23, (4) 719-26. [102] Riede, U., and Drexler, H. (1999). Herzleistungsstörungen. In: Allgemeine und spezielle Pathologie, (U Riede, and H Schaefer, Eds.), Thieme, Stuttgart, New York, 488. [103] Riede, U., Ihling, C., and Schaefer, H. (1999). Arterien. In: Allgemeine und spezielle Pathologie, (U Riede, and H Schaefer, Eds.), Thieme, Stuttgart; New York, 437. [104] Ringertz, N. The Nobel Prize in Physics 1952 (Zugriff am 21.12.2005). http://nobelprize.org/physics/laureates/1952/index.html [105] Ringertz, N. The Nobel Prize in Physiology or Medicine 2003 (Zugriff am 21.12.2005). http://nobelprize.org/medicine/laureates/2003/index.html [106] Roguin, A. (2004). Nikola Tesla: the man behind the magnetic field unit. J Magn Reson Imaging, 19, (3) 369-74. 120 [107] Roskamm, H., Neumann, F. J., Kalusche, D., and Bestehorn, H. P. (2004). Herzkrankheiten. Springer Verlag, Berlin Heidelberg New York. [108] Scanlon, P. J., Faxon, D. P., Audet, A. M., Carabello, B., Dehmer, G. J., Eagle, K. A., Legako, R. D., Leon, D. F., Murray, J. A., Nissen, S. E., Pepine, C. J., Watson, R. M., Ritchie, J. L., Gibbons, R. J., Cheitlin, M. D., Gardner, T. J., Garson, A., Jr., Russell, R. O., Jr., Ryan, T. J., and Smith, S. C., Jr. (1999). ACC/AHA guidelines for coronary angiography. A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines (Committee on Coronary Angiography). Developed in collaboration with the Society for Cardiac Angiography and Interventions. J Am Coll Cardiol, 33, (6) 1756-824. [109] Schild, H. H. (1997). MRI made easy. Schering Aktiengesellschaft. [110] Schilling, A., and Elzer, M. Elektrokardiogramm (Zugriff am 21.12.2005). http://medizinus.de/ekg.php [111] Schouman-Claeys, E., Frija, G., Revel, D., Doucet, D., and Donadieu, A. M. (1988). Canine acute myocardial infarction. In vivo detection by MRI with gradient echo technique and contribution of Gd-DOTA. Invest Radiol, 23 Suppl 1, S254-7. [112] Schuster, H. P., and Trappe, H. J. (2001). EKG-Kurs für Isabel. Thieme, Stutgart. [113] Schuster, H. P., and Trappe, H. J. (2005). EKG bei Myokardinfarkt: Infarktlokalisation. In: EKG-Kurs für Isabel, Thieme, Stuttgart, New York, 72-73. [114] Sechtem, U., Pflugfelder, P., and Higgins, C. B. (1987). Quantification of cardiac function by conventional and cine magnetic resonance imaging. Cardiovasc Intervent Radiol, 10, (6) 365-73. [115] Selvanayagam, J. B., Kardos, A., Nicolson, D., Francis, J., Petersen, S. E., Robson, M., Banning, A., and Neubauer, S. (2004). Anteroseptal or apical myocardial infarction: a controversy addressed using delayed 121 enhancement cardiovascular magnetic resonance imaging. J Cardiovasc Magn Reson, 6, (3) 653-61. [116] Semmler, W. (2004). [The Nobel Prize in "Physiology or Medicine" 2003 for the discoveries concerning magnetic resonance imaging]. Z Med Phys, 14, (2) 81. [117] Shampo, M. A., and Kyle, R. A. (1995). Felix Bloch--developer of magnetic resonance imaging. Mayo Clin Proc, 70, (9) 889. [118] Silber, S., Albrecht, A., Gohring, S., Kaltenbach, M., Kneissl, D., Kokott, N., Levenson, B., Mathey, D., Pohler, E., Reifart, N., Sauer, G., Schofer, J., and Schwarzbach, F. (1998). [First annual report of practitioners of interventional cardiology in private practice in Germany. Results of procedures of left heart catheterization and coronary interventions in the year 1996]. Herz, 23, (1) 47-57. [119] Simonetti, O. P., Kim, R. J., Fieno, D. S., Hillenbrand, H. B., Wu, E., Bundy, J. M., Finn, J. P., and Judd, R. M. (2001). An improved MR imaging technique for the visualization of myocardial infarction. Radiology, 218, (1) 215-23. [120] So, C. S. (2003). Praktische EKG Deutung. Thieme, Stuttgart, New York. [121] So, C. S. (1999). Praktische Elektrokardiographie. In, Thieme, Stuttgart, New York, 8. [122] Sobotta, J. (1988). Atlas der Anatomie des Menschen. Urban & Schwarzenberg, München. [123] Spodick, D. H. (1983). Q-wave infarction versus S-T infarction. Nonspecificity of electrocardiographic criteria for differentiating transmural and nontransmural lesions. Am J Cardiol, 51, (5) 913-5. [124] Spodick, D. H. (1980). Transmural vs nontransmural infarction. Circulation, 62, (2) 447-8. [125] Spodick, D. H. (1986). "Transmural" or "Q-wave"? Chest, 90, (5) 785. 122 [126] Stramba-Badiale, M., Fox, K. M., Priori, S. G., Collins, P., Daly, C., Graham, I., Jonsson, B., Schenck-Gustafsson, K., and Tendera, M. (2006). Cardiovascular diseases in women: a statement from the policy conference of the European Society of Cardiology. Eur Heart J, 27, (8) 994-1005. [127] Thiel, T. Die Geschichte der Radiologie - Magnetresonanztomographie (Zugriff am 13.10.2005). http://www.radiologienetz.de/article/archive/83 [128] Thiele, H., Kappl, M. J. E., Conradi, S., Niebauer, J., Hambrecht, R., and Schuler, G. (2006). Reproducibility of chronic and acute infarct size measurement by delayed enhancement-magnetic resonance imaging. J Am Coll Cardiol, 47, 1641-5. [129] Thomson, L. E., Kim, R. J., and Judd, R. M. (2004). Magnetic resonance imaging for the assessment of myocardial viability. J Magn Reson Imaging, 19, (6) 771-88. [130] Thurn, P., Bücheler, E., Lackner, K., and Thelen, M. (1998). Einführung in die radiologische Diagnostik. Thieme, Stuttgart. [131] Trappe, H. J. (1999). Elektrokardiographie. In: Thiemes Innere Medizin:TIM, (K Alexander, W Daniel, H Diener, M Freund, H Köhler, S Matern, H Maurer, B Michel, D Nowak, T Risler, A Schaffner, W Scherbaum, G Sybrecht, G Wolfram, and M Zeitz, Eds.), Thieme, Stuttgart;New York, 1036-1045. [132] Viera, A. J., and Garrett, J. M. (2005). Understanding interobserver agreement: the kappa statistic. Fam Med, 37, (5) 360-3. [133] Vogel-Claussen, J., Rochitte, C. E., Wu, K. C., Kamel, I. R., Foo, T. K., Lima, J. A., and Bluemke, D. A. (2006). Delayed enhancement MR imaging: utility in myocardial assessment. Radiographics, 26, (3) 795810. [134] vom Dahl, J., Eitzman, D. T., al-Aouar, Z. R., Kanter, H. L., Hicks, R. J., Deeb, G. M., Kirsh, M. M., and Schwaiger, M. (1994). Relation of 123 regional function, perfusion, and metabolism in patients with advanced coronary artery disease undergoing surgical revascularization. Circulation, 90, (5) 2356-66. [135] Waller, A. (1887). A demonstration on man of electromotive changes accompanying the heart's beat. J Physiol (London), 8, 229-234. [136] Watada, H., Ito, H., Oh, H., Masuyama, T., Aburaya, M., Hori, M., Iwakura, M., Higashino, Y., Fujii, K., and Minamino, T. (1994). Dobutamine stress echocardiography predicts reversible dysfunction and quantitates the extent of irreversibly damaged myocardium after reperfusion of anterior myocardial infarction. J Am Coll Cardiol, 24, (3) 624-30. [137] Weishaupt, D., Köchli, V., and Marincek, B. (2003). Wie funktioniert MRI? Eine Einführung in Physik und Funkionsweise der Magnetresonanzbildgebung. Springer, Berlin; Heidelberg; New York; Barcelona; Budapest; Hongkong; London; Mailand; Paris; Santa Clara; Singapur; Tokio. [138] Wilson, N., Johnston, F., Macleod, A., and Barker, P. (1934). Electrocardiograms that represent the potential variations of a single electrode. Am Heart J, 9, 447-458. [139] Wu, E., Judd, R. M., Vargas, J. D., Klocke, F. J., Bonow, R. O., and Kim, R. J. (2001). Visualisation of presence, location, and transmural extent of healed Q-wave and non-Q-wave myocardial infarction. Lancet, 357, (9249) 21-8. [140] Zimetbaum, P. J., and Josephson, M. E. (2003). Use of the electrocardiogram in acute myocardial infarction. N Engl J Med, 348, (10) 933-40. 124 8. Anhang Tabelle A1: Alter und Lokalisation des Late Enhancement bei untersuchten Probanden mit transmuralen Myokardinfarkt KM Anreicherung Nr. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 Initialien D.L. K.S. K.A. M.W. K.P. L.H, G.G. J.I. D.K. G.W. J.H. R.G. K.A. W.R. K.J. G.W. P.P. S.C. B.M. P.B. S.G. W.H. E.F. T.H. P.H. M.R. W.G. B.R. S.R. K.K. R.K. H.R. W.H. F.H. D.H. D.H. G.G. K.E. R.W. N.B. B.G. S.K. B.H. Y.F. G.F. Alter 67 54 28 59 43 47 58 57 65 71 42 72 69 62 58 63 78 69 65 72 74 66 78 71 58 57 73 77 81 74 83 71 71 72 63 62 55 80 77 58 79 58 70 52 80 anterior 1 0 0 1 0 0 0 0 0 0 0 0 1 0 0 0 1 0 1 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 1 0 1 0 0 0 0 0 0 1 0 anterolateral 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 lateral 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 1 0 1 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 1 Lokalisation inferolateral inferior 0 0 0 1 1 1 0 0 0 1 1 1 1 1 0 1 1 1 0 0 0 1 0 0 0 0 1 1 1 0 1 0 0 0 1 0 0 0 1 1 0 0 0 1 1 1 0 1 0 1 0 0 0 0 0 0 1 1 0 0 1 0 1 0 1 0 0 0 0 0 0 1 0 0 1 1 0 1 1 0 0 0 1 0 0 1 0 0 0 0 inferoseptal 0 1 1 1 0 0 0 1 0 0 1 0 0 0 0 0 0 0 0 1 0 0 1 1 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 septal 1 1 0 1 0 0 0 1 0 0 1 1 0 0 0 0 0 0 0 0 1 0 0 1 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 1 0 0 1 0 anteroseptal 1 1 0 1 0 0 0 0 0 0 1 0 1 0 0 0 0 0 1 0 1 0 0 1 1 0 0 0 0 1 0 0 0 1 1 0 1 0 0 0 0 0 0 0 0 transmural 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Ausdehnung endokardial nicht endokardial 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 125 Tabelle A2: Alter und Lokalisation des Late Enhancement bei untersuchten Probanden mit nicht-transmuralen Myokardinfarkt KM Anreicherung Nr. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 Initialien G.R. G.J. H.D. S.H. B.H. D.L. K.H. K.H. L.E. M.E. P.I. S.A. S.R. K.P. K.H. H.D. R.H. M.E. G.W. J.E. O.F. T.H. G.K. G.D. N.R. A.E. S.U. M.E. K.G. K.M. U.M. V.I. R.H. P.W. K.E. S.W. B.A. M.E. B.G. L.T. S.R. S.A. T.R. S.R. G.A. Alter 52 72 59 81 77 67 71 64 71 49 76 71 52 43 47 63 66 69 60 62 53 60 57 60 69 78 83 66 79 66 61 75 62 53 63 73 63 75 70 36 73 52 48 66 59 anterior 1 0 0 0 0 1 0 1 0 0 0 0 0 0 0 0 0 1 0 0 0 1 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 anterolateral 1 1 0 0 0 0 0 1 0 0 0 0 0 0 0 1 0 1 0 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 1 0 0 0 0 0 0 0 1 0 0 lateral 0 1 0 1 0 0 1 0 0 0 0 0 0 0 0 1 0 0 0 1 0 0 0 1 1 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 0 Lokalisation inferolateral inferior 0 0 0 0 1 1 1 1 1 1 0 0 1 1 0 0 1 1 0 1 0 1 0 1 0 1 0 1 1 0 0 0 0 1 0 0 0 1 0 0 1 1 0 0 0 1 1 1 1 1 0 0 1 1 1 1 0 0 0 0 1 0 0 0 0 1 0 1 1 1 0 0 1 1 1 0 0 1 0 0 0 0 0 1 0 0 0 0 0 1 inferoseptal 0 0 1 1 0 0 1 1 1 1 0 1 1 0 0 0 0 0 0 0 0 0 1 0 1 0 0 1 1 1 0 0 0 1 1 0 0 0 0 0 1 0 0 0 0 septal 1 0 0 1 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 1 0 1 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 anteroseptal 1 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 1 0 1 0 1 0 1 0 0 0 1 0 0 0 1 0 0 0 0 0 transmural 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Ausdehnung endokardial subendokardial 1 0 1 0 1 0 1 0 0 1 0 1 0 1 1 0 1 0 1 0 1 0 1 0 0 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 0 1 1 0 0 1 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 1 0 126 Tabelle A3: Untergruppe der Patienten mit nicht-transmuralem Myokardinfarkt und Bestimmung der Infarktmasse in Gramm (g) durch die CMR KM Anreicherung Nr. Initalien Alter Infarktmasse Lokalisation Ausdehnung anterior anterolateral lateral inferolateral inferior inferoseptal septal anteroseptal transmural Endokardial subendokardial Infarktmasse total (g) Masse pro Schicht (g) 1 G.R. 52 1 1 0 0 0 0 1 1 0 1 0 7,78 32,83 2 G.J. 72 0 1 1 0 0 0 0 0 0 1 0 4,35 57,33 3 H.K. 59 0 0 0 1 1 1 0 0 0 1 0 4,44 24,27 4 S.H. 81 0 0 1 1 1 1 1 0 0 1 0 7,02 50,38 5 D.L. 67 1 0 0 0 0 0 0 0 0 0 1 5,56 18,93 6 K.H. 71 0 0 1 1 1 1 0 0 0 0 1 1,93 27,43 7 K.H. 64 1 1 0 0 0 1 1 1 0 1 0 6,44 27,73 8 L.E. 71 0 0 0 1 1 1 0 0 0 1 0 11,77 53,18 9 M.E. 49 0 0 0 0 1 1 0 0 0 1 0 4,07 45,56 10 P.I. 76 0 0 0 0 1 0 0 0 0 1 0 2,32 25,02 11 S.R. 52 0 0 0 0 1 1 0 0 1 0 0 7,43 40,71 12 K.P. 43 0 0 0 0 1 0 0 0 0 1 0 0,94 13,13 13 K.H. 47 0 0 0 1 0 0 0 0 0 1 0 3,97 46,08 14 R.H. 66 0 0 0 0 1 0 0 0 0 1 0 3,15 31,06 15 M.E. 69 1 1 0 0 0 0 0 0 0 1 0 0,6 21,18 16 G.W. 60 0 0 0 0 1 0 0 0 0 1 0 0,83 12,75 17 J.E. 62 0 0 1 0 0 0 0 0 0 1 0 5,09 60,16 18 O.F. 53 0 0 0 1 1 0 0 0 0 1 0 3,08 37,5 19 T.H. 60 1 0 0 0 0 0 0 1 0 1 0 1,28 13,91 20 G.K. 57 0 0 0 0 1 1 1 0 0 1 0 4,25 47,2 21 G.D. 60 0 0 1 1 1 0 0 0 0 1 0 2,89 24,73 22 N.R. 69 0 1 1 1 1 1 0 0 0 1 0 7,27 46,61 127 Tabelle A4: Patienten mit transmuralem Myokardinfarkt und Bestimmung der Infarktmasse in Gramm (g) durch die CMR KM Anreicherung Nr. Initialien Alter Infarktmasse Lokalisation Ausdehnung anterior anterolateral lateral inferolateral inferior inferoseptal septal anteroseptal transmural endokardial nicht endokardial MASS INFARCT MASS SLICE 1 D.L. 67 1 1 0 0 0 0 1 1 1 0 0 10,75 46,73 2 K.S. 54 0 0 0 0 1 1 1 1 1 0 0 5,31 28,26 3 K.A. 28 0 0 0 1 1 1 0 0 1 0 0 8,57 25,74 4 M.W. 59 1 0 0 0 0 1 1 1 1 0 0 2,01 14,99 5 K.P. 43 0 0 0 0 1 0 0 0 1 0 0 4,84 30,29 6 L.H. 47 0 0 0 1 1 0 0 0 1 0 0 5,77 50,97 7 G.G. 58 0 0 0 1 1 0 0 0 1 0 0 6,23 47,55 9 G.H. 71 0 0 1 0 0 0 0 0 1 0 0 11,71 53,69 10 J.H. 42 0 0 0 0 1 1 1 1 1 0 0 5,42 32,68 11 R.G. 72 0 0 0 0 0 0 1 1 1 0 0 3,71 36,88 12 K.A. 69 1 0 0 0 0 0 0 1 1 0 0 4,41 18,71 13 W.R. 62 0 0 0 1 1 0 0 0 1 0 0 13,37 44,93 14 K.J. 58 0 0 0 1 0 0 0 0 1 0 0 4,76 31,73 15 G.W. 63 0 0 1 1 0 0 0 0 1 0 0 17,97 64,23 16 P.P. 78 1 0 0 0 0 0 0 0 1 0 0 3,52 17,26 17 S.C. 69 0 0 1 1 0 0 0 0 1 0 0 6,14 17,65 18 B.M. 65 1 0 0 0 0 0 0 1 1 0 0 2,68 13,57 19 P.B. 72 0 0 0 1 1 1 0 0 1 0 0 13,1 67,25 128 9. Danksagung An dieser Stelle möchte ich mich ganz herzlich bei Herrn Prof. Dr. med. Trappe, Direktor der Medizinischen Klinik II des Marienhospitals Herne, für die Überlassung des Themas, die Betreuung und Koordination der Arbeit bedanken. Besonderer Dank gebührt Dr. med. Burkhard Sievers, Dr. med. Ulrich Franken und Dr. med. Marc van Bracht für die Betreuung unserer Arbeitsgruppe. Ohne Ihre Unterstützung, Geduld und viele hilfreiche Ratschläge wäre meine Arbeit in dieser Form nicht zustande gekommen. Meinen Mitdoktoranden Marvin Addo, Asli Bakan und Simon Kirchberg danke ich für die sehr gute Zusammenarbeit und die ständige gegenseitige Unterstützung. Dr. med. Rolf Borchard und Ingo Wickenbrock aus der Medizinischen Klinik II danke ich für die großartige Unterstützung und Diskussionsbereitschaft. Bedanken möchte mich ich die bei ständige meinen Studienkollegen Tobias Klein für das Erstellen der Fotos. Dr. med. Stefan Zimmermann, Sebastian Dick, Barbara Seeliger und besonders Sören Müller danke ich für die Ratschläge beim Erstellen und Layouten des Textes. Meinen Freunden Dominik Müller und Sükran Yolcu danke ich für die ständige Motivation und die kulinarische Versorgung zu jeder Tages- und Nachtzeit auch noch weit über meine Studienzeit hinaus. Dipl. Ing. (ETH) Tina Spiess danke ich dafür, dass Sie mir zeigt, was und wie alles zu schaffen ist. Für Ihre ständige Motivation und die konstruktiven Ratschläge danke ich von ganzem Herzen. Meinen Eltern und meinem Bruder Sinu A. John-Puthenveettil danke ich für Ihre Liebe und ständige Unterstützung vor und während meines ganzen Studiums. Sie haben mir mein Studium und somit den Weg zu dieser Arbeit ermöglicht. Großer Dank gebührt meiner Tante Maria und meinem Onkel Herbert – sie haben entscheidend dazu beigetragen, dass ich das geworden bin, was ich bin. 129 10. Lebenslauf Vorname: Binu Sebastian Nachname: John-Puthenveettil Eltern: Vater: Sebastian John Puthenveettil Mutter: Mary John, geb. Chamakalayil Geschwister: Sinu Antony John-Puthenveettil Geburtstag und Geburtsort: 5. Juli 1978 in Paderborn Nationalität: Deutsch Familienstand: ledig Schulausbildung 08/1984 – 06/1988 Dionysius - Grundschule in Paderborn - Elsen 08/1988 – 06/1997 Goerdeler - Gymnasium in Paderborn 07/1997 Schulabschluss: Abitur Berufsausbildung 10/1997 – 10/1999 Ausbildung zum „Staatlich Geprüften Informatikassistenten Medizinökonomie“ am Bildungszentrum für informationsverarbeitende Berufe e.V. (b.i.b. - Höhere Berufsfachschule) in Paderborn. Studium 10/1999 –11/2005 Humanmedizin an der Ruhr-Universität Bochum 09 / 2001 Physikum 08/2002 1. Staatsexamen 08/2004 2. Staatsexamen 130 Praktisches Jahr 10/2004 – 02/2005 Innere Medizin (Pneumologie und Kardiologie) am Marienhospital I, Herne. 02/2005 - 05/2005 Chirurgie (General Surgery, Emergency medicine, Paediatric surgery sowie Orthopaedic Surgery) am St. John’s Medical College Hospital in Bangalore, Indien. 05/2005 – 09/2005 Orthopädie am St. Josef-Hospital, Bochum sowie am St. Elisabeth-Hospital, Bochum 10.11.2005 3. Staatsexamen 21.11.2005 Approbation zum Arzt Seit 1. Januar 2006 Assistenzarzt an der Klinik und Poliklinik für Herz-, Thorax- und herznahe Gefäßchirurgie der Universität Regensburg (Prof. Dr. med. D.E. Birnbaum) Die Dissertation ist in folgenden Publikationsorganen vorveröffentlicht: Vortrag im Rahmen des 5. Mainzer Kardio-MR-Symposium im Juni 2003: Sievers B, John B, Brands B, Franken U, van Bracht M, Trappe HJ. „Ist mittels EKG’s eine Differenzierung von transmuralen und nicht-transmuralen Infarkten möglich? Eine Studie mittels der kardiovasuklären Magnetresonanztomographie.“ Veröffentlichung im International Journal of Cardiology im Dezember 2004: Sievers B, John B, Brandts B, Franken U, van Bracht M, Trappe HJ. “How reliable is electrocardiography in differentiating transmural from nontransmural myocardial infarction? A study with contrast magnetic resonance imaging as gold standard.” Int J Cardiol. 2004 Dec;97(3):417-23. Posterpräsentation im Rahmen der 71. Jahrestagung der Deutschen Gesellschaft für Kardiologie 2005, Mannheim: Sievers B, John-Puthenveettil B, Kirchberg S, Franken U, Addo M, Bakan A, Trappe HJ. “Sensitivity of Q-wave in chronic myocardial infarction: A study with contrast enhancement cardiovascular magnetic resonance imaging as gold standard.” Z Kardiol 94: Suppl 1 (2005) 131