Untersuchung des bakteriellen Zytoskeletts
Werbung
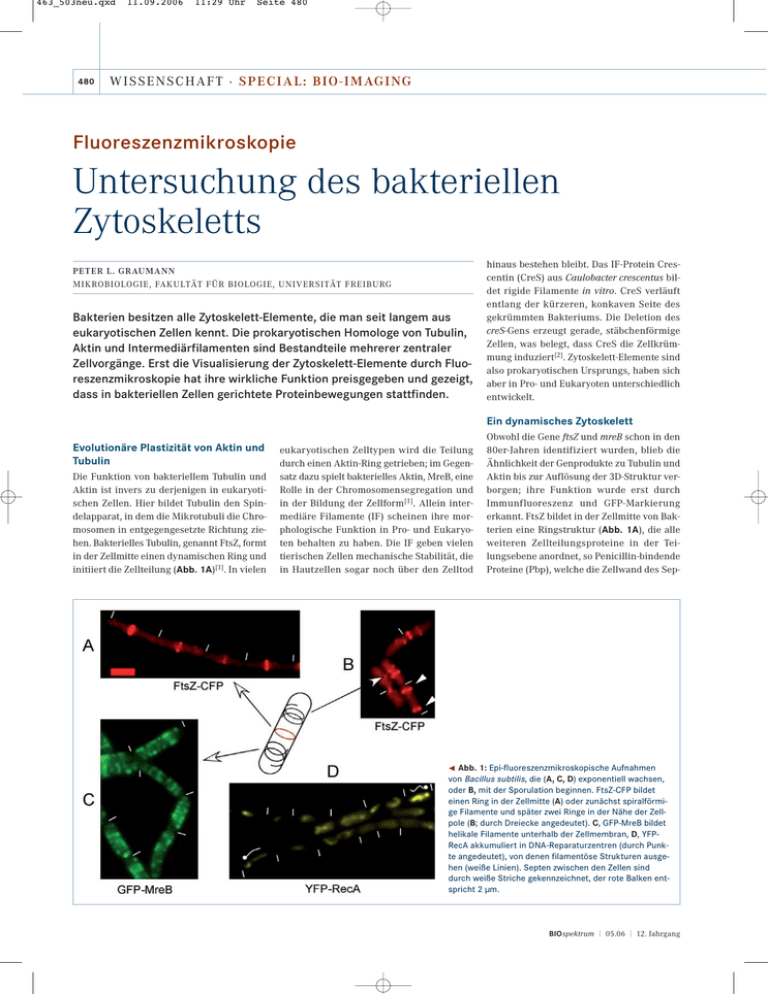
463_503neu.qxd 480 11.09.2006 11:29 Uhr Seite 480 WISSENSCHAFT · S PECIA L: BI O-I MAGI NG Fluoreszenzmikroskopie Untersuchung des bakteriellen Zytoskeletts PETER L. GRAUMANN MIKROBIOLOGIE, FAKULTÄT FÜR BIOLOGIE, UNIVERSITÄT FREIBURG Bakterien besitzen alle Zytoskelett-Elemente, die man seit langem aus eukaryotischen Zellen kennt. Die prokaryotischen Homologe von Tubulin, Aktin und Intermediärfilamenten sind Bestandteile mehrerer zentraler Zellvorgänge. Erst die Visualisierung der Zytoskelett-Elemente durch Fluoreszenzmikroskopie hat ihre wirkliche Funktion preisgegeben und gezeigt, dass in bakteriellen Zellen gerichtete Proteinbewegungen stattfinden. hinaus bestehen bleibt. Das IF-Protein Crescentin (CreS) aus Caulobacter crescentus bildet rigide Filamente in vitro. CreS verläuft entlang der kürzeren, konkaven Seite des gekrümmten Bakteriums. Die Deletion des creS-Gens erzeugt gerade, stäbchenförmige Zellen, was belegt, dass CreS die Zellkrümmung induziert[2]. Zytoskelett-Elemente sind also prokaryotischen Ursprungs, haben sich aber in Pro- und Eukaryoten unterschiedlich entwickelt. Ein dynamisches Zytoskelett Evolutionäre Plastizität von Aktin und Tubulin Die Funktion von bakteriellem Tubulin und Aktin ist invers zu derjenigen in eukaryotischen Zellen. Hier bildet Tubulin den Spindelapparat, in dem die Mikrotubuli die Chromosomen in entgegengesetzte Richtung ziehen. Bakterielles Tubulin, genannt FtsZ, formt in der Zellmitte einen dynamischen Ring und initiiert die Zellteilung (Abb. 1A)[1]. In vielen eukaryotischen Zelltypen wird die Teilung durch einen Aktin-Ring getrieben; im Gegensatz dazu spielt bakterielles Aktin, MreB, eine Rolle in der Chromosomensegregation und in der Bildung der Zellform[1]. Allein intermediäre Filamente (IF) scheinen ihre morphologische Funktion in Pro- und Eukaryoten behalten zu haben. Die IF geben vielen tierischen Zellen mechanische Stabilität, die in Hautzellen sogar noch über den Zelltod Obwohl die Gene ftsZ und mreB schon in den 80er-Jahren identifiziert wurden, blieb die Ähnlichkeit der Genprodukte zu Tubulin und Aktin bis zur Auflösung der 3D-Struktur verborgen; ihre Funktion wurde erst durch Immunfluoreszenz und GFP-Markierung erkannt. FtsZ bildet in der Zellmitte von Bakterien eine Ringstruktur (Abb. 1A), die alle weiteren Zellteilungsproteine in der Teilungsebene anordnet, so Penicillin-bindende Proteine (Pbp), welche die Zellwand des Sep- ¯ Abb. 1: Epi-fluoreszenzmikroskopische Aufnahmen von Bacillus subtilis, die (A, C, D) exponentiell wachsen, oder B, mit der Sporulation beginnen. FtsZ-CFP bildet einen Ring in der Zellmitte (A) oder zunächst spiralförmige Filamente und später zwei Ringe in der Nähe der Zellpole (B; durch Dreiecke angedeutet). C, GFP-MreB bildet helikale Filamente unterhalb der Zellmembran, D, YFPRecA akkumuliert in DNA-Reparaturzentren (durch Punkte angedeutet), von denen filamentöse Strukturen ausgehen (weiße Linien). Septen zwischen den Zellen sind durch weiße Striche gekennzeichnet, der rote Balken entspricht 2 μm. BIOspektrum | 05.06 | 12. Jahrgang 463_503neu.qxd 11.09.2006 11:29 Uhr Seite 481 tums synthetisieren (Abb. 2A). Der FtsZ-Ring ist dynamisch. Er polymerisiert und depolymerisiert unter Verbrauch von GTP und erneuert sich ständig[3]. Zu Beginn der Sporulation in B. subtilis bildet FtsZ spiralförmige Filamente, die sich von der Mitte in Richtung der Zellpole ausdehnen (Abb. 1B), bis zwei FtsZ-Ringe in Polnähe entstehen[4]. Nur einer der Ringe ist in der asymmetrischen Zellteilung aktiv. Das MreB-Protein bildet ausschließlich helikale Filamente, die unterhalb der Zellmembran lokalisiert sind (Abb. 1C)[5], wobei es, wie Aktin, ATP verbraucht. Wir haben gezeigt, dass sich die Filamente in Zellen von B. subtilis rapide bewegen. Im Minutentakt laufen mehrere Filamente auf helikalen Bahnen durch die Zelle[6]; MreB könnte demnach eine Motorfunktion ausüben. Vermutlich ist die Funktion von bakteriellem Aktin dual. Die Abschaltung der MreB-Synthese führt zur Änderung der Zellmorphologie; die Zellen werden rund und lysieren schließlich. MreB interagiert mit dem Membranprotein MreC (Abb. 2A), welches wiederum essenziell für die Zellmorphologie ist und mit Proteinen wechselwirkt, die an der Zellwandsynthese beteiligt sind (Pbps, Abb. 2A). In stäbchenförmigen Bakterien wie B. subtilis erfolgt auch die Inkorporation von neuem Zellwandmaterial helikal entlang der Zellachse und orientiert sich demnach an zytosolischen AktinFilamenten. Bevor jedoch die Bazillen ihre Zellform verlieren, tritt nach Abschalten der MreB-Synthese ein drastischer Defekt bei der Segregation der Schwesterchromosomen auf. MreB ist direkt oder indirekt mit dem Chromosom verknüpft, was eine aktive Rolle bei dem Mitose-analogen Prozess in Bakterien belegt. Die Verdopplung des zirkulären Chromosoms in E. coli und B. subtilis erfolgt in der Zellmitte durch einen stationären DNA-Polymerase-Komplex. Das Chromosom wird durch die Replikationsmaschinerie gespult, und neu replizierte Bereiche werden zu den Zellpolen transportiert (Abb. 2B). Wir vermuten, dass MreB bei diesem Transportprozess entweder die treibende Kraft durch Bewegung der Filamente ausübt oder die Schienen für ein Motorprotein stellt. Wie die Verknüpfung von MreB mit dem Chromosom auf molekularer Ebene aussieht, ist Gegenstand intensiver Forschung. Weitere dynamische Proteinfilamente in Bakterien Nicht nur MreB und FtsZ bilden filamentöse Strukturen in Bakterien, sondern auch die BIOspektrum | 05.06 | 12. Jahrgang 463_503neu.qxd 482 11.09.2006 11:29 Uhr Seite 482 WISSENSCHAFT · S PECIA L: BI O-I MAGI NG ¯ Abb. 2: Modell für das bakterielle Zytoskelett. A, Interak- tion von FtsZ mit mehreren Membranproteinen (FtsQLW), welche spezialisierte Proteine (Pbps) rekrutieren, die das Septum bilden; Interaktion von MreB mit dem Membranprotein MreC, welches wiederum mit Zellwand-Syntheseproteinen (Pbps) interagiert. B, Modell für die Reparatur von DNA-Doppelstrangbrüchen, an denen sich ein Reparaturzentrum bildet, von dem aus sich RecA-Filamente zum Schwesterchromosom bewegen. Die hellblauen Bereiche stellen die verdoppelten Chromosomen dar. Min-Proteine wandern in E. coli zwischen den Zellpolen hin und her (durch die gestrichelte Min-Helix angedeutet). Min-Proteine in E. coli, die eine Zellteilung in Polnähe durch Inhibition der FtsZ-Polymerisation verhindern (Abb. 2B). Wir haben kürzlich zeigen können, dass auch während der Reparatur von DNA-Doppelstrangbrüchen Filamente entstehen, die das Protein RecA enthalten. An einem DNA-Bruch formiert sich ein Reparaturzentrum, in welchem in definierter Abfolge eine Reihe von Reparaturproteinen binden. RecA wird durch mehrere Proteine an einem DNA-Bruch rekrutiert und dort auf einzelsträngige (ss) DNA geladen, welche enzymatisch erzeugt wird. RecA bildet Nukleoprotein-Filamente mit ssDNA in vitro, sucht nach homologen DNA-Strängen, und führt ssDNA in einen DNA-Duplex ein, um Strangaustausch zu katalysieren. Dies hat die Bildung von Cross-over zur Folge, welche die Sequenzinformation des intakten Schwesterchromosoms zugänglich machen. In B. subtilis bildet RecA dynamische filamentöse Strukturen, die sich von einem Reparaturzentrum in die andere Zellhälfte bewegen, wo das Schwesterchromosom liegt (Abb. 1D, 2B)[7]. Die RecA-Filamente scheinen ssDNA vom Reparaturzentrum zum Schwesterchromosom hin und her zu transportieren und dadurch Cross-over über eine große Distanz aufzubauen. Eine ähnliche Funktion erfüllen RecA-Filamente auch in kompetenten Zellen. Diese können DNA aus der Umgebung aufnehmen und bei vorhandener Homologie in ihr Chromosom integrieren. Diese Fähigkeit besitzen auch pathogene Bakterien, die so effizient Resistenzgene erwerben. Kompetente Zellen von B. subtilis nehmen DNA nur an einem Zellpol auf, von dem sich RecA-Filamente ausbilden[8]. Auch diese Filamente sind hoch dynamisch und scheinen DNA zum Chromosom zu transportieren. Bakterien besitzen also offensichtlich eine Art ssDNATransportmaschinerie im Zytosol, die auf einem Filament-bildenden Protein basiert. Zellbiologie von Bakterien Hochauflösende Fluoreszenzmikroskopie hat die ungeahnt ausgeprägte subzelluläre Organisation von Prokaryoten ans Licht gebracht. Bakterien besitzen innen wie außen definierte Strukturen, die an Replikation, Chromosomensegregation und Zellteilung bis zur Zellwandsynthese beteiligt sind. Viele dieser Strukturen basieren auf Proteinen, die Filamente ausbilden, oft mit hochdynamischen Eigenschaften, die es ermöglichen, dass sich die Filamente bewegen. Die Untersuchung von Zytoskelett-Elementen in Pro- und Eukaryoten bleibt weiterhin spannend, da noch viele grundlegende Fragen unbeantwortet sind. ó Danksagung Literatur [1] Graumann, P. L. (2004): Cytoskeletal elements in bacteria. Curr Opin Microbiol 7: 565–571. [2] Ausmees, N., Kuhn, J. R., and Jacobs-Wagner, C. (2003): The bacterial cytoskeleton: an intermediate filament-like function in cell shape. Cell 115: 705–713. [3] Stricker, J., Maddox, P., Salmon, E. D., and Erickson, H. P. (2002): Rapid assembly dynamics of the Escherichia coli FtsZring demonstrated by fluorescence recovery after photobleaching. Proc. Natl. Acad. Sci. U S A 99: 3171–3175. [4] Ben-Yehuda, S., and Losick, R. (2002): Asymmetric cell division in B subtilis involves a spiral-like intermediate of the cytokinetic protein FtsZ. Cell 109: 257–266. [5] Jones, L. J., Carballido-Lopez, R., and Errington, J. (2001): Control of cell shape in bacteria: helical, actin-like filaments in Bacillus subtilis. Cell 104: 913–922. [6] Defeu Soufo, H. J., and Graumann, P. L. (2004): Dynamic movement of actin-like proteins within bacterial cells. EMBO Rep 5: 789–94. [7] Kidane, D., and Graumann, P. L. (2005): Dynamic formation of RecA filaments at DNA double strand break repair centres in live cells. J. Cell Biol. 170: 357–366. [8] Kidane, D., and Graumann, P. L. (2005): Intracellular protein and DNA dynamics within competent Bacillus subtilis cells. Cell 122: 73–84. Korrespondenzadresse: Prof. Peter L. Graumann Mikrobiologie, Fakultät für Biologie, Albert-Ludwigs Universität Freiburg Schänzlestr. 1 D-79104 Freiburg Tel.: 0761-2032630 Fax: 0761-2038349 [email protected] Ich bedanke mich bei der Deutschen Forschungsgemeinschaft und dem Fonds der Chemischen Industrie für die Förderung der Forschung. BIOspektrum | 05.06 | 12. Jahrgang











