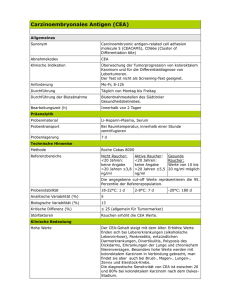
Die klinische Bedeutung des carcinoembryonalen Antigens (CEA
Werbung

Aus der Medizinischen Klinik Innenstadt der Ludwig-Maximilians-Universität München Direktor: Prof. Dr. med. M. Reincke Die klinische Bedeutung des carcinoembryonalen Antigens (CEA) für Patienten mit hereditärem nicht-polypösem kolorektalem Karzinom (HNPCC) Dissertation zum Erwerb des Doktorgrades der Medizin an der Medizinischen Fakultät der Ludwig-Maximilians-Universität zu München vorgelegt von Silke Günther aus Düsseldorf 2005 Mit Genehmigung der Medizinischen Fakultät der Universität München Berichterstatter: PD Dr. med. U. Schiemann Mitberichterstatter: PD Dr. med. F. T. Kolligs Dekan: Prof. Dr. med. D. Reinhardt Tag der mündlichen Prüfung: 17.11.2005 2 Meinen lieben Eltern gewidmet 3 Inhaltsverzeichnis Seite 6 1. Einleitung 1.1 Das carcinoembryonale Antigen 7 1.1.1 Entdeckung und erste Erkenntnisse 7 1.1.2 Struktur und Biologie 8 1.1.3 Physiologie und Pathophysiologie 8 1.1.4 Vorkommen im gesunden Gewebe 9 1.1.5 Vorkommen bei verschiedenen Erkrankungen 10 1.2 Das hereditäre nicht-polypöse kolorektale Karzinom 11 1.2.1 Geschichte des HNPCC 11 1.2.2 Systematik und Klassifikation des HNPCC 12 1.2.3 Weitere Merkmale des HNPCC 13 1.2.4 Genetische Aspekte 14 2. Zielsetzung 16 3. Patienten und Methoden 17 3.1 Patientenkollektiv 17 3.2 Tumoren 18 3.3 Bestimmung des CEA 19 3.4 Molekulargenetische Untersuchungen 20 3.4.1 Mikrosatellitenanalyse 20 3.4.2 Mutationsanalyse 21 3.4.3 Immunhistochemie 22 3.5 Statistische Auswertung 22 4. Ergebnisse 24 4.1 Vergleich der Kollektive 24 4.2 CEA bei HNPCC und sporadischem Karzinom 27 4.3 Weitere Ergebnisse im HNPCC-Kollektiv 34 4.3.1 Differenzierungsgrad 34 4.3.2 Tumorhistologie 35 4.3.3 Tumorlokalisation 35 4.3.4 Genetische Merkmale 36 5. Diskussion 39 4 6. Zusammenfassung 49 7. Literaturverzeichnis 51 Lebenslauf 61 Danksagung 62 5 1. Einleitung Tumormarker haben seit der Zeit ihrer Entdeckung sowohl für Ärzte als auch für viele Patienten eine besondere Bedeutung; bieten - oder suggerieren - sie doch die Möglichkeit, eine noch nicht symptomatische maligne Erkrankung frühzeitig zu erkennen. Das carcinoembryonale Antigen, abgekürzt CEA, ist dabei eines der am längsten bekannten tumorassoziierten Antigene. Es hat sich inzwischen als „Klassiker“ etabliert und wird heute wegen seiner gesicherten klinischen Bedeutung allgemein anerkannt. Seit seiner Entdeckung vor fast 40 Jahren haben sich Arbeitsgruppen in aller Welt kontinuierlich mit diesem Tumormarker beschäftigt, sodass mittlerweile der Kenntnisstand sowohl über das CEA an sich, als auch über seine Rolle in der Diagnostik und der postoperativen Verlaufsbeobachtung v.a. des kolorektalen Karzinoms (CRC) recht umfangreich ist. Auch nach der Entdeckung weiterer Tumormarker, die relevant für das kolorektale Karzinom sind (z. B. CA 19-9, CA 242), behielt das CEA seine Stellung als Spitzenreiter bei.32 In den zahlreichen Untersuchungen rund um das kolorektale Karzinom wurde allerdings kaum einmal speziell der Blick auf dessen hereditäre Formen gerichtet. Zu diesen gehören u.a. das Lynch-Syndrom (HNPCC: hereditary non-polyposis colorectal cancer) und die familiäre adenomatöse Polyposis (FAP). Diese unterscheiden sich in verschiedenem Maße, z.B. in ihrem klinischen und histopathologischen Erscheinungsbild, vom „normalen“ sporadisch auftretenden kolorektalen Karzinom. Die vorliegende Arbeit soll daher dazu dienen, Unterschiede bzw. Gemeinsamkeiten zwischen HNPCC und sporadischem kolorektalem Karzinom bezüglich der CEAExpression herauszuarbeiten. 6 1.1 Das carcinoembryonale Antigen 1.1.1 Entdeckung und erste Erkenntnisse Das carcinoembryonale Antigen wurde erstmals im Jahre 1965 von Phil Gold und Samuel O. Freedman, Wissenschaftlern der McGill-Universität in Montreal, beschrieben.21 Sie identifizierten das CEA als ein Protein, das nach damaliger Meinung sowohl in embryonaler Kolon-Schleimhaut als auch in Adenokarzinomen des Kolons vorkam, nicht aber in gesundem Kolongewebe des Erwachsenen, und nannten es deshalb „carcinoembryonales Antigen“. Einige Jahre später konnte diese Arbeitsgruppe dasselbe Antigen auch im Serum von Patienten mit kolorektalen und anderen Karzinomen nachweisen und mit Hilfe des von Thomson et al. beschriebenen Radioimmunassays sogar quantitativ bestimmen.85 Seit diesem Zeitpunkt wurde die Möglichkeit des Gebrauchs von CEA als Tumormarker mit großem Interesse verfolgt. Im Jahr 1974 wurde der CEA-Test für eine Reihe von Indikationen, darunter Früherkennung, Verlaufsbeobachtung und Screening von Risikopatienten bezüglich verschiedener Karzinome, durch die amerikanische Food and Drug Administration (FDA) anerkannt. Nachdem ganz zu Anfang noch optimistisch von einer fast hundertprozentigen Sensitivität des CEA für Karzinome des Gastrointestinaltraktes ausgegangen wurde, erwartet man heute nur noch bei 55 % aller kolorektalen Karzinome erhöhte Werte.8,10 Besser geeignet ist der Tumormarker für die Detektion von Metastasen (v.a. Lebermetastasen); hier ergaben verschiedene Studien eine Sensitivität von 80-100 %. Erkennung von (Lokal-)Rezidiven herrscht dagegen 4,35,90 geteilte Bezüglich der Meinung.19,33,87,89 Grundsätzlich ist das CEA für die postoperative Beobachtung und für das Monitoring unter Radio-/Chemotherapie unverzichtbar.30,33 Auch die prognostische Bedeutung des präoperativen CEA wurde bereits in den 70er Jahren erkannt. Patienten mit hohen Werten weisen häufig bereits fortgeschrittene Tumoren auf und leiden in höherem Maße an Rezidiven als Patienten mit niedrigen Ausgangwerten.28,33,56,63,65,79-80,90 7 1.1.2 Struktur und Biologie Die Struktur und die physikalisch-chemischen Parameter des CEA sind in den 70er Jahren gründlich untersucht worden. Es wurde als ein komplexes Glykoprotein mit einem Molekulargewicht von 180-200 kDa, einem Sedimentationskoeffizienten von 7-8 S und der elektrophoretischen Mobilität eines ß-Globulins beschrieben; die Halbwertzeit wird mit 3-8 Tagen angegeben.25,33,86 Inzwischen weiß man darüber hinaus, dass es sich um ein Monomer mit der stattlichen Größe von 20 x 8 nm handelt, was durch den großen Kohlenhydratanteil zu erklären ist. Dieser macht bis zu 50 % der Gesamtmasse aus und weist große Unterschiede in den Seitenketten auf, woraus wiederum die starke Heterogenität des Moleküls resultiert. Vorwiegend sind L-Fucose, D-Mannose, DGalactose, N-Acetyl-D-Glucosamin und Sialinsäure zu finden. Dagegen ist der Proteinanteil, eine einzelne Polypeptidkette aus 668 Aminosäuren, recht homogen.15,25,83 Die Analyse der Aminosäuresequenz brachte die Erkenntnis, dass das CEA der Immunglobulin-Superfamilie zuzurechnen ist, zu der auch Adhäsionsmoleküle wie ICAM1 sowie MHC-Antigene gehören.59 Mehrere in vitro-Studien haben auch bereits gezeigt, dass CEA als homo- und heterophiles Adhäsionsmolekül agieren kann. Dies wäre gut mit der Vorstellung vom Tumorwachstum vereinbar, konnte in vivo jedoch noch nicht bestätigt werden.5,26,58,93 Die 29 Gene, die für die CEA-Familie codieren, sind inzwischen vollständig identifiziert worden. Sie befinden sich allesamt auf Chromosom 19q13.2. Von ihnen werden 18 Gene exprimiert (sieben codieren für die CEA-Gruppe, elf für die verwandte pregnancy-specific glycoprotein-Gruppe), die restlichen elf sind Pseudogene.84 1.1.3 Physiologie und Pathophysiologie Mit Hilfe spezifischer monoklonaler Antikörper für CEA ließ sich dessen exakte Lokalisation nachweisen: Es ist ein zellmembran-assoziiertes Molekül; genauer gesagt, es findet sich fast ausschließlich in der apikalen Glykokalyx („fuzzy coat“).25 Elektronenmikroskopische Bilder zeigen es den Mikrovilli der Enterozyten aufgelagert, wo es aus speziellen CEA-Mikrovesikeln freigesetzt wird. Interessanterweise scheint es zwischen gesunder und karzinomatöser Kolonschleimhaut keinen Unterschied in der pro Tag freigesetzten Menge zu geben; sie beträgt nach derzeitigem Kenntnisstand in beiden Fällen etwa 50-70 mg CEA pro Tag.49 Weshalb dennoch beim gesunden Erwachsenen 8 selten Serumspiegel über 2 ng/ml gefunden werden, während es bei malignen Kolontumoren zu deutlich erhöhten Werten kommen kann, lässt sich heute pathophysiologisch folgendermaßen erklären: Die gesunde Kolonschleimhaut setzt das CEA ausschließlich von der apikalen Seite her in Richtung Darmlumen frei, sodass es keinen Kontakt mit Blut- oder Lymphgefäßen bekommt und größtenteils mit den Fäzes ausgeschieden wird. Die Tumorzellen dagegen haben diese Polarität verloren; das CEA wird von allen Seiten der Zelloberfläche abgegeben. Vor allem bei gutdurchbluteten Tumoren kann es auf diese Weise natürlich leicht in den Blutkreislauf gelangen und so die erhöhten Serumspiegel hervorrufen.5,25 Die große Menge an carcinoembryonalem Antigen, die auch im gesunden Kolon produziert wird, lässt eine funktionelle Bedeutung vermuten. Tatsächlich konnte schon 1990 gezeigt werden, dass CEA in der Lage ist, E.coli zu binden. Seitdem wird ein adhäsiver (Bakterienbindung) und daher protektiver (Kolonschutz) Nutzen postuliert.25,36 Insgesamt muss der CEA-Wert im Serum als Endgröße verstanden werden, die von mehreren Faktoren abhängig ist: z.B. der Tumorgröße (Anzahl markerproduzierender Zellen), der Synthese- und Freisetzungsrate, der Blutversorgung des Tumors, seinem Nekrosegrad, der Verdünnung des Markers im Gesamtblutvolumen und der Abbaurate.64 Die Basiswerte sind bei älteren Personen im Allgemeinen höher als bei jüngeren, wobei dies nicht allein durch die häufigere Prävalenz benigner Lebererkrankungen zu erklären ist. Außerdem konnte epidemiologisch gezeigt werden, dass Männer höhere CEA-Werte als Frauen, und Raucher höhere als Nichtraucher aufweisen.15,19 1.1.4 Vorkommen im gesunden Gewebe Zu Beginn der Ära des CEA wurde noch angenommen, das Antigen würde nach der Embryonalzeit, während der fetalen Prozesse (Differenzierung, Spezialisierung, Organisation), verschwinden, und nur im Falle eines Karzinoms - aufgrund von Disorganisation und Entdifferenzierung - wieder auftreten.22 Dies ist inzwischen revidiert worden; die CEA-Expression lässt sich ab der frühen Fetalzeit (9.-14. Woche) nachweisen und „scheint dann während des ganzen Lebens zu persistieren“.57 Sie ist beim Gesunden allerdings auf selektiv epitheliale Expression beschränkt, und zwar in folgenden Geweben: 25 9 • Zylinderepithel- und Becherzellen des Kolons • Muzinöse Zellen in Kardia und Pylorus (Magen) • Plattenepithelzellen von Zunge, Ösophagus und Cervix uteri • Drüsenepithel und Ausführungsgänge von Schweißdrüsen • Epithelzellen der Prostata 1.1.5 Vorkommen bei verschiedenen Erkrankungen 1969 wurde das CEA von Gold and Freedman noch als systemspezifischer Tumormarker bezeichnet: „present in all tested malignant tumors of the entodermally derived epithelium of the digestive system“.22 In neueren Studien und Reviews wurde dagegen festgehalten, dass die CEA-Expression nicht bei allen, jedoch bei folgenden Malignomen nachgewiesen werden kann: Karzinome von Kolon, Magen, Pankreas, Gallenblase, Harnblase, Adenokarzinom und kleinzelliges Karzinom der Lunge, muzinöses Ovarialkarzinom, und Adenokarzinom des Endometriums.19,25,75 Auch bei einer Vielzahl von nichtmalignen, z.B. entzündlichen Erkrankungen finden sich erhöhte CEA-Werte im Serum. Dazu gehören v.a. Lebererkrankungen (alkoholbedingte, biliäre, chronisch-aktive und kryptogene Hepatitis, obstruktiver Ikterus), gastrointestinale Ulzera, Pankreatitis, Divertikulitis, entzündliche Darmerkrankungen, Bronchitis und fibrozystische Mammaerkrankungen.76 Generell beeinflusst natürlich auch die Funktion des CEA-abbauenden Organs, der Leber, die messbaren Serumspiegel; eine Leberinsuffizienz kann wegen des verminderten Abbaus zu höheren CEA-Serumspiegeln führen. Kreuzreagierende Substanzen sind zwar beschrieben worden (z.b. das non-specific crossreacting antigen, NCA, und das biliary glycoprotein, BGP), spielen aber im allgemeinen keine Rolle in der klinischen Diagnostik.25,82 Beachtet werden muss allerdings die Möglichkeit einer Wertverfälschung durch antiMaus-Antikörper (HAMA), die bei Patienten nach Immunszintigraphie oder -therapie (sog. Frischzellenkur) im Serum zu finden sind.82,89 Außerdem wurden bestimmte äußere Faktoren beschrieben, die die CEA-Produktion steigern können; darunter Lösungsmittel, Retinoide, Natriumbutyrat und Interferone.83 10 1.2 Das hereditäre nicht-polypöse kolorektale Karzinom Das kolorektale Karzinom gilt in seiner Gesamtheit als einer der häufigsten malignen Tumoren in den Industrieländern. Bei Männern ist es das zweithäufigste nach dem Bronchialkarzinom, bei Frauen das zweithäufigste nach dem Mammakarzinom; fasst man beide Geschlechter zusammen, ist es mit einer Häufigkeit von 12,8 % sogar insgesamt das häufigste.20,27,81 Dabei werden meist die sporadisch auftretenden mit den verschiedenen hereditären Formen zusammengefasst. Zu den letzteren zählen einerseits diejenigen Formen, die mit auffälliger Polyposis einhergehen, wie die familiäre adenomatöse Polyposis (FAP), die familiäre juvenile Polyposis, das Turcot- und das Gardner-Syndrom; andererseits die Formen ohne Polyposis, zu denen das hereditäre nicht-polypöse kolorektale Karzinom (HNPCC, auch „Lynch-Syndrom“), dessen Sonderform Muir-Torre-Syndrom (mit zusätzlichen Talgdrüsentumoren), und das hereditäre „flat adenoma“-Syndrom (HFAS) gerechnet werden. Die häufigste der erblich bedingten Formen ist dabei das Lynch-Syndrom (HNPCC). Sein Anteil unter den CRC wird allgemein mit 5-10 % angegeben (Ausnahme bildet eine einzelne, aber renommierte Studie aus Finnland, die einen Prozentsatz von nur 0,7 % ergab), wobei die Ziffer natürlich abhängig von den verwendeten Kriterien ist und eine Unterschätzung der tatsächlichen Quote oft vermutet wird.17,41,45,50,81,86 Es ist in jedem Fall eine bedeutend große Zahl von Menschen, die - wissentlich oder unwissentlich - von einem erblich erhöhten Karzinomrisiko betroffen sind. 1.2.1 Geschichte des HNPCC Die Entdeckung des HNPCC kann bis in das Jahr 1895 zurückverfolgt werden, als Aldred Warthin, ein Pathologe an der Universität Michigan, von der Familie seiner Näherin erfuhr, die eine ungewöhnliche Häufung von Magen- und kolorektalen Karzinomen verzeichnete. Seine Untersuchungen über diese „Familie G“ publizierte Warthin bereits im Jahr 1913.91 Ein halbes Jahrhundert später, 1966, beschrieben Henry T. Lynch und seine Mitarbeiter zwei weitere ähnlich belastete Großfamilien und nannten erstmals den Begriff „Cancer Family Syndrome“ (CFS).42 Erst in den 80er Jahren nahmen international das Interesse und die Zahl der Studien zu diesem Syndrom zu, und der Terminus „HNPCC“ wurde eingeführt. Synonym dazu wird auch der Begriff „Lynch-Syndrom“ gebraucht. 11 1.2.2 Systematik und Klassifikation des HNPCC Die Gesamtheit der HNPCC kann in zwei Untergruppen, Typ I und II, unterteilt werden, basierend auf dem Vorhandensein oder Nichtvorhandensein von extrakolonischen Tumormanifestationen. Das Lynch-Syndrom I ist charakterisiert durch eine autosomal dominant vererbte Häufung von kolorektalen Karzinomen vor dem 50. Lebensjahr, ein auffälliges Vorherrschen von proximal lokalisierten Tumoren (70 %), und eine Neigung zu synchronen und metachronen Tumoren. Familien, die außer diesen Merkmalen auch Tumoren in Endometrium, Ureter, Nierenbecken, Magen, Dünndarm, Ovar, Pankreas, Gallengängen, Haut und Larynx sowie maligne hämatologische Erkrankungen aufweisen (sog. HNPCC-assoziierte Tumoren), werden unter Lynch-Syndrom II klassifiziert; hierfür wird teilweise auch heute noch der alte Begriff „Cancer Family Syndrome“ (CFS) verwendet (s.o.). Seit einem Expertentreffen im August 1990 in Amsterdam, bei der die „International Collaborative Group on Hereditary Non-Polyposis Colorectal Cancer“ (ICG-HNPCC) gegründet wurde, bestehen definierte Kriterien zur Diagnostizierung des LynchSyndroms.88 Diese „Amsterdam-Kriterien“ sind wie folgt (alle Kriterien müssen erfüllt sein): 1. mindestens drei Familienangehörige mit histologisch gesichertem Kolon- oder Rektumkarzinom, einer davon Verwandter ersten Grades der beiden anderen 2. Erkrankungen in mindestens zwei aufeinanderfolgenden Generationen 3. mindestens ein Patient mit der Diagnose eines Kolon- oder Rektumkarzinoms vor dem 50. Lebensjahr 4. Ausschluss einer familiären Adenomatosis polyposis coli (FAP) Da jedoch nicht alle Patienten bzw. Familien mit nachgewiesener Keimbahnmutation die sehr strengen Amsterdam-Kriterien erfüllen, alle extrakolorektalen Karzinome unbeachtet bleiben und insbesondere kleinere Familien möglicherweise dieser Klassifikation entgehen, wurde 1997 ein erweiterter Kriterienkatalog definiert („Bethesda-Kriterien“ Von diesen muss nur ein Kriterium erfüllt sein: 12 66 ). 1. positive Familienanamnese entsprechend den Amsterdam-Kriterien 2. synchrone/metachrone Kolon- oder Rektumkarzinome oder andere, HNPCCassoziierte Karzinome (s.o.) 3. zwei erstgradig verwandte betroffene Familienmitglieder mit Kolon- oder Rektumkarzinom und/oder HNPCC-assoziierter Tumorerkrankung (davon einer vor dem 45. Lebensjahr) und/oder Adenom des Kolons oder Rektums vor dem 40. Lebensjahr 4. Kolon- oder Endometriumkarzinom vor dem 45. Lebensjahr 5. Adenom des Kolons oder Rektums vor dem 40. Lebensjahr 6. undifferenziertes rechtsseitiges Kolonkarzinom vor dem 45. Lebensjahr 7. muzinöses/siegelringzelliges Kolonkarzinom vor dem 45. Lebensjahr Bei Festlegung dieser Kriterien ging es im Übrigen nicht primär darum, ausnahmslos jeden einzelnen HNPCC-Patienten zu erfassen, sondern vor allem einen internationalen „gemeinsamen Nenner“ zu schaffen. Neue Modelle und Algorithmen werden immer wieder diskutiert, aktuell z. B. das Amsterdam-plus-Modell, das zusätzlich zu den Amsterdam-Kriterien noch fünf weitere Variablen einbezieht (Gesamtzahl der kolorektalen und endometrialen Karzinome in der Familie, Zahl der Patienten mit fünf oder mehr Adenomen, Zahl der Patienten mit mehr als einem Primärkarzinom Krankheitsbeginn). in Kolorektum oder Endometrium, mittleres Alter bei 39 1.2.3 Weitere Merkmale des HNPCC Zusätzlich zu den bereits genannten klinischen Merkmalen (frühes Erkrankungsalter, synchrone und metachrone Tumoren, Tendenz zu rechtskolonischer Tumorlokalisation) weisen die HNPCC-assoziierten Tumoren zum Teil auch bestimmte (histo-)pathologische Charakteristika auf. Zusammenfassend gesagt sind kolorektale Karzinome des LynchSyndroms häufig gering differenziert, zeigen öfter muzinöse, siegelringzellige und villöse Elemente, wachsen eher expansiv als infiltrativ, sind häufiger diploid als aneuploid, und weisen öfter Kryptenatrophie sowie peritumorale Entzündungsreaktionen lymphfollikel-ähnliche Reaktionen („Crohn’s-like lymphoid reaction“) auf. und 9,45, 51,78 Beim erfahrenen Pathologen kann also schon die genaue Untersuchung des Tumorgewebes den Verdacht auf ein HNPCC hervorrufen. 13 Die deutlich stärkere Immunabwehr, die sich in der o.g. Entzündungsreaktion zeigt, ist ein besonderes Merkmal der HNPCC-assoziierten Tumoren. Es ist inzwischen als gesichert anzusehen, dass das Immunsystem bei diesen erblich belasteten Patienten besser arbeitet als bei anderen Karzinompatienten: Im Gegensatz zum sporadischen Karzinom können die Tumorzellen beim hereditären Karzinom vom Immunsystem als „fremd“ erkannt und somit bekämpft werden. Aus diesem Grund findet man auch weniger Tumoren im fortgeschrittenen Stadium und weniger Metastasen. Zusätzlich gewähren das weniger aggressive Tumorwachstum und die Euploidie (s.o.) einen gewissen Vorteil, und auch die hier häufige rechtsseitige Lokalisation wird an sich als prognostisch günstiger angesehen80 - wenngleich solche Tumoren eher der Gefahr unterliegen, bei Vorsorgeuntersuchungen dem Untersucher zu entgehen. Demzufolge ist die 5-Jahres-Überlebensrate von Patienten mit hereditärem CRC verschiedenen Studien zufolge höher als die von Patienten mit sporadischem CRC (52 vs. 35,3 %, nach Smyrk sogar 83 %).2,78 Zu dieser guten Prognose trägt aber sicherlich auch die Tatsache bei, dass HNPCC-Patienten im Durchschnitt erstens jünger sind und wegen fehlender Begleiterkrankungen ein niedrigeres postoperatives Risiko haben, sowie zweitens verstärkt Vorsorge- und Früherkennungsuntersuchungen in Anspruch nehmen, wenn das familiäre Risiko bekannt ist.2,17 1.2.4 Genetische Aspekte Das Lynch-Syndrom folgt einem autosomal-dominanten Erbgang mit etwa 80%iger Penetranz bis zum 80. Lebensjahr. Seit Beginn der 90er Jahre wurden Keimbahnmutationen von Genen, die für sogenannte DNA-Reparatur-Enzyme codieren (Mismatch-Reparatur-Gene, MMR), identifiziert, darunter der Gene hMLH1, hMSH2, hMSH6, hPMS1, hPMS2 und hMLH3. Die beiden erstgenannten Gene werden dabei schon für 90 % der Lynch-Karzinome verantwortlich gemacht.41,87 Zudem werden stetig neue Mutationen und Polymorphismen gefunden, so dass im Jahr 2001 bereits über 300 Mutationen in einer internationalen Datenbank der ICG-HNPCC in Leiden (Niederlande) dokumentiert waren.60,62 Dies ist einer der Gründe dafür, dass eine exakte Zahl für den Prozentsatz hereditärer Tumoren innerhalb der kolorektalen Karzinome (noch) nicht angegeben werden kann. Durch Mutation eines der Mismatch-Reparatur-Gene und den konsekutiven Ausfall des DNA-Reparatursystems, das im Normalfall für die genomische Stabilität sorgt (also eine „antionkogene“ Funktion erfüllt), kommt 14 es zur Anhäufung von genetischen Veränderungen und somit unter Umständen zur malignen Entartung der Zelle.17 Diese „Instabilität“ der DNA spiegelt sich im Tumorgewebe unter anderem in sog. „Mikrosatellitenmarkern“ wider. Mikrosatelliten sind repetitive Mono-, Di-, Tri- oder Tetranukleotidsequenzen, die über das gesamte Genom verteilt vorkommen und in jedem Individuum ein bestimmtes Muster zeigen. Bei HNPCC-Patienten lässt sich durch die PCR eine Sequenzlängendifferenz zwischen Tumor- und gesundem Gewebe nachweisen, die durch den Verlust oder die Addition von Nukleotiden zustande kommt und jeweils im gesamten Genom des Tumors gefunden wird. Dieses Phänomen wird als „Mikrosatelliteninstabilität“ bezeichnet und nicht nur häufig bei hereditären nichtpolypösen Kolonkarzinomen gefunden, sondern geradezu als Marker für das LynchSyndrom angesehen. In 90 % aller Amsterdam-positiven Fälle ist eine Mikrosatelliteninstabilität zu finden.1,11,61 Letztendlich führt dieser Mechanismus zu einer akzelerierten Adenom-Karzinom-Sequenz: Die Entstehung von malignen Tumoren aus benignen Adenomen (Adenom-KarzinomSequenz) ist bei Anlageträgern beschleunigt; d.h. nicht primär die Tumorinitiation, sondern die Progression ist durch den Reparaturgendefekt bedingt.31,43 Die endgültige Diagnose einer Keimbahnmutation erfolgt molekulargenetisch durch eine Mutationsanalyse aus der DNA von peripheren Blutlymphozyten. Auch wenn bisher nur bei etwa der Hälfte der klinisch als HNPCC diagnostizierten Familien Keimbahnmutationen identifiziert werden können, ist beim diagnostischen Vorgehen eine Kombination aus Mutationsscreening, Testung Immunhistochemie derzeit die beste Methode.39,41 15 auf Mikrosatelliteninstabilität und 2. Zielsetzung Das Lynch-Syndrom als hereditäre Form des kolorektalen Karzinoms weist unter klinischen, pathologischen und natürlich molekulargenetischen Gesichtspunkten einige deutliche Unterschiede zur normalen, sporadisch auftretenden Form auf. Bezüglich der Labordiagnostik werden die beiden Typen jedoch meist „in einen Topf geworfen“. Genauere Aussagen über das Verhalten des carcinoembryonalen Antigens beim Lynch-Syndrom sind bisher weder in Lehrbüchern der Labormedizin, noch in der Literatur zum kolorektalen Karzinom zu finden. Somit ist nicht gesichert, ob z. B. die Erkenntnisse über Tumormarker einfach so von der sporadischen auf die hereditäre Form übertragen, oder die Referenzwerte analog übernommen werden können. Wie Ergebnisse der CEAMessung beim hereditären Kolonkarzinom, auch im Vergleich zum sporadischen CRC, zu werten sind, und ob eine standardmäßige CEA-Bestimmung bei HNPCC-Patienten überhaupt sinnvoll ist, ist also noch unklar. Ziel der vorliegenden Arbeit war daher, in einer retrospektiv angelegten Studie die CEAWerte von Patienten mit gesichertem HNPCC zu untersuchen und mit Vorergebnissen von sporadischen kolorektalen Karzinomen zu vergleichen. Dabei sollten nicht nur qualitative Unterschiede (in der Inzidenz von erhöhten CEA-Werten) ausgemacht werden, sondern die absoluten präoperativen Werte auch quantitativ analysiert werden. Ferner sollten die hereditären nicht-polypösen kolorektalen Karzinome bezüglich verschiedener genetischer und histologischer Merkmale in Subgruppen eingeteilt und somit auch untereinander verglichen werden. Ziel war die Suche nach möglichen Faktoren, die bei erblich belasteten Patienten auf die Höhe des Tumormarkers Einfluss nehmen könnten. 16 3. Patienten und Methoden 3.1 Patientenkollektiv Im Rahmen des Verbundprojektes „Familiärer Darmkrebs“ der Deutschen Krebshilfe werden seit 1999 an sechs Universitätskliniken (Bochum, Bonn, Dresden, Düsseldorf, Heidelberg und München/Regensburg) die Daten von Patienten mit gesicherter HNPCCDiagnose systematisch dokumentiert. Eingeschlossen in diese Studie werden ausschließlich Personen, die entweder die Amsterdam- oder die Bethesda-Kriterien (s.1.2.2) erfüllen. Die Daten der Patienten des Zentrums München/Regensburg bis zum Stand Ende November 2003 dienten als Basis für die vorliegende Arbeit. Es wurden diejenigen Patienten ausgewählt, von denen die relevanten Tumormarkerwerte (präoperativ, bei Ersttumor) zu ermitteln waren (insgesamt 105 Fälle). Angaben zu Alter, Tumorbefund, Laborwerten etc. konnten teils den bereits vorhandenen Patientenakten entnommen werden, teils bei den jeweiligen Kliniken (Archiv, Labor) erfragt werden. Die Personen, die für diese Studie herangezogen werden konnten, kamen aus Münchener Kliniken oder aus kooperierenden Krankenhäusern des Münchener Umlandes (Augsburg, Deggendorf, Ebersberg, Landshut, Passau, Traunstein). Zum Vergleich wurden präoperative CEA-Werte von 107 Patienten mit sporadischem CRC aus der Tumornachsorgekartei des Klinikums Innenstadt der LMU München (Chirurgische Klinik und Chirurgische Poliklinik) herangezogen, die zwischen Juni 1991 und Mai 2003 operiert worden waren und die keinerlei Kriterien für eine Klassifikation als „HNPCC“ erfüllten. Ausgewählt werden konnten auch hier nur diejenigen Patienten, bei denen präoperativ der CEA-Wert bestimmt und dokumentiert worden war. Das Geschlechterverhältnis der Vergleichsgruppe wurde soweit wie möglich dem der HNPCC-Gruppe angepasst. Ein Matching der beiden Kollektive nach dem Alter der Patienten war dagegen per definitionem nicht möglich: Eines der Kriterien für die Klassifikation „HNPCC“ ist gerade das frühe Erkrankungsalter. Dagegen betrifft das sporadische CRC - auch „Alterskarzinom“ genannt - vorrangig ältere Personen, und Patienten < 45 J. durften gar 17 nicht in die Vergleichsgruppe eingeschlossen werden, da sie damit ein Bethesda-Kriterium für HNPCC erfüllt hätten. 3.2 Tumoren Alle Tumoren wurden postoperativ durch einen Pathologen der jeweiligen Klinik makroskopisch sowie mikroskopisch (Hämatoxylin-Eosin-Färbung) untersucht. Der pathologische Befund beinhaltete eine Tumorklassifikation, basierend auf dem TNMSystem (UICC). Nachträglich wurden alle Tumoren in ein vereinfachtes Schema mit den vier Gruppen A-D (angelehnt an die gebräuchliche, von Turnbull modifizierte DukesKlassifikation, nachfolgend „Dukes-Stadien“ genannt) eingeteilt: 16,46 T N M T= Ausdehnung des Primärtumors A T1-2 N0 M0 N= Befall der regionären Lymphknoten B T3-4 N0 M0 M= Fernmetastasen C T1-4 N1-3 M0 D T1-4 N0-3 M1 Ferner wurde von allen Tumoren der Differenzierungsgrad (G1-4 nach WHO-Einteilung) sowie der histologische Tumortyp, insbesondere das Vorhandensein von muzinösen (= schleimbildenden) Elementen, dokumentiert. Bei Mehrfachtumoren wurde jeweils das Stadium und der Differenzierungsgrad des höchstmalignen Tumors gewertet. Bei vier HNPCC-Patienten war vor der operativen Resektion eine neoadjuvante Radio-/ Chemotherapie (RCT) durchgeführt worden. In diesen Fällen war nur die posttherapeutische Tumorklassifikation „yTNM“ verfügbar; dementsprechend ging der zugehörige CEA-Wert nach RCT, aber vor OP in die Rechnung ein. 18 3.3 Bestimmung des CEA Die Messung des Tumormarkers erfolgte stets 1-8 Tage präoperativ (meist am Vortag der Operation) in der jeweiligen Klinik. Die diversen Laboratorien verwendeten hierbei Analysegeräte von unterschiedlichen Herstellern (Bayer, Roche, Abbott), bei denen auch verschiedene Messmethoden zum Einsatz kommen. (Die Methode wurde auf den meisten Laborbefunden mit angegeben. Für die Longitudinalbeurteilung des einzelnen Patienten muss auf einen einheitlichen Test geachtet werden, interindividuell sind die verschiedenen Messungen aber im Allgemeinen „gut vergleichbar“).82 Sie alle basieren auf dem Prinzip der Antikörperbindung („Immunoassays“), wobei der zu messende Analyt das Antigen darstellt. Werden zwei Antikörper verwendet, spricht man vom „Sandwich-Assay“. Drei gebräuchliche Methoden sollen kurz erläutert werden: 13-14 • Die älteste und lange Zeit bedeutendste Methode ist der Radio-Immuno-Assay (RIA). Bei diesem werden die in der Probe enthaltenen Antigenmoleküle zunächst an einen im Überschuss vorliegenden Antikörper gebunden, dann wird ein zweiter, radioaktiv markierter Antikörper zu diesen Ag-Ak-Komplexen zugegeben und der ungebundene zweite Antikörper weggespült. Dadurch entspricht das Maß an Radioaktivität im Probenröhrchen der Antigenmenge (also der Menge des Analyts). • Inzwischen haben Enzym-Immuno-Assay (EIA) bzw. Mikropartikel-Enzym- Immuno-Assay (MEIA) den Vorgänger weitgehend abgelöst. Bei diesen Methoden wird statt des radioaktiv markierten ein enzymmarkierter Antikörper gebraucht. Dieser löst mit dem zu messenden Antigen zusammen eine Indikatorreaktion aus, die durch ein Chromogen sichtbar gemacht und quantifiziert wird. • In letzter Zeit hat sich neben diesen beiden noch eine weitere Technik, die Chemilumineszenz, etabliert, die schneller als RIA und EIA funktioniert. Sie macht sich das Prinzip der elektromagnetischen Trennung zunutze: An Eisenoxidkristalle mit magnetischen Eigenschaften wird ein mit Acridiniumester markierter Antikörper gekoppelt, der wiederum das zu messende Antigen bindet. Durch Anlegen eines Magnetfeldes werden die Eisenoxidkristalle mit Antigen und Antikörper an der Küvettenwand fixiert. Zuletzt wird durch Zugabe von Säure und Base die 19 Chemilumineszenz-Reaktion ausgelöst: Durch Oxidation des Acridiniumesters wird eine bestimmte Lichtmenge produziert, dessen Größe der Antigenmenge entspricht. Unabhängig von der verwendeten Methode erfolgen CEA-Messungen heutzutage vollautomatisiert. Bestimmt wird üblicherweise der Gehalt im Serum (seltener Plasma); die Angabe erfolgt in ng/ml. 3.4 Molekulargenetische Untersuchungen 3.4.1 Mikrosatellitenanalyse Wie bereits erwähnt, ist bei HNPCC-assoziierten Tumoren gehäuft eine fehlerhafte DNAReparatur zu finden, die durch eine Instabilität der DNA bzw. der Mikrosatelliten im Tumorgewebe nachgewiesen werden kann. Die Analyse des Mikrosatellitenstatus erfolgte im Medizinisch-Genetischen Zentrum in München (Leiterin: Fr. PD Dr. med. Dipl. chem. E. Holinski-Feder). Hierfür werden formalinfixierte und in Paraffin eingebettete Tumorblöcke zunächst mikrodisseziiert (10µm dick); anschließend wird aus diesem Tumorgewebe durch Proteinase K-Verdauung und mehrfache Ethanolausfällung (QIAmp Tissue Kit von QIAGEN, Hilden) die DNA extrahiert. Neben Tumor-DNA wird vom selben Patienten Kontroll-DNA aus gesundem Gewebe (peripheren Blutlymphozyten oder Normalschleimhaut) nach üblicher Vorgehensweise isoliert und parallel analysiert. Die gereinigte DNA wird spektrophotometrisch quantifiziert, bevor sie mittels PolymeraseKettenreaktion (PCR) im Thermocycler (Biometra, Göttingen) vervielfältigt wird. Hierfür wird der Master Mix von QIAGEN, Hilden, verwendet. Das PCR-Produkt kann dann durch Ethidiumbromidfärbung in einer Agarosegel-Elektrophorese sichtbar gemacht werden. Anschließend wird die amplifizierte DNA auf dem Sequenziergerät („Genetic Analyzer ABI 310“, Applied Biosystems) analysiert. Dabei werden fluoreszenzmarkierte DNAFragmente mittels Gelelektrophorese auf einer Polymermatrix der Größe nach aufgetrennt und durch Anregung mit Laserlicht detektiert. Länge der PCR-Produkte und Höhe der 20 Peaks werden bestimmt. Das Erscheinen neuer Banden, das Fehlen von Banden oder ein Bandenshift in der Tumor-DNA kennzeichnet eine genetische Instabilität. Entsprechend dem international empfohlenen Markerpanel werden fünf verschiedene Mikrosatellitenmarker untersucht: BAT 25, BAT 26, D2S123, D5S346, und D17S250. 62 Findet sich bei zwei oder mehr Markern (40%) eine Differenz zwischen gesundem und Tumorgewebe, spricht man von Mikrosatelliteninstabilität (MSI); Tumoren mit nur einem oder keinem instabilen Marker werden als mikrosatellitenstabil (MSS) bezeichnet. Auf die Unterscheidung zwischen „low instability“ (MSI-L, bei einem von fünf Markern) und „high instability“ (MSI-H, bei zwei oder mehr Markern) wird aus Gründen der besseren Übersichtlichkeit hier verzichtet. Eine MSI ist weder notwendig noch hinreichend für die Diagnose HNPCC; i.e. eine genetische Instabilität ist kein Beweis für eine HNPCC-assoziierte Erkrankung, macht diese aber sehr wahrscheinlich. Der endgültige Nachweis eines Reparaturgendefekts bzw. einer Keimbahnmutation erfolgt molekulargenetisch durch Mutationsanalyse. 3.4.2 Mutationsanalyse Die Untersuchung der DNA-Reparaturgene hinsichtlich einer krankheitsverursachenden Mutation wurde in einem eigens hierfür entwickelten Verfahren an DNA aus peripheren Blutlymphozyten durchgeführt (Institut für Medizinische Genetik der LMU München).29,54 Zuerst ist auch hier eine PCR nötig, um die relevanten Exons der beiden Reparaturgene hMLH1 und hMSH2 zu amplifizieren. Anschließend wird als „Mutationsscreening“ eine automatische Flüssigkeitschromatographie (DHPLC = denaturing high performance liquid chromatography) (WAVE: Transgenomic, San Jose, Kalifornien) durchgeführt. Dabei werden die DNA-Stränge getrennt und durch einen linearen Acetonitril-Gradienten separiert. Mithilfe fragmentspezifischer Schmelzkurven und eines vorgegebenen Algorithmus (WAVE-MAKER) wird die optimale Temperatur für den Schmelzvorgang ermittelt. Finden sich in der Probe außer der Wildtyp-DNA auch Mutanten, so entstehen beim Schmelzen zusätzlich zu den Homoduplices auch Heteroduplices, die bei weiterer Temperaturerhöhung früher (schon bei niedrigerer Temperatur) von der Polymermatrix eluieren als die Homoduplices. Auf dem Chromatogramm erscheint dann ein zweiter Peak vor dem Wildtyp-Peak, wodurch die genetische Veränderung (Mutation oder Polymorphismus) deutlich angezeigt wird.72 In solch einem Fall wird das entsprechende Exon sequenziert (Medigenomix, Martinsried). 21 Wird eine Mutation dieser Reparaturgene gefunden, wird der Tumor als RER+ („replication error positive“) bezeichnet. Grundsätzlich werden alle Mutationen vor Diagnosestellung in einer zweiten unabhängigen PCR bestätigt und bei pathologischem Befund durch eine zweite Blutentnahme kontrolliert. 3.4.3 Immunhistochemie Im Pathologischen Institut der LMU wurde die immunhistochemische Untersuchung des Tumorgewebes, jeweils vom Ersttumor, durchgeführt. Dabei wurde die tatsächliche Proteinexpression der Gene hMLH1 und hMSH2 mithilfe markierter Antikörper untersucht. Verwendet wurde das Vectastain Elite ABC-Kit von Vector Laboratories, das auf der Avidin-Biotin-Technik basiert: Gewebeschnitte von Tumor und gesundem Gewebe, mit Xylol entparaffiniert, werden nach entsprechenden Vorbereitungsschritten zunächst für 20 h in der feuchten Kammer mit dem jeweiligen Primärantikörper (anti-MLH1, anti-MSH2) inkubiert, dann 30 min. mit einem biotinylierten Sekundärantikörper und schließlich 30 min. mit dem ABC-Reagenz, dessen Avidin-Teil - so gut wie irreversibel - an das Biotin am Sekundärantikörper bindet. Dieser Avidin-Biotin-Komplex wird mit einem Chromogen (3-Amino-9-Ethyl-Carbazol, AEC) sichtbar gemacht, wodurch sich der Sekundär- und der Primärantikörper und somit im Endeffekt auch das gesuchte Antigen (hMLH1, hMSH2) darstellt. Nach Gegenfärbung mit Hämalaun werden die angefärbten (also exprimierenden) Zellen unter dem Mikroskop ausgezählt, sodass eine quantitative Aussage über Expression oder Expressionsausfall gemacht werden kann. 3.5 Statistische Auswertung Die statistische Auswertung der Einzelwerte erfolgte mit dem Programmpaket BMDP, Version 7.0, des Department of Biomathematics, School of Medicine, University of California, Los Angeles. 22 Die Annahme einer Normalverteilung der Einzelwerte musste nach Anwendung des Kolmogorov-Smirnov-Tests verworfen werden. Es wurden daher für alle Berechnungen entweder der Mann-Whitney-U-Test Rangvarianzanalyse) verwendet. oder der Kruskal-Wallis-Test Außerdem kamen Pearson’s Chi2-Test (Ein-Weg(für die Untersuchung des Einflussfaktors „Geschlecht“) sowie ein lineares Regressionsmodell (für die Bestimmung der Beeinflussung durch den Faktor „Alter“) zum Einsatz. Für jede Untersuchungsgruppe wurden jeweils Rangsumme und Signifikanzniveau bestimmt. Eine Unterscheidungswahrscheinlichkeit von p < 0,05 wurde als signifikant bezeichnet. Die Basisstatistik, wie Sensitivität und Spezifität, Mediane, Perzentilen etc., wurde anhand von Vierfelder-Tafeln bzw. mit gängiger Computersoftware berechnet.18,74 23 4. Ergebnisse 4.1 Vergleich der Kollektive Das zu untersuchende Kollektiv der HNPCC-Patienten setzte sich aus 59 Männern und 46 Frauen zusammen, die Vergleichsgruppe bestand aus 61 Männern und 46 Frauen mit sporadischem Karzinom. Das mittlere Alter zum Zeitpunkt der Erstmanifestation (OP-Termin), in Jahren + Standardabweichung, betrug 45,3 +11,5 Jahre bei den HNPCC-Patienten und 65,9 + 10,3 Jahre bei den Vergleichspersonen. In Tab. 1 sind die genannten Werte zusammengefasst. Tab. 1: Vergleich der Kollektive HNPCC 105 n 59 : 46 männlich : weiblich Mittelwert + Standardabw. 45,3 + 11,5 Alter bei OP (in Jahren) Median 44 25/75 %-Perzentilen 37 / 52 Bereich 20-82 Sporadisches CRC 107 61 : 46 65,9 + 10,3 66 58 / 73 46-86 Die Häufigkeitsverteilung der verschiedenen Tumorlokalisationen ist für beide Gruppen in Abb. 1a und 1b dargestellt. Tumoren, die proximal der linken Kolonflexur gelegen waren (Caecum, Colon ascendens, Colon transversum), traten etwas häufiger bei HNPCC-Patienten als bei der Vergleichsgruppe auf; ebenso die Mehrfachtumoren. Etwa zwei Drittel der sporadischen Karzinome waren distal der Flexur lokalisiert (Colon descendens, Colon sigmoideum, Rectum). Bei je einem einzelnen Fall eines hereditären und sporadischen Karzinoms war keine Angabe zur genauen Lokalisation im Dickdarm zu ermitteln. Alle Tumoren beider Kollektive wurden entsprechend der in 3.2 beschriebenen modifizierten Dukes-Klassifikation in die Stadien A-D eingeteilt. Die prozentuale Häufigkeitsverteilung (A-B-C-D) war jeweils sehr ähnlich mit 20-38-30-12 % bei den HNPCC-Tumoren und 21-34-27-18 % bei den sporadischen CRC. (Abb. 2a und 2b) 24 Abb. 1a: Tumorlokalisation bei HNPCC Abb. 1b: Tumorlokalisation bei sporadischem Karzinom HNPCC Sporadisches Karzinom 1% 8% 1% 1% 37% 43% 61% 48% proximal distal Mehrfachtumor proximal keine Angabe Abb. 2a: Verteilung der Dukes-Stadien bei HNPCC distal Mehrfachtumor keine Angabe Abb. 2b: Verteilung der Dukes-Stadien bei sporadischem Karzinom HNPCC Sporadisches Karzinom 12% 18% 20% 21% 30% 27% 34% 38% Dukes A Dukes B Dukes C Dukes D Dukes A Dukes B Dukes C Dukes D Vor weiteren Analysen zunächst die Ergebnisse ergänzender Berechnungen: 1.) Anhand von Tab. 1 wird deutlich, dass das mittlere Alter der Patienten sich in den beiden Gruppen deutlich unterscheidet. Gerade das Alter eines Patienten hat jedoch für die CEA-Messung eine nicht zu vernachlässigende Bedeutung, da die Basiswerte bei Älteren im Allgemeinen höher sind als bei Jüngeren (s. 1.1.3.). Um sicherzugehen, dass der Unterschied der CEA-Werte nicht einfach durch das unterschiedliche mittlere Alter in den 25 beiden Gruppen verursacht ist, wurde mit Hilfe eines Regressionsmodells die Assoziation zwischen Alter und präoperativem Serumwert (log CEA) berechnet. Es ergab sich für beide Gruppen einen nicht signifikanten Wert (s. Tab. 2). Somit kann ausgeschlossen werden, dass die nachfolgend dargestellten Ergebnisse durch den Störfaktor „Alter“ verfälscht wurden. Tab. 2: Regressionsmodell Alter / log CEA HNPCC Signifikanzniveau p = 0,1320 Sporadisches CRC p = 0,1591 2.) Ebenso wie das Alter eines Patienten spielt, wie bereits erwähnt, auch das Geschlecht eine Rolle bei der Bestimmung der CEA-Werte. Obwohl das Geschlechterverhältnis der Vergleichsgruppe an das der HNPCC-Gruppe bewusst angeglichen wurde, sollte zusätzlich auch auf statistischer Ebene eine Verfälschung der Werte durch das Geschlecht ausgeschlossen werden. Pearson’s Chi2-Test ergab für den Unterschied des Geschlechterverhältnisses in den beiden Gruppen erwartungsgemäß den nicht signifikanten Wert p = 0,9843. 3.) Ein weitere, sehr bedeutende Frage betrifft die Methodik der CEA-Messung. Aufgrund der geringen Zahl von sicher als „erblich bedingt“ klassifizierten kolorektalen Karzinomen wurden bei der vorliegenden Studie die Patienten des HNPCC-Kollektivs aus diversen Kliniken Deutschlands rekrutiert (s. 3.1), damit eine Gruppe von statistisch verwertbarer Größe untersucht werden konnte. Dadurch bedingt wurden jedoch für die Bestimmung der CEA-Serumspiegel in den verschiedenen Laboratorien mehrere Methoden angewandt (s. 3.3). Die Meinung über die Vergleichbarkeit von Werten aus verschiedenen Laboratorien geht auseinander. Im allgemeinen gelten zwar die Differenzen zwischen den gebräuchlichen Messmethoden im interindividuellen Vergleich als nicht relevant, zumal die Referenzbereiche übereinstimmen; dennoch sollte gewisse Vorsicht bei der Bewertung geübt werden. Aus diesem Grund wurde folgender Test durchgeführt : Von den 105 HNPCC-Patienten waren 41 im Klinikum Großhadern der LMU operiert worden, die restlichen 64 in verschiedenen anderen Kliniken. 41mal war also eine einheitliche Methode der CEA-Messung (MEIA) verwendet worden. 26 Nun waren die CEA-Werte dieser Subgruppe (41 von 105) nahezu identisch mit denen des Gesamtkollektivs, wie Abb. 3 anhand der Medianwerte zeigt. Das Subkollektiv der 41 HNPCC-Patienten aus Großhadern zeigte einen annähernd gleich großen Unterschied zur Gruppe der sporadischen Karzinome wie das Gesamtkollektiv. Dieses Ergebnis erlaubte also, nachfolgend durchaus die CEA-Werte aller 105 HNPCCPatienten in die verschiedenen Rechnungen eingehen zu lassen. Die Vergleichsgruppe bestand einheitlich aus Patienten des Klinikums Innenstadt der LMU München, sodass hier dieses Problem nicht aufkam. Abb. 3: Mediane des CEA bei Gesamt- bzw. Subkollektiv der HNPCC-Patienten und bei der Vergleichsgruppe 3 Median CEA (ng/ml) 2,6 2,5 2,1 2,0 2 1,5 1 0,5 0 Gesamtkollektiv HNPCC (n=105) 4.2 Subkollektiv HNPCC (n=41) Sporadisches Karzinom (n=107) CEA bei HNPCC und sporadischem Karzinom Abb. 4a und 4b zeigen zunächst die präoperativen Einzelwerte des carcinoembryonalen Antigens bei erblichem und sporadischem Karzinom. Auf den ersten Blick sind sich die beiden Diagramme recht ähnlich; in beiden Gruppen waren viele CEA-Werte nicht pathologisch erhöht. Genauer betrachtet fanden sich aber beim hereditären CRC deutlich mehr Niedrigstwerte (< 1 ng/ml) als beim sporadischen Karzinom. Die „Ausreißer“ waren bei der sporadischen Form von größerer Zahl und noch höherem Wert. 27 Abb. 4a: Einzelwerte der CEA-Messung bei den 105 HNPCC-Patienten HNPCC CEA (ng/ml) 10000 1000 100 10 1 0,1 0 20 40 60 80 100 120 100 120 n Abb. 4b: Einzelwerte der CEA-Messung bei den 107 Vergleichspatienten Sporadisches Karzinom 10000 CEA (ng/ml) 1000 100 10 1 0 0 20 40 60 80 n Ein deutlicher Unterschied ist im Vergleich des präoperativen CEA-Mittelwertes (+ Standardabweichung) bei HNPCC und sporadischem Karzinom zu erkennen. Dieser lag in der ersten Gruppe bei 31,7 + 180,5 ng/ml, bei der Vergleichsgruppe betrug er etwa das Doppelte mit 68,3 + 424,5 ng/ml. (Abb. 5) Als „robuster“ als der arithmetische Mittelwert, d.h. weniger anfällig für Schwankungen der Einzelwerte (sogenannte „Ausreißer“), gilt in der Statistik der Median, der den mittleren Wert der nach Größe sortierten Einzelwerte darstellt. Hierbei sind die Differenzen zwischen den Kollektiven sehr viel geringer, aber dafür aussagekräftiger. Die 28 für die Labormedizin relevanten statistischen Werte - Median, Bereich, Perzentilen - sind daher nachfolgend jeweils als Tabelle, zur Vervollständigung der Abbildungen, beigefügt. Im Gesamtvergleich der CEA-Werte war auch der Median bei HNPCC niedriger als bei sporadischem Karzinom (Tab. 3). Dennoch konnte insgesamt kein signifikanter Unterschied zwischen den beiden Kollektiven ermittelt werden (p = 0,72). Abb. 5: Mittelwerte der CEA-Messung bei HNPCC und sporadischem Karzinom Mittelwert CEA (ng/ml) 80 68,3 70 60 50 40 31,7 30 20 10 0 HNPCC Sporadisches Karzinom Tab. 3 n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich HNPCC 105 31,7 + 180,5 2,1 1,1 / 8,1 0,0 – 1819,0 Sporadisches CRC Signifikanzniveau 107 68,3 + 424,5 p = 0,72 2,6 1,1 / 7,5 0,0 – 4276,0 Im Folgenden sollen nun die präoperativen CEA-Werte genauer analysiert werden. Zunächst wurden sie getrennt nach den vier Dukes-Stadien betrachtet. Wie in Abb. 6 ersichtlich, steigt der CEA-Mittelwert in beiden Gruppen mit fortgeschrittenem Tumorstadium an. In allen vier Stadien ist dabei das mittlere CEA bei HNPCC-Patienten niedriger als bei den Patienten mit sporadischem Karzinom. Die Differenz der Mittelwerte ist besonders deutlich im Stadium D. Teilweise werden diese Ergebnisse jedoch durch die Medianwerte widerlegt, und auch eine statistische Signifikanz konnte in keinem der vier Stadien ermittelt werden. (Tab. 4) 29 Abb. 6: CEA-Mittelwerte in Abhängigkeit vom Tumorstadium HNPCC Sporadisches Karzinom 400,0 350,5 Mittelwert CEA (ng/ml) 350,0 300,0 250,0 220,2 200,0 150,0 100,0 50,0 2,5 2,2 12,7 7,3 6,2 4,8 0,0 A B C D Dukes-Stadium Tab. 4: CEA-Werte in Abhängigkeit vom Tumorstadium Dukes A Dukes B Dukes C Dukes D n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich HNPCC 21 2,2 + 2,5 1,2 0,8 / 2,5 0,0 - 8,6 39 4,8 + 8,2 2,0 1,1 / 5,0 0,6 - 50,0 32 7,3 + 13,4 2,7 1,1 / 5,0 0,5 - 60,0 13 220,2 + 487,7 49,3 16,6 / 194,0 7,4 – 1819,0 30 Sporadisches CRC 23 2,5 + 2,4 1,9 1,0 /2,6 0,5 – 9,9 36 6,2 + 12,4 2,7 1,0 / 5,3 0,5 - 70,3 29 12,7 + 42,2 2,4 1,0 / 6,5 0,2 – 229,3 19 350,5 + 977,6 18,1 4,3 / 143,0 0,5 – 4276,0 Signifikanzniveau p = 0,17 p = 0,89 p = 0,91 p = 0,24 Vergleicht man - statt der absoluten Werte - den Prozentsatz präoperativer CEAErhöhungen (i.e. die Sensitivität) bei hereditärem und sporadischem Karzinom, so ergibt sich insgesamt nur ein geringer Unterschied. 31,4 % der CEA-Werte bei HNPCC waren erhöht (bei Festlegung des Grenzwertes auf 5 ng/ml, wie allgemein üblich), dagegen 34,6 % bei den sporadischen Tumoren. Die Untersuchung der einzelnen Dukes-Stadien ergab jedoch ein überraschendes Ergebnis. Bei Tumoren der Stadien A-C war die Sensitivität des CEA bei HNPCC ähnlich niedrig wie bei sporadischen Karzinomen. Bei hereditären Tumoren im Stadium D dagegen erwies sich das erhöhte CEA mit 100 % als hoch sensitiv. (Abb. 7) Abb. 7 : Sensitivität des erhöhten CEA (> 5 ng/ml) bei HNPCC und sporadischem Karzinom HNPCC Sporadisches Karzinom Sensitivität in % 100 100 90 80 70 60 50 40 30 20 10 0 73,7 37,9 23,1 14,3 25,0 25,0 13,0 Dukes A Dukes B Dukes C Dukes D Aufgrund dieses Ergebnisses wurde die Aussagekraft des erhöhten CEA-Wertes speziell für die Erkennung der bereits metastasierten Dukes D-Tumoren ausführlicher untersucht. Hierfür wurden jeweils die nichtmetastasierten Tumorstadien Dukes A-C dem metastasierten Stadium D gegenübergestellt, sodass zusätzlich zur Sensitivität auch die Spezifität sowie der positiv und negativ prädiktive Wert des erhöhten CEA anhand von Vierfelder-Tafeln berechnet werden konnten. Analog zur guten Sensitivität waren dabei auch die übrigen Werte für die hereditären Tumoren höher als für die sporadischen. (Tab. 5) 31 Tab. 5: Statistische Werte zur Aussagekraft des CEA bei metastasiertem Karzinom (Dukes D) % Sensitivität Spezifität Pos.präd.Wert Neg.präd.Wert HNPCC 100 78,3 39,4 100 Sporadisches CRC 73,7 73,9 37,8 92,9 Das geschilderte Ergebnis lässt sich auch anhand einer ROC-Kurve (ROC = „ReceiverOperating-Characteristics“) darstellen. Bei dieser werden Sensitivität und inverse Spezifität des Parameters CEA gegeneinander aufgetragen, im vorliegenden Fall bezogen auf nicht-metastasierte (Dukes A-C) gegenüber metastasierten Tumoren (Dukes D). Gewünscht wird von der Messgröße (hier CEA) eine möglichst hohe Sensitivität bei ebenfalls möglichst hoher Spezifität. In solch einem Fall entfernt sich die Kurve möglichst weit von der Winkelhalbierenden (d.h. wird steiler). Abb. 8 zeigt deutlich das bessere Abschneiden des CEA bei den HNPCC-Tumoren gegenüber dem bei den sporadischen Karzinomen. Abb. 8: ROC-Kurven für CEA (metastasierte vs. nicht-metastasierte Tumoren ) bei HNPCC und sporadischem Karzinom 100 Sensitivität [%] 80 60 HNP CC S p ora dis c h es C R C 40 20 Spezifität [%] 0 100 80 60 40 20 0 Auch die Fläche unter der ROC-Kurve („AUC“ = area under the curve) hat eine Bedeutung. Sie ist umso größer, je besser das Sensitivitäts-Spezifitäts-Verhältnis des untersuchten Parameters ist (im Idealfall hat sie den Wert 1). 32 Im vorliegenden Vergleich zwischen hereditären und sporadischen Dukes D-Karzinomen war diese Flächenmaßzahl, wie es sich schon mit bloßem Auge erkennen lässt, bei HNPCC etwas größer als bei sporadischen Tumoren. (Tab. 6) Tab. 6: AUC des Markers CEA bei HNPCC und sporadischem Karzinom in Stadium D AUC + Standardabw. Konfidenzintervall HNPCC 0,962 + 0,019 0,926 – 0,999 Sporadisches CRC 0,821 + 0,059 0,705 – 0,937 In acht Fällen des HNPCC-Kollektivs lagen außer dem präoperativen CEA beim Ersttumor auch Werte bei späterer Metastasierung (im postoperativen Verlauf) vor. Von diesen acht Patienten mit späteren Metastasen hatten drei (= 37,5 %) bereits beim Ersttumor einen präoperativen CEA-Wert > 5 ng/ml. Der Mittelwert lag mit 21,6 + 32,6 ng/ml ähnlich niedrig wie im Gesamtkollektiv mit 31,7 + 180,5. Zum Zeitpunkt der Metastasierung war der CEA-Mittelwert dieser acht Patienten dann signifikant höher mit 170,3 + 343,0 ng/ml (p < 0,02). Fünf der acht Werte (= 62,5 %) lagen über 5 ng/ml. Die Medianwerte (s. Tab. 7) verhielten sich äquivalent zu den (in Abb. 9 dargestellten) Mittelwerten. Abb. 9: CEA bei Ersttumor und bei späterer Metastasierung 170,3 Mittelwert CEA (ng/ml) 180 160 140 120 100 80 60 40 21,6 20 0 Ersttumor Metastasen Tab. 7 n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich Ersttumor 8 21,6 + 32,6 3,6 1,8 / 49,0 1,1 – 85,3 33 Metastasen Signifikanzniveau 8 170,3 + 343,0 p < 0,02 33,6 2,6 / 179,5 1,8 – 1000,0 4.3 Weitere Ergebnisse im HNPCC-Kollektiv Innerhalb des HNPCC-Kollektivs wurde der mittlere CEA-Wert in Abhängigkeit von verschiedenen histologischen und molekulargenetischen Charakteristika analysiert. 4.3.1 Differenzierungsgrad Zunächst wurde die Höhe des mittleren CEA-Wertes bei Tumoren mit verschiedenen histologischen Differenzierungsgraden (G1-4) untersucht. Dieser war bei 103 der insgesamt 105 Patienten zu ermitteln. Je ein einziger Tumor wurde als hoch- (G1) und sehr gering differenziert (G4) diagnostiziert, 53 als mittelmäßig (G2) und 48 als gering differenziert (G3). Aufgrund der geringen Fallzahlen von G1 und G4 wurden die gutdifferenzierten Tumoren (G1/2) sowie die schlechtdifferenzierten (G3/4) zusammengefasst. Dabei ergab sich ein signifikant höherer Mittelwert (p = 0,02) für die stärker entdifferenzierten Tumoren gegenüber den differenzierteren (62,2 + 262,2 vs. 5,0 + 9,6 ng/ml). (Abb. 10, Tab. 8) Abb. 10: CEA in Abhängigkeit vom Differenzierungsgrad Mittelwert CEA (ng/ml) 70 62,2 60 50 40 30 20 10 5,0 0 G1+2 G3+4 Tab. 8 N CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich G1+2 54 5,0 + 9,6 1,7 1,0 / 4,5 0,0 – 49,3 34 G3+4 Signifikanzniveau 49 62,2 + 262,2 p = 0,02 3,3 1,1 / 14,7 0,5 – 1819,0 4.3.2 Tumorhistologie Bei den 105 Patienten wurde in 19 Fällen ein muzinöses und in 86 Fällen ein nichtmuzinöses Karzinom diagnostiziert. Der mittlere präoperative CEA-Wert war bei den nichtmuzinösen höher (37,1 + 199,2 ng/ml) als bei den muzinösen Tumoren (7,0 + 13,3 ng/ml). Allerdings verhielten sich die Medianwerte umgekehrt (2,1 vs. 3,3), und dementsprechend war auch keine statistische Signifikanz zu ermitteln (p = 0,62). (Abb. 11, Tab. 9) Abb. 11: CEA in Abhängigkeit von der Tumorhistologie Mittelwert CEA (ng/ml) 70 60 50 37,1 40 30 20 10 7,0 0 muzinös nichtmuzinös Tab. 9 n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich muzinös 19 7,0 + 13,3 3,3 1,7 / 8,6 0,0 – 60,0 nichtmuzinös 86 37,1 + 199,2 2,1 1,1 / 7,8 0,5 - 1819,0 Signifikanzniveau p = 0,62 4.3.3 Tumorlokalisation 45 Tumoren waren proximal der Flexura coli sinistra im Darm lokalisiert, 50 distal der Flexur (übrige Verteilung s. Abb. 1a). Der Mittelwert des CEA lag bei den proximal gelegenen Tumoren deutlich höher als bei den distalen (57,3 + 278,7 vs. 16,1 + 40,9 ng/ml), während sich die Medianwerte hier wieder umgekehrt verhielten (2,0 vs. 3,0). Somit war der Unterschied auch nicht signifikant (p = 0,64). (Abb. 12, Tab. 10) 35 Abb. 12: CEA in Abhängigkeit von der Tumorlokalisation Mittelwert CEA (ng/ml) 70 57,3 60 50 40 30 16,1 20 10 0 proximal distal Tab. 10 n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich proximal 45 57,3 + 278,7 2,0 1,0 / 8,6 0,0 – 1819,0 distal 50 16,1 + 40,9 3,0 1,1 / 8,8 0,5 – 208,0 Signifikanzniveau p = 0,64 4.3.4 Genetische Merkmale Das Patientengut, das unter HNPCC klassifiziert werden kann, stellt molekulargenetisch betrachtet keine homogene Gruppe dar: Nicht bei allen familiär belasteten Patienten lässt sich eine Mutation der Reparaturgene nachweisen. Aus diesem Grund wurden die HNPCCPatienten in Bezug auf drei „klassische“ Charakteristika des Lynch-Syndroms in Subgruppen eingeteilt: Nach ihrem Mikrosatellitenstatus (stabil/instabil), ihrem Genotyp bzgl. der Reparaturgene hMLH1 und hMSH2 (keine/eine/zwei Mutationen), sowie nach der entsprechenden immunhistochemischen Expression Untersuchung der Mismatch-Reparatur-Proteine (Expressionsausfall von in der keinem/einem/beiden Proteinen). In jeder Gruppe wurde dann die Verteilung der CEA-Werte analysiert. In die nachfolgend dargestellten Einzelanalysen wurden nur diejenigen 76 HNPCCPatienten einbezogen, von denen Ergebnisse aller drei Untersuchungen vorlagen. Bei der Untersuchung des Mikrosatellitenstatus zeigten 49 Tumoren eine Auffälligkeit in zwei oder mehr Markern des internationalen Referenzpanels, sodass sie als „instabil“ (MSI) klassifiziert werden konnten. Die restlichen Tumoren wiesen keinen oder nur einen abweichenden Marker auf und wurden als „mikrosatellitenstabil“ (MSS) gezählt. 36 Der mittlere CEA-Wert lag bei den mikrosatellitenstabilen Tumoren mit 52,8 + 263,5 ng/ml deutlich höher als bei den instabilen Tumoren (6,9 + 13,4 ng/ml). Dieser Unterschied konnte jedoch nicht durch die Medianwerte unterstützt werden, welche fast identisch waren. Daher war das Ergebnis auch nicht signifikant (p = 0,88). (Abb. 13, Tab.11) Abb. 13: CEA-Werte in Abhängigkeit vom Mikrosatellitenstatus Mittelwert CEA (ng/ml) 60 52,8 50 40 30 20 6,9 10 0 stabil instabil Tab. 11 n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich stabil 48 52,8 + 263,5 2,1 1,0 / 8,5 0,5 – 1819,0 instabil 28 6,9 + 13,4 2,2 1,0 / 6,4 0,0 – 60,0 Signifikanzniveau p = 0,88 Die Mutationsanalyse ergab in acht Fällen eine Mutation im hMLH1-Gen, in sechs Fällen eine im hMSH2-Gen, und in neun Fällen sogar in beiden Genen. Bei 53 Patienten konnte in keinem der beiden Gene eine Mutation nachgewiesen werden. Der höchste mittlere CEA-Wert sowie auch der höchste Medianwert fand sich in der Gruppe ohne nachweisbare hMLH1- oder hMSH2-Mutation, dennoch war das Ergebnis nicht statistisch signifikant (p = 0,63). (Abb. 14, Tab. 12) In der immunhistochemischen Untersuchung zeigten zehn Tumoren einen Expressionsverlust des hMLH1-Proteins, neun einen Verlust des hMSH2-Proteins und ein einziger wies einen Ausfall beider Proteine auf. In 56 Fällen war die Expression beider Proteine positiv. Diese Patienten mit normaler Proteinexpression boten auch hier den höchsten Mittelwert mit 46,2 + 244,2 ng/ml. Die Medianwerte zeigten jedoch ein weniger deutliches Bild, und auch eine statistische Signifikanz ließ sich nicht feststellen (p = 0,89). (Abb. 15, Tab. 13) 37 Abb. 14: CEA in Abhängigkeit vom Mutationsstatus Mittelwert CEA (ng/ml) 60 50 48,4 40 30 20 10,9 10 4,8 4,9 Mutation hMLH1 Mutation hMSH2 0 keine Mutation Mutation hMLH1 und hMSH2 Tab. 12 n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich keine Mutation 53 48,4 + 250,8 Mut. hMLH1 8 4,8 + 5,2 Mut. hMSH2 6 4,9 + 5,9 Mut. hMLH1 und hMSH2 9 10,9 + 27,9 3,0 1,0 / 8,0 0,5 – 1819,0 2,6 1,2 / 7,9 1,0 – 15,9 1,2 1,1 / 11,9 1,0 – 13,5 2,1 0,6 / 3,1 0,0 – 85,3 Sign.niveau p = 0,63 Abb. 15: CEA in Abhängigkeit von der Proteinexpression Mittelwert CEA (ng/ml) 50 46,2 40 30 20 10,3 10 5,0 4,0 0 normale Expression Ausfall hMLH1 Ausfall hMSH2 Ausfall hMLH1 und hMSH2 Tab. 13 n CEA (ng/ml) Mittelwert + Standardabw. Median 25/75 %-Perzentilen Bereich normale Expression 56 46,2 + 244,2 Ausfall hMLH1 10 4,0 + 4,1 Ausfall hMSH2 9 10,3 + 19,3 2,1 1,0 / 6,9 0,5 – 1819,0 2,2 1,0 / 7,2 0,7 – 13,0 1,2 1,0 / 12,4 0,0 – 60,0 38 Ausfall hMLH1 und hMSH2 Sign.niveau 1 5,0 p = 0,89 5. Diskussion Seit über 30 Jahren ist das carcinoembryonale Antigen (CEA) als meistverwendeter Tumormarker anerkannt. Besonders in der Diagnostik und Verlaufsbeobachtung des kolorektalen Karzinoms ist seine Bedeutung unumstritten.15 Entgegen früherer Behauptung wird das Antigen nicht nur im embryonalen und karzinomatösen Gewebe produziert, sondern in geringen Mengen auch in der normalen Kolonschleimhaut. Je nach verwendeter Messmethode werden Serumwerte unter 1,5 oder unter 5 ng/ml als normal angesehen.82 Leichte, meist transitorische Erhöhungen bis 10 ng/ml können bei Patienten mit benignen Erkrankungen von Darm, Leber, Pankreas und Lunge, sowie bei starken Rauchern auftreten. Werte über 15-20 ng/ml sind als stark malignitätsverdächtig zu betrachten. In den meisten Studien zum CEA wird der Cut-off-Punkt (Grenzwert) zwischen „normal“ und „pathologisch“ bei 5 ng/ml festgesetzt. So ergibt sich für das kolorektale Karzinom folgender Prozentsatz an CEA-Erhöhungen in Abhängigkeit vom Tumorstadium nach Dukes (in Klammern die Prozentwerte unserer Patienten mit sporadischem CRC, die den Daten der Literatur weitgehend entsprachen): A = 0-20 % (13,0), B = 20-40 % (25,0), C = 40-60 % (37,9), D = 60-95 % (73,7).34-35,86 Mit dieser geringen Sensitivität ist das CEA als reine Screeningmethode für die Erkennung kolorektaler Karzinome als ungeeignet anzusehen. Nichtsdestotrotz ist die Bestimmung des carcinoembryonalen Antigens durchaus von Bedeutung. Die Höhe des präoperativen CEA korreliert vielen Studien zufolge mit dem Tumorstadium, der Rezidivrate und der Überlebenszeit.4,25,27,52,75,80,90,92 Da sich das CEA insgesamt als unabhängiger prognostischer Faktor bewiesen hat, wurde im Jahr 2000 vom AJCC sogar vorgeschlagen, diesen Wert in das TNM-Staging-System zur präoperativen Klassifikation von Tumoren aufzunehmen.65,92,12 Klinische, biologische und histopathologische Unterschiede zwischen sporadischen und hereditären Kolonkarzinomen sind schon von vielen Arbeitsgruppen sehr ausführlich untersucht worden (s.o.). Die bisher durchgeführten Studien zum CEA basieren jedoch auf Patientengruppen ohne Differenzierung zwischen erblichen und nicht-erblichen Formen des Kolonkarzinoms. 39 Zum Serum-CEA speziell bei hereditärem Kolonkarzinom waren dagegen in der Literatur nur spärliche und z.T. veraltete Ergebnisse zu finden: Guirgis et al. sowie Lynch et al. erwähnten 1978 „elevated CEA values (...) in the cancer family syndrome“.24,40 Hierbei wurde allerdings nicht genauer zwischen der tatsächlichen Höhe der Werte bei sporadischen und der bei hereditären Tumoren unterschieden. Die gleichen Autoren werteten das erhöhte CEA als Marker für „erhöhtes genetisches Karzinomrisiko“ bei Patienten mit Cancer Family Syndrome.23-24 In diesen Studien wurde jedoch auch bei den jeweiligen nicht-verwandten Ehepartnern der CFSPatienten CEA-Erhöhungen gefunden, sodass andere, unbeachtete Faktoren als Grund für solch ein Ergebnis anzunehmen sind. Die Validität dieser Aussage muss daher wohl recht vorsichtig bewertet werden. In einer Studie von Lau-Werner und Stieber wurde erwähnt, CEA habe „keinerlei Stellenwert in der Screeningsituation, (...) auch für Risikogruppen mit genetischer Belastung für ein kolorektales Karzinom“.35 Es wird allerdings lediglich die Qualität des Tumormarkers im Screening bewertet, und auf die Risikogruppen wird in diesem Artikel auch nicht näher eingegangen. Eine aktuellere Publikation (2004) existiert zumindest zu einem verwandten Thema: Eine Arbeitsgruppe aus Korea untersuchte u.a. die CEA-Werte bei zwar sporadischen, aber mikrosatelliteninstabilen CRC. Sie ermittelten in dieser speziellen Gruppe nicht nur niedrigere präoperative Serumwerte des CEA, sondern auch eine Dominanz proximal gelegener Tumoren, Assoziation mit geringer Differenzierung, sowie selteneres Auftreten von systemischen Metastasen. Diese Merkmale erinnern sehr an die „richtigen“ HNPCC-Tumoren, die eine positive Familienanamnese aufweisen. Zu jenen wurde in der Studie jedoch keine Aussage gemacht.37 Die vorliegende Arbeit diente daher dem Ziel, die Höhe der präoperativen CEA-Werte bei Patienten mit hereditärem nicht-polypösen Kolonkarzinom genauer zu analysieren, sie qualitativ und quantitativ mit denen von Patienten mit sporadischem Kolonkarzinom zu vergleichen und die Bedeutung der CEA-Bestimmung für diese Patientenentität zu ermitteln. Hierfür wurden von 105 Patienten mit kolorektalem Karzinom, die entsprechend den Amsterdam- oder Bethesda-Kriterien in die anfangs beschriebene HNPCC-Studie 40 aufgenommen worden waren, Daten gesammelt. Tumorzahl und -lokalisation, pathologische Befunde und weitere Angaben zu Alter, Geschlecht etc. wurden dokumentiert. Des Weiteren wurde eine Mikrosatellitenanalyse nach den Empfehlungen der International Collaborative Group on HNPCC (ICG-HNPCC), eine Mutationsanalyse der beiden höchstrelevanten Gene hMLH1 und hMSH2, sowie eine immunhistochemische Untersuchung der Proteinexpression durchgeführt. Als Vergleichsgruppe dienten 107 Patienten des Klinikums Innenstadt der LMU München, die wegen eines sporadischen kolorektalen Karzinoms operiert worden waren. Wie unter 1.1.3 bereits beschrieben, gibt es Faktoren, die einen gesicherten Einfluss auf die Höhe des CEA-Wertes haben; hauptsächlich Alter, Geschlecht und Nikotinkonsum des Patienten sowie das Tumorstadium. Diese sollten natürlich das Ergebnis nach Möglichkeit nicht verzerren, weswegen zusätzliche Berechnungen nötig waren (s. 4.1). Das mittlere Alter der HNPCC-Patienten bei Erstoperation lag mit 45,3 Jahren fast genau bei dem Wert, den Lynch et al. als Durchschnittswert angeben (45,6)44 und damit deutlich unter dem der familiär nicht belasteten Patienten. Dieses Ergebnis war aufgrund der Definition des Lynch-Syndroms zu erwarten und ein AltersMatching der beiden Kollektive auch gar nicht möglich (s. 3.1). Bei älteren Patienten finden sich allerdings im Allgemeinen vermehrt erhöhte CEAWerte. Um diese mögliche Fehlerquelle aufzudecken wurde ein Vergleich zwischen jüngeren und älteren Patienten beider Kollektive aufgestellt. Da sich hierbei kein signifikanter Unterschied herausstellte, kann man davon ausgehen, dass der niedrigere Mittelwert nicht allein durch das niedrigere Alter der HNPCC-Patienten bedingt ist. Die Geschlechterverteilung im HNPCC-Kollektiv zeigte eine leichte Männerdominanz (59 : 46). Diese ist laut einer Studie von Mecklin typisch für das Cancer Family Syndrome.51 Das sporadische Karzinom dagegen betrifft im Allgemeinen etwas häufiger Frauen.86 Da der CEA-Wert u.a. auch durch das Geschlecht des Patienten beeinflusst wird, wurde das Verhältnis männlicher zu weiblicher Patienten in der Vergleichsgruppe weitestgehend dem des HNPCCKollektivs angepasst. Zusätzlich wurde mit Hilfe von Pearson’s Chi2-Test der nicht vorhandene Unterschied im Geschlechterverhältnis der beiden Gruppen bestätigt. Bezüglich der Verteilung der Tumorstadien (Dukes A-D) zeigten die beiden Kollektive kaum Unterschiede (s. Abb. 2a und 2b), d.h. in beiden Gruppen gab es 41 ähnlich viele Patienten mit fortgeschrittenem Tumor und damit eher erhöhtem CEA-Wert. Einzig das Rauchverhalten der Patienten konnte in dieser retrospektiven Studie nicht mehr ermittelt werden, sollte aber durch das gematchte Geschlechterverhältnis ausgeglichen werden. Eine erste Betrachtung von Einzel-, Mittel- und Medianwerten der präoperativen CEABestimmung zeigte, dass bei HNPCC-Patienten mit insgesamt niedrigeren Markerwerten gerechnet werden muss als bei Patienten mit sporadischem kolorektalen Karzinom. Eine Differenz der Mittelwerte war in allen vier Dukes-Stadien nachzuweisen. Die Medianwerte bestätigten diese Differenz zumindest in den Stadien A und B. Für die geringere CEA-Ausschüttung bei HNPCC-assoziierten Tumoren gibt es sicherlich mehr als eine Erklärung. Eine naheliegende ist die pathophysiologische: Wie in 1.1.3 bereits erläutert, befindet sich das CEA im gesunden Kolon als zellmembran-assoziiertes Molekül in der apikalen Glykokalyx der Enterozyten und wird aus Mikrovesikeln ins Darmlumen abgegeben, geht also mit den Fäzes verloren. Tumorzellen dagegen setzen CEA in alle Richtungen ins Gewebe frei. Bei einem aggressiv wachsenden Tumor, der evtl. auch Gefäße arrodiert, gelangt das Antigen auf diese Weise also leicht in die Blutbahn. Die hereditären Karzinome beim Lynch-Syndrom werden jedoch häufiger als „expansiv“ statt „infiltrativ“ beschrieben, greifen demnach auch weniger Gefäße an und geben weniger CEA in die Blutbahn ab. Vermutlich spielen auch anti-CEA-Antikörper eine Rolle. Wie eine Untersuchung von Albanopoulos et al. zeigte, können solche Antikörper als Zeichen einer guten Immunantwort des Körpers und somit (ebenso wie CEA selbst, nur in umgekehrter Relation) als prognostischer Faktor gewertet werden.3 Da sich Patienten mit LynchSyndrom nun gerade durch ein starkes Immunsystem auszeichnen, ist anzunehmen, dass bei ihnen auch die Zahl der Antikörper gegen CEA besonders hoch ist. Diese Antikörper, welche die CEA-Moleküle in der Blutbahn eliminieren, bieten also eine weitere Begründung für den reduzierten Serumspiegel an CEA. 42 Nachdem also insgesamt eher niedrige CEA-Werte bei HNPCC-Patienten ermittelt worden waren, überraschte das Ergebnis der Sensitivitätsbestimmung umso mehr: Die unzureichende Sensitivität des erhöhten CEA für die (Erst-)Diagnose eines kolorektalen Tumors war bereits bekannt (s.o.). Auch die vorliegende Untersuchung an 105 Patienten mit hereditärem Karzinom führte, insgesamt gesehen, zu einem ähnlich „schlechten“ Ergebnis: Hier waren sogar insgesamt noch weniger CEA-Werte erhöht (31,4 % der Werte > 5 ng/ml) als bei den Vergleichspatienten mit sporadischem Karzinom (34,6 %). Auch für die Subgruppe der Patienten mit HNPCC muss das carcinoembryonale Antigen also als nicht hinreichend zuverlässiger Tumorindikator gesehen werden. Eine Ausnahme zeigte sich jedoch bei der Untersuchung der einzelnen Tumorstadien. Für die Stadien Dukes A-C lag die Sensitivität des CEA bei HNPCC ähnlich niedrig wie bei den sporadischen Karzinomen - nicht aber für das Stadium D. Dass das carcinoembryonale Antigen ein guter Indikator für Metastasen (insbesondere Lebermetastasen) ist, war für sporadische kolorektale Tumoren bereits hinlänglich bekannt.4,35,90 In der Literatur wird für das kolorektale Karzinom allgemein eine Sensitivität von 60-95 % für das Erkennen eines metastasierten Erstumors (Dukes D) angegeben.34-35,86 Bei den hier untersuchten HNPCC-Patienten waren sogar 100 % der CEA-Werte bei Dukes D-Tumoren erhöht (> 5 ng/ml), womit die Erwartung noch übertroffen wurde. Auch Spezifität, positiv und negativ prädiktiver Wert waren überraschend hoch (und jeweils noch höher als bei den sporadischen Karzinomen). Dieses Ergebnis konnte auch durch Erstellung der ROC-Kurve und der entsprechenden AUC bestätigt werden. Daraus kann geschlussfolgert werden, dass ein metastasierter Tumor bei HNPCC-Patienten zuverlässiger durch den präoperativen CEA-Serumspiegel angezeigt wird als bei Patienten mit sporadischem CRC. Auch eine später folgende Metastasierung im postoperativen Verlauf führte bei fünf von acht HNPCC-Patienten zu einem erhöhten CEA-Wert (> 5 ng/ml). Das mittlere CEA 43 dieser acht Patienten lag zum Zeitpunkt der Metastasierung deutlich höher als bei den entsprechenden Ersttumoren der selben Patienten. Das Vorhandensein von Metastasen eines hereditären Primärtumors wird demnach relativ zuverlässig durch CEA-Erhöhung angezeigt; und zwar auch wenn der Ersttumor nicht mit erhöhten Tumormarkerwerten einhergegangen war. Kritisch angemerkt werden muss allerdings, dass diese Ergebnisse auf sehr geringen Fallzahlen basiert, da nur 13 HNPCC- und 19 Vergleichspatienten einen Dukes D-Tumor aufwiesen. Ein weiteres Ziel dieser Studie lag darin, mögliche Faktoren bzw. Tumormerkmale zu untersuchen, welche die CEA-Ausschüttung beeinflussen bzw. zu den reduzierten Serumspiegeln führen könnten. Diese sollen im Folgenden einzeln erläutert werden. 1.) Ein besonderes Merkmal der hereditär bedingten Kolonkarzinome ist deren niedriger Differenzierungsgrad. differenzierten In Tumoren vielen zu Untersuchungen niedrigen führten CEA-Spiegeln, gerade diese sodass sich der gering niedrige Gesamtmittelwert bei HNPCC-Patienten durch die Häufigkeit schlecht differenzierter Karzinome erklären ließe.4,25,53,76 Im vorliegenden HNPCC-Kollektiv wurde dies allerdings nicht bestätigt; hier riefen gerade die höherdifferenzierten Tumoren (G1, G2) niedrigere CEA-Werte hervor als die schlecht differenzierten (G3, G4). In der Summe änderte dieser Faktor den Mittelwert jedoch nicht; es kam trotz der Vielzahl schlechtdifferenzierter HNPCC-Tumoren zu dem insgesamt niedrigeren Mittelwert. 2.) Bei Einteilung der 105 Karzinome nach ihrem histologischen Typ (muzinöse / nichtmuzinöse Tumoren) und Vergleich der jeweiligen Mittelwerte des präoperativen CEA ergab sich ein höherer Wert für nichtmuzinöse als für muzinöse Tumoren. Bekanntermaßen sind unter hereditären Kolonkarzinomen mehr muzinöse vetreten als unter sporadischen Kolonkarzinomen. Die häufigeren muzinösen Tumoren, die niedrigere CEA-Werte hervorrufen, könnten also zu dem niedrigen Mittelwert beitragen. Allerdings konnte das Ergebnis weder durch die Medianwerte noch durch statistische Signifikanz gestützt werden. 44 3.) Ebenfalls als Merkmal des Lynch-Syndroms bezeichnet wird die häufigere proximale Tumorlokalisation. In der Literatur wurde hierzu mehrfach berichtet, dass genau diese rechtsseitig gelegenen Dickdarmkarzinome zu niedrigeren CEA-Werten führten, bzw. dass die Sensitivität des CEA für proximale Tumoren geringer sei.4,15,33,48,77,90 Somit würde das Vorherrschen der proximal lokalisierten Karzinome bei HNPCC-Patienten den niedrigen CEA-Gesamtwert zusätzlich erklären. Im untersuchten Kollektiv war das Bild jedoch schwer zu analysieren, da die proximalen Tumoren keinen niedrigeren, sondern höheren Mittelwert aufwiesen - dafür aber einen niedrigeren Medianwert. Eine Wiederholung der Untersuchung, möglichst an einem größeren Kollektiv, wäre daher angebracht. 4.) Des Weiteren sollten die CEA-Werte bei Patienten mit und ohne genetische Veränderungen verglichen werden. Dafür wurde das Kollektiv der HNPCC-Patienten auf drei „klassische“ Charakteristika von HNPCC-Tumoren (Mikrosatelliteninstabilität, Reparaturgenmutation und Ausfall der entsprechenden Proteinexpression) hin untersucht und die CEA-Werte der jeweiligen Untergruppen einander gegenübergestellt. Im Vergleich von mikrosatellitenstabilen und instabilen Tumoren ergaben sich deutlich höhere CEA-Mittelwerte in der stabilen Gruppe. Bei Einteilung der HNPCC-Tumoren in solche ohne Mutation (weder hMLH1 noch hMSH2), mit einer Mutation (entweder hMLH1 oder hMSH2) und mit Mutation beider Gene) stellte sich heraus, dass die mutationsfreien Tumoren wiederum die höchsten CEA-Werte hervorriefen. Ebenso verhielt es sich mit den jeweiligen Untergruppen bzgl. der entsprechenden Proteinexpression; hier zeigten Tumoren mit normaler MMR-Proteinexpression die höchsten CEA-Werte. Insgesamt fanden sich also bei Tumoren, die nicht nur nach klinischen Kriterien (Amsterdam-/Bethesda-) als HNPCC klassifiziert werden konnten, sondern auch die klassischen genetischen „HNPCC-Merkmale“ (Mikrosatelliteninstabilität, Reparaturgenmutation und entsprechender Expressionsausfall) aufwiesen, niedrigere CEAWerte als bei Tumoren ohne diese Merkmale. Tumoren, die zwar klinisch als HNPCC klassifiziert wurden, aber nicht die genetischen Charakteristika aufwiesen, ähnelten bezüglich ihrer hohen Werte eher den sporadischen Tumoren. 45 Diese Auffälligkeit ist gut vereinbar mit kürzlich publizierten Ergebnissen von Schiemann et al. sowie Müller-Koch et al.55,70-71 Jenen zufolge kann davon ausgegangen werden, dass innerhalb der HNPCC-Population noch eine Subgruppe von Tumoren ohne genetische Veränderungen (mikrosatellitenstabil, mutationsnegativ) existiert, die typische Merkmale von sporadischen CRC aufweisen (höheres Erkrankungsalter, weniger extrakolonische Tumormanifestationen und vermehrt linksseitige Kolonkarzinome). In Publikationen anderer Arbeitsgruppen, sowie auch in denjenigen, die aus der hier vorliegenden Arbeit herausgegangen sind, wurde bereits häufiger auf diese Gruppe von mikrosatellitenstabilen Amsterdam- oder Bethesda-positiven Tumoren und deren Ähnlichkeit zu sporadischen CRC hingewiesen.6,67-69,73 Nach Lindor et al. muss diese spezielle Gruppe sogar als eigene Krankheitsentität gesehen werden, für die seine Arbeitsgruppe die Bezeichnung „familial colorectal cancer type X“ vorschlägt.38 Die Ergebnisse der vorliegenden Studie legen nahe, dass auch die höhere CEAAusschüttung als Charakteristikum dieser Gruppe von „HNPCC-Tumoren ohne genetische Alterationen“ zu sehen ist. Insgesamt wird es durch die neuen Erkenntnisse schwieriger, zwischen hereditären Tumoren mit positiver Familienanamnese, aber ohne genetische Merkmale, und sporadischen CRC ohne familiären Hintergrund, aber mit nachgewiesener Instabilität (die z.B. die Gruppe aus Korea untersuchte) zu unterscheiden. Insgesamt sind die meisten der einzelnen Ergebnisse der vorliegenden Arbeit in sich konsistent und führen zu dem Schluss, dass bei Lynch-Patienten prinzipiell niedrigere CEA-Werte zu erwarten sind. Insbesondere zeigte sich dies für die „typischen“ HNPCCTumoren mit genetischen Alterationen (Mikrosatelliteninstabilität, Reparaturgenmutation, Proteinexpressionsausfall). Kritisch bewertet werden muss allerdings, dass die errechneten Mittelwerte zwar auf den ersten Blick sehr deutliche Unterschiede aufweisen und somit ein klares Ergebnis suggerieren, dieses sich jedoch nicht immer durch statistische Signifikanz bestätigen ließ und teilweise die Medianwerte ein anderes Bild ergaben. Vermutlich werden die Berechnungen, gerade die dafür anfälligen Mittelwerte, trotz der relativ großen Fallzahlen durch die „Ausreißer“, die in beiden Kollektiven auftraten, stark beeinflusst. 46 Dennoch lässt sich eine gewisse Tendenz zu niedrigen Tumormarkerwerten bei HNPCCPatienten nicht leugnen. Für den klinischen Alltag bedeutet dies, dass bei Patienten mit bekannter familiärer Belastung im Sinne des Lynch-Syndroms die Bestimmung des CEA-Wertes mit größerer Vorsicht zu betrachten ist als beim Kolonkarzinom im Allgemeinen. Während die Höhe des Messwertes bei Patienten mit sporadischem Karzinom ein bestimmtes Stadium anzeigen kann, darf man sich bei den niedrigeren Werten der HNPCC-Patienten nicht darauf verlassen, dass sich tatsächlich ein Tumor in Anfangsstadien dahinter verbirgt. Andererseits zeigte die gute Sensitivität des CEA für hereditäre Dukes D-Tumoren sowie für spätere (postoperative) Metastasierungen, dass dieser Tumormarker gerade für die hereditär belasteten Patienten ein guter Metastasenindikator ist. Dies führt zu dem Schluss, dass der CEA-Wert für Patienten mit hereditärem Kolonkarzinom zwar wenig Bedeutung im präoperativen Staging des Ersttumors hat, aber in der Verlaufsbeobachtung und im Erkennen von Metastasen von größerem Nutzen ist. Die relativ teure Maßnahme (die Kosten einer CEA-Bestimmung nach DKGNTVerrechnungsschlüssel, Stand 17.01.2005, betragen immerhin für HNPCC-Patienten durchaus sinnvoll, nicht zuletzt weil sie einfach und standardisiert durchführbar ist und von den meisten Patienten bereitwillig akzeptiert wird. Weitere Untersuchungen an größeren Kollektiven sind nun nötig, um die Ergebnisse der vorliegenden Studie zu bestätigen. Zudem werfen die genannten Erkenntnisse wieder neue Fragen (insbesondere bzgl. des postoperativen Verlaufs des CEA-Wertes bei HNPCCTumoren, was nicht Thema dieser Arbeit war) auf, die der Klärung bedürfen. Auch andere Methoden wie z.B. die Bestimmung von anti-CEA-Antikörperspiegeln oder die direkte immunhistochemische Messung von (tissue-)CEA im Tumorgewebe sollten auf ihre Relevanz für Patienten mit Lynch-Syndrom hin untersucht werden. Zudem sollte nochmals darauf hingewiesen werden, dass die hier ermittelten Ergebnisse auf CEA-Messungen verschiedener Krankenhauslaboratorien basieren und daher unterschiedliche Messmethoden angewandt wurden. Zukünftige Untersuchungen sollten nach Möglichkeit an einem Patientenkollektiv aus einer einzigen Klinik erfolgen; wobei 47 sich dann natürlich nicht so leicht eine statistisch verwertbare Fallzahl von Patienten findet. In jedem Fall zeigt bereits diese erste Studie zu dem Thema deutlich, dass die hereditären Tumoren innerhalb der Gesamtheit der Kolonkarzinome grundsätzlich - und damit auch in Bezug auf die Tumormarker-Diagnostik - eigenständig für sich betrachtet werden müssen. Ist die familiäre Belastung eines Karzinompatienten bekannt, Tumormarkerbestimmung unbedingt differenzierter bewertet werden. 48 sollte die 6. Zusammenfassung Das carcinoembryonale Antigen (CEA) ist ein Tumormarker, der insbesondere für das prätherapeutische Staging und die Verlaufsbeobachtung kolorektaler Karzinome geeignet ist. Auf die hereditäre, nicht-polypöse Form des Dickdarmkarzinoms (HNPCC) lässt sich dies jedoch nicht äquivalent übertragen. 105 Patienten mit hereditärem und 107 Vergleichspatienten mit sporadischem kolorektalen Karzinom wurden auf ihre präoperativen CEA-Werte hin untersucht. Folgende Ergebnisse können zusammenfassend genannt werden : 1. Bei HNPCC-Patienten war der Tumormarker insgesamt etwas seltener erhöht, d.h. die Sensitivität des CEA war geringfügig niedriger. Auch die absoluten Messwerte waren im Mittel bei hereditären Tumoren niedriger. Ist eine familiäre Disposition bei einem Patienten bekannt, dürfen niedrige präoperative CEA-Werte nicht zu allzu optimistischen Prognosen verleiten, sondern müssen kritischer betrachtet werden als bei Patienten mit sporadischem Karzinom. 2. Verschiedene Tumormerkmale wurden in Bezug auf ihre Relation zur Höhe des CEA-Wertes untersucht. Muzinöse Karzinome, wie sie gehäuft bei HNPCC auftreten, führten zu niedrigeren Mittelwerten als nicht-muzinöse Tumoren. Für niedrig differenzierte sowie proximal lokalisierte CRC wäre nach bisheriger Kenntnis dasselbe zu erwarten gewesen, konnte hier jedoch nicht gezeigt werden. HNPCC-Tumoren mit typischen genetischen Alterationen (Mikrosatelliten- Instabilität, Genmutation, Expressionsausfall) wiesen niedrigere CEA-Werte auf als diejenigen ohne genetischen Befund. Letztere ergaben einen ähnlich hohen Messwert wie sporadische Karzinome. Niedrige präoperative CEA-Werte sollten daher besonders bei den „klassischen“ HNPCC-Tumoren mit genetischen Veränderungen kritisch bewertet werden. 49 3. Für das Anzeigen von Tumoren im fortgeschrittenen Metastasenstadium erwies sich das carcinoembryonale Antigen dagegen auch bei HNPCC-Patienten als geeignet. Es zeichnete sich sowohl durch hohe Sensitivität als auch durch einen hohen absoluten Mittelwert aus, für bereits metastasierende Ersttumoren ebenso wie für postoperativ auftretende Metastasen. So muss bei HNPCC-Patienten zwar insgesamt mit eher niedrigeren CEA-Werten gerechnet werden; eine Metastasierung wird dagegen zuverlässiger durch CEA-Erhöhung angezeigt. Die regelmäßige Markerbestimmung im Zuge der standardisierten Tumornachsorge ist daher auch bei Patienten aus HNPCC-Familien indiziert. 50 7. Literaturverzeichnis 1. Aaltonen L.A., Peltomaki P., Leach F.S., Sistonen P., Pylkkanen L., Mecklin J., Jarvinen H., Powell S.M., Jen J., Hamilton S.R.: Clues to the pathogenesis of familial colorectal cancer. Science 1993; 260:812-816 2. Albano W.A., Recabaren J.A., Lynch H.T., Campbell A.S., Mailliard J.A., Organ C.H., Lynch J.F., Kimberling W.J.: Natural history of hereditary cancer of the breast and colon. Cancer 1982; 50:360-363 3. Albanopoulos K., Armakolas A., Konstadoulakis M.M., Leandros E., Tsiobanou E., Katsaragakis S., Alexiou D., Androulakis G.: Prognostic significance of circulating antibodies against carcinoembryonic antigen (AntiCEA) in patients with colon cancer. Am J Gastroenterol 2000; 95(4):1056-1061 4. Arnaud J.P., Koehl C., Adloff M.: Carcinoembryonic antigen (CEA) in diagnosis and prognosis of colorectal carcinoma. Dis Colon Rectum 1980; 23:141-144 5. Benchimol S., Fuks A., Jothy S., Beauchemin N., Shirota K., Stanners C.P.: Carcinoembryonic antigen, a human tumor marker, functions as an intercellular adhesion molecule. Cell 1989; 57:327-334 6. Bisgaard M.L., Jager A.C., Myrhoj T., Bernstein I., Nielson F.C.: Hereditary non-polyposis colorectal cancer (HNPCC): phenotype-genotype correlation between patients with and without identified mutation. Hum Mutat 2002; 20(1):20-27 7. Boland C.R., Thibodeau S.N., Hamilton S.R., Sidransky D., Eshleman J.R., Burt R.W., Meltzer S.J., Rodriguez-Bigas M.A., Fodde R., Ranzani G.N., Srivastava S.: A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res 1998; 58(22):5248-5257 8. Bombardieri E., Jotti G.S., Cocciolo M.G., Mori M., Rusconi A., Rusca M., Seregni E., Becchi G., Fontanesi M., Tardini A.: Tissue polypeptide antigen and carcinoembryonic antigen in colon tumors: Serum levels and immunohistochemical localization. Cancer Detect Prev 1985; 8(1/2):219-226 9. Bufo P., Frassanito F., Müller H., Cristofar G., Senatore S., Appelman H.D., Lynch H.T.: Crypt atrophy of colorectal mucosa in Lynch syndromes I and II: Its characteristics and meaning, preliminary observations. 51 in: Utsunomiya J., Lynch H.T. (ed.): Hereditary Colorectal Cancer. Springer-Verlag, Tokyo, 1990 10. Carpelan-Holmstrom M., Louhimo J., Stenman UH., Alfthan H., Haglund C.: CEA, CA 19-9 and CA 72-4 improve the diagnostic accuracy in gastrointestinal cancers. Anticancer Res 2002; 22(4):2311-2316 11. de la Chapelle A.: Microsatellite Instability. N Engl J Med 2003; 349(3):209-210 12. Compton C., Fenoglio-Preiser C.M., Pettigrew N., Fielding L.P.: American Joint Committee on Cancer Prognostic Factors Consensus Conference: Colorectal Working Group. Cancer 2000; 88:1739-1757 13. Dörner K.: Klinische Chemie. Ferdinand Enke Verlag, Stuttgart, 2. Auflage 1992 14. Dudley R.: Chemiluminescence immunoassay: an alternative to RIA. Lab Med 1990; 21(4):216-221 15. Duffy M.J.: Carcinoembryonic antigen as a marker for colorectal cancer: Is it clinically useful ? Clin Chem 2001; 47(4):624-630 16. Dukes C.E., Bussey H.J.: The spread of rectal cancer and its effect on prognosis. Br J Cancer 1958; 12:309-320 17. d’Emilia J.C., Rodriguez-Bigas M.A., Petrelli N.J.: The clinical and genetic manifestations of hereditary nonpolyposis colorectal carcinoma. Am J Surg 1995; 169:368-372 18. Exner H., Renner D.: Medizinische Biometrie, GK 2 Georg Thieme Verlag, Stuttgart/New York, 12. Auflage 2001 19. Fletcher R.H.: Carcinoembryonic Antigen. Ann Int Med 1986; 104:66-73 20. Gerok W., Huber C., Meinertz T., Zeidler H.: Die Innere Medizin. Verlag Schattauer, Stuttgart/New York, 10. Auflage 2000 52 21. Gold P., Freedman S.O.: Demonstration of tumor-specific antigens in human colonic carcinomata by immunological tolerance and absorption techniques. J Exp Med 1965; 121:439- 462 22. Gold P., Freedman S.O.: Specific carcinoembryonic antigens of the human digestive system. J Exp Med 1965; 122:467 23. Guirgis H.A., Lynch H.T., Harris R.E., Vandevoorde J.P.: Genetic and communicable effects on carcinoembryonic antigen expressivity in the cancer family syndrome. Cancer Res 1978; 38:2523-2528 24. Guirgis H.A., Lynch H.T., Harris R.E., Vandevoorde J.P.: Carcinoembryonic antigen (CEA) in the cancer family syndrome. Cancer 1978; 42(3):1574-1578 25. Hammarström S.: The carcinoembryonic antigen (CAE) family: structures, suggested functions and expression in normal and malignant tissues. Sem Cancer Biol 1999; 9:67-81 26. Hammarström S., Olsen A., Teglund S., Baranov V.: The nature and expression of the human CEA family. in: Stanners C. (ed.): Cell adhesion and communication mediated by the CEA family: Basic and clinical perspectives. Harwood Academic Publishers, Amsterdam, 1997 27. Herold G.: Innere Medizin Gerd Herold, Köln, 2005 28. Herrera M.A., Chu T.M., Holyoke E.D.: Carcinoembryonic antigen (CEA) as a prognostic and monitoring test in clinically complete resection of colorectal carcinoma. Ann Surg 1976; 183(1):5-9 29. Holinski-Feder E., Müller-Koch Y., Friedl W., Moeslein G., Keller G., Plaschke J., Ballhausen W., Gross M., Baldwin-Jedele K., Jungck M., Mangold E., Vogelsang H., Schackert H.-K., Lohse P., Murken J., Meitinger T.: DHPLC mutation analysis of the hereditary nonpolyposis colon cancer (HNPCC) genes hMLH1 and hMSH2. J Biochem Biophys Methods 2001; 47(1-2):21-32 30. Holyoke E.D., Chu T.M., Murphy G.P.: CEA as a monitor of gastrointestinal malignancy. Cancer 1975; 35:830-836 53 31. Jass J.R.: Natural history of hereditary non-polyposis colorectal cancer. J Tumor Mark Oncol 1995; 10:65-71 32. Kim S.B., Fernandes L.C., Saad S.S., Matos D.: Assessment of the value of preoperative serum levels of CA 242 and CEA in the staging and postoperative survival of colorectal adenocarcinoma patients. Int J Biol Mark 2003; 18(3):182-187 33. Ladenson J.H., McDonald J.M.: Colorectal carcinoma and carcinoembryonic antigen (CEA). Clin. Chem. 1980; 26(8):1213-1220 34. Lamerz R.: Klinische Relevanz von Tumormarkern. Wien Klin Wochenschr 1989; 101(14):464-472 35. Lau-Werner U., Stieber P.: Tumormarker beim kolorektalen Karzinom. J Lab Med 2003; 27(1/2):20-25 36. Leusch H.G., Hefta S.A., Drzeniek Z., Hummel K., Markos-Pusztai Z., Wagener C.: Escherichia coli of human origin binds to carcinoembryonic antigen (CEA) and nonspecific crossreacting antigen (NCA). FEBS Lett 1990; 261:405-409 37. Lim S.B., Jeong S.Y., Lee M.R., Ku J.L., Shin Y.K., Kim W.H., Park J.G.: Prognostic significance of microsatellite instability in sporadic colorectal cancer. Int J Colorectal Dis 2004; 19:533-537 38. Lindor N.M., Rabe K., Peterson G.M., Haile R., Casey G., Baron J., Gallinger S., Bapat B., Aronson M., Hopper J., Jass J., LeMarchand L., Grove J., Potter J., Newcomb P., Terdiman J.P., Moslein G., Goldberg R., Ziogas A., Anton-Culver H., de Andrade M., Siegmund K., Thibodeau S.N., Boardman L.A., Seminara D.: Lower cancer incidence in Amsterdam-I criteria families without mismatch repair deficiency: familial colorectal cancer type X. JAMA 2005; 293:1979-1985 39. Lipton L.R., Johnson V., Cummings C., Fisher S., Risby P., Eftekhar Sadat A.T., Cranston T., Izatt L., Sasieni P., Hodgson S.V., Thomas H.J., Tomlinson I.P.: Refining the Amsterdam Criteria and Bethesda Guidelines: testing algorithms for the prediction of mismatch repair mutation status in the familial cancer clinic. J Clin Oncol 2004; 22(24):4934-4943 40. Lynch H.T., Guirgis H.: Carcinoembryonic antigen in families. J Am Med Assoc 1979; 224:1042 41. Lynch H.T., Lynch J.F.: Lynch syndrome: History and current status. Dis Markers 2004; 20:181-198 54 42. Lynch H.T., Shaw M.W., Magnuson C.W., Larsen A.L., Krush A.J.: Hereditary factors in cancer. Study of two large Midwestern kindreds. Arch Intern Med 1966; 117:206-212 43. Lynch H.T., Smyrk T., Lynch J.: An update of HNPCC (Lynch syndrome). Cancer Genet Cytogenet 1997; 93:84-99 44. Lynch H.T., Smyrk T., Watson P., Lanspa S.J., Boman B.M., Lynch P.M., Lynch J.F., Cavalieri J.: Hereditary Colorectal Cancer. Sem Onc 1991; 18(4):337-366 45. Lynch H.T., Smyrk T.C., Watson P., Lanspa S.J., Lynch J.F., Lynch P.M., Cavalieri R.J., Boland C.R.: Genetics, natural history, tumor spectrum, and pathology of hereditary nonpolyposis colorectal cancer: An updated review. Gastroenterology 1993; 104:1535-1549 46. Lynch H.T., Utsunomiya J.: Overview and epilogue. in: Utsunomiya J., Lynch H.T. (ed.): Hereditary Colorectal Cancer. Springer-Verlag, Tokyo, 1990 47. Marchena J., Acosta M.A., Garcia-Anguiano F., Simpson H., Cruz F.: Use of the preoperative levels of CEA in patients with colorectal cancer. Hepatogastroenterology 2003; 50:1017-1020 48. Martin E.W.jr, Kibbey W.E., DiVecchia L., Anderson G., Catalano P., Minton J.P.: Carcinoembryonic antigen: Clinical and historical aspects. Cancer 1976; 37:62-81 49. Matsuoka Y., Matsuo Y., Okamoto N., Kuroki Mo., Kuroki Ma., Ikhara Y.: Highly effective extraction of carcinoembryonic antigen with phosphatidylinositol-specific phospholipase C. Tumor Biol 1991; 12:91-98 50. Mecklin J.-P., Järvinen H.J., Hakkiluoto A., Hallikas H., Hiltunen K.-M., Härkönen N., Kellokumpu I., Laitinen S., Ovaska J., Tulikoura J., Valkamo E.: Frequency of hereditary nonpolyposis colorectal cancer. Dis Colon Rectum 1995; 38(6):588-593 51. Mecklin J.P., Sipponen P., Järvinen H.J.: Histopathology of colorectal carcinomas and adenomas in cancer family syndrome. Dis Colon Rectum 1986; 29:849-853 52. Mentges B., Brückner R., Weiss C.: Die Bedeutung des präoperativen CEA-Wertes für die Prognose des Rektumkarzinomes. Langenbecks Arch Chir 1990; 375:106-111 55 53. Moertel C.G., O’Fallon J.R., Go V.L.W., O’Connell M.J., Thynne G.S.: The preoperative carcinoembryonic antigen test in the diagnosis, staging, and prognosis of colorectal cancer. Cancer 1986; 58:603-610 54. Müller-Koch Y., Kopp R., Lohse P., Baretton G., Stoetzer A., Aust D., Daum J., Kerker B., Gross M., Dietmeier W., Holinski-Feder E.: Sixteen rare sequence variants of the hMLH1 and hMSH2 genes found in a cohort of 254 suspected HNPCC (hereditary non-polyposis colorectal cancer) patients: mutations or polymorphisms ? Eur J Med Res 2001; 6(11):473-482 55. Müller-Koch Y., Vogelsang H., Kopp R., Lohse P., Keller G., Aust D., Muders M., Gross M., Daum J., Schiemann U., Grabowski M., Scholz M., Kerker B., Becker I., Henke G., Holinski-Feder E.: HNPCC – clinical and molecular evidence for a new entity of hereditary colorectal cancer. Gut 2005; published online first: 14 June 2005 56. Nakagoe T., Sawai T., Tsuji T., Ayabe H., Nakazaki T., Ishikawa H., Hatano K., Kajiwara K., Miyashita K., Matsuo T., Nogawa T., Arisawa K.: Prognostic value of carcinoembryonic antigen (CEA) in tumor tissue of patients with colorectal cancer. Anticancer Res 2001; 21:3031-3036 57. Nap M., Mollgard K., Burtin P., Fleuren G.J.: Immunohistochemistry of carcino-embryonic antigen in the embryo, fetus and adult. Tumour Biol 1988; 9(2-3):145-153 58. Oikawa S., Kuroki M., Matsuoka Y., Kosaki G., Nakazato H.: Homotypic and heterotypic Ca2+-independent cell adhesion activities of biliary glycoprotein, a member of carcinoembryonic antigen family, expressed on CHO cell surface. Biochem Biophys Res Commun 1992; 186:881-887 59. Paxton R.J., Mooser G., Pande H., Lee T.D., Shively J.E.: Sequence analysis of carcinoembryonic antigen: identification of glycosylation sites and homology with the immunoglobulin supergene family. Proc Natl Acad Sci USA 1987; 84:920-924 60. Peltomaki P.: Deficient DNA mismatch repair : a common etiologic factor for colon cancer. Hum Mol Genet 2001; 10(7):735-740 61. Peltomaki P., Lothe R.A., Aaltonen L.A., Pylkkanen L., Nystrom-Lahti M., Seruca R., David L., Holm R., Ryberg D., Haugen A.: Microsatellite instability is associated with tumors that characterize the hereditary nonpolyposis colorectal carcinoma syndrome. Cancer Res 1993; 53:5853-5855 56 62. Peltomaki P., Vasen H.F.: Mutations predisposing to hereditary nonpolyposis colorectal cancer: database and results of a collaborative study. The International Collaborative Group on Hereditary Nonpolyposis Colorectal Cancer. Gastroenterology 1997; 113(4):1146-1158 63. Pribelsky M., Pechan J., Okolieany R., Prochotsky A.: Der präoperative CEA-Wert als ein prognostischer Faktor. Acta Chir. Austriaca 2001; 33(1):35-38 64. Quentmeier A., Schlag P., Schmidt-Gayk H., Herfarth C.: Untersuchungen zur Expression und Sekretion der Tumormarker CEA und CA 19-9 bei nicht metastasierten Colon-Karzinomen. in: Greten H., Klapdor R.: Klinische Relevanz neuer monoklonaler Antikörper. Georg Thieme Verlag, Stuttgart/New York, 1986 65. Reiter W., Stieber P., Reuter C., Nagel D., Lau-Werner U., Lamerz R.: Multivariate analysis of the prognostic value of CEA and CA 19-9 serum levels in colorectal cancer. Anticancer Res 2000; 20:5195-5198 66. Rodriguez-Bigas M.A., Boland C.R., Hamilton S.R., Henson D.E., Jass J.R., Khan P.M., Lynch H., Perucho M., Smyrk T., Sobin L., Srivastava S.: A national cancer institute workshop on hereditary nonpolyposis colorectal cancer syndrome: Meeting highlights and Bethesda guidelines. J Natl Cancer Inst 1997; 89:1758-1762 67. Rovella V., Carrara S., Crucitti S.C., Coco C., Magistrelli P., Lucci-Cordisco E., Anti M., Neri G., Genuardi M.: Familial microsatellite-stable non-polyposis colorectal cancer: incidence and characteristics in a clinic-based population. Ann Oncol 2001; 12(6):813-818 68. Schiemann U., Günther S., Henke G., Gross M., Stieber P., Müller-Koch Y., Muders M., Folwaczny C., Mussack T., Holinski-Feder E.: Niedrigere präoperative Serum-Spiegel des carcinoembryonalen Antigens (CEA) beim hereditären nicht-polypösen kolorektalen Karzinom (HNPCC) verglichen mit SerumSpiegel beim sporadischen Kolonkarzinom. Z Gastroenterol 2004; 42:1231 69. Schiemann U., Günther S., Gross M., Henke G., Müller-Koch Y., König A., Muders M., Folwaczny C., Mussack T., Holinski-Feder E.: Carcinoembryonic antigen (CEA) in hereditary non polyposis colorectal cancer (HNPCC): consideration with regard to age, tumor stage, grade of differentiation and genetic heterogenity. Cancer Detect Prev 2005; im Druck 57 70. Schiemann U., Müller-Koch Y., Gross M., Daum J., Lohse P., Baretton G., Muders M., Mussack T., Kopp R., Holinski-Feder E.: Extended microsatellite analysis in microsatellite stable, MSH2 and MLH1 mutationnegative HNPCC patients: genetic reclassification and correlation with clinical features. Digestion 2004; 69(3):166-176 71. Schiemann U., Müller-Koch Y., Gross M., Glas J., Baretton G., Muders M., Mussack T., Holinski-Feder E.: Detection of occult high graded microsatellite instabilities in MMR gene mutation negative HNPCC tumors by addition of complimentary marker analysis. Eur J Med Res 2005; 10:23-28 72. Schwarzer S.: DHPLC spürt DNA-Mutationen auf. LaborPraxis 2000; 24(10):28-30 73. Scott R.J., McPhillips M., Meldrum C.J., Fitzgerald P.E., Adams K., Spigelman A.D., du Sart D., Tucker K., Kirk J.: Hereditary nonpolyposis colorectal cancer in 95 families: differences and similarities between mutation-positive and mutation-negative kindreds. Am J Hum Genet 2001; 68(1):118-127 74. Seelos, H.J.: Medizinische Informatik, Biometrie und Epidemiologie. Verlag Walter de Gruyter, Berlin/New York, 1997 75. Shively J.E., Beatty J.D.: CEA-related antigens: Molecular biology and clinical significance. CRC Crit Rev Oncol Hematol 1985; 2:355-399 76. Sikorska H., Shuster J., Gold P.: Clinical applications of carcinoembryonic antigen. Cancer Detect Prev 1988; 12:321-355 77. Slater G., Papatestas A.E., Aufses A.H.: Preoperative carcinoembryonic antigen levels in colorectal carcinoma. Arch Surg 1979; 114:52-53 78. Smyrk T.C., Lynch H.T., Watson P.A., Appelman H.D.: Histologic features of hereditary nonpolyposis colorectal carcinoma. in: Utsunomiya J., Lynch H.T. (ed.): Hereditary Colorectal Cancer. Springer-Verlag, Tokyo, 1990 79. Staab H.J., Anderer F.A., Brümmendorf T., Hornung A.: Prognostic significance of CEA in gastrointestinal cancer. Protides of the Biol Fluids 1984; 31:941-944 58 80. Staab H.J.,Anderer F.A., Brümmendorf T., Stumpf E., Fischer R.: Prognostic value of preoperative serum CEA level compared to clinical staging. I. Colorectal Carcinoma. Br J Cancer 1981; 44:652-662 81. Thiemes Innere Medizin. Georg Thieme Verlag, Stuttgart/New York, 1999 82. Thomas L.: Labor und Diagnose. Medizinische Verlagsgesellschaft, Marburg, 4. Auflage 1992 83. Thomas P., Toth C.A., Saini K.S., Jessup J.M., Steele Jr G.: The structure, metabolism and function of the carcinoembryonic antigen gene family. Biochim Biophys Acta 1990; 1032:177-189 84. Thompson J.A., Grunert F., Zimmermann W.: Carcinoembryonic antigen gene family: Molecular biology and clinical perspectives. J Clin Lab Anal 1991; 5:344-366 85. Thomson D.M.P., Krupey J., Freedman S.O., Gold P.: The radioimmunoassay of circulating carcinoembryonic antigen of the human digestive tract. Proc Natl Acad Sci USA 1966; 64:161-167 86. Tumorzentrum München: Empfehlungen zur Diagnostik, Therapie und Nachsorge. Gastrointestinale Tumoren. 5.Auflage 1997 87. Vasen H.F.A., Boland C.R.: Progress in genetic testing, classification, and identification of Lynch syndrome. JAMA 2005; 293(16)2028-2030 88. Vasen H.F.A., Mecklin J.-P., Meera Khan P., Lynch H.T.: The International Collaborative Group on Hereditary Non-Polyposis Colorectal Cancer (ICG-HNPCC). Dis Colon Rectum 1991; 34(5):424-425 89. Wagener C., Wickert L., Meyers W.: Limited improvement of tumour diagnosis by the simultaneous determination of carcinoembryonic antigen (CEA) and of a tumour-associated CEA-related antigen of Mr 128000 in serum. J Clin Chem Clin Biochem 1989; 27:643 90. Wanebo H.J., Rao B., Pinsky C.M., Hoffman R.G., Stearns M., Schwartz M.K., Oettgen H.F.: Preoperative carcinoembryonic antigen level as a prognostic indicator in colorectal cancer. N Engl J Med 1978; 299(9):448-451 91. Warthin A.S.: Heredity with reference to carcinoma. Arch Intern Med 1913; 12:546-555 59 92. Wiratkapun S., Kraemer M., Seow-Choen F., Yik-Hong H., Eu K.W.: High preoperative serum carcinoembryonic antigen predicts metastatic recurrence in potentially curative colonic cancer : Results of a five-year study. Dis Colon Rectum 2001; 44(2):231-235 93. Zhou H., Stanners C.P., Fuks A.: Specificity of anti-carcinoembryonic antigen monoclonal antibodies and their effects on CEA-mediated adhesion. Cancer Res 1993; 53:3817-3822 60 Lebenslauf Persönliche Angaben Name Geburtsdatum Geburtsort Staatsangehörigkeit Eltern Silke Günther 6. April 1979 Düsseldorf-Kaiserswerth Deutsch Wolf-Dieter Günther (Zentraleinkäufer) Monika Günther, geb. Komberez (Schulleiterin) Schulausbildung 1985-1989 1989-1998 1996 Juni 1998 Besuch der Wilhelm-Busch-Grundschule in Ratingen-Hösel Besuch des Geschwister-Scholl-Gymnasiums in Ratingen Sechsmonatiger Besuch der Scone Grammar School, New South Wales, Australien Abschluss: Abitur Studium WS 1998 – SS 2000 August 2000 WS 2000 – SS 2005 August 2001 September 2003 Mai 2005 Seit September 2005 Studium der Medizin an der Heinrich-Heine-Universität, Düsseldorf Ärztliche Vorprüfung Studium der Medizin an der Ludwig-MaximiliansUniversität, München 1.Abschnitt der Ärztlichen Prüfung 2.Abschnitt der Ärztlichen Prüfung 3.Abschnitt der Ärztlichen Prüfung Weiterbildung zur Fachärztin für Innere Medizin, Krankenhaus Dritter Orden, München 61 Danksagung Ich danke Herrn PD Dr. med. U. Schiemann (ehem. Medizinische Klinik Innenstadt, LMU München, jetzt Oberarzt am Inselspital-Universitätsspital Bern, Schweiz) für die freundliche Überlassung des Themas und ganz besonders für die herausragende, engagierte Betreuung. Ebenso gilt mein Dank Frau PD Dr. med. Dipl. chem. E. Holinski-Feder, die als Leiterin der HNPCC-Studie (Zentrum München/Regensburg) die Rahmenbedingungen für diese Arbeit geschaffen hat. Herrn Prof. Dr. med. A. König und Frau H. Beranek vom Institut für Biomathematik (Medizinische Klinik Innenstadt, LMU München) danke ich herzlich für die Unterstützung bei der statistischen Evaluation. Weiterhin möchte ich Frau Dr. med. P. Stieber und ihren Mitarbeitern vom Institut für Klinische Chemie in Großhadern für die hilfreiche und kompetente fachliche Beratung bei der Auswertung der Laborparameter danken. Außerdem geht mein Dank an Frau Dr. rer. nat. M. Grabowski sowie an Frau G. Henke und Frau B. Kerker vom Institut für Medizinische Genetik, die mir während der Datensammlung immer freundlich mit Rat und Tat zur Seite standen. 62