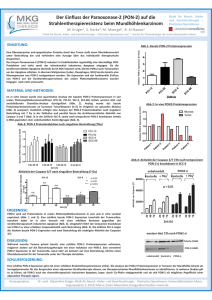
Multiple Funktionen des FGF-Signalwegs regulieren die
Werbung

Multiple Funktionen des FGF-Signalwegs regulieren die Lateralitätsentwicklung im Krallenfrosch Xenopus Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften (Dr. rer. nat.) Fakultät Naturwissenschaften Universität Hohenheim Institut für Zoologie vorgelegt von Isabelle Janina Schneider aus Stuttgart 2013 Dekan: Prof. Dr. Heinz Breer 1.berichtende Person: Prof. Dr. Martin Blum 2.berichtende Person: Prof. Dr. Heinz Breer Eingereicht am: 02.12.2013 Mündliche Prüfung am: 23.04.2014 Die vorliegende Arbeit wurde am 21.02.2014 von der Fakultät Naturwissenschaften der Universität Hohenheim als „Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften“ angenommen. Zusammenfassung Zusammenfassung Während der Embryonalentwicklung werden die drei Körperachsen der Wirbeltiere gebildet, wobei sich die links-rechts (LR) Achse wie in einem kartesischen Koordinatensystem durch die Festlegung der anterior-posterioren und der dorso-ventralen Achse ergibt. In der weiteren Entwicklung muss die Lateralität etabliert werden, d.h. die ursprüngliche Symmetrie der LR-Achse muss gebrochen werden, um die asymmetrische Anordnung der inneren Organe zu ermöglichen. Dabei werden die Organe nicht zufällig, sondern in einem bestimmten Muster angeordnet. Dies wird durch die Expression der konservierten Nodal-Genkaskade gewährleistet, die asymmetrisch im linken Seitenplattenmesoderm exprimiert wird. Der Bruch der Symmetrie, welcher zu dieser asymmetrischen Nodal-Kaskade führt, wird über einen linksgerichteten Flüssigkeitsstrom vermittelt, der wiederum durch die rotierende Bewegung motiler Cilien entsteht. Das Epithel, das den Flüssigkeitsstrom erzeugt, findet sich im Bereich des posterioren Notochords und weist lateral auf beiden Seiten eine symmetrische Expression von Nodal auf. Diese frühe bilaterale Nodal-Domäne ist Vorraussetzung für die Induktion der asymmetrischen Nodal-Kaskade. Während Nodal-Funktion und Flüssigkeitsstrom innerhalb der Wirbeltiere weitgehend konserviert sind, wurden für den FGF-Signalweg divergierende Funktionen in der Lateralitätsentwicklung von Maus, Huhn, Kaninchen und Zebrabärbling beschrieben. In dieser Arbeit wurde die Rolle der FGF-Signalaktivität für die Lateralitätsentwicklung von Xenopus laevis untersucht. Durch systemische Anwendung eines Rezeptorantagonisten in verschiedenen Entwicklungsstadien war es möglich, zwei zeitlich unterschiedliche Funktionen von FGF zu dokumentieren. Zum einen wird der FGF-Signalweg in den frühen Gastrulastadien für die Expression von FoxJ1 benötigt, dem Masterkontrollgen für motile Cilien, und somit für die Ciliogenese des symmetriebrechenden Epithels des Krallenfrosches, der GRP („gastrocoel roof plate“). Zum anderen wirkt der FGF-Signalweg auf die bilaterale Expression von Nodal. Durch deskriptive und funktionelle Untersuchung konnte gezeigt werden, dass die Nodal-exprimierenden Zellen den somitischen Anteil der GRP darstellen und ihre Entstehung durch FGF-Funktionsverlust verhindert wird. Interessanterweise steht der frühe Effekt von FGF auf die Ciliogenese im Einklang mit der beschriebenen Rolle im Zebrabärbling, während der spätere Effekt der Inhibition, der Verlust der bilateralen NodalDomäne, bereits in der hypomorphen Fgf8 Mausmutanten beschrieben wurde. Die Zusammenfassung Beschreibung von zwei zeitlich getrennten Funktionen in Xenopus zeigt somit, dass der FGF-Signalweg eine stärkere Konservierung aufweisen könnte als bislang angenommen. Der FGF-Signalweg teilt sich in verschiedene Zweige auf, von denen zwei in der frühen Embryonalentwicklung von Xenopus eine wichtige Rolle spielen. Hierbei wird über die FGF-abhängige MAPK-Aktivierung die Induktion des Mesoderms gewährleistet, während der PLC/PKC/Calcium-Signalweg Einfluss auf morphogenetische Veränderungen nimmt. Die FGF-vermittelte Wirkung auf die Expression von FoxJ1 stand dabei in einem zeitlichen Zusammenhang mit der Aktivität des FGF-Signalweges in der Spezifizierung des Mesoderms. Somit hatte die Rezeptor-vermittelte FGF-Inhibition in frühen Gastrulastadien starke Defizite in der Expression mesodermaler Markergene und, damit einhergehend, Blastoporusschlussdefekte zur Folge. Dies konnte durch Inhibition in späteren Gastrulastadien, in denen die Induktion des Mesoderms als weitestgehend abgeschlossen gilt und in denen der FGF-Signalweg auf die lateralen GRP-Zellen wirkt, vermieden werden. Um aufzuklären, welche der beiden intrazellulären Signaltransduktionskaskaden für die beobachteten Phänotypen verantwortlich waren, wurde der FGF-abhängige PLC/PKC/Calcium-Signalweg durch den intrazellulären Antagonisten Sprouty1 inhibiert. Sprouty1-Funktionsgewinnexperimente zeigten keinen negativen Einfluss auf die Ciliogenese, jedoch hatten sie denselben inhibierenden Effekt auf die somitischen GRPZellen wie die Rezeptor-vermittelte Inhibition des FGF-Signalweges. Dies deutete darauf hin, dass die FGF-abhängige Entstehung dieser Zellen durch den PLC/PKC/CalciumSignalweg gewährleistet wird. Dass hierbei insbesondere intrazelluläres Calcium für die Bildung dieser Zellen wichtig ist, ergab sich aus Experimenten mit einem Calciumpermeablen Ionenkanal. Die frühere Funktion von FGF, die Ciliogenese, wurde dagegen unabhängig vom PLC/PKC/Calcium-Signalweg vermittelt, möglicherweise über den MAPK-Signalweg. Zusammenfassend zeigt die vorliegende Arbeit, dass der FGF-Signalweg in der Lateralitätsentwicklung von Xenopus zwei Funktionen spielt, die in Einklang mit einer konservierten Funktion dieses Signalwegs in der Lateralitätsentwicklung der Wirbeltiere stehen. Die hier gezogenen Erkenntnisse über die Wirkung des FGF-Signalwegs auf die lateralen GRP-Zellen, liefern neue Ansätze zur Untersuchung der LR- Achsendeterminierung. Als Sensorzellen des linksgerichteten Flüssigkeitsstroms spielen sie eine entscheidende Rolle in der Lateralitätsentwicklung. Abstract Abstract Early embryogenesis governs the formation of the three body axis. Like in a cartesian coordinate system, the LR-axis is defined by the generation of the anterior-posterior and the dorso-ventral axis. In the course of laterality specification, the original LR-symmetry has to be broken to enable the asymmetric arrangement of inner organs in a specific manner. This is mediated by the expression of conserved gene cascade, namely the Nodal gene cascade, which is expressed in the left but not in the right lateral plate mesoderm of the neurula stage embryo. Symmetry breakage, which leads up to this asymmetric Nodal gene cascade, is manifested by a cilia-based leftward fluid flow. The flow generating epithelium is located at the posterior end of the notochord and expresses Nodal in a bilateral symmetrical mode. This early Nodal domain is a prerequisite of the later asymmetric Nodal gene cascade. Despite the conserved nature of Nodal expression and of leftward flow, no conservation of the role of the FGF signaling has been described for mouse, chick, rabbit and zebrafish. In this work the role of FGF signaling in Xenopus laevis LR-development was investigated. Using of a receptor antagonist to inhibit FGF signaling revealed two temporally distinguishable functions. Firstly, FGF signaling in early gastrula stages is required for the proper expression of FoxJ1, the master control gene of motile cilia. Here, FGF signaling acts in the process of ciliogenesis of the symmetry-breaking epithelium, which is represented by the GRP (“gastrocoel roof plate”) in Xenopus. Secondly, FGF acts in a cilia-independent manner on the bilateral Nodal expression. A series of descriptive and functional studies revealed that these cells constitute the somitic part of the GRP and that inhibition of FGF signaling leads to the loss of these cells. Interestingly, the effect on ciliogenesis is consistent with the role of FGF signaling in zebrafish, whereas the loss of bilateral Nodal expression is in line with the hypomorpic Fgf8 mutant mouse. The description of these two successive functions in Xenopus indicates a higher degree of conservation of the role of FGF signaling than suggested so far. The FGF signaling pathway splits into several branches, two of which play important roles in the early development of Xenopus embryos. Activation of MAPK signaling is implicated in the induction of mesoderm, whereas the PLC/PKC/Calcium signaling branch impacts on morphogenetic movements. FGF-mediated control of Foxj1 expression was temporally Abstract correlated with FGF signaling that acts on mesoderm specification. As a consequence, mesodermal gene expression and blastopore closure was seriously affected by loss of FGF signaling at early gastrula stages. By starting inhibition experiments during gastrula stages, when mesoderm induction is almost finished, general mesoderm specification defects were avoided but the effect on the somitic GRP cells persisted. To unravel which FGF-induced signaling branch acted on the two different functions of FGF described here, the PLC/PKC/Calcium signaling branch was inhibited using the antagonist Sprouty1. Sprouty1 gain of function experiments had no effect on ciliogenesis, but caused loss of somitic GRP cells comparable to loss of function experiments using the FGF receptor antagonist. This suggests that the FGF-dependent formation of these cells is regulated by the PLC/PKC/Calcium pathway. A specific role of Calcium was supported by experiments using a calcium-permeable channel. Despite this, ciliogenesis was not affected by inhibition of PLC/PKC/Calcium, suggesting a role of MAPK for the early function of FGF. In conclusion, this work demonstrates two functions of FGF signaling in Xenopus LRdevelopment, which furthermore are consistent with a conserved function of FGF signaling in vertebrate LR-axis determination. Novel insights into the role of FGF signalling in the very cells which sense leftward flow at the lateral margin of the GRP will open new approaches to analyse laterality specification in more detail. Inhaltsverzeichnis Inhaltsverzeichnis Einleitung Die Embryogenese der Wirbeltiere 1 Xenopus laevis als Modellorganismus der Entwicklungsbiologie 2 Die Entstehung der dorso-ventralen und anterior-posterioren Körperachsen 3 Die Spezifizierung der Keimblätter und Gastrulation 5 Die LR-Achse weist Asymmetrien bezüglich der inneren Organe auf 7 Die Nodal-Genkaskade im linken Seitenplattenmesoderm bestimmt die die asymmetrische Positionierung der Organe 8 Motile primäre Cilien im Zentrum des Symmetriebruchs 9 Morphogenese und Spezifizierung des LR-Organisators von Xenopus laevis 11 Die Umsetzung des linksgerichteten Flüssigkeitsstroms: Morphogen- versus Zwei-Cilien-Modell 14 Die Bedeutung der bilateralen Expression von Nodal für den Transfer linkspezifischer Information 15 Der Symmetriebruch des Huhns nimmt innerhalb der Wirbeltiere eine Sonderstellung ein 18 Der FGF-Signalweg als zentraler Regulator der Embryogenese 19 Der FGF-Signalweg 19 Sprouty als negativer Regulator des FGF-Signalwegs 21 FGF-abhängige Induktion und Aufrechterhaltung mesodermaler Gene 21 Die Bedeutung des FGF-Signalwegs für konvergente Extensionsbewegungen 22 FGF-Signalaktivität in der LR-Achsenentwicklung der Wirbeltiere 23 Arbeitshypothese 25 Inhaltsverzeichnis Ergebnisse Funktionsverlustexperimente zur Darstellung der FGF-vermittelten Funktion 26 Inhibition der FGF-Signalaktivität bewirkt einen Verlust der asymmetrischen Genexpression 26 Kompetenz der Seitenplatte zur Expression von Pitx2c nach SU5402-Inkubation 31 FoxJ1-abhängiger Einfluss der FGF-Signalaktivität auf die LR-Achsenentwicklung 32 FoxJ1-/Cilien-unabhängiger Einfluss der FGF-Signalaktivität auf die LR-Achsenentwicklung 35 FGF-Signalaktivität beeinflusst die paranotochordale Expression von Xnr1 und Coco 39 Expression der paranotochordalen Xnr1-Domäne tritt in den somitischen GRP-Zellen auf 43 FGF-Signalaktivität beeinflusst die Bildung somitischer GRP-Zellen 45 Auswirkungen der SU4502-Inkubationen auf mesodermale Genexpressionen 50 Vergleich der SU5402-Inkubationen ab St.12-12,5 mit Inkubationen ab St.12,5-13 51 Keine verminderte Zellproliferation durch SU5402-Inkubation 54 Keine erhöhte Apoptose durch SU5402-Inkubation 55 Überexpression von Spry1 übt keinen Effekt auf die Expression von FoxJ1 aus 59 Verlust der paranotochordalen Xnr1- und Coco-Domäne nach Überexpression von Spry1 60 Verlust somitischer GRP-Zellen nach Überexpression von Spry1 61 Geringer Effekt auf mesodermale Genexpression nach Überexpression von Spry1 63 Pkd2-Knockdown führt ebenfalls zum Verlust der somitischen GRP-Zellen 65 Spry1 und Pkd2 wirken gemeinsam auf die paranotochordale Xnr1und Coco-Domäne 66 Thapsigargin-Inkubationsexperimente zur Inhibierung von intrazellulärem Calcium 68 Spry1 und Wnt11b wirken gemeinsam auf die paranotochordale Xnr1- und Coco-Domäne 70 Inhaltsverzeichnis Diskussion FGF-Signalaktivität als Determinante der Lateralitätsentwicklung von Xenopus 73 Konservierte und nicht konservierte Funktionen von FGF-Signalaktivität 75 Warum fehlen Sensorzellen der GRP nach FGF-Funktionsverlust? 80 1) Umspezifizierung zu entodermalen Zellen 80 2) Somitische GRP-Zellen sind schon frühzeitig in den Somitenverbund integriert 81 3) Somitische GRP-Zellen sind in den epithelialen Bereich der medialen GRP integriert 81 Welche FGF-vermittelten Signaltransduktionen wirken auf die Lateralitätsentwicklung? 83 PLC/PKC/Calcium-unabhängige Signaltransduktion wirkt auf FoxJ1 84 MAPK-unabhängige Signaltransduktion wirkt auf die Sensorzellen der GRP 84 FGF-Signalaktivität wirkt über Calcium auf die Sensorzellen der GRP 85 FGF-Signalaktivität könnte über den kanonischen Wnt-Signalweg auf FoxJ1 wirken 87 Modell des Zusammenspiels von Calcium mit anderen Signalwegen in der Spezifizierung der Sensorzellen des LR-Organisators 91 Material und Methoden 98 Literaturverzeichnis 110 Lebenslauf 127 Danksagung 129 Abbildungsverzeichnis Abbildungsverzeichnis Abb. 1 Die GRP bildet sich aus den superfiziellen Mesodermzellen der Gastrulastadien 12 Abb. 2 Frühe LR-Achsenentwicklung von Xenopus laevis 17 Abb. 3 FGF-vermittelte Signaltransduktion 20 Abb. 4 SU5402-Inkubationen lassen ein Zeitfenster erkennen, indem die Inhibition der FGF-Signalaktivität den Verlust der asymmetrischen Pitx2cExpression bewirkt 27 FGF-Signalaktivität in der GRP ist notwendig für die Induktion der NodalGenkaskade 30 Kompetenz der Seitenplatte bei SU5402-Inkubationen ab der mittleren/ späten Gastrula 31 Abb. 7 Abhängigkeit der FoxJ1-Expression von der FGF-Signalaktivität 34 Abb. 8 SU5402-Inkubationen ab mittleren/späten Gastrulastadien üben keinen Effekt auf die Ciliogenese der GRP aus 36 niedrige Konzentrationen von dnFGFR1 üben keinen Effekt auf GRPCilienlänge aus 38 Verlust der paranotochordalen Xnr1-/Coco-Expression durch Inhibition der FGF-Signalaktivität 40 Abb. 11 Xnr1-Expression in den somitischen Zellen der GRP 44 Abb. 12 Inhibition von FGF-Signaltransduktion führt zum Verlust der somitischen GRP 46 Abb. 13 FGF-Signalaktivität determiniert die somitischen GRP-Zellen 49 Abb. 14 Reduktion mesodermaler Genexpression durch SU5402-Inkubationen 51 Abb. 15 Vergleich zwischen SU5402-Inkubationen ab St.12-12,5 und St.12,5-13 52 Abb. 16 Keine Verminderung der Zellproliferationsrate nach Applikation von SU5402 55 Abb. 17 Keine apoptotischen Zellen im Bereich der GRP nach Applikation von SU5402 56 Verlust der somitischen GRP-Zellen nach SU5402-Inkubation kann nicht durch Koinjektion von Bcl-XL verhindert werden 58 Abb. 19 Expressionsanalyse von FoxJ1 und Tekt2 nach Überexpression von Spry1 59 Abb. 20 Expressionsanalyse der Xnr1- und Coco-Domäne nach Überexpression von Spry1 60 Überexpression von Spry1 führt zum Verlust der somitischen GRP-Zellen 62 Abb. 5 Abb. 6 Abb. 9 Abb. 10 Abb. 18 Abb. 21 Abbildungsverzeichnis Abb. 22 Expression mesodermaler Marker nach Überexpression von Spry1 64 Abb. 23 Verlust somitischer GRP-Zellen nach Pkd2-Knockdown 65 Abb. 24 Spry1-Überexpression und Pkd2-Knockdown wirken epistatisch auf die Expression von Xnr1 und Coco 66 Pkd2-Funktionsgewinn rettet den Verlust der paranotochordalen Xnr1-Expression nach Spry1-Überexpression 67 Thapsigargin-Inkubation bewirkt Verlust der paranotochordalen Xnr1-Expression 69 Wnt11b-MO und Spry1-mRNA wirken epistatisch auf die Expression von Xnr1 und Coco 71 Abb. 28 FGF-Signalaktivität in der LR-Achsenentwicklung der Wirbeltiere 76 Abb. 29 Modell: LR-spezifische Funktionen der FGF-Signalaktivität werden über unterschiedliche Signaltransduktionswege reguliert 83 Abb. 30 Modell der Wirkung von FGF-Signalaktivität auf die Expression von FoxJ1 88 Abb. 31 Modell des Zusammenspiels von Calcium mit anderen Signalwegen in der Spezifizierung der Sensorzellen 93 Abb. 25 Abb. 26 Abb. 27 Einleitung Einleitung Die Embryogenese der Wirbeltiere In der Embryonalentwicklung vielzelliger Tiere finden wichtige Prozesse wie Furchungsteilungen, Blastulation, Gastrulation, Organogenese und Gewebebildung statt, wobei die Ausrichtung der Körperachsen und die Körpergrundgestalt des Embryos festgelegt werden. Die Embryogenese beginnt nach der Befruchtung der Eizelle, indem sich die entstandene Zygote in den Furchungsteilungen mehrmals schnell hintereinander bis zur Bildung der Blastula teilt. Nun beginnt die Spezifizierung der Keimblätter, welche im Zuge der Gastrulation umorganisiert werden, sodass sie an ihren entsprechenden Positionen zu liegen kommen. Bilateral symmetrische Tiere besitzen als Triploblasten neben dem Entoderm und Ektoderm ein drittes Keimblatt, das Mesoderm. Nach Abschluss der Gastrulationsbewegungen befindet sich das Entoderm im Inneren des Embryos, das Ektoderm bildet die Außenhülle des Embryos und das Mesoderm liegt zwischen Entoderm und Ektoderm. Während der Organogenese entstehen aus dem Entoderm unter anderem der Verdauungstrakt und ihm assoziierte Organe. Aus dem Mesoderm werden die Knochen, die Muskulatur und das Blutgefäßsystem gebildet und aus dem Ektoderm gehen die Haut und das Nervensystem hervor. Dabei spaltet sich während der Neurulation das neurale Ektoderm vom hautbildenden Ektoderm ab und wird ebenfalls ins Innere des Embryos verlagert. Am Ende der Embryonalentwicklung entsteht durch Zellteilung, Zellwanderung und Zelldifferenzierung ein Organismus mit diversen Zell- und Gewebetypen und drei Körperachsen. Gesteuert wird dies durch eine Handvoll konservierter Signalwege, die im Zusammenspiel agieren und jeweils diverse musterbildende Prozesse regulieren (Wolpert et al., 2007). Im Zentrum dieser Arbeit steht der Signalweg der Fibroblasten-Wachstumsfaktoren („fibroblast growth factor“; FGF). Dieser ist unter anderem in Entwicklungsprozessen wie der Induktion von Mesoderm und Neuralgewebe, der anterior-posterioren (AP) Musterbildung, der Extremitäten-Entwicklung, in Zellbewegungen und in morphogenetischen Veränderungen involviert (Thisse and Thisse, 2005; Pownall and Isaacs, 2010). In dieser Dissertation wird die Rolle des FGF-Signalwegs in der Lateralitätsentwicklung von X. laevis analysiert. Im Folgenden werden die Embryonalentwicklung dieses Modellorganismus, bisherige Erkenntnisse über die 1 Einleitung Entstehung der Links-Rechts (LR) Achsenasymmetrie und wichtige Grundlagen des FGFSignalwegs zusammengefasst. Xenopus laevis als Modellorganismus der Entwicklungsbiologie Die Etablierung als international verbreiteter Modellorganismus von X. laevis, der ursprünglich in Mittel- und Südafrika heimisch ist, ist unter anderem seiner früheren Verwendung zur Feststellung einer Schwangerschaft zu verdanken. Basierend auf der Entdeckung von Lancelot Hugben, dass die Injektion des Urins schwangerer Frauen die Ovulation von X. laevis induziert, verbreitete sich X. laevis in den 1940er und 1950er Jahren aufgrund der Nachfrage nach Schwangerschaftstest in Europa und Nordamerika. Für die dort ansässigen Entwicklungsbiologen, welche bis dato auf einheimische Amphibien und ihre saisonale Ovulation angewiesen waren, bot X. laevis mit seiner einfachen Haltung und der ganzjährig möglichen Ovulation durch Injektion des Schwangerschaftshormon Choriongonadotropin einen entscheidenden Vorteil. Neben dem Feld der Entwicklungsbiologie fand X. laevis auch Anwendung in den damals aufstrebenden Interessensgebieten der biochemischen, zellulären und genetischen Vorgänge, womit er sich als Modellorganismus durchsetzte. Methoden der Mikrochirurgie und Embryonenkultur, wie sie schon für andere Amphibien entwickelt waren, wurden für die Anwendung bei X. laevis optimiert (Gurdon and Hopwood, 2000). Bis heute bietet X. laevis viele Vorteile, die ihn zu einem beliebten Modellorganismus machen. Die Größe seiner Eier ermöglicht eine leichte Handhabung bei der Injektion spezifischer Substanzen oder gezielte mikrochirurgische Eingriffe, wie z.B. die Transplantation von bestimmten Gewebearealen. Die externe Entwicklung ist ideal für die zeitlich festgelegte Inkubation mit Substanzen, die einfach zum Kulturmedium zugegeben und auch wieder ausgewaschen werden können, während in vivo die dadurch hervorgerufenen Phänotypen zu beobachtet sind. Die große Anzahl an Eiern (mehrere hundert Eier pro Gelege) ermöglicht zudem die Manipulation vieler Embryonen zur quantitativen Auswertung der beobachteten Phänotypen. Durch die unterschiedliche Pigmentierung der Blastomeren lässt sich schon im 4-Zellstadium das spätere Zellschicksal der einzelnen Blastomere erkennen. Dadurch wird eine gezielte Injektion ermöglicht, damit die Manipulation nicht per se den ganzen Embryo trifft. So wird beispielsweise die Aufdeckung einer Genfunktion in einem bestimmten Bereich des Embryos ermöglicht. Zur Untersuchung der LR- 2 Einleitung Achsenentwicklung lässt sich damit gezielt die linke oder rechte Seite manipulieren und die uninjizierte Seite kann als interne Kontrolle dienen. Die Entstehung der dorso-ventralen und anterior-posterioren Körperachsen Die frühe Festlegung der Köperachsen ist für die Musterbildung des Embryos entscheidend. So werden durch die Spezifizierung der AP-Achse, die sich entwickelnden anterioren Strukturen, wie der Kopf, von posterioren Strukturen, wie dem Schwanz, räumlich getrennt, während sich Rücken und Bauchstrukturen entlang der dorso-ventralen (DV) Achse ausrichten. Die LR-Achse, die später die asymmetrische Ausrichtung der inneren Organe gewährleistet, wird als letzte der drei Körperachsen spezifiziert. Im primären Symmetriebruch von Xenopus sind maternale Faktoren des Eies involviert, welche asymmetrisch entlang der animal-vegetalen Achse abgelegt sind und durch die somit eine Polarität der unbefruchteten Eizelle entsteht. Von außen betrachtet lässt sich diese Polarität anhand der Pigmentierung erkennen. So ist die animale Hemisphäre dunkel pigmentiert und schützt den Embryo vor der mutagenen Wirkung des UV-Anteils der Sonneneinstrahlung. Die animal-vegetale Achse entspricht in etwa der späteren APAchse. Die Ausrichtung der DV-Körperachse wird durch den Eintrittsort des Spermiums festgelegt. Durch den Spermiumeintritt, der nur in der animalen Hemisphäre stattfinden kann, kommt es zu einer Umorganisation von Mikrotubuli und einer Rotation des Zellcortex in Richtung des Eintrittsorts (Vincent and Gerhart, 1987; Gerhart et al., 1989). Zeitgleich werden vegetal abgelegte maternale Faktoren entlang der Rotationsbewegung verschoben und legen die dorsale Seite fest. Somit entsteht die dorsale Seite gegenüber dem Spermiumeintrittsorts, welcher wiederum zur ventralen Seite wird. Die Rotation des Zellcortex kann dabei für die Verschiebung der dorsalen Determinanten nicht ausreichend sein. So verschiebt sich der Zellcortex durch die Rotation nur um 30 Grad, während die dorsalen Faktoren, ausgehend vom vegetalen Pol bis in Nähe des Äquators verschoben werden und hierbei die Rotation des Cortex übertreffen. Die Entdeckung von Membran gebundenen Organellen, die sich schneller als die Rotation in dorsale Richtung bewegen, legte die Vermutung nahe, dass ihr Transport durch Motorproteine entlang der Mikrotubuli bewerkstelligt wird. Dabei hängen sowohl die kortikale Rotation als auch die Verschiebung der dorsalen Determinanten von der Umorganisation der Mikrotubuli ab. Diese befinden sich unter anderem im subcortikalen 3 Einleitung Bereich der vegetalen Hemisphäre und organisieren sich nach der Befruchtung zu parallelen Bündeln, deren Plus-Ende sich in Richtung der dorsalen Seite orientiert (Weaver and Kimelman, 2004; Houston, 2012). In Folge der Umlagerung dorsaler Determinanten wird ß-Catenin im Zellkern lokalisiert. Die Bedeutung, die ß-Catenin für die Spezifizierung der dorsalen Seite inne hat, lässt sich anhand von Embryonen verdeutlichen, deren maternales ß-Catenin via MorpholinoOligonukleotiden reduziert wurde und die einen Verlust dorsaler Strukturen aufweisen (Heasman et al., 1994). Ohne Aktivierung des kanonischen Wnt-Signalwegs wird ßCatenin normalerweise durch einen Proteinkomplex im Cytoplasma festgehalten, der durch Phosphorylierung via Casein Kinase 1α und Glykogen Synthase Kinase 3 (GSK-3) zur Ubiquitinylierung und Degradation von ß-Catenin führt. Die Bindung eines WntLiganden an seinen Rezeptor führt im kanonischen Signalweg zur Aktivierung von Dishevelled (Dsh), welches den Degradationskomplex inhibiert, sodass ß-Catenin stabilisiert wird und sich im Zellkern anreichern kann. Dort aktiviert ß-Catenin im Zusammenspiel mit Tcf/Lef Transkriptionsfaktoren die Expression seiner Zielgene (Sokol, 1999; Cadigan and Waterman, 2012). Als mögliche dorsale Determinanten werden mehrere Moleküle diskutiert, die im Zuge der cortikalen Rotation und Ausrichtung der Mikrotubuli vom vegetalen Pol der Zelle auf der dorsalen Seite akkumulieren, um die Stabilisierung von ß-Catenin zu gewährleisten (Weaver and Kimelman, 2004). Beispielsweise wirken Dsh und GBP („GSK3-binding protein“), ein Inhibitor der GSK-3, als intrazelluläre Vermittler des kanonischen WntSignalwegs, die auch unabhängig von der extrazellulären Aktivierung durch einen WntLiganden die dorsale Stabilisierung von ß-Catenin gewährleisten. So ist eine dorsale Anreicherung Dsh-positiver Vesikel-ähnlicher Organellen nach Beendigung des ersten Zellzyklus zu beobachten (Miller et al., 1999). Mittels GFP-Markierung von Dsh und GBP konnte für beide Proteine eine Bewegung in Richtung der kortikalen Rotation gezeigt werden. Dabei kann GBP sowohl an die leichte Kette der Kinesine als auch an Dsh binden (Weaver et al., 2003). Kinesin-Motorproteine bewegen sich entlang von Mikrotubuli vom Minus-Ende in Richtung Plus-Ende. Somit könnte der dorsale Transport dieser Determinanten über die Kinesin-Bewegung entlang der Mikrotubuli vermittelt werden (Weaver and Kimelman, 2004). Dass zudem eine Liganden-abhängige Aktivierung des kanonischen Wnt-Signalwegs für die dorsale Stabilisierung von ß-Catenin notwendig ist, 4 Einleitung zeigt sich durch den Verlust von maternalem Wnt11 oder Wnt5 (Tao et al., 2005; Cha et al., 2008). Die Spezifizierung der dorsalen Achse durch ß-Catenin induzierte Genexpressionen beginnt nach der Midblastula-Transition (Beginn der zygotischen Gentranskription), während die Anreicherung von kernlokalisiertem ß-Catenin auf der dorsalen Seite des Embryos schon ab dem 16-32-Zellstadium zu beobachten ist (Larabell et al., 1997). In der zeitlichen Lücke, die zwischen der Anreicherung von ß-Catenin und der Aktivierung von Gentranskription besteht, ist ß-Catenin in den Zellkernen der dorsalen Seite wichtig für die Chromatinmodifikation der Promotorregionen (Blythe et al., 2010). Die Spezifizierung der Keimblätter und Gastrulation Die ersten zwölf Zellteilungen in der Entwicklung von Xenopus folgen zeitlich rasch aufeinander. Während dieser Entwicklungsphase nimmt der Embryo nicht an Größe zu, da in diesen Zellzyklen die Replikation der DNA, Mitose und Zellteilung direkt aufeinanderfolgen, ohne dass dazwischen Phasen des Zellwachstums benötigt werden. Im Stadium der Midblastula-Transition besteht der Embryo aus etwa 4000 Zellen und hat die Form einer Kugel. Dieses Stadium ist bei den meisten Wirbeltieren gekennzeichnet durch einen flüssigkeitsgefüllten Hohlraum, das Blastocoel, welcher durch aktive Ionentransportvorgänge gebildet wird. Das Blastocoel trennt die animale Polkappe von dem äquatorialen und vegetalen Bereich. Ab diesem Stadium verlängert sich die Dauer der einzelnen Zellzyklen, da nun zygotische Gentranskription stattfindet und die Interphase neben der Synthesephase auch die Lückenphase zur Ergänzung von Zellbestandteilen aufweist. Ermöglicht wird das späte Einsetzen zygotischer Genaktvität durch maternale Vorräte, die beispielsweise die Replikation der DNA ermöglichen. Durch weitere maternale Faktoren wie mRNAs, die für Transkriptionsfaktoren codieren und die schon in der Oocyte lokalisiert platziert werden, wird gewährleistet, dass verschiedene Gene in unterschiedlichen Arealen des Embryos transkribiert werden (Heasman, 2006). So findet sich beispielsweise maternale mRNA für den T-Boxtranskriptionsfaktor VegT angereicht in den vegetalen Zellen (Stennard et al., 1996). VegT ist entscheidend für die Spezifizierung des vegetalen Pols zu Entoderm und für die Mesoderminduktion in den darüberliegenden Zellen (Zhang and King, 1996; Zhang et al., 1998; Kofron et al., 1999). Mit Eintreten in die Midblastula-Transition induziert VegT die Transkription von Zielgene wie die der Nodal5 Einleitung verwandten Proteine, welche sezernierte Wachstumsfaktoren darstellen und als Morphogene agieren können (Chen and Schier, 2001). Morphogene sind dadurch charakterisiert, dass sie über gewisse Distanzen diffundieren können und in unterschiedlichen Konzentrationen verschiedene Genexpressionen anschalten. Nodal-verwandte Proteine induzieren in hohen Konzentrationen Entoderm während niedrigere Konzentrationen für die Induktion von Mesoderm ausreichend sind (Shen, 2007). Neben VegT wirkt auch nukleäres ß-Catenin auf die Expression Nodalverwandter Proteine, mit der Folge, dass diese in einem von dorsal nach ventral verlaufenden Gradienten exprimiert werden und bei höherer Aktivität dorsales Gewebe spezifizieren (Agius et al., 2000; Kimelman, 2006). Der vegetale Pol spezifiziert über die Nodal-verwandten Proteine das angrenzende Gewebe zu Mesoderm. Das über dem Mesoderm am animalen Pol liegende Gewebe entwickelt sich zu Ektoderm, da es durch das Blastocoel vor den induzierenden Faktoren des vegetalen Pols geschützt ist. Somit gliedert sich das Blastulastadium in einen vegetalen Pol aus Entoderm und einen animalen Pol aus Ektoderm, mit dem Mesoderm dazwischenliegend im äquatorialen Bereich, der sogenannten Randzone. Die Information über dorsale versus ventrale Identität wird durch die Aktivität des kanonischen Wnt-Signalweg vermittelt, der wie bereits oben beschrieben asymmetrisch auf der dorsalen Seite aktiviert wird. Durch das Zusammenspiel von ß-Catenin mit anderen maternalen Faktoren wird in der vegetalen dorsalen Region der Blastula das Nieuwkoop-Zentrum als initiales dorsales Signalzentrum ausgebildet. Es dient dafür, die Bildung des Spemann-Organisators in den darüber liegenden dorsalen Zellen der Randzone zu spezifizieren. Der Spemann Organisator als Signalzentrum ist wichtig für die Musterbildung der AP- und der DV-Achse und induziert die Bildung des Zentralen Nervensystems (Wolpert et al., 2007). Transplantiert man die Region des Spemann Organisators in den Bereich der ventralen Randzone so bildet sich eine zweite dorsale Achse aus (Spemann and Mangold, 1924). Aus dem dorsalen Mesoderm gehen später die Chorda dorsalis (axial; im Weiteren als Notochord bezeichnet) und die Somiten (paraxial) hervor, während sich aus dem dorsalen Ektoderm das Nervengewebe und aus dem ventralen Ektoderm die Haut bilden. Da der spätere Embryo von außen mit Ektoderm ummantelt ist, müssen das Mesoderm und das Entoderm im Zuge der Gastrulation ins Innere des Embryos umgelagert werden. Für das Auftreten von Gastrulationsbewegungen spielen Änderungen in der Zellform, Zelladhäsion und die Zellmotilität eine wichtige Rolle. Zu Beginn der Gastrulation werden im 6 Einleitung Äquatorialbereich, auf der dorsalen Seite beginnend, die sogenannten Flaschenhalszellen gebildet. Durch apikale Konstriktion verändern sie ihre Zellform und bilden eine Vertiefung, welche die dorsale Urmundlippe festlegt. Die dorsale Urmundlippe entspricht dem Spemann Organisator. Durch Involution (Einrollen als zusammenhängendes Gewebe) und konvergente Extensionsbewegungen (siehe unten) wandern die Zellen des Ento- und des Mesoderms dann ins Keiminnere ein, während durch Epibolie (Ausbreitung über radiale Interkalation) die Öberfläche des Ektoderms vergrößert wird. Mit fortschreitender Gastrulation breitet sich die Bildung der Urmundlippe nach ventral aus, sodass sich der ringförmige Blastoporus bildet. Sind beide Keimblätter eingewandert, wobei das Entoderm nun den Urdarm, das Archenteron oder Gastrocoel, auskleidet und das Mesoderm im tiefen Gewebe liegt, kommt es zur Neurulation, der Bildung und Einstülpung des Neuralrohres. In den Stadien der Neurulation findet zudem auch die Determinierung der LR-Achse statt (Solnica-Krezel, 2005; Gilbert, 2006; Wolpert et al., 2007). Die LR-Achse weist Asymmetrien bezüglich der inneren Organe auf Wirbeltiere weisen von außen betrachtet eine bilaterale Symmetrie auf. So lässt sich anhand der Augen, Ohren und Gliedmaßen eine spiegelbildliche Anordnung entlang der Mittellinie erkennen. Die inneren Organe sind dagegen nicht spiegelbildlich aufgebaut, sondern ordnen sich in ihrer Entwicklung asymmetrisch entlang der LR-Achse an (Wolpert et al., 2007). Die korrekte Lage und Morphologie der asymmetrisch angelegten Strukturen zueinander ist entscheidend für ihre Funktion. Ist dies gegeben so spricht man von Situs solitus. Wenn alle Organe im Bezug zueinander in einer vollständig umgekehrten Position entlang der LR-Achse angeordnet sind, wird dies als Situs inversus (oder auch Situs inversus totalis) bezeichnet. Unter Situs ambiguus (oder auch Situs inversus partialis) versteht man dagegen die Situation, wenn ein Teil der Organe richtig entlang der LRAchse angeordnet ist, während der andere Teil es nicht ist. Zudem können die linke oder rechte Seite auch die inneren Organe betreffend ein Spiegelbild ihrer selbst darstellen, dies bezeichnet man dann als Isomerismus (linker Isomerismus: Polysplenia; rechter Isomerismus: Asplenia; Hackett, 2002). Während der Situs inversus totalis, der mit einer Häufigkeit von etwa eins zu 8500 auftritt, keine gesundheitsgefährdenden Symptome nach sich zieht, haben der Situs ambiguus und Organisomerismen oft schwerwiegende Folgen (Brueckner, 2007; Wolpert et al., 2007). 7 Einleitung Die Nodal-Genkaskade im linken Seitenplattenmesoderm bestimmt die asymmetrische Positionierung der Organe Die asymmetrische Entwicklung entlang der LR-Achse wird über eine innerhalb der Vertebraten konservierte Genkaskade vermittelt, welche die linke Seite spezifiziert und sie von der rechten Seite unterscheidbar macht (Hamada et al., 2002). Diese sogenannte Nodal-Genkaskade tritt im Stadium der Neurulation als Folge des Symmetriebruchs auf. Damit stellt die LR-Achse die Körperachse dar, die als letzte im Laufe der frühen Embryonalentwicklung spezifiziert wird. Die Nodal-Genkaskade wirkt als Determinante der linken Seite, da ihr Vorhandensein im Seitenplattenmesoderm die linksspezifische Morphologie bestimmt, während ihr Fehlen die rechtsspezifische Morphologie vermittelt. So weisen beide Körperhälften bei einer fehlenden Nodal-Genkaskade eine rechtsspezifische Anordnung der inneren Organe (rechter Isomerismus) auf, während der Organismus einen linken Isomerismus aufweist, wenn die Genkaskade auf beiden Seiten exprimiert wird (Hamada et al., 2002). Nodal oder Nodal-verwandte Proteine gehören zu den TGFß-Wachstumsfaktoren und aktivieren wie die meisten Mitglieder dieser Familie Serin-/Threonin-Kinase-Rezeptoren, welche wiederum durch Phosphorylierung von Smad Proteinen die Gentranskription regulieren. Als Dimere aktivieren sie ihren Signalweg über Bindung an Typ-2-Aktivinrezeptoren, die daraufhin mit Typ-1-Aktivinrezeptoren einen heterotetrameren Komplex bilden, um als Serin-/Threonin-Kinasen zu agieren. Im Gegensatz zu anderen TGFß-Liganden wie Derrière oder Aktivin benötigen Nodal-Proteine Korezeptoren der EGF-CFC-Familie. Im Nodal-Signalweg führt die Rezeptoraktivierung zur Phosphorylierung der Transkriptionsfaktoren Smad2 und Smad3, die daraufhin mit Smad4 einen Komplex bilden. Dieser Komplex wandert in den Zellkern und reguliert im Zusammenspiel mit anderen Transkriptionsfaktoren wie FoxH1 oder Mixer die Gentranskription (Shen, 2007b; Schier, 2009). Während Maus, Huhn und Mensch nur über ein Nodal-Protein verfügen, existieren mehrere Homologe in den Modellorganismen Krallenfrosch und Zebrabärbling. Im Krallenfrosch wird das Nodal-verwandte Protein Xenopus-Nodal-related 1 (Xnr1) im Zuge der asymmetrischen Genkaskade im linken Seitenplattenmesoderm exprimiert (Lowe et al., 1996). Die Nodal-Genkaskade beginnt mit der Expression von Nodal/Xnr1 im posterioren Bereich des Seitenplattenmesoderms und weitet sich in anteriore Richtung aus, da der Nodal8 Einleitung Signalweg seine eigene Expression im Sinne einer positiven Rückkopplung verstärkt. Hierbei agiert der EGF-CFC-Faktor Cryptic als Korezeptor, der unter anderem im Seitenplattenmesoderm und in der Mittellinie exprimiert wird und durch seine bilateral symmetrische Expression auch die ektopische Induktion der Nodal-Genkaskade auf der rechten Seite ermöglicht. Dass Cryptic nicht im paraxialen Mesoderm exprimiert wird, liefert eine mögliche Erklärung warum sich die asymmetrische Genkaskade nicht auf diesen Bereich ausbreitet (Shen et al., 1997; Gaio et al., 1999; Yan et al., 1999). Neben seiner eigenen Expression induziert Nodal die Expression von Lefty-Proteinen, die ebenfalls zur TGFß-Familie zählen. Lefty-Proteine verhindern durch Interaktion mit EGFCFC-Proteinen oder Nodal selbst die Rezeptorbindung und beschränken so als Antagonisten die räumlich und zeitliche Expression der Nodal-Genkaskade (Meno et al., 1998, 2001; Nakamura et al., 2006; Müller et al., 2012). In der Seitenplatte wird neben Lefty2 die Expression des Homeoboxtranskriptionsfaktor Pitx2c als Teil der asymmetrischen Genkaskade von Nodal induziert. Pitx2c überdauert zeitlich die Expression von Nodal bis zur Bildung der Organanlagen und gilt als Mediator der asymmetrischen Organmorphogenese (Campione et al., 1999; Schweickert et al., 2000; Shiratori et al., 2001; Hamada et al., 2002). So weisen Mausembryonen denen spezifisch Pitx2c in der Seitenplatte fehlt, Defekte in der asymmetrischen Morphogenese vieler Organe auf (Liu et al., 2001; Shiratori et al., 2006; Simard et al., 2009). Beispielweise vermittelt Pitx2c die erste morphologische Asymmetrie des Darmrohres bei Amnioten, eine Schrägstellung zur linken Seite, über Seitenunterschiede in der extrazelullären Matrix und in Zell-Zelladhesionen des dorsalen Mesenteriums (Davis et al., 2008; Kurpios et al., 2008). In allen bisher untersuchten Wirbeltieren, außer dem Huhn, auf das später noch eingegangen wird, konnte gezeigt werden, dass der Symmetriebruch auf einem von motilen primären Cilien erzeugten linksgerichteten Flüssigkeitsstrom beruht. Motile primäre Cilien im Zentrum des Symmetriebruchs Die den linksgerichteten Flüssigkeitsstrom generierenden Cilien zählen zu den sogenannten primären Cilien. Primäre Cilien lassen sich auf fast allen Zellen der Wirbeltiere finden. Als motile Cilien können sie extrazelluläre Flüssigkeitsbewegungen generieren oder einzelne Zellen bewegen, während immotile Cilien, wie beispielsweise die 9 Einleitung der Riechzellen oder Photorezeptorzellen, sensorische Funktionen wahrnehmen (Berbari et al., 2009). Das Axonem, das Skelett des Ciliums, ist aus neun peripheren MikrotubuliDuplets und einer variablen Anzahl zwischen keinem, einem oder zwei inneren Mikrotubuli-Duplets aufgebaut (Feistel and Blum, 2006). Die benachbarten MikrotubuliDuplets sind bei motilen Cilien durch Dyneinarme verbunden, welche die Motilität gewährleisten (Hirokawa et al., 2009). Erste Hinweise, die einen Zusammenhang zwischen motilen Cilien und der korrekten Etablierung der LR-Achse erkennen ließen, lieferten Untersuchungen des humanen Karthagener-Syndroms (Afzelius, 1976). Später wurde in der Maus eine mit beweglichen Monocilien besetzte transiente Struktur, urspünglich als „node“ benannt, beschrieben, die wichtig für die Bildung der LR-Achsendeterminierung ist (Sulik et al., 1994; Harvey, 1998; Nonaka et al., 1998). Aufgrund von Untersuchungen zur genaueren Identität dieser Struktur wird sie bezüglich ihrer Lage auch als posteriores Notochord (PNC) bezeichnet (Blum et al., 2007). Die Bedeutung ihrer Monocilien wird anhand von Kif3b KnockoutMäusen deutlich. Kif3b codiert für eine Untereinheit des heterotrimeren Kinesin-3Komplexes, wobei Kinesine als Motorproteine für die Ciliogenese essentiell sind. Kif3b Knockout-Mäuse bilden keine Monocilien auf dem PNC aus und weisen LRAchsendefekte auf (Nonaka et al., 1998). Den Beweis, dass die Motilität dieser Cilien essentiell ist, lieferten Arbeiten an der „situs inversum viscerum“ (iv) Mauslinie, die eine randomisierte Expression der asymmetrischen Markergene besitzt (Lowe et al., 1996; Meno et al., 1996; Campione et al., 1999). Entscheidend war hierbei die Aufdeckung der für die LR-Defekte kausalen Mutation in der schweren Kette des axonemalen „left-right dynein“ (lrd), welches in den PNC-Monocilien der Maus exprimiert wird (Supp et al., 1997, 1999). Da axonemale Dyneine die Motiltät von Cilien gewährleisten, sind die Monocilien des PNC von iv-Mäusen unbeweglich (Okada et al., 1999). Neben der Maus konnte auch für die Modellorganismen Kaninchen, Zebrabärbling und Xenopus ein mit motilen Monocilien besetztes Epithel im Bereich des posterioren Notochords beschrieben werden. Dieses wird im Kaninchen ebenfalls als „node“ oder PNC, im Zebrabärbling als Kupffer’sches Vesikel (KV) und im Krallenfrosch als Dachplatte des Gastrocoels („gastrocoel roof plate“;GRP) bezeichnet (Essner et al., 2002, 2005; Okada et al., 2005; Blum et al., 2007; Schweickert et al., 2007). Die Monocilien sind am posterioren Pol der jeweiligen Zellen verankert und führen eine rotierende Bewegung aus, die mit Sicht auf die apikale Seite des Epithels im Uhrzeigersinn verläuft. Durch die 10 Einleitung konvexe Wölbung der Zelloberfläche ist die Rotationsachse in posteriore Richtung gekippt. Dies führt dazu, dass sich die Cilien in ihrer linksseitigen Drehung in einiger Distanz zur Zelloberfläche befinden, während sie sich im Zuge der rechtsseitigen Drehung nahe der Zelloberfläche befinden. Dies hat wiederum zur Folge, dass die linkseitige Drehung effektiver wirkt als die rechtsseitige. Dadurch entsteht ein nach links gerichteter Flüssigkeitsstrom, der durch Applikation fluoreszierender Latex-Kügelchen visualisiert werden kann (Hirokawa et al., 2006; Schweickert et al., 2007). Da die Etablierung LRasymmetrischer Genexpressionen durch das den Flüssigkeitsstrom-generierende Epithel gewährleistet wird, kann es auch als Organisator der LR-Achse bezeichnet werden. Die Bedeutung des LR-Organisators lässt sich im Frosch veranschaulichen, indem man die Viskosität von Methylcellulose und die Injektion dieser ins Archenteron von Neurulastadien nutzt, um den linksgerichteten Flüssigkeitsstrom zu unterbinden. Injektionen, die vor Beginn des linksgerichteten Flüssigkeitsstromes durchgeführt werden, verhindern bei fast 50% der Embryonen die Induktion asymmetrischer Markergene der Seitenplatte (Schweickert et al., 2007). Neben dieser mechanischen Inhibition lässt sich der Flüssigkeitsstrom molekular durch den Knockdown der axonemalen schweren Dyneinketten („dynein axonemal heavy chain“) Dnah5 und Dnah9, die beide in der GRP des Krallenfrosches exprimiert werden, inhibieren. Dies hat wie die Applikation von Methylcellulose ein Fehlen der asymmetrischen Genexpression zur Konsequenz (Vick et al., 2009). Somit stellt das posteriore Ende des Notochords im Frosch gleichsam den „Organisator“ der LR-Achse dar und die Morphogenese der GRP ist damit essentiell für den Symmetriebruch. Morphogenese und Spezifizierung des LR-Organisators von Xenopus laevis Vor Beginn der Gastrulation besteht die Randzone aus einer superfiziellen epithelialen Schicht und den tiefen mesenchymalen Zellen des Mesoderms. Zellen der superfiziellen Randzone lassen sich in entodermale und mesodermale Zellen einteilen, wobei die mesodermalen superfiziellen Zellen sich im dorsalen Bereich befinden. Während durch Involution das tiefe mesenchymale Mesoderm zu seiner endgültigen Lage zwischen der entodermalen Auskleidung des Gastrocoels und dem Ektoderm zu liegen kommt, stellt das superfizielle Mesoderm eine Besonderheit dar. Es kleidet nach Abschluss der Gastrulation das epitheliale Dach des Gastrocoels aus und wird erst gegen Ende der Neurulation durch 11 Einleitung Ingression in die darunterliegende mesenchymale Schicht verlagert (Keller et al., 2003; Shook et al., 2004). Im Jahr 2004 wurde das superfizielle Mesoderm von X. laevis erstmals beschrieben. Durch Biotinylierung von Blastulaembryonen war es möglich, ausschließlich die epithelialen Zellen zu markieren, um sie von den mesenchymalen Zellen abzugrenzen und ihre spätere Integration in die tiefen Schichten des Mesoderm zu verfolgen. Zudem konnte durch eine rasterelektronenmikroskopische Analyse die GRP näher charakterisiert und die Existenz ihrer Monocilien dargestellt werden. Dabei lassen sich die GRP-Zellen morphologisch von den flankierenden, großen Entodermzellen unterscheiden. Die GRP selbst wird in zwei Zonen eingeteilt, in eine mediale und zwei randständige, deren Zellen entweder der Notochord (medial) oder den Somiten (randständig) aufliegen. Beide Zonen können optisch anhand der Grenze, die sich in den tiefen Schichten zwischen dem Notochord und den Somiten erkennen lässt und sich bis an die Oberfläche des Gastrocoels fortsetzt, unterschieden werden. Posterior setzt sich die GRP bis in die dorsale Region des „circum blastoporal collars“ (CBC) fort (Shook et al., 2004). Der CBC stellt eine Verdickung dar, die sich ringförmig um den Blastoporus zieht, und besteht aus mesodermalem Gewebe, das im Laufe der Entwicklung zur posterioren Verlängerung der Somiten und des Notochords beiträgt (Keller, 1976; Keller et al., 1989). Abbildung 1: Die GRP bildet sich aus den superfiziellen Mesodermzellen der Gastrulastadien (A,B) Schematische Darstellungen eines sagittalen Anschnittes von Embryonen im Gastrula (A) und Neurulastadium (B). (A) Das superfizielle Mesoderm (grün) befindet sich epithelial oberhalb der dorsalen Urmundlippe (dl). (B) Nach Einwanderung des Entoderms (gelb) und Mesoderms (rot) wird der Embryo von außen mit Ektoderm (blau) bedeckt. Die mesodermalen Zellen liegen im tiefen Gewebe zwischen dem Entoderm und dem Ektoderm. (B’) Das superfizielle Mesoderm bildet transient die Dachplatte des Gastrocoels (GRP; grün in B’) und wird lateral von entodermalen Zellen („lateral endodermal cells“;LECs) begrenzt. (C) Rasterelektronenmikroskopische Aufnahme der GRP (aus Schweickert et al., 2007). Cilien fangen im Neurulastadium 14 (C’) an auszuwachsen. Im Neurulastadium 19 (C’’) sind sie vollständig ausgewachsen und lokalisieren am posterioren Pol der Zelle. a, anterior; an, animal; ar, archenteron; bc, Blastocoel; bp, Blastoporus; CBC, „circum blastoporal collar“; d, dorsal; l, links; p, posterior; r, rechts; v, ventral; veg, vegetal; Schemazeichnungen Bernd Schmid, Hohenheim Da die GRP nur eine transiente Struktur darstellt, werden die lateralen Zellen später durch apikale Konstriktion und Ingression (X.laevis) in den Verbund der Somiten integriert, 12 Einleitung während die Zellen der medialen Zone zur Bildung des Notochords oder des Hypochords beitragen (Shook et al., 2004). Die Spezifizierung des superfiziellen Mesoderm auf der dorsalen Seite wird durch den kanonischen Wnt-Signalweg gewährleistet. Hierbei spielt Serotonin, welches mit Beginn der Blastula-Stadien zunehmend in der superfiziellen Schicht der gesamten Randzone angereichert wird, eine Rolle als Kompetenzfaktor. Als Folge der Spezifizierung wird das Masterkontrollgen für motile Cilien FoxJ1, das entscheidend für die spätere Ciliogenese der GRP ist, im superfiziellen Mesoderm exprimiert (Beyer, Danilchik, et al., 2012). Nach Einwanderung der Zellen über den Blastoporus nimmt die Expression von FoxJ1 ab, während die von FoxJ1 aktivierten Gene Dnah9 und Tekt2 (codiert für Tektin2) in der GRP der Neurulastadien exprimiert werden. Tektin2 stellt ebenfalls ein Cilien-assoziiertes Protein dar, welches in Verbindung mit der Cilien-Motilität steht (Tanaka et al., 2004; Stubbs et al., 2008). Im frühen Neurulastadium (Stadium 14) beginnen die Cilien der GRP auszuwachsen, wobei sie in diesem Stadium meist medial an der apikalen Zelloberfläche lokalisieren. Mit fortschreitender Neurulation verlängern sich die Cilien und werden an den posterioren Pol der Zelloberfläche verlagert, sodass sich ab St.17 ein robuster linksgerichteter Flüssigkeitsstrom ausbilden kann. Dieser ist im St.19/20 nur noch schwach zu detektieren, da die Zellen der GRP zunehmend in das tiefe Gewebe einwandern (Schweickert et al., 2007). Neben dem kanonischen Signalweg, der hier für die initiale Spezifizierung der GRP entscheidend ist, spielen auch nicht-kanonische ß-Catenin-unabhängige Wnt- Signaltransduktionen eine Rolle für die Morphogenese der GRP. So vermittelt der nichtkanonische Wnt/PCP („planar cell polarity“) Signalweg, der den Zellen eine Polarität entlang ihrer planaren Achse verleiht, die posteriore Lokalisierung der Cilien (Antic et al., 2010; Song et al., 2010). Ob im Wnt-Signalweg nachgeschaltet zum Rezeptor kanonische oder nicht-kanonische Signaltransduktionen stattfinden, wird unter anderem durch die unterschiedlichen Liganden vermittelt. Liganden wie Wnt1, -3a und -8 aktivieren den kanonischen Signalweg und können so bei Überexpression eine zweite Achse auf der ventralen Seite induzieren, während Liganden wie Wnt4, -5a und -11 keine achseninduzierende Wirkung aufweisen (Kohn and Moon, 2005). Wnt11 steht dabei in Bezug zum nicht-kanonischen Wnt/PCPSignalweg und dem Wnt/Calcium-Signalweg (Heisenberg et al., 2000; Tada and Smith, 2000; Kühl, 2004). In der LR-Achsenentwicklung übt dieser Ligand nur einen moderaten 13 Einleitung Effekt auf die Expression von FoxJ1 aus, während er entscheidend in der Polarisierung der GRP-Cilien und der Morphogenese der GRP-Zellen mitwirkt (Walentek, 2012). Die Umsetzung des linksgerichteten Flüssigkeitsstroms: Morphogen- versus ZweiCilien-Modell Für die Umsetzung des biomechanischen Prozesses des linksgerichteten Flüssigkeitsstroms in eine biochemische linksspezifische Information wurden zwei Hypothesen postuliert. Im „Morphogen-Modell“ wird angenommen, dass symmetrisch freigesetzte Faktoren durch den gerichteten Flüssigkeitsstrom auf die linke Seite transportiert werden, um dort eine Signalkaskade zu starten (Nonaka et al., 1998; Okada et al., 1999). In diesem Falle sollten die entsprechenden Faktoren jedoch aus dem medialen Teil des cilienbesetzten Epithels hervorgehen, da gezeigt werden konnte, dass der von der rechten Seite der GRP generierte Flüssigkeitsstrom nicht für die korrekte LRAchsenetablierung benötigt wird (Vick et al., 2009). Dem Morphogen-Modell gegenübergestellt wird das „Zwei-Cilien-Modell“, welches neben den motilen Cilien mechanosensorische immotile Cilien zur Detektion des Flüssigkeitsstroms impliziert. Tabin und Vogan postulierten es im Jahr 2003, basierend auf der Beobachtung, dass Mutationen welche die Motilität Expressionsmuster der Cilien asymmetrischer betreffen eine Markergene in andere der Auswirkung Seitenplatte auf haben, das als Mutationen, welche die Bildung der Cilien beinflussen (Wagner and Yost, 2000; Brueckner, 2001). Die Hypothese mechanosensorischer Cilien wurde dabei von Hinweisen, dass ein cilienständiger Polycystin-Komplex in Nierenzellen eine mechanosensorische Funktion ausübt und durch LR-Achsendefekte bei Knockout-Mäusen des Polycystischen Nierensyndrom Gens Pkd2 („polycystic kidney disease 2“) unterstützt (Igarashi and Somlo, 2002; Pennekamp et al., 2002; Yoder, 2002; Tabin and Vogan, 2003). Die Gene Pkd1 und Pkd2 kodieren für die Transmembranproteine Polycystin-1 (PC1) und Polycystin-2 (PC2), die als Heterodimere auf den primären Cilien verschiedener Zelltypen lokalisieren (Dalagiorgou et al., 2010). Polycystin1, ein G-Protein-gekoppelter Rezeptor, verfügt über eine große extrazelluläre Domäne, die als Sensor agieren soll, während Polycystin-2 einen Calcium-durchlässigen Kationenkanal darstellt. Im Zusammenspiel sollen sie beide den Flüssigkeitsstrom entlang von Nierenepithelzellen mechanosensorisch detektieren und in einen Einstrom von Calcium übersetzen (Praetorius and Spring, 2001; Nauli and Zhou, 2004). 14 Einleitung Durch GFP-Markierung des lrd- und Pkd2-Genlokus der Maus lässt sich erkennen, dass alle Monocilien des PNCs Pkd2-positiv sind, während dagegen die Cilien der randständigen PNC-Zellen kein lrd exprimieren und unbeweglich sind. Als Folge des Flüssigkeitsstrom kann ein intrazellulärer Calciumanstieg an der linken Seite des PNCs beobachtet werden, der abhängig von der Expression von Pkd2 ist (McGrath et al., 2003). Dabei ist die Lokalisation von Pkd2 in den randständigen Zellen des PNCs für die korrekte Determinierung der LR-Achse ausreichend (Yoshiba et al., 2012). Anders als für das Nierenepithel beschrieben agiert PC2 im PNC der Maus unabhängig von PC1, da die Pkd1-Knockout Maus keine LR-Achsendefekte aufweist (Karcher et al., 2005). Im Zebrabärbling lässt sich in den entsprechenden Stadien ebenfalls eine intrazelluläre Calciumerhöung auf der linken Seite des KVs detektieren (Sarmah et al., 2005). Im PNC der Maus oder im KV von Medaka gewährleistet PC2 im Zusammenspiel mit PC1l1 („polycystin 1 like 1“), das eine hohe Sequenzähnlichkeit zu PC1 aufweist, die korrekte Expression linkspezifischer Seitenplattengene (Vogel et al., 2010; Field et al., 2011; Kamura et al., 2011). Weiterhin wurde auch im Zusammenhang mit dem MorphogenModell ein linksseitiger Calciumanstieg beschrieben (Tanaka et al., 2005). In X. laevis lokalisiert PC2 ebenfalls auf den Cilien des LR-Organisators (Vick, 2009). Durch Knockdown von Pkd2 mittels Morpholino-Oligonukleotiden (MO) zeigte sich jedoch, dass Pkd2 im Frosch schon eine frühe Funktion in der Spezifizierung der GRP spielt. So weisen Pkd2-MO injizierte Embryonen neben dem Verlust von FoxJ1 und dem damit einhergehenden Verlust der GRP-Cilien eine gestörte GRP-Morphologie auf (Vick, 2009; Grüdl, 2012). Die Bedeutung der bilateralen Expression von Nodal für den Transfer linksspezifischer Information Vor Beginn der konservierten asymmetrischen Genkaskade im Seitenplattenmesodem wird Nodal bilateral im Bereich des posterioren Notochords exprimiert (Levin et al., 1995; Lowe et al., 1996; Fischer et al., 2002; Long, 2003). In allen untersuchten Modellorganismen, die einen linksgerichteten Flüssigkeitsstrom generieren, flankiert diese paranotochordale Nodal-Domäne das symmetriebrechende, cilienbesetzte Epithel des LROrganisators. In der Maus werden die bilaterale Domäne im Bereich des PNCs und die asymmetrische Domäne in der Seitenplatte von unterschiedlichen genregulatorischen 15 Einleitung Sequenzen kontrolliert (Adachi et al., 1999; Norris and Robertson, 1999; Saijoh et al., 2005). Der für die bilaterale Expression zuständige Promotor wird als NDE („node-specific enhancer“) bezeichnet und liegt circa 10kb upstream des Nodal-Genlokus. Durch gezielten Knockout dieser Enhancer-Region kommt es neben dem Verlust der bilateralen Expression um das PNC zudem zum Verlust der asymmetrischen Seitenplattenexpression. Somit ist die frühe PNC-Expression eine Voraussetzung für die späte asymmetrische Expression von Nodal (Brennan et al., 2002; Saijoh et al., 2003). Die asymmetrische Seitenplattenexpression wird in der Maus von zwei unterschiedlichen Enhancer-Regionen kontrolliert, die beide FoxH1-Bindestellen aufweisen und aufgrund dieser sensitiv auf die Aktivität des Nodal-Signalwegs reagieren (Saijoh et al., 2000, 2005). Damit eröffnet sich die Möglichkeit, dass das im Bereich des PNCs exprimierte Nodal selbst den Faktor darstellt, der in die Seitenplatte translokalisiert um dort die asymmetrische Expression zu induzieren. In diesem Zusammenhang konnte ein weiterer Wachstumsfaktor der TGFß-Familie (GDF1 in Maus und Derrière in Xenopus) beschrieben werden, der wie Nodal bilateral das posteriore Notochord flankierend exprimiert wird und ebenfalls essentiell für die Induktion der Seitenplattenexpression ist (Rankin et al., 2000; Vonica and Brivanlou, 2007). Sowohl GDF1 als auch Derrière sind in der Lage mit Nodal zu dimerisieren und sollen dadurch die weite Übertragung (sogenannte „longe range“ Aktivität) des Nodal-Proteins in die Seitenplatte vermitteln (Eimon and Harland, 2002; Tanaka et al., 2007). Die paranotochordale Expression von GDF1 ist für die anfängliche Induktion der asymmetrischen Genkaskade im posterioren Bereich der Seitenplatte essentiell, während in der Seitenplatte exprimiertes GDF1 für die Ausweitung der asymmetrischen Genkaskade in anteriore Richtung benötigt wird (Tanaka et al., 2007). Eine weitere Bestätigung, dass paranotochordal exprimiertes Nodal direkt vor Ort die Seitenplatteninduktion bewerkstelligt und nicht indirekt, z.B. über einen cytoplasmatischen Signaltransfer vom PNC in die Seitenplatte, lieferten Untersuchungen am Korezeptor Cryptic, der in diesen Stadien Nodal-Aktivität gewährleistet. So kann in Cryptic KnockoutMäusen, in denen durch ein Transgen Cryptic-Expression spezifisch in der Seitenplatte wiederhergestellt wird, die asymmetrische Expression von Nodal und seiner Zielgene Lefty2 und Pitx2c gerettet werden (Oki et al., 2007). Dies zeigt, dass allein die Seitenplattenexpression von Cryptic ausreichend für die asymmetrische Genkaskade ist und paranotochordales Nodal somit nicht über Signalaktivität am PNC die linksseitige Genkaskade induziert. 16 Einleitung Abbildung 2: Frühe LR-Achsenentwicklung von Xenopus laevis FoxJ1 wird während der Gastrulastadien im superfiziellen Mesoderm exprimiert. Während den Stadien des linksgerichteten Flüssigkeitsstroms wird Xnr1(Nodal) symmetrisch auf beiden Seiten der GRP transkribiert (paranotochordal). Im Nerurulastadium 17 kann ein effektiver linksgerichteter Flüssigkeitsstrom durch die Applikation fluoreszierender Mikrobeads und Zeitrafferaufnahmen visualisiert werden. Die Bewegung der einzelnen Partikel wird mit einem Farbgradienten über die Zeit von grün (0 Sekunden) bis rot (25 Sekunden) dargestellt (Abbildung aus Schweickert et al., 2007). Gegen Ende der Neurulation wird Xnr1 asymmetrisch im linken Seitenplattenmesoderm exprimiert (Pfeilspitze). Dort induziert es die asymmetrische Expression des Transkriptionsfaktors Pitx2c, dessen linkspezifische Expression bis zu Beginn der asymmetrischen Organmorphogenese bestehen bleibt. Eine Woche nach der Befruchtung kann man die asymmetrische Organmorphogenese einer X. laevis Kaulquappe anhand der Darmwindung (schwarz), der Lage der Gallenblase (grün) und der Ausrichtung des Herzen (rot) erkennen. LECs, „lateral endodermal cells“; SPM, Seitenplattenmesoderm Übereinstimmend damit kann die autokrine-parakrine Nodal-Signalaktivität innerhalb der bilateralen Domäne durch Überexpression des dominant-negativen ALK4 Rezeptors oder des dominant-negativen Smad3 unter der Kontrolle des NDE-Enhancers unterbunden werden, ohne den Verlust der asymmetrischen Genkaskade zu bewirken (Kawasumi et al., 2011). Die Beschränkung der Genkaskade auf das linke Seitenplattenmesoderm wird dabei durch einen Nodal-Antagonisten der Cerberus/Dan-Familie (Cerl-2 (Maus), Charon (Zebrabärbling), Coco (Krallenfrosch)) gewährleistet (Hashimoto et al., 2004; Marques et al., 2004; Vonica and Brivanlou, 2007). Dieser wird ebenfalls in den Stadien des linksgerichteten Flüssigkeitsstroms bilateral um das posteriore Notochord exprimiert und ähnelt somit der frühen Expressionsdomäne von Nodal und GDF1/Derrière. Cerl2/Coco wird zu Beginn bilateral symmetrisch auf beiden Seiten exprimiert. Diese Symmetrie geht mit einsetzender Aktivität des linksgerichteten Flüssigkeitsstroms verloren, sodass die linke Domäne im Vergleich zur rechten Domäne weniger Expression aufweist (Marques et al., 2004; Schweickert et al., 2010; Nakamura et al., 2012). Coco stellt somit ein kritisches Zielgen des linksgerichteten Flüssigkeitsstroms dar und liefert die Verbindung zwischen dem Symmetriebruch (linksgerichteter Flüssigkeitsstrom) und linksseitiger Geninduktion/linkseitigem Signaltransfer (Schweickert et al., 2010). Bisher unpublizierte Daten unseres Labor zeigen, dass der Flüssigkeitsstrom auf noch nicht geklärte Weise (Zwei Cilien Modell versus Morphogen-Modell) über die 3`UTR von Coco 17 Einleitung posttranskriptionell seine linksseitige Repression bewirkt (unpublizierte Daten von Maike Getwan). Auch in der Maus wird Cerl2 postranskriptionell über die 3`UTR reguliert (Nakamura et al., 2012). Dadurch wird linkseitig weniger Cerl2-Protein translatiert und paranotochordales Nodal-Protein auf der linken Seite von der Cerl2/Coco-Repression freigelassen, um den Signaltransfer in die Seitenplatte bewerkstelligen zu können. In Übereinstimmung damit konnte in der Maus gezeigt werden, dass durch die Repression von Cerl2 linkseitig Nodal frei wirken kann und sich so Nodal-Signalaktivität abhängig vom Korezeptor Cryptic in der Phosphorylierung von Smad2 im PNC und in der Seitenplatte wiederspiegelt (Kawasumi et al., 2011). Der Symmetriebruch des Huhns nimmt innerhalb der Wirbeltiere eine Sonderstellung ein Im Huhn konnte bislang kein linksgerichteter Flüssigkeitsstrom oder kein zum PNC der Maus und zur GRP des Frosches äquivalenter epithelialer Bereich mit beweglichen Cilien beschrieben werden. Der konservierten asymmetrischen Genkaskade im linken Seitenplattenmesoderm geht ebenfalls eine frühere Nodal-Expressionsdomäne im posterioren Bereich des Notochords voran. In diesem Bereich nahe des Hensen Knoten (Organisatorgewebe des Huhns) werden Nodal und eine Reihe anderer Genen asymmetrisch exprimiert. Beispielsweise werden Nodal und Shh (Sonic Hedgehog) auf der linken Seite des Hensen Knotens transkribiert, während der Rezeptor cAct-RIIa und Fgf8 auf der rechten Seite des Hensen Knoten exprimiert werden (Levin et al., 1995; Boettger et al., 1999). Lange Zeit ging man davon aus, dass die asymmetrische Expression von Shh der von Nodal vorausgeht, diese induziert und über diese die asymmetrische Seitenplattenexpression von Nodal ermöglicht (Levin et al., 1995; Pagán-Westphal and Tabin, 1998). Die Asymmetrie von Nodal scheint sich aber zeitgleich mit jener von Shh zu entwickeln und Shh, welches zudem bilateral im Bereich der Seitenplatte exprimiert wird, scheint ähnlich wie in der Maus in der Seitenplatte benötigt zu werden (Tsiairis and McMahon, 2009; Tsikolia et al., 2012). Der asymmetrischen Genexpression um den Knoten geht die asymmetrische Morphologie des Knoten voran, beide Prozesse sind dabei die Folge von asymmetrischen linksgerichteten Zellbewegungen. Dies lässt sich durch pharmakologische Inhibition dieser Zellbewegungen erkennen, die neben der symmetrischen Morphologie auch zur symmetrischen Expression von Shh und Fgf8 führen (Dathe et al., 2002; Gros et al., 2009). 18 Einleitung Der FGF-Signalweg als zentraler Regulator der Embryogenese Neben dem Nodal-Signalweg spielen noch weitere Signalwege eine wichtige Rolle in der Etablierung der LR-Asymmetrie. So soll in dieser Arbeit insbesondere die Funktion des FGF-Signalwegs erforscht werden. In den frühen Entwicklungsstadien von X. laevis, in denen die Spezifierung des superfiziellen Mesoderms und die Morphogenese der GRP ablaufen, finden FGF-abhängig Entwicklungsprozesse wie die Induktion des Mesoderms und des Neuralgewebes, anteriore-posteriore Musterbildung sowie morphogenetische Veränderungen und die Myogenese statt (Pownall and Isaacs, 2010). Da die GRP von mesodermalen Ursprung ist, ist eine korrekte Spezifizierung des Mesoderms indirekt wichtig für die korrekte Mesodermspezifizierung Ausbildung finden der während LR-Achsenasymmetrie. der Gastrulation Zeitgleich zur konvergente Extensionsbewegungen statt, die entscheidend für die Gastrulation und somit für die Morphogenese der GRP sind. Im Folgenden wird deswegen auf die Abhängigkeit der Mesoderminduktion und der konvergenten Extensionsbewegungen von einem intakten FGF-Signalweg eingegangen. Zunächst sollen jedoch bekannte molekulare Grundlagen des FGF-Signalwegs kurz erläutert werden, der aufgrund seiner diversen Funktionen wie der Regulierung von Zelldifferenzierung, -adhesion, -bewegung sowie von Zellproliferation und Apoptose für verschiedenste Prozesse der Embryonalentwicklung notwendig ist (Böttcher and Niehrs, 2005). Der FGF-Signalweg FGF-Liganden binden extrazellulär abhängig von Heparansulfat-Proteoglykanen (HSPG) an ihre Rezeptoren. Daraufhin kommt es zur Dimerisierung zweier Rezeptoren und zur Aktivierung der intrazellulären Signaltransduktion, indem verschiedene Tyrosin-Reste der intrazellulären Rezeptordomänen transautophosphoryliert werden. Diese dienen dann als Andockstellen zur Rekrutierung von Adapterproteinen oder Signalenzymen, die über eine SH2- oder PTB-Domäne verfügen, sodass der Rezeptorphosphorylierung unterschiedliche Signalwege nachgeschaltet sind (Dailey et al., 2005; Pownall and Isaacs, 2010). 19 Einleitung Abbildung 3: FGF-vermittelte Signaltransduktion Dem FGF-Rezeptor nachgeschaltet werden verschiedene Signalwege induziert. Über den MAPK-Signalweg nimmt die FGF-Aktivität Einfluss auf die Genexpression und spielt unter anderem eine Rolle in zellulären Prozessen wie Proliferation und Differenzierung. Die Aktivierung der Phosphoinositid-3-(PI3-)Kinase und der Proteinkinase B (PKB) spielt eine Rolle beim Überleben von Zellen, während der PLC/PKC/CalciumSignalweg in Bezug zur Morphologie und Migration von Zellen steht. Sprouty-Proteine können als intrazelluläre Antagonisten von Raf, Grb2 und PLC agieren. In der frühen Entwicklung von Xenopus agieren sie als Antagonisten des PLC/PKC/Calcium-Signalwegs. Quellen und nähere Bezeichnung sind im Text verzeichnet. Im MAPK („mitogen activated protein kinase“) Signalweg wird über FRS2 („FGFR substrate 2“) das Adaptorprotein Grb2 und der damit assoziierte Nukleotid- Austauschfaktor SOS („son-of-sevenless“) rekrutiert, um dann über das GTP Bindeprotein Ras eine Phosphorylierungskaskade zu starten, an deren Ende die MAPK ERK („extracellular signal-regulated kinase“) steht. Die phosphorylierte MAPK wandert in den Zellkern ein, um unter anderem Transkriptionsfaktoren der Ets-Familie zu modifizieren und damit die Transkription von FGF-Zielgenen zu stimulieren. Der MAPK-Signalweg ist oft mit der Aktivierung von Zellproliferation und Zelldifferenzierung verbunden. In Xenopus spielt dieser Signalweg eine prominente Rolle in der FGF-induzierten Mesodermspezifizierung (Umbhauer et al., 1995; Dorey et al., 2010; Pownall and Isaacs, 2010). Über Grb2 kann auch der Phosphoinositid-3-(PI3-)Kinase-Signalweg eingeschaltet werden, der über die Aktivierung der Proteinkinase B (Akt) einen Signalweg in Gang setzt, der unter anderem die Zellen vor Apoptose schützt. Andererseits kann über einen Phosphotyrosin-Rest im FGF-Rezeptor (FGFR) die Phospholipase Cγ (PLCγ) aktiviert werden. PLCγ hydrolisiert Phosphatidylinositol-4,5-bisphosphate (PIP) zu Diacylglycerol 20 Einleitung (DAG) und Inositol-1,4,5-triphosphat Proteinkinase C (PKC), während IP3 (IP3). DAG intrazelluläre wiederum aktiviert Calcium-Freisetzung die stimuliert (Böttcher and Niehrs, 2005; Dailey et al., 2005; Pownall and Isaacs, 2010). Sprouty als negativer Regulator des FGF-Signalwegs Proteine der Sprouty-Familie sind als intrazelluläre Inhibitoren der Rezeptor-TyrosinKinasen-vermittelten Signalwege bekannt. Im Sinne einer negativen Rückkopplung wird die Expression von Sprouty-Genen (Spry) sowohl durch den MAPK- als auch durch den Calcium-Signalweg induziert (Ozaki et al., 2001; Abe and Naski, 2004). Dabei können Sprouty-Proteine den MAPK-Signalweg über Bindung von Grb2 oder Raf oder die FGFRezeptor-vermittelte Mobilisierung von intrazellulärem Calcium durch Inhibition von PLCγ antagonisieren (Christofori, 2003; Akbulut et al., 2010). In frühen Gastrulastadien von Xenopus werden Spry1 und Spry2 in der mesodermalen Randzone exprimiert und wirken über die Inhibition des PLC/PKC/Calcium-Signalwegs negativ auf morphogenetische Zellbewegungen, während sie keinen antagonistischen Effekt auf die MAPK-vermittelte Mesodermspezifizierung ausüben. Ab den mittleren/späten Gastrulastadien nimmt ihre Expression ab. Dadurch sollen sie als Schalter zwischen MAPK- und PLC/PKC/Calcium-vermittelten Signaltransduktionen wirken (Nutt et al., 2001; Sivak et al., 2005; Dorey et al., 2010). FGF-abhängige Induktion und Aufrechterhaltung mesodermaler Gene Auch wenn Fibroblasten-Wachstumsfaktoren zunächst aufgrund ihrer Eigenschaft Fibroblasten zu stimulieren mesoderminduzierenden isoliert Eigenschaften wurden, eines konnte FGF-Liganden bereits 1987 dargestellt die werden (Gospodarowicz, 1974; Gospodarowicz and Moran, 1975; Slack et al., 1987). Aus Rinderhirn isoliertes FGF2 war in der Lage animales Polkappenektoderm des Krallenfrosches zu Mesoderm zu differenzieren (Slack et al., 1987). Dass FGF Signalaktivität auch endogen eine Rolle in der Spezifizierung des Mesoderms spielt, lieferten Überexpressionsexperimente des dominant-negativen FGF-Rezeptors 1 (dnFGFR1). Durch diese FGFR-Inhibition lässt sich der Verlust von mesodermalen Rumpf21 Einleitung und Schwanzgewebe beobachten (Amaya et al., 1991). Anders als die TGFßWachstumsfaktoren (Nodal-verwandeten Proteine oder Vg1) gehören Fibroblasten Wachstumsfaktoren nicht zu den vegetal exprimierten mesoderminduzierenden Signalen, sondern werden im Zuge der frühen Induktionsphase selbst durch die vegetalen Faktoren in der mesodermalen Randzone aktiviert. FGF-Signalaktivität, erkennbar an phosphoryliertem ERK, lässt sich bis zum Stadium der Midblastula-Transition nur in einem geringen Maße detektieren und steigt nach Einsetzen zygotischer Gentranskription im mesodermalen Ring und im dorsalen Ektoderm an (Christen and Slack, 1999; Branney et al., 2009). Nichtsdestotrotz ist die Mesoderminduktion von FGF-Signalaktivität abhängig. So lässt sich durch Applikation des mesoderminduzierenden TGFß-Wachstumsfaktors Aktivin animales Polkappengewebe zu Mesoderm induzieren und viele der dabei aktivierten Geninduktionen lassen sich durch Überexpression des dnFGFR1 oder mutanter Formen von Ras oder Raf verhindern (Cornell and Kimelman, 1994; LaBonne and Whitman, 1994). Höhere Konzentrationen an Aktivin induzieren dorsales Mesoderm, wohingegen ventrales Mesoderm unter den gleichen Bedingungen induziert wird, wenn FGF-Signalaktivität inhibiert wird (Lee et al., 2011). Endogen ist FGF-Signalaktivität beispielsweise für die Induktion und Aufrechterhaltung des panmesodermalen Markers Xbra oder für die paraxial exprimierten Gene MyoD und Myf 5 essentiell (Amaya et al., 1993; Isaacs et al., 1994; Fisher et al., 2002). Viele axialen Organisatorgene dagegen reagieren in ihrer ersten Induktion weniger sensitiv auf FGF-Inhibition und benötigen FGFSignalaktivität vielmehr für die Aufrechterhaltung ihrer Genexpressionen (Fletcher and Harland, 2008). Die Bedeutung des FGF-Signalwegs für konvergente Extensionsbewegungen Die konvergente Extension beschreibt einen Prozess, in dem sich Zellen entlang der einen Achse aufeinander zubewegen und sich dadurch das Gewebe in der dazu senkrechten Achse verlängert (Wallingford et al., 2002). Diese Bewegungen finden unter anderem während der Gastrulation und Neurulation auf der dorsalen Seite des Embryos im zukünftigen Notochord, somitischen Mesoderm und in der Neuralplatte statt und tragen zur AP-Verlängerung bei. Ein Großteil der morphogenetischen Veränderungen, die während der Gastrulation stattfinden, wird von konvergenten Extensionsbewegungen vermittelt (Keller et al., 1992). Mit Beginn der Gastrulation werden Lamellipodien, die sich an der mediolateralen Achse der Zellen befinden, stabilisiert, sodass die Zellen eines Gewebes 22 Einleitung mediolateral interkalieren können. Hierbei ist der Wnt/PCP-Signalweg für die Ausrichtung der Lamellipodien entlang der planaren Zellachse entscheidend. Im Mesoderm von Xenopus werden konvergente Extensionsbewegungen durch das Zusammenspiel der mediolateralen Interkalation und der Notochord-Somiten-Grenze ermöglicht (Wallingford et al., 2002). Der FGF-Signalweg reguliert konvergente Extension sowohl auf indirekte als auch auf direkte Weise. Indirekt wirkt hierbei MAPK-abhängige FGF-Signalaktivität auf die Expression von Xbra, welches wiederum Wnt11 induziert und darüber den Wnt/PCPSignalweg reguliert (LaBonne et al., 1995; Curran and Grainger, 2000; Tada and Smith, 2000). Direkt und unabhängig von Xbra wirkt der FGF-Signalweg über Zielgene wie NRH („neurotrophin receptor homolog“) und Xmc („Xenopus marginal coil“) oder über die Aktivierung der PLC, die über DAG die PKC an die Zellmembran rekrutiert oder über IP3 einen intrazellulären Calcium-Anstieg bewirkt (Frazzetto et al., 2002; Chung et al., 2005; Wang and Steinbeisser, 2009). Sowohl die Rekrutierung der PKC an die Zellmembran als auch intrazelluläres Calcium spielen eine Rolle bei konvergenten Extensionsbewegungen (Wallingford et al., 2001; Wang and Steinbeisser, 2009). FGF-Signalaktivität in der LR-Achsenentwicklung der Wirbeltiere FGF-Signalaktivität spielt eine Rolle in der LR-Achsenentwicklung der Wirbeltiere. Dabei unterscheiden sich funktionelle Erkenntnisse aus Huhn/Kaninchen, Maus und dem Zebrabärbling und lassen keine Konservierung dieses Signalwegs erkennen. In Huhn und Kaninchen wirkt der Ligand FGF8 reprimierend auf die Expression von Nodal. Dabei weist Fgf8 im Huhn eine asymmetrisch verstärkte Expression auf der rechten Seite des Hensen Knoten auf (Boettger et al., 1999). Im Kaninchen dagegen wird Fgf8, wie in den homologen Bereichen von Maus, Zebrabärbling und Xenopus, symmetrisch im Organisator (Hensen Knoten) exprimiert (Crossley & Martin, 1995; Fischer et al., 2002; Reifers et al., 1998, Schneider, 2008). Durch die Inhibiton des FGF-Signalwegs kann Nodal im Huhn und Kaninchen ektopisch im rechten Seitenplattenmesoderm induziert werden, während die ektopische Applizierung von FGF8-Protein auf der linken Seite zur Repression der endogenen Seitenplattenexpression führt (Boettger et al., 1999; Rodríguez 23 Einleitung Esteban et al., 1999; Fischer et al., 2002). Hierbei soll FGF8 im Kaninchen seine repressive Funktion über Gap Junctions vermittelt ausüben (Feistel and Blum, 2008). Fgfr1 und Fgf8 Knockout-Mäuse zeigen aufgrund der Funktion von FGF-Signalaktivität für Gastrulationsbewegungen und die Spezifizierung des Mesoderms schwerwiegende Defekte, welche die Aufdeckung einer spezifischen FGF-Funktion in der LR- Achsenentwicklung unmöglich machen. So weisen Fgf8 Knockout-Mäuse einen Verlust des embryonalen Mesoderms und Entoderms auf, während Fgfr1 Knockout-Mäuse unter schweren Wachstumsverzögerungen sowie dem Verlust von paraxialem Mesoderm leiden und noch während der Gastrulation sterben (Deng et al., 1994; Yamaguchi et al., 1994; Sun et al., 1999; Ciruna and Rossant, 2001). Mit der hypomorphen Fgf8-Mutanten konnte erstmals eine Rolle des FGF-Signalwegs in der LR-Achsenentwicklung der Maus aufgedeckt werden. Hierbei kommt zu einem Verlust der bilateralen paranotochordalen Nodal-Domäne, was den Verlust der asymmetrischen Nodal-Kaskade nach sich zieht (Meyers and Martin, 1999; Oki et al., 2010). Zudem wurde in der Maus eine zweite Funktion beschrieben, in der FGF-Signalaktivität zum Zeitpunkt des linksgerichteten Flüssigkeitsstroms eine Rolle spielt. Hierbei soll die FGF-abhängige Freisetzung von extrazellulären Vesikeln, den sogenannten NVPs („nodal vesicular particles“), einen intrazellulären Calciumanstieg auf der linken Seite bewirken (Tanaka et al., 2005). Auch im Zebrabärbling konnte eine Funktion des FGF-Signalwegs nachgewiesen werden. So besitzen ein Drittel der FGF8-mutanten Linie „acerebellar“ kein KV und bildet infolge dessen LR-Achsendefekte aus (Albertson and Yelick, 2005). Weitere Analysen, in denen unter anderem die Rezeptor-vermittelte Transduktion des FGFR1 inhibiert wurde, konnten zeigen dass FGF eine Rolle für die Ciliogenese des KVs spielt (Hong and Dawid, 2009; Neugebauer et al., 2009; Yamauchi et al., 2009; Liu et al., 2011). 24 Arbeitshypothese Arbeitshypothese Die Forschungsarbeit der letzten Jahre zeigte, dass der Mechanismus des Symmetriebruchs bei den Wirbeltieren weitgehend konserviert ist. Da nachgewiesen werden konnte, dass bisher als „frühe Determinanten“ bekannte Moleküle ebenfalls innerhalb des linksgerichteten Flüssigkeitsstroms wirken, weist immer mehr auf einen konservierten Mechanismus der LR-Achsendeterminierung hin. Im Widerspruch zu einem allgemeingültigen Wirkmechanismus steht allerdings, dass der FGF-Signalweg bei der LR-Achsenentwicklung unterschiedliche Funktionen in den bisher untersuchten Wirbeltieren zeigte. Eine nicht-konservierte Funktion des FGF-Signalwegs lässt sich dabei schlecht mit der Konservierung vieler anderer Signalwege vereinbaren. In dieser Arbeit wurde die Hypothese aufgestellt, dass auch für die FGF-Signalaktivität eine funktionelle Konservierung vorliegt. Aufgrund seiner evolutionären Einordnung zwischen dem Zebrabärbling und den Modellorganismen der höheren Vertebraten Huhn, Kaninchen und Maus stellt Xenopus einen relevanten Modellorganismus zur Analyse der Konservierung des FGF-Signalwegs in der Lateralitätsentwicklung dar. Deshalb wurde in dieser Dissertation die bisher unbekannte Rolle der FGF-Signalaktivität in X. laevis untersucht. Dabei stellte sich die Frage, wann und in welchem Bereich dieser Signalweg für die Lateralitätsentwicklung entscheidend ist. Widersprüchliche Erkenntnisse aus anderen Modellorganismen infolge von Funktionsverlustexperimenten könnten auf der Beeinträchtigung unterschiedlicher Entwicklungsstadien beruhen. So ist es möglich, dass der FGF-Signalweg mehrere aufeinanderfolgende Funktionen ausübt, die jeweils konserviert sind. Diese Hypothese wurde durch zeitlich oder räumlich begrenzte Modulation des FGF-Signalweges mit Hilfe von Funktionsverlust- und Funktionsgewinnexperimenten untersucht. 25 Ergebnisse Ergebnisse Funktionsverlustexperimente zur Darstellung der FGF-vermittelten Funktion Zur Darstellung der Funktion, die der FGF-Signalweg endogen in der LR- Achsenentwicklung von Xenopus spielt, wurden im ersten Schritt Funktionsverlustexperimente durchgeführt. Bei diesen wurden der synthetische Rezeptorantagonist SU5402 und der dominant-negative FGF-Rezeptors 1 (dnFGFR1) verwendet. SU5402 inhibiert die FGF-Signaltransduktion, indem es durch Interaktion mit der katalytischen Domäne die Autophosphorylierung des FGF-Rezeptors unterbindet (Mohammadi, 1997). Die systemische Inkubation in SU5402 ermöglichte es, die Embryonalentwicklung zu einem beliebigen Zeitpunkt zu unterbinden. Durch die anschließende Expressionsanalyse des Markergens Pitx2c ließ sich zeitlich einschränken, in welchen Stadien der FGF-Signalweg eine Funktion auf die Lateralitätsentwicklung ausübt. Die Injektion von dnFgfr1 ermöglichte es, die Signaltransduktion in einem bestimmten Bereich des Embryos zu unterbinden. Der dnFGFR1 stellt eine Deletionsmutante des FGFR1 dar. Dieser fehlt die intrazelluläre Tyrosinkinase-Domäne, sie wirkt durch Dimerisierung mit den endogen exprimierten FGF-Rezeptoren dominant-negativ (Amaya et al., 1991). Dabei kann eine Deletionsmutante des FGFR1 auch inhibierend auf alle anderen Rezeptortypen wirken (Ueno et al., 1992). Inhibition der FGF-Signalaktivität bewirkt einen Verlust der asymmetrischen Genexpression Zur Unterdrückung von FGF-Signalaktivität wurden systemische Inkubationen in SU5402haltiger Pufferlösung durchgeführt. Da SU5402 in DMSO gelöst genutzt wurde, wurden die Kontrollembryonen in DMSO-haltiger Pufferlösung der entsprechenden Konzentration inkubiert. Bereits in meiner Diplomarbeit konnte ich zeigen, dass die Applikation von SU5402 während Gastrulastadien zu einem Verlust der asymmetrischen Expression von Pitx2c im linken Seitenplattenmesoderm führt (Schneider, 2008). Zur Aufklärung des zugrunde liegenden Wirkmechanismus wurden diese Ergebnisse in der vorliegenden Arbeit näher analysiert. Um Rückschlüsse ziehen zu können, auf welche LR-relevanten 26 Ergebnisse Ereignisse die FGF-Signalaktivität Einfluss nimmt, wurden die Inkubationen zu unterschiedlichen Zeitpunkten gestartet und durch Auswaschen des Inhibitors beendet (schematisch dargestellt in Abb. 4A). Abbildung 4: SU5402-Inkubationen lassen ein Zeitfenster erkennen, indem die Inhibition der FGFSignalaktivität den Verlust der asymmetrischen Pitx2c-Expression bewirkt (A) Zeitskala der LR-Achsenentwicklung von X.laevis. Inkubationen, die zwischen St.10,5 und St.12/12,5 gestartet wurden (hellrot) und im Neurulastadium 17/18 gestoppt wurden, hatten einen Effekt auf die LRAchsendeterminierung, während Inkubationen, die im St.12,5/13 oder im St.15/16 gestartet wurden (dunkelblau) keinen Effekt ausübten. (B) Prozentuale Anteile der verschiedenen Expressionsmuster von Pitx2c im Seitenplattenmesoderm. SU5402-Inkubationen beginnend zwischen St.10,5 und St.12/12,5 bewirkten im Vergleich zu DMSO-Kontrollembryonen einen signifikanten Anteil an Embryonen mit fehlender Pitx2c-Expression (C) Expressionsanalyse von MyoD und Pitx2c im Schwanzknospenstadium. Beispiele SU5402-behandelter Embryonen mit reduzierter Expression des Somitenmarkers MyoD (SU5402 St.10,5), leicht verkürzter, nach dorsal gebogener Achse (SU5402 St.11-11,5) oder mit wildtypisch erscheinender APAchse (SU5402 St.12), die einen Verlust von asymmetrischem Pitx2c aufwiesen. Der Kontrollembryo hingegen exprimierte Pitx2c wildtypisch im linken Seitenplattenmesoderm. n, Anzahl der Embryonen; n.s., nicht signifikant; SPM, Seitenplattenmesoderm; wt, wildtypisch 27 Ergebnisse Embryonen, die beginnend ab frühen bis späten Gastrulastadien in SU5402 inkubiert wurden und deren Inkubation in den Neurulastadien 17/18 beendet wurde, wiesen einen signifikanten Verlust der Pitx2c-Expression auf (Abb. 4B). Dabei reichten in den Inkubationsexperimenten ab St.10,5/11 (n=117) oder 11/11,5 (n=285) Konzentrationen von 30µM SU5402 aus, um einen Expressionsverlust von über 80% hervorzurufen (p<0,001, Abb. 4B), während Inkubationen ab St.12/12,5 in dieser niedrigen Konzentration keinen signifikanten Effekt ausübten (nicht gezeigt). Mit einer erhöhten Konzentration von 50-80µM SU5402 ließ sich in den Inkubationsexperimenten ab St.12/12,5 wieder ein signifikanter Verlust von circa 70% bewirken (n=122, p<0,001, Abb. 4B). Dieser Effekt war auf ein kleines Zeitfenster beschränkt, selbst hohe Konzentrationen von 80µM konnten bei Inkubationsexperimenten ab St.12,5/13 keine signifikante Abweichung von der wildtypischen Pitx2c-Expression hervorrufen (n=245, p=0,926, Abb. 4B). Inkubationsexperimente ab St.15/16 wurden durchgeführt, um die FGF-Signalaktivität in den Stadien des linksgerichteten Flüssigkeitsstroms zu inhibieren. Durch Applikation von SU5402 ließ sich kein Einfluss der FGF-Signalaktivität auf die Determinierung der LR- Achsenentwicklung während der Stadien des Symmetriebruchs feststellen (n=103, p=0,102, Abb. 4B). Somit konnte durch diese Experimente ein zeitliches Fenster festlegt werden, in dem FGF-Signalaktivität bis Ende der Gastrulation für die korrekte Determinierung der LR-Achse essentiell ist. Der FGF-Signalweg ist demnach bis Ende der Gastrulation (St.12-12,5) von Bedeutung für die Lateralitätsentwicklung. Wurde die Applikation von SU5402 bereits vor Erreichen des Gastrulastadiums 11 durchgeführt, hatte dies neben dem Verlust der asymmetrischen Pitx2c-Expression schwere Gastrulationsdefekte zur Folge. In diesen Embryonen schloss sich der Blastoporus nicht vollständig, sodass sich die dorsale Achse nicht korrekt bilden konnte und die Embryonen im Schwanzknospenstadium eine dorsale Kurvatur aufwiesen. In extremen Fällen führte der Blastoporusschlussdefekt dazu, dass das axiale Gewebe direkt hinter dem Kopf auseinander klaffte (Abb. 4C, SU5402 St.10,5). Dieser Phänotyp, der auf Störungen der Mesodermentwicklung und der konvergenten Extensionsbewegungen zurückzuführen ist, ist ein gut bekanntes Beispiel für die Auswirkungen des Verlusts von FGF-Signalaktivität (Amaya et al., 1991). Die fehlerhafte Mesoderminduktion ist dabei anhand der reduzierten Transkription des Somitenmarkers MyoD nachweisbar (Abb. 4C). Je später die Inkubationen durchgeführt wurden, desto milder fiel der AP-Achsenphänotyp aus. Embryonen, die ab St.11/11,5 inkubiert wurden, wiesen noch eine leicht verkürzte, nach dorsal gebogene Achse auf. Embryonen dagegen, die ab St.12/12,5 behandelt 28 Ergebnisse wurden, ließen nur selten eine Verkürzung der AP-Achse erkennen und verfügten zudem über eine wildtypische Expression von MyoD (Abb. 4C). SU5402-Inkubationen ab St.15/16 wurden nicht im Neurulastadium sondern im Schwanzknospenstadium gestoppt und wiesen im Vergleich zu den Kontrollembryonen eine verkürzte AP-Achse auf (nicht gezeigt). Zur Bestätigung, dass der durch SU5402 hervorgerufene Effekt auf der Inhibition von FGF-Signalaktivität beruht und nicht auf unspezifischen Nebenwirkungen des Inhibitors, wurde zudem dnFgfr1, als mRNA oder als DNA-Konstrukt im pCS2+-Vektor, injiziert. Wie bereits publiziert, und in Übereinstimmung mit dem Funktionsverlust via SU5402, hatte die Injektion dieses dominant-negativen Konstruktes Embryonen zur Folge, die eine normale Kopfentwicklung aufwiesen, aber schwere Defizite ab Höhe des Rumpfes ausbildeten (nicht gezeigt; Amaya et al., 1991). Gastrulationsdefekte wurden zu einem großen Anteil durch die Injektion niedrigerer Konzentrationen vermieden. Um zu bestimmen, in welchem Bereich FGF-Signalaktivität entscheidend ist, wurden gezielte Injektionen durchgeführt. Eine Funktion des FGF-Signalwegs wurde in Bezug zum Kupffer`schen Vesikel des Zebrabärblings oder zum PNC der Maus beschrieben. Dabei trifft man bei Injektionen in den dorsalsten Bereich der Randzone von Embryonen im 4Zellstadium (entsprechend der C1 Blastomere im 32-Zellstadium) den medialsten Anteil der GRP, während man den lateralen Anteil der GRP durch Injektionen in die dorsolaterale Randzone (entsprechend der C2 Blastomere im 32-Zellstadium) beeinflusst (Vick, 2009). Da die Fehlexpression von dnFgfr1 gerade im dorsalen Bereich der Randzone (zukünftige GRP) häufig Blastoporusschlussdefekte zur Folge hatte, wurden die geringsten noch wirksamen Konzentrationen ermittelt und injiziert. Dabei bewirkten Injektionen von dnFgfr1 in Form von DNA (5-8pg) oder mRNA (8-12pg) vergleichbare Effekte und wurden deswegen zusammengefasst. Ein schwacher aber statistisch sehr hoch signifikanter Anteil an Embryonen mit fehlender Pitx2c-Expression ergab sich bei einer linkseitigen Fehlexpression in der C2-Region (p<0,001, Abb. 5A). Die rechtsseitige Fehlexpression (C2) rief dagegen keine signifikante Veränderung im Vergleich zu den Kontrollembryonen hervor (p=0,055; nicht gezeigt). Injektionen in den ventrolateralen Bereich der Randzone (entsprechend der C3Blastomere im 32-Zellstadium) zielen auf das Gewebe welches sich gemäß seines Zellschicksal später im Seitenplattenmesoderm wiederfinden lässt (Vick, 2009). 29 Ergebnisse So hätte durch solche Injektionen eine mögliche Funktion des FGF-Signalwegs in der Seitenplatte anhand der Pitx2c-Expression nachgewiesen werden können. Da Letztere endogen in der linken Seite circa zwei Tage nach der Befruchtung transkribiert wird, wurde dnFgfr1-DNA (5-8pg) linksseitig injiziert. Allerdings veränderte diese Fehlexpression die wildtypische Pitx2c-Expression nicht (p=0,061; Abb. 5A). Abbildung 5: FGF-Signalaktivität in der GRP ist notwendig für die Induktion der Nodal-Genkaskade Expressionsanalyse von Pitx2c nach linksseitiger Injektion in den Bereich der zukünftigen lateralen GRP (C2) oder in die zukünftige Seitenplatte (C3) im 4-Zellstadium. DnFgfr1 wurde als mRNA (8-12pg) oder als + DNA-Konstrukt (5-8pg) injiziert. Als Kontrolle dienten ß-Gal-mRNA- oder pCS2 -Leervektor-Injektionen der entsprechenden Konzentrationen sowie uninjizierte Embryonen. (A) Prozentuale Anteile der verschiedenen Expressionsmuster. Die Injektion in die linke C2-Region bewirkte einen signifikanten Anteil an Embryonen mit fehlender Pitx2c-Expression im Seitenplattenmesoderm (B) Beispielembryonen mit wildtypisch starker (wt) oder schwacher Transkription (schwach). n, Anzahl der Embryonen Zusammengefasst ließ sich erkennen, dass der Funktionsverlust von FGF-Signalaktivität mittels SU5402-Inkubationen in frühen Gastrulastadien oder mittels Fehlexpression von dnFgfr1 in der dorsalen Randzone schwere Gastrulationsdefekte zur Folge hatte. Da sich hierbei keine funktionelle GRP ausbilden konnte, stellte das Fehlen der Pitx2cTranskription einen indirekten Effekt dar. SU5402-Inkubationen ab späten Gastrulastadien sowie die Injektion von dnFgfr1 in niedrigen Konzentrationen erzielten einen signifikanten Verlust von Pitx2c. Da hierbei Gastrulationsdefekte umgangen werden konnten, kann man diesen Verlust als einen spezifischen und direkten Effekt der FGFR-Inhibition auf die LRAchsenentwicklung erachten. Dabei konnte die Funktion des FGF-Signalwegs in der Lateralitätsentwicklung zeitlich bis zum Ende der Gastrulation (SU5402) eingrenzt werden. Die gezielte Fehlexpression von dnFgfr1 deutet darauf hin, dass das FGF-Signal exklusiv im Bereich der GRP benötigt wird. Damit sollte der FGF-Signalweg keinen direkten Einfluss auf die Seitenplatte haben. Da der Effekt von dnFgfr1 aber im Allgemeinen mit 30 Ergebnisse 10% an beeinträchtigten Embryonen zwar signifikant, aber eher schwach war, sollte durch SU5402-Inkubation und Expressionsanalyse von Pitx2c untersucht werden, ob die Seitenplatte nach FGFR-Inhibition kompetent für die Induktion der asymmetrischen Genkaskade war. Kompetenz der Seitenplatte zur Expression von Pitx2c nach SU5402-Inkubation In Wildtyp-Embryonen ist auch die rechte Seite kompetent Pitx2c im Seitenplattenmesoderm zu exprimieren. Dabei kann man eine ektopische Transkription von Pitx2c durch Injektion von Xnr1 im Sinne eines Funktionsgewinns in die C3-Region (zukünftige Seitenplatte) bewirken. Zunächst wurde ein Expressionsvektor mit der codierenden Sequenz von Xnr1 unter Kontrolle des CMV-Promotors (pCS2+-Vektor) in die linke oder rechte C3-Region injiziert. Diese sowie uninjizierte Kontrollembryonen wurden ab den Gastrulastadien 11-12 bis zum Neurulastadium 17/18 entweder in SU5402 oder in DMSO inkubiert und anschließend im Schwanzknospenstadium 30-33 für eine Pitx2cExpressionsanalyse fixiert (Abb. 6A). Abbildung 6: Kompetenz der Seitenplatte bei SU5402-Inkubationen ab der mittleren/späten Gastrula (A) Schematische Darstellung des Experimentes. (B) Die Pitx2c-Analyse nach Inkubation in 50µM SU5402 ab St.11-12 wies einen signifikanten Verlust der Expression auf, der durch Injektion von Xnr1-DNA in die linke ventrale Randzone (C3) gerettet wurde. Injektionen in die rechte C3-Region und anschließende Inkubation in SU5402 oder DMSO resultierten vorwiegend in einer Invertierung der asymmetrischen Pitx2cExpression. li, links; n, Anzahl der Embryonen; re, rechts; SPM, Seitenplattenmesoderm Die alleinige Applikation von 50µM SU5402 bewirkte den Verlust von Pitx2c in 81% der Embryonen (n=186, p<0,001, Abb. 6B). Durch vorherige Xnr1-Injektion in die linke Seite 31 Ergebnisse konnte dieser Effekt auf einen Anteil von 16% gesenkt werden (n=101, p<0,001, Abb. 6B). Die Injektion in die rechte Seite bewirkte dagegen sowohl bei der SU5402- (86% invers oder bilateral, n=72, Abb. 6B), als auch bei der DMSO-Inkubation (86% invers oder bilateral, n=88, Abb. 6B), eine rechtsseitig ektopische Transkription von Pitx2c. Der große Anteil an Embryonen mit inverser statt bilateraler Expression in der DMSO-Kontrolle steht in Übereinstimmung mit der berichteten raschen Diffusion des Nodal-induzierten Antagonisten Lefty (Ohi and Wright, 2007; Müller et al., 2012). Durch den ektopischen Xnr1-Funktionsgewinn wurde dabei die asymmetrische Genkaskade auf der rechten Seite vor Beginn der endogene Expression induziert, sodass durch Lefty möglicherweise die endogene Expression auf der linken Seite unterdrückt wurde. Die Überexpression von Xnr1 zeigte, dass das Seitenplattenmesoderm bei SU5402Inkubationsansätzen, die ab den Gastrulastadien 11-12 gestartet und im Neurulastadium 17/18 beendet wurden, kompetent für die Transkription von Pitx2c war und somit der Verlust von Pitx2c einer anderen Ursache zu Grunde lag. In X. laevis kann der Verlust der asymmetrischen Genexpression auch als Konsequenz eines nicht korrekt ausgebildeten linksgerichteten Flüssigkeitsstroms entstehen (Schweickert et al., 2007; Vick et al., 2009). Um zu untersuchen, ob die fehlende Expression von Pitx2c infolge der inhibierten FGF-Signaltransduktion auf einem gestörten Flüssigkeitsstrom beruht, wurde zunächst die Transkription von FoxJ1 analysiert. FoxJ1 gilt als Masterkontrollgen motiler Cilien und seine korrekte Transkription ist somit Vorraussetzung für die Bildung und Beweglichkeit der GRP-Cilien (Stubbs et al., 2008; Yu et al., 2008). FoxJ1-abhängiger Einfluss der FGF-Signalaktivität auf die LR-Achsenentwicklung Im Zebrabärbling führt die Applikation von SU5402 oder der Knockdown des FGFR1 zu einer Reduktion der Cilienlänge im Kupffer`schen Vesikel. Auch eine Reduktion der GRPCilien im Frosch konnte hierbei durch Fehlexpression von dnFgfr1 beschrieben werden (Neugebauer et al., 2009). In dieser Arbeit induzierten Injektionen einer vergleichbaren Konzentration von dnFgfr1 Gastrulationsdefekte, welche die Ausbildung einer funktionellen GRP verhinderten und damit eine Analyse der GRP-Cilien nicht ermöglichten. Dennoch ließen sich diese dnFgfr1-injizierten Embryonen sowie Embryonen, die ab frühen Gastrulastadien in SU5402 inkubiert wurden, auf die Expression von FoxJ1 im 32 Ergebnisse superfiziellen Mesoderm untersuchen. Embryonen, die vor Erreichen des Stadiums 11 in SU5402 inkubiert wurden, wiesen eine signifikante Reduktion von FoxJ1 im superfiziellen Mesoderm auf. Untersucht wurden hierbei Embryonen, die ab dem 128-Zellstadium, ab St.8/9 oder ab St.10,5-11 in 80µM SU5402 inkubiert wurden (n=57, Abb. 7A’). Die Transkription von FoxJ1 wurde durch die Inhibition des FGF-Signalwegs insoweit reduziert, dass in den untersuchten Embryonen nur eine schwache (66%), eine sehr schwache (33%) oder keine (4%) Genexpression zu erkennen war, wohingegen 94% der Kontrollembryonen FoxJ1 stark exprimierten (n=71, p<0,001, Abb. 7A’). Zudem wurden Funktionsverlustexperimente durch Fehlexpression von dnFgfr1 auf die Transkription von Foxj1 untersucht. Injektionen von dnFgfr1, die im 4-Zellstadium beidseitig in der C1-Region durchgeführt wurden, ließen bei Injektion von 16pg mRNA (n=19) im Vergleich zu den Kontrollembryonen (n=13) keine signifikante Reduktion von FoxJ1 im superfiziellen Mesoderm erkennen (p=0,683, Abb. 7B’). Dagegen bewirkten hohe Konzentrationen von dnFgfr1-mRNA (240pg, n=27) einen signifikanten Unterschied gegenüber den Kontrollembryonen (p=0,027, Abb. 7B’) und gegenüber den niedrigen Konzentrationen von dnFgfr1-mRNA (16pg, p=0,004, Abb. 7B’). Da der Funktionsverlust von FGF-Signalaktivität mittels SU5402-Inkubation oder durch Injektion von dnFgfr1 eine negative Wirkung auf die Expression von FoxJ1 im superfiziellen Mesoderm zeigte, wurde der Funktionsgewinn durch Überexpression des Liganden Fgf8b untersucht. Hierbei sollte analysiert werden, ob der Funktionsgewinn im Gegenzug eine positive Wirkung auf FoxJ1 ausübt. Embryonen wurden dazu im 4Zellstadium in die dorsale (C1), dorsolaterale (C2) oder in die ventrale (C4) Randzone injiziert. In der Tat bewirkte die Überexpression von Fgf8b-DNA (5pg) eine Verstärkung des FoxJ1-Signals (Abb. 7C). Die Anschnitte in Abb. 7C zeigen, dass sich die ektopisch induzierte Transkription bei dorsal injizierten Embryonen in den Schichten des tiefen Mesoderms wiederfand und sich zudem im tiefen Gewebe in Richtung des animalen Pols ausweitete. Ventrale Injektionen bewirkten ebenfalls eine ektopische Induktion, allerdings befand sich die ektopische Expression in der superfiziellen Schicht und nicht im tiefen Gewebe der ventralen Randzone (Abb. 7C). Die Analyse der FoxJ1-mRNA Lokalisation zeigte, dass SU5402-Inkubationen ab frühen Gastrulastadien sowie die Fehlexpression an hohen Konzentrationen von dnFgfr1 einen spezifischen Effekt auf die LR-Achsenentwicklung hatten (Abb. 7A’,B’). Wie auch im 33 Ergebnisse Abbildung 7: Abhängigkeit der FoxJ1-Expression von der FGF-Signalaktivität (A-C) Expressionsanalyse von FoxJ1 im superfiziellen Mesoderm von Embryonen im Gastrulastadium. Bilder zeigen vegetale Ansicht, dorsal oben. (A) Beispielbilder der Expressionsstärken von FoxJ1 nach Inkubation in SU5402 beginnend ab St.8/9. (A’) Die Applikation von SU5402 vor Erreichen des Gastrulastadiums 11 führte zur einer signifikanten Reduktion von FoxJ1 im Vergleich zur DMSO-Kontrollinkubation. (B) Beispielbilder der Expressionsstärke von FoxJ1 eines Kontrollembryos und nach beidseitiger Injektion von 16pg oder 240pg dnFgfr1-mRNA in die dorsale Randzone (2xC1) im 4-Zellstadium. Dabei bewirkte nur die Injektion einer hohen Konzentration des dnFgfr1 eine signifikante Reduktion von FoxJ1 (B’). (C) Ektopische Induktion von FoxJ1 nach Überexpression von Fgf8b. Kontrollembryo im Vergleich zu Embryonen, die im 4Zellstadium mit Fgf8b-DNA (5pg) beidseitig in die dorsale (2xC1), einseitig in die dorsolaterale (rechts C2) oder beidseitig in die ventrale (2xC4) Randzone injiziert wurden. Beispielbilder mit den jeweiligen Anschnitten (gestrichelte schwarze Linie) auf Höhe der wildtypischen oder ektopischen Expressionsdomänen. Im wildtypischen Kontrollembryo beschränkte sich die Expression auf das 34 Ergebnisse superfizielle Epithel der dorsalen Seite, während die FoxJ1-Expression durch Fgf8b-Überexpression auf der dorsalen Seite sowohl superfiziell (orange Pfeilspitze) als auch radial in die tiefen Schichten des Mesoderms (gelbe Pfeilspitze) erweitert wurde. Oftmals weitete sich die FoxJ1-Expression noch weiter in animaler Richtung in der tiefen Schicht aus (grüne Pfeilspitzen). Durch ventrale Injektion konnte FoxJ1 in der superfiziellen Schicht der ventralen Randzone (rote Pfeilspitze) ektopisch induziert werden. Zebrabärbling konnte so eine Rolle der FGF-Signalaktivität für die Expression von FoxJ1 und somit indirekt für die Bildung der GRP-Cilien beobachtet werden. Allerdings bewirkte die Injektion von dnFgfr1 in niedrigen Konzentrationen keine erkennbare Abweichung von der wildtypischen FoxJ1-Transkription (Abb. 7B’), obwohl diese niedrigen Konzentration dennoch LR-Achsendefekte zur Folge hatten (Abb. 5A). Ob der hierbei auftretende signifikante Verlust von Pitx2c auf einer weiteren FoxJ1-unabhängigen Funktion des FGFSignalwegs in der LR-Determinierung beruht, sollte durch SU5402-Inkubationen ab mittleren/späten Gastrulastadien geklärt werden. FoxJ1-/Cilien-unabhängiger Einfluss der FGF-Signalaktivität auf die LR- Achsenentwicklung Für die Analyse der Inkubationen ab mittleren Gastrulastadien wurden Embryonen ab St.11 in SU5402 (80µM) oder DMSO (0,4%) inkubiert und zum Teil im St.12 für eine FoxJ1-Analyse fixiert. Zusätzlich wurden Embryonen bis St.17 behandelt und dann einerseits für die Expressionsanalyse des FoxJ1-Zielgens Tekt2 fixiert (Stubbs et al., 2008). Der andere Teil der im St.17 gestoppten Embryonen wurde im Schwanzknospenstadium für die Expressionsanalyse von Pitx2c fixiert, um den Verlust dieses asymmetrischen Markergens durch SU5402-Inkubation zu kontrollieren. Sowohl die Transkription von FoxJ1 als auch die von Tekt2 zeigte keine Abschwächung durch SU5402 im Vergleich zur DMSO-Kontrolle (Abb. 8A). Da Inkubationen ab St.11 keine Blastoporusschlussdefekte aufwiesen, konnten diese Embryonen auf die GRPCilierung untersucht werden. Die unbeeinträchtigte Expression von FoxJ1 bei Inkubationsexperimenten ab den mittleren/späten Gastrulastadien spiegelte sich auch in der rasterelektronenmikroskopischen (REM) Analyse der GRP-Cilien im Neurulastadium 17/18 wieder. Hierfür wurden Aufnahmen des medialen Anteils der GRP nach SU5402 (40µM)- oder DMSO (0,2%)-Inkubation ab St.11-11,5 (zwei unabhängige Experimente) mittels ImageJ ausgewertet. Weder in der Cilierungsrate (p=0,482), der Durchschnittsgröße der Zelloberfläche (p=0,148), der Cilienlänge (p=0,168) oder der 35 Ergebnisse 36 Ergebnisse Abbildung 8: SU5402-Inkubationen ab mittleren/späten Gastrulastadien üben keinen Effekt auf die Ciliogenese der GRP aus (A) Expressionsanalyse des Masterkontrollgens für motile Cilien FoxJ1 im Gastrulastadium (vegetale Ansicht, dorsal oben) und seines Zielgens Tekt2 im Neurulastadium (ventrale Ansicht auf die GRP von dorsalen Explantaten) zeigte keine Reduktion der Expressionsstärke durch Inkubation in SU5402. (B) REMAufnahmen der medialen GRP wurden mittels ImageJ bezüglich der Cilierungsrate, der Zellgröße, der Cilienlänge und der Cilienlokalisation ausgewertet und wiesen keine signifikanten Unterschiede zwischen SU5402- und DMSO-inkubierten Embryonen auf. (C) Analyse des linksgerichteten Flüssigkeitsstroms durch Applikation fluoreszierender Kügelchen auf dorsale Explantate. Die Ausrichtung des Flüssigkeitsstroms nach links ist beispielhaft anhand eines DMSO- oder SU5402-inkubierten Embryos dargestellt. Dabei ist in den jeweiligen oberen Abbildungen der mittels Zeitrafferaufnahmen dokumentierte Bereich dargestellt. Die Partikelbewegungen der einzelnen Mikrobeads konnten durch die maximalen Grauwerte der einzelnen Zeitrafferaufnahmen dargestellt werden. Da mit dem „ParticleTracker“ Plugin von ImageJ alle Partikelbewegungen erfasst wurden, wurde in ImageJ eine Maske (Polygon) anhand der Durchlichtaufnahme erstellt, um speziell die Partikelbewegung innerhalb der GRP (einzelne Partikelbewegungen in bunt dargestellt) zu analysieren. Mittels eines in der Programmiersprache R geschriebenen Programms wurden die so erlangten Daten entlang der X- und Y-Koordinaten aufgegliedert. In den Windrosendiagrammen sind die Projektionen der Richtungsvektoren der Partikel dargestellt, wobei linksgerichtete Partikel den größten Anteil ausmachten. Die Quantifizierung der Rho-Werte machte deutlich, dass DMSO- und SU5402-inkubierte Embryonen eine wildtypische Direktionalität (Rho>0,6) hatten. Diese Analyse wurde mit Hilfe von Thomas Thumberger durchgeführt (Thumberger, 2011). n, Anzahl der Embryonen Cilienlokalisation (p=0,641) ergab sich ein signifikanter Unterschied zwischen der DMSO(n=12) und der SU5402- (n=15) Inkubation (Abb. 8B). Die Funktionalität der GRP-Cilien nach SU5402-Inkubation wurde durch die Analyse des linksgerichteten Flüssigkeitsstroms verifiziert (Inkubation ab St.11-11,5; 2 unabhängige Experimente). Dieser Teil der Analyse wurde zusammen mit Thomas Thumberger durchgeführt (Thumberger, 2011). Von Embryonen im St.17 wurden dorsale Explantate angefertigt, diese in eine Lösung mit fluoreszierenden Latexkügelchen transferiert, um dann die Bewegungen der Mikrobeads mikroskopisch anhand von Zeitrafferaufnahmen zu verfolgen. Mittels des „ParticleTracker“ Plugin von ImageJ konnten die einzelnen Partikelbewegungen analysiert werden (Sbalzarini and Koumoutsakos, 2005; Schweickert et al., 2007; Vick et al., 2009). Die Direktionalität der Partikel wurde durch die dimensionslose Zahl Rho zusammengefasst. Ein Rho-Wert gegen 0 steht für zufällige Bewegungen, während ein Rho-Wert gegen 1 bedeutet, dass alle Bewegungen in die gleiche Richtung verlaufen. Der Flüssigkeitsstrom wird dabei als wildtypisch gewertet, wenn er nach links gerichtet ist und der Rho-Wert zwischen 0,6 und 1 liegt, da Rho-Werte unter 0,6 auch auf Brownschen Molekularbewegungen beruhen können. Sowohl DMSO (0,2%)- als auch SU5402 (40µM)-inkubierte Embryonen wiesen einen wildtypischen Flüssigkeitsstrom auf (DMSO: n=9, Ø-Rho-Wert: 0,76; SU5402: n=15, Ø-RhoWert: 0,70; p=0,1521; Abb. 8C). 37 Ergebnisse Die Ausbildung der GRP-Cilien wurde ebenfalls rasterelektronenmikroskopisch analysiert, nachdem die FGF-Signalaktivität durch Fehlexpression niedriger Konzentrationen von dnFgfr1 inhibiert wurde. Embryonen, die nach Injektion niedriger Mengen an dnFgfr1mRNA (8-12pg) einen geschlossenen Blastoporus aufwiesen, wurden im Neurulastadium 17/18 fixiert und die Länge ihrer GRP-Cilien anhand von REM-Aufnahmen ausgemessen. Dabei ergab sich kein signifikanter Unterschied in der Cilienlänge zwischen den ß-Galinjizierten Kontrollembryonen (n=7) und den dnFgfr1-injizierten Embryonen (n=8, Abb. 9B, p=0,817). Einhergehend mit der wildtypischen FoxJ1-Expression ließ sich somit auch durch die Längenausmessung kein Einfluss von niedrigen dnFgfr1-Konzentrationen auf die Bildung der GRP-Cilien feststellen. Abbildung 9: niedrige Konzentrationen von dnFgfr1 üben keinen Effekt auf GRP-Cilienlänge aus Analyse der Cilienlänge im Neurulastadium anhand von REM-Aufnahmen nach beidseitiger Injektion von ßGal- oder dnFgfr1-mRNA (8-12pg) in die dorsale Randzone (2xC1). (A) Aufnahmen eines ß-Gal-injizierten Kontrollembryos und eines dnFgfr1-injizierten Embryos mit jeweiligen Vergrößerungen im Bereich der GRP. (B) Die Ausmessung der Cilienlänge ließ keine signifikanten Unterschiede zwischen ß-Gal- und dnFgfr1injizierten Embryonen erkennen. n, Anzahl der Embryonen; n.s., nicht signifikant Weder SU5402-Inkubationen ab mittleren/späte Gastrulastadien noch Injektionen niedriger Konzentrationen von dnFgfr1 weisen somit einen Effekt auf die Expression von FoxJ1 und die Cilierung der GRP nach. Aufgrund der Tatsache, dass diese Experimente dennoch einen Verlust der asymmetrischen Pitx2c-Expression bewirkten, muss FGF-Signalaktivität neben ihrer Funktion in der Expressionskontrolle von FoxJ1 noch eine andere Rolle in der LR-Achsenentwicklung ausüben. 38 Ergebnisse Die Expression der paranotochordalen Nodal-Domäne ist eine Voraussetzung für die asymmetrische Geninduktion in der Seitenplatte (Brennan et al., 2002). Deswegen wurde im nächsten Schritt untersucht, ob diese FGF-abhängig induziert wird. FGF-Signalaktivität beeinflusst die paranotochordale Expression von Xnr1 und Coco Zur Untersuchung der bilateralen Xnr1-Domäne nach SU5402-Applikation, wurden Inkubationen ab mittleren/späten Gastrulastadien durchgeführt und die Inkubationsansätze im Neurulastadium 17/18 gestoppt. Ein Teil der Embryonen wurde direkt im Anschluss für die Expressionsanalyse im Neurulastadium fixiert. Der andere Teil der Embryonen wurde zur Kontrolle der Experimente im Schwanzknospenstadium für die Analyse von Pitx2c fixiert. Parallel zum Verlust der Pitx2c-Expression, ließ sich eine starke Reduktion oder der komplette Verlust der paranotochordalen Xnr1-Domäne feststellen (Abb. 10A). SU5402Inkubationen ab St.12-12,5 hatten wie oben gezeigt einen etwa 70%-igen Verlust von Pitx2c zur Folge (Abb. 4B). Die Expression von Xnr1 war dabei ebenfalls in einem Anteil von etwa 70% stark reduziert oder fehlte vollständig (50µM SU5402, n=152, p<0,001, Abb. 10B). Damit konnte der Verlust der linksseitigen Seitenplattenidentität bei Inkubationen ab späten Gastrulastadien, trotz wildtypischer FoxJ1-Expression, durch den Verlust der bilateralen Xnr1-Domäne erklärt werden. Um näher zu analysieren, ob das Fehlen der Xnr1-Expression nach SU5402-Applikation auf einem Defekt auf transkriptioneller Ebene beruht, wurde des Weiteren die Expression des Nodal-Antagonisten Coco untersucht, da Coco in den gleichen Zellen wie Xnr1 exprimiert wird (Vonica and Brivanlou, 2007). Die Expression von Coco war dabei wie die Expression von Xnr1 nach SU5402-Inkubation reduziert (Abb. 10A). Bei SU5402Inkubationen ab Stadium 12-12,5 war Coco ebenfalls zu fast 70% stark reduziert oder fehlte vollständig (n=78, p<0,001, Abb. 10B). 39 Ergebnisse Abbildung 10: Verlust der paranotochordalen Xnr1-/Coco-Expression durch Inhibition der FGFSignalaktivität 40 Ergebnisse Expressionsanalyse von Xnr1 und Coco im Neurulastadium 17/18. (A,D,E) Beispiele der Expressionsmuster. Ventrale Ansicht auf die GRP dorsaler Explantate (A,B) Embryonen wiesen nach Inkubation ab St.12 in DMSO oder SU5402 eine stark reduzierte oder fehlende Expression auf. (B) Der Anteil an Embryonen mit stark reduzierter oder fehlender Xnr1- oder Coco-Transkription war nach SU5402-Inkubation signifikant. (C,D) Embryonen wiesen nach einseitiger Injektion von dnFgfr1-mRNA (8-12pg) oder –DNA (5-8pg) in die dorsolaterale Randzone (C2) im 4-Zellstadium eine stark reduzierte oder fehlende Expression auf der injizierten Seite auf. (C) Der Anteil an Embryonen mit stark reduzierter oder fehlender Xnr1- oder CocoTranskription war nach Fehlexpression von dnFgfr1 signifikant. (D) Unabhängig vom Expressionsmuster der injizierten Embryonen konnte eine Verschiebung (schwarz gestrichelte Linie) oder eine normale Ausprägung (orange gestrichelte Linie) des Blastoporus beobachtet werden. (E,F) Embryonen wiesen nach Injektion von Fgf8b-DNA (5-8pg) in die dorsolaterale Randzone (C2) im 4-Zellstadium eine Verbreiterung der endogenen Expressionsdomäne auf (gelbe Pfeilspitze). (F) Die Injektion von Fgf8b-DNA in die rechte Seite bewirkte einen signifikanten Anteil an Embryonen mit verbreiterter Xnr1- oder Coco- Expression, während die Expression von Pitx2c im Schwanzknospenstadium unverändert blieb. wt, wildtypisch Zur Verifizierung, dass der Xnr1/Coco-Expressionsverlust nach SU5402-Inkubation spezifisch auf der Inhibition von FGF-Signaltransduktion beruht, wurden auch dnFgfr1injizierte Embryonen untersucht. Embryonen, die nach Injektion von dnFgfr1 keinen Blastoporuschlussdefekt aufwiesen, wurden im St.17/18 für die Expressionsanalyse von Xnr1 oder Coco fixiert. Wie bei der Applikation von SU5402 konnte ein Effekt beobachtet werden, wenn in die dorsale Randzone injiziert wurde. RNA (8-12pg)- und DNA (5-8pg)– Injektionen lieferten wiederum vergleichbare Ergebnisse und wurden zusammengefasst. Injektionen in die C2-Region hatten einen höheren Anteil von Embryonen mit reduzierter Transkription als Injektionen in die C1-Region zur Folge. Da einseitige Injektionen durchgeführt wurden, fanden die Änderungen in der Expressionsstärke unilateral auf der injizierten Seite statt und die uninjizierte Seite diente als interne Kontrolle. In WildtypEmbryonen kommt es vor, dass die mRNA-Lokalisation auf einer Seite etwas größer ist als auf der anderen. Es wurden nur Seitenunterschiede gewertet, die das Maß der wildtypischen Unterschiede überschritten. Dabei war die Expression auf der injizierten Seite entweder auffällig stark reduziert (Kategorie „reduziert“) oder fehlte vollständig (Kategorie „fehlend“; Abb. 10D). So ergab sich durch Injektion in die linke (vier unabhängige Experimente) oder rechte C2-Region (zwei unabhängige Experimente) ein signifikanter Anteil von 34% (linke Seite, n=53), bzw. 36% (rechte Seite, n=45) an Embryonen, die eine reduzierte oder keine Expression auf der injizierten Seite aufwiesen (p<0,001, Abb. 10C). Bei der Expressionsanalyse von Coco ließ sich nach Injektion von dnFgfr1 ein vergleichbarer Effekt wie auf Xnr1 feststellen. So ergab sich durch Injektion in die linke (neun unabhängige Experimente) oder rechte C2-Region (zwei unabhängige Experimente) ein signifikanter Anteil von 43% (linke Seite, n=217), bzw. 38% (rechte Seite, n=21) an Embryonen, die eine reduzierte oder keine Expression von Coco auf der injizierten Seite aufwiesen (p<0,001, Abb. 10C). 41 Ergebnisse Unabhängig davon ob Xnr1 oder Coco in den dnFgfr1-injizierten Embryonen reduziert waren oder nicht, ließen sich bei manchen Embryonen Auffälligkeiten im Bereich des Blastoporus erkennen: Die Wölbung des „circum blastoporal collars“ (CBC) war auf der uninjizierten Seite stärker ausgeprägt als auf der injizierten Seite und der Blastoporus somit schräg verschoben (schwarz gestrichelt, Abb. 10D). Bei den meisten Embryonen war dies aber nur leicht oder nicht ausgebildet. Eine direkte Korrelation zwischen der Expressionsreduktion und einer abnormalen Blastoporusentwicklung bestand dabei nicht, sodass beide Phänotypen unabhängig voneinander beobachtet wurden. Neben diesen Funktionsverlustexperimenten wurden Funktionsgewinnexperimente mit Fgf8b durchgeführt. Dazu wurde Fgf8b-DNA (5-8pg) in die dorsolaterale Randzone (C2) von Embryonen im 4-Zellstadium injiziert, um den lateralen Bereich der GRP zu treffen. Anders als der Funktionsverlust hatte die Fgf8b-Überexpression eine Verbreiterung der Xnr1- und Coco-Domänen auf der injizierten Seite zur Folge. So war bei Injektion in die rechte Seite in 45% (n=148) Xnr1 und in 43% (n=120) der untersuchten Embryonen Coco auf der rechten Seite verbreitert (p<0,001, Abb. 10E). Ein Teil der injizierten Embryonen wurde im Schwanzknospenstadium fixiert und die Expression von Pitx2c analysiert. Während sich mittels Xnr1-Überexpression auf der rechten Seite die asymmetrische Genkaskade ektopisch im rechten Seitenplattenmesoderm induzieren lässt, hatte die Überexpression von Fgf8b auf der rechten Seite trotz Verbreiterung der rechten paranotochordalen Xnr1-Domäne keinen Effekt auf Pitx2c (p=0,376, Abb. 10E). Dies lässt sich dadurch erklären, dass zeitgleich auch die Transkription des Xnr1-Antagonisten Coco auf der rechten Seite anstieg. Der zeitgleiche Verlust von Xnr1- und Coco-Transkription durch systemische SU5402Inkubation oder durch Fehlexpression von dnFgfr1 legte den Schluss nahe, dass die Inhibition des FGF-Signalwegs möglicherweise auch das Zellschicksal dieser Zellen während ihrer Entwicklung beeinflusste. Um daher in einem weiteren Schritt die Auswirkungen des FGF-Signalverlustes auf die Zellen besser untersuchen zu können, wurden diese näher charakterisiert. 42 Ergebnisse Expression der paranotochordalen Xnr1-Domäne tritt in den somitischen GRPZellen auf Zur Charakterisierung der Xnr1-exprimierenden Zellen wurde eine vergleichende Expressionsanalyse von Markergenen im Neurulastadium 17/18 durchgeführt. Die GRP wird seitlich von entodermalen Zellen begrenzt (Shook et al., 2004). Als Markergen für das Entoderm sparte Panza-Expression den Bereich der GRP aus (Abb. 11A). Shh, das während Neurulastadien neben seiner Expression in der Bodenplatte des Neuralrohrs hauptsächlich im Notochord transkribiert wird, nahm dabei den Bereich ein, der medial von der Xnr1-Domäne ausgespart wurde (Abb. 11C,D). Xnr1-mRNA lokalisierte in den Zellen, die weder zum Notochord (Shh) noch zum Entoderm (Panza) beitragen. Dies veranschaulichte die Aussparung, die bei einer zeitgleichen in-situ-Hybridisierung (ISH) von Shh und Panza ensteht (Abb. 11B). In transversalen Anschnitten ließen sich anhand der Struktur die Grenzen zwischen dem Notochord, den Somiten und den entodermalen Zellen erkennen. Das somitische Mesoderm, das wie schon zuvor beschrieben zur GRP beiträgt und dabei den lateralsten Anteil der GRP ausmacht, war auf der Höhe der GRP Xnr1-positiv (Abb. 11D’). Der mediale Anteil der GRP war positiv für Shh (Abb. 11C’). Dnah9 und Tekt2 sind Zielgene von FoxJ1, die im cilierten Epithel der GRP exprimiert werden (Stubbs et al., 2008; Vick et al., 2009). Dnah9 und Tekt2 wurden sowohl von den Shh-positiven als auch in den Xnr1-positiven Zellen exprimiert (Abb. 11E,E’,F,F’). Die Kolokalisation von Xnr1, Tekt2 und Dnah9 zeigt, dass Xnr1-positive Zellen selbst Teil der GRP sind. Da diese Zellen seitlich von den entodermalen Panza-positiven Zellen eingegrenzt werden, stellen sie zudem den lateralsten Anteil der GRP dar. Im Anschluss an eine Xnr1-ISH wurde eine REM-Analyse durchgeführt. Durch die spätere Überlagerung der Xnr1-ISH-Aufnahme mit der korrespondierenden REM-Aufnahme konnte der Cilienbesatz der randständigen Xnr1-positiven Zellen und ihr Anteil an der GRP bestätigt werden (Abb. 11G, Pfeilspitzen zeigen auf Cilien; REM-Aufnahme von Tina Beyer). Die lateralsten Zellen der GRP, die später in den Somitenverbund integriert werden, exprimieren wie auch das tiefe somitische Gewebe MyoD als Markergen in diesen Stadien. Der Vergleich der Xnr1- und MyoD-Expression in transversalen Schnitten wies die Überlappung beider Genexpressionen im Bereich der somitischen GRP nach und bestätigte die somitische Identität der Nodal-exprimierenden Zellen (Abb. 11H). 43 Ergebnisse Abbildung 11: Xnr1-Expression in den somitischen Zellen der GRP (A-F) Expressionsanalyse der dorsalen Explantate mit korrespondierenden transversalen Anschnitten auf Höhe der GRP (C’-F’: das somitische Mesoderm ist gestrichelt umrandet). Panza-positive Zellen lassen den Bereich der GRP frei (A), während Shh nur im medialen Anteil der GRP exprimiert wird (C). Xnr1-Expression tritt in der Aussparung, die bei gleichzeitiger Anfärbung von Panza und Shh entsteht auf (B), und kolokalisiert mit der lateralen Transkription von Tekt2 (E) und Dnah9 (F). (G) Überlagerung einer Aufnahme nach Xnr1ISH mit der korrespondierenden REM-Aufnahme des gleichen Embryos. Die Vergrößerung im lateralen Xnr1-positiven Bereich lässt die Cilierung dieser Zellen erkennen (orangene Pfeilspitzen). (H) Vergleich von MyoD- und Xnr1-Expression. (H’, H’’) Transversale Schnitte machen deutlich, dass Xnr1-positive Zellen Teil des MyoD-exprimierenden somitischen Mesoderms sind. (I) REM-Aufnahme. Im transversalen Anschnitt auf Höhe der GRP wurde der Anteil des somitischen Mesoderms gelb eingefärbt. Die Vergrößerung auf den epithelialen Anteil dieser Zellen innerhalb der GRP lässt die Cilierung erkennen (Pfeilspitzen zeigen auf die einzelnen Cilien). Gestrichelte Linie in C, E, D, F, H: Schnittebene der jeweiligen Schnitte; N, Notochord; S, somitisches Mesoderm In REM-Analysen sind die somitischen GRP-Zellen optisch gut von den sie flankierenden entodermalen Zellen und den mesodermalen, medialen GRP-Zellen zu unterscheiden, da sie als erste den epithelialen Verbund der GRP verlassen und deswegen im Vergleich etwas eingesunkener sind (Abb. 11I; Shook et al., 2004). Anhand transversaler Anschnitte 44 Ergebnisse auf Höhe der GRP ließ sich der somitische GRP-Anteil deutlich erkennen (Abb. 11I, Pfeilspitzen zeigen auf Cilien). Xnr1 und Coco werden paranotochordal in denselben Zellen transkribiert. In diesem Abschnitt konnte gezeigt werden, dass diese Zellen Teil der somitischen GRP sind und den lateralsten Bereich der GRP ausmachen. Die nähere Charakterisierung macht es möglich, die Wirkung des FGF-Signalverlusts auf die Bildung dieser Zellen zu untersuchen. FGF-Signalaktivität beeinflusst die Bildung somitischer GRP-Zellen Neben einer gemeinsamen FGF-abhängigen Transkriptionskontrolle lässt sich der zeitgleiche Verlust von Xnr1 und Coco nach Inhibition des FGF-Signalwegs auch durch einen generellen Verlust der somitischen GRP-Zellen erklären. Ist dem so, sollten keine somitischen GRP-Zellen im Verbund der GRP zu finden sein. Dies lässt sich anhand von REM-Analysen der GRP im Neurulastadium 17/18 untersuchen. Dazu wurden Embryonen aus vier unabhängigen, kontrollierten Inkubationsansätzen (Verlust der Pitx2c- und Xnr1-/Coco-Expression nach SU5402-Applikation) beginnend im Stadium 12-12,5 verwendet (50-80µM SU5402; 0,25-0,4% DMSO). In den DMSOKontrollembryonen konnten die lateralen somitischen GRP-Zellen gut von den entodermalen und medialen GRP-Zellen abgrenzt werden (Abb. 12A). Zum einen verfügen die somitischen GRP-Zellen im Vergleich zu den lateralen Entodermzellen über eine kleinere Zelloberfläche und ein längeres Monocilium (Abb. 12A’’), zum anderen setzt sich morphologisch die Grenze zwischen Notochord und Somiten auch im Epithel der GRP fort. Transversale Anschnitte, in denen sich das Notochord und das somitische Gewebe gut voneinander unterscheiden lassen, erleichtern die Differenzierung auf Höhe der GRP. Zur besseren Veranschaulichung wurde das somitische Mesoderm in silico gelb eingefärbt. Im Gegensatz zur DMSO-Kontrolle ließen sich in den SU5402-inkubierten Embryonen keine somitischen GRP-Zellen differenzieren (Abb. 12B). Die Vergrößerung in Abb. 12B’’ verdeutlicht, dass sich oberhalb des tiefen somitischen Mesoderms keine GRP-ähnlichen Zellen mit langen Cilien im Epithel des Gastrocoels befanden. Dieser Bereich war von Entoderm-spezifisch großen Zellen, die nur über ein kurzes Cilium verfügten, eingenommen (Abb. 12B’’). GRP-spezifische Zellen konnten nach Inkubation in SU5402 45 Ergebnisse 46 Ergebnisse Abbildung 12: Inhibition von FGF-Signaltransduktion führt zum Verlust der somitischen GRP (A-D) REM-Aufnahmen von Embryonen im Neurulastadium 17 nach Inkubation in 0,3% DMSO (A,A’,A’’,C) oder 60µM SU5402 (B,B’,B’’,D) ab St.12-12,5; aufgenommen in zwei verschiedenen Perspektiven. Zellen des somitischen Mesoderms wurden gelb eingefärbt. (A-B) Aufsicht auf den transversalen Anschnitt auf Höhe der GRP. Dorsale Seite des Anschnitts oben, ventrale Seite des Anschnitts mit GRP und Blastoporus unten. Die gesamte GRP ist dabei von einer rot gestrichelten Linie eingefasst. (A,A’) Beispielembryo nach DMSO-Inkubation verdeutlicht Beitrag somitischer Zellen zur GRP. (B,B’) Aufnahme eines Beispielembryos nach SU5402-Inkubation zeigt, dass somitische Zellen nicht zur GRP beitragen. (A’’,B’’) Vergrößerungen im Grenzbereich der jeweiligen GRP in A’ und B’ zeigen lange GRP-Cilien (Pfeilspitzen) im Vergleich zu kurzen Cilien der großen Entodermzellen (Kreis). (C,D) Ventrale Ansicht der GRP der jeweiligen Embryonen aus A und B, anterior oben. (C) Der mediale noto- und hypochordale GRP-Bereich der DMSO-Kontrolle ist von einer gelb gestrichelten Linie eingefasst. Der CBC („circum blastoporal collar“) ist wildtypisch gewölbt (rote Sternchen). (D) Nach SU5402-Inkubation weist der CBC keine Wölbung auf (rote Sternchen; gesamte GRP gelb gestrichelt umrandet). (E) In zwei unabhängigen Experimenten wurde die Breite der GRP mittels ImageJ ausgemessen. Dazu wurden für DMSO-Kontrollembryonen zwei verschiedene Werte ermittelt, die Breite der gesamten GRP (grüne Linie) und die Breite des noto-und hypochordalen Anteils der GRP (lila Linie). Für SU5402-inkubierte Embryonen konnte nur die Breite der gesamten GRP (lila Linie) ermittelt werden. Dabei glich sich die gesamte Breite der GRP nach SU5402-Inkubation dem Wert des noto-und hypochordalen GRP-Anteils der DMSO-Kontrollen an. (A-D) Maßbalken (gelb) entsprechen einer Länge von 50µm (A,B) und 20µm (A’,A’’,B’,B’’,C,D). n: Anzahl der Embryonen; N, Notochord; S, somitisches Mesoderm nur in dem Bereich beobachtet werden, der bei den DMSO-Kontrollembryonen von den medialen GRP-Zellen eingenommen wurde. In zwei dieser Inkubationsansätze wurde die Breite der GRP anhand der REM-Aufnahmen ausgemessen. Während bei den Embryonen der DMSO-Kontrolle sowohl die Breite der gesamten GRP, als auch die Breite abzüglich des somitischen Anteils bestimmt wurde, war es bei den SU5402-inkubierten Embryonen nicht möglich, zwischen diesen Zellbereichen zu unterscheiden (Abb. 12C,D). Zur Veranschaulichung der Reduktion nach SU5402 der beiden Inkubationsexperimenten wurde das jeweilige arithmetische Mittel der gesamten GRP-Breite (Somiten + Notochord + Hypochord) der DMSO-Kontrollen auf 1 gesetzt. Es zeigte sich, das die Breite der GRP durch die Inkubation in SU5402 im Vergleich zur Breite der Kontrolle signifikant reduziert wurde (p<0,001, Abb. 12E). Die GRP-Breite glich sich in ihrem Ausmaß mehr dem Wert des nur hypo- und notochordalen Anteils der Kontrolle an (p=0,0289, Abb. 12E). Eine weitere Beobachtung, die durch SU5402-Inkubation gemacht werden konnte, war eine Abflachung im Bereich des CBCs. Während dieser Bereich in Kontrollembryonen eine Wölbung um den Blastoporus bildet, die anterior im Übergang zur GRP abflacht, wiesen SU5402-behandelte Embryonen keine solche Wölbung auf (vergleiche Abb. 12 C und D). Anhand der REM-Analyse ließ sich somit durch die Inkubation in SU5402 eine Reduktion der GRP auf den medialen noto- und hypochordalen Anteil und ein Verlust der somitischen GRP-Zellen dokumentieren. Der Beitrag somitischer Zellen zur GRP kann auch anhand einer MyoD-ISH analysiert werden. Im Falle des Verlusts somitischer GRP47 Ergebnisse Zellen sollten sich keine MyoD-positiven Zellen auf Höhe der GRP befinden. Hierzu wurde der dnFGFR1 unilateral überexprimiert und anschließend eine MyoD-Expressionsanalyse durchgeführt. In transversalen Schnitten ragten MyoD-positive Zellen nur auf der uninjizierten Seite bis auf die Höhe des Archenteronepithels (Abb. 13A). Die REM-Analyse von drei unabhängigen Experimente ergab, dass durch unilateraler Injektion von dnFgfr1 bei 64% der untersuchten Embryonen eine Reduktion der somitischen GRP-Zellen auf der injizierten Seite stattfand, die die Breite des somitischen GRP-Bereichs teilweise nur leicht verringerte, während in 16% der Embryonen keine somitischen GRP-Zellen auf der injizierten Seite zu unterscheiden waren (n=25, Abb. 13B). Zusätzlich sollte die Auswirkung des FGF-Funktionsgewinns auf die lateralen somitischen GRP-Zellen durch Überexpression von Fgf8b untersucht werden. Dazu wurden die Embryonen ebenfalls im 4-Zellstadium in die dorsolaterale Randzone (C2) injiziert. Umgekehrt zum Funktionsverlust hatte die Fgf8b-Überexpression eine Verbreiterung der Xnr1Expressionsdomäne auf der injizierten Seite zur Folge. Dies wurde oftmals von einer generellen Verdickung der injizierten Seite begleitet. Im Gegenzug dazu schien die uninjizierte Seite teilweise etwas ausgedünnter. In Abb. 13C ist ein Embryo dargestellt, der im transversalen Anschnitt eine Verbreiterung der Xnr1-positiven Domäne auf der injizierten Seite aufweist. Dieser Embryo wurde zudem rasterelektronenmikroskopisch untersucht, um die generelle Verdickung der injizierten Seite zu veranschaulichen (Abb. 13C,C’). Während die Verbreiterung der Xnr1- und Coco-Expressionsdomäne in solchen Embryonen mit einer generellen Größenzunahme der injizierten Seite einherging, wiesen einige der untersuchten Embryonen auch dann eine verstärkte Xnr-1 oder CocoTranskription auf, wenn die injizierte Seite nicht erkennbar größer war als die uninjizierte Seite. Somit konnte man eine Vergrößerung des somitischen GRP-Epithels auf der injizierten Seite beobachten, die nicht von einer generellen Verdickung der injizierten Seite begleitet wurde (Abb. 13D,D’). 48 Ergebnisse Abbildung 13: FGF-Signalaktivität determiniert die somitischen GRP-Zellen 49 Ergebnisse (A-D) Embryonen wurden im Neurulastadium 17/18 bezüglich der Ausbildung somitischer GRP-Zellen untersucht. (B,B’,C’,D,D’) REM-Aufnahmen. Der Grenzbereich zwischen GRP und Entoderm und zwischen noto-/hypochordalen und somitischen GRP-Bereich wurde gelb eingestrichelt und die somitischen Zellen gelb eingefärbt. (A-B) Embryonen, die im 4-Zellstadium linksseitig in die dorsolaterale Randzone (C2) mit dnFgfr1-RNA (8-12pg) injiziert wurden. (A, A’) ISH auf MyoD. Im Transversalschnitt auf Höhe der GRP lassen sich auf der injizierten Seite keine somitischen Zellen erkennen (orange Pfeilspitze). (B, B’) Durch Fehlexpression von dnFgfr1 kam es zur Reduktion somitischer GRP-Zellen auf der injizierten Seite. (B’) In der Vergrößerung weisen rote Pfeilspitzen auf die langen Cilien des GRP-Epithels, wohingegen die blauen Pfeilspitzen die kurzen Cilien des Entodermepithels markieren. (C-D) Embryonen, die im 4-Zellstadium rechtsseitig in die dorsolaterale Randzone (C2) mit Fgf8b-DNA (5pg) injiziert wurden. (C) Ansicht auf transversalen Anschnitt auf Höhe der GRP nach Xnr1-ISH. Die rechte Xnr1-Expressionsdomäne ist deutlich vergrößert. (C’) Derselbe Embryo wie in (C) wurde zudem rasterelektronenmikroskopisch aufgenommen. Dieselbe Aufsicht wie in (C) verdeutlicht die generelle Größenzunahme der injizierten Seite. (D) Embryo, dessen injizierte Seite keine generelle Größenzunahme und dennoch eine Verbreiterung des somitischen GRP-Anteils aufweist. (D’) Die Vergrößerung im Bereich der GRP macht Vergrößerung des somitischen Anteils deutlich. Orangenes Sternchen: somitisches Mesoderm der injizierten Seite; Ar, Archenteron; Ek, Ektoderm; En, Entoderm; N, Notochord; S, somitisches Mesoderm FGF-Signalaktivität spielt eine wichtige Rolle in der Induktion und Aufrechterhaltung der Mesodermspezifizierung. Durch zeitlich exakt definierte SU5402-Inkubationen konnte nachgewiesen werden, dass FGF-Signalaktivität bis zum Stadium der späten Gastrula für die Bildung somitischer GRP-Zellen entscheidend ist. Da die Mesodermspezifizierung in X. laevis mit Erreichen der späten Gastrulastadien als weitgehend abgeschlossen gilt, lag die Vermutung nahe, dass der Verlust dieser Zellen auf einer mangelnden Aufrechterhaltung ihrer mesodermalen Identität beruht. Deswegen wurden im Folgenden untersucht, inwieweit die Spezifizierung des Mesoderms durch Inhibition von FGFSignalaktivität beeinträchtigt wird. Auswirkungen der SU4502-Inkubationen auf mesodermale Genexpressionen Wie stark SU5402 die mesodermale Genexpression beeinflusste, hing vom Zeitpunkt der Inkubation ab. Wurden Inkubationen in 50-80µM SU5402 im Gastrulastadium 10,5/11 begonnen, so kam es zu einer starken Reduktion der mesodermalen Markergene Xbra und MyoD in späteren Gastrula- und Neurulastadien (Abb. 14). Inkubationen, die dagegen erst in den späten Gastrulastadien (ab St.11,5) gestartet wurden, wiesen keine allgemeine Veränderung der Transkription von Xbra und MyoD in den Neurulastadien auf. Jedoch war der posterior zur GRP gelegene Bereich des CBCs SU5402-behandelter Embryonen bezüglich der Xbra- und MyoD-Expression abgeschwächt und MyoD wies eine leichte Reduktion seiner lateralen Ausbreitung auf (Abb. 14). Inwieweit dieser lokal begrenzte Effekt auf die Mesodermentwicklung bei SU5402-Inkubationen ab St.12/12,5 entscheidend für die Entwicklung der LR-Achse ist, sollte im Folgenden untersucht werden. 50 Ergebnisse Abbildung 14: Reduktion mesodermaler Genexpression durch SU5402-Inkubationen Gastrulastadien: vegetale Ansicht, dorsal oben. Inkubationen in 80µM SU5402 ab St.10,5-11 bewirkten eine Reduktion der Xbra- und MyoD-Expression im Gastrulastadium 11,5 und im Neurulastadium 17 (dorsale Ansicht, anterior oben) im Vergleich zu DMSO-Kontrollembryonen (anterior oben; MyoD: dorsale Ansicht; Xbra: ventrale Ansicht). SU5402-Inkubationen ab St.11,5 bewirkten nur eine leichte Abschwächung von Xbra (ventrale Ansicht) und MyoD (dorsale Ansicht) im Bereich des CBCs im Neurulastadium 17 (gelbe Pfeilspitzen). Vergleich der SU5402-Inkubationen ab St.12-12,5 mit Inkubationen ab St.12,5-13 Da SU5402-Inkubationen ab St.12-12,5 zum Verlust der asymmetrischen Pitx2c-Domäne führten, nicht aber SU5402-Inkubationen ab St.12,5-13, wurden beide Inkubationsansätze in drei unabhängigen Experimenten miteinander verglichen. Dazu wurde in den verschiedenen Ansätzen jeweils ein Teil beginnend St.12-12,5 in SU5402 oder DMSO und ein anderer Teil beginnend St.12,5-13 in SU5402 inkubiert und bei allen drei Ansätzen die Inkubation St.17/18 beendet. Die Embryonen wurden dann entweder direkt im Neurulastadium für die weitere Analyse fixiert oder erst in den Schwanzknospenstadien 28-33. So konnte mit Hilfe der Expressionsanalyse von Pitx2c der Effekt des Experiments kontrolliert werden. Die Expressionsanalyse von MyoD machte deutlich, dass die SU5402Inkubation (50µM) sowohl ab St.12-12,5 (n=30, Abb. 15A), als auch ab St.12,5-13 (n=27, Abb. 15A) zu einer leichten Reduktion der Mesodermspezifizierung im lateralen und posterioren Bereich führte. Im Vergleich zur DMSO-Kontrolle war die Transkription von MyoD auf den Bereich anterior zum Blastoporus begrenzt, sodass bei den beiden verschiedenen SU5402-Ansätzen keine Expression im posterioren Bereich nachgewiesen werden konnte. Wie bereits beschrieben für SU5402-Inkubationen, die einen Effekt auf Pitx2c ausübten, führte auch die Applikation von SU5402 ab St.12,5-13 zu einer vergleichbaren Abflachung des CBCs. 51 Ergebnisse Abbildung 15: Vergleich zwischen SU5402-Inkubationen ab St.12-12,5 und St.12,5-13 (A) MyoD-Expression im Neurulastadium 17/18. SU5402-Inkubationen (50µM) ab St.12/12,5 oder St.12,5/13 übten lateral (Pfeile) und posterior (Sternchen) eine Reduktion von MyoD aus. (A’,A’’) Von verschiedenen Embryonen wurden jeweils die Breite des hypo- und notochordalen GRP-Anteils (grüner Balken in A) und die Breite des somitischen GRP-Anteils (roter Balken in A) anhand von Transversalschnitten mit ImageJ ausgemessen. (A’) Das arithmetische Mittel der Breite des hypo-und notochordalen GRP-Anteils der DMSOKontrollembryonen wurde auf 1 gesetzt und mit dem arithmetischen Mittel der Breite des hypo- und notochordalen GRP-Anteils der SU5402-inkubierten Embryonen verglichen. (A’’) Das arithmetische Mittel der Breite des somitischen GRP-Anteils der DMSO-Kontrollembryonen wurde auf 1 gesetzt und mit dem arithmetischen Mittel der Breite des somitischen GRP-Anteils der SU5402-inkubierten Embryonen verglichen. (B) SU-Inkubationen ab St.12-12,5 (80µM) wiesen einen Verlust der bilateralen Xnr1-Domäne auf. Der generelle Verlust somitischer GRP-Zellen spiegelte sich in dem Verlust der Aussparung, die durch gleichzeitige Färbung von Shh und Panza entstand, wieder. SU5402-Inkubationen ab St.12,5-13 (80µM) wiesen nur eine leichte Reduktion der Xnr1-Expression und eine leichte Verschmälerung des somitischen GRP-Anteils (Shh+Panza) auf. Damit wurden die exakt gleichen Beeinträchtigungen der mesodermalen Spezifizierung auch bei SU5402-Inkubation nach dem Zeitfenster, bei dem die Entwicklung der LR-Achse gestört werden kann, beobachtet. Dieser leichte Effekt auf mesodermales Gewebe außerhalb der GRP sollte somit nicht kausal für die Entstehung von LR-Defekten nach FGF-Funktionsverlust sein. Wenn aber das Fehlen der somitischen GRP-Zellen, wie in 52 Ergebnisse Abb. 12 gezeigt, die Ursache für die Lateralitätsdefekte nach FGF-Funktionsverlust ist, sollten die somitischen GRP-Zellen bei SU5402-Inkubationen ab St.12,5-13 nicht betroffen sein. Da diese späten Inkubationen keinen Effekt auf die linksseitige Expression von Pitx2c hatten, sollten sie folgerichtig im Bereich der GRP mit Wildtyp-Embryonen vergleichbar sein. Um festzustellen, inwieweit sich Inkubationen ab Stadium 12,5-13 auf die Bildung somitischer GRP-Zellen auswirkten, wurden Embryonen, die im St.17/18 auf die Expression von MyoD untersucht wurden, transversal geschnitten (SU5402 St.12-12,5: n=9; SU5402 St.12,5-13: n=5; DMSO St.12-12,5 n=6). Mit dem Vibratom-angefertigte Schnitte wurden photographiert und auf Höhe der GRP miteinander verglichen. Dazu wurde der jeweilige Schnitt verwendet, der den größten Beitrag von MyoD-Expression zum Epithel der GRP aufwies. Die Breite des somitischen Anteils der GRP und die Breite des hypo- und notochordalen Anteils der GRP wurden mit ImageJ ausgemessen. Zum einen wurde das arithmetische Mittel der Breite des hypo- und notochordalen Anteils der DMSOKontrollembryonen auf 1 gesetzt und mit den hypo- und notochordalen Anteilen der beiden verschiedenen SU5402-Ansätze verglichen. Zwischen den verschiedenen Inkubationen ergab sich kein signifikanter Unterschied in der Breite dieses medialen GRP-Anteils (Abb. 15A’; SU5402 St.12-12,5 versus DMSO: p= 0,573; SU5402 St.12,5-13 versus DMSO: p=1,000). Zum andern wurde das arithmetische Mittel der Breite des somitischen GRP-Anteils der DMSO-Kontrollembryonen auf 1 gesetzt und wiederum mit den somitischen Anteilen der beiden verschiedenen SU5402-Ansätze verglichen (Abb. 15A’’). In der Breite der somitischen GRP ergab sich zwischen allen drei Inkubationen ein signifikanter Unterschied. SU5402-Inkubationen ab St.12-12,5 wiesen dabei eine stärkere Reduktion des somitischen Beitrags zur GRP auf als SU5402-Inkubationen ab St.12,5-13 (p<0,001, Abb. 15A’’). Dies ließ sich ebenfalls anhand der Expressionsanalyse von Xnr1 und Shh+Panza erkennen (Abb. 15B). Im direkten Vergleich wiesen die ab St.12-12,5 in SU5402 inkubierten Embryonen zu 50% einen Verlust und zu 37% eine Reduktion von Xnr1 auf (n=59), während die Inkubation ab St.12,5-13 zu 5% eine starke und zu 70% nur eine leichte Reduktion von Xnr1 bewirkte (n=55). DMSO-behandelte Embryonen wiesen höchstens eine leichte Reduktion auf, die 20% der Embryonen betraf (n=54). Die Aussparung der somitischen GRP-Zellen, die bei Doppel-ISH auf Shh+Panza entsteht, wurde durch SU5402-Inkubationen ab St.12-12,5 zu 52% stark reduziert (n=21). SU5402Inkubationen ab St.12,5-13 (n=14) hatten dagegen im Vergleich zu den DMSO-Kontrollen (n=12) nur eine leichte Reduktion der Aussparung zur Folge. Somit bewirkte die 53 Ergebnisse Inkubation ab St.12,5-13 zwar ebenfalls einen Verlust des somitischen Beitrags zur GRP, dieser war aber weniger ausgeprägt. Damit waren bei den späten Inkubationen ab St.12,513 die somitischen Zellen ausreichend vorhanden, was die Induktion der asymmetrischen Seitenplattenexpression gewährleistete. Durch das bemerkenswerte enge Zeitfenster, indem SU5402 einen Einfluss auf die Entstehung der Lateralität hat, konnte somit belegt werden, dass das Fehlen der somitischen GRP-Zellen mit der Entstehung von LRDefekten korreliert und somit kausal sein kann. Sonstige leichte Beeinträchtigungen der Mesodermspezifizierung wiesen dagegen keine Korrelation mit LR-Defekten auf und sollten somit nicht kausal sein. Der FGF-Signalweg ist neben seiner Rolle in der Mesodermspezifizierung in viele andere zelluläre Prozesse wie z.B. Differenzierung, Migration, Chemotaxis, Adhäsion, Zellüberleben, Proliferation oder Apoptose involviert. Im Folgenden sollte untersucht werden, ob die Applikation von SU5402 eine Veränderung in Zellproliferation oder Apoptose bewirkte, welche als mögliche Ursache des Verlusts somitischer GRP-Zellen in Frage kommt. Sollten die Vorläuferzellen der somitischen GRP nach Erreichen des Stadium 12/12,5 – FGF abhängig – proliferieren müssen, damit sie einen messbaren Beitrag zur GRP leisten, müsste sich eine verminderte Zellproliferation zwischen SU5402und DMSO-inkubierten Embryonen nachweisen lassen. Sollte dagegen FGF- Signalaktivität für das Überleben der somitischen Zellen essentiell, so müssten apoptotische Zellen im Bereich der GRP nach SU5402-Inkubation nachgewiesen werden können. Keine verminderte Zellproliferation durch SU5402-Inkubation Während der Chromatinkondensation in proliferierenden Zellen wird das Histon3 phosphoryliert. Proliferierende Zellen können daher durch einen Antikörper nachgewiesen werden, der spezifisch gegen die Ser10-Phosphorylierung von H3 gerichtet ist. In Xenopus-Embryonen konnte gezeigt werden, dass dieser phospho-H3 (pH3) Antikörper Chromosomen während der Prophase/Prometaphase, Metaphase und Anaphase detektiert (Saka et Smith 2001). Zum Nachweis der Zellproliferation wurden in zwei kontrollierten, unabhängigen Experimenten Embryonen ab Stadium 11,5/12 in 60µM SU5402 (n=20) oder 0,3% DMSO (n=17) inkubiert. Die Inkubationen wurden im St. 12,5, St.13/14 oder St.16 gestoppt und 54 Ergebnisse die Embryonen Immunohistochemie zu diesen (IHC) fixiert. unterschiedlichen Zusätzlich zur Entwicklungsstadien pH3-Detektion für wurden die durch Hoechst33342-Färbung die Zellkerne und mit Alexa488-Phalloidin die Zellgrenzen visualisiert. Anhand von Aufnahmen im Bereich der GRP wurde einerseits die Gesamtzahl der Zellen und andererseits die Anzahl pH3-positiver Zellen mit dem „CellCounter“ Plugin von ImageJ ausgezählt. Zwischen SU5402- und DMSO-behandelten Embryonen konnten keine signifikanten Unterschiede in der Zellproliferationsrate festgestellt werden. So lag die Zellproliferationsrate bei beiden Ansätzen in den Stadien 12,5 und 13/14 im Durchschnitt zwischen 7-8% (p=0,869, zusammen dargestellt im Boxplot Abb. 16B), während sie im Stadium 16 Werte zwischen 6-7% annahm (p=0,094, Abb. 16C). Abbildung 16: Keine Verminderung der Zellproliferationsrate nach Applikation von SU5402 (A) Beispielembryonen nach IHC mit Antikörpern gegen phospho-Histon3 (rot), Darstellung der Zellgrenzen mit 488-Palloidin (grün) und Färbung der Zellkerne mit Hoechst33342 (blau) im Bereich der GRP. (B,C) Vergleich der Zellproliferationsrate in den Stadien 12,5 und 13/14 (B) und im Stadium 16 (C) lässt keinen signifikanten Unterschied zwischen der DMSO (0,3%)- und der SU5402 (60µM)-Inkubation erkennen. n, Anzahl der Embryonen. Keine erhöhte Apoptose durch SU5402-Inkubation Im nächsten Schritt wurde durch TUNEL-Analyse untersucht, ob die Inkubation in SU5402 eine verstärkte Apoptose zu Folge hatte. Embryonen mit TUNEL-positiven Zellen lassen sich in Xenopus ab Beginn der Gastrulation im Stadium 10,5 beobachten (Hensey et Gautier 1998). Das Ausmaß des natürlich auftretenden Zelltodes wird dabei als sehr variabel beschrieben. Das Spektrum reicht von Embryonen, die keine einzige TUNELpositive Zelle aufweisen, bis zu Embryonen im gleichen Entwicklungsstadium, die Hunderte von TUNEL-positiven Zellen besitzen. Embryonen mit mehr als fünf TUNELgefärbten Zellkernen wurden dabei als TUNEL-positiv gewertet. In den Entwicklungsstadien 10,5-12,5 und 13, bzw.16/17 konnte so ein Anteil an TUNELpositiven Embryonen von 67%, bzw. 64% beschrieben werden. Mit Einsetzen der 55 Ergebnisse Neurulation können reproduzierbare Muster von apoptotischen Regionen nachgewiesen werden, in denen TUNEL-positive Zellen vor allem im Neuroektoderm auftreten (Hensey et Gautier 1998). Zur Überprüfung des TUNEL-Assays wurden unbehandelte Embryonen im Neurulastadium 17/18 untersucht. Bei Ihnen ließen sich, wie für diese Stadien publiziert, apoptotische Zellen im Bereich des Neuroektoderms detektieren (Abb. 17 A,B). Zum Nachweis der Zellapoptose bei behandelten Embryonen wurden in zwei kontrollierten, unabhängigen Experimenten Embryonen ab Stadium 11,5/12 in 60µM SU5402 oder in 0,3% DMSO inkubiert und in den Entwicklungsstadien 12,5 und 13/14, bzw. in den Stadien 14 und 16 für den TUNEL-Assay fixiert. In diesen frühen Stadien waren TUNEL-positive Zellen hauptsächlich diffus im Ektoderm und Neuroektoderm verteilt, im posterioren Bereich der GRP ließen sich bei beiden Inkubationsansätzen jedoch keine apoptotischen Zellen detektieren. In den Stadien 12,5 und 13/14 war der Anteil TUNEL-positiver Embryonen nach Inkubation in SU5402 (42%, n=26) im Vergleich zur DMSO-Kontrolle (38%, n=21) nicht signifikant erhöht (p=0,770). Sowohl bei der SU5402- als auch bei der DMSO-Inkubation lag hier der Anteil TUNEL-positiver Embryonen etwas unter dem publizierten Anteil von 67%. Abbildung 17: Keine apoptotischen Zellen im Bereich der GRP nach Applikation von SU5402 (A-D) Embryonen nach TUNEL-Färbung im Neurulastadium. Anterior oben (A,B: St.18, dorsale Ansicht; C,D: St.16, dorsale Ansicht; C’,D’: St.16, ventrale Ansicht zeigt GRP). (A, B) TUNEL-Färbung unbehandelter Embryonen mit TUNEL-positiven Zellen, die im Zuge des programmierten Zelltod im Bereich des Neuroektoderms auftreten. (C,D) DMSO (0,3%)- oder SU5402 (60µM)-inkubierte Embryonen mit TUNELpositiven Zellen im Ektoderm. (C’, D’) Weder nach DMSO- noch nach SU5402-Inkubation ließen sich apoptotische Zellen im Bereich der GRP erkennen. 56 Ergebnisse In den Stadien 14 und 16 war der Anteil TUNEL-positiver Embryonen nach Inkubation in SU5402 (71%, n=14) im Vergleich zur DMSO-Kontrolle (67%, n=12) ebenfalls nicht signifikant erhöht (p=0,793). In diesem Experiment lag jedoch die Anzahl TUNEL-positiver Zellen pro positiv-gewerteten Embryo bei den SU5402-inkubierten Embryonen etwas höher (nicht gezeigt). Dieser leicht positive Effekt auf die Zellapoptose nach SU5402Inkubation fand hauptsächlich im Ektoderm statt. Wie auch in den Stadien 12,5 und 13/14 waren die TUNEL-gefärbten Zellen in den Stadien 14 und 16 nie im Bereich der GRP lokalisiert. Somit lieferte die Analyse dieser verschiedenen Entwicklungsstadien keinen Hinweis darauf, dass der Verlust somitischer GRP-Zellen auf Apoptose beruhte. Eine andere Möglichkeit zu untersuchen, ob der Verlust somitischer GRP-Zellen auf einer induzierten Apoptose dieser Zellen beruht, lieferte die Überexpression von Bcl-XL. Proteine der Bcl2 (B-cell lymphoma 2) Familie wirken entweder pro- oder antiapoptotisch (Youle and Strasser 2008). Antiapoptotische Proteine der Bcl2-Familie können eine Rolle bei der Entstehung von Tumoren spielen, indem sie den Zelltod verhindern (Vaux et al.1988). Durch die Überexpression von Bcl-XL lässt sich in Xenopus-Embryonen sowohl der natürlich vorkommende programmierte Zelltod als auch die durch chemische Substanzen induzierte Apoptose unterbinden (Sible et al.1997, Yeo et Gautier 2003, Johnston et al.2005). Die gezielte Überexpression von Bcl-XL in den somitischen GRPZellen sollte somit die Apoptose dieser Zellen unterbinden. Wenn also der Verlust der somitischen GRP-Zellen nach Inhibition der FGF-Signalaktivität auf induzierter Apoptose beruht, sollte die Injektion von Bcl-XL den Verlust dieser Zellen verhindern. Bcl-XL wurde hierfür als DNA-Konstrukt im pCS2+-Vektor (8pg) in die Region (C2) von 4Zellembryonen injiziert, aus der die somitischen GRP-Zellen entstehen. Injizierte und uninjizierte Embryonen wurden ab dem Gastrulastadium 12 in SU5402 (60µM) oder DMSO (0,3%) inkubiert und im Neurulastadium 17/18 für Expressionsanalysen fixiert. Der durch die SU5402-Inkubation entstehende Verlust der Xnr1- oder Coco-Expression, konnte durch die zusätzliche Injektion von Bcl-XL nicht gerettet werden (Abb. 18). Die Transkription von Xnr1 und Coco und die Bildung der somitischen GRP-Zellen können möglicherweise auch unabhängig voneinander vom FGF-Signalweg beeinflusst werden. Um indirekt auf die Bildung der somitischen GRP-Zellen schließen zu können, wurde die durch Shh/Panza Doppelfärbung entstehende Aussparung analysiert. 57 Ergebnisse Abbildung 18: Verlust der somitischen GRP-Zellen nach SU5402-Inkubation kann nicht durch Koinjektion von Bcl-XL verhindert werden Embryonen im St.17/18, ventrale Ansicht auf GRP, anterior oben. Embryonen wurden im 4-Zellstadium mit Bcl-XL-DNA (8pg) beidseitig in die dorsolaterale Randzone injiziert. Bcl-XL-injizierte oder uninjizierte Embryonen wurden ab St.12 in 60µM SU5402 inkubiert und mit DMSO (0,3%)-Kontrollembryonen verglichen. Durch Inkubation in SU5402 kam es zu einem Verlust der bilateralen Xnr1- und Coco-Domäne und zu einer Reduktion der Aussparung in den somitischen GRP-Zellen, die durch kombinierte Shh und Panza ISH entsteht. Weder Xnr1 noch Coco noch die Aussparung konnten durch die Überexpression von Bcl-XL gerettet werden. Die Koinjektion von Bcl-XL konnte die starke Reduktion dieser Aussparung in SU5402inkubierten Embryonen nicht vermindern (Abb. 18). Durch die Injektion von Bcl-XL konnte damit das Ergebnis der TUNEL-Analyse, dass keine durch SU5402-induzierte Apoptose im Bereich der somitischen GRP-Zellen stattfindet, bestätigt werden. Somit ließ sich weder eine gestörte Zellproliferation noch eine verstärkte Apoptose als Ursache des Verlusts somitischer GRP-Zellen nachweisen. 58 Ergebnisse Um zu verstehen, wie ein Signalweg auf einen bestimmten Prozess wirkt, kann es hilfreich sein zu wissen, welche dem Signalweg nachgeschaltete Signaltransduktion dabei Einfluss nimmt. Sprouty1 (Spry1) als Antagonist der PLC/PKC/Calcium-vermittelten Transduktion des FGF-Signalwegs in Xenopus wurde überexprimiert, um spezifisch diesen Signalzweig zu inhibieren (Sivak et al., 2005). Ein Einfluss auf die Induktion von FoxJ1 oder die Bildung der somitischen GRP-Zellen sollte in diesem Falle bedeuten, dass der FGF-Signalweg über PLC/PKC/Calcium auf diese LR-spezifischen Funktionen des FGF-Signalwegs wirkt. Überexpression von Spry1 übt keinen Effekt auf die Expression von FoxJ1 aus Um zu analysieren, ob die Überexpression von Spry1 einen Effekt auf die Expression von FoxJ1 oder Tekt2 ausübt, wurde in drei unabhängigen Experimenten Spry1-mRNA (560800pg) beidseitig in die dorsale Randzone (C1-2 Region) injiziert. Abbildung 19: Expressionsanalyse von FoxJ1 und Tekt2 nach Überexpression von Spry1 (A,B) Kontrollembryonen im Vergleich mit Embryonen nach Injektion von 640pg Spry1-mRNA in die dorsale Randzone des 4-Zellstadiums. (A) Gastrulastadien mit wildtypischer FoxJ1-Expression im superfiziellen Mesoderm. Vegetale Ansicht, dorsal oben (B) Neurulastadien mit Tekt2-Expression in der GRP. Im Spry1injizierten Embryo beschränkt sich die Expression auf den medialen Anteil der GRP (eingefasst dargestellt durch gelbe gestrichelte Linie). Trotz Überexpression von Spry1 wiesen alle Embryonen eine unverändert starke Transkription von FoxJ1 (n=58) oder Tekt2 (n=79) auf (Abb. 19 A,B). Bei einem großen Anteil der Spry1-injizierten Embryonen (n=35/79) beschränkte sich jedoch die Expression auf den medialen Bereich der GRP, die laterale Expression in den somitischen GRPZellen war nicht zu erkennen. Die Überexpression von Spry1 führte also im Gegensatz zu der Rezeptor-vermittelten Unterbindung des FGF-Signalwegs zu keiner Beeinträchtigung der FoxJ1-Expression und betraf im Falle von Tekt2 nur die lateralen GRP-Zellen. 59 Ergebnisse Verlust der paranotochordalen Xnr1- und Coco-Domäne nach Überexpression von Spry1 Im Folgenden sollte geklärt werden, ob die Überexpression von Spry1 einen Effekt auf die paranotochordale Expression von Xnr1 und Coco ausübt. Dazu wurden 320-800pg Spry1mRNA im 4-Zellstadium unilateral in die linke oder rechte C2-Region injiziert. Abbildung 20: Expressionsanalyse der Xnr1- und Coco-Domäne nach Überexpression von Spry1 Expressionsanalyse von Xnr1 und Coco im Neurulastadium 17/18 nach Injektion von 320-800pg Spry1mRNA in die linke oder rechte (gekennzeichnet als rechts injiziert) dorsolaterale Randzone (C2) im 4Zellstadium. (A) Beispiele der Expressionsmuster, ventrale Ansicht auf die GRP. Embryonen wiesen nach Überexpression von Spry1 eine stark reduzierte oder fehlende Expression auf. Unabhängig vom Expressionsmuster der injizierten Embryonen konnte eine Verschiebung (schwarz gestrichelte Linie) oder eine normale Ausprägung (orange gestrichelte Linie) des Blastoporus beobachtet werden. (B) Der Anteil an Embryonen mit stark reduzierter oder fehlender Xnr1- oder Coco-Transkription war nach Injektion von Spry1 sehr hoch signifikant. 60 Ergebnisse Bei der Expressionsanalyse im Neurulastadium 17/18 wurden, wie bei der Auswertung nach Injektion von dnFgfr1, leichte Unterschiede zwischen der linken und rechten Seite, wie sie in ihrer Stärke auch in Wildtyp-Embryonen vorkommen, nicht gewertet. Embryonen, die eine über das Wildtyp-Niveau hinaus verringerte Expression aufwiesen, wurden zur Kategorie „reduziert“ gezählt und den Embryonen mit vollständigem Verlust (Kategorie „fehlend“) gegenübergestellt. Durch die Überexpression von Spry1 kam es zu einer verminderten Expression von Xnr1 und Coco. Die unilaterale Injektion von Spry1mRNA führte zu einem Anteil von 53% (linksseitig, n=102) oder 60% (rechtsseitig, n=215) an Embryonen, deren Xnr1-Expression auf der injizierten Seite der Kategorie „reduziert“ oder „fehlend“ zugeordnet werden konnte. Dabei war der vollständige Expressionsverlust (Kategorie „fehlend“) nur selten zu beobachten (p<0,001, Abb. 20 A,B). Der expressionsmindernder Effekt auf Coco fiel nach Überexpression von Spry1 vergleichbar zu dem Effekt auf Xnr1 aus. Die unilaterale Injektion von Spry1-mRNA führte zu einem Anteil von 56% (linksseitig, n=72) oder 50% (rechtsseitig, n=113) an Embryonen, deren CocoExpression der Kategorie „reduziert“ oder „fehlend“ zugeordnet werden konnte, wobei auch hier die letztere Kategorie nur selten vertreten war (p<0,001, Abb. 20 A,B). Wie für den Funktionsverlust nach Fehlexpression von dnFgfr1 beschrieben, bewirkte Sprouty1 in manchen Embryonen eine Verminderung der CBC-Wölbung auf der injizierten Seite. Dieser Effekt war unabhängig vom Verlust der Xnr1- oder Coco-Transkription (Abb. 20A). Der Expressionsverlust von bilateralem Xnr1 und Coco, wie er durch die Rezeptorblockierung via SU5402 oder durch den dnFGFR1 zustande kommt, konnte also auch durch die Überexpression von Spry1 bewirkt werden. Da ein Verlust dieser Expressionsdomänen nicht zwingend mit dem generellen Verlust somitischer Zellen einhergehen muss, wurde nachfolgend die Bildung dieser Zellen nach Injektion von Spry1 untersucht. Verlust somitischer GRP-Zellen nach Überexpression von Spry1 Zur genaueren Analyse, ob der Verlust der Xnr1- und Coco-Expression auch bei Überexpression von Spry1-mRNA mit dem generellen Verlust somitischer GRP-Zellen einhergeht, wurden weitere Expressionanalysen und REM-Untersuchungen durchgeführt. Derrière wird wie Coco und Xnr1 in den somitischen GRP-Zellen exprimiert (Vonica and Brivanlou, 2007). Weiterhin lassen sich diese Zellen durch die Expressionslücke, die bei 61 Ergebnisse Abbildung 21: Überexpression von Spry1 führt zum Verlust der somitischen GRP-Zellen (A-E) Embryonen im Neurulastadium 17/18, ventrale Ansicht auf GRP. (A,A’,B,B’) Kontrollembryonen im Vergleich zu Embryonen, die im 4-Zellstadium mit 800pg Spry1-mRNA in die rechte dorsolaterale Randzone (C2) injiziert wurden. Expressionsanalysen von Derrière (A) und Shh+Panza (B) ließen verminderte Expression (A’) und verminderte Aussparung (B’) im somitischen GRP-Bereich der injizierten Seite erkennen. (C,D) REM-Aufnahmen von Embryonen, die im 4-Zellstadium mit 800pg Spry1-mRNA in die linke dorsolaterale Randzone (C2) injiziert wurden. In den jeweiligen Vergrößerungen wurde der Grenzbereich zwischen GRP und Entoderm und zwischen noto-/hypochordalen und somitischen GRP-Bereich gelb eingestrichelt, die somitischen Zellen wurden gelb eingefärbt. (C) Embryo mit Verschmälerung des somitischen GRP-Anteils auf der injizierten Seite. In den Auschnitten aus G’ (blauer und orangener Kasten) weisen rote Pfeilspitzen auf die langen Cilien des GRP-Epithels, wohingegen die blauen Pfeilspitzen die kurzen Cilien des Entodermepithels markieren. (D,E) Embryonen bei denen keine somitischen GRP-Zellen auf der injizierten Seite ausgemacht werden konnten. (C,D) Symmetrisch ausgebildeter Blastoporus. (E) Das circumblastoporale Gewebe konzentriert sich stärker auf der uninjizierten Seite, sodass der Blastoporus leicht verschoben wirkt. einer Doppelfärbung von Panza und Shh entsteht, visualisieren. Die Expressionsanalyse von Derriere und Shh/Panza nach unilateraler Überexpression von Spry1 deutete auf einen Verlust somitischer GRP-Zellen auf der injizierten Seite hin (Abb. 21A’,B’). Die REMAnalyse bestätigte diesen Befund. Hierbei wiesen 27% der Embryonen wildtypisch somitische GRP-Zellen auf der injizierten Seite auf, während die Breite der somitischen 62 Ergebnisse GRP bei 50% der Embryonen reduziert war (Abb. 21C) und sich in 23% der Embryonen keine somitischen Zellen auf der injizierten Seite unterscheiden ließen (n=22, Abb. 21D,E). Zusammengefasst zeigte die Injektion von Spry1 keinen Effekt auf die frühe Funktion des FGF-Signalwegs in der LR-Achsenentwicklung (Expression von FoxJ1), wohingegen die zweite Funktion (Bildung somitischer GRP-Zellen) beeinträchtigt wurde. Da Sprouty1 nachgeschaltet zum FGF-Signalweg als Antagonist von PLC/PKC/Calcium agiert, scheint dieser Signalzweig die Bildung der somitischen GRP-Zellen zu vermitteln. Mesodermale Genexpressionen wurden im Folgenden analysiert, um abzusichern, dass die Überexpression von Spry1 wie publiziert, keinen Effekt auf den FGF-abhängigen MAPKSignalweg ausübt (Nutt et al., 2001; Sivak et al., 2005). Geringer Effekt auf mesodermale Genexpression nach Überexpression von Spry1 Um zu überprüfen ob und gegebenenfalls welchen Effekt die Überexpression von Spry1 auf die MAPK-abhängige Spezifizierung des Mesoderms ausübt, wurden Embryonen im 4Zellstadium in die dorsale Randzone injiziert (560-800pg Spry1-mRNA). Im Gastrula- und Neurulastadium wurde durch Expressionsanalyse die Transkription der Mesodermmarker Xbra und MyoD in Spry1-injizierten Embryonen mit Kontrollembryonen verglichen. In vier unabhängigen Experimenten konnte im Gastrulastadium eine leichte Reduktion von Xbra im dorsal medialen Bereich (bilaterale Injektionen in die C1-Region, n=37) und von MyoD im dorsolateralen Bereich (unilaterale Injektion in die C2-Region, n=51) festgestellt werden. Die Reduktion fiel selbst bei hohen Konzentrationen von 800pg Spry1-mRNA pro Injektion mild aus und bewirkte bei Xbra höchstens eine Verschmälerung der dorsalen Expression (Abb. 22B). Die Reduktion des MyoD-Signals war im Unterschied zur Kontrollseite zwar zu erkennen (Abb. 22F), jedoch nicht vergleichbar mit dem Verlust mesodermaler Genexpression, wie er durch die Rezeptor-vermittelte Inhibition hervorgerufen wird. Embryonen, die im Neurulastadium auf ihre Genexpression untersucht wurden, wiesen keinen Unterschied zwischen den Spry1-injizierten und den uninjizierten Kontrollembryonen auf (Abb. 22C,D,G,H). So hatte Sprouty1 einen leichten Effekt auf die MAPK-abhängige Mesodermspezifizierung, der leicht in Gastrulastadien, nicht aber in Neurulastadien zu erkennen war. Somit kann man sagen, dass Sprouty1 sich hier als schwacher Antagonist der MAPK-vermittelten 63 Ergebnisse Geninduktion bemerkbar machte. Aufgrund der vorliegenden Experimente kann nicht völlig ausgeschlossen werden, dass der FGF-Signalweg in späten Gastrulastadien über die MAPKinase auf die Entstehung der Lateralität wirkt. Der schwache Effekt auf die Mesodermspezifizierung und die in der Literatur beschriebene Funktion von Sprouty1 als Antagonist des PKC/PLC/Calcium-Signalzweigs deuten jedoch darauf, dass der Verlust somitischer Zellen nach FGF-Funktionsverlust über PKC/PLC/Calcium vermittelt wird. Abbildung 22: Expression mesodermaler Marker nach Überexpression von Spry1 (A,B;E,F) Gastrula: vegetale Ansicht, dorsal oben. (C,D,G,H) Neurula: ventrale Ansicht, dorsal oben. (A,C,E,G) Kontrollembryonen. (B,D,F,H) Embryonen nach Injektion von Spry1-mRNA (640pg) im 4Zellstadium in die dorsale Randzone (beidseitig: 2xC1; B,D) oder in die dorsolaterale Randzone (rechtsseitig C2; F,H) im 4-Zellstadium. Die Injektion von Spry1 bewirkte eine leichte Reduktion von Xbra (B, gelbe Pfeilspitze) oder MyoD (F, rote Pfeilspitze) im dorsalen Bereich der Randzone im Gastrulastadium, ließ aber keine Veränderung der Xbra- (D) oder MyoD- (H) Expression im Neurulastadium erkennen. Der Funktionsverlust von Pkd2, das für einen Calcium-permeablen Kanal codiert, führt ebenfalls zum Verlust der paranotochordalen Xnr1-Domäne (Vick, 2009). Damit weist er eine Parallele zur Inhibition des FGF-Signalwegs via Sprouty1 auf. Dies liefert einen weiteren Hinweis, dass der FGF-Signalweg nicht über die MAPK, sondern über PKC/PLC/Calcium auf die somitischen GRP-Zellen wirkt. In diesem Falle sollte der für den Pkd2-Knockdown beschriebene Verlust der bilateralen Xnr1-Domäne ebenfalls auf einem generellen Verlust dieser Zellen beruhen. Dadurch würde sich insbesondere die Freisetzung von intrazellulärem Calcium als ein essentieller Faktor für die Bildung der somitischen GRP-Zellen herausstellen. 64 Ergebnisse Pkd2-Knockdown führt ebenfalls zum Verlust der somitischen GRP-Zellen Für die Pkd2-Funktionsverlustexperimente wurde 1pmol Pkd2-MO unilateral in die linke oder rechte C2-Region von Embryonen im 4-Zellstadium injiziert. Wie von Vick (2009) gezeigt, hatten die Injektionen des Pkd2-MOs die Reduktion oder den vollständigen Verlust der paranotochordalen Xnr1-Domäne im Neurulastadium 17/18 zur Folge (Abb. 23A’). Dies traf zudem auch auf die Expressionsdomäne von Coco zu (Abb. 23B’). Abbildung 23: Verlust somitischer GRP-Zellen nach Pkd2-Knockdown (A-C) Embryonen im Neurulastadium 17/18, ventrale Ansicht auf GRP. (A,A’,B,B’) Kontrollembryonen im Vergleich mit Embryonen, die im 4-Zellstadium mit 1pmol Pkd2-MO in die linke dorsolaterale Randzone (C2) injiziert wurden. (A’) Expressionsanalyse von Xnr1 (A’) oder Coco (B’) machte Reduktion (A’) oder vollständigen Verlust (B’) der Expression im somitischen GRP-Bereich der injizierten Seite deutlich. (C) REM-Aufnahmen eines Embryos, der im 4-Zellstadium mit 1pmol Pkd2-MO in die linke dorsolaterale Randzone (C2) injiziert wurde. Der Grenzbereich zwischen GRP und Entoderm und zwischen noto/hypochordalen und somitischen GRP-Bereich wurde gelb eingestrichelt, die somitischen Zellen wurden gelb eingefärbt. Auf der injizierten Seite konnten keine somitischen GRP-Zellen ausgemacht werden. In den Ausschnitten (blauer und orangener Kasten) weisen rote Pfeilspitzen auf die langen Cilien des somitischen GRP-Anteils, wohingegen lila Pfeilspitzen auf die langen Cilien des medialen GRP-Anteils deuten. So wiesen Embryonen aus drei unabhängigen Experimenten nach Injektion des Pkd2MOs einen Anteil von 39% mit stark reduzierter Coco-Expression und einen Anteil von 65 Ergebnisse 22% mit vollständigem Expressionsverlust von Coco auf der injizierten Seite auf (n=59), während die Kontrollembryonen wildtypische Seitenunterschiede aufwiesen (n=82, p<0,001). In REM-Aufnahmen konnte durch die gezielte Injektion in den dorsolateralen Bereich der Randzone (C2-Region) der generelle Verlust somitischer GRP-Zellen beobachtet werden (Abb. 23C). Somit lag nahe, dass ein Calciumsignal für die Bildung der somitischen GRP-Zellen essentiell ist. Um zu klären ob Sprouty1 als Antagonist des FGFSignalwegs insbesondere über die Inhibition von Calcium auf die somitischen GRP-Zellen wirkt, wurden kombinierte Experimente mit Pkd2-MO und Pkd2-mRNA durchgeführt. Spry1 und Pkd2 wirken gemeinsam auf die paranotochordale Xnr1- und CocoDomäne 66 Ergebnisse Abbildung 24: Spry1-Überexpression und Pkd2-Knockdown wirken epistatisch auf die Expression von Xnr1 und Coco (A) Expressionsanalyse von Xnr1 und Coco im Neurulastadium 17. Embryonen, die im 4-Zellstadium rechtsseitig in die dorsolaterale Randzone (C2) mit Pkd2-MO (0,5pmol) oder Spry1-mRNA (160pg) injiziert wurden, zeigten insgesamt eine stärkere Expression als die kombinierte Injektion von Pkd2-MO und Spry1mRNA in den gleichen Konzentrationen. (B) Quantifizierung der Expressionsanalyse macht die signifikante Verstärkung des Anteils an Embryonen mit reduzierter oder fehlender Expression nach kombinierter Injektion im Vergleich zu Einzel-Injektionen deutlich. re, rechts Um zu untersuchen, ob Spry1 und Pkd2 im gleichen Signalweg wirken, wurden EpistasisExperimente durchgeführt. Separate Injektionen von 0,5pmol Pkd2-MO oder von 160pg Spry1-mRNA hatten nur einen geringen Anteil an Embryonen mit reduzierter Xnr1- oder Coco-Expression zur Folge (Abb. 24). Die simultane Injektion von Pkd2-MO und Spry1mRNA bewirkte dagegen einen signifikant verstärkten Anteil an Embryonen, die eine reduzierte oder keine Expression von Xnr1 oder Coco auf der injizierten Seite aufwiesen (p<0,001, Abb. 24). Ergänzend zu diesen Experimenten wurde untersucht, ob sich der Verlust der Xnr1Expression bei Spry1-Überexpression durch eine Verstärkung der intrazellulären CalciumKonzentration retten ließ. Dabei wurde davon ausgegangen, dass die Injektion von Pkd2mRNA, wie beschrieben, einen Anstieg an intrazellulärem Calcium bewirkt (Koulen et al., 2002). Abbildung 25: Pkd2-Funktionsgewinn rettet den Verlust der paranotochordalen Xnr1-Expression nach Spry1-Überexpression (A) Expressions-Analyse von Xnr1 im Neurulastadium 17/18. Embryonen, die im 4-Zellstadium rechtseitig in die dorsolaterale Randzone (C2) mit Spry1-mRNA (320pg) injiziert wurden, wiesen eine reduzierte Xnr1Expression auf der injizierten Seite auf, die durch Koinjektion von Pkd2-mRNA (960pg) gerettet wurde. (B) Quantifizierung der Expressionsanalyse macht die sehr hoch signifikante Verminderung des Anteils an Embryonen mit reduzierter oder fehlender Expression nach kombinierter Injektion im Vergleich zur Spry1EinzeIinjektion deutlich. In vier unabhängigen Experimenten wurde Spry1-mRNA einseitig in solchen Konzentrationen (320-800pg/8nl) injiziert, die eine signifikante Reduktion der Xnr167 Ergebnisse Domäne bewirkten. Die Koinjektion von Pkd2-mRNA konnte diesen Effekt signifikant senken (p<0,001, Abb. 25). Die Spry1-vermittelte Reduktion der Xnr1- und CocoExpression ließ sich somit sowohl von Pkd2-Funktionsverlust- als auch von Funktionsgewinnexperimenten modulieren. Die hierbei nachgewiesenen Effekte deuten an, dass Sprouty1 die FGF-abhängige Bildung der somitischen GRP-Zellen über die Inhibition der Freisetzung von intrazelluären Calcium-Ionen unterbindet. Der Effekt den der Pkd2-Funktionsverlust und der Spry1-Funktionsgewinn auf die somitischen Zellen ausüben, lässt sich mit einer Rolle von intrazellulärem Calcium für die Bildung dieser lateralen GRP-Zellen vereinbaren. Pkd2 spielt in Xenopus bereits in frühen Gastrulastadien eine Rolle in der Morphogenese der GRP (Vick, 2009). Eine Möglichkeit intrazellulären Calcium-Wellen insbesondere zu festgelegten Zeitpunkten zu inhibieren, liegt in der Anwendung eines spezifischen Inhibitors, dessen Einsatz im nachfolgenden Absatz beschrieben wird. Thapsigargin-Inkubationsexperimente zur Inhibition von intrazellulärem Calcium Ein initialer Einstrom von Calcium kann den weiteren intrazellulären Anstieg durch die Freisetzung von Calcium aus dem Endoplasmatischen Retikulum induzieren. Das aus Thapsia garganica isolierte Thapsigargin wirkt als Inhibitor der endoplasmatischretikulären Calcium-ATPase. Thapsigargin inhibiert die Freisetzung von intrazellulärem Calcium, indem es die Auffüllung des Endoplasmatischen Retikulums als intrazellulären Calciumspeicher verhindert (Treiman et al., 1998). In Xenopus kann die Entstehung von intrazellulären Calcium-Wellen im Bereich der dorsalen Randzone durch die Applikation von Thapsigargin unterbunden werden. Dies führt zu Störungen der konvergenten Extensionsbewegungen, sodass im Gastrulastadium behandelte Embryonen Blastoporusschlussdefekte aufweisen (Wallingford et al., 2001). Thapsigargin wurden im Rahmen dieser Arbeit angewendet, um den Einfluss von Calcium auf die somitischen Zellen zu analysieren. Hierfür wurde eine Expressionsanalyse von bilateralen Xnr1 durchgeführt. Um die Funktionalität von Thapsigargin im Vorfeld abzusichern, wurden Embryonen ab dem Gastrulastadium 10,5 bis zum Neurulastadium 15 in einer Dosis von 4µm Thapsigargin oder 1% DMSO inkubiert und anschließend morphologisch untersucht. Während in den DMSO-Kontrollembryonen kein Unterschied zu 68 Ergebnisse den unbehandelten Kontrollembryonen festgestellt werden konnte, wiesen alle Thapsigargin-behandelten Embryonen einen offenen Blastoporus auf (nicht gezeigt). Dies steht in Einklang mit der Störung von konvergenten Extensionsbewegungen. Für die Untersuchung der bilateralen Xnr1-Domäne wurden Inkubationsexperimente zu verschiedenen Zeitpunkten gestartet. Durch Inkubationen ab dem späten Gastrulastadium 11,5 konnten Blastoporusschlussdefekte vermieden werden. Die Thapsigargin-inkubierten Embryonen erschienen jünger, da sich ihre Neuralfalten noch nicht ihrem Stadium entsprechend geschlossen hatten, was durch eine Inhibition der konvergenten Extensionsbewegungen im Neuroektoderm mittels Thapsigargin zu erklären war (Abb. 26C). Inkubationen beginnend ab St.11,5 bewirkten einen Verlust (45%, Abb. 26D) oder eine Reduktion (55%, Abb. 26E) der bilateralen Xnr1-Domäne (n=22). Auffallend war, dass bei Embryonen mit reduzierter Xnr1-Domäne die beiden Expressionshälften nah aneinander liefen und die mediale Aussparung des Notochords teilweise stark verkleinert wurde (Abb. 26E). Abbildung 26: Thapsigargin-Inkubation bewirkt Verlust der paranotochordalen Xnr1-Expression (A-E) Neurulaembryonen im St.17/18, anterior oben. (A,C) dorsale Ansicht auf die Neuralfalten. (B,D,E) Ventrale Ansicht auf GRP. (A,B) DMSO-Kontrollembryo mit geschlossenen Neuralfalten und wildtypisch starker Xnr1-Expression. (C,D) Thapsigargin-inkubierter Embryo mit Neuralrohrschlussdefekt und fehlender Xnr1-Expression. (E) Thapsigargin-inkubierter Embryo mit stark reduzierter Xnr1-Expression und vermindertem Abstand der beiden Expressionshälften Die Inkubation in Thapsigargin zeigt, dass Calcium am Ende der Gastrulation auf die somitischen GRP-Zellen wirkt. Auch Liganden des nicht-kanonischen Wnt-Signalwegs wie Wnt11 wirken über die Mobilisierung von intrazellulärem Calcium (Kühl, 2004). Die frühe Funktion, die Wnt11b in der Morphogenese der GRP-Zellen spielt, könnte über den nichtkanonischen Wnt/Calcium-Signalweg gesteuert werden, da der hierbei beobachtete Phänotyp bei Funktionsverlust an den Funktionsverlust von Pkd2 erinnert (Walentek, 2012). Weiterhin konnte eine Funktion für die bilaterale Xnr1- und Coco-Expression beschrieben werden. 69 Ergebnisse Im Weiteren sollte daher untersucht werden, ob der Wnt-Signalweg über dieselbe Signaltransduktion wie der FGF-Signalweg Einfluss auf die somitischen GRP-Zellen nimmt. Dazu wurden Epistasis-Experimente durchgeführt, in denen der Wnt-Signalweg durch MO-Knockdown von Wnt11b ausgeschaltet wurde, während der FGF-Signalweg durch die Überexpression von Spry1 inhibiert wurde. Spry1 und Wnt11b wirken gemeinsam auf die paranotochordale Xnr1- und CocoDomäne Vorab wurde die Spezifität des Wnt11b-Knockdowns auf den Verlust der bilateralen Expressionsdomäne untersucht. Hierfür wurde der Wnt11b-MO allein oder in Kombination mit Wnt11b-DNA injiziert. Durch die Injektion von 1pmol Wnt11b-MO konnte die Xnr1Expression auf der injizierten Seite im Vergleich zu Kontrollembryonen signifikant reduziert werden (34%, n=76, p<0,001, Abb. 27A’). Durch Koinjektion von 8pg Wnt11b-DNA ließ sich der Verlust der Xnr1-Expression dagegen signifikant senken (8%, n=66, p<0,001, Abb. 27A’). Durch die Injektion von 8pg Wnt11b-DNA konnte ein starker Effekt auf das Schließen der Neuralfalten beobachtet werden (Abb. 27A, gelber Pfeil). Zudem wurden die Expressionshälften der bilateralen Xnr1-Domäne über das wildtypische Maß voneinander getrennt (Abb. 27A). Diese beiden Phänotypen traten bei Koinjektion von Wnt11b-MO vermindert auf und lassen sich durch konvergente Extensionsstörungen, wie sie sowohl beim Funktionsverlust als auch beim Funktionsgewinn von PCP-Komponenten beschrieben wurden, erklären. Im Zuge von Epistasis-Experimenten hatten separate Injektionen von 0,5pmol Wnt11b-MO oder von 160pg Spry1-mRNA nur einen geringen Anteil an Embryonen mit reduzierter Xnr1- oder Coco-Expression zur Folge. Die simultane Injektion von Wnt11b-MO und Spry1-mRNA bewirkte dagegen einen signifikant verstärkten Anteil an Embryonen, die eine reduzierte oder fehlende Expression von Xnr1 oder Coco auf der injizierten Seite aufwiesen (Tab.1, Abb. 27B,B’). Xnr1 Coco Spry1-mRNA versus Spry1 mRNA + Wnt11b-MO p<0,001 p<0,001 Wnt11b-MO versus Spry1-mRNA + Wnt11b-MO p=0,004 p<0,001 Tabelle 1: Signifikanzen der Epistasis-Experimente von Spry1-mRNA und Wnt11-MO 70 Ergebnisse Abbildung 27: Wnt11b-MO und Spry1-mRNA wirken epistatisch auf die Expression von Xnr1 und Coco (A) Expressionsanalyse von Xnr1 im Neurulastadium 17/18 (anterior oben; obere Reihe: ventrale Ansicht; untere Reihe: dorsale Ansicht). (A,A’) Embryonen, die im 4-Zellstadium rechtsseitig in die dorsolaterale Randzone (C2) mit 1pmol Wnt11b-MO injiziert wurden wiesen einen signifikanten Verlust der rechten Expressionshälfte auf (roter Pfeil in A), der durch Koinjektion von 8pg Wnt11b-DNA sehr hoch signifikant gerettet werden konnte. (A) Die alleinige Überexpression von 8pg Wnt11b-DNA bewirkte Neuralrohrschlussdefekte (gelber Pfeil), die durch Koinjektion von Wnt11b-MO vermindert wurden. (A’) 71 Ergebnisse Quantifizierung der Expressionsanalyse. (B,B’)) Expressionsanalyse von XnrI und Coco im Neurulastadium 17/18. Embryonen, die im 4-Zellstadium rechtsseitig in die dorsolaterale Randzone (re C2) mit Spry1-mRNA (160pg) oder Wnt11b-MO (0,5pmol) injiziert wurden zeigten, zeigten insgesamt eine stärkere Expression als Embryonen nach kombinierter Injektion von Wnt11b-MO und Spry1-mRNA in den gleichen Konzentrationen. (B) Quantifizierung der Expressionsanalyse. Diese macht die Verstärkung des Anteils an Embryonen mit reduzierter oder fehlender Expression nach kombinierter Injektion im Vergleich zu Einzel-Injektionen deutlich. Für Pkd2 und Wnt11b, deren Genprodukte im Zusammenhang mit der Erhöhung der intrazellulären Calcium-Konzentration stehen, konnte somit ein Einfluss auf die somitischen GRP-Zellen nachgewiesen werden. Eine Rolle von Calcium in der Regulation dieser Zellen wurde durch Thapsigargin-Inkubationsexperimente bestätigt. Im Bezug zur FGF-Signalaktivität konnte gezeigt werden, dass Sprouty1 als Antagonist des FGFabhängigen PKC/PLC/Calcium-Signalwegs, sowohl in der Pkd2- als auch in der Wnt11b– vermittelen Signaltransduktion mitwirkt. Inwiefern Calcium die Bildung somitischer GRPZellen regulieren könnte, wird unter anderem in der folgenden Diskussion erörtert. 72 Diskussion Diskussion FGF-Signalaktivität als Determinante der Lateralitätsentwicklung von Xenopus Die Ergebnisse dieser Arbeit zeigen, dass die Unterbindung der Rezeptor-vermittelten Signaltransduktion den Verlust der asymmetrischen Seitenplattenexpression zur Folge hat, und weisen somit eine Rolle des FGF-Signalwegs in der LR-Achsendeterminierung von Xenopus nach. Durch die Inhibition von FGF-Signalaktivität konnten zwei spezifische Funktionen in Xenopus beschrieben werden. (1) Die frühe Funktion äußert sich in der Induktion von FoxJ1 im Gastrulastadium und damit in der Spezifizierung des späteren LR-Organisators (Abb. 28). Die Expression von FoxJ1 ist entscheidend für die korrekte Entwicklung der LR-Achse, da dieser Transkriptionsfaktor übergeordnet die Expression von Genen aktiviert, welche für Bildung und Beweglichkeit der Cilien verantwortlich sind (Yu et al., 2008). So verfügen FoxJ1 Knockout-Mäuse nur über kurze und immotile Cilien im PNC (Alten et al., 2012). Der Morpholino-Knockdown von FoxJ1 in Xenopus und Zebrabärbling bewirkt die Reduktion der Länge und der Anzahl der Cilien in der GRP oder im Kupffer’schen Vesikel (KV) (Stubbs et al., Flüssigkeitsstroms, 2008). was Dadurch in kommt Xenopus es zum einen Verlust Verlust des der linksgerichteten asymmetrischen Seitenplattenexpression nach sich zieht (Vick et al., 2009; Beyer et al., 2012). (2) FGF-Signalaktivität wirkt in Xenopus auf die lateralen somitischen Zellen der GRP (Abb. 28). Diese Nodal-/Coco-exprimierenden Zellen ließen sich im Rahmen dieser Arbeit durch vergleichende Markergenanalysen und rasterelektronenmikroskopische Aufnahmen näher charakterisieren (publiziert in Schweickert et al., 2010). Durch ihre Zugehörigkeit zur GRP ergibt sich die Möglichkeit, dass der linksgerichtete Flüssigkeitsstrom direkt auf diese Zellen wirkt. In Medaka kann man ebenfalls anhand von transversalen Schnitten erkennen, dass Charon- als auch Spaw-exprimierende Zellen einen direkten Anteil am Epithel des KVs ausmachen (Hojo et al., 2007). Nodal sowie Cerl2 werden auch in der Maus von den lateralen Zellen des PNCs, den sogenannten „Crown cells“ exprimiert, welche sensitiv auf den Flüssigkeitsstrom reagieren (Oki et al., 2009; Nakamura et al., 2012; Yoshiba et al., 2012). Im Folgenden werden die Nodal(Spaw)-/Coco(Cerl2, Charon)exprimierenden Zellen als Sensorzellen des LR-Organisators bezeichnet. Durch FGFR73 Diskussion Inhibition ab späten Gastrulastadien kam es zum spezifischen Verlust dieser Zellen. Dabei korrelierte der Anteil an Embryonen, die keine oder eine stark reduzierte Expression von Nodal aufwiesen, mit dem Anteil an Embryonen, die einen Verlust an Pitx2c-Expression aufwiesen. Dies steht im Einklang damit, dass in Xenopus die paranotochordale NodalDomäne, wie in der Maus, eine Voraussetzung der asymmetrischen Genkaskade in der Seitenplatte ist (Brennan et al., 2002; Saijoh et al., 2003; Schweickert et al., 2010). Da der FGF-Signalweg in konvergenten Extensionsbewegungen beteiligt ist und diese in Verbindung zum Wnt/PCP-Signalweg stehen, stellte sich die Frage, ob durch die Rezeptor-vermittelte Inhibition die Polarisierung der Cilien beeinträchtigt wurde (Wallingford et al., 2002). Nach Inhibtion des FGF-Signalwegs ab mittleren/späten Gastrulastadien ließ sich teilweise eine leichte Verzögerung des Neuralrohrschlusses ausmachen. Dies war wahrscheinlich ein Resultat gestörter konvergenter Extensionsbewegungen das sich jedoch zeitnah nach Beenden der Inkubation normalisierte (nicht gezeigt). Aufgrund einhergehender konvergenter Extensionsdefekte bei Inhibition von FGF-Signalaktivität hätte man anhand der rasterelektronen- mikroskopischen Aufnahmen SU5402-inkubierter Embryonen vielmehr eine Verbreiterung der GRP erwartet, jedoch war diese aufgrund der fehlenden somitischen GRP-Zellen verschmälert (Abb. 12D). Zudem wiesen die Cilien eine wildtypische Polarisierung auf (Abb. 8B). FGF scheint somit hier keine Rolle auf die PCP-vermittelte Polarisierung der Cilien und Morphogenese der medialen GRP zu spielen. Zwar werden der FGF- und der PCP-Signalweg für konvergente Extensionsbewegungen benötigt, jedoch agiert der FGFSignalweg beispielsweise über NRH („neurotrophin receptor homolog“) parallel und unabhängig vom PCP-Signalweg (Wallingford et al., 2002; Chung et al., 2005). Auch die Aktivierung von PKC, die im Zusammenhang mit dem FGF- und PCP-Signalweg steht, kann unabhängig vom PCP-Signalweg in der konvergenten Extension wirken (Choi and Han, 2002). Die Lateralitätsentwicklung der Wirbeltiere weist viele konservierte Prozesse auf. So konnte die Nodal-Kaskade im linken Seitenplattenmesoderm in allen untersuchten Wirbeltieren beschrieben Flüssigkeitsstrom als werden (Hamada symmetriebrechender et al., 2002). Mechanismus Der wurde linksgerichtete neben dem Säugermodell Maus, im Kaninchen, im Amphibienmodell und in den Knochenfischen Zebrabärbling und Medaka nachgewiesen (Nonaka et al., 1998; Essner et al., 2005a; Okada et al., 2005; Hojo et al., 2007; Schweickert et al., 2007). Das Huhn im Gegensatz 74 Diskussion könnte den Flüssigkeitsstrom als symmetriebrechenden Mechanismus sekundär verloren haben, nachdem sich asymmetrische Zellbewegungen zur Gewährleistung der Lateralität entwickelt hatten, jedoch ist hier die Situation unklar. Eine weitere Konservierung lässt sich im Ursprung des PNC, der GRP und des KVs erkennen. Diese transienten Strukturen entwickeln sich im posterioren Bereich des Notochords aus mesodermalen Zellen, die schon zuvor in der Entwicklung als Zellen des äußeren Zellgewebes einen epithelialen Charakter aufwiesen (Shook et al., 2004; Blum et al., 2007, 2009; Schweickert et al., 2007; Oteíza et al., 2008). Inwieweit die beiden hier beschriebenen Funktionen der FGF-Signalaktivität in anderen Wirbeltieren konserviert sind, wird im Folgenden diskutiert. Konservierte und nicht konservierte Funktionen von FGF-Signalaktivität Wie in Xenopus wird FoxJ1 im Zebrabärbling während den Gastrulastadien in den Vorläuferzellen des KV, den sogenannten DFCs („dorsal forerunner cells“) exprimiert und reagiert hierbei sensitiv auf die Inhibition von FGF-Signalaktivität (Abb.28; Aamar and Dawid, 2008; Neugebauer et al., 2009). Anders als in Xenopus führt die Unterbindung des FGF-Signalwegs zu einem signifikanten Anteil an Embryonen mit bilateraler Seitenplattenexpression (Neugebauer et al., 2009). Neben dieser bilateralen Induktion wurde auch eine Invertierung oder der Verlust der asymmetrischen Genexpression in Bezug zu FGF-abhängigen Ciliendefekten beschrieben (Hong and Dawid, 2009; Liu et al., 2011). Die unterschiedliche Interpretation des FGF-Signalverlusts zwischen Xenopus und Zebrabärbling, könnte die Folge der unterschiedlichen Architektur des LR-Organisators beider Organismen sein. Damit einher geht, dass auch die direkte Inhibition des Flüssigkeitsstroms via Dnah9-Knockdown in Xenopus und Zebrabärbling in ihrer Auswirkung auf die asymmetrische Seitenplattenexpression variiert. Im Zebrabärbling ist hierbei eine Randomisierung asymmetrischer Markergene zu erkennen, während in Xenopus ein Verlust dieser zu beobachten ist (Essner et al., 2005; Vick et al., 2009). FGF-Signalaktivität wirkt im Zebrabärbling auf die Expression von Charon (Hong and Dawid, 2009). Dies bedeutet, dass der FGF-Signalweg wie in Xenopus Einfluss auf die Spezifizierung der Sensorzellen des LR-Organisators nimmt. Jedoch wurde bisher keine Funktion des FGF-Signalwegs für die Expression von paranotochordalem Spaw im 75 Diskussion Abbildung 28: FGF-Signalaktivität in der LR-Achsenentwicklung der Wirbeltiere Drei zeitlich aufeinanderfolgende Ereignisse der LR-Achsenentwicklung werden von FGF-Signalaktivität beeinflusst. (1) In Xenopus und Zebrabärbling spielt der FGF-Signalweg eine Rolle in der Spezifizierung des LR-Organisators, indem er die Expression von FoxJ1 kontrolliert. (2) In Xenopus und in der Maus wirkt sich der FGF-Signalweg auf die Spezifizierung der Sensorzellen des LR-Organisators aus. Durch frühe Inhibition des FGF-Signalwegs im Kaninchen konnte die Inhibition der asymmetrischen Seitenplattenexpression beobachtet werden, möglicherweise als sekundäre Folge des Expressionsverlust der paranotochordalen Nodal-Domäne. In diesem Fall würde der FGF-Signalweg auch hier Einfluss auf die Spezifizierung der Sensorzellen nehmen. (3) Während den Stadien des Signaltransfers ist der FGF-Signalweg in Kaninchen und Huhn essentiell für die Repression der Nodal-Kaskade auf der rechten Seite. Quellen und nähere Details sind im Text erläutert. Zebrabärbling beschrieben. Die bilaterale Seitenplattenexpression, welche in Bezug zur Inhibition des FGF-Signalwegs auf Höhe des Rezeptors im Zebrabärbling auftritt, deutet indirekt darauf hin, dass grundsätzlich noch ausreichend Spaw im Bereich des KVs 76 Diskussion exprimiert wird (Neugebauer et al., 2009). Allerdings wurden in diesem Zusammenhang keine schwerwiegenden Effekte in Bezug zum axialen und paraxialen Mesoderm beschrieben, wie sie durch Inhibition des dnFGFR1 zuvor dokumentiert wurden (Griffin et al., 1995, 1998; Neugebauer et al., 2009). Somit könnte die Stärke oder die transiente Dauer der hier angewendeten Inhibition zwar ausreichend für einen Verlust von FoxJ1Expression sein, nicht aber für einen vollständigen Verlust von paranotochordalem Spaw. Da durch FGF-Inhibition die Expression von Charon negativ beeinflusst wird, würde in diesem Fall selbst ein kleiner Rest an paranotochordalem Spaw ausreichen um die Seitenplattenexpression zu induzieren (Hong and Dawid, 2009). Interessanterweise wurde erwähnt, dass im Zebrabärbling neben der frühen FGFR-Inhibition im Gastrulastadium, die zu verkürzten Cilien führt, eine spätere Applikation zu Cilien-unabhängigen LR-Defekten führt, die bis dato nicht weiter untersucht wurden (Neugebauer et al., 2009). Eine genauere Analyse von SU5402-Inkubationen ab späten Gastrulastadien könnte im Zebrabärbling einen Verlust der paranotochordalen Spaw-Domäne aufdecken, womit diese Funktion des FGF-Signalwegs auch im Zebrabärbling konserviert wäre. Indirekt lässt sich bereits jetzt eine Funktion von FGF vermuten. So ist der FGF-Signalweg im Zebrabärbling, wie auch in Xenopus und in der Maus für die Expression des T-Box Transkriptionsfaktors Brachyury (no tail, ntl im Zebrabärbling) notwendig, und Brachyury wiederum reguliert im Sinne einer positiven Rückkopplung die Expression von FGF (Griffin et al., 1995; Schulte-Merker and Smith, 1995; Ciruna and Rossant, 2001). In allen drei Modellorganismen bewirkt der Verlust von Brachyury eine fehlende oder stark reduzierte Expression von bilateralem Nodal (King et al., 1998; Amack et al., 2007; Gourronc et al., 2007; Andre, 2009). Möglicherweise nimmt Brachyury hierbei über FGF Einfluss auf die Sensorzellen. Auch in der Lateralitätsentwicklung der Maus wirkt der FGF-Signalweg über die Regulation der Sensorzellen. So konnten Meyers und Martin (1999) anhand einer hypomorphen Fgf8Mausmutanten zeigen, dass der Funktionsverlust einen Verlust der paranotochordalen Nodal-Expression nach sich zieht (Abb. 28). Ob dabei der FGF-Signalweg wie in Xenopus für die Expression von Cerl2 oder die generelle Bildung dieser Sensorzellen benötigt wird, wurde bis dato noch nicht untersucht. Um aufzuklären, ob die Sensorzellen in der Maus FGF-abhängig gebildet werden, könnte man dabei durch Immunohistochemie (IHC) untersuchen. So lassen sich die Cilien der lateralen PNC-Zellen in der Maus von den medialen Zellen unterscheiden, da sie im Gegensatz zu diesen kein lrd („left-right dynein“) exprimieren. Im Falle eines Verlusts dieser Sensorzellen in hypomorphen Fgf877 Diskussion Mausmutanten sollten sich somit keine lrd-negativen Zellen im PNC detektieren lassen. Zudem sollte eine rasterelektronenmikroskopische Analyse eine Verkleinerung des PNCs aufdecken. Die Frage, ob der FGF-Signalweg in der Maus eine frühere Rolle bei der Etablierung der FoxJ1-Expression spielt, bleibt bisher infolge mangelnder Analyse unbeantwortet. Um einen möglichen Ciliendefekt nach FGF-Signalverlust aufzudecken, müsste man die Bildung (z.B. IHC auf das Cilienstrukturprotein Tubulin oder Rasterelektronenmikroskopie) und Funktionalität (Analyse des Cilienschlages mit einer Hochgeschwindigkeitskamera) in hypomorphen Fgf8-Mutanten untersuchen. Allerdings ließe sich anhand der hypomorphen Fgf8-Mauslinie aufgrund des partiellen Funktionsverlustes im Falle einer unbeeinträchtigten Cilienentwicklung ein FGF-abhängiger Einfluss nicht ausschließen. Denkbar wäre hier, um schwere Entwicklungsstörungen zu umgehen, wie sie bei Fgfr1 als auch bei Fgf8 Knockout-Mäusen vorkommen, eine konditionelle Mauslinie bei der Fgfr1 von loxPSeiten flankiert wird (Xu et al., 2002) und die Cre-Rekombinase unter Kontrolle eines Hormon-regulierten Promotors exprimiert wird. Durch zeitspezifische Injektion von Tamoxifen in schwangere Mäuse könnte eine FGF-abhängige Funktion für die Entstehung der Lateralität nach den für die Gastrulation kritischen Stadien untersucht werden. In Xenopus konnte die Unterbindung der FGF-Signalaktivität während der Stadien des linksgerichteten Flüssigkeitsstroms keinen weiteren Einfluss auf die Lateralitätsentwicklung belegen. Im Gegenzug dazu wurde in der Maus eine weitere Funktion in diesem Entwicklungszeitraum beschrieben. So soll es durch FGF-Aktivität zur Freisetzung von sogenannten NVPs („Nodal vesicular particles“) kommen. Diese sollen Shh und Retinsäure enthalten und durch den Flüssigkeitsstrom auf die linke Seite transportiert werden, um in Folge asymmetrisch einen intrazellulären Calciumanstieg auf der linken Seite zu bewirken. Hierbei wurde publiziert, dass FGF-Signalaktivität sowohl für die Generierung eines intrazellulären Calciumanstiegs als auch für eine Vesikelfreisetzung benötigt wird. Allerdings wurde kein funktioneller Effekt auf die Expression der linksseitigen Nodal-Kaskade gezeigt und ob der FGF-Signalweg über die gewährleistete Vesikelfreisetzung auf Calcium wirkt (Tanaka et al., 2005). Die NVP-Hypothese, wie sie hierbei aufgestellt wurde, kann aus folgenden Gründen in Frage gestellt werden: erstens wurde in der Maus nachgewiesen, dass Retinsäure für die Induktion der asymmetrischen Seitenplattenexpression nicht notwendig ist und zweitens dass Shh in der Seitenplatte, 78 Diskussion nicht aber im Bereich des PNCs für die korrekte LR-Achsenentwicklung benötigt wird (Niederreither et al., 2001; Tsiairis and McMahon, 2009). In Huhn und Kaninchen soll der FGF-Signalweg reprimierend auf die Expression der Nodal-Kaskade wirken (Abb. 28). Dabei könnte sich die repressive Funktion von FGF in Kaninchen und Huhn im Laufe der Evolution als Folge unterschiedlicher Anforderungen zur Gewährleistung der Repression der asymmetrischen Genexpression im rechten Seitenplattenmesoderm etabliert haben. Einen Unterschied zwischen Kaninchen und Huhn im Vergleich zu den Modellorganismen Xenopus, Zebrabärbling und Maus lässt sich beispielsweise in der Architektur dieser Embryonen erkennen. So entwickeln sich Huhn und Kaninchen als flache Keimscheibe. Dies hatte möglicherweise einen Einfluss auf die Generierung unterschiedlicher Transfer- und Repressionsmechanismen. Allerdings wurden in Kaninchen und Huhn Experimente zum Funktionsgewinn und Funktionsverlust auf kultivierte Embryonen durchgeführt. Die hier beschriebene Anwendung von FGF8-Protein getränkten Kügelchen ist dabei insofern bedenklich, da Fgf8 endogen nicht in den entsprechenden Bereichen exprimiert wird und hierbei der Funktionsgewinn von der endogenen Funktion abweichen kann (Boettger et al., 1999; Rodríguez Esteban et al., 1999; Fischer et al., 2002). Auch für den Funktionsverlust problematisch ist, dass die extrauterine Entwicklung von Kaninchenembryonen in frühen Stadien selbst ohne Anwendung von Inhibitoren LR-Achsendefekte induzieren kann (Fischer et al., 2002; Bitzer, 2008). Im Kaninchen könnte eine frühere, zweite Funktion von FGF ebenfalls auf die Sensorzellen des LR-Organisators wirken. Im Rahmen von frühen FunktionsverlustExperimenten ließ sich der Verlust asymmetrischer Markergene in der Seitenplatte dokumentieren (Abb. 28; Bitzer 2008). Dies könnte wie in Xenopus und Maus im Verlust der paranotochordalen Nodal-Domäne begründet sein. Auch eine Wirkung von FGF bei der Regulation von FoxJ1 lässt sich im Kaninchen anhand bisher durchgeführter Experimente nicht ausschließen, da diese nicht ausreichend früh kultiviert werden können, um mittels systemischen Inkubationsexperimenten einen frühen Effekt auf die Spezifizierung des LR-Organisators zu erzielen. Schlussfolgernd lässt sich sagen, dass die frühe Funktion der FGF-Signalaktivität in Xenopus der im Zebrabärbling ähnelt, während ein Effekt auf die Sensorzellen des LROrganisators auch bei der Maus detektiert werden kann. Dies könnte bedeuten, dass 79 Diskussion FGF-Signalaktivität in der LR-Determinierung der Wirbeltiere stärker konserviert ist als bislang vermutet wurde. Die bisherige Divergenz der beobachteten Phänotypen könnte somit auf der Art des Signalverlustes und dem Mangel an zeitlicher Auflösung beruhen. Warum fehlen Sensorzellen der GRP nach FGF-Funktionsverlust? SU5402-Inkubationen, die in späten Gastrulastadien begonnen wurden, zeigten, dass zu diesem Zeitpunkt spezifisch die somitischen GRP-Zellen noch sensitiv auf FGFSignalaktivität reagieren. Da der FGF-Signalweg in zelluläre Prozesse wie Apoptose und Zellproliferation verwickelt ist, wäre der Verlust somitischer GRP-Zellen auf einfache Weise - entweder durch induzierte Apoptose oder durch verminderte Zellproliferation in Folge des FGF-Funktionsverlustes - zu erklären gewesen (Böttcher and Niehrs, 2005; Dorey and Amaya, 2010). Allerdings konnte weder mittels TUNEL-Färbung (Apoptose) noch durch pH3-Markierung (Zellproliferation) eine entsprechende Auswirkung der FGFRInhibition entdeckt werden. Als mögliche Ursache eines Fehlens somitischer Zellen im Verbund der GRP zum Neurulastadium 17/18 sind weitere Möglichkeiten zu betrachten: erstens, die somitischen GRP-Zellen haben sich zu entodermalen Zellen umspezifiziert, zweitens, die somitischen Zellen haben ihre epitheliale Anordnung früher verlassen und sind schon in den tiefen Verbund der Somiten integriert, oder drittens, sind in den epithelialen Bereich der medialen GRP eingewandert. 1) Umspezifizierung zu entodermalen Zellen Stubbs und Kollegen konnten 2008 zeigen, dass durch Überexpression von FoxJ1 in den lateral zur GRP gelegenen Entodermzellen GRP-ähnliche Cilien mit einer vergleichbaren Länge entstehen. Die Entodermzellen sind somit in der Lage allein durch den Besitz von Foxj1 GRP-ähnliche Cilien auszubilden. Da die FGFR-Inhibition ab St.11 keine Auswirkung auf die FoxJ1-Expression hatte, wäre zu erwarten gewesen, dass bei einer Respezifizierung der somitischen GRP-Zellen zu entodermalen Zellen, diese lange GRPähnliche Cilien ausbilden. Allerdings konnten durch die rasterelektronenmikroskopische Analyse nur kurze unpolarisierte Cilien, wie sie auch sonst im Entoderm zu beobachten sind, in den lateral zur GRP gelegenen Zellen detektiert werden (Abb. 12B’’). Jedoch ist 80 Diskussion nicht vollkommen auszuschließen, dass die Expression von FoxJ1 in den somitischen im Gegensatz zu den medialen GRP-Zellen auch nach St.11 noch sensitiv auf die FGFInhibition reagiert. Dies würde bedeuten, dass FoxJ1 noch ab St.12/12,5 zu beeinflussen wäre, da dies der späteste Zeitpunkt war, bei dem durch SU5402 ein signifikanter Verlust somitischer GRP-Zellen beobachtet werden konnte. Dies kann allerdings in Frage gestellt werden, da zu diesem Zeitpunkt die endogene FoxJ1-Expression bereits abnimmt. 2) Somitische GRP-Zellen sind schon frühzeitig in den Somitenverbund integriert Die Analyse des FoxJ1-Zielgens Tekt2 wies korrelierend zur wildtypischen FoxJ1Expression nach SU5402-Inkubation eine vergleichbar starke Expression wie nach Inkubation in DMSO auf (Abb. 8A; Stubbs et al., 2008). In transversalen Anschnitten auf Höhe der GRP konnten keine Tekt2-positiven Zellen in dem tiefen Bereich der Somiten ausgemacht werden (nicht gezeigt). Dies spricht dagegen, dass die somitischen GRPZellen durch FGFR-Inhibition schon frühzeitig in den Verbund der Somiten eingewandert sind. Allerdings könnten spezifische Genexpressionen der somitischen GRP-Zellen indirekt durch ihren Ausschluss aus dem Verbund der GRP verloren gegangen sein. Um eine endgültige Aussage treffen zu können, ob sich diese Zellen nach Inhibition des FGFSignalwegs im tiefen Gewebe befinden, bedarf es dies auf eine andere Weise genauer zu untersuchen. Ray Keller konnte die Entstehung der GRP aus dem superfiziellen Mesoderm durch Biotinylierung der Embryonen im Blastulastadium darstellen (Shook et al., 2004). Auf diese Weise markiert man die gesamte GRP und auch das entodermale Epithel und damit eignet sich diese Methode nicht um spezifisch den Verbleib der somitischen GRP nachzuverfolgen. Jedoch markiert man hiermit spezifisch die superfiziellen, nicht aber die tiefen Mesodermzellen. So sollte der Verlust somitischer GRP-Zellen infolge einer frühzeitigen Ingression dadurch gezeigt werden können, dass sich nach Inkubation in SU5402 oder DMSO im Neurulastadium oder auch später vergleichbar viele Biotin-markierte Zellen in den Somiten wieder finden lassen. 3) Somitische GRP-Zellen sind in den epithelialen Bereich der medialen GRP integriert Gemäß der späteren Zellschicksale gliedert sich die mesodermale Randzone von Xenopus entlang der dorsoventralen Achse in verschiedene Bereiche (Dale and Slack, 1987a, 1987b). Während der frühen Gastrulation können die unterschiedlichen Bereiche anhand von spezifischen Expressionsdomänen definiert werden. Zellen erlangen so 81 Diskussion aufgrund ihrer Position unterschiedliche Zellschicksale und grenzen sich dort voneinander ab, wo sich die verschiedenen Zellpopulationen berühren. Differenzielle Zell-Zell-Adhesion wird hierfür als entscheidender Faktor betrachtet. Die Abgrenzung gewährleistet, dass sich Zellpopulationen getrennt voneinander entwickeln können (Reintsch et al., 2005). Bei konvergenten Extensionsbewegungen des axialen (Notochord) und paraxialen (Somiten) Gewebes interkalieren so einzelne Zellen innerhalb ihrer Zellpopulation, ohne die Grenze zu den benachbarten Strukturen zu überschreiten. Morphologisch lassen sich somitische und notochordale Zellen schon ab der mittleren Gastrula unterscheiden (Keller et al., 1989). Durch Manipulation von Genexpressionen lässt sich bewirken, dass Zellen ein neues Zellschicksal annehmen und Zellgrenzen überschreiten. Beispielsweise integrieren notochordale Zellen, die nach Einsetzen der Midblastula-Transition ß-Catenin ektopisch überexprimieren, in die Somiten. Die somitische Zellen dagegen finden sich durch die Inhibition von ß-Catenin im Notochord wieder (Reintsch et al., 2005). Eine Integration dieser Zellen lässt sich selbst noch in späten Gastrulastadien beobachten, also zu dem Zeitpunkt, in dem mittels Inkubation in SU5402 ein spezifischer Verlust der somitischen GRP-Zellen bewirkt werden konnte. Neben ß-Catenin sind in Bezug zur Gewebetrennung des Notochords und der Somiten die Protocadherine PAPC (paraxiales Protocadherin) und AXPC (axiales Protocadherin) in der homophilen Zell-Zell Aggregation und in der Zellsortierung involviert. PAPC wird zum Ende der Gastrulation vom somitischen Mesoderm exprimiert, während AXPC im Notochord exprimiert wird (Kim et al., 1998; Kuroda et al., 2002). Somitische Zellen benötigen somit die Expression von PAPC für die Zelladhesion mit anderen PAPC-exprimierenden Zellen, wobei die Transkription von PAPC abhängig vom FGF-Signalweg ist (Kim et al., 1998; Branney et al., 2009). Der Verlust an FGF-Signalaktivität in späten Gastrulastadien könnte sich so spezifisch auf die Identität der somitischen GRP-Zellen und ihre Adhesionseigenschaften ausgewirkt haben und ihre Integration in den medialen Bereich der GRP bewirkt haben. Dass in diesem Zusammenhang die Inhibition des FGFSignalwegs zu keiner auffallenden Verbreiterung des medialen Anteils der GRP führte, könnte dabei Folge der konvergenten Extensionsbewegungen sein. Um zu untersuchen, ob sich somitische GRP-Zellen nach Inhibition der FGF-Signalaktivität im medialen Bereich der GRP eingegliedert haben, könnte man lacZ als Reportergen unter die Kontrolle eines schon zu Beginn der Inkubation (Ende Gastrula) spezifisch in den 82 Diskussion Somiten nicht aber im Notochord exprimierten Gens (z.B. PAPC) setzen. Auch wenn sich durch eine Umspezifizierung der Zellen das Expressionsprofil ändert, sollte durch den späten Beginn der SU5402-Inkubation bereits lacZ exprimiert worden sein. Die Analyse der ß-Galactosidase-Aktivität könnte dann zeigen, ob sich somitische Zellen im medialen Bereich der GRP wiederfinden lassen. Welche FGF-vermittelten Signaltransduktionen wirken auf die Lateralitäts- entwicklung? Die zwei Funktionen, die der FGF-Signalweg zu den unterschiedlichen Entwicklungszeitpunkten in der LR-Achsenentwicklung von Xenopus spielt, könnten hierbei von verschiedenen Signaltransduktionswegen abhängen. Da die Spezifizierung des superfiziellen Mesoderms in späten Blastula-/frühen Gastrulastadien von der FGFSignalaktivität abhängig ist, könnte hier der MAPKinase-Signalweg entscheidend sein. Abbildung 29: Modell: LR-spezifische Funktionen der FGF-Signalaktivität werden über unterschiedliche Signaltransduktionswege reguliert Da der FGF-Signalweg in späten Blastula-/frühen Gastrulastadien über MAPKinase eine Rolle in der Spezifizierung des Mesoderms spielt, wird die FGF-abhängige Spezifizierung des superfiziellen Mesoderms möglicherweise ebenfalls über den MAPK-Signalweg gesteuert. Gegen Ende der Gastrulastadien soll es zu einem Wechsel von der MAPK- zur PLC/PKC/Calcium-vermittelten Signaltransduktion kommen. Konvergente Extensionsbewegungen hängen dabei von intrazellulären Cacliumkonzentrationen ab. Auch die Spezifizierung der Sensorzellen in den späten Gastrulastadien wird FGF-abhängig über Calcium reguliert. Dagegen wirkt der FGF-Signalweg in späten Gastrulastadien spezifisch in der LRAchsenentwicklung, indem er die Bildung der Sensorzellen kontrolliert. Die zweite 83 Diskussion Funktion fällt somit in das Zeitfenster, in dem ein Wechsel von der MAPK- zur PLC/PKC/Calcium-vermittelten Signaltransduktion stattfinden soll (Abb. 29; Sivak et al., 2005). PLC/PKC/Calcium-unabhängige Signaltransduktion wirkt auf FoxJ1 Mittels Inhibitionsexperimenten ließ sich zeigen, dass der FGF-Signalweg in frühen Gastrulastadien für die Expression von FoxJ1 im superfiziellen Mesoderm essentiell ist (Abb. 7A). Da der FGF-Signalweg zu diesem Entwicklungszeitpunkt über die MAPK auf die Embryogenese von Xenopus wirkt, lässt sich indirekt mutmaßen, dass auch die FoxJ1Expression von der Aktivierung der MAPK-Signaltransduktion abhängt. Im Einklang damit hatte die Überexpression von Spry1 und somit die Inhibition des PLC/PKC/CalciumSignalwegs keinen Einfluß auf die Expression von FoxJ1 (Abb. 19A). Im Gegensatz zu SU5402, welches jegliche Signaltransduktion nachgeschaltet zum FGFRezeptor unterbindet, lässt sich durch MEK-Inhibitoren wie U0126 spezifisch der MAPKSignalweg inhibieren (Sivak et al., 2005). Um weiterführend zu untersuchen, ob die Expression von FoxJ1 über die MAPK-vermittelte Signaltransduktion abhängig vom FGFSignalweg ist, müsste man spezifisch diesen Signalzweig inhibieren. Die Anwendung von U0126 in frühen Gastrulastadien könnte hierbei genutzt werden und sollte im Falle einer MAPK-abhängigen Induktion von FoxJ1 zu dessen Expressionsverlust führen. MAPK-unabhängige Signaltransduktion wirkt auf die Sensorzellen der GRP Durch die Unterbindung der Rezeptor-vermittelten FGF-Signaltransduktion in späten Gastulastadien konnten Defekte bei der Mesodermspezifizierung der Randzone umgangen werden. Nichtsdestotrotz spielt FGF-Signalaktivität eine Rolle in der weiteren Spezifizierung und Aufrechterhaltung mesodermaler Genexpressionen. So hatte die Inhibition eine leichte Abschwächung mesodermaler Gene (Xbra, MyoD) im Neurulastadium zur Folge. Dabei war hauptsächlich das posterior zur GRP gelegene Mesoderm betroffen, während das entlang der AP-Achse auf Höhe der GRP gelegene Mesoderm Expression von MyoD (Somiten) und Xbra (Notochord) aufwies. Bei MyoD konnte auch eine Reduktion der lateralen Ausbreitung beobachtet werden. Embryonen, 84 Diskussion deren FGF-Signaltransduktion zeitlich etwas später, beginnend ab St.12,5-13 inhibiert wurde, wiesen dieselbe Reduktion dieser mesodermalen Genexpressionen auf, ohne jedoch unter LR-Achsendefekte zu leiden (Abb. 4B, Abb. 15A). Dies spricht dafür, dass die Abschwächung mesodermaler Gene infolge der FGFR-Inhibition nicht kausal mit Störungen der Lateralitätsentwicklung zusammenhängt und dass der Verlust somitischer Zellen unabhängig von der MAPK-abhängigen Mesodermspezifizierung stattfindet. Der Verlust somitischer GRP-Zellen durch die Überexpression von Spry1 unterstützte, dass die späte Funktion des FGF-Signalwegs unabhängig von der MAPK auf die Bildung der Sensorzellen wirkt. Jedoch konnte in dieser Arbeit ein leicht negativer Effekt von Spry1 auf die Mesoderminduktion festgestellt werden. Die Reduktion fiel allerdings relativ mild aus und war nur in Gastrulastadien auszumachen, also zu einem Zeitpunkt, indem die späten SU5402-Inkubationen noch nicht begonnen worden waren. In späteren Stadien hatte sich die Expression mesodermaler Marker auf ein wildtypisches Maß erholt. Zudem wurde die Reduktion von MyoD in Gastrulastadien in allen injizierten Embryonen beobachtet, während die Reduktion von XnrI oder Coco höchstens 60% der Embryonen betraf. Dies spricht dafür, dass Sprouty1 unabhängig vom MAPK-Signalweg Einfluss auf die somitischen GRP-Zellen nimmt. FGF-Signalaktivität wirkt über Calcium auf die Sensorzellen der GRP Der Verlust somitischer GRP-Zellen nach Überexpression von Spry1 legt nahe, dass nachgeschaltet zur Aktivierung des FGF-Rezeptors der PLC/PKC/Calcium-Signalweg Einfluss auf die Bildung der Sensorzellen des LR-Organisators nimmt. Dass hierbei insbesondere die intrazelluläre Freisetzung von Calcium von Bedeutung ist, lässt sich aus Funktionsverlustexperimenten von Pkd2 herleiten. So hatte der Knockdown von Pkd2 neben dem bereits beschriebenen Verlust der paranotochordalen Xnr1-Domäne den generellen Verlust der somitischen GRP-Zellen zur Folge (Abb. 23; Vick, 2009). EpistasisExperimente von Pkd2-MO und Spry1-mRNA und Rescue-Experimente von Spry1-mRNA mit Pkd2-mRNA unterstützen dabei, dass Sprouty1 über die Inhibition von Calcium FGFabhängig auf die Sensorzellen der GRP Einfluss nimmt. Im Gegensatz zur Überexpression von Spry1, die einen spezifischen Effekt auf die Sensorzellen ausübte, hat der Funktionsverlust von Pkd2 Auswirkungen auf die 85 Diskussion Spezifizierung des gesamten superfiziellen Mesoderms. Die Injektion von Pkd2-MO wirkt hier negativ auf die Expression von FoxJ1 und seinen Zielgene (Vick, 2009; Grüdl, 2012). Übereinstimmend dazu konnte auf rasterelektronenmikroskopischen Aufnahmen, die im Rahmen dieser Arbeit durchgeführt wurden, beobachtet werden, dass im Gegensatz zu SU5402, dnFgfr1 oder Spry1 nach Pkd2-MO auch teilweise die medialen Zellen der GRP kein langes Monocilium aufwiesen (nicht gezeigt). Aufgrund der gezielten Injektion in den lateralen Teil der GRP war dieser Effekt nur leicht zu beobachten. Der generell schwere Phänotyp des Pkd2-Funktionsverlusts korreliert damit, dass Calcium in der frühen Entwicklung in mehr Prozessen als nur in der Bildung somitischer GRPZellen beteiligt ist. Calcium-Wellen, welche in den Blastula- und Gastrulastadien von Xenopus- und Zebrabärbling-Embryonen auftreten, wirken in vielen musterbildenden Prozessen mit (Webb and Miller, 2006). Im Zebrabärbling sind dynamische Calciumanstiege während der Gastrulastadien essentiell für die Bildung des KV und in Xenopus wird neben Pkd2 der Serotoninrezeptor 5HTR3c, der unter anderem einen Calcium durchlässigen Ionenkanal bildet, für die korrekte Spezifizierung des superfiziellen Mesoderms benötigt (Schneider et al., 2008; Vick, 2009; Oteiza et al., 2010; Beyer et al., 2012). Der Pkd2-Funktionsverlust inhibiert intrazelluläre Calciumanstiege auf einer anderen Ebene als Sprouty1. Neben den Cilien lokalisiert PC2 größtenteils im ER als Calciumaktivierter Calcium-Kanal, der durch Interaktion mit dem IP3-Rezeptor den intrazellulären Calciumanstieg unabhängig vom FGF-Signalweg moduliert (Li et al., 2005; Qian and Noben-Trauth, 2005; Mekahli et al., 2012). Sprouty-Proteine wirken dagegen negativ auf die Calcium-regulierende Signaltransduktion des FGF-Signalwegs, indem sie PLCγ und somit die Umsetzung von PIP zu DAG und IP3 inhibieren (Akbulut et al., 2010). Generell können also Calciumanstiege trotz Überexpression von Spry1 stattfinden. Da SproutyProteine endogen während der Gastrulation im Mesoderm exprimiert und erst zu Ende der Gastrulation herabreguliert werden, sollten theoretisch keine FGF-induzierten Calciumanstiege während der frühen Entwicklung erfolgen. Durch die zeitlich begrenzte Inhibition via SU5402 konnte gezeigt werden, dass der FGF-Signalweg in späten Gastrulastadien auf die Bildung der somitischen GRP-Zellen wirkt. Die Überexpression von Spry1 könnte so ektopisch in einem Zeitfenster am Ende der Gastrulation inhibierend 86 Diskussion auf Calcium wirken. Im Gegensatz zu frühen Calcium-abhängigen Prozessen reagieren die Sensorzellen auf diese Weise sensitiv auf die FGF-vermittelte Regulation von Calcium. Dass Calcium am Ende der Gastrulation auf die Sensorzellen der GRP wirkt, wurde durch die Anwendung eines Inhibitors (Thapsigargin), der die intrazellulären Calciumspeicher des Endoplasmatischen Retikulums dezimiert, bestärkt (Abb. 26; Treiman et al., 1998). Durch Funktionsverlustexperimente des Liganden Wnt11b, der unter anderem den nichtkanonischen Wnt/Calcium-Signalweg aktiviert, konnte ebenfalls ein Effekt auf die Sensorzellen beobachtet werden (Abb. 27; Kühl, 2004; Walentek et al., 2013). Dass der Knockdown von Wnt11b zum Verlust der bilateralen Nodal- und Coco-Expression führte und epistatisch mit Spry1 wirkte, unterstützt die Hypothese, dass dieser Ligand über den Wnt/Calcium-Signalweg auf die Sensorzellen Einfluss nimmt. FGF-Signalaktivität könnte über den kanonischen Wnt-Signalweg auf FoxJ1 wirken In Xenopus und im Zebrabärbling konnte gezeigt werden, dass die Expression von FoxJ1 abhängig vom kanonischen Wnt-Signalweg ist (Beyer, Danilchik, et al., 2012; Caron et al., 2012). Da der kanonische Wnt-Signalweg essentiell für die zygotische Induktion der Organisatorgene und somit für die Spezifizierung der dorsalen Seite ist, scheint er ein geeigneter Faktor für die Spezifizierung des superfiziellen Mesoderms zu sein (Heasman, 2006). Im Folgenden soll diskutiert werden, wie der FGF-Signalweg auf die Expression von FoxJ1 Einfluss nehmen könnte. Hierzu wird ein Modell vorgeschlagen, wie FoxJ1Expression über den kanonischen Wnt-Signalweg gewährleistet und dabei auf den dorsalen Bereich beschränkt wird und wie der FGF-Signalweg darin integriert werden könnte (Abb. 30). ß-Catenin lässt sich, abhängig von maternalen Faktoren und der kortikalen Rotation, vor Beginn der Midblastula-Transition ausschließlich auf der dorsalen Seite der Blastulastadien 8-8,5 kernlokalisiert detektieren (Schohl and Fagotto, 2002). Von St.8,5 an findet sich ß-Catenin jedoch zunehmend auch im ventralen und lateralen Bereich der zukünftigen mesodermalen Randzone, was ebenfalls durch maternale Faktoren vermittelt wird (Schohl and Fagotto, 2003). Dass die Induktion von Organisatorgenen dennoch ausschließlich auf der dorsalen Seite stattfindet, wird hier durch den zeitlichen Aspekt der Signalintensität erklärt. Nukleäres ß-Catenin reichert sich zuerst auf der dorsalen Seite an, 87 Diskussion Abbildung 30: Modell der Wirkung von FGF-Signalaktivität auf die Expression von FoxJ1 Der kanonische Wnt-Signalweg (kernlokalisiertes ß-Catenin) induziert FGF-abhängig die Expression von FoxJ1. Der BMP-Signalweg reprimiert den kanonischen Wnt-Signalweg im ventrolateralen Bereich, während der kanonische Wnt-Signalweg im tiefen Mesoderm von PAPC antagonisiert wird. Serotonin ist stark in der superfiziellen Schicht der animalen Kappe angereicht und wirkt positiv auf den kanonischen Wnt-Signalweg, sodass FoxJ1 auf der dorsalen Seite im superfiziellen Mesoderm exprimiert wird. Der FGF-Funktionsverlust wirkt sich negativ auf den kanonischen Wnt-Signalweg aus und die Expression von FoxJ1 geht verloren. Durch FGF-Funktionsvgewinn wird der kanonische Wnt-Signalweg verstärkt, sodass ektopisch FoxJ1 induziert wird. Ektopische FoxJ1-Expression tritt dabei ventral nur in dem Bereich auf wo auch Serotonin den kanonischen Wnt-Signalweg ausreichend verstärkt. Auf der dorsalen Seite ist die FGF-induzierte Verstärkung des kanonischen Wnt-Signalwegs ausreichend, um die FoxJ1-Expression ins tiefe Gewebe des Mesoderms auszuweiten. wodurch es schnell einen hohen Pegel erreicht, welcher für die Induktion der Organisatorgene benötigt wird. Ventral wird dieser Pegel erst später (ab St.8,5 88 Diskussion zunehmend) erreicht, zu einem Zeitpunkt, in dem er nicht mehr ausreichend für die Induktion der Organisatorgene ist (Schohl and Fagotto, 2003). Die Einschränkung von Organisatorgenen auf das dorsale Mesoderm wird zudem durch den zygotisch aktivierten BMP-Signalweg gewährleistet, der ab Beginn der Midblastula-Transition im ventrolateralen Bereich aktiv ist und repressiv auf organisatorspezifische Genexpressionen wirkt (Marom et al., 2005). BMP-Signalaktivität könnte so auch repressiv auf die Wnt-abhängige Spezifizierung des superfiziellen Mesoderms und die Expression von FoxJ1 wirken (Abb. 30). Im Rahmen einer Doktorarbeit unseres Labors konnte nach Anwendung von Cycloheximide, einem Inhibitor der Proteinsynthese, eine ektopische Expression von FoxJ1 in der ventralen Randzone beobachtet werden (Beyer, 2011). Dies deutet darauf hin, dass FoxJ1 durch die Aktivierung zygotischer Genaktivität (z.B. BMP) auf den dorsalen Bereich beschränkt wird. Wenn FoxJ1 in Xenopus , wie im Zebrabärbling gezeigt, direkt durch ß-Catenin induziert wird, dann liefert die von maternalen Faktoren gewährleistete Anreicherung von ß-Catenin in der ventrolateralen Mesodermzone eine Erklärung weshalb durch Cycloheximide FoxJ1 ektopisch induziert werden kann (Caron et al., 2012). Während die Cycloheximide-Experimente eine Rolle des maternalen WntSignalwegs in der Induktion von FoxJ1 implizieren, konnte zudem gezeigt werden, dass auch zygotische Wnt-Aktivität die Expression von FoxJ1 kontrolliert (Walentek et al., 2012). Serotonin als Kompentenzfaktor des kanonischen Wnt-Signalwegs findet sich stark angereichert im superfiziellen Epithel der animalen Hemisphäre und beschränkt so die Spezifizierung des superfiziellen Mesoderms auf die epitheliale Schicht. Der Verlust von FoxJ1-Expression nach Knockdown des Serotonin-Rezeptors 3 lässt sich durch Überexpression von Xdsh und ß-Catenin retten (Beyer et al., 2012). Dass hierbei die Induktion von FoxJ1 trotz des Funktionverlustes von Serotonin ausschließlich in der epithelialen Schicht stattfindet, lässt sich möglicherwiese durch PAPC erklären. PAPC wird im tiefen Gewebe der mesodermalen Randzone exprimiert und inhibiert hier durch Interaktion mit Casein Kinase 2 beta den kanonischen Wnt-Signalweg in diesem Bereich (Kietzmann et al., 2012). Somit stellt dieses Protocadherin neben Serotonin einen weiteren Faktor dar, der die Einschränkung der Spezifizierung des superfiziellen Mesoderms und somit der Expression von FoxJ1 auf die epitheliale Schicht gewährleisten könnte (Abb. 30). 89 Diskussion In vielen Prozessen wirkt der Wnt-Signalweg im Zusammenspiel mit dem FGF-Signalweg (Pownall and Isaacs, 2010). Beispielsweise lässt sich die Repression die Groucho auf den kanonischen Wnt-Signalweg ausübt durch MAPK-vermittelte Phosphorylierung verhindern (Burks et al., 2009). Der FGF-Signalweg könnte somit als Kompetenzfaktor des WntSignalwegs dienen, sodass seine Inhibition den Verlust von FoxJ1-Expression nach sich zieht (Abb.30). Im Einklang mit dem FoxJ1-Phänotyp nach FGF-Funktionsverlust, führte der Funktionsgewinn mittels Injektion von DNA des Liganden Fgf8b zu einer ektopischen Induktion von FoxJ1. FGF könnte hierbei über die Verstärkung des Wnt-Signalwegs FoxJ1 induzieren. Bei ventraler Injektion wurde diese ektopische Expression ausschließlich im superfiziellen Mesoderm der ventralen Seite beobachtet, also in dem Bereich in welchem die ektopische FGF-Aktivierung nach Einsetzen der Midblastula-Transition auf Serotonin und kernlokalisiertes ß-Catenin trifft. Die FGF-vermittelte Verstärkung könnte hierbei nur im Serotonin-positiven Bereich ausreichend stattfinden, während der FGF-Signalweg nicht in der Lage wäre die repressiven Faktoren der ventralen Zone (z.B. BMP) im tiefen Gewebe zu überwinden (Abb. 30). Im Gegensatz zur ventralen wurde durch die dorsale Überexpression von Fgf8b die Expression von FoxJ1 auch in den tiefen Zellschichten ektopisch induziert. Einerseits könnte die FGF-Signalaktivität hier über eine direkte Verstärkung des kanonischen WntSignalwegs die Überwindung der repressiven PAPC-Eigenschaften vermitteln. Andererseits könnte man auch vermuten, dass der FGF-Signalweg über die Inhibition von PAPC positiv auf den kanonischen Wnt-Signalweg wirkt. Diese Hypothese beruht auf der Beobachtung, dass sich FoxJ1 ebenfalls durch Überexpression von Spry1 ektopisch in der tiefen Schicht des dorsalen Mesoderms induzieren lässt (eigene Beobachtung). Endogen wird Sprouty1 von PAPC gebunden und inhibiert (Wang et al., 2008). Wäre Sprouty1 umgekehrt auch in der Lage durch Bindung an PAPC dessen antagonistische Aktivitäten auf den kanonischen Wnt-Signalweg zu unterbinden, könnte dies die ektopische Induktion von FoxJ1 nach Überexpression von Spry1 erklären. Da Spry1 selber durch den FGFSignalweg induziert wird, kann diese Hypothese eine Erklärung liefern, wie durch den FGF-Funktionsgewinn FoxJ1 im tiefen Gewebe induziert werden könnte. Andererseits lässt sich bisher nicht ausschließen, dass kernlokalisiertes ß-Catenin in Xenopus über die Aktivierung des FGF-Signalwegs auf FoxJ1 wirkt. So induziert ßCatenin im mesodermalen Ring die Induktion von FGF3 und trägt so zur Aktivierung des FGF-abhängigen MAPK-Signalwegs und der Spezifizierung des Mesoderms bei (Schohl and Fagotto, 2003). Letztere Möglichkeit scheint aus folgenden Gründen nicht 90 Diskussion wahrscheinlich: Anders als maternale Wnt-Aktivität ist der FGF-Signalweg vor Einsetzen der Midblastula-Transition nur in geringem Ausmaß aktiv und während der Wnt-Signalweg früh ausschließlich die Spezifizierung der dorsalen Seite gewährleistet, wirkt der FGFSignalweg auf die Spezifizierung der gesamten mesodermalen Randzone. Weiterhin würde sich damit nicht erklären lassen, wie durch die Anwendung von Cycloheximide die ektopische Induktion von FoxJ1 bewirkt werden kann. FGF als permissiver und verstärkender Faktor des Wnt-Signalwegs könnte dagegen gewährleisten, dass ß-Catenin nach Einsetzen der Midblastula-Transition ausreichend stark agieren kann, während es durch die Inhibition von FGF nur vermindert wirkt. In diesem Falle sollte die durch die FGFR-Inhibition hervorgerufene Reduktion von FoxJ1 durch eine zusätzliche Überexpression der Wnt-Signalkomponenten dvl2 oder ß-Catenin überwunden werden. Würde jedoch der FGF-Signalweg nachgeschaltet zum Wnt-Signalweg wirken, so sollte die Überexpression von Wnt-Signalkomponenten nicht in der Lage sein, die Inhibition von FGF auf Höhe des Rezeptors zu unterbinden. Zu bedenken bleibt, dass der frühe Verlust von Rezeptor-vermittelter FGF-Signalaktivität starke Auswirkungen auf die generelle Mesodermentwicklung ausübt. Dieser Effekt lässt sich zeitlich nicht von der Spezifizierung des superfiziellen Mesoderms trennen. Trotz der entscheidenden Rolle des FGF-Signalwegs als Regulator des Mesoderms, kann der Ciliendefekt, der sich durch Inhibition dieses Signalwegs im Zebrabärbling ergibt, durch die Aktivierung des kanonischen Wnt-Signalwegs gerettet werden (Griffin et al., 1995; Caron et al., 2012). Dass der kanonische Wnt-Signalweg hierbei den durch FGFR-Inhibition verursachten Ciliendefekt retten kann zeigt, dass die Mesodermspezifizierung dennoch ausreichend stattgefunden hat. Weiterhin könnte FGF auch über die Regulation von Xbra wirken. So gehen Lateralitätsdefekte infolge des Funktionsverlustes von Brachyury in Maus und Xenopus mit Ciliendefekten und einer gestörten Morphologie des LROrganisators einher (Andre, 2009). Modell des Zusammenspiels von Calcium mit anderen Signalwegen in der Spezifizierung der Sensorzellen des LR-Organisators In der Literatur sind mehrere Signalwege beschrieben worden, die an der Regulation der Sensorzellen mitwirken. In Abb. 31 ist ein Modell dargestellt, das über verschiedene 91 Diskussion Möglichkeiten der Wirkung von Calcium auf die Sensorzellen spekuliert und Erkenntnisse aus anderen Signalwegen integriert. Der FGF-Signalweg induziert die Freisetzung von intrazellulärem Calcium über die Aktivierung der PLC. Calcium wiederum aktiviert die PKC und könnte hierüber die Morphogenese der Zellen beeinflussen (Slusarski and Pelegri, 2007). So ist die PKC unter anderem in der Abgrenzung von unterschiedlichen Gewebedomänen involviert und reguliert über cdc42 die Adhesion von Zellen (Winklbauer et al., 2001; Choi and Han, 2002; Webb and Miller, 2006). Wenn der FGF-Signalweg über Calcium auf die Adhesionseigenschaften der somitischen GRP-Zellen Einfluss nimmt, könnte dies beispielsweise bewirken, dass diese nicht in den medialen Bereich der GRP oder nicht frühzeitig in den Somitenverbund integriert werden. Zudem sind intrazelluläre CalciumWellen mit der Generierung von Zellpolarität verknüpft und werden für koordinierte Zellbewegungen benötigt (Shindo et al., 2010). Der Verlust der spezifischen Genexpression der Sensorzellen (Nodal/Coco/Derrière) nach Inhibition des FGFSignalwegs könnte indirekt die Folge der Calcium-abhängigen Aufrechterhaltung von somitischen Zellen im Epithel der GRP sein. Allerdings könnte Calcium auch unabhängig von der Morphogenese dieser Zellen eine zusätzliche Funktion in der Regulation von Gentranskription ausüben. Ein Signalweg, dem eine direkte transkriptionelle Kontrolle der Sensorzellen nachgewiesen werden konnte, stellt der Notch-Signalweg dar (Abb. 31). In der Maus reguliert der Notch-Signalweg nachgeschaltet zu FGF die Induktion der paranotochordalen Nodal-Domäne (Krebs et al., 2003; Przemeck, 2003; Raya et al., 2003; Oki et al., 2010). Die Enhancer-Region, über die spezifisch bilaterales Nodal (NDE-Enhancer) induziert wird, weist zwei funktionelle CSL Bindestellen auf. CSL Proteine agieren als Mediatoren des Notch-Signalwegs. Durch Aktivierung des Notch-Signalwegs translokalisiert die intrazelluläre Domäne des Notch-Rezeptors („Notch intracellular domain“; NICD) in den Zellkern und induziert im Zusammenspiel mit CSL die Gentranskription. Dll1 KnockoutMäusen und Notch1/2 homozygoten doppelmutanten Mäusen fehlt somit die paranotochordale und asymmetrische Nodal-Expression (Krebs et al., 2003; Raya et al., 2003). Auch in Xenopus und Zebrabärbling spielt der Notch-Signalweg eine Rolle. Sowohl der Rezeptor Notch, als auch sein Ligand Delta, weisen hierfür ebenso wie in der Maus eine entsprechende Expression im Bereich der GRP und des KVs auf (Niikura et al., 2006; Sakano et al., 2010). Im Einklang damit führt in Xenopus der Funktionsverlust von Notch 92 Diskussion mittels Morpholino-Oligonukleotid Knockdown zum Verlust der bilateralen und asymmetrischen Nodal-Domäne (Sakano et al., 2010). Im Zebrabärbling lassen Funktionsgewinn und -verlust indirekt auf eine Rolle des Notch-Signalwegs in der Regulation der paranotochordalen Nodal-Domäne schließen. So kommt es durch Überexpression von NICD oder DeltaD (Funktionsgewinn) zur bilateralen Expression von Seitenplattengenen, während die Inkubation in DAPT oder der Knockdown von Smarcd3 Abbildung 31: Modell des Zusammenspiels von Calcium mit anderen Signalwegen in der Spezifizierung der Sensorzellen Durch Interaktion des Notch Rezeptors (Sensorzelle) mit seinem Liganden Dll1, der auf der benachbarten Zelle lokalisiert (paraxiale Mesodermzelle) wird der Notchsignalweg aktiviert. Die intrazelluläre Domäne von Notch (NICD) wird abgespalten, wandert in den Zellkern und aktiviert über CSL die Transkription sensorspezifischer Genexpressionen (Nodal/Coco). Zic3 beeinflusst hierbei auf unbekannte Weise die Notch-vermittelte Geninduktionen und wird selber von Brachyury in einer FGF/Calcium-abhängigen Weise induziert. Nachgeschaltet zur FGF-Rezeptoraktivierung wird über den MAPK-Signalzweig MyoD-Expression reguliert. MyoD wiederum induziert die Expression von Dll1, wobei das Calcium-bindende Protein Calmodulin in der MyoD-vermittelten Genkontrolle permessiv wirkt. In diesem Modell wirkt intrazelluläres Calcium FGF-abhängig über Dll1 und Zic3 auf die Genexpression der Sensorzellen. Zudem aktiviert Calcium PKC und nimmt darüber Einfluss auf die Morphogenese dieser Zellen. 93 Diskussion (codiert für Baf60c: positiver Regulator des Notch-Signalwegs: Funktionsverlust) einen Verlust der asymmetrischen Seitenplattengene nach sich zieht (Raya et al., 2003; Kawakami et al., 2005; Niikura et al., 2006; Takeuchi et al., 2007). Calcium könnte hierbei Einfluss auf den Notch-Signalweg nehmen, indem es die Transkription des Liganden Dll1 in den benachbarten paraxialen Zellen kontrolliert. In Xenopus wirkt der FGF-Signalweg über MyoD auf die Expression von Dll1 (Wittenberger et al., 1999; Fisher et al., 2002; Fletcher and Harland, 2008). In vorläufigen Experimenten, die innerhalb dieser Arbeit durchgeführt wurden, konnte durch den MorpholinoOligonukleotid Knockdown von MyoD der Verlust der Nodal- und Coco-Expression erzielt werden (nicht gezeigt). Der FGF-abhängige Calcium-Signalweg könnte hierbei über Calmodulin permessiv auf die MyoD-induzierte Expression von Dll1 wirken (Abb. 31). Beispielsweise ermöglicht in Fibroblasten Calcium-sensitives Calmodulin die MyoDvermittelte Gentranskription und somit die Differenzierung zu Myoblasten (Hauser et al., 2008). Zudem würde in diesem Kontext auch die MAPK-vermittelte Signaltransduktion des FGF-Signalwegs über die Expressionskontrolle von MyoD eine Rolle spielen (Abb. 31). In der Maus wird die Transkription von Dll1 durch den Transkriptionsfaktor Tbx6 angeschaltet, sodass die Inhibition von FGF-Signalaktivität einhergehend mit dem Verlust von bilateralem Nodal den Verlust von Tbx6 und Dll1 aufweist (White and Chapman, 2005; Oki et al., 2010). Das zu Tbx6 der Maus homologe Gen spadetail wird im Zebrabärbling ebenfalls vom FGF-Signalweg induziert und für die Expression der paranotochordalen Nodal-Expression benötigt (Griffin et al., 1998; Amack et al., 2007; Gourronc et al., 2007). In Xenopus lässt sich eindeutig erkennen, dass Nodal- und Coco- dasselbe Expressionsmuster in den somitischen Sensorzellen der GRP aufweisen (Schweickert et al., 2010). Hierbei würde sich das gleiche Expressionmuster leicht durch eine gemeinsame Genkontrolle beider Gene verwirklichen lassen. Wenn hierbei Calcium über den NotchSignalweg auf die Genexpression wirkt, so bedeutet dies, dass der Notch-Signalweg generell die spezifische Genexpression der Sensorzellen kontrolliert. Dies lässt sich mit Experimenten aus der Maus vereinbaren, wo die Applikation von DAPT sowohl den Verlust der paranotochordalen Nodal als auch Cerl2-Expression verhindert. Hiervon sind auch andere Gene wie GDF1, die in derselben Domäne exprimiert werden, betroffen (Kitajima et al., 2013). Allerdings führt kontrovers dazu der Knockdown von Smarcd3 zu einem Verlust von bilateralem Nodal, ohne Cerl-2 und GDF1 zu beeinträchtigen (Takeuchi 94 Diskussion et al., 2007). Auch im Zebrabärbling gibt es widersprüchliche Beschreibungen der Funktion des Notch-Signalwegs. Zum einen führt die Inhibition mittels DAPT zu einem Verlust von Nodal-Expression, während in einer anderen Publikation DAPT den Verlust von Charon, nicht aber von Nodal, zur Folge hat (Kawakami et al., 2005; Gourronc et al., 2007). Die genaue Funktion des Notch-Signalwegs in der Regulation der Sensorzellen bleibt damit noch offen. Denkbar ist auch, dass Calcium über den Zinkfinger-Transkriptionsfaktor Zic3, der zur GliSuperfamilie zählt, auf die Gentranskription der Sensorzellen wirkt (Abb. 31). In Xenopus wird Zic3 im Mesoderm und Neuroektoderm exprimiert und ist abhängig von FGFRezeptoraktivität und intrazellulären Calciumanstiegen (Kitaguchi et al., 2000; Leclerc et al., 2003; Marchal et al., 2009). Die Transkription von Zic3 im Mesoderm von Xenopus findet während der Gastrulastadien statt. Dies deutet an, dass Zic3 bei einer Funktion in der Spezifizierung des LR-Organisators schon früh in den Vorläuferzellen wirkt. Eine Funktion von Zic3 in der LR-Achsenentwicklung von Xenopus konnte nachgewiesen werden (Kitaguchi et al., 2000). Der Knockdown von Zic3 hat einen hohen Anteil an Embryonen mit bilateraler oder fehlender Pitx2c-Expression zur Folge (Cast et al., 2012). Hierbei werden die LR-Defekte von konvergenten Extensionsdefekten begleitet, die möglicherweise auf einem gestörten PCP-Signalweg beruhen und somit das bilaterale Expressionsmuster erklären könnten (Walentek et al., 2012). Das Fehlen der Seitenplattenexpression dagegen könnte Folge einer fehlenden paranotochordalen Nodal Domäne sein. In der Maus wurde bereits eine Funktion von Zic3 in der Regulation der bilateralen Nodal-Domäne nachgewiesen (Purandare et al., 2002). Heterozygote Zic3Mäuse, die LacZ unter der Kontrolle des NDE-Enhancers exprimieren, weisen Expression nur in einzelnen Zellen der paranotochordalen Domäne auf. Da der Genlokus von Zic3 sich auf dem X-Chromosom befindet, fällt die Mutation in männlichen Embryonen stärker aus und die Expression eines Reportergens, das unter Kontrolle des bilateralen NodalEnhancers steht, fehlt meist vollständig (Ware et al., 2006). Wenn auch bisher nicht feststeht wie genau Zic3 auf den Nodal-Enhancer wirkt, wird Zic3 in der Maus am richtigen Ort exprimiert, um in der Genexpressionskontrolle der Sensorzellen regulierend mitzuwirken (Elms et al., 2004). Auch der Funktionsverlust von Brachyury wirkt sich, wie bereits in Maus und Xenopus beschrieben, auf die Sensorzellen aus, da er den Verlust der paranotochordalen NodalExpression zur Folge hat (King et al., 1998; Andre, 2009). Durch die Überexpression von 95 Diskussion Brachyury lässt sich in Xenopus relativ zeitnah die Expression von Zic3 induzieren (Kitaguchi et al., 2002). Somit könnte Brachyury als direkter Faktor die Transkription von Zic3 kontrollieren, wobei FGF-abhängige Calciumaktivität als permessiver Faktor agieren würde (Abb. 31). Dies liefert eine Erklärung wie Brachyury auf die Expression der bilateralen Nodal-Domäne wirkt. Zic3 wiederum könnte möglicherweise zusammen mit dem Notch-Signalweg auf die Transkription der Sensorzellen Einfluss nehmen. Die Spezifizierung der Sensorzellen findet nicht nur in Xenopus, sondern zumindest auch in der Maus Calcium-abhängig statt. Im Einklang mit den Ergebnissen dieser Arbeit konnte kürzlich gezeigt werden, dass bereits während der Spezifizierung dieser Zellen symmetrisch auftretende intrazelluläre Calcium-Wellen für die Determinierung der LRAchse entscheidend sind. Diese werden Pkd2-unabhängig generiert und sind für die Induktion der paranotochordalen Nodal- und Cerl-2 Expressionsdomänen essentiell (Takao et al., 2013). Im Huhn wurde in diesem Kontext zuerst eine Rolle für extrazelluläres Calcium in der Induktion von Nodal über die Regulation von Notchaktivität beschrieben (Raya et al., 2004). Später konnte auch die Notwendigkeit von intrazellulärem Calcium für die Nodal-Expression nachgewiesen werden (Garic-Stankovic et al., 2008). Seine wohl prominenteste Rolle in der LR-Achsenentwicklung der Wirbeltiere spielt Calcium zu dem Entwicklungszeitpunkt, in welchem der linksgerichtete Flüssigkeitsstrom stattfindet. Die Sensorzellen detektieren dabei den Flüssigkeitsstrom entweder mechanooder chemosensorisch und übersetzen ihn in einen linksseitigen intrazellulären Calciumanstieg (McGrath et al., 2003; Sarmah et al., 2005; Francescatto et al., 2010; Takao et al., 2013). Calcium wirkt jedoch schon zu einem früheren Stadium in der Spezifizierung des zukünftigen LR-Organisators. So werden Pkd2 und der Serotoninrezeptor 5HTR3 für die Bildung des superfiziellen Mesoderms benötigt (Vick, 2009; Beyer et al., 2012). In dieser Arbeit konnte gezeigt werden, dass der FGFSignalweg hierbei eine Rolle spielt, jedoch Calcium-unabhängig und vermutlich über eine positive Regulation des kanonischen Wnt-Signalwegs. Zudem konnte eine weitere FGFabhängige Funktion von Calcium in der Spezifizierung der Sensorzellen von Xenopus beschrieben werden. Somit lassen sich bisher drei Calcium-abhängige Entwicklungszeiträume in der frühen Lateralitätsentwicklung erkennen. Inwieweit diese Funktionen innerhalb der Wirbeltiere konserviert sind, bleibt zu klären. 96 Diskussion Die Daten dieser Arbeit zeigen, wie der FGF-Signalweg regulierend auf die Entstehung der Lateralität von Xenopus laevis wirkt. Dabei konnte beschrieben werden, dass der FGFSignalweg auf zwei unterschiedliche Entwicklungsphasen wirkt. Über die Expression von FoxJ1 reguliert er die Ciliogenese des LR-Organisators und somit den Mechanismus des Symmetriebruchs. Über die lateralen GRP-Zellen als Sensorzellen des LR-Organisators reguliert er die Übersetzung des Symmetriebruchs in eine linksspezifische Information. Beide Prozesse sind essentiell für die Etablierung der Lateralität. Die Beschreibung dieser beiden Funktionen kann dabei zum Verständnis beitragen wie auch andere Signalwege mit Bezug zum FGF-Signalweg in die Lateralitätsentwicklung integriert sein können. Weiterhin zeigt die Aufdeckung dieser beiden Funktionen in Xenopus, dass der FGFSignalweg innerhalb der Wirbeltiere eine stärkere Konservierung im Prozess der LRAchsendeterminierung aufweist, als es bislang angenommen wurde. Damit unterstützen die hier gewonnenen Erkenntnisse über den FGF-Signalweg eine Konservierung des symmetriebrechenden Mechanismus der Wirbeltiere. 97 Material und Methoden Material und Methoden Chemikalien, Kits, Hilfswerkzeuge Material Agar Agarose LE Agarose Low Melt Albumin Fraktion V (BSA) Aluminium-Probenteller Ammoniumacetat Ampicillin-Natriumsalz AmplicapTM SP6High Yield Message Make Kit Anti-Digoxigenin-AP Fab Fragments Bakterienschalen 10 cm BM-Purple AP-Substrat Boehringer-Blocking-Reagenz BSA (bovine serum albumin) Calciumchlorid-Dihydrat (CaCl2*2H2O) Calciumnitrat-Tetrahydrat (Ca(NO3)2*4H2O) CAS-BlockTM CHAPS Chloroform Cystein Deckgläschen Desoxynukleosidtriphosphate (dNTPs) Digoxigenin-dNTP-Labeling Mix Digoxigenin-11-dUTP Dimethylsulfoxid (DMSO) Dithioreitol (DTT) DNA-Purification-Kit (Easy-Pure) DNAse I Essigsäure Ethanol Ethidiumbromid Ethylendiamintetraessigsäure EDTA Ethylenguanintetraessigsäure EGTA Ethyl-p-Aminobenzoat (Benzocain) Ficoll Filtereinheiten FluospheresR Carboxylate-modified Microspheres, 0.5µm, yellowgreen Formaldehyd Formamid Gelatine Gentamycin Glaswaren Schott Glucose Glutaraldehyd (25%) Glycerol Glycin HCG (humanes Choriongonadotropin) HCl (37%) Hefeextrakt Hefe-RNA (Torula) Heparin Hepes Hoechst 33342 Injektionsnadeln Sterican (0,4x20 mm, Gr. 20) Injektionsspritzen F1, 1 ml IPTG Bezugsquelle AppliChem Genaxxon Bioscience Roth AppliChem Plano Roth AppliChem Biozym Roche Greiner Roche Roche Promega Roth Roth Invitrogen AppliChem Merck AppliChem Roth Promega Roche und Promega Roche Roth Promega Biozym Thermo Scientific AppliChem Roth Roth Roth Roth Sigma AppliChem Whatman Molecular Probes Roth Roth Merck Biochrome Duran AppliChem Roth Roth Applichem Sigma Merck Roth Sigma AppliChem AppliChem Molecular Probes B.Braun B.Braun Roth 98 Material und Methoden Isopropanol (2-Propanol) Kaliumacetat Kaliumchlorid Kaliumdihydrogenphosphat (KH2PO4) Ladepuffer-DNA IV (10x) Lambda-DNA Leitfähige Haftaufkleber Ligase (T4-Ligase) Magnesiumchlorid (MgCl2) Magnesiumsulfat (MgSO4) Maleinsäure Methanol mMESSAGE mMACHINE SP6 M-MLV Reverse Transkriptase Multiwell Platten (24 Well) Mowiol Natriumacetat Natriumcitrat Natriumchlorid Natriumhydrogencarbonat (NaHCO3) Natriumhydrogenphosphat (Na2HPO4) Natriumdihydrogenphosphat-Monohydrat (NaH2PO4*H2O) Di-Natriumhydrogenphosphat (Na2HPO4) Natriumhydroxid (NaOH) Objektträger, geschnitten Oligonukleotide Paraformaldehyd (PFA) PBS+ (DPBS) Petrischalen (Plastik) Penstrep (Pencillin und Streptomycin) Pfu DNA Polymerase pGEM®-T-Easy-Vektor 488Alexa-konjugiertes Phalloidin Phenol/Chloroform (Rotiphenol) Pipetten (Einweg-Pasteur-Pipetten) Pipettenspitzen PureYield Plasmid Midiprep System Präparationsbesteck Proteinase K Reaktionsgefäße Restriktionsenzyme und Puffer RhodaminB-Dextran RNAse A RNAse-Inhibitor (RNAsin) Saccharose Skalpelle Sp6-RNA-Polymerase Sterilfilter SU5402 T3-RNA-Polymerase T7-RNA-Polymerase Taq-DNA-Polymerase (Go-Taq) Terminal-deoxynucleotidyl-Transferase Thapsigargin Trifast PeqGold Tris Triton X-100 Trypsin Trypton Tween20 Wizard Plus SV Minipreps DNA Purification Kit X-Gal Roth Roth AppliChem AppliChem AppliChem Promega Plano Promega Merck Roth Roth Roth Ambion Promega Greiner Hoechst Roth Roth AppliChem Merck Roth Roth Roth Roth Knittel MWG-Biotech AG AppliChem Gibco Multimed Gibco Promega Promega Molecular Probes/Invitrogen Roth Sarstedt Sarstedt/Eppendorf Promega Fine Science Tools Roth Eppendorf/Sarstedt Promega Molecular Probes Roth Promega AppliChem Bayha Promega Schleicher und Schuell Calbiochem Promega Promega Promega Invitrogen AppliChem PEQLAB Biotech. AppliChem Serva Roth AppliChem Roth Promega Roche 99 Material und Methoden Ziegenserum Sigma Organismen Versuchstiere Afrikanischer Krallenfrosch Xenopus laevis Es wurden Xenopus laevis Frösche verwendet, die von Guy Pluck, Xenopus express, Ancienne Ecole de Vernassal, Le Bourg 43270, Vernassal, Haute-Loire, Frankreich stammten. Die Frösche wurden artgerecht in einem zwölfstündigen Lichtzyklus in den Tierställen des Instituts für Zoologie Hohenheim gehalten. Bakterienstamm E.coli XL1-Blue q r Genotyp: recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F' proAB lacI ZDM15 Tn10 (Tet )] (aus dem Bakterienvorrat des Instituts für Zoologie, Hohenheim) Internet-Datenbanken und Programme Froschdatenbank Xenbase: http://www.xenbase.org/common/; Bowes et al., 2008 Sequenzdatenbank GenBank: http://www.ncbi.nlm.nih.gov/; Benson et al., 2005 Literaturverwaltungsprogramm Mendeley: http://www.mendeley.com/ Programme zur Bildverarbeitung, -bearbeitung: ImageJ: Abràmoff, 2004; Anwendungsbezogene Skripte und Makros für die Analyse wurden von Thomas Thumberger erstellt (Thumberger, 2011). Adobe Suite CS3: Photoshop und Illustrator Geräte Fluoreszenz-Stereomikroskop: Leica MZ FLIII Fluoreszenzmikroskop: Zeiss Axio Imager. M1 Gelkammern: ThermoEC ClassicTM mit Consort Elektrophoresis Power E844 Kritisch-Punkt-Trockner: Leica EM CPD030 Konfokales Laser-Scan-Mikroskop: LSM 700 Micropipette Puller : P-87, Sutter Instrument Mikroskop: Zeiss Axioskop2 mot plus Photometer: Eppendorf Bio Photometer Rasterelektronenmikroskope: LEO DSM 940A, Zeiss NeoScope JCM-5000, Jeol Stereomikroskop: Zeiss Discovery V.12 A SteREO Sputtergerät: Leica EM SCD005 Taumelrollenmischer: TRM-V, IDL Thermocycler : Peltier Thermal Cycler PTC-200; Biozym Vibratom: Leica VT 1000 Kulturmedien, Puffer, Lösungen In-situ-Hybridisierung Alkaline Phosphatase Puffer (AP1-Puffer), pH 9,5 100mM TRIS pH9.5; 100mM NaCl, 50mM MgCl2 100 Material und Methoden Blockierungslösung 10g Boehringer-Blocking-Reagenz in 800ml PBS bei 70°C gelöst; Nach Abkühlen: Zugabe von 100ml Ziegenserum (hitze-inaktiviert), mit PBS auf 1l aufgefüllt; steril filtiert; Zugabe von 1ml Tween20 Hybridisierungslösung 12,5M Formamid; 10g/l Boehringer Blocking-Reagenz; 0,75M NaCl; 75mM Natriumcitrat; 0,5% (v/v) Tween 20; 5mM EDTA; 0,1% CHAPS; 1mg/ml Torula-RNA; 0.1mg/ml Heparin; pH 7,0 MAB (Maleic Acid Buffer) 150mM NaCl; 100mM Maleinsäure; pH 7,5 10xPBS (Phosphate Buffered Saline) 1,37M NaCl; 100mM Na2HPO4; 27mM KCl; 18mM; KH2PO4; pH 7,4 1xPBSw 137mM NaCl; 10mM Na2HPO4; 2,7mM KCl; 1,8mM KH2PO4; 0.1% (v/v) Tween 20; pH 7,4 1xPBST 137mM NaCl; 10mM Na2HPO4; 2,7mM KCl; 1,8mM KH2PO4, 0.1% (v/v) Triton-X-100; pH 7,4 20xSSC (Sodium Citrate Buffer) 3M NaCl; 300mM Natriumcitrat; pH 7,0 Froschexperimente 5xMBSH (Modified Barth`s Saline mit HEPES) 440mM NaCl; 50mM HEPES; 12mM NaHCO3; 5mM KCl; 4mM MgSO4*7H2O; 2mM CaCl2; 1,7mM Ca(NO3)2*4H2O; 0,5mg/ml Streptomycin; 500U/ml Penicillin; pH 7,4 10xMEMFA 1M MOPS; 20mM EGTA; 10mM MgSO4; pH 7,4 1xMEMFA 100mM MOPS; 2mM EGTA; 1mM MgSO4; 3,7% (v/v) Formaldehyd; pH 7,4 Gurdon`s Puffer 88mM NaCl; 15mM HEPES; 15mM Tris-HCl; 1mM KCl; pH 7,6 Ficoll-Lösung 2%Ficoll in 1xMBSH lösen Cystein-Lösung 2% Cystein in H2O lösen, auf pH 8,0 einstellen Bakterienkultur SOC-Medium (Super Optimal Catabolite repression medium) 20g/l Trypton; 10mM MgSO4; 10mM MgCl2; 10mM NaCl; 5g/l Hefeextrakt; 2,5mM KCl; 3,6g/l Glucose LB-Medium (lysogeny broth medium) 10g/l Trypton, 12,2mM NaCl, 5g/l Hefeextrakt; pH 7,0 DNA-Präparation P1 (Resuspensions-Puffer) 50mM Tris-HCl, 10mM EDTA (pH 8,0); 100µg/ml RNAseA P2 (Lysis-Puffer) 0,2M NaOH; 1% (v/v) SDS P3 (Neutralizations-Puffer) 3M Kaliumacetat pH 5,1 101 Material und Methoden Rasterelektronenmikroskopie Sörensen Phophat-Puffer (PB-Puffer) Stammlösung A: 0,2M NaH2PO4*H2O Stammlösung B: 0,2M Na2HPO4 für 0,1M PB-Puffer pH 7,4: 19ml A, 81ml B, 100ml H2O für 0,1M PB-Puffer pH 7,0: 39ml A, 61ml B, 100ml H2O Sonstige Mowiol 96g Mowiol 4-88; 24g Glycerol; 24ml H2Odd; 2 Stunden rühren; Zugabe von 48ml 0,2M TRIS pH8,5; 2 Stunden rühren bei 50°C; 15 Minuten bei 5000rpm zentrifugieren; Überstand bei -20°C lagern 50x TAE-Puffer (Tris Acetate EDTA electrophoresis buffer) 2M Tris pH 8,5, 1M Essigsäure, 50mM EDTA (pH 8,0); pH 8,5 Allgemeine Molekularbiologische Methoden Isolierung der Gesamt-RNA aus embryonalem Gewebe Zur Isolierung der Gesamt-RNA wurden 3-4 Embryonen in 1ml Trifast (PEQGold) mazeriert und bei RT lysiert. Danach wurden 200µl Chloroform hinzugegeben, 15 Sekunden gevortext, weitere 5 Minuten inkubiert und dann 5 Minuten zentrifugiert (RT/14000rpm). Anschließend wurde aus der oberen wässrigen Phase die Gesamt-RNA mit 500µl Isopropanol gefällt. Nach kurzem Vortexten wurde 10 Minuten bei RT inkubiert und dann 15 Minuten bei 4°C/14000rpm zentrifugiert. Der Überstand wurde verworfen und das RNA-Pellet mit 75%Ethanol gewaschen. Nach ausreichendem Trocknen des RNA-Pellets wurde dieses in 30µl sterilen Wasser resuspendiert und der Gehalt mittels photometrischer Bestimmung ermittelt. RNA wurde bis für die weitere Verwendung bei -80°C eingelagert. cDNA-Herstellung durch reverse Transkription 1µg RNA wurde umgeschrieben in cDNA mit 0,5µl einer Bibliothek an zufälligen Primersequenzen (random hexamers, Promega). Dafür wurde das Gemisch an RNA und Primer mit H2Odd auf ein Endvolumen von 14µl gebracht, auf 70°C erhitzt um sekundäre RNA-Strukturen aufzuschmelzen und anschließend auf Eis schnell abgekühlt, um das Anheften der Primer zu ermöglichen. Danach wurden 5µl M-MLV RT Puffer (5x), 1,25µl dNTPs (10mM), 1µl M-MLV Reverse Transkriptase und 3,75µl Wasser hinzu gegeben. Nach 10 Minuten bei RT und 60 Minuten bei 50°C wurde die Reaktion durch die Inkubation bei 70°C für 15 Minuten abgestoppt. Polymerase Kettenreaktion (PCR) Zur Amplifikation von DNA–Sequenzen, die beispielsweise für die Herstellung von Antisense-RNA zur Expressionsanalyse eines Gens mittels in-situ-Hybridisierung dienten, wurde die Taq-Polymerase verwendet. Sollten dagegen codierende DNA-Sequenzen oder andere DNA-Konstrukte amplifiziert werden, die für spätere Mikroinjektionsexperimente verwendet wurden, so wurde die Pfu-Polymerase verwendet, da diese eine geringere Fehlerrate aufweist. Für eine Taq-Polymerase-PCR wurde ein 25µl Ansatz bestehend aus 1µl cDNA, 5µl GoTaq-Puffer (5x), 2,5µl dNTPs, 1µl 10mM spezifischer Primer 1 (forward), 1µl 10mM spezifischer Primer2 (reverse), 0,2µl TaqDNA-Polymerase und 14,3µl Wasser in ein PCR-Gefäß pipettiert. Für die Negativ-Kontrolle wurde die cDNA durch Wasser ersetzt. Für eine Pfu-Polymerase-PCR wurde ein 50µl Ansatz bestehend aus 1µl cDNA oder 1µl Plasmid-DNA (verdünnt auf 10pg/µl), 5µl Pfu-Puffer (10x), 5µl dNTPs, 1µl 10mM spezifischer Primer 1 (forward), 1µl 10mM spezifischer Primer2 (reverse), 1µl Pfu-Polymerase und 28µl Wasser in ein PCR-Gefäß pipettiert. Die Amplifikation im Thermocycler beinhaltete folgende Schritte: (1) 5 Minuten Denaturierung bei 95°C (Auftrennung der Doppelstänge der DNA) (2) 30 Sekunden Denaturierung bei 95°C (3) 30 Sekunden Anlagerung bei 55°C (Anlagerung der Primer je nach Schmelztemperatur) (4) 45 Sekunden Elongation bei 72°C (Zweitstrangsynthese durch DNA-Polymerase, wobei Elongationszeit von der Sequenzlänge des Produktes und von der verwendeten DNAPolymerase abhängt) (5) Zurück zu Schritt (2), 35 Zyklen (Taq-Polymerase), 15 Zyklen (Pfu-Polymerase) (6) Kühlung auf 8°C bis zur Entnahme der Proben aus dem Thermocycler 102 Material und Methoden Im Falle der Pfu-Polymerase-PCR wurde die Amplifikation im Thermocycler nach erneuter Zugabe von PfuPolymerase (0,8µl) mit dem gleichen Programm ein weiteres Mal wiederholt. Sollte das PCR-Produkt anschließend in den pGEM-T Easy Vektor kloniert werden, so wurde mittels Taq-Polymerase die NukleotidBase Adenin an das 3’ des PCR-Produktes angefügt. Hierzu wurden 5µl amplifizierte PCR-DNA, 2µl 5x Colorless GoTaq-Puffer (ohne Farbstoffe, da anschließend keine Gelelektrophorese durchgeführt wurde), 0,4µl 5mM dATPs, 1µl Taq-Polymerase zusammenpipettiert und dieser Ansatz bei 70°C 20 Minuten inkubiert. Eine geringe Menge an unaufgereinigtem PCR Produkt wurde qualitativ durch Gelelektrophores überprüft. Gelelektrophoretische Auftrennung von Nukleinsäuren Die Auftrennung erfolgte mittels eines 1%-igen Agarosegels (1g Agarose auf 100ml 1xTAE-Puffer), welches mit Ethidiumbromid (0,4µg/ml) versetzt wurde, in einer 1x TAE-Puffer gefüllten Gelelektrophoresekammer bei 100-120 Volt. Zur Größenbestimmung der DNA-Fragmente wurde zusätzlich ein geeigneter DNAFragmentlängenstandard (spezifisch restriktionsfragmentierte DNA des Phagen lambda) aufgetragen. Die Nukleinsäurefragmente wurden durch Fluoreszenz unter einem UV-Transilluminator bei 312 nm (TCP 20 M, Vilber Lourmat) sichtbar gemacht und konnten so photographiert werden. Ligation in pGEM-Teasy Das 3‘ adenylierte PCR-Produkt wurde anschließend in den pGEM-T Easy Vektor (Promega) kloniert. Hierzu wurde ein 5µl Ansatz aus 2,5µl Ligationspuffer (2x), 0,5µl pGEM-T Easy, 0,5µl T4 DNA Ligase, 0,5µl Wasser und 1µl des 3‘ adenylierten PCR-Produktes angesetzt, der über Nacht bei 4°C bis zur Transformation in kompetente E.coli-Bakterien inkubiert wurde. Transformation der Bakterien mit Plasmid-DNA Für die Transformation wurde die Plasmid-DNA zu 100µl chemisch kompetenten Bakterien (E.coli XL1-blue) gegeben, die zuvor auf Eis angetaut wurden. Dieser Ansatz wurde für 30 Minuten auf Eis inkubiert, damit sich die DNA gleichmäßig verteilt und an den Zellen anheften konnte. Der danach durchgeführte Hitzeschock für 90 sec bei 42 °C bewirkte, dass die Membran der Bakterien permeabilisiert wurde und die DNA aufgenommen werden konnte. Die Bakterien wurden anschließend 2 Minuten auf Eis inkubiert. Danach wurden 400µl SOC-Medium zugegeben. Die Bakterien wurden für 1 Stunde bei 37°C im Heizblock inkubiert. Währenddessen vermehrten sich die transformierten Zellen und bildeten die bei erfolgreicher Aufnahme des Plasmids gewonnene Antibiotikaresistenz gegen das Selektionsmedium aus. Die erhaltenen 500 µl wurden franktioniert auf Selektions-Agarplatten (100µg/ml Ampicillin, 0,5mM IPTG, 80µg/ml XGal) ausgestrichen und lichtgeschützt über Nacht bei 37°C inkubiert. IPTG (Isopropyl-beta D-thiogalaktopyranosid) diente der Bindung und Inhibierung eines Repressors des ß-Galaktosidase-Gens, während das lichtempfindliche Substrat X-Gal, von dem Enzym ß-Galaktosidase umgesetzt wird. Der pGEM-T Easy Vektor enthält ein ßGalaktosidase-Gen in seiner multiple cloning site (MCS). Wenn das PCR-Produkt korrekt in die MCS ligiert wird, wird das ß-Galaktosidase-Gen dabei zerstört und eine Blaufärbung bleibt aus. Dadurch konnten selektiv die weißen Kolonien von den Agarplatten isoliert werden, die den Plasmid-Vektor mit einem Insert enthielten. Mini-Präparation von Plasmid-DNA Für die Mini-Präparation wurden einzelne, weiß gefärbte Bakterien-Kolonien von den Selektions-Agarplatten mit Hilfe einer Pipettenspitze in ca. 3ml LB-Selektionsmedium (mit 100µg/ml Ampicillin) transferiert und über Nacht bei 37°C unter Schütteln inkubiert. Am nächsten Morgen wurden von dieser Flüssigkeit ca. 1,5ml in Eppendorfröhrchen überführt und für 5 Minuten bei 5000 rpm zentrifugiert. Der Überstand wurde verworfen und das Bakterienpellet in 100µl P1-Lösung mittels Vortexen resuspendiert. Für die Lyse der Zellen wurde 200µl P2-Puffer hinzugegeben und für 5min bei RT inkubiert. Anschließen wurden mit 150µl P3 Puffer neutralisiert und die Suspension für 20min auf Eis inkubiert. Die Ansätze wurden bei 14000 rpm und 4°C für 10 Minuten zentrifugiert und danach der Überstand in ein neues Gefäß überführt. Dann wurde 1ml Ethanol (20°C) zugegeben, gevortext und die DNA für mindestens 30 Minuten bei -20°C gefällt. Die präzipierte DNA wurde nochmals für 10 Minuten bei 14000 rpm abzentrifugiert, das DNA-Pellet mit 500µl 75% Ethanol (-20°C) gewaschen und anschließend bei 14000 rpm für 5 Minuten zentrifugiert. Der Ethanol-Überstand wurde verworfen, das Pellet circa 10 Minuten an der Luft getrocknet und in 50µl H2Odd resuspendiert. Restriktionsverdau von DNA-Fragmenten 1µg DNA oder 5µl der Plasmid-DNA aus dem Mini-Präp, 0,5µl Restriktionsenzym (10U/µl), 2µl 10x Puffer und 0,2µl BSA wurden mit Wasser auf ein Endvolumen von 20µl gebracht. Dieser Reaktionsansatz wurde bei 37°C für mindestens 2 Stunden inkubiert und anschließend mittels Gelektrophorese aufgetrennt. 103 Material und Methoden Midi-Präparation von Plasmid-DNA mit dem PureYield Midiprep Kit 100ml LB-Selektionsmedium (LB-Medium, 100µg/ml Ampicillin) wurden mit 1ml der getesten Bakterienkultur über Nacht bei 37°C inkubiert. Diese Bakterienkultur wurde in einen Zentrifugenbecher überführt, zentrifugiert (10 Minuten/4000 rpm) und die Plasmid-DNA entsprechend des „PureYield Plasmid Midiprep System“ Protokoll von Promega und unter Verwendung der Vakuum-Methode isoliert. Zur Überprüfung der Qualität und Ausbeute der DNA wurde die Konzentration dieser DNA-Lösung photometrisch bestimmt. Mittels Sanger-Sequenzierung (MWG-Biotech AG) wurde die Sequenz überprüft. + Bei einer anschließenden Klonierung des DNA-Inserts in den pCS2 -Vektor wurde das DNA-Insert mittels Restriktionsverdau aus dem pGEM-T Easy Vektor geschnitten (Ansatz 50µl), durch Gelaufreinigung (Easy + Pure, Biozym) isoliert und mit dem ebenfalls geschnittenen pCS2 -Vektor (Rupp et al., 1994) ligiert und die Orientierung durch Sequenzierung kontrolliert. Linearisierung der Plasmid-DNA Für die Linearisierung der Plasmid-DNA wurden 20µg DNA, 5µl Restriktionsenzym, 10µl 10xPuffer, 1µl BSA mit Wasser auf ein Endvolumen von 100µl gebracht. Der Restriktionsverdau erfolgte über Nacht bei 37°C. Für die Aufreinigung der linearisierten DNA wurden am nächsten Morgen 10µl Ammoniumacetat-Lösung (5M Ammoniumacetat, 100mM EDTA) und 220µl Ethanol hinzugegeben, gevortext und für mindestens 15 Minuten bei -20°C inkubiert. Anschließend erfolgte ein Zentrifugationschritt bei 4°C/14000rpm für 20 Minuten. Der Überstand wurde verworfen, das Pellet an der Luft kurz getrocknet und in 20µl Wasser resuspendiert. In-vitro Transkription von mRNA + Als Template für die in-vitro Transkription der mRNA diente das gewünschte DNA-Insert im pCS2 -Vektor. + Dabei gewährleistet der pCS2 -Vektor aufgrund seines SV40 Polyadenylierungssignals, dass die transkribierte mRNA über einen Poly-A-Schwanz am 3’-Ende verfügt. Für die in-vitro Transkription wurden 7 der linearisierte Plasmid-Vektor, SP6 RNA-Polymerase Mix (Promega), NTPs und ein Ribo m GAP-Analog (Promega) eingesetzt um dadurch RNA zu erhalten die wie eukaryotischer mRNA eine 5‘ CAP Struktur besitzt. Da RNA sehr schnell degradiert, erfolgten alle Schritte auf Eis, entsprechend der Angaben der Hersteller (Ambion oder Applicap). Nach zweistündiger Inkubation des Transkriptionsansatzes wurde zum Abbau der Template-DNA 1µl DNase zugesetzt und für 15 Minuten inkubiert. Anschließend wurde eine Phenol-Chloroform-Extraktion mit darauffolgender Isopropanol-Fällung durchgeführt. Die capped-RNA wurde als 1µl Aliquots bei -80°C gelagert. Die Konzentration wurde photometrisch gemessen und auf einem Gel eine mögliche Degeneration der mRNA überprüft. Photometrische Konzentrationsmessung von Nukleinsäuren Zur Konzentrationsbestimmung von Nukleinsäuren wurde die Extinktion von UV-Strahlen der Wellenlänge 260 und 280 nm beim Durchqueren einer Nukleinsäurelösung in einem Biophotometer (Eppendorf) gemessen. Als Leerprobe wurde das entsprechende Lösungsmittel verwendet. Zur Bewertung der Reinheit der Nukleinsäure dient das Extinktionsverhältnis von 260 und 280 nm. Ein optimaler Reinheitswert liegt bei circa 1,8 für DNA und 2,0 für RNA. Arbeiten mit Xenopus laevis Stimulation der Eiablage von Xenopus laevis Weibchen: Die Ovulation wurde durch subkutane Injektion des humanen Hormons Choriongonadotropin in den dorsalen Lymphsack induziert. Dazu wurden Weibchen eine bis zwei Wochen zuvor durch die Injektion einer kleinen Menge Choriongonadotropin (50µl) auf die gewünschte Ovulation vorbereitet. Nach Induktion der Ovulation mittels einer größeren Menge an Choriongonadotropin, die je nach Größe der Weibchen zwischen 400-600µl variierte, kam es circa 10-12 Stunden später zur gewünschten Eiablage. Für die Experimente wurden ausschließlich Eier verwendet die direkt vom Weibchen abgelegt wurden. Das direkte Ablaichen wurde hierfür durch behutsames Massieren des Bauches angeregt, um dann die Eier in einer Petrischale aufzusammeln. In-vitro Befruchtung der Eier Für die in-vitro Befruchtung wurden die Hoden aus einem zuvor getöteten Männchen isoliert. Dabei reichte ein kleines Stück von circa 2 mm² für die Befruchtung eines Geleges aus. Der restliche Hoden wurde in 1xMBSH bei 4°C aufbewahrt und für max. 2 Wochen für weitere Befruchtungen verwendet. Für die 104 Material und Methoden anschließende Verwendung wurde das Hodenstück in 1ml 1xMBSH mazeriert und auf die Eier verteilt. Die Salzkonzentration des 1xMBSH wurde durch Zugabe von Wasser gesenkt, so dass sich die Spermien bewegen konnten. 40 Minuten nach der Befruchtung wurden die Eier für max. 7 Minuten in einer 2%-igen Cysteinlösung (pH 8,0) inkubiert und leicht geschwenkt um die Gallerthülle der Eier zu entfernen. Die Cysteinlösung wurde anschließend durch mehrmaliges Waschen in 0,1xMBSH entfernt. Für die weitere Kultivierung wurden die Embryonen in 0,1xMBSH/1%Agrar-Schälchen oder für die Mikroinjektion in 1xMBSH überführt. Mikroinjektion + Für die Mikroinjektion von mRNA, kodierender DNA (im pCS2 -Vektor, Rupp et al., 1994), oder MorpholinoOligonukleotiden wurden die Embryonen in 1xMBSH/1%Agar-Schälchen mit 2%Ficoll-Lösung umgesetzt. Dabei wirkt die hohe Viskosität des Ficolls einem Austreten der injizierten Flüssigkeit und des Zellcytosplasmas entgegen. Die Injektionsnadeln wurden mit Hilfe eines Micropipette Pullers hergestellt. Dazu wurde eine Glaskapillare (1mm Durchmesser, Glass thinW, World Precision Instruments) eine Vorrichtung eingespannt, in der Mitte erhitzt und parallel dazu auseinander gezogen, so dass zwei Injektionsnadeln entstanden. Für die Injektion musste die feine Spitze unter dem Stereomikroskop mit einer Uhrmacherpinzette abgebrochen werden. Die mRNA, DNA oder der Morpholino-Oligonukleotid wurde mit isotonischem Gurdon’s-Puffer verdünnt, in die Injektionsnadeln aufgezogen und in Embryonen im 4-Zellstadium mittels eines Injektionsapparat der Firma Havard Apparatus, der über einen Druckluftanschluss den nötigen Druckaufbau generierte, injiziert. Das Volumen des Injektionstropfens wurde mittels des Injektionsdruckes und der Messung des Tröpfchendurchmesser anhand von Millimeterpapier auf 8nl eingestellt. Die im Text angegebene injizierte Menge in pg (bei mRNA und DNA) oder in pmol (bei Morpholino-Oligonukleotiden) entspricht also der Menge in einem Injektionsvolumen von 8nl (bei beidseitiger Injektion zweimal 8nl). Beispielsweise wurde für eine Injektion von 8pg eine Injektionslösung mit der Konzentration von 1ng/µl injiziert. Die Injektionen wurden unter Verwendung eines Stereomikroskops und eines Mikromanipulators zur Ermöglichung von präzisen Bewegungen durchgeführt. Anhand der Pigmentierung lässt sich das spätere Zellschicksal der Blastomeren erkennen. So sind die beiden ventralen Blastomeren eines Embryos im 4-Zellstadium in Folge der kortikalen Rotation nach der Befruchtung im idealen Fall dunkel pigmentiert (Klein, 1987). Die Eier richten sich nach Entfernen der Gallerthülle aufgrund der schweren dotterreichen vegetalen Hemisphäre mit dem animalen Pol nach oben an. Aus den beiden Informationen (ventral/dorsal versus animal/vegetal) lassen sich automatisch die linke und rechte Seite identifizieren. Dies ermöglicht eine gerichtete Injektion, wodurch beispielsweise spezifisch auf der linken oder rechten Seite Genfunktionen manipuliert werden können (siehe Vick et al., 2009). Alle Injektionen wurden durch Koinjektion eines „lineage tracers“ (RhodamineB-Dextran) unter einem Stereomikroskop mit UV-Quelle (LEJ ebq100 isolated) kontrolliert. Injizierte mRNA, DNA: Bcl-XL: Fusionskonstrukt von Myc und der kodierenden Sequenz von Bcl-XL (X.laevis R11). Zur Verfügung gestellt von Ralph Rupp, München. (Hensey and Gautier, 1997) dnFgfr1: dominant-negatives Deletionskonstrukt des FGF-Rezeptor 1 (Xenopus). Deletionssequenz im modifizierten pSP64T Vektor (pXFD/Xss) zur Verfügung gestellt von Edgar Pera, Lund (Schweden), erstmals publiziert in (Amaya et al., 1991). + Für DNA-Injektionen in den pCS2 -Vektor kloniert, dabei wurden folgende Primer verwendet: XFD-EcoRI-forward: 5’ GAATTCATGGTCTCCGGAATGTCCCTC 3’ XFD-XhoI-revers: 5’CTCGAGTCACGGGTGCTTCATTTTAAAGATAA 3’ + Linearisierung des pCS2 -Vektors erfolgte mit SacII und in-vitro Transkription der mRNA mit Sp6 RNAPolymerase. + Fgf8b: kodierende Sequenz (Xenopus) im pCS2 -Vektor. Für die Klonierung wurden folgende Primer verwendet: Primer 1 (forward): 5` ATGAACTACATCACCTCCATCCTG 3` Primer 2 (reverse): 5` CTCGATATTCAAGTTCTCGGTAG 3` Die Sequenz wurde nach Amplifikation (Pfu-Polymerase und anschließendes Anfügen eines 3’A-Überhangs mittels der Taq-Polymerase) in den pGEM-Teasy Vektor kloniert und nach Restriktionsverdau (EcoRI) und + Gelaufreinigung in den pCS2 -Vektor (ebenfalls EcoRI) kloniert. Orientierung wurde mittels Sequenzierung überprüft. Linearisierung erfolgte mit SacII und in-vitro Transkription der mRNA mit Sp6 RNA-Polymerase. 105 Material und Methoden Spry1: Fusionskonstrukt von Myc und der kodierenden Sequenz von Sprouty1 (Xenopus) im modifizierten + pCS2 -Vektor (CS4 BamH1 Schnittstelle durch Bgl2 Schnittstelle ersetzt). Zur Verfügung gestellt von Herbert Steinbeisser, Heidelberg; erstmals publiziert siehe Hanafusa et al. 2002. Linearisierung erfolgte mit NotI und in-vitro Transkription der mRNA mit Sp6 RNA-Polymerase. + Pkd2: kodierende Sequenz (Xenopus) im pCS2 -Vektor (Tran et al., 2010). Linearisierung erfolgte mit NotI und in-vitro Transkription der mRNA mit Sp6 RNA-Polymerase. + Wnt11b: kodierende Sequenz (Xenopus) im pCS2 -Vektor (Tada and Smith, 2000). + Xnr1: kodierende Sequenz von Xnr1 (Xenopus) im pCS2 -Vektor (Campione et al., 1999). Injizierte Morpholino-Oligonukleotide (Gene Tools, LLC, Philomath, USA): Pkd2-MO: 5’ GGTTTGATTCTGCTGGGATTCATCG 3’ (Tran et al., 2010) Wnt11b-MO: 5’ TAACCCAGTGACGGGTCGGAGCCAT 3’ (Walentek et al., 2013) Inkubationexperimente SU5402 wurde lichtgeschützt in DMSO auf eine Stammlösung von 20mM gelöst, aliquotiert und für bis zu 6 Monate bei -20°C aufbewahrt. Thapsigargin lag in einer Stammlösung von 2mM in DMSO gelöst vor, die aliquotiert und lichtgeschützt bei 20°C aufbewahrt wurde. Inkubationen wurden in 24-Multiwell Platten lichtgeschützt bei RT durchgeführt. Die jeweiligen Aliquots wurden aufgetaut, gevortext und die entsprechende Menge je nach verwendeter Konzentration zum vorgelegten Kulturmedium (0,1xMBSH) pipettiert. Durch mehrmaliges Auf- und Abziehen wurde die Pipettenspitze ausgewaschen und durch anschließendes Rühren der Pipettenspitze die Vermischung von SU5402/Thapsigargin und MBSH beschleunigt. Embryonen wurden mit einer 5ml Einwegpipette in das vorbereitete Kulturmedium transferiert. Durch mehrmaliges Waschen in 0,1xMBSH wurde die Inkubation zum gewünschten Zeitpunkt beendet. Fixierung von Embryonen Embryonen wurden bis zum gewünschten Stadium kultiviert, in 5ml Glasfläschen transferiert und in frisch hergestelltem 1xMEMFA für 1,5-2 Stunden bei RT auf dem Taumelrollenmischer oder über Nacht bei 4°C fixiert. Für die in-situ-Hybridisierung wurden die Embryonen anschließend in Ethanol gewaschen, danach etwa 20min bei RT auf dem Taumelrollenmischer inkubiert und nach einem weiteren Ethanolwechsel bei 20°C aufbewahrt. Expressionsanalyse mittels in-situ-Hybridisierung (ISH) In-vitro Transkription der Digoxygenin-markierten RNA-Sonde 1µg der jeweiligen linearisierten Plasmid-DNA (pGEM-Teasy Vektor oder pBluescript Vektor) wurden für die Transkription der Antisense-Sonde verwendet. Je nach Orientierung der Template-DNA wurden 2µl von Sp6-, T7- oder T3-RNA-Polymerase (10U/µl) in einen Reaktionsansatz mit 4µl Transkriptionspuffer, 0,5µl RNasin (40 Units/µl), 2µl DTT, 2µl Digoxigenin-dNTP-Labeling-Mix und der Template-DNA pipettiert und mit sterilem Wasser auf 20µl aufgefüllt. Dieser Ansatz wurde anschließend für 2 Stunden bei 37°C inkubiert. Anschließend wurden zum Abbau der DNA 2µl DNAse (1Unit/µl) hinzupipettiert und für 15 Minuten bei 37°C inkubiert. Zur Aufreinigung der RNA-Sonde wurden 30µl Wasser, 5µl Ammoniumacetat und 165µl Ethanol in den Reaktionsansatz pipettiert, gevortext und die RNA für mindestens 30 Minuten bei -20°C gefällt. Anschließend wurde bei 4°C/14000rpm für 25 Minuten zentrifugiert, der Überstand verworfen und das RNAPellet in 40µl Formamid/ Wasser (1:1) aufgenommen und bei -80°C gelagert. In-situ-Hybridisierung Mittels ISH wurden spezifische Genexpression im Granzpräparat oder auf dorsalen Explantaten analysiert. Dieses Protokoll wurde ursprünglich im De Robertis Labor entwickelt (Belo et al., 1997). Es dauert 3 Tage bis die Embryonen in die Färbelösung überführt werden können. An Tag1 wird das Gewebe für die Antisense-RNA mittels Proteinase K Verdau und dem Einsatz des nicht-ionischen Detergent Tween 20 permeabilisiert, die dann über Nacht mit der endogenen mRNA hybridisiert. Am zweiten Tag wird die Antisense-Sonde ausgewaschen und die Embryonen werden auf die Inkubation im Antikörper, der spezifisch gegen Digoxigenin gerichtet ist, vorbereitet. Über Nacht inkubieren die Embryonen dann im Digoxigenin- 106 Material und Methoden Antikörper. Unspezifische Bindungen sollen am dritten Tag durch extensive Waschschritte entfernt werden. Am Ende von Tag 3 werden die Embryonen in die Färbelösung umgesetzt. Der Digoxigenin-Antikörper ist an Alkalische Phosphatase, einem Enzym das die Farbreaktion katalysiert, gekoppelt (Anti-Digoxigenin-AP Fab Fragments). Durch Umsetzung der Embryonen in die Färbelösung (BM Purple) ermöglicht die Farbreaktion die räumliche Expression eines Gens zum gewählten Entwicklungszeitpunkt zu visualisieren. Tag1: Bis auf den Proteinase K-Schritt wurden alle Schritte auf Eis durchgeführt. Die in Ethanol gelagerten Embryonen wurden durch eine absteigende Alkoholreihe: 75%, 50%, 25% Ethanol in PBS rehydriert. Anschließend wurden die Embryonen dreimal für mindestens 5 Minuten in PBSw gewaschen. Die Neurulastadien wurden auf Agarschälchen in PBS geschnitten (ventrales Gewebe wurde entfernt). Die Embryonen wurden erneut in PBSw gewaschen. Dann Inkubation in 10µg/µl Proteinase K in PBSw bei RT für 15 Minuten um das Gewebe durchlässig zu machen. Anschließend wurde der Proteinase-K Verdau mit 2mg/ml Glycin in PBS- gestoppt. Embryonen wurden dreimal für mindestens 5 Minuten in PBSw gewaschen, in 4%PFA/0,2%Glutaraldehyd in PBS für 15 Minuten nachfixiert und dreimal für mindestens 5 Minuten in PBSw gewaschen. Anschließend wurde das Gewebe mit Hybridisierungsblockinglösung geblockt, um somit unspezifische Hindergrundhybridisierungen zu vermeiden. Dafür wurde zunächst PBSw durch eine 1:2 Verdünnung der Hybridisierungslösung in PBSw ersetzt und anschließend wurde die jeweilige Lösung durch unverdünnte Hybridisierungslösung ersetzt. Die Embryonen wurden dann im Wasserbad bei 65°C für 3 Stunden vorhybridisiert. Kurz vor Ablaufen der drei Stunden wurde die Antisense-RNA vorbereitet. Dazu wurde 1µl der Sonde in 100µl Hybridisierungslösung pipettiert, dies wurde für 5 Minuten bei 95°C aufgekocht, anschließend direkt auf Eis gesetzt, dann zu den Embryonen in 900µl Hybridisierunglösung dazugegeben und über Nacht bei 70°C im Wasserbad inkubiert. Tag2: Embryonen wurden 2x 30 Minuten bei 70°C in 100% Hybridisierungslösung gewaschen. Die Lösung wurde ein weiteres Mal durch 800µl Hybridisierungslösung ersetzt. Nach 5 Minuten bei 70°C wurden in drei Schritten (je 5 Minuten, 70°C) jeweils 400µl 2xSCC (pH 4,5) hinzugefügt ohne die Lösung zu ersetzen. Anschließend wurde 2x 30Minuten bei 70°C in 2xSCC (pH 7,0) gewaschen. Es folgten vier Waschritte in MABw, wobei 2x 10 Minuten bei RT, gefolgt von 2x 30 Minuten bei 70°C. Dann wurden die Embryonen 3x 10 Minuten bei RT in PBSw gewaschen und für 2 Stunden im Antikörper-Blockingpuffer bei 4°C inkubiert um unspezifische Antikörperbindungen später zu vermeiden. Der Antidigoxygenin Antikörper gekoppelt mit Alkalischer Phosphatase wurde 1:10000 im Blockingpuffer verdünnt und zeitgleich in den 2 Stunden bei 4°C vorgeblockt. Nach den 2 Stunden, wurde der Blockingpuffer in den Embryonengläschen durch das Antikörper-Blockingpuffer-Gemisch ersetzt und bei 4°C über Nacht inkubiert. Tag3: Die Inkubation der einzelnen Waschschritte fand bei RT auf dem Taumelrollenmischer statt. Zuerst wurden die Embryonen 6x 0,1%BSA in PBSw gewaschen, 1x 5 Minuten und 5x 45 Minuten. Es folgten 2x 30 Minuten in PBS und 2x 30 Minuten in AP1-Puffer. Dann wurden die Embryonen in die Färbelösung (Gemisch aus 1:1 AP1-Puffer und BM Purple), das sich vorgelegt in 12-Wellplatten befand, gebracht. Diese Wellplatten wurden über Nacht bei RT lichtgeschützt inkubiert. In der Regel hatte die enzymatische Farbreaktion bis zum nächsten Morgen ausreichend stark stattgefunden und konnte gestoppt werden. Hierfür wurden die Embryonen mehrere Male in PBS gewaschen. Anschließend wurden die Embryonen schrittweise in Methanol überführt und bei 100%Methanol/-20°C aufbewahrt. Zur Auswertung der Embryonen wurden diese Schrittweise in PBS rehydriert. Anfertigung von histologischen Schnitten mit einem Vibratom-Mikrotom Der zu schneidende Embryo wurde in 1ml einer Gelatine-Albumin-Mischung (2,2g Gelatine, 135g Rinderalbumin, 90g Saccharose in 450ml PBS äquibriliert). In eine Einbettkasette wurde 1ml GelatineAlbumin-Mischung gegossen, der kurz zuvor 70µl Glutaraldehyd (25%) zugegeben wurde. Nach dem Aushärten der Mischung wurde der Embryo mit einer 5ml Einwegpipette in die Einbettkasette überführt und nach Ausrichten des Embryos mit derselben Mischung übergossen. Nach Aushärten des Blockes wurde dieser aus der Einbettkasette gelöst und mit einer Rasierklinge unter dem Binokular getrimmt und auf eine Metallplatte geklebt. Diese wurde in die Halterung des Vibratoms eingespannt und mit PBS übergossen. Schnitte mit einer Dicke von 30µm wurden angefertigt und auf einen Objektträger überführt. Anschließend wurden die Schnitte mit Mowiol eingedeckelt. Analyse proliferierender Zellen mittels phosphoHiston3(pH3)-Immunhistochemie (IHC) Die Embryonen wurden im gewünschten Stadium 1 Stunde bei RT in 4%PFA fixiert. Danach wurden sie 3x 10 Minuten in PBS gewaschen. Da mittels pH3-Färbung detektiert werden sollte, ob spezifisch im Bereich der zukünftigen GRP ein Unterschied in der Zellproliferation zwischen SU5402- und DMSO-inkubierten Embryonen bestand, war der ventrale Bereich für die Auswertung nicht relevant. Dieser Bereich wurde weggeschnitten, so dass der Hohlraum des Archenterons zerstört wurde und die Lösungen leicht das schon im Zuge der Gastrulation eingewanderte Gewebe erreichen konnten. Die Embryonen wurden dazu auf 107 Material und Methoden Agarschälchen geschnitten, 3x 10 Minuten in PBST gewaschen und in einer mit PBST 1:10 verdünnten CAS-Block-Lösung für 2 Stunden bei RT geblockt. Anschließend wurde die verdünnter CAS Lösung abgenommen und die Embryonen in primärer Antikörperlösung (Anti-phospho-Histone H3 (Ser10), Kaninchen, Millipore), 1:140 in CAS-Lösung verdünnt, bei 4°C über Nacht inkubiert. Durch drei Waschschritte je 30 Minuten in PBS wurden ungebundener Antikörper und unspezifische AntikörperBindungen entfernt. Da der sekundär Antikörper (Anti-Rabbit IgG, F(ab‘)2Fragment Cy3) konjugiert mit dem lichtempfindlichen Fluorophor Cy3 vorlag, erfolgte der Inkubationsschritt mit ihm 1:150 verdünnt in CAS unter Lichtausschluss über Nacht bei 4°C. Am nächsten Morgen wurde 3x 15 Minuten in PBS gewaschen. Anschließend folgten die Phalloidin- und Hoechst-Färbung. Phalloidinfärbung Zu Anfärbung des F-Aktinzytoskelettes und Markierung der Zellgrenzen wurde eine Färbung mit Phalloidin, einem hochtoxischem Alkaloid des weißen Knollenblätterpilzes (Amanita phalloides) durchgeführt. Phallodin wurde als Lithiumsalz und als Konjugat mit dem grünen Fluorophor Alexa 488 bezogen, 1:40 in PBS verdünnt und für 30 min bei RT auf der Rüttelplatte mit den Embryoschnitten inkubiert. Anschließend wurde mit PBS mehrmals gewaschen. Hoechst-Färbung der DNA Der blau fluoreszierender Farbstoff Hoechst 33342 wurde zum Anfärben der Zellkerne verwendet und hierfür 1:10000 in PBST verdünnt und 1 Stunde bei RT inkubiert. Anschließend erfolgten einige Waschschitte in PBS . Die Proliferation wurde mit einem konfokalen Laser-Scan-Mikroskop (LSM 700, Objektiv A-Plan 10x/0,25 Ph1) dokumentiert. Die Auszählung proliferierender versus nicht-proliferierender Zellen erfolgte mittels des „CellCounter“ Plugins von ImageJ anhand von Aufnahmen, die den Bereich der GRP abdeckten. TUNEL-Markierung apoptotischer Zellen (nach Hensey and Gautier, 1998) Diese Methode beruht darauf, dass die durch die Apoptose entstehenden DNA-Fragmente an ihren 3’-OHEnden durch das Enzym TdT (Terminal-deoxynucleotidyl-Transferase) markiert werden und dadurch die betroffenen Zellkerne visualisiert werden können. Die Embryonen wurden im gewünschten Stadium 1 Stunde bei RT in MEMFA fixiert und anschließend 2x 30 Minuten in Methanol gewaschen. Durch eine absteigende Alkoholreihe: 75%, 50%, 25% Methanol in PBSw wurden die Embryonen schrittweise rehydriert. Wie bei der pH3-Färbung angegeben wurden die Embryonen geschnitten und anschließend 2x 15 Minuten in PBSw und 2x 15 Minuten in PBS gewaschen. Dann wurden sie 1 Stunde bei RT in TdT-Puffer gewaschen und nach Zugabe von neuem TdT-Puffer, Digoxygenin-dUTP (1µM) und TdT (150U/ml) konnte bei Inkubation über Nacht bei RT die Enzymreaktion stattfinden. Am nächsten Tag wurden die Embryonen 2x 30 Minuten bei 65°C in 1mM EDTA/PBS , 4x 1 Stunde in PBS bei RT und 2x 10 Minuten PBSw bei RT gewaschen. Anschließend wurden die Embryonen 1 Stunde bei RT in Blockinglösung vorblockiert. Der Digoxygenin-Antiköper gekoppelt mit Alkalischer Phosphatase wurde parallel dazu in Blockinglösung inkubiert (1:5000). Die Blockinglösung ohne Antiköper wurde ersetzt und die Inkubation des Antikörpers fand über Nacht bei 4°C statt. Die Waschritte am dritten Tag zur Entfernung des nicht-gebundenen Antikörpers und unspezifische Antikörperbingen erfolgten alle bei RT. Es wurde 6x 1 Stunde in PBSw und 2x30 Minuten in PBS gewaschen. Über Nacht wurden die Embryonen in PBS bei 4°C gelagert. Zur Vorbereitung auf die Färbelösung wurden die Embryonen am nächten Tag 2x 30 Minuten bei RT in AP1-Puffer gewaschen und dann in die Färbelösung (Gemisch aus 1:1 AP1-Puffer und BM Purple) überführt. Die enzymatische Farbreaktion trat nach wenigen Stunden Inkubation bei RT statt. Die Embryonen wurden eine Stunde in MEMFA nachfixiert. Bei der Auswertung wurden Embryonen mit mehr als fünf gefärbten Zellen als TUNEL-positiv gewertet. Analyse des linksgerichteten Flüssigkeitsstroms Die Analyse des linksgerichteten Flüssigkeitsstroms erfolgte nach Schweickert et al., 2007 und Thumberger, 2011. Embryonen wurden bis zum Neurulastadium 17 kultiviert. Für die Freilegung der GRP wurde die Vitellinmembran entfernt und dorsale Explantate angefertigt. Die Präparation wurde in 1%Agaroseschächen (1xMBSH) mit 1xMBSH als Präparationsmedium durchgeführt. Die dorsalen Explantate wurden in einer 1/2500 Verdünnung von fluoreszierenden Latexpartikeln (FluoSpheres) in 1xMBSH in eine Vaselinkammer auf einem Objekträger überführt, mit der GRP nach oben ausgerichtet und eingedeckelt. Die Bewegung der fluoreszierenden Latexpartikel wurde dann unter dem Mikroskop (Axioskop2, Zeiss) mittels einer CCD Kamera (AxioCam HSm, Zeiss) und Zeitrafferaufnahmen (AxioVision 4.6, Zeiss) verfolgt. Mittels des ImageJ plugin „ParticleTracker“ wurden die Partikelbewegungen analysiert (Sbalzarini and Koumoutsakos, 2005). Durch Erstellen einer Maske wurden nur Partikelbewegungen im Bereich der GRP ausgewertet. Die qualitative und quantitative Auswertung erfolgte mit einem von Thomas Thumberger 108 Material und Methoden geschriebenen Skript im statistischen Programm R (R Development Core Team: http://www.r-project.org/) zur Erstellung der Windrosendiagramme. Um die Brownsche Molekularbewegung auszugrenzen wurden nur Partikelspuren verwendet, die mindestens einen Rho-Wert von 0.6, also Direktionalität, vorwiesen und auf mindestens 10 aufeinanderfolgenden Bildern detektiert werden konnten. Rasterelektronenmikroskopie Embryonen wurden bis zum gewünschten Stadium (Neurulastadium 17/18) kultiviert und in 4%PFA und 2,5% Glutaraldehyd 1 Stunde bei RT oder über Nacht bei 4°C fixiert. Anschließend wurden die Embryonen 3x 10Minuten in 0.1M Phosphate Puffer (PB, pH 7,4) gewaschen. Zur Freilegung der GRP wurden dorsale Explantate angefertigt. Die Präparation wurde in 1%Agaroseschächen (PBS ) und 0.1M PB-Puffer als Präparationsmedium durchgeführt. Die Embryonen wurden wiederum 3x 10 Minuten in 0,1M PB-Puffer gewaschen und in 1% OsO4/0,1M PB-Puffer für 1 Stunde bei 4°C nachfixiert. OsO4 besitzt eine hohe Elektronendichte und lagert sich an biologischen Makromolekülen an, sodass der Kontrast später bei den rasterelektronenmikroskopischen Aufnahmen erhöht wird. Durch ausgiebiges Waschen in 0,1M PB-Puffer (mindestens 5x 10 Minuten) wurde freies OsO4 entfernt. Die Embryonen wurden durch eine aufsteigende Alkoholreihe: 25%, 50%, 75%, 2x 100% entwässert und bis zum Trocknungsprozess bei -20°C gelagert. Mittels eines Kritisch-Punkt-Trockners wurde der Alkohol bei 10°C und einem hohen Druck gegen flüssiges Kohlendioxid ausgetauscht. Durch Erhöhung der Temperatur (40°C) wurde das Kohlendioxid in die Gasphase überführt und langsam über ein Ventil aus der Trocknungskammer abgeleitet. Die getrockneten Embryonen wurden vorsichtig mit einer Uhrmacherpinzette auf einen, mit einem leitfähigen Haftaufkleber überzogenen, Aluminium-Probenteller überführt und in einem Sputtergerät mit einer dünnen Goldschicht überzogen (100sec bei 40mA, Arbeitsabstand 55mm). Gold als Edelmetall und dadurch als guter elektrischer Leiter besitzt die Eigenschaft, einstrahlende Elektronen wieder zurück zu streuen. Mit dieser Eigenschaft ist es überhaupt erst möglich Oberflächenstrukturen abzurastern. Embryonen wurden mit einem Rasterelektronenmikroskop (Zeiss oder Jeol) untersucht und die Bilder digital abgespeichert. Die Auswertung der GRP-Zellen bezüglich Zellgröße und Cilierungseigenschaften erfolgte, indem ein größendefinierter Ausschnitt der zentralen GRP (1000x1000Pixel; 1000Pixel entsprachen einer Länge von circa 86µm) einer Aufnahme (500-fache Vergrößerung) mittels ImageJ analysiert wurde. Hierfür wurde ein von Thomas Thumberger erstelltes Makro verwendet (Thumberger, 2011). Die Zellgröße, Cilienlänge und statistische Signifikanzen wurden weiterführend im statistischen Programm R berechnet und dargestellt (R Development Core Team: http://www.r-project.org/). Photodokumentation und Bildbearbeitung Die dorsalen Explantate oder Embryonen im Ganzpräparat wurden nach der ISH mittels eines Zeiss Stereomikroskops (Discovery.V12) und einer digitalen Farbkamera (AxioCam HRc, Zeiss) aufgenommen. Die Aufnahme der Vibratom-Schnitte erfolgte mit einem Zeiss Axioskop 2 Mikroskop und derselben Farbkamera. Die so erhaltenen Bilder wurden im TIF-Format in Adobe Photoshop Version CS3 importiert und weiterverarbeitet. Dabei wurden die Embryonen freigestellt und ein gleichmäßiger Hintergrund verwendet, um den Vergleich der Embryonen zu erleichtern. Helligkeit, Kontrast sowie Gradiationskurven wurden teilweise nachbearbeitet, ohne jedoch dabei das Ergebnis der ISH zu verfälschen. Die Einteilung der Embryonen in Kategorien erfolgte blind, ohne das Wissen über die jeweilige Behandlung der Embryonen. Zur Anfertigung einer Abbildung wurden die einzelnen Bilder mittels Adobe Illustrator Version CS3 arrangiert und beschriftet. Statistische Analyse Die statistische Analyse erfolgte mittels des 2x2-Felder Chi-Quadrat-Test (http://www.datenconsult.de/index.html; letzter Zugriff November 2013) oder wurde mittels des Mann-Whitney-U Test durch ein statitisches Programm in R berechnet (R Development Core Team: http://www.r-project.org/). Die Signifikanzlevels wurden angegeben mit: signifikant*: p<0.05; hoch signifikant**:p<0.01; Sehr hoch signifikant***:p<0.001. 109 Literaturverzeichnis Literaturverzeichnis Aamar, E., Dawid, I.B., 2008. Isolation and expression analysis of foxj1 and foxj1.2 in zebrafish embryos. The International journal of developmental biology 52, 985–91. Abe, M., Naski, M.C., 2004. Regulation of sprouty expression by PLCgamma and calciumdependent signals. Biochemical and biophysical research communications 323, 1040–7. Abràmoff, M., Magalhães, P.J., Ram, S.J., 2004. Image processing with ImageJ. Biophotonics International, 11(7), pp.36–42. Adachi, H., Saijoh, Y., Mochida, K., Ohishi, S., Hashiguchi, H., Hirao, a, Hamada, H., 1999. Determination of left/right asymmetric expression of nodal by a left side-specific enhancer with sequence similarity to a lefty-2 enhancer. Genes & development 13, 1589–600. Afzelius, B. a, 1976. A human syndrome caused by immotile cilia. Science (New York, N.Y.) 193, 317–9. Agius, E., Oelgeschläger, M., Wessely, O., Kemp, C., De Robertis, E.M., 2000. Endodermal Nodalrelated signals and mesoderm induction in Xenopus. Development (Cambridge, England) 127, 1173–83. Akbulut, S., Reddi, A.L., Aggarwal, P., Ambardekar, C., Canciani, B., Kim, M.K.H., Hix, L., Vilimas, T., Mason, J., Basson, M.A., Lovatt, M., Powell, J., Collins, S., Quatela, S., Phillips, M., Licht, J.D., 2010. Sprouty Proteins Inhibit Receptor-mediated Activation of Phosphatidylinositolspecific Phospholipase C 21, 3487–3496. Albertson, R.C., Yelick, P.C., 2005. Roles for fgf8 signaling in left-right patterning of the visceral organs and craniofacial skeleton. Developmental biology 283, 310–21. Alten, L., Schuster-Gossler, K., Beckers, A., Groos, S., Ulmer, B., Hegermann, J., Ochs, M., Gossler, A., 2012. Differential regulation of node formation, nodal ciliogenesis and cilia positioning by Noto and Foxj1. Development (Cambridge, England) 139, 1276–84. Amack, J.D., Wang, X., Yost, H.J., 2007. Two T-box genes play independent and cooperative roles to regulate morphogenesis of ciliated Kupffer’s vesicle in zebrafish. Developmental biology 310, 196–210. Amaya, E., Musci, T.J., Kirschner, M.W., 1991. Expression of a dominant negative mutant of the FGF receptor disrupts mesoderm formation in Xenopus embryos. Cell 66, 257–70. Amaya, E., Stein, P. a, Musci, T.J., Kirschner, M.W., 1993. FGF signalling in the early specification of mesoderm in Xenopus. Development (Cambridge, England) 118, 477–87. Andre, P., 2009. Delimitation of the organizer from the posterior notochord: descriptive and functional studies in mouse and African clawed frog. Dissertation, Fakultät Naturwissenschaften, Universität Hohenheim Antic, D., Stubbs, J.L., Suyama, K., Kintner, C., Scott, M.P., Axelrod, J.D., 2010. Planar cell polarity enables posterior localization of nodal cilia and left-right axis determination during mouse and Xenopus embryogenesis. PloS one 5, e8999. 110 Literaturverzeichnis Belo, J.A., Bouwmeester, T., Leyns, L., Kertesz, N., Gallo, M., Follettie, M., De Robertis, E.M., 1997. Cerberus-like is a secreted factor with neutralizing activity expressed in the anterior primitive endoderm of the mouse gastrula. Mechanisms of development 68, 45–57. Benson, D.A., Karsch-Mizrachi, I., Lipman, D.J., Ostell, J., Wheeler, D.L., 2005. GenBank. Nucleic acids research 33, D34–8. Berbari, N.F., O’Connor, A.K., Haycraft, C.J., Yoder, B.K., 2009. The primary cilium as a complex signaling center. Current biology: CB 19, R526–35. Beyer, T., 2011. The role of serotonin and gap junctions in left-right development of Xenopus laevis. Dissertation, Fakultät Naturwissenschaften, Universität Hohenheim Beyer, T., Danilchik, M., Thumberger, T., Vick, P., Tisler, M., Schneider, I., Bogusch, S., Andre, P., Ulmer, B., Walentek, P., Niesler, B., Blum, M., Schweickert, A., 2012. Serotonin signaling is required for Wnt-dependent GRP specification and leftward flow in Xenopus. Current biology: CB 22, 33–9. Beyer, T., Thumberger, T., Schweickert, A., Blum, M., 2012. Connexin26-mediated transfer of laterality cues in Xenopus. Biology open 1, 473–81. Bitzer, E., 2008. Establishment of a new in vitroCulture System and functional Analysis of Sonic Hedgehog and FGF8 in the Determination of Laterality in the Rabbit Embryo. Dissertation, Fakultät Naturwissenschaften, Universität Hohenheim Blum, M., Andre, P., Muders, K., Schweickert, A., Fischer, A., Bitzer, E., Bogusch, S., Beyer, T., van Straaten, H.W.M., Viebahn, C., 2007. Ciliation and gene expression distinguish between node and posterior notochord in the mammalian embryo. Differentiation; research in biological diversity 75, 133–46. Blum, M., Weber, T., Beyer, T., Vick, P., 2009. Evolution of leftward flow. Seminars in cell & developmental biology 20, 464–71. Blythe, S. a, Cha, S.-W., Tadjuidje, E., Heasman, J., Klein, P.S., 2010. beta-Catenin Primes Organizer Gene Expression by Recruiting a Histone H3 Arginine 8 Methyltransferase, Prmt2. Developmental cell 19, 220–231. Boettger, T., Wittler, L., Kessel, M., 1999. FGF8 functions in the specification of the right body side of the chick. Current biology: CB 9, 277–80. Böttcher, R.T., Niehrs, C., 2005. Fibroblast growth factor signaling during early vertebrate development. Endocrine reviews 26, 63–77. Bowes, J.B., Snyder, K.A., Segerdell, E., Gibb, R., Jarabek, C., Noumen, E., Pollet, N., Vize, P.D., 2008. Xenbase: a Xenopus biology and genomics resource. Nucleic acids research 36, D761–7. Branney, P. a, Faas, L., Steane, S.E., Pownall, M.E., Isaacs, H. V, 2009. Characterisation of the fibroblast growth factor dependent transcriptome in early development. PloS one 4, e4951. Brennan, J., Norris, D.P., Robertson, E.J., 2002. Nodal activity in the node governs left-right asymmetry. Genes & Development 2339–2344. Brueckner, M., 2001. Cilia propel the embryo in the right direction. American journal of medical genetics 101, 339–44. 111 Literaturverzeichnis Brueckner, M., 2007. Heterotaxia, congenital heart disease, and primary ciliary dyskinesia. Circulation 115, 2793–5. Burks, P.J., Isaacs, H. V, Pownall, M.E., 2009. FGF signalling modulates transcriptional repression by Xenopus groucho-related-4. Biology of the cell / under the auspices of the European Cell Biology Organization 101, 301–8. Cadigan, K.M., Waterman, M.L., 2012. TCF/LEFs and Wnt signaling in the nucleus. Cold Spring Harbor perspectives in biology 4, a007906. Campione, M., Steinbeisser, H., Schweickert, a, Deissler, K., van Bebber, F., Lowe, L. a, Nowotschin, S., Viebahn, C., Haffter, P., Kuehn, M.R., Blum, M., 1999. The homeobox gene Pitx2: mediator of asymmetric left-right signaling in vertebrate heart and gut looping. Development (Cambridge, England) 126, 1225–34. Caron, A., Xu, X., Lin, X., 2012. Wnt/β-catenin signaling directly regulates Foxj1 expression and ciliogenesis in zebrafish Kupffer’s vesicle. Development (Cambridge, England) 139, 514–24. Cast, A.E., Gao, C., Amack, J.D., Ware, S.M., 2012. An essential and highly conserved role for Zic3 in left–right patterning, gastrulation and convergent extension morphogenesis. Developmental Biology 1–10. Cha, S.-W., Tadjuidje, E., Tao, Q., Wylie, C., Heasman, J., 2008. Wnt5a and Wnt11 interact in a maternal Dkk1-regulated fashion to activate both canonical and non-canonical signaling in Xenopus axis formation. Development (Cambridge, England) 135, 3719–29. Chen, Y., Schier, a F., 2001. The zebrafish Nodal signal Squint functions as a morphogen. Nature 411, 607–10. Choi, S.-C., Han, J.-K., 2002. Xenopus Cdc42 regulates convergent extension movements during gastrulation through Wnt/Ca2+ signaling pathway. Developmental biology 244, 342–57. Christen, B., Slack, J.M., 1999. Spatial response to fibroblast growth factor signalling in Xenopus embryos. Development (Cambridge, England) 126, 119–25. Christofori, G., 2003. Split personalities: the agonistic antagonist Sprouty. Nature cell biology 5, 377–9. Chung, H. a, Hyodo-Miura, J., Nagamune, T., Ueno, N., 2005. FGF signal regulates gastrulation cell movements and morphology through its target NRH. Developmental biology 282, 95–110. Ciruna, B., Rossant, J., 2001. Mesoderm Cell Fate Specification and Morphogenetic Movement at the Primitive Streak 1, 37–49. Cornell, R. a, Kimelman, D., 1994. Activin-mediated mesoderm induction requires FGF. Development (Cambridge, England) 120, 453–62. Crossley, P.H., Martin, G.R., 1995. The mouse Fgf8 gene encodes a family of polypeptides and is expressed in regions that direct outgrowth and patterning in the developing embryo. Development (Cambridge, England) 121, 439–51. Curran, K.L., Grainger, R.M., 2000. Expression of activated MAP kinase in Xenopus laevis embryos: evaluating the roles of FGF and other signaling pathways in early induction and patterning. Developmental biology 228, 41–56. 112 Literaturverzeichnis Dailey, L., Ambrosetti, D., Mansukhani, A., Basilico, C., 2005. Mechanisms underlying differential responses to FGF signaling. Cytokine & Growth Factor Reviews 16, 233–247. Dalagiorgou, G., Basdra, E.K., Papavassiliou, A.G., 2010. Polycystin-1: function as a mechanosensor. The international journal of biochemistry & cell biology 42, 1610–3. Dale, L., Slack, J.M., 1987a. Regional specification within the mesoderm of early embryos of Xenopus laevis. Development (Cambridge, England) 100, 279–95. Dale, L., Slack, J.M., 1987b. Fate map for the 32-cell stage of Xenopus laevis. Development (Cambridge, England) 99, 527–51. Dathe, V., Gamel, A., Männer, J., Brand-Saberi, B., Christ, B., 2002. Morphological left-right asymmetry of Hensen’s node precedes the asymmetric expression of Shh and Fgf8 in the chick embryo. Anatomy and embryology 205, 343–54. Davis, N.M., Kurpios, N. a, Sun, X., Gros, J., Martin, J.F., Tabin, C.J., 2008. The chirality of gut rotation derives from left-right asymmetric changes in the architecture of the dorsal mesentery. Developmental cell 15, 134–45. Deng, C.X., Wynshaw-Boris, a, Shen, M.M., Daugherty, C., Ornitz, D.M., Leder, P., 1994. Murine FGFR-1 is required for early postimplantation growth and axial organization. Genes & development 8, 3045–57. Dorey, K., Amaya, E., 2010. FGF signalling: diverse roles during early vertebrate embryogenesis. Development (Cambridge, England) 137, 3731–42. Eimon, P.M., Harland, R.M., 2002. Effects of heterodimerization and proteolytic processing on Derrière and Nodal activity: implications for mesoderm induction in Xenopus. Development (Cambridge, England) 129, 3089–103. Elms, P., Scurry, A., Davies, J., Willoughby, C., Hacker, T., Bogani, D., Arkell, R., 2004. Overlapping and distinct expression domains of Zic2 and Zic3 during mouse gastrulation. Gene expression patterns: GEP 4, 505–11. Essner, J.J., Amack, J.D., Nyholm, M.K., Harris, E.B., Yost, H.J., 2005. Kupffer’s vesicle is a ciliated organ of asymmetry in the zebrafish embryo that initiates left-right development of the brain, heart and gut. Development (Cambridge, England) 132, 1247–60. Essner, J.J., Vogan, K.J., Wagner, M.K., Tabin, C.J., Yost, H.J., Brueckner, M., 2002. Conserved function for embryonic nodal cilia. Nature 418, 37–8. Feistel, 2006. Determination of Laterality in the Rabbit Embryo: Studies on Ciliation and Asymmetric Signal Transfer. Naturwissenschaften. Feistel, K., Blum, M., 2006. Three types of cilia including a novel 9+4 axoneme on the notochordal plate of the rabbit embryo. Developmental dynamics: an official publication of the American Association of Anatomists 235, 3348–58. Feistel, K., Blum, M., 2008. Gap junctions relay FGF8-mediated right-sided repression of Nodal in rabbit. Developmental dynamics: an official publication of the American Association of Anatomists 237, 3516–27. 113 Literaturverzeichnis Field, S., Riley, K.-L., Grimes, D.T., Hilton, H., Simon, M., Powles-Glover, N., Siggers, P., Bogani, D., Greenfield, A., Norris, D.P., 2011. Pkd1l1 establishes left-right asymmetry and physically interacts with Pkd2. Development (Cambridge, England) 1142, 1131–1142. Fischer, A., Viebahn, C., Blum, M., 2002. FGF8 acts as a right determinant during establishment of the left-right axis in the rabbit. Current biology: CB 12, 1807–16. Fisher, M.E., Isaacs, H. V, Pownall, M.E., 2002. eFGF is required for activation of XmyoD expression in the myogenic cell lineage of Xenopus laevis. Development 1307–1315. Fletcher, R.B., Harland, R.M., 2008. The role of FGF signaling in the establishment and maintenance of mesodermal gene expression in Xenopus. Developmental Dynamics 237, 1243–54. Francescatto, L., Rothschild, S.C., Myers, A.L., Tombes, R.M., 2010. The activation of membrane targeted CaMK-II in the zebrafish Kupffer’s vesicle is required for left-right asymmetry. Development (Cambridge, England) 137, 2753–62. Frazzetto, G., Klingbeil, P., Bouwmeester, T., 2002. Xenopus marginal coil (Xmc), a novel FGF inducible cytosolic coiled-coil protein regulating gastrulation movements. Mechanisms of development 113, 3–14. Gaio, U., Schweickert, A., Fischer, a, Garratt, a N., Müller, T., Ozcelik, C., Lankes, W., Strehle, M., Britsch, S., Blum, M., Birchmeier, C., 1999. A role of the cryptic gene in the correct establishment of the left-right axis. Current biology: CB 9, 1339–42. Garic-Stankovic, A., Hernandez, M., Flentke, G.R., Zile, M.H., Smith, S.M., 2008. A ryanodine receptor-dependent Ca(i)(2+) asymmetry at Hensen’s node mediates avian lateral identity. Development (Cambridge, England) 135, 3271–80. Gerhart, J., Danilchik, M., Doniach, T., Roberts, S., Rowning, B., Stewart, R., 1989. Cortical rotation of the Xenopus egg: consequences for the anteroposterior pattern of embryonic dorsal development. Development (Cambridge, England) 107 Suppl, 37–51. Gilbert, S. F. (2006). Developmental Biology, Eighth Edition.Sinauer. Gospodarowicz, D., 1974. Localisation of a fibroblast growth factor and its effect alone and with hydrocortisone on 3T3 cell growth. Nature 249, 123–127. Gospodarowicz, D., Moran, J.S., 1975. Mitogenic effect of fibroblast growth factor on early passage cultures of human and murine fibroblasts. The Journal of cell biology 66, 451–7. Gourronc, F., Ahmad, N., Nedza, N., Eggleston, T., Rebagliati, M., 2007. Nodal activity around Kupffer’s vesicle depends on the T-box transcription factors Notail and Spadetail and on Notch signaling. Developmental dynamics: an official publication of the American Association of Anatomists 236, 2131–46. Griffin, K., Patient, R., Holder, N., 1995. Analysis of FGF function in normal and no tail zebrafish embryos reveals separate mechanisms for formation of the trunk and the tail. Development (Cambridge, England) 121, 2983–94. Griffin, K.J., Amacher, S.L., Kimmel, C.B., Kimelman, D., 1998. Molecular identification of spadetail: regulation of zebrafish trunk and tail mesoderm formation by T-box genes. Development (Cambridge, England) 125, 3379–88. 114 Literaturverzeichnis Gros, J., Feistel, K., Viebahn, C., Blum, M., Tabin, C.J., 2009. Cell movements at Hensen’s node establish left/right asymmetric gene expression in the chick. Science (New York, N.Y.) 324, 941–4. Grüdl, K., 2012. Die Analyse der embryonalen Pkd2 -Funktion auf die Festlegung der LinksRechts-Achse in Xenopus laevis. Diplomarbeit, Fakultät Naturwissenschaften, Universität Hohenheim Gurdon, J.B., Hopwood, N., 2000. The introduction of Xenopus laevis into developmental biology: of empire, pregnancy testing and ribosomal genes. The International journal of developmental biology 44, 43–50. Hackett, B.P., 2002. Formation and malformation of the vertebrate left-right axis. Current molecular medicine 2, 39–66. Hamada, H., Meno, C., Watanabe, D., Saijoh, Y., 2002. Establishment of vertebrate left-right asymmetry. Nature reviews. Genetics 3, 103–13. Harvey, R.P., 1998. Links in the left/right axial pathway. Cell 94, 273–6. Hashimoto, H., Rebagliati, M., Ahmad, N., Muraoka, O., Kurokawa, T., Hibi, M., Suzuki, T., 2004. The Cerberus/Dan-family protein Charon is a negative regulator of Nodal signaling during leftright patterning in zebrafish. Development (Cambridge, England) 131, 1741–53. Hauser, J., Saarikettu, J., Grundstro, T., 2008. Calcium Regulation of Myogenesis by Differential Calmodulin Inhibition of Basic Helix-Loop-Helix Transcription Factors 19, 2509–2519. Heasman, J., 2006. Patterning the early Xenopus embryo. Development (Cambridge, England) 133, 1205–17. Heasman, J., Crawford, a, Goldstone, K., Garner-Hamrick, P., Gumbiner, B., McCrea, P., Kintner, C., Noro, C.Y., Wylie, C., 1994. Overexpression of cadherins and underexpression of betacatenin inhibit dorsal mesoderm induction in early Xenopus embryos. Cell 79, 791–803. Heisenberg, C., Tada, M., Rauch, È., Smith, J.C., Wilson, S.W., 2000. Silberblick / Wnt11 mediates convergent extension movements during zebrafish gastrulation 405. Hensey, C., Gautier, J., 1997. A developmental timer that regulates apoptosis at the onset of gastrulation. Mechanisms of development 69, 183–95. Hensey, C., Gautier, J., 1998. Programmed cell death during Xenopus development: a spatiotemporal analysis. Developmental biology 203, 36–48. Hirokawa, N., Tanaka, Y., Okada, Y., 2009. Left-right determination: involvement of molecular motor KIF3, cilia, and nodal flow. Cold Spring Harbor perspectives in biology 1, a000802. Hirokawa, N., Tanaka, Y., Okada, Y., Takeda, S., 2006. Nodal flow and the generation of left-right asymmetry. Cell 125, 33–45. Hojo, M., Takashima, S., Kobayashi, D., Sumeragi, A., Shimada, A., Tsukahara, T., Yokoi, H., Narita, T., Jindo, T., Kage, T., Kitagawa, T., Kimura, T., Sekimizu, K., Miyake, A., Setiamarga, D., Murakami, R., Tsuda, S., Ooki, S., Kakihara, K., Naruse, K., Takeda, H., 2007. Rightelevated expression of charon is regulated by fluid flow in medaka Kupffer ’ s vesicle. Society 395– 405. 115 Literaturverzeichnis Hong, S.-K., Dawid, I.B., 2009. FGF-dependent left-right asymmetry patterning in zebrafish is mediated by Ier2 and Fibp1. Proceedings of the National Academy of Sciences of the United States of America 106, 2230–5. Houston, D.W., 2012. Cortical rotation and messenger RNA localization in Xenopus axis formation. Wiley interdisciplinary reviews. Developmental biology 1, 371–88. Igarashi, P., Somlo, S., 2002. Genetics and Pathogenesis of Polycystic Kidney Disease. Journal of the American Society of Nephrology 13, 2384–2398. Isaacs, H. V, Pownall, M.E., Slack, J.M., 1994. eFGF regulates Xbra expression during Xenopus gastrulation. The EMBO journal 13, 4469–81. Kamura, K., Kobayashi, D., Uehara, Y., Koshida, S., Iijima, N., Kudo, A., Yokoyama, T., Takeda, H., 2011. Pkd1l1 complexes with Pkd2 on motile cilia and functions to establish the left-right axis. Development (Cambridge, England) 138, 1121–9. Karcher, C., Fischer, A., Schweickert, A., Bitzer, E., Horie, S., Witzgall, R., Blum, M., 2005. Lack of a laterality phenotype in Pkd1 knock-out embryos correlates with absence of polycystin-1 in nodal cilia. Differentiation; research in biological diversity 73, 425–32. Kawakami, Y., Raya, A., Raya, R.M., Rodríguez-Esteban, C., Belmonte, J.C.I., 2005. Retinoic acid signalling links left-right asymmetric patterning and bilaterally symmetric somitogenesis in the zebrafish embryo. Nature 435, 165–71. Kawasumi, A., Nakamura, T., Iwai, N., Yashiro, K., Saijoh, Y., Belo, J.A., Shiratori, H., Hamada, H., 2011. Left-right asymmetry in the level of active Nodal protein produced in the node is translated into left-right asymmetry in the lateral plate of mouse embryos. Developmental biology. Keller, R., Cooper, M.S., Danilchik, M., Tibbetts, P., Wilson, P. a, 1989. Cell intercalation during notochord development in Xenopus laevis. The Journal of experimental zoology 251, 134–54. Keller, R., Davidson, L. a, Shook, D.R., 2003. How we are shaped: the biomechanics of gastrulation. Differentiation; research in biological diversity 71, 171–205. Keller, R., Shih, J., Domingo, C., 1992. The patterning and functioning of protrusive activity during convergence and extension of the Xenopus organiser. Development (Cambridge, England). Supplement 91, 81–91. Keller, R.E., 1976. Vital Dye Mapping of the Gastrula and Neurula laevis. Developmental Biology 137, 118–137. Kietzmann, A., Wang, Y., Weber, D., Steinbeisser, H., 2012. Xenopus paraxial protocadherin inhibits Wnt/β-catenin signalling via casein kinase 2β. EMBO reports 13, 129–34. Kim, S.H., Yamamoto, a, Bouwmeester, T., Agius, E., Robertis, E.M., 1998. The role of paraxial protocadherin in selective adhesion and cell movements of the mesoderm during Xenopus gastrulation. Development (Cambridge, England) 125, 4681–90. Kimelman, D., 2006. Mesoderm induction: from caps to chips. Nature reviews. Genetics 7, 360–72. King, T., Beddington, R.S., Brown, N. a, 1998. The role of the brachyury gene in heart development and left-right specification in the mouse. Mechanisms of development 79, 29– 37. 116 Literaturverzeichnis Kitaguchi, T., Mizugishi, K., Hatayama, M., Aruga, J., Mikoshiba, K., 2002. Xenopus Brachyury regulates mesodermal expression of Zic3, a gene controlling left-right asymmetry. Development, growth & differentiation 44, 55–61. Kitaguchi, T., Nagai, T., Nakata, K., Aruga, J., Mikoshiba, K., 2000. Zic3 is involved in the left-right specification of the Xenopus embryo. Development (Cambridge, England) 127, 4787–95. Kitajima, K., Oki, S., Ohkawa, Y., Sumi, T., Meno, C., 2013. Wnt signaling regulates left-right axis formation in the node of mouse embryos. Developmental biology 380, 222–32. Klein, S.L., 1987. The first cleavage furrow demarcates the dorsal-ventral axis in Xenopus embryos. Developmental biology 120, 299–304. Kofron, M., Demel, T., Xanthos, J., Lohr, J., Sun, B., Sive, H., Osada, S., Wright, C., Wylie, C., Heasman, J., 1999. Mesoderm induction in Xenopus is a zygotic event regulated by maternal VegT via TGFbeta growth factors. Development (Cambridge, England) 126, 5759–70. Kohn, A.D., Moon, R.T., 2005. Wnt and calcium signaling: beta-catenin-independent pathways. Cell calcium 38, 439–46. Koulen, P., Cai, Y., Geng, L., Maeda, Y., Nishimura, S., Witzgall, R., Ehrlich, B.E., Somlo, S., 2002. Polycystin-2 is an intracellular calcium release channel. Nature cell biology 4, 191–7. Krebs, L.T., Iwai, N., Nonaka, S., Welsh, I.C., Lan, Y., Jiang, R., Saijoh, Y., Brien, T.P.O., Hamada, H., Gridley, T., 2003. Notch signaling regulates left – right asymmetry determination by inducing Nodal expression. Genes & Development 1207–1212. Kühl, M., 2004. The WNT/calcium pathway: biochemical mediators, tools and future requirements. Frontiers in bioscience: a journal and virtual library 9, 967–74. Kuroda, H., Inui, M., Sugimoto, K., Hayata, T., Asashima, M., 2002. Axial protocadherin is a mediator of prenotochord cell sorting in Xenopus. Developmental biology 244, 267–77. Kurpios, N. a, Ibañes, M., Davis, N.M., Lui, W., Katz, T., Martin, J.F., Izpisúa Belmonte, J.C., Tabin, C.J., 2008. The direction of gut looping is established by changes in the extracellular matrix and in cell:cell adhesion. Proceedings of the National Academy of Sciences of the United States of America 105, 8499–506. LaBonne, C., Burke, B., Whitman, M., 1995. Role of MAP kinase in mesoderm induction and axial patterning during Xenopus development. Development (Cambridge, England) 121, 1475–86. LaBonne, C., Whitman, M., 1994. Mesoderm induction by activin requires FGF-mediated intracellular signals. Development (Cambridge, England) 120, 463–72. Larabell, C.A., Torres, M., Rowning, B.A., Yost, C., Miller, J.R., Wu, M., Kimelman, D., Moon, R.T., 1997. Establishment of the Dorso-ventral Axis in 136, 1123–1136. Leclerc, C., Lee, M., Webb, S.E., Moreau, M., Miller, A.L., 2003. Calcium transients triggered by planar signals induce the expression of ZIC3 gene during neural induction in Xenopus. Developmental Biology 261, 381–390. Lee, S.-Y., Lim, S.-K., Cha, S.-W., Yoon, J., Lee, S.-H., Lee, H.-S., Park, J.-B., Lee, J.-Y., Kim, S.C., Kim, J., 2011. Inhibition of FGF signaling converts dorsal mesoderm to ventral mesoderm in early Xenopus embryos. Differentiation; research in biological diversity 82, 99– 107. 117 Literaturverzeichnis Levin, M., Johnson, R.L., Stern, C.D., Kuehn, M., Tabin, C., 1995. Determining Left-Right Asymmetry in Chick Embryogenesis. Cell 82, 803–814. Li, Y., Wright, J.M., Qian, F., Germino, G.G., Guggino, W.B., 2005. Polycystin 2 interacts with type I inositol 1,4,5-trisphosphate receptor to modulate intracellular Ca2+ signaling. The Journal of biological chemistry 280, 41298–306. Liu, C., Liu, W., Lu, M.F., Brown, N. a, Martin, J.F., 2001. Regulation of left-right asymmetry by thresholds of Pitx2c activity. Development (Cambridge, England) 128, 2039–48. Liu, D.-W., Hsu, C.-H., Tsai, S.-M., Hsiao, C.-D., Wang, W.-P., 2011. A variant of fibroblast growth factor receptor 2 (Fgfr2) regulates left-right asymmetry in zebrafish. PloS one 6, e21793. Long, S., 2003. The zebrafish nodal-related gene southpaw is required for visceral and diencephalic left-right asymmetry. Development 130, 2303–2316. Lowe, L. a, Supp, D.M., Sampath, K., Yokoyama, T., Wright, C. V, Potter, S.S., Overbeek, P., Kuehn, M.R., 1996. Conserved left-right asymmetry of nodal expression and alterations in murine situs inversus. Nature. Marchal, L., Luxardi, G., Thomé, V., Kodjabachian, L., 2009. BMP inhibition initiates neural induction via FGF signaling and Zic genes. Proceedings of the National Academy of Sciences of the United States of America 106, 17437–42. Marom, K., Levy, V., Pillemer, G., Fainsod, A., 2005. Temporal analysis of the early BMP functions identifies distinct anti-organizer and mesoderm patterning phases. Developmental biology 282, 442–54. Marques, S., Borges, A.C., Silva, A.C., Freitas, S., Cordenonsi, M., 2004. The activity of the Nodal antagonist Cerl-2 in the mouse node is required for correct L / R body axis 2342–2347. McGrath, J., Somlo, S., Makova, S., Tian, X., Brueckner, M., 2003. Two populations of node monocilia initiate left-right asymmetry in the mouse. Cell 114, 61–73. Mekahli, D., Sammels, E., Luyten, T., Welkenhuyzen, K., van den Heuvel, L.P., Levtchenko, E.N., Gijsbers, R., Bultynck, G., Parys, J.B., De Smedt, H., Missiaen, L., 2012. Polycystin-1 and polycystin-2 are both required to amplify inositol-trisphosphate-induced Ca2+ release. Cell calcium 51, 452–8. Meno, C., Saijoh, Y., Fujii, H., Ikeda, M., Yokoyama, T., Yokoyama, M., Toyoda, Y., Hamada, H., 1996. Left-right asymmetric expression of the TGF beta-family member lefty in mouse embryos. Nature 381, 151–5. Meno, C., Shimono, a, Saijoh, Y., Yashiro, K., Mochida, K., Ohishi, S., Noji, S., Kondoh, H., Hamada, H., 1998. Lefty-1 Is Required for Left-Right Determination As a Regulator of Lefty-2 and Nodal. Cell 94, 287–97. Meno, C., Takeuchi, J., Sakuma, R., Koshiba-Takeuchi, K., Ohishi, S., Saijoh, Y., Miyazaki, J., ten Dijke, P., Ogura, T., Hamada, H., 2001. Diffusion of nodal signaling activity in the absence of the feedback inhibitor Lefty2. Developmental cell 1, 127–38. Meyers, E.N., Martin, G.R., 1999. Differences in left-right axis pathways in mouse and chick: functions of FGF8 and SHH. Science (New York, N.Y.) 285, 403–6. 118 Literaturverzeichnis Miller, J.R., Rowning, B.A., Larabell, C.A., Yang-snyder, J.A., Bates, R.L., Moon, R.T., 1999. Establishment of the Dorsal – Ventral Axis in Xenopus Embryos Coincides. Cell 146, 427– 437. Mohammadi, M., 1997. Structures of the Tyrosine Kinase Domain of Fibroblast Growth Factor Receptor in Complex with Inhibitors. Science 276, 955–960. Müller, P., Rogers, K.W., Jordan, B.M., Lee, J.S., Robson, D., Ramanathan, S., Schier, A.F., 2012. Differential diffusivity of Nodal and Lefty underlies a reaction-diffusion patterning system. Science (New York, N.Y.) 336, 721–4. Nakamura, T., Mine, N., Nakaguchi, E., Mochizuki, A., Yamamoto, M., Yashiro, K., Meno, C., Hamada, H., 2006. Generation of robust left-right asymmetry in the mouse embryo requires a self-enhancement and lateral-inhibition system. Developmental cell 11, 495–504. Nakamura, T., Saito, D., Kawasumi, A., Shinohara, K., Asai, Y., Takaoka, K., Dong, F., Takamatsu, A., Belo, J.A., Mochizuki, A., Hamada, H., 2012. Fluid flow and interlinked feedback loops establish left-right asymmetric decay of Cerl2 mRNA. Nature communications 3, 1322. Nauli, S.M., Zhou, J., 2004. Polycystins and mechanosensation in renal and nodal cilia. BioEssays: news and reviews in molecular, cellular and developmental biology 26, 844–56. Neugebauer, J.M., Amack, J.D., Peterson, A.G., Bisgrove, B.W., Yost, H.J., 2009. FGF signalling during embryo development regulates cilia length in diverse epithelia. Nature 458, 651–4. Niederreither, K., Vermot, J., Messaddeq, N., Schuhbaur, B., Chambon, P., Dollé, P., 2001. Embryonic retinoic acid synthesis is essential for heart morphogenesis in the mouse. Development (Cambridge, England) 128, 1019–31. Niikura, Y., Tabata, Y., Tajima, A., Inoue, I., Arai, K., Watanabe, S., 2006. Zebrafish Numb homologue: phylogenetic evolution and involvement in regulation of left-right asymmetry. Mechanisms of development 123, 407–14. Nonaka, S., Tanaka, Y., Okada, Y., Takeda, S., Harada, A., Kanai, Y., Kido, M., Hirokawa, N., 1998. Randomization of left-right asymmetry due to loss of nodal cilia generating leftward flow of extraembryonic fluid in mice lacking KIF3B motor protein. Cell 95, 829–37. Norris, D.P., Robertson, E.J., 1999. Asymmetric and node-specific nodal expression patterns are controlled by two distinct cis-acting regulatory elements. Genes & Development 13, 1575– 1588. Nutt, S.L., Dingwell, K.S., Holt, C.E., Amaya, E., 2001. Xenopus Sprouty2 inhibits FGF-mediated gastrulation movements but does not affect mesoderm induction and patterning. Genes & Development 4, 1152–1166. Ohi, Y., Wright, C.V.E., 2007. Anteriorward shifting of asymmetric Xnr1 expression and contralateral communication in left-right specification in Xenopus. Developmental biology 301, 447–63. Okada, Y., Nonaka, S., Tanaka, Y., Saijoh, Y., Hamada, H., Hirokawa, N., 1999. Abnormal nodal flow precedes situs inversus in iv and inv mice. Molecular cell 4, 459–68. Okada, Y., Takeda, S., Tanaka, Y., Belmonte, J.-C.I., Hirokawa, N., 2005. Mechanism of nodal flow: a conserved symmetry breaking event in left-right axis determination. Cell 121, 633–44. 119 Literaturverzeichnis Oki, S., Hashimoto, R., Okui, Y., Shen, M.M., Mekada, E., Otani, H., Saijoh, Y., Hamada, H., 2007. Sulfated glycosaminoglycans are necessary for Nodal signal transmission from the node to the left lateral plate in the mouse embryo. Development (Cambridge, England) 134, 3893– 904. Oki, S., Kitajima, K., Marques, S., Belo, J.A., Yokoyama, T., Hamada, H., Meno, C., 2009. Reversal of left-right asymmetry induced by aberrant Nodal signaling in the node of mouse embryos. Development (Cambridge, England) 136, 3917–25. Oki, S., Kitajima, K., Meno, C., 2010. Dissecting the role of Fgf signaling during gastrulation and left-right axis formation in mouse embryos using chemical inhibitors. Developmental dynamics : an official publication of the American Association of Anatomists 239, 1768–78. Oteíza, P., Köppen, M., Concha, M.L., Heisenberg, C.-P., 2008. Origin and shaping of the laterality organ in zebrafish. Development (Cambridge, England) 135, 2807–13. Oteiza, P., Köppen, M., Krieg, M., Pulgar, E., Farias, C., Melo, C., Preibisch, S., Müller, D., Tada, M., Hartel, S., Heisenberg, C.-P., Concha, M.L., 2010. Planar cell polarity signalling regulates cell adhesion properties in progenitors of the zebrafish laterality organ. Development (Cambridge, England) 3468, 3459–3468. Ozaki, K., Kadomoto, R., Asato, K., Tanimura, S., Itoh, N., Kohno, M., 2001. ERK pathway positively regulates the expression of Sprouty genes. Biochemical and biophysical research communications 285, 1084–8. Pagán-Westphal, S.M., Tabin, C.J., 1998. The transfer of left-right positional information during chick embryogenesis. Cell 93, 25–35. Pennekamp, P., Karcher, C., Fischer, A., Schweickert, A., Skryabin, B., Horst, J., Blum, M., Dworniczak, B., 2002. The ion channel polycystin-2 is required for left-right axis determination in mice. Current biology: CB 12, 938–43. Pownall, M.E., Isaacs, H. V, 2010. FGF Signalling in Vertebrate Development. Colloquium Series on Developmental Biology 1, 1–75. Praetorius, H. a., Spring, K.R., 2001. Bending the MDCK Cell Primary Cilium Increases Intracellular Calcium. Journal of Membrane Biology 184, 71–79. Przemeck, G.K.H., 2003. Node and midline defects are associated with left-right development in Delta1 mutant embryos. Development 130, 3–13. Purandare, S.M., Ware, S.M., Kwan, K.M., Gebbia, M., Bassi, M.T., Deng, J.M., Vogel, H., Behringer, R.R., Belmont, J.W., Casey, B., 2002. DEVELOPMENT AND DISEASE A complex syndrome of left-right axis , central nervous system and axial skeleton defects in Zic3 mutant mice 2302, 2293–2302. Qian, F., Noben-Trauth, K., 2005. Cellular and molecular function of mucolipins (TRPML) and polycystin 2 (TRPP2). Pflügers Archiv: European journal of physiology 451, 277–85. Rankin, C.T., Bunton, T., Lawler, A.M., and Lee, S.J. 2000. Regulation of left–right patterning in mice by growth/differentiation factor-1.Nat. Genet.24:262–265 Raya, A., Kawakami, Y., Rodriguez-Esteban, C., Buscher, D., Koth, C.M., Itoh, T., Morita, M., Raya, R.M., Dubova, I., Bessa, J.G., de la Pompa, J.L., Izpisua Belmonte, J.C., 2003. Notch 120 Literaturverzeichnis activity induces Nodal expression and mediates the establishment of left-right asymmetry in vertebrate embryos. Genes & development 17, 1213–8. Raya, A., Kawakami, Y., Rodríguez-Esteban, C., Ibañes, M., Rasskin-Gutman, D., RodríguezLeón, J., Büscher, D., Feijó, J. a, Izpisúa Belmonte, J.C., 2004. Notch activity acts as a sensor for extracellular calcium during vertebrate left-right determination. Nature 427, 121–8. Reifers, F., Böhli, H., Walsh, E.C., Crossley, P.H., Stainier, D.Y., Brand, M., 1998. Fgf8 is mutated in zebrafish acerebellar (ace) mutants and is required for maintenance of midbrain-hindbrain boundary development and somitogenesis. Development (Cambridge, England) 125, 2381– 95. Reintsch, W.E., Habring-Mueller, A., Wang, R.W., Schohl, A., Fagotto, F., 2005. beta-Catenin controls cell sorting at the notochord-somite boundary independently of cadherin-mediated adhesion. The Journal of cell biology 170, 675–86. Rodríguez Esteban, C., Capdevila, J., Economides, a N., Pascual, J., Ortiz, a, Izpisúa Belmonte, J.C., 1999. The novel Cer-like protein Caronte mediates the establishment of embryonic leftright asymmetry. Nature 401, 243–51. Rupp, R. a, Snider, L., Weintraub, H., 1994. Xenopus embryos regulate the nuclear localization of XMyoD. Genes & Development 8, 1311–1323. Saijoh, Y., Oki, S., Ohishi, S., Hamada, H., 2003. Left–right patterning of the mouse lateral plate requires nodal produced in the node. Developmental Biology 256, 161–173. Saijoh, Y., Adachi, H., Sakuma, R., Yeo, C.Y., Yashiro, K., Watanabe, M., Hashiguchi, H., Mochida, K., Ohishi, S., Kawabata, M., Miyazono, K., Whitman, M., Hamada, H., 2000. Leftright asymmetric expression of lefty2 and nodal is induced by a signaling pathway that includes the transcription factor FAST2. Molecular cell 5, 35–47. Saijoh, Y., Oki, S., Tanaka, C., Nakamura, T., Adachi, H., Yan, Y.-T., Shen, M.M., Hamada, H., 2005. Two nodal-responsive enhancers control left-right asymmetric expression of Nodal. Developmental dynamics: an official publication of the American Association of Anatomists 232, 1031–6. Sakano, D., Kato, A., Parikh, N., McKnight, K., Terry, D., Stefanovic, B., Kato, Y., 2010. BCL6 canalizes Notch-dependent transcription, excluding Mastermind-like1 from selected target genes during left-right patterning. Developmental cell 18, 450–62. Sarmah, B., Latimer, A.J., Appel, B., Wente, S.R., 2005. Inositol polyphosphates regulate zebrafish left-right asymmetry. Developmental cell 9, 133–45. Sbalzarini, I.F., Koumoutsakos, P., 2005. Feature point tracking and trajectory analysis for video imaging in cell biology. Journal of structural biology 151, 182–95. Schier, A.F., 2009. Nodal morphogens. Cold Spring Harbor perspectives in biology 1, a003459. Schneider, I., Houston, D.W., Rebagliati, M.R., Slusarski, D.C., 2008. Calcium fluxes in dorsal forerunner cells antagonize beta-catenin and alter left-right patterning. Development (Cambridge, England) 135, 75–84. Schneider, I., 2008. Die Rolle des FGF-Signalwegs in der Links.Rechts-Achsenentwicklung von Xenopus laevis. Diplomarbeit, Fakultät Naturwissenschaften, Universität Hohenheim 121 Literaturverzeichnis Schohl, A., Fagotto, F., 2002. ß-catenin, MAPK and Smad signaling during early Xenopus development. Development 134, 1454–1454. Schohl, A., Fagotto, F., 2003. A role for maternal beta-catenin in early mesoderm induction in Xenopus. The EMBO journal 22, 3303–13. Schulte-Merker, S., Smith, J.C., 1995. Mesoderm formation in response to Brachyury requires FGF signalling. Current biology: CB 5, 62–7. Schweickert, a, Campione1, M., Steinbeisser, H., Blum, M., 2000. Pitx2 isoforms: involvement of Pitx2c but not Pitx2a or Pitx2b in vertebrate left-right asymmetry. Mechanisms of development 90, 41–51. Schweickert, A., Vick, P., Getwan, M., Weber, T., Schneider, I., Eberhardt, M., Beyer, T., Pachur, A., Blum, M., 2010. The nodal inhibitor coco is a critical target of leftward flow in Xenopus. Current biology: CB 20, 738–43. Schweickert, A., Weber, T., Beyer, T., Vick, P., Bogusch, S., Feistel, K., Blum, M., 2007. Ciliadriven leftward flow determines laterality in Xenopus. Current biology: CB 17, 60–6. Shen, M.M., 2007. Nodal signaling: developmental roles and regulation. Development (Cambridge, England) 134, 1023–34. Shen, M.M., Wang, H., Leder, P., 1997. A differential display strategy identifies Cryptic, a novel EGF-related gene expressed in the axial and lateral mesoderm during mouse gastrulation. Development (Cambridge, England) 124, 429–42. Shindo, A., Hara, Y., Yamamoto, T.S., Ohkura, M., Nakai, J., Ueno, N., 2010. Tissue-tissue interaction-triggered calcium elevation is required for cell polarization during Xenopus gastrulation. PloS one 5, e8897. Shiratori, H., Sakuma, R., Watanabe, M., Hashiguchi, H., Mochida, K., Sakai, Y., Nishino, J., Saijoh, Y., Whitman, M., Hamada, H., 2001. Two-step regulation of left-right asymmetric expression of Pitx2: initiation by nodal signaling and maintenance by Nkx2. Molecular cell 7, 137–49. Shiratori, H., Yashiro, K., Shen, M.M., Hamada, H., 2006. Conserved regulation and role of Pitx2 in situs-specific morphogenesis of visceral organs. Development (Cambridge, England) 133, 3015–25. Shook, D.R., Majer, C., Keller, R., 2004. Pattern and morphogenesis of presumptive superficial mesoderm in two closely related species, Xenopus laevis and Xenopus tropicalis. Developmental biology 270, 163–85. Simard, A., Di Giorgio, L., Amen, M., Westwood, A., Amendt, B. a, Ryan, A.K., 2009. The Pitx2c Nterminal domain is a critical interaction domain required for asymmetric morphogenesis. Developmental dynamics: an official publication of the American Association of Anatomists 238, 2459–70. Sivak, J.M., Petersen, L.F., Amaya, E., 2005. FGF signal interpretation is directed by Sprouty and Spred proteins during mesoderm formation. Developmental cell 8, 689–701. Slack, J.M., Darlington, B.G., Heath, J.K., Godsave, S.F., 1987. Mesoderm induction in early Xenopus embryos by heparin-binding growth factors. Nature 326, 197–200. 122 Literaturverzeichnis Slusarski, D.C., Pelegri, F., 2007. Calcium signaling in vertebrate embryonic patterning and morphogenesis. Developmental biology 307, 1–13. Sokol, S.Y., 1999. Wnt signaling axis specification in vertebrates. Current opinion in genetics & development 9, 405–410. Solnica-Krezel, L., 2005. Conserved patterns of cell movements during vertebrate gastrulation. Current biology: CB 15, R213–28. Song, H., Hu, J., Chen, W., Elliott, G., Andre, P., Gao, B., Yang, Y., 2010. Planar cell polarity breaks bilateral symmetry by controlling ciliary positioning. Nature 1–6. Spemann, H. und Mangold, H. (1924). Über die Induktion von Embryonalanlagen durch Implantation artfremder Organisatoren. Roux Archiv für Entwicklungsmechanik, 109, 390-517 Stennard, F., Carnac, G., Gurdon, J.B., 1996. The Xenopus T-box gene, Antipodean, encodes a vegetally localised maternal mRNA and can trigger mesoderm formation. Development (Cambridge, England) 122, 4179–88. Stubbs, J.L., Oishi, I., Izpisúa Belmonte, J.C., Kintner, C., 2008. The forkhead protein Foxj1 specifies node-like cilia in Xenopus and zebrafish embryos. Nature genetics 40, 1454–60. Sulik, K., Dehart, D.B., Iangaki, T., Carson, J.L., Vrablic, T., Gesteland, K., Schoenwolf, G.C., 1994. Morphogenesis of the murine node and notochordal plate. Developmental dynamics : an official publication of the American Association of Anatomists 201, 260–78. Sun, X., Meyers, E.N., Lewandoski, M., Martin, G.R., 1999. Targeted disruption of Fgf8 causes failure of cell migration in the gastrulating mouse embryo. Genes & Development 13, 1834– 1846. Supp, D.M., Brueckner, M., Kuehn, M.R., Witte, D.P., Lowe, L. a, McGrath, J., Corrales, J., Potter, S.S., 1999. Targeted deletion of the ATP binding domain of left-right dynein confirms its role in specifying development of left-right asymmetries. Development (Cambridge, England) 126, 5495–504. Supp, D.M., Witte, D.P., Potter, S.S., Brueckner, M., 1997. Mutation of an axonemal dynein affects left-right asymmetry in inversus viscerum mice. Nature 389, 963–6. Tabin, C.J., Vogan, K.J., 2003. A two-cilia model for vertebrate left-right axis specification. Genes & development 17, 1–6. Tada, M., Smith, J.C., 2000. Xwnt11 is a target of Xenopus Brachyury: regulation of gastrulation movements via Dishevelled, but not through the canonical Wnt pathway. Development (Cambridge, England) 127, 2227–38. Takao, D., Nemoto, T., Abe, T., Kiyonari, H., Kajiura-Kobayashi, H., Shiratori, H., Nonaka, S., 2013. Asymmetric distribution of dynamic calcium signals in the node of mouse embryo during left-right axis formation. Developmental biology 376, 23–30. Takeuchi, J.K., Lickert, H., Bisgrove, B.W., Sun, X., Yamamoto, M., Chawengsaksophak, K., Hamada, H., Yost, H.J., Rossant, J., Bruneau, B.G., 2007. Baf60c is a nuclear Notch signaling component required for the establishment of left-right asymmetry. Proceedings of the National Academy of Sciences of the United States of America 104, 846–51. 123 Literaturverzeichnis Tanaka, C., Sakuma, R., Nakamura, T., Hamada, H., Saijoh, Y., 2007. Long-range action of Nodal requires interaction with GDF1. Genes & development 21, 3272–82. Tanaka, H., Iguchi, N., Toyama, Y., Kitamura, K., Takahashi, T., Kaseda, K., Maekawa, M., Nishimune, Y., 2004. Mice Deficient in the Axonemal Protein Tektin-t Exhibit Male Infertility and Immotile-Cilium Syndrome Due to Impaired Inner Arm Dynein Function 24, 7958–7964. Tanaka, Y., Okada, Y., Hirokawa, N., 2005. FGF-induced vesicular release of Sonic hedgehog and retinoic acid in leftward nodal flow is critical for left-right determination. Nature 435, 172–7. Tao, Q., Yokota, C., Puck, H., Kofron, M., Birsoy, B., Yan, D., Asashima, M., Wylie, C.C., Lin, X., Heasman, J., 2005. Maternal wnt11 activates the canonical wnt signaling pathway required for axis formation in Xenopus embryos. Cell 120, 857–71. Thisse, B., Thisse, C., 2005. Functions and regulations of fibroblast growth factor signaling during embryonic development. Developmental biology 287, 390–402. Thumberger, T., 2011. Towards a unifying model of symmetry breakage in Xenopus laevis : serotonin signaling and the cilia-driven leftward flow. Dissertation, Fakultät Naturwissenschaften, Universität Hohenheim Tran, U., Zakin, L., Schweickert, A., Agrawal, R., Döger, R., Blum, M., De Robertis, E.M., Wessely, O., 2010. The RNA-binding protein bicaudal C regulates polycystin 2 in the kidney by antagonizing miR-17 activity. Development (Cambridge, England) 137, 1107–16. Treiman, M., Caspersen, C., Christensen, S.B., 1998. A tool coming of age: thapsigargin as an inhibitor of sarco-endoplasmic reticulum Ca(2+)-ATPases. Trends in pharmacological sciences 19, 131–5. Tsiairis, C.D., McMahon, A.P., 2009. An Hh-dependent pathway in lateral plate mesoderm enables the generation of left/right asymmetry. Current biology: CB 19, 1912–7. Tsikolia, N., Schröder, S., Schwartz, P., Viebahn, C., 2012. Paraxial left-sided nodal expression and the start of left-right patterning in the early chick embryo. Differentiation; research in biological diversity 84, 380–91. Ueno, H., Gunn, M., Dell, K., Tseng, A., Williams, L., 1992. A truncated form of fibroblast growth factor receptor 1 inhibits signal transduction by multiple types of fibroblast growth factor receptor. The Journal of biological chemistry 267, 1470–6. Umbhauer, M., Marshall, C.J., Mason, C.S., Old, R.W., Smith, J.C., 1995. Mesoderm induction in Xenopus caused by activation of MAP kinase. Nature 376, 58–62. Vick, P, 2009. Functional dissection of leftward flow Philipp Vick. Dissertation, Fakultät Naturwissenschaften, Universität Hohenheim Vick, P., Schweickert, A., Weber, T., Eberhardt, M., Mencl, S., Shcherbakov, D., Beyer, T., Blum, M., 2009. Flow on the right side of the gastrocoel roof plate is dispensable for symmetry breakage in the frog Xenopus laevis. Developmental biology 331, 281–91. Vincent, J.P., Gerhart, J.C., 1987. Subcortical rotation in Xenopus eggs: an early step in embryonic axis specification. Developmental biology 123, 526–39. Vogel, P., Read, R., Hansen, G.M., Freay, L.C., Zambrowicz, B.P., Sands, a T., 2010. Situs inversus in Dpcd/Poll-/-, Nme7-/- , and Pkd1l1-/- mice. Veterinary pathology 47, 120–31. 124 Literaturverzeichnis Vonica, A., Brivanlou, A.H., 2007. The left-right axis is regulated by the interplay of Coco, Xnr1 and derrière in Xenopus embryos. Developmental biology 303, 281–94. Wagner, M.K., Yost, H.J., 2000. Left-right development: the roles of nodal cilia. Current biology : CB 10, R149–51. Walentek, P., 2012. ATP4 and Wnt-signaling are required for ciliogenesis and left-right axis development of Xenopus. Dissertation, Fakultät Naturwissenschaften, Universität Hohenheim Walentek, P., Beyer, T., Thumberger, T., Schweickert, A., Blum, M., 2012. ATP4a Is Required for Wnt-Dependent Foxj1 Expression and Leftward Flow in Xenopus Left-Right Development. Cell Reports 1, 516–527. Walentek, P., Schneider, I., Schweickert, A., Blum, M., 2013. Wnt11b Is Involved in Cilia-Mediated Symmetry Breakage during Xenopus Left-Right Development. PLoS ONE 8, e73646. Wallingford, J.B., Ewald, a J., Harland, R.M., Fraser, S.E., 2001. Calcium signaling during convergent extension in Xenopus. Current biology: CB 11, 652–61. Wallingford, J.B., Fraser, S.E., Harland, R.M., 2002. Convergent extension: the molecular control of polarized cell movement during embryonic development. Developmental cell 2, 695–706. Wang, Y., Janicki, P., Köster, I., Berger, C.D., Wenzl, C., Großhans, J., Steinbeisser, H., 2008. Xenopus Paraxial Protocadherin regulates morphogenesis by antagonizing Sprouty 878–883. Wang, Y., Steinbeisser, H., 2009. Molecular basis of morphogenesis during vertebrate gastrulation. Cellular and molecular life sciences: CMLS 66, 2263–73. Ware, S.M., Harutyunyan, K.G., Belmont, J.W., 2006. Heart defects in X-linked heterotaxy: evidence for a genetic interaction of Zic3 with the nodal signaling pathway. Developmental dynamics : an official publication of the American Association of Anatomists 235, 1631–7. Weaver, C., Farr, G.H., Pan, W., Rowning, B. a, Wang, J., Mao, J., Wu, D., Li, L., Larabell, C. a, Kimelman, D., 2003. GBP binds kinesin light chain and translocates during cortical rotation in Xenopus eggs. Development (Cambridge, England) 130, 5425–36. Weaver, C., Kimelman, D., 2004. Move it or lose it: axis specification in Xenopus. Development (Cambridge, England) 131, 3491–9. Webb, S.E., Miller, A.L., 2006. Ca2+ signaling and early embryonic patterning during the blastula and gastrula periods of zebrafish and Xenopus development. Biochimica et biophysica acta 1763, 1192–208. White, P.H., Chapman, D.L., 2005. Dll1 is a downstream target of Tbx6 in the paraxial mesoderm. Genesis (New York, N.Y.: 2000) 42, 193–202. Winklbauer, R., Medina, a, Swain, R.K., Steinbeisser, H., 2001. Frizzled-7 signalling controls tissue separation during Xenopus gastrulation. Nature 413, 856–60. Wittenberger, T., Steinbach, O.C., Authaler, a, Kopan, R., Rupp, R. a, 1999. MyoD stimulates delta-1 transcription and triggers notch signaling in the Xenopus gastrula. The EMBO journal 18, 1915–22. Wolpert, L., Jessell, T., Lawrence, P.A., Meyerowitz , E., Robertson, E.J., und Smith, J. (2007). Principles of Development, Third Edition. Spektrum 125 Literaturverzeichnis Xu, X., Qiao, W., Li, C., Deng, C., 2002. Generation of Fgfr1 Conditional Knockout Mice 86, 85–86. Yamaguchi, T.P., Harpal, K., Henkemeyer, M., Rossant, J., 1994. Fgfr-1 Is Required for Embryonic Growth and Mesodermal Patterning During Mouse Gastrulation. Genes & development 8, 3032–44. Yamauchi, H., Miyakawa, N., Miyake, A., Itoh, N., 2009. Fgf4 is required for left-right patterning of visceral organs in zebrafish. Developmental biology 332, 177–85. Yan, Y.-T., Gritsman, K., Ding, J., Burdine, R.D., Corrales, J.D., Price, S.M., Talbot, W.S., Schier, a. F., Shen, M.M., 1999. Conserved requirement for EGF-CFC genes in vertebrate left-right axis formation. Genes & Development 13, 2527–2537. Yoder, B.K., 2002. The Polycystic Kidney Disease Proteins, Polycystin-1, Polycystin-2, Polaris, and Cystin, Are Co-Localized in Renal Cilia. Journal of the American Society of Nephrology 13, 2508–2516. Yoshiba, S., Shiratori, H., Kuo, I.Y., Kawasumi, A., Shinohara, K., Nonaka, S., Asai, Y., Sasaki, G., Belo, J.A., Sasaki, H., Nakai, J., Dworniczak, B., Ehrlich, B.E., Pennekamp, P., Hamada, H., 2012. Cilia at the node of mouse embryos sense fluid flow for left-right determination via Pkd2. Science (New York, N.Y.) 338, 226–31. Yu, X., Ng, C.P., Habacher, H., Roy, S., 2008. Foxj1 transcription factors are master regulators of the motile ciliogenic program. Nature genetics 40, 1445–53. Zhang, J., Houston, D.W., King, M.L., Payne, C., Wylie, C., Heasman, J., 1998. The role of maternal VegT in establishing the primary germ layers in Xenopus embryos. Cell 94, 515–24. Zhang, J., King, M.L., 1996. Xenopus VegT RNA is localized to the vegetal cortex during oogenesis and encodes a novel T-box transcription factor involved in mesodermal patterning. Development (Cambridge, England) 122, 4119–29. 126 Lebenslauf Curriculum vitae Persönliche Daten Nachname: Schneider Vorname: Isabelle Janina Nationalität: deutsch Geburtstag und-ort: 29.11.1982, Stuttgart Familienstand: ledig Schulische und universitäre Ausbildung Seit 2008: Doktorarbeit an der Universität Hohenheim Institut für Zoologie, Prof. Dr. Martin Blum 2002-2008: Studium der Biologie an der Universität Hohenheim Hauptfach: Zoologie 1.Nebenfach: chemische Ökologie 2.Nebenfach: Tierphysiologie Abschluss: Diplom, Note: 1,5 1993-2002: Max-Born-Gymnasium Backnang Abschluss: Abitur, Note: 2,5 Fähigkeiten Technische Fähigkeiten: DNA-/RNA-Präparation, PCR, Klonierung, in-situ-Hybridisierung, Immunohistochemie, Mikrochirugie/ Transplantation (Xenopus), Mikroinjektion (Xenopus), systemische Inkubationen (Xenopus) , konfokale Laser-Scanning-Mikroskopie, Rasterelektronenmikroskopie Sprachkenntnisse: Englisch Französisch IT- Kenntnisse: MS-Office XP (Word, Excel, PowerPoint), Adobe Photoshop, Adobe Illustrator, AxioVision, Image J, Programmiersprache R 127 Lebenslauf Wissenschaftlichen Konferenzen & Weiterbildung „International Joint Meeting of German Society for Cell Biology and Society for Developmental Biology” Heidelberg, 20.03.-23.03.2013 „Cell Biology shapes the Embryo”, 13th DGZ Young Scientist Meeting“ Jena, 20.09.-22.09.2012 „14th International Xenopus Conference” Giens Peninsula, Frankreich, 09.09.-13.09.2012 „Cell and developmental biology of Xenopus” Cold Spring Harbor, Vereinigte Staaten, 09.04.-20.04.2010 „German-Italian Xenopus Meeting” Villa Vigoni, Italien, 26.10.-29.10.2009 „18. Wissenschaftliche Tagung der Gesellschaft für Entwicklungsbiologie“ Hannover, 25.03.-28.03.2008 Publikationen Walentek, P., Schneider, I., Schweickert, A., Blum, M., 2013. Wnt11b Is Involved In Cilia- Mediated Symmetry Breakage During Xenopus Left Right Development. PLoS ONE 8, e73646. Beyer, T., Danilchik, M., Thumberger, T., Vick, P., Tisler, M., Schneider, I., Bogusch, S., Andre, P., Ulmer, B., Walentek, P., Niesler, B., Blum, M., Schweickert, A., 2012. Serotonin signaling is required for Wnt-dependent GRP specification and leftward flow in Xenopus. Current biology: CB 22, 33–9. Schweickert, A., Vick, P., Getwan, M., Weber, T., Schneider, I., Eberhardt, M., Beyer, T., Pachur, A., Blum, M., 2010. The nodal inhibitor coco is a critical target of leftward flow in Xenopus. Current biology: CB 20, 738–43. 128 Danksagung Meinem Doktorvater Prof. Dr. Martin Blum möchte ich an allererster Stelle danken: für die Überlassung dieses interessanten Themas, seine Begeisterungsfähigkeit, die Möglichkeit während meiner Doktorarbeit an Konferenzen teilzunehmen, seine Unterstützung bei der Erstellung dieser Arbeit und den Freiraum beim Forschen. Prof. Dr. Breer möchte ich für die Bereitschaft zur Begutachtung dieser Arbeit danken. Prof. Doz. Dr. Axel Schweickert möchte ich sehr herzlich für seine unablässige Hilfsbereitschaft, seine wertvolle Kritik und seine stützende Funktion im Labor danken. Ausdrücklich möchte ich mich bei Bärbel Ulmer und Peter Walentek bedanken. Für die anregenden Diskussionen, die wertvollen Ratschläge, die tolle Hilfe und die schöne Zeit, die mir immer in Erinnerung bleiben wird. Bärbel Ulmer gilt mein größter Dank. Sie hat mich von Anfang an begleitet, bestärkt und ich danke ihr für ihre beständige Bereitschaft zu konstruktiver Kritik aber vor allem für ihre Freundschaft. Ganz herzlich bedanken möchte ich mich bei allen aktuellen und ehemaligen Kollegen. Für die nette Atmosphäre und die schöne Zeit im oder auch außerhalb des Labors. Tina Beyer danke ich darüber hinaus, für die Vielzahl an Dingen, die ich von ihr lernen konnte und ihre umfassende und freundschaftliche Unterstützung. Thomas Thumberger danke ich für seine Hilfe bei technischen Fragen und seine große Unterstützung bei der Analyse des „flows“. Anja Bühler, Anna Iwanska und Anna Schäfer möchte ich überdies für ihre Hilfsbereitschaft danken. Besonders bedanken möchte ich mich auch bei Silke Schmalholz und Susanne Bogusch für ihre aufbauende Art und ihre fabelhafte Hilfe. Bei Kerstin Feistel möchte ich mich zudem für ihren fachlichen Rat bedanken. Ein großer Dank geht außerdem an Paul Brekner, Norbert Kretschmer, Dennis Shcherbakov, Silke Schmalholz und Annegret Bäuerle für die Hilfe im Tierhaus, die technische Unterstützung oder den administrativen Beitrag. Danke auch an all denjenigen, die mir auf vielfältige Weise zur Seite gestanden sind. Nicht zu vergessen meine Freunde: herzlich und großen Dank für den jahrelangen Rückhalt und für die erholsamen Stunden, insbesondere an Franziska Eisenbeiss. Meinen Eltern danke ich zutiefst, dass sie immer für mich da sind. Ebenso meinen Geschwistern Ines, Ivonne, Jasmin und Marius, die mir unglaublich den Rücken gestärkt haben und auf die ich mich immer verlassen kann. Danke für Alles Zuletzt danke ich Sven und dem Frosch für ihre Gesellschaft. An Sven ein besonders großes und herzliches Dankeschön für seine Fürsorge, Geduld, Aufmerksamkeit und seine beruhigende Art, die mir vieles einfacher gemacht hat. 129 Eidesstattliche Versicherung gemäß § 7 Absatz 7 der Promotionsordnung der Universität Hohenheim zum Dr. rer. nat. 1. Bei der eingereichten Dissertation zum Thema “Multiple Funktionen des FGF-Signalwegs regulieren die Lateralitätsentwicklung im Krallenfrosch Xenopus „ handelt es sich um meine eigenständig erbrachte Leistung. 2. Ich habe nur die angegebenen Quellen und Hilfsmittel benutzt und mich keiner unzulässigen Hilfe Dritter bedient. Insbesondere habe ich wörtlich oder sinngemäß aus anderen Werken übernommene Inhalte als solche kenntlich gemacht. 3. Ich habe nicht die Hilfe einer kommerziellen Promotionsvermittlung oder -beratung in Anspruch genommen. 4. Die Bedeutung der eidesstattlichen Versicherung und der strafrechtlichen Folgen einer unrichtigen oder unvollständigen eidesstattlichen Versicherung sind mir bekannt. Die Richtigkeit der vorstehenden Erklärung bestätige ich: Ich versichere an Eides Statt, dass ich nach bestem Wissen die reine Wahrheit erklärt und nichts verschwiegen habe. Stuttgart, den 02.12.2013