Kindliches Neuroblastom
Werbung

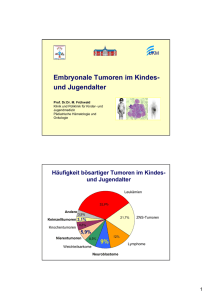
Quelle: Wittmann/SPL/Agentur Focus Kindliches Neuroblastom Auf der Suche nach der besten Therapie Jedes Jahr erkranken in Deutschland etwa 140 Kinder an Neuroblastom, einem Tumor des sympathischen Nervensystems. Doch bei vielen Kindern im ersten Lebensjahr bildet sich der Krebs spontan zurück, manchmal bereits nach wenigen Wochen, manchmal erst nach anderthalb Jahren. Der behandelnde Arzt befindet sich damit in einem Dilemma: Soll er schnell mit einer Chemotherapie beginnen – oder abwarten, ob der Tumor von sich aus regrediert? Große Hoffnungen werden in die Erforschung der genetischen Pathogenese des Neuroblastoms und in Behandlungsstudien gesetzt. Es zeigt sich, dass die Genetik ein unverzichtbares Hilfsmittel ist, um die Patienten in Erkrankungsstadien einzuteilen und daraus die optimale Behandlungsstrategie abzuleiten. Ein embryonaler Tumor Beim Neuroblastom handelt es sich um den häufigsten extrakraniellen soliden Tumor bei Kindern unter 15 Jahren mit einer jährlichen Inzidenzrate von 1,3 pro 100 000 Kinder. Das durchschnittliche Erkrankungsalter liegt bei zwei Jahren [1], wobei 90 Prozent der Kinder in den ersten fünf Lebensjahren diagnostiziert werden [2]. Jungen sind etwas häufiger betroffen als Mädchen. Das Neuroblastom macht Pädiatrix 9/2008 rund acht Prozent aller Krebsarten im Kindesalter aus und ist für etwa 15 Prozent der Todesfälle durch Krebserkrankungen bei Kindern verantwortlich [1]. Als ein embryonaler Tumor besteht er aus undifferenzierten neuroektodermalen Zellen des Neuralrohres, Vorläuferzellen von Ganglienzellen oder Zellen des Nebennierenmarks [2]. Charakteristischerweise sind die Neuroblasten des Tumors histologisch nicht zu unterscheiden von sich entwickelnden Neuroblasten im Embryo [2]. Dies ist ein Hinweis darauf, dass bei diesen Zellen der Differenzierungsschritt zur reifen Nervenzelle nicht stattgefunden hat. Genetische Ursachen Eine Schlüsselrolle spielt beim Neuroblastom das MYCN-Onkogen, das sowohl an der Steuerung der ungebremsten Zellvermehrung als auch an der Induktion des Zelltods beteiligt ist. Das MYCN-Gen, das im Embryo fast ubiquitär transkribiert, nach der Geburt jedoch normalerweise nicht mehr exprimiert wird, kodiert für Wachstumsfaktoren. Es ist denkbar, dass die Überflutung mit diesen Faktoren entscheidend zur Tumorentstehung beiträgt [2]. Eine hohe MYCN-Amplifikation, die teilweise bis zu mehrere hundert Genkopien umfasst, findet sich be- von Regina Naumann Neuroblastom 16 sonders in Tumorzellen höheren Stadiums. Sie ist signifikant für aggressives Tumorwachstum und führt in allen Stadien zu einer schlechteren Prognose (siehe Abbildung 1). An der Tumorentstehung sind offenbar auch Deletionen an verschiedenen Chromosomen beteiligt. So wurden beispielsweise Verluste im Bereich des kurzen Arms an Chromosom 1 (1p36.2-36.3) nachgewiesen, wodurch Tumorsuppressorgene verloren zu gehen scheinen [1]. Häufig Zufallsbefund Das Neuroblastom hat hohe Remissionsraten. Vor allem in den niedrigen Stadien eins bis drei der Erkrankung (Stadieneinteilung nach International Neuroblastoma Staging System INSS) werden viele Neuroblastome nur durch Zufall entdeckt, da sie kaum Beschwerden verursachen. Sie entstehen aus sympathischem Nervengewebe und können deshalb überall dort auftreten, wo sich sympathisches Gewebe befindet: Nebennieren, zervikaler, thorakaler und abdominaler Grenzstrang sowie in den Paraganglien. Etwa die Hälfte aller Neuroblastome hat bei Diagnosestellung bereits Metastasen entwickelt, die in Lymphknoten, Knochenmark, Knochen, Leber oder Haut gefunden werden, seltener im Zentralnervensystem, sehr selten in der Lunge [3]. Die Beschwerden sind sehr vielfältig: von unspezifischen Schmerzen, Fieber und Gewichtsverlust vor allem bei bereits metastasiertem Neuroblastom zu charakteristischen Leitsymptomen, die schon deutliche Hinweise auf die Erkrankung und den Sitz des Primärtumors geben können (siehe Kasten). Zur Diagnose des Neuroblastoms bietet sich neben bildgebenden Verfahren (Sonogra- Leitsymptome des Neuroblastoms – Parese in den unteren Gliedmaßen aufgrund eines paraspinal gelegenen Tumors – Starke, behandlungsresistente Diarrhöen, die durch Produktion von vasoaktiven intestinalen Peptiden durch den Tumor hervorgerufen werden – Bei 15 bis 20 Prozent aller zervikalen Tumore wird ein Horner-Syndrom beobachtet, das durch Befall von zervikalen sympathischen Ganglien entsteht [3]. – Zerebellare Störungen wie schnelle, zufällige Augenbewegungen (Opsoklonus), zerebellare Ataxie oder myoklonische Reflexe – Intrathorakale Tumore machen sich durch Luftnot bemerkbar, abdominelle Tumore durch Harnabflussstörungen bis hin zur Hydronephrose. Bei Tumoren des Grenzstranges können neurologische Symptome bis zum Querschnitt auftreten. – Störungen durch Übersekretion von Katecholaminen rufen übermäßiges Schwitzen, Hochdruck oder Hitzewallungen hervor. fie, Kernspintomografie) die Suche nach Tumormarkern an. Katecholaminmetabolite wie Homovanillinmandelsäure und Vanillinmandelsäure in Serum und – sensitiver – im Urin werden bei bis zu 90 Prozent der kleinen Patienten schon in frühen Stadien gefunden [1]. Ein weiterer wichtiger Tumormarker ist die neuronenspezifische Enolase (NSE). Abbildung 1: Stadiumabhängige Überlebensraten mit und ohne MYCNAmplifikation bei 1706 Patienten mit Neuroblastom Quelle: modifiziert nach The Lancet Oncology, Vol. 4, August 2003 Pädiatrix 9/2008 17 Nach der Diagnose „Neuroblastom“ ist das weitere therapeutische Vorgehen alles andere als einfach. Bei keinem anderen Tumor liegen rasantes, zerstörerisches Wachstum und völlige Remission so nahe beieinander wie beim Neuroblastom. Die Chance auf eine Spontanremission – hauptsächlich bei Kindern unter einem Jahr – ist beim Neuroblastom zwischen zehn und 100 Mal höher als bei jedem anderen menschlichen Tumor [2]. Und auch ein dritter Entwicklungsweg ist möglich, wenn auch deutlich seltener als die Rückbildung: die Reifung von Neuroblastomgewebe in ein gutartiges Ganglioneurom. Allerdings ist die Umbildung in ein Ganglioneurom, wenn sie nach einer Chemotherapie stattfindet, nur unvollständig [2]. Screening – ja oder nein? Mit den Metaboliten des Katecholamins und der neuronenspezifischen Enolase stehen Tumormarker zur Diagnose des Neuroblastoms zur Verfügung. Es läge nahe, diese für ein Neuroblastom-Screening einzusetzen, um den Tumor möglichst frühzeitig erkennen und behandeln zu können. So fanden sich in Gebieten, in denen in den 1990er Jahren Screeningprogramme durchgeführt wurden, regelmäßig zwei bis drei Mal höhere Inzidenzen als üblich. Allerdings ist der Nutzen eines solchen Screenings umstritten. Gerade bei der hohen Remissionsrate bei Neuroblastom kann man davon ausgehen, dass viele Tumore unentdeckt verschwinden würden und in diesen Fällen eine Chemotherapie nach Diagnosestellung ein unnötiges Gesundheitsrisiko darstellt. Zwei Befunde sprechen dafür, dass in den ersten Lebensmonaten eine deutliche Regulation stattfindet mit dem Ziel, Neuroblastomzellen zu eliminieren [4]. Zum einen besteht die hohe Remissionsrate bei 4SNeuroblastomen (s. u.), zum anderen findet sich bei Autopsien von Neugeborenen eine hohe Anzahl von neuroblastischen Zellresten, die nicht zu unterscheiden sind von Neuroblastomzellen. Prof. Frank Berthold am Zentrum für Kinderheilkunde und Jugendmedizin der Universitätsklinik Köln bezieht zum Screening klar Stellung: „Wir halten davon nichts.“ Der Grund hierfür liegt auch in den Ergebnissen der prospektiven Studien (NB95-S und NB97), in denen Berthold mit seiner Arbeitsgruppe nachgewiesen hat, dass bei 93 Patienten im AlPädiatrix 9/2008 Neuroblastom Ein unberechenbarer und rätselhafter Tumor ter unter einem Jahr, deren großer Resttumor nicht operiert worden war, 44 eine Spontanremission erlebten, 28 eine lokale Progression, sieben eine Progression zu Stadium 4S und vier eine Progression zu Stadium 4 [4]. Ärzte und Eltern mussten dabei allerdings zum Teil große Geduld aufbringen: Die ersten Regressionszeichen waren bei einigen Patienten erst nach 18 Monaten zu sehen. Aus den Studienergebnissen zieht Berthold folgendes Fazit: „Möglichst wenig therapieren. Bei Patienten im ersten Lebensjahr ohne MYCN-Amplifikation ist auch im Stadium 3 eine beobachtende Wait-and-seeStrategie gerechtfertigt.“ Abbildung 2: Neuroblastomzellen (violett), infiltriert in Knochenmark Quelle: Universitätsklinik Köln Einschätzung des Krankheitsverlaufs Wird sich das neu diagnostizierte Neuroblastom zurückbilden? Oder wird es aggressiv wachsen? Für die Therapie wäre es extrem wichtig, möglichst genaue Vorhersagen oder zumindest Abschätzungen machen zu können. Nur so kann bei diesem schwer einschätzbaren Tumor schnell eine effektive Behandlung begonnen und umgekehrt eine gefährliche Übertherapie verhindert werden. Doch da auch Ärzte bislang kaum die Entwicklung vorhersagen können, bleiben nur Annäherungen – und das Bemühen, diese immer weiter zu verbessern. Drei sehr wichtige Hilfsmittel bei der Einschätzung des Krankheitsverlaufs sind das Krankheitsstadium, das Alter des Patienten und die genetische Analyse. Die Einteilung der Stadien erfolgt nach dem International Neuroblastoma Staging System (INSS) in die Stadien 1 bis 4 sowie 4S, ein Sonderstadium für Säuglinge unter einem Jahr (siehe Abbildung 1). In den Stadien 1 bis 3 und 4S sind die Prognosen deutlich besser als im Stadium 4. So liegen die Fünfjahres-Überlebensraten, die in den Behandlungsstudien NB 79 bis NB 97 erreicht wurden, in den Stadien 1 bis 3 bei 87 (±1) Prozent, im Stadium 4S bei 82 (±3) Prozent und im Stadium 4 bei 30 (±2) Prozent [5]. Bei Diagnosestellung hat die Hälfte der Neuroblastome bereits metastasiert. 18 Neuroblastom Von Gen-Chips die Zukunft ablesen Aggressive Tumore unterscheiden sich genetisch von benignen, davon sind die Neuroblastomforscher überzeugt. Am Deutschen Krebsforschungszentrum in Heidelberg (DKFZ) entwickelt die Arbeitsgruppe um Prof. Manfred Schwab deshalb einen Gen-Chip, mit dem es möglich werden soll, im klinischen Alltag aggressive Tumoren von denjenigen zu unterscheiden, die einen gutartigen Verlauf nehmen und regredieren [6]. Die Wissenschaftler ermittelten 144 Gene, deren Aktivität charakteristisch für den Verlauf der Erkrankung ist. Einige dieser Gene sind eher bei einem bösartigen Neuroblastom aktiv, andere werden in gutartigen Tumoren stärker abgelesen. Mithilfe eines GenChips können die Wissenschaftler nun Tumorproben auf diese Genaktivitäten hin untersuchen und den weiteren Verlauf der Erkrankung abschätzen. Der Gentest kann auch Patienten herausfiltern, die aufgrund der Klinik bisher nicht behandelt worden wären, obwohl es sich in Wirklichkeit um eine Tumorerkrankung hanRZ_Medizin09_Anz_Pädiatrix_210x149 16.10.2008 16:45 Uhr Seite 1 delt, die bösartig verläuft und die behandlungsbedürftig ist. Eine rechtzeitige Therapie kann in diesen Fällen lebensrettend sein. „Wir können mit einer Genauigkeit von 93 Prozent vorhersagen, wie sich die Krankheit entwickelt. Das ist mit anderen Methoden nicht möglich“, so Dr. Frank Westermann vom DKFZ. „Und wenn wir eines Tages besser verstehen, welche Signalwege kaputt sind, können wir gezielt Reparaturmöglichkeiten entwickeln.“ Literatur 1. Kramps CM: Neue Zielgene des Transkriptionsfaktors E2F-1 und die transkriptionelle Regulation des MYCN Onkogens im humanen Neuroblastom. Dissertation. Philipps-Universität Marburg 2007 2. Schwab M et al.: Neuroblastoma: biology and molecular and chromosomal pathology. Lancet Oncol. 2003 Aug; 4(8): 472-480 3. AWMF Leitlinien Nr. 025/008: Neuroblastom 4. Hero B et al.: Localized infant neuroblastomas often show spontaneous regression: results of the prospective trials NB95-S and NB97. J Clin Oncol. 2008 Mar 20; 26(9): 1504-1510 5. Berthold F: Neuroblastom. In: Seeber S, Schütte J: Therapiekonzepte Onkologie. (4.Auflage) Springer-Verlag GmbH, Heidelberg 2003 6. Oberthuer A et al.: Customized oligonucleotide microarray gene expression-based classification of neuroblastoma patients outperforms current clinical risk stratification. J Clin Oncol. 2006 Nov 1; 24(31): 5070-5078 Auszug aus dem Kongressprogramm MEDIZIN 2009: Akupunktur-Einführungskurs Fit für den Notfall Cardiopulmonale Reanimation einschließlich Defibrillation Arzneimittelwechselwirkungen Die genetische Suszeptibilität als Ursache individ. Toleranz von Pharmaka und Xenobiotika Fußgesundheit – Prävention und Therapie Urologie „Aktuell“ Update Allergie bei Kindern und Jugendlichen Hämatologische Probleme in der Praxis Differentialdiagnose Beinschmerzen Prävention in der Medizin Update Kardiologie Update Neurologie MESSE STUTTGART | 30.01. – 01. 02.2009 www.medizin-stuttgart.de