TILI-PUREN® Tropfen
Werbung

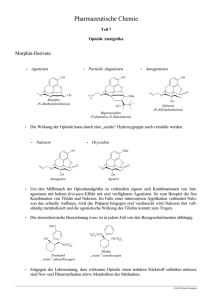
FI-271-03/06 Fachinformation TILI-PUREN® Tropfen 1. Bezeichnung des Arzneimittels TILI-PUREN® Tropfen Wirkstoffe: Tilidinhydrochlorid und Naloxonhydrochlorid 2. Verschreibungsstatus/Apothekenpflicht Verschreibungspflichtig 3. Zusammensetzung des Arzneimittels 3.1. Stoff- oder Indikationsgruppe Kombination aus einem stark wirksamen Analgetikum aus der Gruppe der Opioide und einem Opioid-Antagonisten 3.2. Bestandteile nach der Art und arzneilich wirksame Bestandteile nach Art und Menge - arzneilich wirksame Bestandteile 0,72 ml Lösung zum Einnehmen (ca. 20 Tropfen) enthalten: 51,45 mg Tilidinhydrochlorid 0,5 H2O (entsprechend 50 mg Tilidinhydrochlorid) und 4,40 mg Naloxonhydrochlorid 2 H2O (entsprechend 4 mg Naloxonhydrochlorid). - sonstige Bestandteile Ethanol, Salzsäure, gereinigtes Wasser 4. Anwendungsgebiete Starke und sehr starke Schmerzen. 5. Gegenanzeigen ® TILI-PUREN Tropfen dürfen nicht angewendet werden bei: − Allergie gegen Tilidin, Naloxon oder einen der sonstigen Bestandteile sowie bei − Abhängigkeit von Opiaten (Heroin, Morphin) oder Opioiden wegen der Gefahr einer akuten Entzugssymptomatik. ® TILI-PUREN Tropfen sollten nicht eingenommen werden bei anderen Abhängigkeitserkrankungen (s. Ziffer 8 "Warnhinweise"). ® TILI-PUREN Tropfen dürfen Kindern unter 2 Jahren nicht gegeben werden, da keine ausreichenden Erfahrungen vorliegen. Anwendung in der Schwangerschaft und Stillzeit ® TILI-PUREN Tropfen dürfen in der Schwangerschaft nur bei strenger Indikation verabreicht werden. Ist in der Stillzeit eine Behandlung unbedingt erforderlich, sollte nicht gestillt werden. ® KSt 21.04.06 TILI-PUREN Tropfen, Lsg. z. Einn. Zul.-Verl. v. 19.08.2002, Mustertext fi3800ax.rtf v. 18.06.1999 Seite 1 von 5 FI-271-03/06 6. Nebenwirkungen Gelegentlich treten Schwindel, Benommenheit, Übelkeit und Erbrechen auf. Diese Symptome können verstärkt unter körperlicher Belastung auftreten. Es ist dem Patienten deshalb zu empfehlen, sich nicht körperlich anzustrengen und sich bei Schwindelgefühl hinzulegen. Hinweis für Verkehrsteilnehmer und das Bedienen von Maschinen ® TILI-PUREN Tropfen können Aufmerksamkeit und Reaktionsvermögen so weit beeinträchtigen, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen nicht mehr gegeben ist. Eine verstärkte Beeinträchtigung ist insbesondere bei Behandlungsbeginn, Dosiserhöhung, Präparatewechsel sowie im Zusammenwirken mit Alkohol oder der Einnahme von Beruhigungsmitteln zu erwarten. Die Entscheidung trifft in jedem Einzelfall der behandelnde Arzt. Bei stabiler Therapie ist ein generelles Fahrverbot nicht zwingend erforderlich. 7. Wechselwirkungen mit anderen Mitteln ® Bei gleichzeitiger Einnahme von TILI-PUREN Tropfen und Alkohol oder Beruhigungsmitteln kommt es zu einer gegenseitigen Verstärkung und Verlängerung der Wirkungen auf das Zentralnervensystem. ® TILI-PUREN Tropfen sollen nicht mit anderen Opioiden kombiniert werden, da die resultierende Wirkung aufgrund von Wechselwirkungen nicht abgeschätzt werden kann. Bei Gabe weiterer ZNS-depressiver Arzneimittel ist in Einzelfällen eine Apnoe nicht auszu-schließen. 8. Warnhinweise ® TILI-PUREN Tropfen enthalten 11,9 Vol.-% Alkohol (Ethanol). Bei Arzneimitteln mit Wirkung auf das ZNS besteht grundsätzlich die Gefahr der missbräuchlichen ® Verwendung. Vor der Verschreibung von TILI-PUREN Tropfen an Patienten, die bereits von einem Pharmakon abhängig sind oder es waren oder die zu Arzneimittelmissbrauch neigen, sollte deshalb ® die Indikationsstellung sorgfältig geprüft und die Verabreichung von TILI-PUREN Tropfen gewissenhaft überwacht werden. Vor jedem Missbrauch von TILI-PUREN® Tropfen durch Drogenabhängige wird dringend gewarnt! ® Bei Opiatabhängigen, die als Ersatz für Opiate wie Morphin oder Heroin TILI-PUREN Tropfen in ® hoher Dosis missbräuchlich einnehmen, lösen TILI-PUREN Tropfen akute Entzugserscheinungen aus oder verstärken bereits bestehende Entzugserscheinungen. ® TILI-PUREN Tropfen sind nicht zur Entzugsbehandlung geeignet! Die Lösung ist zur oralen Anwendung bestimmt. Sie ist nicht für eine Injektion geeignet! Nach einer derartigen Fehlanwendung können die nachfolgenden Entzugserscheinungen so stark sein, dass lebensbedrohliche Komplikationen auftreten, z. B. Blutdruckkrisen, Kreislaufversagen. 9. Wichtigste Inkompatibilitäten Bisher keine bekannt. 10. Dosierung mit Einzel- und Tagesgaben ® Erwachsene und Jugendliche ab 14 Jahren nehmen als Einzeldosis 20 - 40 Tropfen TILI-PUREN Tropfen ein. Die Tageshöchstdosis beträgt im Allgemeinen 4-mal 40 Tropfen. Kinder unter 14 Jahren erhalten bis zu 4-mal täglich 1 Tropfen pro Lebensjahr, wobei als Einzeldosis nicht weniger als 3 Tropfen gegeben werden sollten. ® KSt 21.04.06 TILI-PUREN Tropfen, Lsg. z. Einn. Zul.-Verl. v. 19.08.2002, Mustertext fi3800ax.rtf v. 18.06.1999 Seite 2 von 5 FI-271-03/06 ® Ein Tropfen TILI-PUREN Tropfen enthält 2,5 mg Tilidinhydrochlorid und 0,2 mg Naloxonhydrochlorid; die durchschnittliche Tageshöchstdosis für Erwachsene beträgt 400 mg Tilidinhydrochlorid und 32 mg Naloxonhydrochlorid. Für die Anwendung bei Kindern unter 2 Jahren liegen keine ausreichenden Erfahrungen vor. 11. Art und Dauer der Anwendung Die Lösung zum Einnehmen wird zusammen mit etwas Flüssigkeit eingenommen. Zur Entnahme die Tropf-flasche senkrecht nach unten halten. Die Lösung zum Einnehmen darf nicht injiziert werden (s. Ziffer 8 "Warnhinweise")! Für die Behandlung akuter Schmerzzustände genügt oftmals eine einmalige Gabe. Gegebenenfalls ® können TILI-PUREN Tropfen mehrmals, auch über mehrere Tage angewendet werden. Grundsätzlich sollte die kleinste analgetisch wirksame Dosis gewählt werden. Bei der Therapie chronischer Schmerzen ist der Dosierung nach einem festen Zeitplan der Vorzug zu geben. Die empfohlene Tagesdosis kann dabei auf bis zu 600 mg Tilidinhydrochlorid gesteigert werden. 12. Notfallmaßnahmen, Symptome und Gegenmittel a) Symptome der Intoxikation ® Zeichen einer Überdosierung von TILI-PUREN Tropfen sind Schwindelgefühl, Benommenheit, Übelkeit, Erbrechen, Ataxie, psychomotorische Unruhe und Hyperreflexie sowie Hyperventilation und Hypoventilationstetanie. Bei sehr starker Überdosierung kann Atemdepression auftreten. Grundsätzlich sollte an die Möglichkeit einer Mehrfachintoxikation (Alkohol, psychoaktive Substanzen; bei Suizidversuch) gedacht werden. b) Therapie von Intoxikationen Primäre Giftentfernung durch Magenspülung, Resorptionsverminderung durch Kohlegabe, Kreislaufstabilisierung durch Elektrolytinfusionen sowie Verbesserung der Atemfunktion durch Sauerstoff-Inhalationen und kontrollierte Beatmung. Bei exzitatorischen Symptomen Diazepam intravenös in üblicher Dosierung. 13. Pharmakologische und toxikologische Eigenschaften, Pharmakokinetik und Bioverfügbarkeit, soweit diese Angaben für die therapeutische Verwendung erforderlich sind 13.1. Pharmakologische Eigenschaften Tilidin ist ein Prodrug mit schwacher Opioidwirkung. Die eigentliche Wirksubstanz ist Nortilidin. Naloxon ist ein reiner Opioid-Antagonist ohne agonistische Wirkung. Die Kombination aus Tilidin und Naloxon soll unter Beibehalten der analgetischen Wirkung das Missbrauchspotential vermindern. Das Mischungsverhältnis ist dabei so gewählt, dass der NaloxonZusatz die analgetische Wirkung von Tilidin nicht beeinträchtigt. Bei Verwendung unzulässig hoher Dosen durch Opiatabhängige gelangt aber so viel Naloxon in den Organismus, dass ein Abstinenzsyndrom hervorgerufen werden kann. 13.2. Toxikologische Eigenschaften a) Akute Toxizität Untersuchungen zur akuten Toxizität der kombinierten Wirkstoffe wurden im Verhältnis 50:4 (Tilidin/Naloxon) an Ratten und Mäusen durchgeführt. Klinische Symptome waren vor allem tonischklonische Krämpfe, Zyanose, Schnappatmung, Ataxie, Exophthalmus, Tremor, Stellreflexverlust und Straub'sches Schwanzphänomen. ® KSt 21.04.06 TILI-PUREN Tropfen, Lsg. z. Einn. Zul.-Verl. v. 19.08.2002, Mustertext fi3800ax.rtf v. 18.06.1999 Seite 3 von 5 FI-271-03/06 b) Chronische Toxizität Ratten und Hunde wurden 6 Monate lang mit einer Kombination von Tilidinhydrochlorid und Naloxon p.o. behandelt. Bei Ratten traten in hohen Dosierungen erhöhte Lebergewichte auf sowie Verfettungen der Leberzellen und des Nierenkanälchenepithels. c) Mutagenes und tumorerzeugendes Potential Untersuchungen zur Mutagenität von Tilidin im Ames-Test und in einer Zytogenetikstudie an Knochenmarkszellen von Ratten verliefen negativ. Naloxon wurde einer umfassenden Mutagenitätsprüfung unterzogen. Aufgrund der Ergebnisse sind mutagene Wirkungen beim Menschen nach therapeutischer Anwendung von Naloxon hinreichend sicher auszuschließen. Untersuchungen zum tumorerzeugenden Potential liegen weder für die Einzelwirkstoffe noch für die Kombination von Tilidin und Naloxon vor. d) Reproduktionstoxizität Untersuchungen mit der Wirkstoffkombination an trächtigen Ratten und Kaninchen ergaben im maternaltoxischen Bereich der hohen Dosisstufe Hinweise auf eine erhöhte Embryoletalität. Ein Einfluss von Naloxon auf die Fertilität männlicher und weiblicher Ratten war nicht erkennbar. Es liegen keine Untersuchungen zur Kombination vor. Nach Verabreichung von 5 und 40 mg Naloxon pro kg Körpergewicht und Tag während der Embryonalentwicklung bei Ratten traten postnatal Hyperaktivität und zerebrale Veränderungen bei den Jungtieren auf. Kontrollierte Untersuchungen über die Anwendung von Tilidin und Naloxon in Schwangerschaft und Stillzeit beim Menschen liegen nicht vor. 13.3. Pharmakokinetik Tilidin und Naloxon werden nach oraler Gabe rasch resorbiert. Beide Substanzen unterliegen einem ausgeprägtem First-pass-Effekt. Tilidin wird überwiegend zu Nortilidin, der eigentlichen Wirksubstanz, und weiter zu Bis-Nortilidin metabolisiert. Naloxon wird zu dem sehr schwach pharmakologisch wirksamen β-Naloxol metabolisiert, beides wird glukuronidiert. Die analgetische Wirkung tritt nach 10 - 15 Minuten ein . Das Wirkungsmaximum wird nach etwa 25 bis 50 min erreicht (gemessen nach 100 mg Tilidin plus 8 mg Naloxon oral), die Wirkdauer wird mit 4 - 6 Stunden angegeben. Die Eliminationshalbwertzeit beträgt für Nortilidin 3 bis 5 Std. und für Naloxon und seine Metabolite 3 4 Std. Tilidin und Naloxon werden überwiegend metabolisiert renal eliminiert (Tilidin zu 90 %, Naloxon zu über 70 %). Der Rest erscheint in den Fäzes. Nierenfunktionsstörungen können nicht zur Kumulation pharmakologisch aktiver Metabolite führen. Bei Leberfunktionsstörungen ist in Abhängigkeit vom Ausmaß der Einschränkung die Maximalkonzentration von Nortilidin im Plasma geringer als bei Lebergesunden und die Halbwertszeit verlängert. Naloxon, das bei Lebergesunden im Plasma - wenn überhaupt - nur für kurze Zeit in sehr niedrigen Konzentrationen nachweisbar ist, erreicht bei Patienten mit Leberinsuffizienz deutlich höhere Konzentrationen, die mit einer Halbwertszeit von ca. 2 Stunden durch weiteren Metabolismus abklingen. Es ist nicht sicher auszuschließen, dass bei Patienten mit hochgradiger Leberinsuffizienz die Bildung von aktivem Nortilidin so gering sein kann, dass eine ausreichende analgetische Wirkung unter Umständen nicht zu erreichen ist, und dass eine unzureichende Inaktivierung von Naloxon durch Antagonisierung der Nortilidin-Wirkung zu einem weiteren Wirkungsverlust führen kann, der insgesamt eine sinnvolle Therapie derartiger Patienten mit der Kombination in Frage stellt. 13.4 Bioverfügbarkeit Die relative Bioverfügbarkeit nach Einnahme der Lösung zum Einnehmen im Verhältnis zur intravenösen Injektion ist gleich der absoluten systemischen Bioverfügbarkeit, da die eigentlich wirkende Substanz (+)-Nortilidin erst in der Leber bei der ersten Passage gebildet wird. ® KSt 21.04.06 TILI-PUREN Tropfen, Lsg. z. Einn. Zul.-Verl. v. 19.08.2002, Mustertext fi3800ax.rtf v. 18.06.1999 Seite 4 von 5 FI-271-03/06 14. Sonstige Hinweise ® Die Umstellung der Therapie auf TILI-PUREN Tropfen bei Patienten, die bereits Opioide in therapeutischer Dosierung erhalten, erfordert für die empfohlenen Dosierungen keine besonderen Vorsichtsmaßnahmen hinsichtlich des Naloxon-Anteils. 15. Dauer der Haltbarkeit Die Dauer der Haltbarkeit beträgt 2 Jahre. Dieses Arzneimittel soll nach Ablauf des Verfallsdatums nicht mehr angewendet werden. 16. Besondere Lager- und Aufbewahrungshinweise keine 17. Darreichungsformen und Packungsgrößen 50 ml Lösung zum Einnehmen (N2) 100 ml Lösung zum Einnehmen (N3) 18. Stand der Information März 2006 19. Name oder Firma und Anschrift des pharmazeutischen Unternehmers Actavis Deutschland GmbH & Co. KG Elisabeth-Selbert-Str. 1 40764 Langenfeld Telefon: 02173/1674 – 0 Telefax: 02173/1674 – 240 ® KSt 21.04.06 TILI-PUREN Tropfen, Lsg. z. Einn. Zul.-Verl. v. 19.08.2002, Mustertext fi3800ax.rtf v. 18.06.1999 Seite 5 von 5