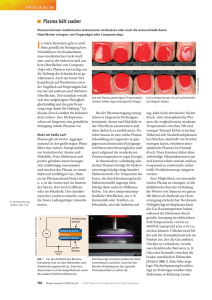
Untersuchungen zur Verteilung ausgewählter Kationen in Plasma
Werbung

Aus dem Zentrum für Lebensmittelwissenschaften Institut für Lebensmitteltoxikologie und Chemische Analytik - Chemische Analytik und Endokrinologie der Tierärztlichen Hochschule Hannover Untersuchungen zur Verteilung ausgewählter Kationen in Plasma und Granula von nativem, embryonierten und lebensmitteltechnologisch verarbeiteten Hühnereigelb INAUGURAL-DISSERTATION Zur Erlangung des Grades einer Doktorin der Veterinärmedizin (Dr. med. vet) durch die Tierärztliche Hochschule Hannover Vorgelegt von Sarina Bäckermann aus Bremen Hannover 2007 wissenschaftliche Betreuung: Univ.- Prof. Dr. W. Ternes 1. Gutachter: Univ.- Prof. Dr. W. Ternes 2. Gutachter: PD Dr. G. Glünder Tag der mündlichen Prüfung: 22.05.2007 Diese Arbeit wurde zum Teil gefördert durch die Fritz Ahrberg Stiftung, Hannover Meiner Familie in Dankbarkeit Inhaltsverzeichnis 1. Einleitung......................................................... 1 2. Schrifttum ........................................................ 5 2.1 Das Hühnerei...............................................................................5 2.1.1 Aufbau des Hühnereies ...............................................................................5 2.1.1.1 Eischale ...................................................................................................... 5 2.1.1.2 Eiklar .......................................................................................................... 5 2.1.1.3 Eigelb.......................................................................................................... 6 2.1.2 Mineralstoffgehalt .....................................................................................11 2.1.3 Technologische Behandlung von Eigelb...................................................15 2.2 2.1.3.1 Gefrieren................................................................................................... 15 2.1.3.2 Zutaten...................................................................................................... 17 2.1.3.3 pH-Wert.................................................................................................... 18 2.1.3.4 Trocknung ................................................................................................ 19 Embryonalentwicklung .............................................................20 2.2.1 Entwicklung des Embryos.........................................................................20 2.2.2 Verbleib der Mineralstoffe während der Embryogenese ..........................22 2.3 Mengenelemente .......................................................................26 2.3.1 2.3.2 Calcium .....................................................................................................26 2.3.1.1 Biologische Bedeutung............................................................................. 26 2.3.1.2 Vorkommen im Ei .................................................................................... 27 Magnesium ................................................................................................29 2.4 Biologische Bedeutung............................................................................. 29 2.3.2.2 Vorkommen im Ei .................................................................................... 30 Spurenelemente .........................................................................31 2.4.1 2.4.2 2.4.3 2.5 2.3.2.1 Eisen ..........................................................................................................32 2.4.1.1 Biologische Bedeutung............................................................................. 32 2.4.1.2 Vorkommen im Ei .................................................................................... 33 Kupfer........................................................................................................36 2.4.2.1 Biologische Bedeutung............................................................................. 36 2.4.2.2 Vorkommen im Ei .................................................................................... 37 Zink ...........................................................................................................38 2.4.3.1 Biologische Bedeutung............................................................................. 38 2.4.3.2 Vorkommen im Ei .................................................................................... 39 Thiamin und seine Phosphatester..............................................40 2.5.1 Chemische Eigenschaften .........................................................................40 2.5.2 Biochemie..................................................................................................41 2.5.3 Thiaminmangel..........................................................................................45 2.5.4 Thiamingehalt in Lebensmitteln ...............................................................46 2.6 2.5.4.1 Allgemein ................................................................................................. 46 2.5.4.2 Thiamin im Ei........................................................................................... 46 Analytische Methoden ..............................................................48 2.6.1 Nachweis von Thiamin..............................................................................48 2.6.2 Elementanalyse mit Atomabsorptionsspektrometrie (AAS).....................55 2.6.2.1 Calcium .................................................................................................... 59 2.6.2.2 Magnesium ............................................................................................... 60 2.6.2.3 Eisen ......................................................................................................... 60 2.6.2.4 Kupfer....................................................................................................... 61 2.6.2.5 Zink .......................................................................................................... 62 3. Material und Methoden.................................. 65 3.1 Behandlung und Fraktionstrennung der Eier............................65 3.1.1 Native Eiproben.........................................................................................65 3.1.2 Eigelbproben mit Zusatz ...........................................................................66 3.1.3 Gefriergetrocknete Eigelbproben mit Zusatz ............................................68 3.1.4 Bruteier......................................................................................................69 3.2 Thiaminanalyse .........................................................................71 3.2.1 Probenmaterial ..........................................................................................71 3.2.2 Probenaufarbeitung ...................................................................................71 3.2.3 3.3 3.2.2.1 Ansetzen der Lösungen ............................................................................ 71 3.2.2.2 Thiaminextraktion .................................................................................... 72 3.2.2.3 Thiaminextraktion aus Plasmaproben ...................................................... 73 3.2.2.4 Thiaminextraktion aus Eiklarproben ........................................................ 74 3.2.2.5 Thiaminextraktion aus Granulaproben..................................................... 74 3.2.2.6 Thiaminextraktion aus Embryoproben..................................................... 75 3.2.2.7 Derivatisierung ......................................................................................... 76 3.2.2.8 Festphasenextraktion ................................................................................ 76 3.2.2.9 Dotierung.................................................................................................. 77 Trennung und Analyse ..............................................................................77 3.2.3.1 Ansetzen der Kalibrierlösungen ............................................................... 77 3.2.3.2 Hochdruckflüssigkeitschromatographie................................................... 77 Mineralstoffanalyse...................................................................79 3.3.1 Chemikalien und Gerätschaften ................................................................79 3.3.2 Probenmaterial ..........................................................................................79 3.3.3 Säureaufschluss .........................................................................................80 3.3.4 Analyse mit Flammen-Atomabsorptionsspektrometrie ............................81 3.3.5 3.3.6 3.4 Apparatur.................................................................................................. 82 3.3.4.2 Ansetzen der Lösungen ............................................................................ 83 3.3.4.3 Bestimmung von Calcium in Granula, Plasma und Eiklar....................... 83 3.3.4.4 Bestimmung von Magnesium in Granula, Plasma und Eiklar ................. 86 3.3.4.5 Bestimmung des Eisengehaltes in der Granulafraktion ........................... 88 3.3.4.6 Bestimmung von Zink in Granula, Plasma und Eiklar............................. 89 3.3.4.7 Bestimmung von Zink in gefriergetrockneten Proben ............................. 91 3.3.4.8 Bestimmung von Zink in nativen Eigelbproben mit Zusatz..................... 91 Analyse mit Graphitrohr-Atomabsorptionsspektrometrie ........................93 3.3.5.1 Apparatur.................................................................................................. 93 3.3.5.2 Ansetzen der Lösungen ............................................................................ 93 3.3.5.3 Kupfer....................................................................................................... 93 3.3.5.4 Eisen ......................................................................................................... 94 Analyse mit ICP-Spektrometrie ................................................................95 Trockenmassebestimmung........................................................96 3.4.1 3.5 3.3.4.1 Analyse......................................................................................................96 Rasterelektronenmikroskopie ...................................................98 3.5.1 Probenvorbereitung ...................................................................................98 3.5.2 Analyse......................................................................................................99 3.6 Statistische Auswertung............................................................99 4. Ergebnisse .................................................... 101 4.1 Thiamin ...................................................................................101 4.1.1 Thiamingehalt in Plasma und Granula nativer Eier ................................101 4.1.2 Thiamingehalt in Plasma und Granula 5 Tage embryonierter Eier ........104 4.1.3 Thiamingehalt in 5 und 7 Tage alten Embryos .......................................107 4.1.4 Wiederfindungsrate, Nachweis-, Erfassungs- und Bestimmungsgrenze 112 4.2 Mineralstoffe ...........................................................................113 4.2.1 Trockenmassegehalt der Proben .............................................................113 4.2.2 Mineralstoffgehalt in Granula nativer Eier und von Bruteiern ...............113 4.2.3 Mineralstoffgehalt im Plasma nativer Eier und von Bruteiern ...............115 4.2.4 Kupfergehalt im Plasma von Eigelbproben mit Zusätzen ......................117 4.2.5 4.2.6 4.2.4.1 Gefriergetrocknete Proben mit Zusätzen................................................ 117 4.2.4.2 Native Eigelbproben mit Zusätzen ......................................................... 119 Eisengehalt im Plasma von Eigelbproben mit verschiedenen Zusätzen .124 4.2.5.1 Gefriergetrocknete Proben mit Zusatz ................................................... 124 4.2.5.2 Native Eigelbproben mit Zusatz............................................................. 126 Rasterelektronenmikroskopie..................................................................131 5. Diskussion.................................................... 135 5.1 Thiamin ...................................................................................135 5.1.1 Methodenentwicklung und Thiaminanalytik ..........................................135 5.1.2 Thiamin- und Thiaminphosphatgehalte in Proben..................................141 5.1.2.1 Thiamingehalt in Plasma und Granula ................................................... 141 5.1.2.2 Thiamingehalt in Embryos ..................................................................... 143 5.2 Mineralstoffe ...........................................................................145 5.2.1 Trockenmassebestimmung in Granulaproben.........................................145 5.2.2 Mineralstoffgehalt in nativen Eiern in Plasma und Granula...................145 5.2.3 Mineralstoffgehalt in Plasma und Granula 5 Tage embryonierter Eier ..147 5.2.4 Kupfer- und Eisengehalt in technologisch behandelten Proben .............150 5.2.5 5.2.4.1 Veränderung des Kupfergehaltes in Plasmaproben................................ 150 5.2.4.2 Veränderung des Eisengehaltes in Plasmaproben .................................. 153 Rasterelektronenmikroskopie..................................................................156 6. Zusammenfassung........................................ 157 7. Summary ...................................................... 161 8. Anhang......................................................... 165 8.1 Chemikalienverzeichnis ..........................................................165 8.2 Geräteliste................................................................................167 9. Abkürzungsverzeichnis................................ 168 10. Tabellenverzeichnis ..................................... 169 11. Abb. Verzeichnis.......................................... 172 12. Lit. Verzeichnis............................................ 174 Einleitung 1. EINLEITUNG Das Ei ist als Objekt wissenschaftlicher Forschung in vielerlei Hinsicht interessant. Vom biologischen Standpunkt aus, da sich, anders als bei Säugetieren, ein Küken fast vollständig von der Außenwelt abgeschieden, mit den im Ei zur Verfügung stehenden Nährstoffen, entwickelt. Diese werden aus den Nährstoffdepots mobilisiert, zum Embryo transportiert und verwertet. Als Nährstofflieferant ist das Ei auch für die menschliche Ernährung sehr wertvoll und wird, auch wegen seiner vielen technofunktionellen Eigenschaften, bei der Zubereitung von Speisen geschätzt. Fragen aus diesen beiden Gebieten der Forschung rund um das Ei werden auch in der vorliegenden Arbeit näher beleuchtet. Einige Nährstoffe werden herausgegriffen und bislang ungeklärte Fragen auf den Gebieten der Embryogenese und der technologischen Bearbeitung geklärt. Besonders im Nährstoffdepot Eigelb vorhandene und an Proteine gebundene Nährstoffe sind in diesem Zusammenhang interessant. Daher fiel die Wahl auf Thiamin, als proteingebundenes Molekül mit ionischem Charakter und die zum Teil proteingebundenen Kationen Calcium, Magnesium, Eisen, Kupfer und Zink. Als essentielles Vitamin ist Thiamin, welches auch als Vitamin B1 bezeichnet wird, im Eigelb des Eies gespeichert. Das Eigelb selbst kann in eine granuläre Fraktion und eine wässrige Fraktion unterteilt werden, die sich bei der Zentrifugation trennen lassen. Welche Verteilung des Thiamins in den beiden Fraktionen vorliegt, ist aber bislang ungeklärt. Die Bezeichnung Thiamin ist ein Sammelbegriff und schließt die Formen Thiaminhydrochlorid, Thiaminmonophosphat, -diphosphat und -triphosphat ein. Das Thiaminhydrochlorid hat im Körper keine bekannte biologische Aktivität. Erst wenn es zu Thiaminphosphaten umgewandelt wird, erfüllt es lebensnotwendige Funktionen. Daher ist interessant, ob die Thiaminphosphate 1 Einleitung schon im Ei für den sich entwickelnden Embryo zur Verfügung stehen, oder erst in der frühen Embryonalphase gebildet werden. In der Literatur konnten zu diesem Thema nur Studien zum Thiamingehalt im Herz 20 Tage alter Hühnerembryos oder zum Vorhandensein bestimmter im Stoffwechsel von Thiamin relevanter Enzyme gefunden werden (Olkowski und Classen, 1999; Sanders, 1980; Sawano und Fujita, 1981). Angaben zu Thiaminphosphaten in den verschiedenen Fraktionen von nativen Eiern, embryonierten Eiern oder zu dem sich entwickelnden Embryo konnten dagegen nicht gefunden werden. Diese Fragen zum Thiamin- und Thiaminphosphatgehalt sollen daher in der vorliegenden Arbeit geklärt werden. Die Methodenentwicklung zum Nachweis von Thiamin ist ein wichtiger Teil der vorliegenden Arbeit, da diese aufgrund der unterschiedlichen chemischen Eigenschaften von Thiamin und den Thiaminphosphaten in zahlreichen vorausgegangenen Arbeiten zu Schwierigkeiten geführt hat und keine zufrieden stellende Methodik in der Literatur gefunden wurde. Daher wurde, sowohl bei der Probenaufarbeitung, als auch bei der Analyse mit HPLC und einem Fluoreszenzdetektor eine neue Möglichkeit der Trennung ausprobiert. Die für die Entwicklung des Embryos notwendigen Mineralstoffe sind ebenfalls im Ei enthalten. Die Konzentration der Mineralstoffe in Eigelb und Eiklar, aber auch in den Fraktionen des Eigelbs im unbebrüteten Ei, ist bekannt. Vor allem Calcium, Eisen, Kupfer und Zink sind in den Granula des Eigelbs fest gebunden und daher nicht ohne weiteres verwertbar (Ternes et al., 1994). Für den sich entwickelnden Embryo werden zwei unterschiedliche Arten der Nährstoffaufnahme diskutiert. Zum einen die Aufnahme der Granula per Endozytose in die Zellen, zum anderen ein extrazellulärer Abbau (Bellairs, 1958; Berg und Szekerczes, 1962; Freeman und Vince, 1974). Da ein Großteil der Mineralstoffe gebunden vorliegt, würden diese entweder bei der Endozytose der Granula mit aufgenommen oder bei der extrazellulären Verdauung frei und 2 Einleitung sich im Plasma anreichern. Würden alle gebundenen Ionen ausschließlich per Endozytose aufgenommen, würde dies womöglich zu einer Anreicherung von Eisen-, Zink- und Kupferionen in toxischen Konzentrationen führen. Es ließen sich jedoch in der Literatur keine Angaben zum Mineralstoffgehalt in den Fraktionen embryonierter Eier finden, so dass unklar ist, ob beim extrazellulären Abbau Mineralstoffe freigesetzt werden und sich folglich im Plasma anreichern. Die Bestimmung der Mineralstoffkonzentration im Plasma embryonierter Eier würde also einen wichtigen Hinweis liefern auf welche Weise die Mineralstoffe während der Embryogenese freigesetzt und vom Embryo aufgenommen werden. Um den Mechanismus des extrazellulären Abbaus zu beleuchten, werden elektronenmikroskopische Aufnahmen der Granula unbebrüteter und bebrüteter Eier angefertigt um festzustellen, ob Veränderungen der Granula zu erkennen sind. Einige Kationen, vor allem Eisen und Kupfer, liegen in den Granula in einem Komplex vor, so dass diese beim Verzehr eines Eies im Darm eine geringe Bioverfügbarkeit aufweisen. Für Eisen wurden daher schon einige technologische Bearbeitungsverfahren auf ihre Tauglichkeit hin getestet, das gebundene Eisen frei zu setzen und damit verfügbar zu machen. Nur Ethylendiamintetraessigsäure (EDTA) und Ascorbinsäure schienen diesbezüglich einen Effekt zu haben (Albright et al., 1984; Morris und Greene, 1972; Ternes et al., 1994). Für Kupferionen ließen sich keine Angaben finden, ob eine technologische Bearbeitung oder der Zusatz von Substanzen zum Eigelb eine Freisetzung fördert. Daher sollte in einem weiteren Versuchsaufbau der Einfluss verschiedener Substanzen auf die Freisetzung in den Granula gebundener Eisen- und Kupferionen untersucht werden, indem der Gehalt im Plasma bestimmt wurde. In diesem Zusammenhang sollte auch untersucht werden, ob eine im Technikum des Instituts neu entwickelte Gefriertrocknungsmethode von Eigelb einen Einfluss auf die Freisetzung der 3 Eisen- und Kupferionen hat. 4 Schrifttum 2. SCHRIFTTUM 2.1 DAS HÜHNEREI 2.1.1 Aufbau des Hühnereies 2.1.1.1 Eischale Die Eischale schützt das Eiinnere vor mechanischer Belastung und gewährleistet den Wärme-, Gas- und Flüssigkeitsaustausch. Für die späte Entwicklungsphase des Embryos wird außerdem Calcium aus der Schale (Glaser und Piehler, 1934; Johnston. und Comar., 1955) für den Knochen- und Muskelaufbau mobilisiert. Der anorganische Teil der Schale, die Kristallitschicht, besteht zu 95 % aus Calciumcarbonat und enthält nur einen geringen Anteil anderer Verbindungen, wie Magnesiumcarbonat, Tricalciumphosphat und Aragonit. Andere Elemente unter anderem Eisen, Kupfer und Zink kommen nur in Spuren vor (Ternes et al., 1994). Zur Eischale werden außerdem die Kutikula (Wachsschicht) und die Eischalenmembranen gezählt (siehe Abbildung 1). 2.1.1.2 Eiklar Um die Dotterkugel ist das Eiklar angeordnet, das einen dreischichtigen Aufbau erkennen lässt (Abbildung 1). Innen liegt die innere dünnflüssige Schicht, gefolgt von der mittleren dickflüssigen Schicht. Ganz Außen liegt das äußere dünnflüssige Eiklar. In der Längsachse des Eies ziehen die Hagelschnüre, auch Chalazen genannt, zur Dotterkugel, wo sie mit der Dottermembran verbunden sind. Dadurch wird die Dotterkugel stabilisiert, wobei eine Drehung um die Längsachse gewährleistet bleibt, damit die Keimscheibe stets oben liegt. Die Abgrenzung des Eiklars zur Eischale bildet die zweischichtige Schalenhaut. Sie spaltet sich am stumpfen Pol des Eies auf und bildet die Luftkammer (Schnorr, 1996). 5 Schrifttum Das Eiklar stellt ein Flüssigkeitsreservoir dar, schützt das Eigelb vor mechanischer Einwirkung und enthält antibakterielle Stoffe (Ternes et al., 1994). Calcium, Magnesium, Eisen, Kupfer und Zink sind im Eiklar nur in geringer Konzentration vorhanden, ebenso Thiamin, so dass für diese Substanzen das Eiklar vermutlich keine Speicherfunktion erfüllt (Waheed et al., 1985). 2.1.1.3 Eigelb Abbildung 1: Schematischer Aufbau des Eies nach Schnorr (Schnorr, 1996) mit Änderungen nach Ternes (Ternes et al., 1994) Das Eigelb (= Dotter) entsteht während der Bildung des Eies aus der weiblichen Eizelle und enthält daher einen Zellkern und ist von einer Zellmembran umgeben (Ternes et al., 1994). Laut Schnorr (1996) besteht die Dottermembran (Vitellinmembran (Burley und Vadehra, 1989)) von Innen nach Außen aus vier 6 Schrifttum Schichten, dem Plasmalemm, der Lamina perivitellina, der Lamina continua und der Lamina extravitellina. Mineki und Kobayashi (1997) dagegen konnten in elektronenmikroskopischen Aufnahmen nur drei Schichten der Dottermembran darstellen. Das im Inneren enthaltene Dotter besteht zu 3 % aus dem Bildungsdotter (weiß), einem Überbleibsel aus der frühen Phase der Dotterentwicklung, und zu 97 % aus dem Nahrungsdotter (gelb). Sie unterscheiden sich erheblich in Morphologie, chemischer Zusammensetzung und in ihren physikalischen Eigenschaften. Das weiße Dotter besteht aus der etwa 6 mm großen, kugeligen Latebra (Dotterbett), die sich in der Mitte des Dotters befindet und dem Latebrahals, der zapfenförmig in das Dotter hineinragt. Der Latebrahals erweitert sich an der Dotterperipherie zum Panderkern, auf dem der abgeflachte Zellkern ruht. Der Zellkern und das ihm umgebende Bildungsplasma bilden die Keimscheibe (Schnorr, 1996). Laut Schlesinger (1958) befindet sich auch eine dünne Schicht weißen Dotters direkt unterhalb der Dottermembran. Das gelbe Dotter nativer Eier wird während der Dotterbildung in konzentrischer Schichtung um die Latebra angeordnet, welche bei uneinheitlicher Fütterung durch unterschiedliche Einlagerung von Pigmenten oder durch Färben, zu erkennen ist. In 3 - 4 Tage alten embryonierten Eiern dagegen, lässt sich diese Schichtung durch Färben nicht mehr darstellen (Grau, 1976). Morphologische Unterschiede des Eigelbs, die die Ringstruktur auch erklären könnten, konnten von Mineki und Kobayashi (1997) in elektronenmikroskopischen Aufnahmen an nativem Eigelb nicht festgestellt werden. 7 Schrifttum Abbildung 2: Schematische Darstellung der Eigelbpartikel Das Eigelb kann als eine Suspension aus Partikeln in einer wässrigen Lösung aus Proteinen (Livetinen) bezeichnet werden (Abbildung 2) (Ternes et al., 1994). Bereits mit dem Lichtmikroskop sieht man die Dotterkugeln (=Kügelchen, Dotterkügelchen, engl.: spheres). Ihre Größe schwankt im weißen Dotter zwischen 4 und 75 µm und sie enthalten wenige, als Tröpfchen (engl.: droplets) bezeichnete, Partikel. Im gelben Dotter dagegen sind sie 15 bis 150 µm groß und enthalten Tröpfchen in größerer Anzahl (Ternes et al., 1994). In elektronenmikroskopischen Aufnahmen stellten sich die Dotterkugeln polyedrisch dar (Woodward und Cotterill, 1987). Sie sind von einer Membran umgeben und enthalten eine Matrix aus einer wässrigen NaCl-Lösung (Ternes et al., 1994). Die Tröpfchen in den Dotterkugeln konnten auch von Bellairs (1961) dargestellt werden. Sie charakterisierte Dotterkugeln ohne, mit einer einschichtigen und mit einer mehrschichtigen Membran. Außerdem vermutete 8 Schrifttum sie, dass die Matrix außerhalb der Dotterkugeln des gelben und weißen Dotters eine ähnliche Beschaffenheit wie die Matrix in ihrem Inneren aufweist. Die Dotterkugeln sind fragile Gebilde, die durch Belastungen wie Rühren, Verdünnen und Zentrifugieren zerstört werden. Burly und Vadehra (1989) beschreiben noch eine andere Art der Dotterkugeln, die unlöslich und gegenüber mechanischer Belastung stabiler sind. Eine detaillierte Untersuchung und Beschreibung des Eigelbs und den enthaltenen Partikeln präsentierten Mineki und Kobayashi (1997). Sie fertigten sowohl trans- als auch rastereletronenmikroskopische Aufnahmen verschiedener Regionen des Eigelbs an. Sie konnten eine Struktur des nativen Eigelbs aus dicht gepackten polyedrischen Dotterkugeln bestätigen. Diese unterschieden sich in ihrer Größe und in ihrem Inhalt. Eine Schicht direkt unter der Dottermembran unterschied sich morphologisch erheblich von dem weiter Innen liegenden Eigelb. In dieser Rindenschicht identifizierten sie kleine 8 bis 12 µm große Dotterkugeln, sowie Öltröpfchen. In den Dotterkugeln identifizierten sie 0,3 bis 2,5 µm große Granula. Aufgrund ihrer strukturellen Charakteristika vermuteten sie, dass diese Strukturen sich noch in einem früheren Entwicklungsstadium befinden, außerdem schienen sie sich in Lösung zu befinden. Diese Ergebnisse bestätigen die Vermutung von Schlesinger (1958) dass sich unter der Dottermembran eine Schicht weißen Dotters befindet. In dem direkt darunter liegenden Dotter waren die Dotterkugeln mit etwa 22 µm Durchmesser kleiner als die weiter im Inneren liegenden, mit etwa 60 µm Durchmesser. Die in ihnen enthaltenen Partikel, die Granula, hatten einen Durchmesser von 0,25 - 1,75 µm. Die Außen liegenden kleineren Dotterkugeln enthielten größere Granula, als die größeren Dotterkugeln im Inneren des Eigelbs. Durch Anfärben konnten sie zeigen, dass die Granula aus 4 nm großen Proteinpartikeln bestehen. Die Dotterkugeln hatten eine glatte Oberfläche und entgegen den Angaben von Bellairs 9 (1961), konnten sie keine Schrifttum Membranstrukturen identifizieren. Zwischen den Dotterkugeln befanden sich, aufgrund ihrer Beschaffenheit und Anfärbbarkeit, Öltröpfchen. Die Größe der Granula wird auch von anderen Autoren mit einem Durchmesser von 0,2 und 2 µm angegeben (Bellairs, 1961; Causeret et al., 1991; Chang et al., 1977a). Durch Ultrazentrifugation des Eigelbs sedimentieren diese, während der Überstand als Plasma bezeichnet wird. Die Proteine der Ganula bestehen zu etwa 12 % aus Low-Density-Lipoprotein, zu 16 % aus Phosvitin und zu 70 % aus Lipovitellin, welches auch als HDL (High-Density-Lipoprotein) der Granula bezeichnet wird. Durch Zugabe von NaCl-Lösung, können die Granula in Untereinheiten aufgebrochen werden (Chang et al., 1977b; Garland und Powrie, 1978; Ternes et al., 1994). Die beiden flotierenden Schichten (VLDL-Fraktionen) enthalten Myelinpartikel und die Low-Density-Lipoproteine (LDL) der Granula, während die drei sedimentierenden Schichten den Phosvitin-Lipovitellin-Komplex enthalten (Ternes et al., 1994). Das Phosvitin ist ein Phosphoglykoprotein und das Lipovitellin (HDL) ein Phospholipoprotein. Bei der Dotterbildung wird das Metalltransportprotein des Huhns, das Vitellogenin, zu Phosvitin und Lipovitellin gespalten und eingelagert (Ternes et al., 1994). Das durch Zentrifugation gewonnene Plasma kann durch erneute Zentrifugation in zwei weitere Fraktionen getrennt werden. In der wässrigen Phase sind Proteine, die Livetine, gelöst. Die darüber flotierende Schicht enthält LowDensity-Lipoproteine, mit einem Durchmesser von 23 bis 50 nm. Durch geeignete Trennverfahren (Ionenaustauschchromatographie, Gelfiltration, Elektrophorese) ließen sich molekulare Unterschiede in den einzelnen Eigelbfraktionen erkennen, so dass ein a- und ß-Phosvitin und ein a- und ßLipovitellin (HDL) in den Granula und ein a, ß und ?- Livetin im Plasma charakterisiert wurden. Das d-Livetin und das Apo-Vitellinin machen jeweils nur 2 % der Livetinfraktion aus (Ternes et al., 1994). 10 Schrifttum Tabelle 1: Zusammensetzung des Eigelbs Eigelb Granula LowDensityLipoprotein Phosvitin a-Phosvitin ß-Phosvitin HDL= High-Density-Lipoprotein LV= Lipovitellin L= Livetin 1 = Apo-Vitellinin Plasma Lipovitellin (HDL) Livetine a- LV a-L ß- LV ß-L LowDensityLipoprotein ?-L d-L Apo-1 Die Low-Density-Lipoproteine des Plasmas sind kugelige Partikel, deren Kern aus neutralen Lipiden von einer Membran aus Proteinen und Phospholipiden umschlossen ist. Die Low-Density-Lipoproteine der Granula sind diesen in ihrer Zusammensetzung ähnlich. In der Literatur werden die Low-Density-Lipoproteine des Eigelbs zum Teil auch als Very-Low-Density-Lipoproteine bezeichnet, wobei es sich um dieselbe Fraktion handelt. Diese kontroverse Bezeichnung resultiert daraus, dass Lipoproteine im menschlichen Serum mit derselben Dichte wie die Lipoproteine des Eigelbs als Very-Low-Density-Lipoproteine bezeichnet werden (Biagi, 1964; Ternes et al., 1994). 2.1.2 Mineralstoffgehalt Der Eisen-, Kupfer- und Zinkgehalt im Ei wird durch eine Erhöhung des Gehaltes in der Fütterungsration der Henne nicht wesentlich erhöht. Hohe Gehalte an Kupfer und Zink in der Futterration der Henne führen im Gegenteil zu einem deutlichen Rückgang der Legeleistung (Richards, 1997). Untersucht man Eier derselben Henne ist der Mineralstoffgehalt relativ konstant, kann sich aber von Huhn zu Huhn dagegen deutlich unterscheiden (Manson et al., 1993). Zu diesen Ergebnissen kamen Manson et al. (1993) als sie die Mineralstoffgehalte in Eiklar und Eigelb bestimmten und die Varianzen des 11 Schrifttum Mineralstoffgehaltes in den Eiern einzelner Hennen mit denen der Gesamtpopulation verglichen. Tabelle 2: Gehalt und Schwankung einiger Mineralstoffe im Ei Fraktion Eigelb Eiklar Mineralstoff Calcium Magnesium Eisen Calcium Magnesium Ø Gehalt µg/g 2550 240 150 180 120 Variationsbereich Variationskoeffizient Reproduzierbarkeit µg/g % t 2080- 3130 210- 260 100- 180 90- 260 90- 140 8,1 7,5 11,8 19,9 12,7 0,36 0,19 0,64 0,13 0,57 t= Varianzen zwischen einzelner Hennen/(Varianz zwischen und Varianz innerhalb der Hennen) nach Manson et al. (1993) Die Autoren geben an, dass ein Wert von t > 0,3 eine signifikante Abweichung in der Varianz der Werte zwischen den Hennen und von ein und derselben Henne bedeutet. Für Calcium und Eisen im Eigelb schwanken die Gehalte zwischen den Hennen, sind aber in Eiern derselben Henne relativ konstant. Dies gilt ebenso für Magnesium im Eiklar. Für die anderen Mineralstoffgehalte ist die Schwankung im Gehalt von Eiern verschiedener Hennen genauso groß wie die Schwankung in Eiern derselben Henne. Die Verteilung der Mineralstoffe im Plasma und der Granula des Eigelbs wurde mit Atomabsorptionsspektrometrie bestimmt und durch die Dialysierbarkeit ermittelt inwieweit die Elemente an Proteine gebunden sind (Wakamatu et al., 1982b). Eine Übersicht zum Gehalt, der Verteilung und der Dialysierbarkeit ist in Tabelle 3 dargestellt. 12 Schrifttum Tabelle 3: Gehalt, Verteilung und Dialysierbarkeit der Mineralstoffe in Eigelbfraktionen Mineralstoff Fraktion Calcium Gesamteigelb Plasma Granula Gesamteigelb Plasma Granula Gesamteigelb Plasma Granula Magnesium Eisen Gehalt µg/g Tr. M. 2720 580 9880 260 110 790 100 In Spuren 480 Verteilung % Dialysierbarkeit % 16,7 83,3 98,3 1 32,1 67,9 45,5 5,1 1 99 22,9 Nach Wakamatu et al. (1982a) Anhand dieser Ergebnisse sind die im Plasma enthaltenen Ionen weniger stark an Proteine gebunden als Ionen in den Granula. Besonders Calcium und Magnesium scheinen in der Granulafraktion überhaupt nicht in freier Form vorzukommen, während Calcium fast vollständig in freier Form und Magnesium gut zur Hälfte in freier Form im Plasma vorliegt. Eisen ist zu einem Großteil in den Granula vorhanden und dort zu 80 % in gebundener Form, wobei andere Autoren eine Bindung von über 90 % angeben (Richards, 1997; Ternes et al., 1994). Im Rahmen der Untersuchung von Hennen mit einem Gendefekt wurde von Grau und Roudybush (1979b) der Mineralstoffgehalt in den Fraktionen der Eier von Kontrolltieren gemessen. Ihre Ergebnisse sind in den Kapiteln über die einzelnen Mineralstoffe angegeben (siehe 2.3 und 2.4). Eine Übersicht über Mineralstoffangaben verschiedener Autoren ist nachfolgend aufgeführt. 13 Schrifttum Tabelle 4: Mineralstoffgehalt im gesamten Ei Quelle Everson & Sounders 1957 Cook & Briggs 1973 Cotteril 1977 Souci 1986 Quelle Mineralstoffgehalt in µg/g Feuchtsubstanz Calcium Magnesium Eisen Kupfer 540 90 21 1,7 540 110 23 590 124 23 6 560 120 21 - Zink 13 15 13,5 Mineralstoffgehalt in µg/g Trockenmasse Calcium Magnesium Eisen Kupfer 2077 346 81 6,5 2053 418 87,5 2332 490 90,9 23,7 1900 460 88 2,38 Zink 50 59,3 50 Everson & Sounders 1957* Cook & Briggs 1973* Cotteril 1977* Souci 2000 * berechnet nach der von den Autoren angegebenen Trockenmasse Tabelle 5: Mineralstoffgehalt im Eigelb Quelle Everson & Sounders 1957 Cook & Briggs 1973 Cotteril 1977 Souci 1986 Quelle Mineralstoffgehalt in µg/g Feuchtsubstanz Calcium Magnesium Eisen Kupfer 1470 130 56 2,5 1410 160 55 1360 124 59 1,3 1400 160 72 Mineralstoffgehalt in µg/g Trockenmasse Calcium Magnesium Eisen Kupfer 177 69,4 20,3 2720 260 100 2905 257 110,7 4,9 2883 327 112,5 2677 244 116 2,6 2820 280 140 2900 780 150 4,8 Grau 1979 Wakamatu 1982 Everson & Sounders 1957* Cook & Briggs 1973* Cotteril 1977* Souci 2000 Romanoff 1967 * berechnet nach der von den Autoren angegebenen Trockenmasse 14 Zink 38 38 38 Zink 46,9 75,1 74,8 1,5 Schrifttum Tabelle 6: Mineralstoffgehalt im Eiklar Quelle Everson & Sounders 1957 Cook & Briggs 1973 Cotteril 1977 Quelle Mineralstoffgehalt in µg/g Feuchtsubstanz Calcium Magnesium Eisen 60 110 3 90 90 1 90 124 - Kupfer 4 2 Zink - Mineralstoffgehalt in µg/g Trockenmasse Calcium Magnesium Eisen 492 902 24,6 726 726 8,1 841 1159 840 720 9 850 1500 33,3 Kupfer 32,8 18,7 3,4 Zink 62 Everson & Sounders 1957* Cook & Briggs 1973* Cotteril 1977* Souci 2000 Romanoff 1967 * berechnet nach der von den Autoren angegebenen Trockenmasse 2.1.3 Technologische Behandlung von Eigelb Zur technologischen Behandlung des Eigelbs gehört das Erhitzen, Kühlen, Trocknen und das Versetzen mit Zutaten. Diese Verfahren werden zum Konservieren, bei der Verarbeitung von Eigelbprodukten, zur Veränderung der technofunktionellen Eigenschaften, oder auch zur Beeinflussung des Nähr- und Genußwertes des Eigelbs genutzt. 2.1.3.1 Gefrieren Der Gefrierpunkt für Eigelb liegt bei durchschnittlich -0,601 °C. Um eine Säurebildung, mikrobielles Wachstum, Verfärbungen und Veränderungen des Geschmacks zu vermeiden, muss ein langsames Gefrieren verhindert werden. Daher werden Schnellgefrierverfahren bei -40 °C und hoher Luftgeschwindigkeit eingesetzt. Beim langsamen Einfrieren und Auftauen von Eigelb erhöht sich, aufgrund struktureller Veränderungen, die Viskosität. Diese zumeist irreversible Änderung des Fließverhaltens von Eigelb wird als Gelbildung bezeichnet. Sie tritt auf, wenn Eigelb langsam auf -6 °C abgekühlt wird und bei dieser 15 Schrifttum Temperatur eine längere Zeit gelagert wird. Bei niedrigeren Temperaturen reicht eine kürzere Lagerdauer. Beim schnellen Gefrieren bei niedrigeren Temperaturen kann eine Gelbildung verhindert werden. Um eine Gelbildung zu vermeiden, können außerdem 10 bis 50 % Saccharose, 0,15 % Papain oder 4 % Kochsalz sowie Phospholipase A zugesetzt werden. Die Gelbildung kann aber nicht nur durch Zusätze, sondern auch durch mechanische Einwirkungen, wie Homogenisieren verhindert werden. Bei der Gelbildung spielen offenbar die Lipovitelline und die Low-Density-Lipoproteine eine Rolle. Der Gefrierprozess bewirkt einen Wasserverlust im Eigelb, so dass die Proteine ihre Hydrathülle verlieren. Außerdem findet eine Konzentration von Proteinen und Salzen in der restlichen flüssigen Phase statt. Durch diese Bedingungen wird eine Umlagerung und Aggregation von Lipoproteinen begünstigt. Die strukturellen Veränderungen können in elektronenmikroskopischen Aufnahmen dargestellt werden. Nicht gefrorenes Eigelb weist ein feines Netzwerk mit kleinen Hohlräumen auf. Nach dem Gefrieren und Wiederauftauen erscheint es als ein gröberes Netzwerk mit größeren Hohlräumen. Mit der Weitmaschigkeit der Struktur ist die Zunahme der Viskosität korreliert. Die Ursache der Gelbildung liegt offenbar in dem Plasma des Eigelbs, da dieses beim Einfrieren bei -8 °C ein Gel bildet, wohingegen eine Granulasuspension in Wasser dies nicht tut. Eine Gelbildung der Granula findet allerdings ebenfalls statt, wenn bei der Behandlung die Granula zerstört werden, so dass die Low-Density-Lipoproteine frei werden. Die aggregierten Proteine konnten als Low-Density-Lipoproteine identifiziert werden, allerdings sollen auch Livetine an der Aggregation beteiligt sein (Ternes et al., 1994). Bislang wird deshalb die thermische Trocknung des Eigelbs im industriellen Maßstab bevorzugt. Aber auch bei der thermischen Behandlung werden die technofunktionellen Eigenschaften des Eigelbs verändert, so dass die Nutzung dieser Eigelbpulver in Eigelbprodukten nur eingeschränkt möglich ist. Gegenüber frisch hergestellten Produkten haben diese Produkte zudem einen 16 Schrifttum veränderten Genusswert. Um die technofunktionellen Eigenschaften frischer Eigelbprodukte zu simulieren müssen andere Zusätze wie Emulgatoren oder Stabilisatoren zugefügt werden. Von Ternes und Dautel (2007) wurde daher ein Gefriertrocknungsverfahren entwickelt bei dem die technofunktionellen Eigenschaften des Eigelbs erhalten bleiben. Das Verfahren ist unter 3.1.3 näher beschrieben. 2.1.3.2 Zutaten Durch den Zusatz von Salz (NaCl) wird die Löslichkeit der Proteine der Granula, durch Zerstörung der Struktur der Granula, erhöht (Causeret et al., 1992; Hasiak et al., 1972; Ternes et al., 1994; Ternes, 1991). Der Zusatz von Salz führt zu einer höheren Dialysierbarkeit von Calcium. Die Differenz von 17,4 % Dialysierbarkeit ohne Zusatz zu 35,4 % mit Zusatz, legt nahe, dass 18 % des gebundenen Calciums freigesetzt werden. Vermutlich werden Calciumionen aus den Phosphor-Calcium-Brücken des PhosvitinLipovitellin-Komplexes verdrängt und somit die Granula destabilisiert. Die Dialysierbarkeit von Eisen konnte dagegen nicht erhöht werden. Der Zusatz von EDTA zur Granulafraktion führt zu einer fast vollständigen Dialysierbarkeit von Calcium (99,6 %) und Eisen (94 %), da diese an EDTA gebunden werden (Causeret et al., 1992). Ein Zusatz von 0,02 M Citronensäure führte ebenfalls zu einer leichten Erhöhung, wohingegen für 1 M NaCl Lösung kein Effekt festgestellt werden konnte (Albright et al., 1984). Durch die Destabilisierung der Granula und den Verlust der Calcium- und Eisenionen erhöhte sich die Löslichkeit der Proteine der Granula. Die Dialysierbarkeit der Ionen und die Struktur der Granula kann auch durch Zusatz von Ionen beeinflusst werden. So führt die Zugabe großer Mengen Calciumchlorid (CaCl2) zur Destabilisierung der Granula, während eine geringere Menge die Calciumbrücken gegen pH-Wert Änderungen stabilisiert. Größere Mengen Eisen dagegen 17 verdrängen Calcium von den Schrifttum Phosphatbindungsstellen und die Struktur der Granula gegenüber NaCl wird stabilisiert (Causeret et al., 1992). Auch in Mayonnaise ist Eigelb vorhanden und ein Zusatz von Ascorbinsäure, hat Einfluss auf den Gehalt an freien Eisenionen in Mayonnaise haben, wie von Jacobsen et al. (1999) festgestellt wurde. Der Gehalt an Eisen im Präzipitat und in der Emulsionsphase wurde gegen den Gehalt in der wässrigen Phase gemessen. Je größer der Zusatz von Ascorbinsäure, desto mehr Eisen konnte in der wässrigen Phase gefunden werden, während gleichzeitig der Gehalt in den anderen beiden Phasen abnahm. Der Zusatz von Ascorbinsäure betrug zwischen 2,27 und 22,7 mM bei verschiedenen pH-Werten. Der größte Effekt konnte bei niedrigen pH-Werten beobachtet werden. Eine pH-Wert-Absenkung mit Essigsäure hatte dagegen keinen solchen Effekt. Ascorbinsäure reduziert an Phosvitin gebundene, sowie freie Eisen-(III)-Ionen, zu Eisen-(II)-Ionen und bindet Eisenionen in beiden Oxidationsstufen (Jacobsen et al., 2001). Diese Ergebnisse decken sich mit Studien, die für Eigelbpulver durchgeführt wurden. Wird Eigelbpulver mit Ascorbinsäure oder Ascorbinsäure-6-Palmitat versetzt, kann für beide Zusätze eine Freisetzung von Eisen-(II)-Ionen aus dem Eisen(III)-Phosvitin-Komplex festgestellt werden (Nielsen et al., 2000). Durch weitere Untersuchungen konnte festgestellt werden, dass Eisen-(III)-Ionen wesentlich stärker an Phosvitin gebunden sind als Eisen-(II)-Ionen (Grogan und Taborsky, 1986). 2.1.3.3 pH-Wert Bei pH 6,3, der dem des nativen Eigelbs von 6,0 (Burley und Vadehra, 1989) in etwa entspricht, bilden Lipovitellin, Phosvitin und Low-Density-Lipoproteine in den Granula einen unlöslichen Komplex. Bei einem pH-Wert unter 4,2 werden vermutlich die Ionenbrücken aufgebrochen und bei über pH 6,3 führt wahrscheinlich die Zunahme von elektrostatischer Abstoßung durch negativ geladene Gruppen (COO-) dazu, dass die Granula destabilisiert werden. In 18 Schrifttum beiden Fällen nimmt dadurch die Löslichkeit der Proteine der Granula zu (Causeret et al., 1992; Hasiak et al., 1972; Ternes et al., 1994). Wird der pHWert anschließend wieder auf den ursprünglichen Wert gebracht, vermindert sich die Löslichkeit wieder. Elektronenmikroskopische Aufnahmen zeigen allerdings, dass die Granula dabei irreversibel zerstört werden (Causeret et al., 1991). Bei Absenkung des pH-Wertes mit Citronensäure unter pH 2,5 zeigt Eigelb eine deutliche Gelbildung, die bei pH 3,5 beginnt (Guerrero et al., 2004). Studien zur Eisenbindung von Phosvitin haben gezeigt, dass eine Absenkung von pH 6,5 auf pH 3 keinen Einfluss auf an Eisen gebundenes Phosvitin hat (Castellani et al., 2004). 2.1.3.4 Trocknung In Fabrikationsanlagen für Eiprodukte wird Eigelb mittels Sprühtrocknung getrocknet. Es gibt die Möglichkeit der Zentrifugenverstäubung und die Hochdruck- (Nozzle-) Verstäubung (Ternes et al., 1994). Bei diesen Trocknungsverfahren werden die Eigelbproteine thermisch geschädigt. Die Möglichkeit der Gefriertrocknung besteht ebenfalls. Die Nachteile dieser Methode sind der hohe Energieaufwand, der hohe apparative Aufwand und die Gefahr der Beeinträchtigung der technofunktionellen Eigenschaften des Eies. Der Trockensubstanzgehalt des Eiklars beträgt 13,1 ± 8 % und im Eigelb 52,4 ± 1,9 % (Ternes et al., 1994). 19 Schrifttum 2.2 EMBRYONALENTWICKLUNG 2.2.1 Entwicklung des Embryos Die Entwicklung des Embryos im Hühnerei beträgt von der Ablage eines befruchteten Eies bis zum Schlupf eines Kükens 22 Tage (Burley und Vadehra, 1989). Schon direkt nach der Befruchtung im Infundibulum (lat. Trichter) des Eileiters der Henne bildet sich durch Furchung aus dem Zellkern die mehrschichtige Keimscheibe (Blastoderm) (Schnorr, 1996). Dabei ruht die Keimscheibe auf dem Panderkern, steht also in direktem Kontakt zum weißen Dotter. Direkt vor der Eiablage besteht die Keimscheibe schon aus etwa 60 000 Zellen, aus denen sich der Embryo und die extraembryonalen Gewebe bilden (siehe Abbildung 1). Zu den extraembyronalen Strukturen werden die Dottersackmembran, die Eiklarmembran, die Chorioallantoismembran, Chorionmembran, die die Amnionmembran, Allantoismembran, die die Vitellinmembran (Eigelbmembran) und die Schalenmembran gezählt. Die Vitellinmembran wird bei der Befruchtung von den Spermatozoen durchbrochen und wird während der ersten 3 bis 4 Tage durch die Entwicklung des Embryos so stark geschädigt, dass sie am animalen Pol, d.h. in der Nähe der Keimscheibe reißt (Burley und Vadehra, 1989). Durch die Eiablage wird die weitere Embryonalentwicklung kurzfristig unterbrochen und erst während des Brütens fortgesetzt. Von der Keimscheibe aus umwächst die Dottersackmembran, direkt unter der Vitellinmembran, das Dotter. Bereits nach 2 ½ Tagen haben Blutgefäße die Dottermembran durchsetzt, so dass der durch die Dottersackepithelzellen phagozytierte Dotter dem Embryo zugeführt wird (Schnorr, 1996). Am neunten Tag schließt sich die dreischichtige Dottersackmembran und bildet so den Dottersack. Um die Kontaktfläche zum Dotter zu erhöhen, besitzt die innere Schicht Ausstülpungen die in das Eigelb ragen. Über den Ductus 20 Schrifttum vitellointestinalis ist der Embryo mit der Dottersackmembran verbunden. In der Dottersackmembran sind verschiedene Enzyme aktiv, die das aufgenommene Dotter verstoffwechseln. Die Aktivität der alkalischen Phosphatase beispielsweise ist am 5. bis 7. Tag und die Aktivität der sauren Phosphatase am 9. bis 12. Bebrütungstag am höchsten. Die Tatsache, dass weder Phosvitin noch Lipovitellin im embryonalen Blut gefunden wurden, legt nahe, dass diese beiden Proteine bereits in der Dottersackmembran verstoffwechselt werden. In der Spätphase der Inkubationszeit vermischen sich Eiklar und Eigelb und Ovalbumin aus dem Eiklar akkumuliert in der Granulafraktion (Burley und Vadehra, 1989). Die Amnionmembran wird nach 30 Stunden Inkubationszeit gebildet und umschließt den Embryo als flüssigkeitsgefüllter Sack, in dem der Embryo schwimmt. Er hat die Aufgabe den Embryo vor mechanischen Einwirkungen zu schützen. Die Chorioallantoismembran ist eine zusammengesetzte Membran aus der Chorionmembran und der Allantoismembran. Die Chorionmembran wächst zur selben Zeit wie die Amnionmembran, wohingegen die Allantoismembran erst am zweiten Tag gebildet wird. Die beiden Membranen fusionieren und umgeben am 11. oder 12. Tag der Embryonalentwicklung den Embryo und die Amnionhöhle. Wie die Amnionmembran sind sie stark mit Blutgefäßen durchsetzt. Der Chorionteil der Membran liegt der Eischale an und ist für den Sauerstoffaustausch und die Aufnahme von Calciumionen und dessen Transport zuständig. Der innere Allantoisteil der Membran übernimmt den Flüssigkeitsund ebenfalls den Ionentransport. Die beiden Membranen sind über den Urachus (Nabel) mit dem Embryo verbunden (Burley und Vadehra, 1989). Das Eiklar verliert während der Inkubationszeit vor allem Flüssigkeit und erst in der letzten Woche etwa ein Drittel seiner Proteine, die in das Dotter übergehen. Dephosphoryliertes Ovalbumin kann ab dem 18. Tag im embryonalen Blut nachgewiesen werden (Burley und Vadehra, 1989). 21 Schrifttum Abbildung 3: Schematische Aufbau eines Embryo am 10 bis 11 Bebrütungstag (Schnorr, 1996) Somit zeigt das Eiinnere eines befruchteten Hühnereies bereits nach wenigen Tagen einen charakteristischen Aufbau: Die Kalkschale mit Schalenhaut schließt das Eiinnere ein. Die zweischichtige Schalenhaut trennt sich am stumpfen Pol und bildet eine Luftkammer. Unter der Eischalenhaut liegt das Eiklar, welches rundherum das Chorion umschließt. Im Chorion liegen die Allantois, die über den Allantoisstiel mit dem Embryo verbunden ist, sowie der Dottersack und die Amnionhöhle, die den Embryo schützend umgibt (Schnorr, 1996). 2.2.2 Verbleib der Mineralstoffe während der Embryogenese Während der Embryonalentwicklung werden die Granula von den Endodermalzellen der Dottersackmembran durch Endozytose aufgenommen (Juurlink und Gibson, 1973; Lambson, 1970; Mobbs und McMillan, 1979). Bellairs fertigte 1958 elektronenmikroskopische Aufnahmen der Keimscheibe 22 Schrifttum des Hühnerembryos an und identifizierte die aufgenommenen Granula in den Zellen (Bellairs, 1958). In den Granula bilden an Phosvitin und Lipovitellin gebundene Eisen-, Kupfer- und Zinkionen mit Calciumionen einen Komplex. Werden die Mineralstoffe nicht vorher abgelöst, würden sie bei der Endozytose der Granula ebenfalls aufgenommen werden. Das in Phagosomen aufgenommene Phosvitin und Lipovitellin wird in diesen abgebaut, so dass die gebundenen Mineralstoffe freigesetzt würden. Neben diesem intrazellulären Eigelbabbau wird ein extrazellulärer Eigelbabbau diskutiert, der von Freeman und Vince (1974) zusammengefasst wurde: Vom zweiten Tag der Embryonalentwicklung an können Hinweise auf eine extrazelluläre Verstoffwechselung des Eigelbs festgestellt werden. Die Endodermalzellen der Dottersackmembran setzen Enzyme frei und nehmen die Abbauprodukte wieder auf. Das gesamte aufgenommene Material wird über den Blutkreislauf zum Embryo transportiert. Es wurden bislang drei proteolytische Enzyme gefunden, die an der Hydrolyse von Proteinen beteiligt sind. Da diese auch in unembryonierten Eiern gefunden wurden, werden sie schon bei der Eibildung ins Ei eingelagert. Die Proteinaseaktivität ist ab dem vierten Tag feststellbar und erhöht sich während der Embryogenese weiter. Dadurch werden Aminosäuren freigesetzt. Ab dem 6. Inkubationstag werden diese auch aktiv durch ein Transportsystem aufgenommen. Bis zum 13. Tag der Inkubation werden die Granula stetig abgebaut und ein Transfer von Protein-Stickstoff aus dem Eigelb in den Embryo ist zu verzeichnen. Die Konzentration gelöster Proteine nimmt auch durch die Vermischung von Eiklar und Eigelb zu. Für Phosphat konnte belegt werden, dass es durch eine Phosphoproteinphosphatase, die im Endoderm und im Eigelb gefunden wurde, freigesetzt wird (Freeman und Vince, 1974). Je nach Bedarf des Embryos werden Mineralstoffe entweder in der Dottersackmembran gespeichert oder in das Blutplasma abgegeben, damit sie zum Embryo transportiert werden können. Diese Beobachtung konnte 23 Schrifttum insbesondere für Zink bestätigt werden (Richards und Steele, 1987). Ein größerer Teil des aufgenommenen Eisens wird direkt in der Dottersackmembran für den Aufbau von Erythrozyten verwendet (Simkiss, 1991). Kurz vor dem Schlupf (21. Tag) können in der Dottersackmembran wesentlich höhere Mineralstoffgehalte als im Eigelb gemessen werden. Metallothionein, als Zink und Kupfer bindendes und Ferritin als Eisen bindendes Protein können in der späten Embryonalphase in der Dottersackmembran nachgewiesen werden. Ihnen wird daher auch eine Speicherfunktion zugesprochen. Transferrin, Albumin und a-Fetoprotein werden dagegen in der Eigelbmembran zum Transport von Mineralstoffen gebildet, die dann mit dem Blut über den Vitellin-Kreislauf zum Embryo transportiert werden. Auf diese Weise kann eine große Menge an Spurenelementen in der Dottersackmembran gespeichert werden und der Embryo seinen Bedürfnissen entsprechend mit diesen versorgt werden. Diese Vermutung legen Schwankungen im Mineralstoffgehalt wie auch im Gehalt der Mineralstofftransportproteine während der Embryonalentwicklung nahe. Die Regulation über die Dottersackmembran gewährleistet, dass eine Unterversorgung oder eine Überversorgung an in hohen Konzentrationen toxisch wirkenden Spurenelementen vermieden wird. Bei der Messung der Gehalte an Spurenelementen im sich entwickelnden Embryo fallen eine hohe Konzentration am fünften Tag und ein Abfallen der Konzentration an den darauf folgenden Tagen auf. Eine mögliche Erklärung wäre, dass die Entwicklung der Dottersackmembran am fünften Tag noch nicht abgeschlossen ist und sie daher ihre regulatorische Funktion noch nicht vollständig erfüllen kann. Möglicherweise ist aber auch ein höherer Bedarf an Spurenelementen die Ursache für die höhere Konzentration am fünften Tag. Calcium wird in der späten Phase der Embryonalentwicklung zusätzlich über die Eischalenmembran und die Chorioallantoismembran aufgenommen. Experimente mit der Chorioallantoismembran bestätigten dies und legen den Schluss nahe, dass zwei Calciumpumpen, eine für jede Zellschicht in der 24 Schrifttum Membran, enthalten sein müssen (Moriarty, 1973). Bis zum 9. oder 10. Tag der Embryogenese werden 85- 95 % des Calciumbedarfs des Embryos durch das in den Granula gespeicherte Calcium gedeckt. Danach werden Calciumionen aus der Eischale mobilisiert (Johnston und Comar, 1955). Dass die Anwesenheit der Eischale während der Inkubation einen Einfluss auf den Mineralstoffgehalt im Hühnerembryo hat, konnte durch Untersuchungen an schalenlosen Eiern bestätigt werden. Die Mineralstoffgehalte im Embryo und im Gesamtei an Calcium, Magnesium, Kalium und Natrium wurden zwischen dem 8. und 21. Tag bestimmt. Der Calcium- und Magnesiumgehalt in Embryos, die ohne Eischale inkubiert wurden, war wesentlich niedriger als der Gehalt in der Kontrollgruppe. Während der Calciumgehalt im Gesamtei in der Kontrollgruppe stetig anstieg, war er für die schalenlosen Embryos sehr niedrig. Dies ist ein Hinweis darauf, dass Calciumionen während der Embryonalentwicklung aus der Eischale mobilisiert werden. Während allerdings der Calciumgehalt deutlich unterschiedliche Werte, sowohl im Embryo als auch im Gesamteiinhalt aufwies, konnte kein so deutlicher Unterschied für den Magnesiumgehalt festgestellt werden. Es wird daher angenommen, dass Magnesium sowohl aus der Eischale als auch den Granula mobilisiert wird (Dunn und Boone, 1977). Welche Rolle die Chorioallantoismembran bei der Versorgung des Embryos mit anderen Mineralstoffen spielt, ist noch nicht hinreichend aufgeklärt. Eine Aufnahme von aufgetragenen Metallsalzen konnte zumindest bestätigt werden. Außerdem wird Metallothionein in der Membran synthetisiert an das das aufgenommene Zink gebunden wird. Ob allerdings Spurenelemente aus der Eischale und der Eischalenmembran in vivo aufgenommen werden, ist unklar. Durch die Vermischung von Eiklar und Eigelb während der Embryogenese, wird auch an Transferrin gebundenes Eisen aus dem Eiklar in der Synthese von roten Blutkörperchen genutzt. Für die Amnionmembran konnte bislang keine 25 Schrifttum Rolle in der Verstoffwechselung von Spurenelementen festgestellt werden (Richards, 1997). Der Gehalt von Kupfer, Eisen, Magnesium und Zink vom 5. bis zum 18. Inkubationstag nimmt, gegen das Embryogewicht aufgetragen, ab. Eine Erklärung dafür wäre, dass das Wachstum des Embryos die Mineralstoffaufnahme übersteigt. Wird hingegen der absolute Gehalt im Embryo und im gesamten Ei bestimmt, kann ein Transfer von Mineralstoffen angenommen werden (Dewar et al., 1974). 2.3 MENGENELEMENTE Zu den Mengenelementen werden Calcium, Phosphor, Magnesium, Kalium, Natrium, Chlor und Schwefel gezählt, da jedes von ihnen in einer Konzentration von mehr als 50 mg pro kg Körpermasse im Organismus vorhanden ist (Engelhardt und Breves, 2000). 2.3.1 Calcium 2.3.1.1 Biologische Bedeutung Bei einem erwachsenen Individuum sind 99 % des gesamten Calciumgehaltes als apatitische Calciumphosphate im Knochen lokalisiert und sorgen für dessen Stabilität (Engelhardt und Breves, 2000). Fehlt das Calcium im Knochen werden diese brüchig, dies wird auch als Osteoporose bezeichnet. Die restlichen Calciumionen des Organismus erfüllen wichtige Aufgaben bei der Signalübertragung in den Nerven, bei der Muskelkontraktion, bei der Hormonproduktion, im Flüssigkeitshaushalt, bei der Herzmuskelkontraktion und bei der Blutgerinnung (Tolonen, 1990). 26 Schrifttum 2.3.1.2 Vorkommen im Ei Im Ei kommt Calcium vor allem im Eigelb vor (Tabelle 7) und dort vor allem in den Granula (Tabelle 8). Die Dialysierbarkeit gibt an, wie viel Prozent der Calciumionen in freier Form vorkommen. Fast alle Calciumionen in den Granula sind in einem Komplex aus Lipovitellin und Phosvitin gebunden. Die im Plasma vorkommenden Calciumionen liegen dagegen fast vollständig in freier Form vor. Tabelle 7: Calciumgehalt im Ei _______ Calcium Gesamtei Eigelb Eiklar µg/g in der Feuchtsubstanz _________ 1 2 3 4 n.a. n.a. n.a. n.a. 1180 1390 630- 2150 1360 150 70 70- 290 90 µg/g Tr. M. 5 1900 2820 840 1: nach Manson et al. (1993), Erste Messreihe 2: nach Manson et al. (1993), Zweite Messreihe 3: nach Shenstone (1968) 4: nach Cotterill et al. (1977) 5: Mineralstoffgehalt nach Souci et al. (2000) n.a.: nicht angegeben Tabelle 8: Verteilung und Dialysierbarkeit der Calciumionen im Ei Calcium Eigelb Granula Plasma µg/g Tr. M. 2720 9880 580 Verteilung in % 83,3 16,7 Nicht dialysierbar in % 99,0 1,7 Mineralstoffgehalt nach Wakamatu et al. (1982a) Eine weitaus größere Calciumreserve als das Eigelb ist die Eischale, welche etwa 10 % des Eigewichtes ausmacht. Die in ihr zu 95 % enthaltenen anorganischen Calciumsalze bestehen zu 98 % aus Calciumcarbonat und zu weniger als 1 % aus Magnesiumcarbonat und Tricalciumphosphat (Burley und Vadehra, 1989; Ternes et al., 1994). Grob geschätzt enthält eine durchschnittliche Eischale von etwa 6 g einen Calciumanteil von etwa 2,5 g. Dieser Wert von 2 bis 2,5 g Calcium für die Calcifizierung der Eischale wird auch in der Literatur angegeben (Ternes et al., 1994). 27 Schrifttum Die Eischale ist somit die größte Calciumreserve im Ei. Die Calciumionen im Eigelb sind vor allem in den Granula lokalisiert und dort zu 99 % an Proteine gebunden (Tabelle 5). Die Calciumionen im Eigelb werden während der ersten 10 Tage der Embryonalentwicklung als Calciumquelle genutzt (Causeret et al., 1991; Johnston und Comar, 1955). In diesen ersten Tagen ist der Abfall der Calciumkonzentration im Eigelb und Eiklar proportional zum Anstieg des Calciumgehaltes im Embryo. Nach dem siebten Tag steigt der Calciumgehalt im Eigelb bis zum 19. Tag stärker an. Vergleicht man außerdem den Calciumgehalt des gesamten Eiinhaltes am Anfang der Inkubation mit dem Gesamtcalciumgehalt am Ende der Inkubationszeit, dann lässt sich eine Erhöhung um 400 % verzeichnen, die eine Calciummobilisation aus der Eischale vermuten lässt. Eine Zusammenfassung zur Calciummobilisation aus der Eischale präsentierten Glaser und Piehler (1934). Demnach diffundiert vom Embryo gebildetes Kohlendioxid (CO2) zur Eischale, wo sich aus dem unlöslichen Calciumcarbonat (CaCO3) lösliches Calciumhydrogencarbonat (Ca(HCO3)2) bildet, welches wieder zum Embryo diffundiert. Ab dem siebten Tag der Embryonalentwicklung steigt der Calciumgehalt der Eischalenmembran stark an und erreicht ein Maximum kurz vor dem Schlupf. Nach dem 9. Tag der Embryonalentwicklung berührt die Allantoismembran die Eischalenmembran (Burley und Vadehra, 1989) und man könnte annehmen, dass von den sie durchziehenden Blutgefäßen nicht nur CO2 abgegeben, sondern auch Calciumcarbonat aufgenommen wird (Romanoff und Romanoff, 1967). Die Anwesenheit von Calciumcarbonat in der Membran konnte durch Versuche mit Bariumhydroxid (Ba(OH)2) bestätigt werden. Während der Embryogenese können Erosionen in der Eischale und eine Vergrößerung der Poren beobachtet werden, die die Annahme einer Calciumabsoprtion aus der Eischale erhärten. Die Vergrößerung der Poren ist darüber hinaus auch notwendig für den Gasaustausch (Romanoff und Romanoff, 1967). 28 Schrifttum Insgesamt werden 78 bis 82 % des Calciumsbedarfs des Embryos durch die Eischale gedeckt und der Rest durch die Calciumionen in den Granula. Obwohl die Chorioallantoismembran stark mit Blutgefäßen durchsetzt ist und einen direkten Kontakt zum Embryo hat, soll das aufgenommene Calcium zunächst in die Granula gelangen und von dort zum Embryo transportiert werden, da der Calciumgehalt in den Granula ab dem 15. Inkubationstag stark ansteigt (Burley und Vadehra, 1989). 2.3.2 Magnesium 2.3.2.1 Biologische Bedeutung Magnesium ist zu 60 % im Knochen und der Rest hauptsächlich in den Zellen, vor allem Muskelzellen und Organen, lokalisiert (Oberleas et al., 1999). In Zellen werden Magnesiumionen für die Zellatmung, die Zellteilung und Enzymproduktion benötigt und für die Aufrechterhaltung der Funktion der Zellmembran. In den Muskeln werden Magnesiumionen für die Muskelkontraktion benötigt, so dass ein Magnesiummangel zu Muskellähmungen führen kann. Sie erfüllen außerdem wichtige Funktionen im Herzmuskel und sind für einen niedrigen Blutdruck verantwortlich. Eine weitere wichtige Funktion scheinen Magnesiumionen bei der Immunabwehr zu erfüllen, da offenbar weniger Antikörper gebildet werden, wenn weniger Magnesium mit der Nahrung aufgenommen wird. In Patientenstudien war die Milderung der Symptome von immunologisch bedingten Erkrankungen wie Allergien und Asthma scheinbar mit einer erhöhten Magnesiumaufnahme korreliert. Außerdem konnte Histamingehalt im Blut festgestellt werden (Tolonen, 1990). 29 ein reduzierter Schrifttum Eine chronische Unterversorgung an Magnesium führt außerdem zu Calciumablagerungen in weichem Gewebe und Blutgefäßen, wohingegen eine schwere akute Unterversorgung zu Gefäßerweiterung, Haarausfall, Zyanose, Übererregbarkeit und Krämpfen führt, die letztlich auch tödlich sind. Umgekehrt führt eine zu hohe Magnesiumkonzentration im Blut zur Erweiterung der Blutgefäße, Durchfall, Blutdruckabfall, Störung des zentralen Nervensystems, Atem- und Herzstillstand. Vergiftungsfälle durch eine hohe Magnesiumaufnahme mit der Nahrung sind bislang nicht bekannt (Oberleas et al., 1999). 2.3.2.2 Vorkommen im Ei Magnesium ist in allen Kompartimenten des Eies (Tabelle 9; Tabelle 10; Tabelle 11), inklusive Eischale, vorhanden. Für die Embryonalentwicklung benötigtes Magnesium wird aus den Granula und zu 23,5 % aus der Eischale mobilisiert (Burley und Vadehra, 1989). Letzteres konnte durch Untersuchungen an schalenlosen Embryos bestätigt werden (Dunn und Boone, 1977). Tabelle 9: Magnesiumgehalt im Ei _______ Magnesium Gesamtei Eigelb Eiklar 1 n.a. 110 100 µg/g in der Feuchtsubstanz _______ 2 3 4 n.a. n.a. n.a. 140 130 120 140 100 120 1: nach Manson et al. (1993), Erste Messreihe 2: nach Manson et al. (1993), Zweite Messreihe 3: nach Shenstone (1968) 4: nach Cotterill et al. (1977) 5: Mineralstoffgehalt nach Souci et al. (2000) n.a.: nicht angegeben 30 µg/g Tr. M. 5 460 280 720 Schrifttum Tabelle 10: Magnesiumgehalt in Eigelbfraktionen Magnesium Eigelb Granula Plasma Lipide d. Granula µg/g Tr. M. 177 749 73,7 45,2 Mineralstoffgehalt nach Grau und Roudybush (1979a) Tabelle 11: Verteilung und Dialysierbarkeit der Magnesiumionen im Ei Magnesium Eigelb Granula Plasma µg/g Tr. M 260 790 110 Verteilung in % 67,9 32,1 Nicht dialysierbar in % 94,9 54,5 Mineralstoffgehalt und Verteilung nach Wakamatu et al. (1982a) Die Dialysierbarkeit in Tabelle 11 gibt an, wie viele Magnesiumionen frei, dass heißt ungebunden, in den Fraktionen des Eigelbs vorkommen. In den Granula liegen demnach fast alle und im Plasma 50 % der Magnesiumionen in gebundener Form vor. 2.4 SPURENELEMENTE Spurenelemente kommen in einer Konzentration von unter 100 mg/kg Trockenmasse im Organismus vor. Dazu gehören Elemente wie Eisen, Kupfer, Zink, Mangan, Iod, Molybdän, Selen, Fluor, Brom, Chrom, Kobalt und Silizium, für die ein essentieller Effekt im Organismus nachgewiesen werden konnte. Für andere im Organismus vorkommende Elemente konnte kein positiver oder essentieller Effekt in niedrigen Konzentrationsbereichen nachgewiesen werde. Allen Spurenelementen ist gemein, dass sie in größeren Konzentrationen toxisch auf den Organismus wirken (Engelhardt und Breves, 2000). Richards trug die Gehalte für Eisen, Kupfer und Zink zusammen und stellte sie als absoluten Gehalt in einem 58 Gramm Ei einander gegenüber. Von diesen waren 19 Gramm Eigelb und 34 Gramm Eiklar (Richards, 1997). 31 Schrifttum Tabelle 12: Absoluter Spurenelementgehalt im Ei Eisen Zink Kupfer Eigelb µg in 19 g 1017 571 37 Eiklar µg in 34 g 53 5 10 nach Richards (1997) Es wird deutlich, dass im Eigelb wesentlich höhere Gehalte an Eisen-, Kupferund Zink vorhanden sind, als im Eiklar. Im Eigelb werden also diese Mineralstoffe gespeichert. 2.4.1 Eisen 2.4.1.1 Biologische Bedeutung Eisenionen sind vor allem im Hämoglobin der roten Blutkörperchen lokalisiert, außerdem im Myoglobin des Muskels und in Organen und im Knochenmark. Das Eisenion im Hämoglobin der roten Blutkörperchen bindet Sauerstoff und ist somit für dessen Transport verantwortlich. Außerdem ist Eisen in Enzymen vorhanden (Tolonen, 1990). Dazu gehören Cytochromoxidase, Peroxydasen, Katalasen, Dehydroxygenasen, Xanthinoxidase. Neben NADH-Cytochrom-Reduktase Sauerstofftransport spielt Eisen und beim Elektronentransport und Energieumsatz eine Rolle (Engelhardt und Breves, 2000). Die Notwendigkeit der Eisenionen für die Entwicklung des aviären Embryos wurde bereits 1968 von Savage experimentell bestimmt (Savage, 1968). Dass Eisenionen essentiell für die Entwicklung von Zellen sind, konnte ebenfalls durch Untersuchung an Zellkulturen bestätigt werden. Die Anwesenheit von Eisen, ob drei- oder zweiwertig, in freier Form oder an Transferrin gebunden, machte das Wachstum der Zellkulturen erst möglich. In Abwesenheit von 32 Schrifttum Eisenionen war das Wachstum bei allen Zellkulturen spärlich oder fand nicht statt. Untersucht wurden Zellkulturen aus Hühnermuskel-, Hühnerherz-, Hühnerretinapigment-, Hühnerfibroblasten- und Hühnerspinalnervenzellen. Der genaue Aufnahmemechanismus in die Zelle von freien und an Transferrin gebundenen Eisenionen ist allerdings noch unklar, wobei eine an einen Rezeptor gekoppelte Aufnahme diskutiert wird (Saito et al., 1982). Wichtigstes Symptom eines Eisenmangels ist eine Anämie, also ein Erythrozytenmangel. Dieser führt letztlich auch zu einem Sauerstoffmangel des Organismus. Ein Eisenmangel führt aber auch zu Schleimhautveränderungen im Magen und im Darm und verringert die Aufnahme von Vitamin B12. Im Zwölffingerdarm werden Eisen-(II)-Ionen durch ein Eisentransportprotein aktiv resorbiert. Eisen-(III)-Ionen werden durch eine Ferroxidase zu Eisen-(II)Ionen reduziert (Schümann und Weiss, 2002). Der niedrige pH-Wert im Zwölffinderdarm begünstigt die Lösung von Eisensalzen und damit deren Resorption (Engelhardt und Breves, 2000). Aufgrund des bedarfsorientierten Aufnahmemechanismus im Darm und der generell geringen Bioverfügbarkeit von Eisen, ist eine Vergiftung durch oral aufgenommenes Eisen unwahrscheinlich, kommt aber bei Aufnahme hoher Konzentrationen löslicher Eisensalze vor. Die Symptome sind charakteristisch für Vergiftungen und schließen Erbrechen, Magenkrämpfe, Schock, Atemnot und generalisierte Muskelkrämpfe ein. Charakteristisch ist außerdem schwarzer Durchfall (Oberleas et al., 1999). 2.4.1.2 Vorkommen im Ei Die im Ei vorkommenden Eisenionen sind vor allem im Eigelb lokalisiert (Tabelle 13) und dort in der Granulafraktion (Tabelle 14 und Tabelle 15). 33 Schrifttum Tabelle 13: Eisengehalt im Ei _______ Eisen Gesamtei Eigelb Eiklar 1 n.a. 60 n.a. µg/g in der Feuchtsubstanz ______ 2 3 4 n.a. n.a. n.a. 80 40 - 110 60 n.a. 0,1 0,1 µg/g Tr. M. 5 88 140 9 1: nach Manson et al. (1993), Erste Messreihe 2: nach Manson et al. (1993), Zweite Messreihe 3: nach Shenstone (1968) 4: nach Cotterill et al. (1977) 5: Mineralstoffgehalt nach Souci et al. (2000) n.a.: nicht angegeben Tabelle 14: Eisengehalt in Eigelbfraktionen Eisen Gesamteigelb Granula Plasma Lipide der Granula µg/g Tr. M. 69,4 400 7,56 10,1 Mineralstoffgehalt nach Grau und Roudybush (1979a) Tabelle 15: Verteilung und Dialysierbarkeit der Eisenionen im Ei Eisen Eigelb Granula Plasma µg/g Tr. M. 100 480 In Spuren Verteilung in % 99,0 1 Nicht dialysierbar in % 77,1 n.a. Mineralstoffgehalt und Verteilung nach Wakamatu et al. (1982a) n.a.: nicht angegeben Die in den Granula vorhandenen dreiwertigen Eisenionen sind zu 95 % an Phosvitin, einem Phosphoprotein, gebunden (Greengard. et al., 1964). Das Lipovitellin des Lipovitellin-Phosvitin-Komplexes kann ebenfalls Eisenionen binden (Richards, 1997). Daher ist auch die Dialysierbarkeit der Eisenionen gering. An aus Hühnereiern isoliertes Phosvitin sind 2 bis 3 Eisenionen pro Molekül gebunden. Wird Eisen zu einer Phosvitinlösung zugesetzt, binden etwa 65 bis 70 Eisenionen pro Molekül. Eisen-(II)-Ionen werden dabei zu Eisen-(III)Ionen oxidiert (Taborsky, 1980). Da die Bindungskapazität des im Ei vorkommenden Phosvitins somit noch nicht erschöpft ist, können auch Eisenionen aus gleichzeitig aufgenommenen Nahrungsmitteln gebunden werden (Callender et al., 1970; Morris und Greene, 34 Schrifttum 1972; Rossander et al., 1979; Ternes et al., 1994). Die Resorptionsrate von nicht an Häm gebundene Eisenionen wird von 1,5 % bis 10 % beim Menschen angegeben (Bjoern-Rasmussen und Hallberg, 1979; Moore, 1965; Schulz und Smith, 1958). Bei einem Eisenmangel kann die Resorptionsrate auf 30 % gesteigert werden (Schümann und Weiss, 2002). Die an Phosvitin gebundenen Eisenionen haben, durch die feste Bindung, eine äußerst geringe Bioverfügbarkeit, die auch durch 40 minütiges Erhitzen bei 110 °C nicht erhöht werden kann (Albright et al., 1984). Auch ein Zusatz von Citronensäure und Kochsalz (Albright et al., 1984) hat keinen Effekt, obwohl die Granula bei Zusatz von 0,58 molarer NaCl-Lösung bereits vollständig gelöst vorliegen (Morris und Greene, 1972; Ternes, 1991). Der Zusatz von Ascorbinsäure (Jacobsen et al., 2001; Morris und Greene, 1972) und EDTA (Albright et al., 1984) dagegen bewirkt eine Freisetzung des an Phosvitin gebundenen Eisens. Der Grund hierfür ist, dass Ascorbinsäure dreiwertige zu zweiwertigen Eisenionen reduziert und mit ihnen einen gut wasserlöslichen Komplex bildet (Windisch und Leitzmann, 1984). Nielsen et al. vermuteten hierin den Grund für eine verstärkte Lipidoxidation in mit Ascorbinsäure angereicherter Mayonnaise durch frei vorliegende Eisen-(II)-Ionen (Nielsen et al., 2000). Castellani et al. (2004) untersuchten die Eisenbindung an Phosvitin bei verschiedenen pH-Werten und Ionenstärken. Die stärkste Bindung von 115 µg Eisen pro mg Phosvitin konnte bei pH 6,5 und einer Ionenstärke von 0,15 M festgestellt werden. Sie fanden außerdem heraus, dass, sobald das Eisen unter günstigen Bedingungen gebunden war, eine starke Ansäuerung die Bindungseigenschaften des Phosvitins nicht mehr beeinflusste. Außerdem konnte die Bindungskapazität des Phosvitins nicht durch hohe Temperaturen von 90 °C für 60 Minuten und einem Druck von 600 MPa gemindert werden. Im Eiklar ist Eisen an Conalbumin gebunden. Dieses Protein gehört zu den Transferrinen (metallbindende Proteine) und wird auch als Ovotransferrin bezeichnet. Dem Conalbumin wird 35 weniger eine Rolle in der Schrifttum Mineralstoffspeicherung, als vielmehr eine Rolle in der mikrobiellen Abwehr zugesprochen, da das an Conalbumin gebundene Eisen für Mikroorganismen nicht mehr verfügbar ist (Ternes et al., 1994). 2.4.2 Kupfer 2.4.2.1 Biologische Bedeutung Die Kupferionen im Organismus sind an Eisenstoffwechsel, Zellatmung, Pigmentierung, Keratinisierung (Verhornung), Fettstoffwechsel und Immunfunktion beteiligt und haben eine Bedeutung für die Reproduktion und das Nervensystem. Kupferionen sind Bestandteil einiger Enzyme im Organismus, dazu gehören Oxidasen, Tyrosinasen und Ceruloplasmin. Außerdem sind sie Bestandteil von Metalloproteinen wie Erythrocuprein, Hepatocuprein und Cerebrocuprein (Engelhardt und Breves, 2000). Zusammen mit Zinkionen im SOD (Superoxiddismutase)-Enzym kommen sie in roten Blutkörperchen und in allen Geweben vor und haben dort die Aufgabe freie Sauerstoffradikale zu neutralisieren. In dem Plasmaprotein Ceruloplasmin kommen allein acht Kupferatome vor. Es reguliert den Hormon-, Adrenalin-, Noradrenalin-, Serotonin- und Melatoningehalt im Organismus. Außerdem spielt es eine Rolle bei der Synthese von roten Blutkörperchen und neutralisiert freie Radikale. Mit der Nahrung aufgenommene Kupferionen werden in niedriger Konzentration durch einen aktiven sättigbaren Transportvorgang resorbiert und in hohen Konzentration auch durch Diffusion. Die Aufnahme erfolgt sowohl im Magen, als auch im Dünndarm (Schümann, 2002). Die Notwendigkeit für das Wachstum von aviären Embryos wurde von Savage 1968 bestätigt, indem sie Hühner mit einer kupferfreien Diät fütterten und die Embryos der Eier dieser Hennen untersuchten (Savage, 1968). Ein 36 Schrifttum Kupfermangel führt zur Störung des Eisenstoffwechsels und Anämie, Knochenschäden und Störungen und Schäden im Herzkreislaufsystem (Oberleas et al., 1999). 2.4.2.2 Vorkommen im Ei Die in den Granula lokalisierten Kupferionen sind vor allem an Lipovitellin, aber auch an Phosvitin des Lipovitellin-Phosvitin-Komplexes gebunden (Richards, 1997). Obwohl auch die Eischale Kupfer enthält ist bislang nicht geklärt, ob es sich hierbei auch um ein Nährstoffdepot handelt, oder ob die Henne durch Ablagerung in der Eischale überschüssiges Kupfer ausscheidet (Richards, 1997). Conalbumin und Ovalbumin binden im Eiklar Kupferionen (Richards und Steele, 1987; Ternes et al., 1994). Der Kupfergehalt im gesamten Ei wird von Souci et al. mit 2,38 µg/g in der Trockenmasse angegeben (Souci et al., 2000). Der Gehalt der Kupferionen in Eigelbfraktionen ist in Tabelle 16 dargestellt. Tabelle 16: Kupfergehalt in Eigelbfraktionen Kupfer Eigelb Granula Plasma Lipide in der Granula µg/g Tr. M. 20,3 20,6 20,5 15,6 Mineralstoffgehalt nach Grau und Roudybush (1979a) Vergleicht man den Gehalt im Eigelb mit Angaben anderer Autoren (siehe Seite 11 Tabelle 5) erscheint der von Grau und Roudybush angegebene Gehalt zu hoch, so dass auch die dargestellte Kupferverteilung in den Eigelbfraktionen möglicherweise nicht den tatsächlichen Verhältnissen entspricht (siehe auch 4.2.2 und 4.2.3). 37 Schrifttum 2.4.3 Zink 2.4.3.1 Biologische Bedeutung Zinkionen sind im ganzen Organismus gleichmäßig verteilt, so dass keine speziellen Organe als Speicherorgane aufgrund erhöhter Zinkkonzentration identifiziert werden können. Bei einem Mangel an Zinkionen wird allerdings das im Knochenmark, Nieren und Hoden gespeicherte Zink als erstes mobilisiert (Oberleas et al., 1999). Bislang konnten Zinkionen als Bestandteil von fast 100 Enzymen identifiziert werden. Dazu gehören Anhydrasen, Carboxypeptidasen, Dehydrogenasen, alkalische Phosphatase, Ribonuclease und DNA-Polymerase (Engelhardt und Breves, 2000). Zinkionen werden für den Hormonhaushalt, das Wachstum, die Hautneubildung, die Wundheilung, die Immunfunktionen, bei der Wasser- und Kationenbilanz (Engelhardt und Breves, 2000), sowie beim Knochenaufbau, bei der Produktion von Proteinen, bei der Regulation der RNA- und Insulinsynthese und im Kohlenstoffwechsel benötigt. Außerdem ist es Bestandteil der KupferZink-Superoxiddismutase, einem Enzym, welches freie Sauerstoffradikale unschädlich macht. Das Enzym welches bei der Vitamin A-Synthese Retinol zu Retinal umwandelt, enthält ebenfalls Zinkionen. Bei der Umwandlung von Linolsäure zu ?-Linolsäure in der Protaglandinsynthese werden ebenfalls Zinkionen benötigt (Tolonen, 1990). In Experimenten mit embryonierten Eiern konnte gezeigt werden, dass Zinkionen für die normale Entwicklung und das Wachstums des aviären Embryos essentiell sind (Savage, 1968). Symptome eines Zinkmangels sind Wachstumsstörungen, Appetitlosigkeit, vermindertes Haarwachstum, Störungen der Hautbildung, Hodenatrophie und Störungen im weißen Blutbild. Eine Zinkvergiftung führt vor allem zu allgemeinen Vergiftungserscheinungen wie Erbrechen, Durchfall und Magenkrämpfen (Oberleas et al., 1999). 38 Schrifttum 2.4.3.2 Vorkommen im Ei Die Zinkionen im Ei sind zum überwiegenden Teil im Eigelb lokalisiert (Tabelle 17) und dort in der Granulafraktion zu 90 % an das Lipovitellin des PhosvitinLipovitellin-Komplexes gebunden. Zinkionen können aber ebenfalls an Phosvitin gebunden vorliegen (Richards, 1997). Zink bindendes Protein im Eiklar ist das Ovalbumin. Tabelle 17: Zinkgehalt im Ei Zink Gesamtei Eigelb Eiklar µg/g Tr. M. 50 62 1,5 Mineralstoffgehalt nach Souci et al (2000) Tabelle 18: Zinkgehalt in Eigelbfraktionen Zink Eigelb Granula Plasma Lipide der Granula µg/g Tr. M. 46,9 288 2,19 * Mineralstoffgehalt nach Grau und Roudybush (1979a) *Gehalt unter Nachweisgrenze Die Zinkionen sind also wie die Eisenionen vor allem in den Granula des Eigelbs lokalisiert. Es konnten in der Literatur keine Angaben gefunden werden, die die von Grau und Roudybush gefundene Verteilung bestätigen. 39 Schrifttum 2.5 THIAMIN UND SEINE PHOSPHATESTER 2.5.1 Chemische Eigenschaften Das Thiaminmolekül besteht aus einem Pyrimidinring und einem Thiazolring, die durch eine Methylgruppe verbunden sind. Die Ethylgruppe am Thiazolring trägt im Falle von Thiamin eine Hydroxygruppe (Abbildung 4). Abbildung 4: Thiamin und Thiaminphosphate R NH2 C N H3C H N Pyrimidinring H N + S Thiamin O H H C C H3C OH R O P OH Thiaminmonophosphat R OH H H O Thiazolring O R O P O P OH OH OH O O Thiamindiphosphat O O P O P O P OH R OH OH Thiamintriphosphat OH Reines Thiamin bildet eine feste, kristalline Struktur und erscheint weiß. Es löst sich gut in Wasser und Methanol und weniger gut in Ethanol (Eisenbrand, 2006). Bei pH 2 bis 4 ist es in Wasser gelöst über einen längeren Zeitraum stabil. Die Stabilität hängt nicht nur vom pH-Wert sondern auch von Lichteinwirkung und Temperatur ab. Je stärker die Licht- oder Temperatureinwirkung, desto schneller der Zerfall. Dabei wird die Verbindung zwischen Thiazol- und Pyrimidinring gespalten. Die Hydroxygruppe am Thiamin kann durch eine oder mehrere Phosphatgruppen substituiert sein (Abbildung 4). In pflanzlichen und tierischen Organismen kommen sowohl Thiaminmono-, -di-, als auch -triphosphat in 40 Schrifttum unterschiedlicher Häufigkeit vor. Thiamindiphosphat wird ebenfalls als Thiaminpyrophosphat bezeichnet. Grundsätzlich sind auch die Phosphatester des Thiamins in saurer wässriger Lösung unter Lichtausschluss und bei niedriger Temperatur stabil. Je mehr Phosphatgruppen vorhanden sind, desto eher werden diese bei ungünstigen Lagerungsbedingungen abgespalten. Thiamin und seine Phosphatester sollen dennoch in gefrorenem Zustand über mehrere Monate stabil sein. Eine wässrige Thiamindiphosphatlösung bei pH 2 bis 6 und 0 °C ist für 6 Monate stabil, ebenso eine wässrige Thiamintriphosphatlösung bei einer Temperatur zwischen -20 °C und -80 °C. Wiederholtes Einfrieren und Auftauen beschleunig den Zerfall der Thiamine (Ball, 2004; Egi und Kawasaki, 2003; Kawasaki und Egi, 2000a; Lonsdale, 2006). 2.5.2 Biochemie Mit der Nahrung aufgenommenes Thiamin wird, sofern es Phosphatgruppen trägt, durch Phosphatasen dephosphoryliert. Durch einen aktiven Transportmechanismus mit Beteiligung von Natriumionen wird es im Duodenum (Zwölffingerdarm) und im vorderen Jejunum (Dünndarm) in die Enterozyten (Darmzellen) aufgenommen (Ball, 2004). Neben diesem aktiven Transport ist eine passive Diffussion möglich, die beim hydrophilen Thiamin gering, bei lipophilen Thiaminanaloga, beispielsweise Benfothiamin (Lonsdale, 2006), dagegen gut ist (Bitsch, 1997). In den Zellen wird ein Austritt aus der Zelle durch Phosphorylation, vor allem zu Thiamindiphosphat, verhindert. Intrazelluläre Thiaminphosphate werden durch mikrosomale Phosphatasen wieder dephosphoryliert und können dann aus der Zelle in den Blutkreislauf transportiert werden. Im Blutkreislauf sind 20 bis 30 % des Thiamins an Plasmaproteine gebunden, Thiaminmonophosphat liegt dagegen frei vor. Über die Pfortader gelangt das Thiamin im Blut zur Leber wo es durch die 41 Schrifttum Thiaminpyrophosphokinase zu Thiamindiphosphat metabolisiert wird. Diese Reaktion ist auch in anderen Geweben möglich. Im Gehirn und Nervengewebe finden verschiedene Reaktionen statt. Da Thiamintriphosphat für die Nervenfunktion eine Rolle spielt wird es aus Thiamindiphosphat durch die Thiaminpyrophosphat-ATP-Phosphoryltransferase gebildet. Im nervalen Gewebe kommen ebenfalls drei Phosphatasen vor (Thiamintriphosphatase, Thiaminpyrophosphatase, Thiaminmonophosphatase), die das Thiamintriphosphat stückweise abbauen, so dass es letztlich als Thiamin vorliegt (Ball, 2004). Die Hälfte des Gesamtthiamingehaltes des Organismus ist in der Muskulatur verteilt und der Rest in Leber, Herz, Niere und Gehirn. Die biologische Halbwertszeit beträgt 9 bis 18 Tage, so dass eine ständige Zufuhr von Thiamin mit der Nahrung notwendig ist. Die Ausscheidung von überschüssigem Thiamin und seiner Spaltprodukte erfolgt hauptsächlich über die Niere, wobei freies Thiamin neben bis zu 18 vermuteten Metaboliten (z.B.: Thiamincarbonsäure, Pyramin= 2,5-Dimethyl-4aminopyrimidin, Pyrimidincarbolsäure, 4- Methylthiazol-5-Essigsäure, Thiazol (Ariaey- Nejad et al., 1970; Matsuo und Suzuoki, 1969)) ausgeschieden werden. Durch Schwitzen können ebenfalls hohe Thiaminmengen verloren gehen, wohingegen mit der Galle nur minimale Mengen abgegeben werden (Ball, 2004). Thiaminpyrophosphat ist bei zwei Reaktionen als Coenzym im Organismus beteiligt. Zum einen spaltet es leicht Bindungen neben Carbonylgruppen, wie zum Beispiel bei einer Decarboxylierung. Zum anderen kann es eine aktivierte Aldehydgruppe von einem Kohlenstoffatom auf ein anderes übertragen. Der funktionelle Teil des Thiaminpyrophosphats ist der Thiazolring. Im Organismus ist Thiaminpyrophosphat als essentieller Co-Faktor an folgenden Reaktionen beteiligt: 42 Schrifttum Tabelle 19: Enzyme mit Thiaminpyrophosphat Enzym Pyruvat-Dehydrogenase a-Ketoglutarat-Dehydrogenase Acetolacetat-Synthetase Funktion Synthese von Acetyl-CoA Citronensäurezyklus Biosynthese von Valin und Leucin Der Pyruvat-Dehydrogenase-Komplex ist in den Mitochondrien lokalisiert und ein wichtiger Teil der Zellatmungskette. Diese besteht aus mehreren Stufen: Zunächst wird aus Glucose in der Glycolyse Pyruvat gebildet. Das Pyruvat wird im Pyruvat-Dehydrogenase-Komplex zu Acetyl-CoA und CO2 oxidiert. Das Acetyl-CoA wird als Substrat im Citronensäurezyklus vollständig zu CO2 abgebaut, wobei letztlich ein Elektronenfluss entsteht, der in der Atmungskette benötigt wird um Adenosintriphosphat zu bilden, welches der Energielieferant des gesamten Organismus ist. Der Pyruvat-Dehydrogenase-Komplex besteht aus drei Enzymen, wobei Thiaminpyrophosphat als Coenzym an das erste gebunden ist. Bei der Umwandlung von Pyruvat zu Acetyl-CoA handelt es sich um eine oxidative Decarboxylierung. Im ersten Schritt wird Pyruvat an Thiaminpyrophosphat gebunden, wobei eine CO2 Gruppe abgespalten wird. Die so gebildete Hydroxyethyl-Gruppe wird dann zu einer Carbonsäure oxidiert und mit Coenzym A zu Acetyl-CoA verestert. Bei der Regeneration des Enzymkomplexes findet eine Elektronenübertragung statt, die wiederum für die Atmungskette von Bedeutung ist (Lehninger et al., 1998). Die a-Ketoglutarat-Dehydrogenase ist Teil des Citronensäurezyklus, welcher über die Bildung reduzierter Cofaktoren Energie konserviert und wichtige Vorstufen anderer Reaktionen im Organismus liefert. Die Reaktionen des Citronesäurezyklus laufen in den Mitochondrien ab. Im vierten Schritt des Citronensäurezyklus katalysiert der a-Ketoglutarat- Dehydrogenase Komplex die oxidative Decarboxylierung von a-Ketoglutarat zu Succinyl-CoA. Die Reaktion gleicht der Reaktion des Pyruvat-Dehydrogenase43 Schrifttum Komplexes und auch die Enzymkomplexe sind einander sehr ähnlich. Der erste Enzymkomplex allerdings, an dem auch das Thiaminpyrophosphat gebunden ist, ist strukturell so verschieden, dass nur das für den Komplex typische Substrat gebunden wird. Die zweite und dritte Untereinheit dagegen sind in beiden Enzymkomplexen fast identisch. Das gebildete Succinyl-CoA ist eine Vorstufe von Porphyrinen und des Häms, welches ein essentieller Bestandteil roter Blutkörperchen ist. Valin wird durch die Acetolactat-Synthetase aus Pyruvat, Energie in Form von NADH und Glutamat gebildet. Aus einer Zwischenstufe dieser Reaktion wird ebenfalls Leucin synthetisiert (Lehninger et al., 1998). Thiamintriphosphat ist zu etwa einem Prozent des Gesamtthiamins im Nervengewebe vertreten. Obwohl nur in geringer Menge vorhanden, scheint es doch eine außerordentlich wichtige Funktion im Nervengewebe zu besitzen. Ein Thiaminmangel des Organismus führt zu einer Abnahme des Gesamtthiamins, während aber, selbst über eine Mangelsituation von vier Wochen, der Thiamintriphosphatgehalt im Gehirn stets konstant bleibt. Es konnte vor allem in Membranen der peripheren Nervenzellen nachgewiesen werden (Ball, 2004). Die Bedeutung von Thiamin für die Nervenerregbarkeit wurde bereits 1971 belegt (Eichenbaum und Cooper, 1971). Sie zerstörten mittels ultravioletter Strahlung das endogene Thiamin und konnten zeigen, dass die nun nicht mehr stimulierbaren Nerven wieder erregbar wurden, wenn sie in eine Thiaminlösung überführt wurden. Diese Tatsache konnte durch Experimente an Flusskrebsaxonen von Sasa et al. 1976 bestätigt werden (Sasa et al., 1976). Fox und Duppel fanden 1975 erste Hinweise, die von Bettendorf 1990 bestätigt wurden, dass Thiamintriphosphat einen stabilisierenden Effekt auf das Membranpotential hat (Fox und Duppel, 1975; Bettendorff et al., 1990). Sie konnten außerdem belegen, dass die Aufnahme von Chloridionen in 44 Schrifttum Membranvesikel durch Thiamintriphosphat um 10 % erhöht wird (Bettendorff et al., 1990). Ein weiterer Wirkmechanismus von Thiamin scheint die Synthese von Neurotransmittern zu sein, da daran Pyruvat-, a-Ketoglutarat-Dehydrogenase und Transketolase beteiligt sind (Ball, 2004). 2.5.3 Thiaminmangel Ein Thiaminmangel kann seine Ursache in einer unzureichenden Aufnahme mit der Nahrung, der Aufnahme von Thiaminantagonisten, Thiaminasen, oder auch einen zu hohen Alkoholkonsum haben. Aufgrund der allgemeinen Notwendigkeit des Thiamins in der Atmunsgskette, äußert sich ein Mangel an Thiamin klinisch besonders in Geweben mit hohem Energieumsatz wie: Zentralnervensystem, Magen, Darm und Muskelsystem. Die Läsionen im Nervensystem stellen sich histopathologisch als allgemeiner Gewebsuntergang, Proliferation von Gliazellen und Zerstörung markhaltiger Nervenfasern dar (Ball, 2004). Die Nekrosen können, da das Gehirn auf eine Energiegewinnung durch aerobe Glykolyse angewiesen ist, durch eine hypoxische Schädigung erklärt werden (Bickhardt, 1992). Die Nervenschädigungen äußern sich in Symptomen wie Appetitlosigkeit, Stimmungsschwankungen, Parästhesie (Sensibilitätsstörung) der Hände und Füße, Abnehmen von Kniescheiben- und Achillessehnenreflexen und einer allgemeinen Abnahme aller Sinnesempfindungen. Eine Magenverstimmung und Darmatonie können ebenfall auftreten. Durch die Muskelbeeinträchtigung kann es zu allgemeiner Muskelschwäche und am Herzen zu Rhythmusstörungen kommen (Ball, 2004). 45 Schrifttum 2.5.4 Thiamingehalt in Lebensmitteln 2.5.4.1 Allgemein In pflanzlichen Geweben kommt Thiamin vorwiegend in seiner freien Form vor. In tierischen Geweben dagegen ist Thiamin hauptsächlich in der biologisch aktiven Form, Thiamindiphosphat, vorhanden, nämlich zu 80 bis 85 %. Der Rest ist freies Thiamin, Thiaminmonophosphat und Thiamintriphosphat. Eine Ausnahme bildet die Skelettmuskulatur vom Schwein und die weiße Skelettmuskulatur vom Huhn, in der Thiamin zu 70 bis 80 % als Thiamintriphosphat vorliegt (Ball, 2004). Als reich an Thiamin gelten laut DGE (Deutsche Gesellschaft für Ernährung) Lebensmittel mit denen in einer Portion mindestens 15 % des Tagesbedarfs gedeckt werden. Anhand dieser Definition zählt Hühnerfleisch zu den thiaminreichen Lebensmitteln und wird nur von Schweinefleisch übertroffen (Elmadfa, 1985). Miyoshi et al. bestimmten den Gehalt von Thiamin und der Thiaminphosphateester, einschließlich Thiamintriphosphat, in der weißen und roten Muskulatur von ausgewachsenen 5 bis 9 Monate alten Hühnern. Sie fanden heraus, dass der Gesamtthiamingehalt in beiden Muskeltypen zwar gleich, aber das Verhältnis von Thiamin und den Thiaminphosphaten unterschiedlich ist. In der weißen Muskulatur betrug der Anteil des Thiamintriphosphats am Gesamtthiamingehalt 80 %, während in der roten Muskulatur nur 30 % Thiamintriphosphat vorhanden sind (Miyoshi et al., 1990). 2.5.4.2 Thiamin im Ei Der Thiamingehalt im Eiklar wird von Ternes et al. mit 0,29 µg/g und für Eigelb mit 2,9 µg/g angeben (Ternes et al., 1994). Zu ähnlichen Ergebnissen kamen auch Hisil und Ötles (1997), die 0,27 µg/g für Eiklar und zwischen 2,71 und 46 Schrifttum 2,84 µg/g für Eigelb angeben. Unterschiede im Gehalt zu Angaben, die in älteren Veröffentlichungen gemacht wurden, so vermuteten sie, können einerseits durch die Fütterung und andererseits dadurch erklärt werden, dass heutige Legehybriden mehr Thiamin in Eiern anreichern, als die Rassen in den 50er und 60er Jahren. Fütterungsstudien zeigten allerdings, dass der Thiamingehalt im Ei nur solange proportional zum Gehalt im Futter ansteigt, bis der Bedarf der Henne gedeckt ist (Hisil und Ötles, 1997). Ein Thiamingehalt im Futter, der über den Bedarf der Henne hinausgeht führt nicht zu einer Erhöhung des Thiamingehaltes im Ei. Der Gehalt ist außer von der Rasse und der Fütterung noch von der Jahreszeit abhängig. Eigelb gehört prinzipiell zu den Lebensmitteln, die einen relativ hohen Thiamingehalt haben, der dem Gehalt in µg/g der meisten Fischsorten entspricht (Elmadfa, 1985). Dennoch werden Eier und auch Eigelb laut DGE nicht zu den thiaminreichen Lebensmitteln gezählt, da ein Ei nur etwa 18 g Eigelb enthält und daher gegenüber einer Portion Fisch von 100 g einen wesentlich geringeren Thiamingehalt aufweist. Anders ausgedrückt ist ein durchschnittlicher Verzehr von 100 g Fleisch oder Fisch pro Tag realistisch, ein Verzehr von 100 g Eigelb aber eher unwahrscheinlich, da dies 5 Eigelben entspräche. Von Muniyappa und Adiga (1981) wurden aus dem Eiklar und dem Eigelb zwei einander sehr ähnliche Proteine isoliert, die unter experimentellen Bedingungen Thiamin im Verhältnis 1:1 binden (Burley und Vadehra, 1989). Es wird angenommen, dass auch im nativen Eigelb das Thiamin an diese Proteine gebunden ist (White et al., 1976). 47 Schrifttum 2.6 ANALYTISCHE METHODEN 2.6.1 Nachweis von Thiamin Eine verbreitete Methode Thiamin in biologischen Proben nachzuweisen ist die Extraktion aus der Matrix und eine anschließende spektroskopische Bestimmung. In biologischen Proben liegen Thiamin und seine Phosphatester entweder frei, oder an Proteine gebunden vor. Je nach Beschaffenheit der Probe müssen sie also gegebenenfalls aus den Zellen heraus- und von den Proteinen abgelöst werden. Da sich Thiamin und seine Phosphatester in Wasser und in Methanol lösen, werden entsprechende Lösungen zur Extraktion gewählt. Bei festerem Probenmaterial erfolgt zusätzlich eine mechanische Bearbeitung. Um die Feststoffe von dem wässrigen Probenextrakt zu trennen erfolgt anschließend eine Zentrifugation. Die Extraktion erfolgt mit Lösungen wässriger Säuren, wobei Trichloressigsäure (Bettendorff et al., 1986; Bettendorff et al., 1991; Bontemps et al., 1984b; Botticher und Botticher, 1986; Burch et al., 1952; Herve et al., 1994; Iwata et al., 1988; Kimura und Itokawa, 1983; Kimura und Itokawa, 1985; Matsuda und Cooper, 1981; Rindi und Giuseppe, 1961; Sander et al., 1991; Tallaksen et al., 1991; Viñas et al., 2003b), Perchlorsäure (Batifoulier et al., 2005; Brunnekreeft et al., 1989; Chase et al., 1993; Laschi-Loquerie et al., 1992; Losa et al., 2005) und Salzsäure (Alyabis und Simpson, 1993; Laschi-Loquerie et al., 1992; Ndwa et al., 2000; Sanchez-Machado et al., 2004; Viñas et al., 2003a) am häufigsten genutzt werden. Nur in Einzelfällen werden andere Säuren (Sulfosalicylsäure, Phosphorsäure) (Kim et al., 2002; Vanderslice und Huang, 1986), oder auch Methanol (Baines, 1985) verwendet. Die Wahl der Säure und deren Konzentration hängt vor allem von der Komplexität der Probenmatrix und von der Art der Analyten ab, die neben Thiamin bestimmt werden sollen. Durch 48 Schrifttum Säurelösungen mit einer Konzentration zwischen 5 und 10 % werden Proteine bei einer Temperatur von 0 °C durch Denaturierung gefällt und können anschließend abzentrifugiert werden (Geckeler, 1998). Die Fällung mit Trichloressigsäure wird beispielsweise in der Bioanalytik mit einer 10 % igen Lösung durchgeführt, wobei eine Endkonzentration in der Probe von 3 bis 4 % angestrebt wird (Lottspeich und Engels, 1998). Eine Bestimmung von Thiamin ohne vorherigen Extraktionsschritt ist nur bei sehr einfachen Probenmatrices, wie Urin, Blutplasma oder Standards möglich (Bontemps et al., 1984a; Ichinose und Mitsui, 1988; Ishii et al., 1979; Viñas et al., 2001). Der Extraktionsschritt ist in der Regel gekoppelt mit einer mechanischen Zerkleinerung der Probe, wenn es sich um Feststoffe handelt. Das Thiamin liegt in biologischen Proben häufig in verschiedenen Formen vor, nämlich als Thiaminhydrochlorid und als Thiaminphosphatester. Soll nun der Gesamtthiamingehalt bestimmt werden, werden die Thiaminphosphate nach der Säureextraktion enzymatisch dephosphoryliert, so dass nur noch Thiaminhydrochlorid in der Probe vorliegt und gemessen wird (Abdel-Kader, 1992; Alyabis und Simpson, 1993; Botticher und Botticher, 1986; Burch et al., 1952; Laschi-Loquerie et al., 1992; Ndwa et al., 2000; Rettenmaier et al., 1979; Sanchez-Machado et al., 2004; Schrijver et al., 1982; Viñas et al., 2003a). In Abhängigkeit von der biologischen Probenmatrix aus der extrahiert wurde und dem Verfahren das gewählt wurde, ist der Probenextrakt mehr oder minder stark mit unerwünschten Bestandteilen verunreinigt. Daher folgt in einigen Fällen eine Probenaufreinigung (Alyabis und Simpson, 1993; Bettendorff et al., 1991; Kim et al., 2002; Rettenmaier et al., 1979; Sanchez-Machado et al., 2004). Je nach Art und Stärke der Verunreinigung können Papierfilter, Spritzenvorsatzfilter oder Festphasenextraktion genutzt werden. Die Trennung der Analyten, mittels Hochdruckflüssigchromatographie (HPLC) und eine nachfolgende spektroskopische Bestimmung sind stark verbreitet. In der Literatur sind HPLC Methoden für die Bestimmung von Thiamin oder 49 Schrifttum Gesamtthiamin (Abdel-Kader, 1992; Botticher und Botticher, 1986; Fayol, 1997; Laschi-Loquerie et al., 1992; Mascher und Kikuta, 1997; Schrijver et al., 1982) für die simultane Bestimmung von Thiamin und anderen Analyten (Chase et al., 1993; Gennaro, 1991; Kim et al., 2002; Ndwa et al., 2000; SanchezMachado et al., 2004; Viñas et al., 2003a) und die gleichzeitige Bestimmung von Thiamin und seinen Phosphatestern (Batifoulier et al., 2005; Bettendorff et al., 1986; Bettendorff et al., 1991; Bontemps et al., 1984b; Bontemps et al., 1984a; Brunnekreeft et al., 1989; Herve et al., 1994; Ishii et al., 1979; Iwata et al., 1988; Kimura und Itokawa, 1983; Kimura und Itokawa, 1985; Losa et al., 2005; Sander et al., 1991; Sanemori et al., 1980; Tallaksen et al., 1991; Vanderslice und Huang, 1986; Viñas et al., 2001; Viñas et al., 2003b) beschrieben. Eine erfolgreiche Trennung hängt vor allem von der Wahl der passenden Chromatographiesäule ab. Für die chromatographische Trennung wurden bislang am häufigsten C-18 Säulen verwendet (Bontemps et al., 1984b; Brunnekreeft et al., 1989; Chase et al., 1993; Gennaro, 1991; Herve et al., 1994; Ichinose und Mitsui, 1988; Iwata et al., 1988; Kim et al., 2002; Kimura und Itokawa, 1983; Kimura und Itokawa, 1985; Li und Brown, 2003; Losa et al., 2005; Sanchez-Machado et al., 2004; Sander et al., 1991; Sanemori et al., 1980; Vanderslice und Huang, 1986; Viñas et al., 2001). Da es sich hierbei um lange, lipophile Kohlenstoffketten handelt, werden lipophile Substanzen am besten retardiert. Um die Retention von Thiamin und seiner Phosphatester zu verbessern, die aufgrund ihrer Seitenketten negativ geladen vorliegen, wird häufig die Ionenpaarchromatographie angewendet. Bei dieser werden der Probenlösung Substanzen zugesetzt, die als Gegenion fungieren, so dass sich ein Ionenpaar bildet, das nach außen neutral ist. Im Falle von Thiamin und seiner Phosphatester werden Alkyl- und Arylsulfonate wie Methan- und Heptansulfonat, sowie Camphersulfonsäure verwendet (Meyer, 1992). Eine 50 Lösung mit Thiamintriphosphat, Schrifttum Thiamindiphosphat, Thiaminmonophosphat und Thiamin würde auch in dieser Reihenfolge, d.h. die Thiaminphosphate mit den meisten Phosphatgruppen zuerst, eluiert. In nicht ausreichend aufgereinigten Probenlösungen werden daher die Thiaminphosphate häufig von Störpeaks überdeckt. Eine Alternative zu den C-18 Phasen stellen die Amid-C-16 Phasen dar, bei denen in die Kohlenstoffkette eine Amidgruppe eingebunden ist. Ein Vergleich der Trennung von Thiamin und Thiaminderivaten auf der C-18 Phase mit Ionenpaarbildung und der Amid-C-16 Phase ergab, dass bei letzterer auf Ionenpaarreagenzien verzichtet werden kann und die Trennung insgesamt besser ist (Viñas et al., 2001). In der Thiaminanalytik wird daher diese Phase in jüngerer Zeit ebenfalls genutzt (Batifoulier et al., 2005; Viñas et al., 2003b; Viñas et al., 2003a). Die Elutionsreihenfolge entspricht der der C-18 Phasen, so dass der Nachweis von Thiaminphosphaten durch Störpeaks ebenfalls erschwert ist. In der Literatur konnten zudem keine Hinweise auf einen erfolgreichen Nachweis von Thiamintriphosphat gefunden werden. Ein Problem der auf Silicagel basierenden Phase ist deren geringe Stabilität bei Werten unter pH 3 oder über pH 7. Bei geringem pH-Wert erfolgt eine saure Hydrolyse der gebundenen funktionellen Gruppen und bei hohen pH-Werten eine Auflösung der Silicapartikel. Gerade höhere pH-Werte des Eluenten verbessern nicht nur die Retentionszeiten (Viñas et al., 2001), sondern erhöhen auch die Fluoreszenz der Thiochrome, deren Maximum über pH 8 liegt (Ishii et al., 1979). Um Eluenten mit höheren pH-Werten nutzen zu können werden daher auch Poly- (Styrol-Divinylbenzol), kurz PRP-Phasen eingesetzt (Bettendorff et al., 1986; Bettendorff et al., 1991; Bontemps et al., 1984a). Diese Phasen sind stabil zwischen pH 1 bis 13 und können als Umkehr- oder Normalphasen verwendet werden (Meyer, 1992). Daher erfolgt eine Trennung entweder wie bei den C-18 Phasen (TTP, TDP, TMP, T) oder umgekehrt wie bei den NH2-Phasen (T, TMP, TDP, TTP). 51 Schrifttum Aufgrund des ionischen Charakters der Thiamine und seiner Phosphatester können ebenfalls hydrophile Phasen wie Silicaphasen mit funktionellen NH2Gruppen (Baines, 1985; Botticher und Botticher, 1986; Ishii et al., 1979; LaschiLoquerie et al., 1992; Tallaksen et al., 1991) für eine Trennung genutzt werden, wobei eine Umkehr der Elutionsreihenfolge erreicht wird. Soll das Vorhandensein von Thiaminphosphaten in Proben bestimmt werden ist diese Elutionseihenfolge (T, TMP, TDP, TTP) von Vorteil, da Thiaminphosphate nicht von Störsubstanzen überdeckt werden und auch nicht die Gefahr besteht, dass Thiaminphosphate überhaupt nicht auf der Säule retardiert werden. Obwohl viele Ansätze für eine Trennung des Thiamins und seiner Thiaminphosphate existieren, konnte bislang durch keine Methode eine gute Trennung aus komplizierten Probenmatrices erreicht werden. An die Trennung der Analyten schließt sich eine geeignete Detektionsmethode an. Dabei werden vor allem UV-spektroskopische Verfahren und Fluoreszenzspektroskopie genutzt. Der Vollständigkeit halber sei erwähnt, dass sich auch andere Verfahren wie zum Beispiel die elektrochemische Detektion (Li et al., 2005) oder die Fourier-transformierte Infrarot-Detektion (Li und Brown, 2003) für Thiamin anwenden lassen. Die Vorteile des UV-Detektors sind ein großer linearer Bereich, Unempfindlichkeit gegenüber Temperaturschwankungen und die Möglichkeit zum Einsatz bei Gradientenelution. Er registriert Substanzen die ultraviolettes Licht absorbieren (Meyer, 1992). Die Absorptionsmaxima liegen für Thiamin bei einer Wellenlänge von 247 nm bei pH 3 und von 235 nm und 267 nm bei pH 5 (Egi und Kawasaki, 2003), die mit UV-Spektroskopie (Degiuseppe und Rindi, 1958; Gennaro, 1991; Kim et al., 2002) oder Photodioden-Array (Viñas et al., 2001) messbar sind. Mit letzterem können ganze Spektren aufgenommen werden, die anschließend elektronisch weiter verarbeitet werden. Mit diesem Detektor können hohe Empfindlichkeiten für Thiamindiphosphat von 5 ng/mL erreicht werden (Viñas et al., 2001). Sehr verbreitet ist die Erfassung der 52 Schrifttum Fluoreszenz mit einem Fluoreszenzdetektor (Abdel-Kader, 1992; Alyabis und Simpson, 1993; Baines, 1985; Batifoulier et al., 2005; Bettendorff et al., 1986; Bettendorff et al., 1991; Bontemps et al., 1984b; Bontemps et al., 1984a; Botticher und Botticher, 1986; Brunnekreeft et al., 1989; Burch et al., 1952; Chase et al., 1993; Herve et al., 1994; Ichinose und Mitsui, 1988; Ishii et al., 1979; Iwata et al., 1988; Kimura und Itokawa, 1983; Kimura und Itokawa, 1985; Laschi-Loquerie et al., 1992; Losa et al., 2005; Ndwa et al., 2000; Rettenmaier et al., 1979; Sanchez-Machado et al., 2004; Sander et al., 1991; Sanemori et al., 1980; Schrijver et al., 1982; Tallaksen et al., 1991; Vanderslice und Huang, 1986; Viñas et al., 2003b) da dessen Empfindlichkeit 103 mal höher sein kann, als bei einem UV-Detektor. Hierbei wird die fluoreszierende Substanz in der Probe mit einer geeigneten Wellenlänge bestrahlt und das emittierte Licht bei einer spezifischen Wellenlänge gemessen (Meyer, 1992). Thiamin und dessen Phosphatester besitzen keine natürliche Fluoreszenz, daher müssen sie in fluoreszierende Verbindungen umgewandelt werden. Dies geschieht durch eine alkalische Oxidation, die durch Oxidationsmittel wie Bromcyan (BrCN) oder Kaliumhexacyanoferrat K3Fe(CN)6 katalysiert wird. Durch die Bildung eines substituierten Ringsystems hat das gebildete Thiochrom fluoreszierende Eigenschaften im alkalischen Milieu (Abbildung 5). Das Exitationsmaximum liegt bei allen Derivaten bei 375 nm und das Fluoreszenzmaximum zwischen 432 nm und 435 nm. Im Gegensatz zum nicht derivatisierten Thiamin und seiner Phosphatester sind die Thiochrome im alkalischen Milieu stabil. Die Stabilität wird durch Lichtausschluss und niedrige Temperaturen verbessert (Kawasaki und Egi, 2000b). 53 Schrifttum Abbildung 5: Thiochrom-Reaktion H H C N N H3C N CH3 + NH2 alkalische Oxidation S C C OH H3C CH3 N N H H N N H H H H S C C OH H H Thiamin Thiochrom Für die Thiochrom-Reaktion wurden am häufigsten Quecksilberchlorid (HgCl2) (Laschi-Loquerie et al., 1992; Ratanaubolchai et al., 1981; Ratanaubolchai et al., 1980; Ratanaubolchai und Panijpan, 1979), Kaliumhexacyanoferrat, K3Fe(CN)6, (Abdel-Kader, 1992; Alyabis und Simpson, 1993; Baines, 1985; Batifoulier et al., 2005; Bettendorff et al., 1986; Bettendorff et al., 1991; Bontemps et al., 1984b; Bontemps et al., 1984a; Botticher und Botticher, 1986; Brunnekreeft et al., 1989; Burch et al., 1952; Chase et al., 1993; Herve et al., 1994; Kimura und Itokawa, 1983; Kimura und Itokawa, 1985; Losa et al., 2005; Ratanaubolchai et al., 1981; Ratanaubolchai et al., 1980; Ratanaubolchai und Panijpan, 1979; Rettenmaier et al., 1979; Sanchez-Machado et al., 2004; Sander et al., 1991; Schrijver et al., 1982; Vanderslice und Huang, 1986; Viñas et al., 2003b) und Bromcyan (BrCN) (Ishii et al., 1979; Iwata et al., 1988; Ratanaubolchai et al., 1981; Ratanaubolchai et al., 1980; Ratanaubolchai und Panijpan, 1979; Rettenmaier et al., 1979; Sanemori et al., 1980; Tallaksen et al., 1991) verwendet. Kaliumhexacyanoferrat wurde demnach am häufigsten genutzt, ist aber Studien zufolge nicht das beste oxidierende Reagenz. Ratanaubolchai untersuchte die oxidierende Wirkung von Quecksilberchlorid, Kaliumhexacyanoferrat und Bromcyan in Pflanzenproben (Ratanaubolchai et al., 1980), in biologischen Proben (Ratanaubolchai et al., 1981) und in Urinproben (Ratanaubolchai und Panijpan, 1979) und fand heraus, dass Bromcyan sich am besten für die alkalische Oxidation von Thiamin zu Thiochrom eignete. Offenbar werden von diesem mehr Thiamine zu Thiochromen oxidiert und außerdem scheint es, aufgrund des abweichenden Reaktionsmechanismus, eine höhere Selektivität als die beiden anderen 54 Schrifttum Reagenzien zu besitzen. Daher werden unerwünschte Substrate in Proben, wie zum Beispiel N-Methylnicotinamid, von Bromcyan nicht zu fluoreszierenden Verbindungen umgesetzt. Dies könnte auch erklären wieso die Wiederfindungsrate bei Verwendung von Kaliumhexacyanoferrat oft höher ist als 100 %. Außerdem wies Morita darauf hin, dass K3Fe(CN)6 ebenfalls das im Muskel vorkommende 2-(1-Hydroxyethyl)-Thiamin zu einer fluoreszierenden Verbindung umsetzen könnte (Morita et al., 1969). Eine Analyse unerwünschter Derivate und deren Beeinflussung der Thiochromoxidation wurde von Ratanaubolchai et al. präsentiert (Ratanaubolchai et al., 1981). 2.6.2 Elementanalyse mit Atomabsorptionsspektrometrie (AAS) Bei der Elementanalytik müssen Kontaminationen und Absorptionsverluste berücksichtigt werden. Daher werden Kalibrier- und Probenlösungen in geeigneten Behältern und bei geeignetem pH-Wert gelagert. Alle Geräte sollten mit mindestens 0,1 molarer Salpetersäurelösung ausgekocht oder ausgespült werden und zum Reinigen und Ansetzen von Lösungen sollte mindestens zweifach destilliertes Wasser verwendet werden, damit Kontaminationen durch andere Elemente kontrolliert werden können. Aufgrund der Kontaminationsgefahr, sollte die Verwendung von Metall- und Glasgeräten vermieden werden. Alle Chemikalien sollten zumindest analytische Reinheit haben, wobei eine höhere Reinheit aber vor allem für die Spurenanalyse oft notwendig ist. Da sowohl für die Messung mit der Flammen-AAS als auch der GraphitrohrAAS möglichst reine Analysenlösungen mit gelösten Ionen benötigt werden, werden die Proben vorher einer Veraschung unterzogen. Dabei unterscheidet man zwischen Trocken- und Nassveraschung. Bei ersterer werden die Proben in einem Muffelofen bei Temperaturen um die 500 °C verascht, so dass die organischen Komponenten zerstört und die 55 Schrifttum Analyten mineralisiert werden und danach in Säure gelöst werden können. Große Probenmengen können auf diese Art aufbereitet werden, allerdings dauert die Aufbereitung lange und Analytverluste oder Kontaminationen können nicht kontrolliert werden, so dass diese Art der Probenaufbereitung nicht mehr häufig verwendet wird. Beim oxidativen Nassaufschluss werden die Proben mit konzentrierten Säuren versetzt und stark erhitzt. Zu den gebräuchlichsten Säuren mit hohem oxidativem Potential gehören: Perchlorsäure, Salpetersäure, Schwefelsäure, Wasserstoffperoxid und Fluorwasserstoffsäure, die auch in verschiedenen Mischungen eingesetzt werden. In offenen Aufschlussgefäßen kann so ebenfalls die Probenmenge reduziert und die Analyten aufkonzentriert werden. Stark oxidierende Säuren mit einem hohen Siedepunkt wie Perchlorsäure haben allerdings den Nachteil, dass sie auch die Lebensdauer der Analysengeräte reduzieren. Für einige Proben und Analyten ist ein kompletter Aufschluss nicht notwendig, da die Analyten bei geringeren Temperaturen aus der Matrix herausgelöst werden können. Weitere Varianten des „klassischen“ oxidativen Nassaufschlusses sind mit Druck oder Hochdruck kombinierte Verfahren, sowie der Mikrowellen unterstützte Säureaufschluss. Neben diesen häufig angewendeten Verfahren gibt es einige Versuche zum Aufschluss mit Veraschung in reiner Sauerstoffatmosphäre, Infrarotbestrahlung, Ultraschallbehandlung und CO2Laser. In Abhängigkeit von der Probenmatrix und den zu untersuchenden Analyten kann sogar auf einen Aufschluss verzichtet werden und die Probe direkt oder nach Verdünnen in einem Graphitrohr-AAS analysiert werden (Welz und Sperling, 1999). Bei der AAS werden Elemente analysiert, indem die licht-physikalischen Eigenschaften der Atome ausgenutzt werden, deren Kenntnis das Verständnis 56 Schrifttum der Funktionsweise der AAS erleichtert und daher im Folgenden in Grundzügen erläutert wird. Die Wellenlängen, das Linienspektrum, welche von einem angeregten Atom eines bestimmten Elements emittiert werden, hängen von dessen atomaren Aufbau ab. Die Elektronen eines Atoms haben, je nach ihrer Lage, eine bestimmte Energie und können auch nur eine bestimmte Menge an zugeführter Energie aufnehmen. Die Valenzelektronen eines Atoms sind verantwortlich für die Spektrallinien eines Atoms, daher werden sie auch als Photoelektronen bezeichnet. Im nicht angeregten Zustand haben sie das niedrigste mögliche Energieniveau. Durch Zufuhr von Energie können sie in verschiedene angeregte Zustände versetzt werden. Dieser angeregte Zustand ist instabil und die aufgenommene Energie wird von den Elektronen in Form von Strahlungsenergie wieder abgegeben. Die Art und Höhe der Emission folgt den quantenphysikalischen Gesetzmäßigkeiten und ist daher für die Elektronen nicht willkürlich, so dass die spezifischen Spektrallinien eines Atoms entstehen. Da die Valenzelektronen in bestimmten Grundzuständen existieren und die Frequenz der möglichen aufgenommenen Energie exakt definiert ist, aber bei der Anregung und Abgabe viele Möglichkeiten der Energieübertragung bestehen, besteht das Absorptionsspektrum, das bei der Aufnahme der Energie entsteht, aus weniger Spektrallinien als das Emissionsspektrum, das bei der Abgabe der Energie und der Rückkehr der Elektronen in den Grundzustand entsteht. Im Atomisator des AAS-Gerätes wird den Molekülen in der Probe Energie zugeführt damit sie dissoziieren, das heißt ihre Bindungsenergie überschritten wird und sie in freier Form vorliegen. Erst in diesem Zustand können Absorption oder Emission gemessen werden. Ist allerdings die zugeführte Energie zu hoch, dann werden die Atome ionisiert, das heißt die Valenzelektronen werden abgespalten. Ein unerwünschter Vorgang, weil sich dadurch auch die Spektrallinien verändern. 57 Schrifttum Das Grundprinzip der AAS ist also, dass Licht in bestimmten Frequenzbereichen von Elementen absorbiert wird und diese Abschwächung der Lichtintensität gemessen werden kann. Als Strahlungsquelle werden bevorzugt Hohlkathodenlampen (HCL) oder elektrodenlose Lampen (EDL), die nur bestimmte Spekrallinien emittieren, genutzt. In Hohlkathodenlampen besteht die Kathode aus dem zu bestimmenden Element, so dass nur Licht emittiert wird, das für dieses Element spezifisch ist. Mit einem Monochromator kann dann eine Wellenlänge isoliert werden. Im Atomisator werden die Atome der Moleküle einer Probe durch Zufuhr von Energie dissoziiert, so dass sie als freie Atome im Gaszustand vorliegen. Bei der älteren Technik, der Flammen-AAS, geschieht dies indem ein Gemisch aus Brenngas, Trägergas und zerstäubter Probenflüssigkeit zusammen verbrannt werden. Das Licht der Hohlkathodenlampe strahlt durch die Flamme und wird dabei von den dissoziierten Atomen geschwächt. Der Detektor misst die Lichtintensität bei der für das Element spezifischen Wellenlänge. Bei der Graphitrohr-AAS wird ein definiertes Probenvolumen, üblicherweise 10 µL bis 50 µL, in ein Rohr aus Graphit verbracht und elektrisch schnell stark erhitzt, so dass die Probe verdampft. So können geringere Probenmengen analysiert und höhere Temperaturen erreicht werden. In Verbindung mit einem Magnetfeld kann durch Ausnutzung des Zeeman-Effektes sogar eine noch höhere Empfindlichkeit erreicht werden, da durch diesen eine Korrektur der Hintergrundabsorption möglich ist. Daher wird das Graphitrohr-AAS für die Spurenanalyse verwendet. Die Konzentration der Probe wird indirekt durch Erstellung einer Kalibriergeraden im linearen Bereich ermittelt. In bestimmten Konzentrationsbereichen gilt das Lambert-Beer’sche Gesetz. Das bedeutet, dass sich mit steigender Konzentration in der Probe die Schwächung (Extinktion) erhöht. Bei stark konzentrierten Lösungen wird daher ein Extinktionsmaximum erreicht. 58 Schrifttum Abgesehen von der Erstellung einer Kalibriergeraden durch Kalibrierlösungen, gibt es noch die Möglichkeit der Standardaddition. Bei dieser wird den Kalibrierlösungen bekannter Konzentration ebenfalls eine definierte Menge der Probenlösung zugegeben. Die Konzentration der Kalibirerlösungen sollte idealerweise ein Vielfaches der Konzentration der Probenlösung betragen, d.h. die Intervalle sollten gleich sein. Sie wird benutzt, wenn die Zusammensetzung der Probenlösung unbekannt ist und Störungen durch die Probenmatrix vorhanden sind oder vermutet werden. Diese Technik ist wesentlich zeitintensiver, da nicht nur eine Kalibriergerade für alle Probenlösungen erstellt wird, sondern für jede Probe eine eigene (Welz und Sperling, 1999). 2.6.2.1 Calcium Calcium war eines der ersten Elemente, welches mit Flammen-AAS gemessen wurde. Es kann mit einem Brenngasgemisch aus Distickstoffoxid (N2O) und Acetylen (C2H2) nahezu frei von Interferenzen bei einer Wellenlänge von 422,9 nm gemessen werden. Die Messung kann durch sehr hohe Silikon- oder Aluminiumkonzentrationen gestört werden, wohingegen eine Ionisation durch Zusatz von Alkalimetallen kontrolliert werden kann. Eine Messung ist ebenso in der Flamme aus einem Gemisch aus Luft und Acetylen möglich, wird dann aber durch Anwesenheit von Phosphaten, Sulfaten, Aluminium und Silikon gestört. Diese können durch Zugabe von 10 g/L Lanthan oder 10 g/L EDTA kontrolliert werden (Welz und Sperling, 1999). Die Nachweisgrenze für die Messung von Calcium mit dem Flammen-AAS liegt bei 0,1 mg/mL. In wässriger Lösung befindliche Calciumionen adsorbieren an Glasflächen bei pH 1,5 über einen Zeitraum von 30 Tagen bis zu 15 %. Bei pH 11 sogar zu 85 %, so dass ein Verlust aus der Lösung bei pH 5 schon nach 24 Stunden feststellbar ist (Welz und Sperling, 1999). 59 Schrifttum 2.6.2.2 Magnesium Magnesium kann mit hoher Sensitivität mit dem Flammen-AAS bestimmt werden. Die Sensitivität mit einer Flamme aus einem Gemisch aus Luft und Acetylen ist höher, als mit einem Gemisch aus Stickstoffoxid und Acetylen, außerdem treten aufgrund der höheren Temperatur Ionisationsstörungen von etwa 6 % auf. In der Flamme aus Luft und Acetylen können niedrige Magnesiumkonzentrationen bei einer Wellenlänge von 285,2 nm und höhere Konzentration bei 202,5 nm gemessen werden. Hohe Silikon- oder Aluminiumkonzentrationen stören die Bestimmung, können aber durch Zusatz von Lanthanchlorid (LaCl3) kontrolliert werden (Welz und Sperling, 1999). Die Nachweisgrenze für die Messung von Magnesium mit dem Flammen-AAS liegt bei 0,1 mg/mL. An Glasflächen adsorbieren Magnesiumionen aufgrund eines Austauschprozesses irreversibel aus wässrigen Lösungen. Diese Verluste betragen nach zwei Wochen etwa 43 % und sind bei pH 6 bereits nach 24 Stunden signifikant (Welz und Sperling, 1999). 2.6.2.3 Eisen Eisen kann mit der Flammen-AAS mit einer Flamme aus einem Gemisch aus Luft und Acetylen gemessen werden. Wird eine brennstoffarme Flamme verwendet, dann treten kaum Interferenzen auf. Eine Signalerniedrigung kann durch Silikon, Strontium, Aluminium, Mangan, Citronensäure und Weinsäure hervorgerufen werden. Hohe Konzentrationen an Kobalt, Kupfer und Nickel erniedrigen ebenfalls die Empfindlichkeit. Durch Zugabe von 8- Hydroxyquinolone oder Ammoniumchlorid zur Analysenlösung können diese Interferenzen vermindert werden. Am häufigsten wird bei einer Wellenlänge 60 Schrifttum von 248,3 nm gemessen. Die Nachweisgrenze für die Messung von Eisen mit dem Flammen-AAS liegt bei 5 mg/mL. Für die Bestimmung mit dem G-AAS wird die Verwendung von Magnesiumnitrat als Modifier und eine Verbrennungstemperatur von 1400 °C empfohlen. Da Eisen in größerer Konzentration im Staub vorhanden ist, muss eine Kontamination durch entsprechende Maßnahmen verhindert werden (Welz und Sperling, 1999). Die Adsorptionsverluste wässriger Eisenlösungen an Glasgefäßen treten bei über pH 1,5 auf und betragen bei pH 3,5 bereits nach 24 Stunden 34 %. Selbst bei pH 2,5 und einer Lagerung in Polyethylen- (PE-) Gefäßen können Verluste von 10 % nach 10 Tagen festgestellt werden. Die Verluste betragen dagegen in PE Gefäßen in 0,06 mol/L HCl nur 2 % (Welz und Sperling, 1999). 2.6.2.4 Kupfer Bei der Messung mit dem Flammen-AAS von Kupfer mit einem Brenngasgemisch aus Luft und Acetylen treten praktisch keine Interferenzen auf. Für niedrige Konzentrationen wird bei einer Wellenlänge von 324,8 nm gemessen. Die Nachweisgrenze für die Messung von Kupferionen mit dem Flammen-AAS liegt bei 1 mg/mL. Mit Graphitrohr-AAS kann Kupfer ohne Modifier bei einer Temperatur von 1100 °C und mit Modifier bei einer Temperatur von 1300 °C gemessen werden. Bei Temperaturen von 1100 bis 1200 °C treten am wenigsten Interferenzen auf (Welz und Sperling, 1999). Adsorptionseffekte und Desorptionseffekte treten bei der Lagerung von wässrigen Kupferlösungen auf. Eine Desorption konnte für Glas-, PE-, PTFEund PFA- Gefäße festgestellt werden. Eine Lagerung sollte daher bei unter pH 61 Schrifttum 1,5 in sorgfältig gereinigten PE-, PFA- oder FEP-Gefäßen erfolgen (Welz und Sperling, 1999). 2.6.2.5 Zink Zink ist das Element für das mit dem Flammen-AAS die höchste Empfindlichkeit mit einem Brenngas aus Luft und Acetylen bei einer Wellenlänge von 213,9 nm erreicht werden kann. Sehr hohe Konzentrationen können ebenfalls bei einer Wellenlänge von 307,6 nm bestimmt werden. Außerdem konnten bislang in Untersuchungen keine durch Sulfate, Phosphate, Nitrite, Nitrate, Bicarbonate, Silicate oder andere Kationen hervorgerufenen Interferenzen festgestellt werden. Die Nachweisgrenze für die Messung von Zinkionen mit dem Flammen-AAS liegt bei 1 mg/mL. Die Sensitivität des Graphitrohr-AAS für Zink ist ebenfalls sehr hoch. Die optimale Verdampfungstemperatur liegt ohne Modifier bei 1600 bis 1800 °C und kann mit einem Palladium-Magnesium-Modifier auf 1000 °C reduziert werden. Bei einer Wellenlänge von 213,9 nm können spektrale Interferenzen, unter anderem von Kupfer, Tellur und Eisen hervorgerufen werden. Ein großes Problem in der Analyse von Zink ist die Kontaminationsgefahr aus der Umgebung oder durch nicht sorgfältig gereinigte Laborgeräte (Welz und Sperling, 1999). Adsorptionen aus wässrigen Lösungen treten an Glasgefäßen bei über pH 5 auf, während dies für die Lagerung in PE-Behältnissen nicht festgestellt werden konnte. Eine Desorption kann ebenfalls für viele Materialen und Geräte, vor allem Glas- und Polypropylengefäße, Pipettenspitzen, Verschlussfolie (Parafilm®), Papiertücher und Filtermaterial festgestellt werden (Welz und Sperling, 1999). 62 63 64 Material und Methoden 3. MATERIAL UND METHODEN Alle untersuchten Eier waren von Hühnern der Art Gallus gallus. Das Probenmaterial umfasste unbefruchtete, unbebrütete Eier aus dem Supermarkt, im Folgenden als Nativei bezeichnet. Es handelte sich hierbei um frische Eier von Hühnern aus Käfighaltung. Sie wurden nach Erwerb umgehend bis zur weiteren Analyse bei +5 °C gelagert. Des Weiteren wurden befruchtete, bis zu fünf und bis zu sieben Tage bebrütete, spezifisch pathogenfreie (SPF) Eier (Valo-SPF-Ei, Lohmann Tierzucht GmbH, Cuxhaven, Germany) untersucht. Diese wurden in der Klinik für Geflügel der Stiftung Tierärztliche Hochschule Hannover bei einer Temperatur von 37,8 °C und einer Luftfeuchtigkeit von 50 % bis 60 % bebrütet. Die Bruteier wurden nach Erhalt bei +5 °C gekühlt und noch am selben Tag untersucht. 3.1 BEHANDLUNG UND FRAKTIONSTRENNUNG DER EIER Vor der Bestimmung des Thiamingehaltes und des Mineralstoffgehaltes, wird das Eigelb in Plasma und Granula getrennt und einige Eigelb werden vorher technologisch behandelt. 3.1.1 Native Eiproben Das Ei wird seitlich aufgeschlagen und die obere Eischale vorsichtig abgenommen. Das Eiklar wird in ein Becherglas abgegossen. Das Eigelb wird in der Hand mit tridestilliertem Wasser vorsichtig abgespült und auf einem Papiertuch trocken gerollt. Es wird an den Rand des Tuchs gerollt, mit einem Spatel angestochen und der Inhalt in einem Becherglas aufgefangen, damit die 65 Material und Methoden Eigelbmembran nicht analysiert wird. Das Eigelb wird gewogen und mit der gleichen Gewichtsmenge tridestilliertem Wasser vermischt. Das Gemisch wird in Reaktionsgefäße (Eppendorfcups) überführt und für 10 Minuten mit einer Zentrifuge (3200 Eppendorf, Eppendorf Vertrieb Deutschland GmbH, Wesseling-Berzdorf, Deutschland) bei einer relativen Zentrifugationsbeschleunigung (RZB) von 8000 zentrifugiert. Der Überstand wird als Eigelbplasma (Plasma) und das Sediment als Eigelbgranula (Granula) weiter verwendet. Das Plasma wird vorsichtig in ein Becherglas pipettiert. Zum Waschen werden einige Tropfen tridestilliertes Wasser auf die in den Reaktionsgefäßen verbliebenen Granula getropft und erneut bei einer RZB von 8000 für 10 Minuten zentrifugiert. Der Überstand wird verworfen und verbleibende Flüssigkeitsreste mit einem Zellstofftuch aufgesaugt. Um Kontaminationen zu verhindern werden für die Elementanalyse alle Metallund Glasgeräte durch Plastikgeräte aus Polymethylpenten (PMP) oder Polyethylen (PE) ersetzt. 3.1.2 Eigelbproben mit Zusatz Da in den Eigelbproben mit Zusatz nur Mineralstoffgehalte bestimmt werden, werden nur Bechergläser aus PMP und Geräte aus PE verwendet. Ein Nativei wird seitlich aufgeschlagen und geöffnet, indem die obere Schalenhälfte abgenommen wird. Das Eiklar wird vorsichtig abgegossen. Das fast vollständig von Eiklar befreite Eigelb wird in die Hand genommen und sorgfältig mit tridestilliertem Wasser abgespült. Das Eigelb wird auf ein Zellstofftuch gelegt, trocken gerollt und anschließend die Eigelbmembran mit einem Plastikspatel eingestochen, so dass der Inhalt ohne Kontakt zum Zellstoff in ein Becherglas abgegossen werden kann. Dieser Vorgang wird mit elf weiteren Eiern wiederholt, die alle in einem Becherglas vermischt werden. Diese 66 Material und Methoden Sammelprobe wird für die Proben mit Ascorbinsäure und Citronensäure verwendet. In sechs Bechergläser werden jeweils 0,2 g Ascorbinsäure und in weitere sechs Bechergläser 0,2 g Citronensäure eingewogen und mit jeweils 9,8 g Eigelb vermischt. Dann werden 10 mL tridestilliertes Wasser zugegeben und erneut gut gemischt. Mit den sechs Proben werden jeweils sechs Reaktionsgefäße befüllt und bei einer RZB von 8000 für 10 Minuten zentrifugiert. Die Überstände (Plasma) aus den je sechs Reaktionsgefäßen werden in je einem Becherglas vereint und das Sediment wird verworfen. Für eine Blindprobe wird kein Zusatz zugemischt, sondern stattdessen 0,2 g tridestilliertes Wasser. Für die Proben mit Essigsäure und Weinsäure wird der gesamte Vorgang mit zwölf neuen Eiern wiederholt. Zu sechs Eigelbproben wird 0,75 % Phospholipase A2 zugesetzt und diese für 3 Stunden bei 60 °C inkubiert.1 Anschliessend werden diesen dieselbe Gewichtsmenge Wasser zugesetzt und gemischt. Wie die anderen Proben werden diese dann in Reaktionsgefäßen zentrifugiert und das Plasma in Bechergläsern gesammelt. Das Sediment wird verworfen. Bei den Blindproben wird das Eigelb durch Wasser ersetzt. Bei den mit Säure versetzten Proben wird der pH-Wert gemessen. 1 Proben wurden zur Verfügung gestellt aus dem Technikum des Instituts für Chemische Analytik unter der Leitung von Prof. Dr. W. Ternes 67 Material und Methoden Tabelle 20: Zusammensetzung der Proben zur Mineralstoffbestimmung Probenbezeichnung A1, A2, A3, A4, A5, A6 Zusatz jeweils 0,2 Eigelb Gramm Ascorbinsäure 9,8 Gramm C1, C2, C3, C4, C5, C6 Citronensäure AC E1, E2, E3, E4, E5, E6 H2O, tridestilliert Essigsäure W1, W2, W3, W4, W5, W6 Weinsäure EW AO CO EO WO H2O, tridestilliert Ascorbinsäure Citronensäure Essigsäure Weinsäure Wasser 10 Gramm 9,8 Gramm kein 19,8 A = mit Ascorbinsäure C = mit Citronensäure E = mit Essigsäure W = mit Weinsäure AC = Vergleichsprobe zu Proben A1-A3 und C1-C3 EW = Vergleichsprobe zu Proben E1-E3 und W1-W3 3.1.3 Gefriergetrocknete Eigelbproben mit Zusatz Es werden 60 g Eigelb zunächst pasteurisiert und anschließend bei -6 °C vorgefroren. Danach wird die Probe schockgefroren und anschließend für fünf Stunden bei -25 °C gefriergetrocknet. Durch das Vorfrieren oberhalb der Gelbildungstemperatur wird dem pasteurisierten Eigelb die Kristallationsenergie des enthaltenen Wassers entzogen und anschließend durch ein Doppelplattenkontaktgefrierverfahren der Temperaturbereich der Gelbildung in wenigen Sekunden durchlaufen und damit die Gelbildung verhindert (Ternes und Dautel, 2007). Die Zusätze werden vor der Pasteurisation zum Eigelb hinzu gegeben. Jeweils drei Proben enthalten als Zusatz entweder 1 % Salz, 3 % Zucker, 2 % 68 Material und Methoden Essigsäure, 0,5 % Phospholipase A2, oder sind ohne Zusatz. Mit 0,75 % Phospholipase A2 standen sechs Proben zur Verfügung.2 Da in den gefriergetrockneten Proben der Mineralstoffgehalt bestimmt wird, erfolgte die Probenaufarbeitung ausschließlich in Bechergläsern aus PMP und es werden nur Geräte aus PE verwendet. Das gefriergetrocknete Eigelbpulver wird zunächst resuspendiert. Dazu werden zwischen 2 g und 4 g Probe in ein Becherglas eingewogen und mit der gleichen Gewichtsmenge tridestilliertem Wasser versetzt, da durch die Gefriertrocknung etwa 50 % Wasser verloren gegangen sind. Nun wird die gleiche Gewichtsmenge Wasser hinzugefügt und gut verrührt. Die Suspension wird in Reaktionsgefäße gefüllt und bei einer RZB von 8000 für 10 Minuten zentrifugiert. Der Überstand (Plasma) wird in einem Becherglas vereint und das Sediment verworfen. 3.1.4 Bruteier Das Brutei wird in einem Becherglas mit dem stumpfen Pol nach oben aufgestellt und mit einem Spatel die Eischale angebrochen. Mit einer Pinzette werden die Schalenfragmente entfernt, bis die Eischalenhaut sichtbar ist. Diese wird mit tridestilliertem Wasser abgespült und danach mit einer Pinzette entfernt. Nun wird der Embryo mit einer Pinzette entnommen und in ein Becherglas überführt. Da die Eigelbmembran durch den Brutprozess brüchig geworden ist, ist eine Entnahme des Eigelbs im Ganzen, wie beim Nativei, nicht möglich. Daher wird das Eigelb vorsichtig in ein Becherglas abgeseiht und das Eiklar in einem separaten Becherglas aufgefangen. Durch den Flüssigkeitstransfer, der aus dem Eiklar ins Eigelb während der Bebrütung stattfindet ist eine Wasserzugabe, um die Fraktionen bei der 2 Proben wurden zur Verfügung gestellt aus dem Technikum des Instituts für Chemische Analytik unter der Leitung von Prof. Dr. W. Ternes 69 Material und Methoden Zentrifugation voneinander zu trennen, nicht notwendig. Das abgeseihte Bruteigelb wird durchmischt und in Reaktionsgefäßen für 10 Minuten bei einer RZB von 8000 zentrifugiert. Das Sediment in den Reaktionsgefäßen wird als Granula und der Überstand als Plasma weiter behandelt. Letzteres wird in ein Becherglas abpipettiert. Zum Waschen werden einige Tropfen tridestilliertes Wasser auf die in den Reaktionsgefäßen verbliebenen Granula getropft und erneut zentrifugiert. Der Überstand wird verworfen und verbleibende Flüssigkeitsreste mit einem Zellstofftuch aufgesaugt. Für die Mineralstoffanalyse wird das Brutei mit Verschlussfolie (Parafilm®) umwickelt, um eine Kontamination durch die Eischale beim Abseihen des Eigelbs zu vermeiden. Alle Glas- und Metallgeräte werden durch Plastikgeräte aus PMP oder PE ersetzt. 70 Material und Methoden 3.2 THIAMINANALYSE 3.2.1 Probenmaterial Für die Bestimmung des Thiamins und der Thiaminphosphate wurden vor allem Eigelbgranula und Eigelbplasma untersucht. Die Analyse des Eiklars erfolgte ausschließlich zu Vergleichszwecken. Aufgrund des geringen Gewichtes der Embryos wurden Sammelproben analysiert. Tabelle 21: Proben für die Thiaminanalytik Nativei Brutei 5. Tag Brutei 7. Tag Dotierte Proben Fraktion Eiklar Eigelbplasma Eigelbgranula Eiklar Eigelbplasma Eigelbgranula Embryo Embryo Eigelbplasma Eigelbgranula Probenanzahl 3 6 7 2 6 6 41 42 16 9 1 = vier gepoolte Proben aus jeweils vier Embryos = zwei Sammelproben aus je zwei Embryos und zwei Sammelproben aus je vier Embryos 2 3.2.2 Probenaufarbeitung 3.2.2.1 Ansetzen der Lösungen • Trichloressigsäure wird als 0,4 g/L wässrige Lösung angesetzt. • Die Bromcyanlösung hat eine Konzentration von 0,3 g/L. • Eine Natriumhydroxid- und eine Salzsäurelösung werden mit einer Konzentration von 1 mol/L hergestellt. 71 Material und Methoden • Eine weitere Salzsäurelösung wird mit einer Konzentration von 5 mmol/L angesetzt. • Die Elutionslösung für die Festphasenextraktion wird hergestellt als 20:80 (v/v) Acetonitril: Phosphatpuffer, letzterer mit einer Konzentration von 250 mM und pH 6,4. • Für die Kalibrierlösungen wird eine 40:60 (v/v) Acetonitril: Phosphatpuffer-Lösung, 110 mM, pH 6 angesetzt. 3.2.2.2 Thiaminextraktion Die Methode für die Thiaminextraktion wurde im Verlauf des Untersuchungszeitraumes geringfügig geändert, so dass beide verwendeten Methoden beschrieben werden. Einige der zu Anfang untersuchten Proben wurden, ungeachtet des Thiamingehaltes und der Matrixbeschaffenheit, einheitlich extrahiert. Es wurden Granula, Eiklar und Plasma untersucht. Es wird jeweils 1 g Probe in ein Zentrifugenglas eingewogen. Die Probe wird mit 4 mL eiskalter Trichloressigsäurelösung versetzt und mit einem Stabrührer (Ultra-Turrax, TP 18-10, Janke-Kunkel GmbH & Co. KG-IKA Labortechnik, Staufen, Breisgau) für 30 Sekunden homogenisiert. Am Gerät haftende Probenreste werden mit eiskalter Trichloressigsäurelösung abgespült. Das Zentrifugenglas wird in einer Tischzentrifuge (Hettich Universal 1200) bei einer RZB von 1500 für 15 Minuten zentrifugiert. Währenddessen wird ein Messkolben mit einem Trichter und Filterpapier versehen und zum Schutz vor Licht in ein braunes Pulverglas gestellt. Der Überstand der zentrifugierten Probe wird in den Messkolben abfiltriert. Dem, im Zentrifugenglas verbliebenen, Sediment werden 4 mL eiskalte Trichloressigsäurelösung zugefügt und der Extraktionsvorgang wiederholt. Die gesamte Probenlösung wird anschließend derivatisiert. 72 Material und Methoden Die später verwendete Extraktionsmethode berücksichtigt den erwarteten Thiamingehalt und die Matrixbeschaffenheit, so dass sie für Granula, Plasma, Eiklar und Embryo individuell verändert wurde. 3.2.2.3 Thiaminextraktion aus Plasmaproben Es wird 4 g Eigelbplasma in ein Zentrifugenglas eingewogen. Die Probe wird mit 7 mL eiskalter Trichloressigsäurelösung versetzt und 2 Minuten lang kräftig geschüttelt. Anschließend wird die Probe in einer Tischzentrifuge bei einer RZB von 1500 für 15 Minuten zentrifugiert. Ein 20 mL Messkolben wird mit einem Trichter und Filterpapier versehen und zum Schutz vor Licht in ein braunes Pulverglas gestellt. Nach der Zentrifugation wird der Überstand über den Filter in den 20 mL Kolben abgegossen. Das im Zentrifugenglas verbleibende Sediment wird mit 6 mL eisgekühlter Trichloressigsäurelösung versetzt und mit einem Stabrührer 30 Sekunden homogenisiert. Am Stabrührer verbleibende Probenreste werden mit 1 mL eisgekühlter Trichloressigsäurelösung abgespült. Danach erfolgt eine Zentrifugation in der Tischzentrifuge bei einer RZB von 1500 für 15 Minuten. Dann wird der Überstand in den 20 mL Messkolben abgegossen und das Sediment mit 3 mL eiskalter Trichloressigsäurelösung versetzt und mit dem Stabrührer für 30 Sekunden homogenisiert. Mit 1 mL eiskalter Trichloressigsäurelösung werden verbleibende Reste abgewaschen. Die Probe wird zentrifugiert und der Überstand in den 20 mL Messkolben abgegossen. Der im Messkolben gesammelte Überstand wird mit tridestilliertem Wasser auf 20 mL aufgefüllt. Für die Derivatisierung werden 2 mL entnommen und in ein braunes Probenglas überführt. 73 Material und Methoden 3.2.2.4 Thiaminextraktion aus Eiklarproben In ein Zentrifugenglas werden 2 g Eiklar eingewogen. Die Probe wird mit 4 mL eiskalter Trichloressigsäurelösung versetzt und 2 Minuten lang kräftig geschüttelt. Danach wird die Probe in einer Tischzentrifuge bei einer RZB von 1500 für 15 Minuten zentrifugiert. Ein 10 mL Messkolben wird mit einem Trichter und einem Filterpapier versehen und zum Schutz vor Licht in ein braunes Pulverglas gestellt. Der Überstand der zentrifugierten Probe wird in den Messkolben abgegossen, das Sediment mit 3 mL eiskalter Trichloressigsäurelösung versetzt und mit einem Stabrührer für 30 Sekunden homogenisiert. Am Stabrührer verbleibendes Probenmaterial wird mit 1 mL eiskalter Trichloressigsäurelösung abgewaschen. Die Probe wird bei einer RZB von 1500 für 15 Minuten zentrifugiert und der Überstand in den 10 mL Messkolben abgegossen. Das Sediment wird verworfen und der 10 mL Messkolben mit tridestilliertem Wasser aufgefüllt. Die gesamten 10 mL werden für die Derivatisierung in ein braunes Probenglas überführt. 3.2.2.5 Thiaminextraktion aus Granulaproben Aus den Reaktionsgefäßen (siehe 3.1) wird das Sediment entnommen und in ein Zentrifugenglas etwa 1 g eingewogen. Dazu werden 4 mL eiskalte Trichloressigsäurelösung pipettiert und solange kräftig geschüttelt bis die Granula und die Säure vermischt sind. Das Zentrifugenglas wird in einer Tischzentrifuge bei einer RZB von 1500 für 15 Minuten zentrifugiert. Der Überstand wird über einen Trichter mit Papierfilter in einen 10 mL Messkolben abgegossen und dieser zum Schutz vor Licht in ein braunes Pulverglas gestellt. Das Sediment wird mit 3 mL eiskalter Trichloressigsäurelösung versetzt und mit einem Stabrührer für 30 Sekunden homogenisiert. Reste am Stabrührer werden mit 1 mL eiskalter Trichloressigsäurelösung abgewaschen. Es folgt eine 74 Material und Methoden Zentrifugation bei einer RZB von 1500 für 15 Minuten. Der Überstand wird in den 10 mL Messkolben abgegossen und das Sediment verworfen. Der 10 mL Messkolben wird mit tridestilliertem Wasser aufgefüllt und für die Derivatisierung 5 mL Probenlösung in ein braunes Probenglas überführt. 3.2.2.6 Thiaminextraktion aus Embryoproben Jeweils zwei bis vier Embryos werden mit tridestilliertem Wasser abgespült, mit einer Pinzette in ein Zentrifugenglas eingewogen, mit 3 mL eiskalter Trichloressigsäurelösung versetzt und mit einem Stabrührer 30 Sekunden lang homogenisiert. Am Gerät verbleibende Probenreste werden mit 1 mL eiskalter Trichloressigsäurelösung abgewaschen. Das Zentrifugenglas wird in einer Tischzentrifuge bei einer RZB von 1500 für 15 Minuten zentrifugiert. Anschließend wird der Überstand über einen Trichter mit Filterpapier in einen 10 mL Messkolben abfiltriert und der Kolben zum Schutz vor Lichteinfall in ein braunes Pulverglas gestellt. Das Sediment wird mit 3 mL eiskalter Trichloressigsäurelösung versetzt und mit einem Stabrührer für 30 Sekunden homogenisiert. Reste am Stabrührer werden mit 1 mL eiskalter Trichloressigsäurelösung abgewaschen. Es folgt eine Zentrifugation bei einer RZB von 1500 für 15 Minuten. Der Überstand wird in den 10 mL Messkolben abgegossen und das Sediment verworfen. Der 10 mL Messkolben wird mit tridestilliertem Wasser aufgefüllt und für die Derivatisierung die gesamten 10 mL in ein braunes Probenglas überführt. 75 Material und Methoden 3.2.2.7 Derivatisierung Für die Derivatisierung wird die Probe mit 0,5 mL Bromcyanlösung versetzt und anschließend mit einer 1 molaren NaOH-Lösung auf pH 10 eingestellt. Die Probe wird für eine Reaktionszeit von 20 Minuten im Dunkeln gelagert. 3.2.2.8 Festphasenextraktion Mit einer 1 molaren HCl-Lösung und einer 1 molaren NaOH-Lösung wird die Probenlösung auf pH 7 eingestellt. Für die Festphasenextraktion werden die Ventile der Unterdruckkammer erst mit tridestilliertem Wasser gereinigt und anschließend mit Luft getrocknet. Die C-18 und die SAX-Festphasensäulen werden erst mit 5 mL Methanol und dann mit 5 mL tridestilliertem Wasser konditioniert. Die beiden Säulen werden durch ein Verbindungsstück verbunden und auf ein Ventil der Festphasenkammer gesteckt. Die Probe wird in die obere C-18 Säule pipettiert und der Durchfluss in einem Becherglas aufgefangen. Die Säulen werden auf das nächste Ventil gesteckt, mit 5 mL tridestilliertem Wasser gewaschen und die Waschlösung in einem Reagenzglas aufgefangen. Für die Elution werden die Säulen auf das nächste Ventil gesteckt und 4 mL Elutionslösung langsam durch die Säulen in einen 5 mL Glaskolben getropft. Für ein weiteres Eluat wird die Säulenkombination auf das nächste Ventil gesteckt und der Vorgang wiederholt. Die Glaskolben mit dem 1. und 2. Eluat werden mit tridestilliertem Wasser auf 5 mL aufgefüllt und analysiert. 76 Material und Methoden 3.2.2.9 Dotierung Für die Bestimmung der Wiederfindungsrate werden 16 Plasmaproben und 9 Granulaproben mit jeweils 840 ng TMP und 1374 ng TDP vor der Extraktion dotiert. 3.2.3 Trennung und Analyse 3.2.3.1 Ansetzen der Kalibrierlösungen Es werden zunächst Stammlösungen mit 1,1 mg/mL Thiamin, 1,4 mg/mL Thiaminmonophosphat und 2,29 mg/mL Thiamindiphosphat hergestellt, die in etwa 0,5 mL Portionen geteilt und in braunen Probenflaschen bei -20 °C gelagert werden. Durch Auftauen der Stammlösung bei Raumtemperatur werden jeden Tag frische Kalibrierlösungen erstellt. Die Stammlösungen werden auf 1100 ng/mL für Thiamin, 2800 ng/mL für Thiaminmonophosphat und 4580 ng/mL für Thiamindiphosphat verdünnt. Es werden jeweils 400 µL, zusammen mit 200 µL BrCN-Lösung und 200 µL 1 molarer NaOH-Lösung in einen 5 mL Kolben pipettiert und nach 30 Minuten Reaktionszeit mit Elutionslösung aufgefüllt. Durch Verdünnen wird eine Kalibrationsreihe erstellt. Zum Überprüfen der Retentionszeit von Thiamintriphosphat wurde aus einer 1000 mg/L Stammlösung eine Lösung mit einer Konzentration von 600 ng/mL hergestellt. 3.2.3.2 Hochdruckflüssigkeitschromatographie Die Trennung erfolgte anfänglich mit einer isokratischen Hochdruckflüssigkeitschromatographie (HPLC), wurde aber, um eine bessere 77 Material und Methoden Trennung zu erzielen, später auf ein Gradientensystem umgestellt. Die Analyse erfolgte mit einem Fluoreszenzdetektor. Isokratisches System: - Eluent: 40:60 (v/v) Acetonitril: Phosphatpuffer, 75mM pH (6,5) 7 - Probenschleife: Knauer 20 µL - Pumpe: Knauer HPLC Pump 64 - Vorsäule: Knauer Eurospher-100 C-8, 30 mm x 4,6 mm - Säulen: 1. Knauer: Europher-100 C-8, 250 mm x 4 mm, 5 µm Ø 2. LiChrospher-100 NH2, 250 mm x 4 mm, 5 µm Ø - Fluoreszenzdetektor: Perkin-Elmer LC 240 - Computersystem: Intel Pentium III mit 751 MHz, 256 MB RAM, Betriebssystem: Windows XP Professionell Version 2002, Programm: Knauer Eurochrom 2000, Drucker: HP Laserjet 1010 Die Analyse wurde mit einer Flussrate von 0,7 mL/min über 30 Minuten durchgeführt. Gradientensystem: - Eluent A: 37:63 (v/v) Acetonitril:Phosphat-Puffer; 65mM, pH (6,5) 7,15 - Eluent B: 40:60 (v/v) Acetonitril:Phosphat-Puffer; 110mM, pH (6,5) 7,25 - Probenschleife: Knauer 20 µL - Pumpe: Knauer HPLC Pump 64 - Vorsäule: Knauer Eurospher-100 C-8, 30 mm x 4,6 mm, - Säulen: 1. Knauer: Europher-100 C-8, 250 mm x 4 mm, 5 µm Ø 2. Alltech-Grom Saphir 110 NH2, 150 mm x 4 mm, 5 µm Ø - Fluoreszenzdetektor: Perkin-Elmer LC 240 - Computersystem: Intel Pentium III mit 751 MHz, 256 MB RAM, Betriebssystem: Windows XP Professionell Version 2002, Programm: Knauer Eurochrom 2000, Drucker: HP Laserjet 1010 Die Zusammensetzung der Eluenten, während eines Analysenlaufes, ist in Tabelle 22 dargestellt. 78 Material und Methoden Tabelle 22: Gradientensystem Zeit hh:mm:ss 00:00:00 00:08:00 00:31:00 00:45:00 Fluss mL/min 0,7 0,7 0,7 0,0 Eluent A % 97 3 97 97 Eluent B % 3 97 3 3 Die Excitation erfolgt bei beiden Systemen bei einer Wellenlänge von 375 nm und die Emmision bei einer Wellenlänge von 450 nm. Die Probenlösung wird mit einer 200 µL Probenspritze aufgezogen und zweimal verworfen. Beim dritten Mal wird die 20 µL Probenschleife befüllt und die Analyse über die Steuerungssoftware gestartet und nach dem Probenlauf mit dieser ausgewertet. 3.3 MINERALSTOFFANALYSE 3.3.1 Chemikalien und Gerätschaften Alle verwendeten Glas-, PMP- und PE-Gefäße und Geräte wurden entweder mit 0,2 g/L Salpetersäurelösung (HNO3-Lösung) ausgekocht, oder über Nacht in 1 g/L HNO3-Lösung stehen gelassen und anschließend mit tridestilliertem Wasser ausgespült. Alle gespülten Gefäße und Geräte wurden trocken und staubfrei gelagert. 3.3.2 Probenmaterial Für die Mineralstoffanalyse wurden die in Tabelle 24 dargestellten Proben untersucht. Alle Proben, die aufgrund ihres niedrigen Gehaltes des 79 Material und Methoden entsprechenden Elements nicht mit Flammen-AAS untersucht werden konnten, wurden mit Graphitrohr-AAS untersucht. Tabelle 23: Analysenplan für die Mineralstoffbestimmung mit F-AAS und G-AAS ______ Nativei Granula Plasma Eiklar Granula Plasma Eiklar Plasma Brutei 5.Tag Gefrierproben Ca2+ Ca2+ Ca2+ Ca2+ Ca2+ Ca2+ - F-AAS Mg2+ Mg2+ Mg2+ Mg2+ Mg2+ Mg2+ - ______ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+ _____ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ Cu2+ _____ G-AAS Fe2+/ Fe3+ Fe2+/ Fe3+ Fe2+/ Fe3+ Fe2+/ Fe3+ Fe2+/ Fe3+ Fe2+/ Fe3+ Fe2+/ Fe3+ Probenumfang 6 6 6 6 6 6 211 1 = Drei gefriergetrocknete Proben enthalten als Zusatz entweder 1 % Salz, 3 % Zucker, 2 % Essigsäure, 0,5 % Phospholipase A2, oder keinen Zusatz. Sechs Proben mit 0,75 % Phospholipase A2 wurden untersucht, drei davon mit ICP-OES. Tabelle 24: Analysenplan für die Mineralstoffbestimmung mit G-AAS und ICP-OES ______ Proben mit Zusatz, Plasma Ascorbinsäure Citronensäure Essigsäure Weinsäure PLA A2 G-AAS______ Cu2+ Fe2+/ Fe3+ n=3 n=3 n=3 n=3 - ______ ICP-OES______ Cu2+ Fe2+/ Fe3+ n=3 n=3 n=3 n=3 n=6 Probenumfang 6 6 6 6 6 3.3.3 Säureaufschluss Die Granula-, Plasma- und Eiklarproben werden wie unter 3.1.1, 3.1.2 und 3.1.3 dargestellt gewonnen. Die Granula in den Reaktionsgefäßen werden über Nacht im Trockenschrank bei 103 ± 2 °C getrocknet. Mit einem Plastikspatel wird die trockene Granulafraktion in den Reaktionsgefäßen zerkleinert und etwa 1 g in ein Teflongefäß eingewogen. Von Plasma und Eiklar werden jeweils 2 g Probe in ein Teflongefäß eingewogen. Zur Probe wird 500 µL suprapure, konzentrierte Salpetersäure pipettiert und das Teflongefäß in einem Heizblock für 6 Stunden bei 60 °C 80 Material und Methoden erhitzt. Danach werden 600 µL suprapure, konzentrierte Salpetersäure und 400 µL suprapure, konzentrierte Perchlorsäure zupipettiert und die Temperatur jede halbe Stunde um 10 °C erhöht bis eine Temperatur von 130 °C erreicht ist. Diese Temperatur wird 8 Stunden gehalten. Nach vier Stunden werden nochmals 400 µL suprapure, konzentrierte Perchlorsäure und 600 µL suprapure, konzentrierte Salpetersäure zupipettiert. Die klaren fast vollständig verdampften Proben werden in 10 mL oder 5 mL Messkolben überführt und mit tridestilliertem Wasser bis zur Marke aufgefüllt. Die Lösung wird in PE-Gefäße überführt und bis zur weiteren Untersuchung bei + 5 °C gelagert. 3.3.4 Analyse mit Flammen-Atomabsorptionsspektrometrie Der Gehalt der Mineralstoffe in den Proben wurde mit externer und interner Kalibrierung bestimmt, um einen Matrixeffekt abschätzen zu können. Das Verfahren ist für jedes Element gleich, variiert werden lediglich die Konzentration der Matrixmodifiers. Standardlösungen Durch ein und Screening die wurde Art der und zu Menge des erwartende Konzentrationsbereich ermittelt und der Ansatz der Kalibrierlösungen angepasst, so dass bei möglichst hoher Konzentration im linearen Bereich gearbeitet wurde. 81 Material und Methoden Abbildung 6: Schematische Darstellung der Kalibrierverfahren 3.3.4.1 Apparatur Die Analyse der Lösungen wird mit einem Flammen- Atomabsorptionsspektrometer (PU 9100x, Philips) an dem ein Schreiber (Kompensograph III, Siemens) angeschlossen ist durchgeführt. Für die Analyse werden Hohlkathodenlampen (LOT-Oriel GmbH & Co. KG, Darmstadt, Deutschland) verwendet. Die aufgezeichneten Peaks wurden manuell ausgemessen und mit einer am Computer erstellten Kalibriergeraden ausgewertet. 82 Material und Methoden 3.3.4.2 Ansetzen der Lösungen Mit tridestilliertem Wasser und suprapurer, konzentrierter Salpetersäure wird eine 0,2 % ige HNO3-Lösung angesetzt. Als Modifier werden durch Lösen in tridestilliertem Wasser eine 10 % ige Lanthanchloridlösung und eine 5 % ige Kaliumchloridlösung hergestellt. Die 1000 mg Calcium-, Eisen-, Zink-, Magnesium- und Kupferstandards werden gemäß den Herstellerangaben zu 1000 mg/L Stammlösungen verdünnt. 3.3.4.3 Bestimmung von Calcium in Granula, Plasma und Eiklar Für die Bestimmung des Calciumgehaltes in den Granula wird die 1000 mg/L Calciumstammlösung mit 0,2 % iger HNO3-Lösung zu einer 100 mg/L Lösung verdünnt. Für die externe Kalibrierung wird diese Lösung zu einer 10; 20; 30 und 40 mg/L Lösung verdünnt. Von der Probenlösung werden 0,25 mL zusammen mit 1 mL 10 % iger Lanthanchloridlösung in einem 5 mL Messkolben angesetzt. Für die Standardaddition werden zu 0,25 mL aufgeschlossener Probenlösung und 1 mL der 10 % igen Lanthanchloridlösung jeweils 1; 2; 3 und 4 mL der 100 mg/L Standardlösung in einen 10 mL Messkolben pipettiert. Alle Kolben werden mit 0,2 % iger HNO3-Lösung aufgefüllt. 83 Material und Methoden Tabelle 25: Kalibrierlösungen für die Calciumbestimmung in Granulaproben Kalibrierpunkt 1 Kalibrierpunkt 2 Kalibrierpunkt 3 Kalibrierpunkt 4 Probe Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Für die Messkolben mL 10 10 10 10 10 10 10 10 10 Bestimmung 100 mg/L Calciumlösung mL 1 2 3 4 0 1 2 3 4 des Konzentration mg/L 10 20 30 40 10 20 30 40 Granula Probenlösung mL 0 0 0 0 0,25 0,25 0,25 0,25 0,25 Calciumgehaltes 10 % ige LaCl3Lösung mL 0 0 0 0 1 1 1 1 1 in den aufgeschlossenen Plasmaproben, wird aus der Calciumstammlösung, durch Verdünnen mit 0,2 % iger HNO3-Lösung, eine 10 mg/L Calciumlösung hergestellt. Für die externe Kalibrierung werden Calciumlösungen mit einer Konzentration von 0,5; 1; 1,5 und 2 mg/L angesetzt. Von der Plasmaprobenlösung werden 100 µL zusammen mit 0,5 mL einer 10 % igen Lanthanchloridlösung in einem 5 mL Messkolben mit 0,2 % iger HNO3-Lösung verdünnt. Für die Standardaddition werden 100 µL Probenlösung mit 0,5 mL 10 % iger Lanthanchloridlösung in einem 5 mL Kolben mit 10 mg/L Calciumlösung angesetzt, so dass eine Endkonzentration von 0,5; 1; 1,5 und 2 mg/L erreicht wird. Das Auffüllen der Kolben erfolgt mit 0,2 % iger HNO3-Lösung. 84 Material und Methoden Tabelle 26: Kalibrierlösungen für die Calciumbestimmung in Plasmaproben Kalibrierpunkt 1 Kalibrierpunkt 2 Kalibrierpunkt 3 Kalibrierpunkt 4 Probe Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 10 10 10 10 5 5 5 5 5 10 mg/L Calciumlösung mL 0,5 1 1,5 2 0 0,25 0,5 0,75 2 Konzentration mg/L 0,5 1 1,5 2 0,5 1 1,5 2 Plasma Probenlösung µL 0 0 0 0 100 100 100 100 100 10 % ige LaCl3Lösung mL 0 0 0 0 0,5 0,5 0,5 0,5 0,5 Für die Eiklarproben wird die aufgeschlossene Probenlösung 1:10 verdünnt und zum Herstellen der Kalibrierlösungen eine 10 mg/L Calciumlösung verwendet. Für die externe Kalibrierung werden Lösungen mit einer Konzentration von 1; 1,5; 2 und 2,5 mg/L hergestellt. Von der 1:10 verdünnten Eiklarprobenlösung werden 0,1 mL und 0,5 mL 10 % ige Lanthanchloridlösung in einem 5 mL Kolben mit 0,2 % iger HNO3-Lösung aufgefüllt. Für die Standardaddition werden Calciumlösungen in einer Konzentration von 1; 1,5; 2 und 2,5 mg/L zusammen mit 0,1 mL 1:10 verdünnter Eiklarprobenlösung und 0,5 mL 10 % iger Lanthanchloridlösung in einem 5 mL Kolben hergestellt. Alle Kolben werden mit 0,2 % iger HNO3-Lösung aufgefüllt. Tabelle 27: Kalibrierlösungen für die Calciumbestimmung in Eiklarproben Kalibrierpunkt 1 Kalibrierpunkt 2 Kalibrierpunkt 3 Kalibrierpunkt 4 Probe Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 10 10 10 10 5 5 5 5 5 10 mg/L Calciumlösung mL 1 1,5 2 2,5 0 0,5 0,75 1 1,25 Konzentration mg/L 1 1,5 2 2,5 1 1,5 2 2,5 85 10 % ige Eiklar LaCl3Probenlösung 1:10 Lösung mL mL 0 0 0 0 0 0 0 0 0,5 0,1 0,5 0,1 0,5 0,1 0,5 0,1 0,5 0,1 Material und Methoden Die Messung der Proben erfolgte bei einer Spaltbreite von 0,2 nm, einer Stromstärke von 4 mA, bei einer Wellenlänge von 422,7 nm in einem Luft:Acetylen-Gemisch 80:20. 3.3.4.4 Bestimmung von Magnesium in Granula, Plasma und Eiklar Für die Bestimmung in den Granula wird die Magnesiumstammlösung mit 0,2 % iger HNO3-Lösung zu einer 10 mg/L Lösung verdünnt. Die Lösungen für die externe Kalibrierung werden als 0,2; 0,6; 1 und 1,2 mg/L Magnesiumlösungen angesetzt. Für die mit externer Kalibrierung zu messenden Proben wird 0,1 mL der Probenlösung mit 0,5 mL 10 % iger Lanthanchloridlösung in einem 10 mL Messkolben angesetzt. Zu den Proben für die Standardaddition wird zusätzlich soviel 10 mg/L Magnesiumlösung pipettiert, dass eine Endkonzentration von 0,2; 0,6; 1 und 1,2 mg/L erreicht wird. Alle Kolben werden mit 0,2 % iger HNO3-Lösung aufgefüllt. Tabelle 28: Kalibrierlösungen für die Magnesiumbestimmung in Granulaproben Kalibrierpunkt 1 Kalibrierpunkt 2 Kalibrierpunkt 3 Kalibrierpunkt 4 Probe Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 10 10 10 10 10 10 10 10 10 10 mg/L Magnesiumlösung mL 0,2 0,6 1 1,6 0 0,2 0,6 1 1,2 Konzentration mg/L 0,2 0,6 1 1,6 0,2 0,6 1 1,2 Granula Probenlösung mL 0 0 0 0 0,1 0,1 0,1 0,1 0,1 10 % ige LaCl3Lösung mL 0 0 0 0 0,5 0,5 0,5 0,5 0,5 Für die externe Kalibrierung der Plasmaproben werden Magnesiumlösungen mit einer Konzentration von 40; 80; 120; 160 µg/L angesetzt. Für die mit externer Kalibrierung zu bestimmenden Proben werden 0,25 mL 1:10 verdünnte Plasmaprobenlösung 86 und 0,25 mL 10 % ige Material und Methoden Lanthanchloridlösung in einem 5 mL Messkolben angesetzt. Für die Standardadditionsproben wird zusätzlich von der 10 mg/L Magnesiumlösung soviel zugesetzt, dass eine Endkonzentration von 40; 80; 120 und 240 µg/L erreicht wird. Alle Messkolben werden mit 0,2 % iger HNO3-Lösung aufgefüllt. Tabelle 29: Kalibrierlösungen für die Magnesiumbestimmung in Plasmaproben Kalibrierpunkt 1 Kalibrierpunkt 2 Kalibrierpunkt 3 Kalibrierpunkt 4 Probe Standard-Addition 1 Standard-Addition 2 Standard-Addition 3 Standard-Addition 4 Messkolben mL 10 10 10 10 5 5 5 5 5 10 mg/L Magnesiumlösung µL 40 80 120 160 0 20 40 60 80 Konzentration µg/L 40 80 120 160 40 80 120 160 Plasma 10 % ige ProbenLaCl3lösung 1:10 Lösung mL mL 0 0 0 0 0 0 0 0 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 Für die Eiklarproben werden Kalibrierlösungen mit einer Konzentration von 0,4; 0,8; 1,2 und 1,6 mg/L aus der 10 mg/L Magnesiumlösung hergestellt. Von der aufgeschlossenen Eiklarprobenlösung wird 0,25 mL mit derselben Menge 10 % iger Lanthanchloridlösung in einem 10 mL Messkolben angesetzt. Die Proben für die Standardaddition werden zusätzlich mit Magnesiumlösung versetzt, so dass eine Endkonzentration von 0,4; 0,8; 1,2 und 1,6 mg/L erreicht wird. Alle Kolben werden mit 0,2 % iger HNO3-Lösung aufgefüllt. 87 Material und Methoden Tabelle 30: Kalibrierlösungen für die Magnesiumbestimmung in Eiklarproben Kalibrierpunkt 1 Kalibrierpunkt 2 Kalibrierpunkt 3 Kalibrierpunkt 4 Probe Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 10 10 10 10 5 5 5 5 5 10 mg/L Magnesiumlösung mL 0,4 0,8 1,2 1,6 0 0,2 0,4 0,6 0,8 Konzentration mg/L 0,4 0,8 1,2 1,6 0,4 0,8 1,2 1,6 Eiklar Probenlösung mL 0 0 0 0 0,25 0,25 0,25 0,25 0,25 10 % ige LaCl3Lösung mL 0 0 0 0 0,25 0,25 0,25 0,25 0,25 Die Messung der Proben erfolgt bei einer Spaltbreite von 0,2 nm, einer Stromstärke von 2,8 mA, bei einer Wellenlänge von 285,2 nm in einem Luft:Acetylen-Gemisch 80:20. 3.3.4.5 Bestimmung des Eisengehaltes in der Granulafraktion Mit dem Flammen-AAS wurden die mit Graphitrohr-AAS ermittelten Eisengehalte stichprobenartig überprüft. Die Eisenstammlösung wird mit 0,2 % iger HNO3 Lösung zu einer 10 mg/L Lösung verdünnt. Für die externe Kalibrierung werden 0,4; 1,2; 2 und 2,8 mg/L konzentrierte Eisenlösungen hergestellt. Die mit externer Kalibrierung zu messenden Proben werden mit 0,5 mL aufgeschlossener Granulaprobenlösung und 1 mL 5 % iger Kaliumchloridlösung in einem 10 mL Messkolben angesetzt. Für die Standardadditon wird zusätzlich Eisenstandardlösung zugesetzt, so dass eine Endkonzentration entsprechend der externen Kalibrierlösungen erreicht wird. Alle Kolben werden mit 0,2 % iger HNO3-Lösung aufgefüllt. 88 Material und Methoden Tabelle 31: Kalibrierlösungen für die Eisenbestimmung in Granulaproben Kalibrierpunkt 1 Kalibrierpunkt 2 Kalibrierpunkt 3 Kalibrierpunkt 4 Probe Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 10 10 10 10 10 10 10 10 10 Konzen10 mg/L Eisenlösung tration mL mg/L 0,4 0,4 1,2 1,2 2 2 2,8 2,8 0 0,4 0,4 1,2 1,2 2 2 2,8 2,8 Granula Probenlösung mL 0 0 0 0 0,5 0,5 0,5 0,5 0,5 5 % ige KClLösung mL 0 0 0 0 1 1 1 1 1 Für die Messung wird die Spaltbreite auf 0,2 nm, die Wellenlänge auf 248,3 nm, die Stromstärke auf 10 mA und das Luft:Acetylen-Gemisch auf 80:20 eingestellt. 3.3.4.6 Bestimmung von Zink in Granula, Plasma und Eiklar Für die Zinkbestimmung in den Granula wird die 1000 mg/L Zinkstammlösung auf 10 mg/L verdünnt und für die externe Kalibrierung vier weitere Lösungen mit einer Konzentration von 1; 2; 3 und 4 mg/L hergestellt. Die aufgeschlossenen Granulaprobenlösungen werden für die Messung mit externer Kalibrierung 1:10 verdünnt. Für die interne Kalibrierung werden in einen 10 mL Messkolben 1 mL Probenlösung und 1; 2; 3 und 4 mL 10 mg/L Zinklösung angesetzt. Alle Kolben werden mit 0,2 % iger HNO3-Lösung aufgefüllt. Tabelle 32: Standardaddition der Granulaproben für die Zinkbestimmung Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 10 10 10 10 10 mg/L Zinklösung mL 1 2 3 4 Konzentration mg/L 1 2 3 4 89 Granula Probenlösung mL 1 1 1 1 Material und Methoden Für die Bestimmung von Zink in den Plasmaproben werden für die externe Kalibrierung Lösungen mit einer Konzentration von 0,1; 0,2; 0,3 und 0,4 mg/L hergestellt und die Proben unverdünnt und in einer 1+1 Verdünnung mit 0,02 % iger Magnesiumnitrat-Hexahydrat-Lösung gemessen. Für die interne Kalibrierung werden Lösungen mit einem Zinkgehalt von 0,1; 0,2; 0,3 und 0,4 mg/L und einer Probenverdünnung von 1+1 hergestellt. Tabelle 33: Standardaddition der Plasmaproben für die Zinkbestimmung Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 2 2 2 2 2 mg/L Zinklösung mL 0,1 0,2 0,3 0,4 Konzentration mg/L 0,1 0,2 0,3 0,4 Plasma Proben- lösung mL 1 1 1 1 Für die externe Kalibrierung für die Bestimmung der Eiklarproben wurden Lösungen mit einer Konzentration von 0,1; 0,2; 0,3 und 0,4 mg/L aus der Zinkstammlösung hergestellt. Die Eiklarproben werden einmal nicht verdünnt und einmal 1+1 mit 0,02 % iger Magnesiumnitrat-Hexahydrat-Lösung verdünnt gemessen. Die Brutei-Eiklarproben wurden nochmals 1+1 verdünnt und gemessen. Für die interne Kalibrierung werden in einem 2 mL Messkolben 0,25 mL Probe und soviel einer 2 mg/L Zink-Lösung zugesetzt, so dass eine Endkonzentration von 0,1; 0,2; 0,3 und 0,4 mg/L erreicht wird. 90 Material und Methoden Tabelle 34: Standardaddition der Eiklarproben für die Zinkbestimmung Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 2 2 2 2 2 mg/L ZinkLösung mL 0,1 0,2 0,3 0,4 Konzentration mg/L 0,1 0,2 0,3 0,4 Eiklar Probenlösung mL 0,25 0,25 0,25 0,25 3.3.4.7 Bestimmung von Zink in gefriergetrockneten Proben Für die externe Kalibrierung werden Lösungen mit einer Konzentration von 0,1; 0,2; 0,3 und 0,4 mg/L hergestellt und die Proben unverdünnt und in einer 1+1 Verdünnung mit 0,02 % iger Magnesiumnitrat-Hexahydrat-Lösung gemessen. Für die Standardaddition der gefriergetrockneten Proben werden in 2 mL Kolben 1 mL Probenlösung mit 0,1; 0,2, 0,3 und 0,4 ml einer 2 mg/L Zinkstandardlösung angesetzt. Tabelle 35: Standardaddition der gefriergetrockneten Plasmaproben für die Zinkbestimmung Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 2 2 2 2 2 mg/L ZinkLösung mL 0,1 0,2 0,3 0,4 Konzentration mg/L 0,1 0,2 0,3 0,4 Plasma Probenlösung mL 1 1 1 1 3.3.4.8 Bestimmung von Zink in nativen Eigelbproben mit Zusatz Für die externen Kalibrierpunkte werden Zinklösungen mit einer Konzentration von 0,1; 0,2; 0,3 und 0,4 mg/L vorbereitet. Die Proben A1, A2, A3, C1, C2, C3, E1, E2, E3, W1, W2 und W3 werden in 1:20 Verdünnung und die Proben AC und EW unverdünnt gemessen. 91 Material und Methoden Für die Standardaddition werden 0,25 mL der Probenlösung der Probe A1 in vier 5 mL Kolben mit 10 mg/L Zinkstandardlösung angesetzt, so dass eine Endkonzentration von 0,1; 0,2; 0,3 und 0,4 mg/L erreicht wird. Für die Proben A2, A3, E1, E2, E3 wird der Vorgang mit jeweils vier neuen Kolben wiederholt. Für die Proben C1, C2, C3, W1, W2, W3 wird statt 0,25 mL Probenlösung 0,1 mL Probenlösung verwendet. Die Proben AC und EW werden in 2 mL Kolben angesetzt. Tabelle 36: Standardaddition der Proben A1-A3, C1-C3, E1-E3, W1-W3 Proben A1, A2, A3, E1, E2, E3 C1, C2, C3, W1, W2, W3 Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 5 5 5 5 5 5 5 5 10 mg/L Zinklösung mL 0,05 0,1 0,15 0,2 0,05 0,1 0,15 0,2 Konzentration mg/L 0,1 0,2 0,3 0,4 0,1 0,2 0,3 0,4 Probenlösung mL 0,25 0,25 0,25 0,25 0,1 0,1 0,1 0,1 Konzentration mg/L 0,1 0,2 0,3 0,4 0,1 0,2 0,3 0,4 Probenlösung mL 0,5 0,5 0,5 0,5 0,75 0,75 0,75 0,75 Tabelle 37: Standardaddition der Proben AC und EW Proben AC EW Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Standardaddition 1 Standardaddition 2 Standardaddition 3 Standardaddition 4 Messkolben mL 2 2 2 2 2 2 2 2 2 mg/mL Zinklösung mL 0,1 0,2 0,3 0,4 0,1 0,2 0,3 0,4 Die Zinklösungen werden bei einer Wellenlänge von 213,9 nm, einer Spaltbreite von 0,2 nm, in der Luf:Acetylen Flamme 80:20, bei einer Stromstärke von 7 mA, gemessen. 92 Material und Methoden 3.3.5 Analyse mit Graphitrohr-Atomabsorptionsspektrometrie 3.3.5.1 Apparatur Die Analyseneinheit umfasst einen Computer mit darauf installierter Steuerungssoftware (AAWinLab 3.51, Perkin-Elmer LAS GmbH RodgauJügesheim, Deutschland), einen Autosampler (AS70 Perkin-Elmer LAS GmbH Rodgau-Jügesheim, Deutschland) und einen Zeeman-Graphitrohr- Atomabsorptionsspektrometer (4100ZL, Perkin-Elmer LAS GmbH RodgauJügesheim, Deutschland). Als Strahlungsquelle wurden Hohlkathodenlampen (LOT-Oriel GmbH & Co. KG, Darmstadt, Deutschland) verwendet. 3.3.5.2 Ansetzen der Lösungen Konzentrierte suprapure Salpetersäure wird mit tridestilliertem Wasser zu einer 0,2 % igen Lösung verdünnt. Der Matrixmodifier für die Kupferbestimmung wird mit 2,5 mL Palladiumnitratund 0,025 g Magnesiumnitratlösung in einem 100 mL Kolben mit 0,2 % iger HNO3-Lösung angesetzt. Dies entspricht einer Konzentration von 0,25 mg/mL Palladium und 0,15 mg/mL Magnesiumnitrat. Der Modifier für die Eisenbestimmung wurde in einer Konzentration von 0,75 mg/mL Magnesiumnitrat in 0,2 % iger HNO3-Lösung angesetzt. 3.3.5.3 Kupfer Die 1000 mg/L Kupferstammlösung wird mit 0,2 % iger HNO3-Lösung zu einer 100 µg/L Kupferlösung verdünnt und zum Erstellen der Kalibriergeraden im 93 Material und Methoden Autosampler platziert. Das Behältnis des Autosamplers für die Verdünnungslösung wird mit 0,2 % iger HNO3-Lösung befüllt. Der KupferMatrixmodifier, sowie die zu messenden Proben werden ebenfalls in Probengefäßen im Autosampler platziert. Die Steuerungssoftware des Graphitrohr-AAS erstellt aus dem Kalibrierstandard, Matrixmodifier und Verdünnungslösung Kalibrierlösungen für eine Konzentration von 25, 50, 75 und 100 µg/L. Tabelle 38: Zusammensetzung der Lösungen für die Kupferbestimmung 100 µg/L Kalibrierpunkt 75 µg/L Kalibrierpunkt 50 µg/L Kalibrierpunkt 25 µg/L Kalibrierpunkt Blindwert Probe 100 µg/L Kupferstandard µL 20 15 10 5 - 0,2 % ige HNO3Lösung µL 5 10 15 20 - Kupfermodifier µL 20 20 20 20 20 20 Probe µL 20 Für die Messbedingungen wurden die in der Datenbank der Steuerungssoftware vorhandenen Standardbedingungen gewählt. Die Kalibriergerade wird auf Linearität überprüft und dann die Proben gemessen. Sind die Proben zu hoch konzentriert, werden sie entsprechend mit 0,2 % iger HNO3-Lösung verdünnt. 3.3.5.4 Eisen Die 1000 mg/L Eisenstammlösung wird mit 0,2 % iger HNO3-Lösung zu einer 200 µg/L Eisenlösung verdünnt und zum Erstellen der Kalibriergeraden im Autosampler platziert. Der Autosampler wird mit Probenlösungen, Verdünnungslösung und dem Matrixmodifier für Eisen bestückt. Die 94 Material und Methoden Steuerungssoftware erstellt mit Standardlösungen, Modifier und Verdünnungslösung die Kalibrierlösungen. Tabelle 39: Zusammensetzung der Lösungen für die Eisenbestimmung 200 µg/L Kalibrierpunkt 150 µg/L Kalibrierpunkt 100 µg/L Kalibrierpunkt 50 µg/L Kalibrierpunkt Blindprobe Proben 200 µg/L Eisenstandard µL 20 15 10 5 - 0,2 % ige HNO3Lösung µL 5 10 15 20 - Eisenmodifier µL 20 20 20 20 20 20 Probe µL 20 Für die Messbedingungen wurden die in der Datenbank der Steuerungssoftware vorhandenen Standardbedingungen gewählt. Nach Überprüfung der Kalibriergerade auf Linearität wird die Analyse der Proben gestartet. Müssen Proben verdünnt werden, so erfolgt dies durch Zugabe von 0,2 % iger HNO3Lösung. 3.3.6 Analyse mit ICP-Spektrometrie Zum Überprüfen der mit Graphitrohr-AAS ermittelten Kupfer- und Eisenwerte, werden weitere Proben mit einem ICP- (engl.: inductively coupled plasma) Spektrometer gemessen. Die Proben umfassen drei Plasmaproben aus mit 0,75 % Phospholipase A2 versetzten und anschließend gefriergetrockneten Eigelbproben, sowie 6 Plasmaproben aus mit 0,75 % Phospholipase A2 versetzten und jeweils 3 Plasmaproben aus mit 2% Ascorbinsäure, Citronensäure, Essigsäure und Weinsäure versetzten Eigelbs. Die aufgeschlossenen Probenlösungen werden der Klinik für Rinder an der Tierärztlichen Hochschule Hannover übergeben und dort mit einem ICPSpektrometer (ICP-OES vista pro, Varian Deutschland GmbH, Darmstadt, 95 Material und Methoden Deutschland) gemessen. Dort wurden die Proben mit einer sechs Kalibrierpunkte umfassenden Standardaddition gemessen. Eine Verdünnung der Proben erfolgte mit einer wässrigen Lösung aus 0,05 % Triton-X-100 und 0,5 % Salpetersäure. Der Messbereich lag bei Kupfer zwischen 0 und 24 µmol/L und für Eisen zwischen 0 und 54 µmol/L. Tabelle 40: Analysenplan der mit ICP-OES gemessenen Proben Zusatz ohne Zusatz 0,75 % Phospholipase A2, gefriergetrocknet 0,75 % Phospholipase 2 % Ascorbinsäure 2 % Citronensäure 2 % Essigsäure 2 % Weinsäure Probenanzahl 2 3 6 3 3 3 3 3.4 TROCKENMASSEBESTIMMUNG Die Trockenmasse wird von allen Proben, bei denen Thiamin- oder Mineralstoffgehalt gemessen wurde, gravimetrisch bestimmt. 3.4.1 Analyse Eine Keramikschale wird mit Blaugel befüllt und in einem Trockenschrank bei 103 °C ± 2 °C über Nacht getrocknet und danach in den Exsikkator gestellt. Die Aluminiumschalen werden mit Seesand befüllt. Zum späteren Durchmischen wird ein Probenfläschchen aus Glas zugefügt. Die Menge Seesand richtet sich nach der eingesetzten Probenmenge. Pro Gramm Probe werden etwa 15 g Seesand eingewogen. Die Schalen werden in den Trockenschrank gestellt und über Nacht bei 103 °C ± 2 °C getrocknet. 96 Material und Methoden Nach dem Trocknen werden die Schalen in einen mit Blaugel gefüllten Exsikkator gestellt und eine Stunde lang auf Raumtemperatur abgekühlt. Die Schalen werden auf einer Feinwaage gewogen. Dann wird die Probe eingewogen und der Sand mit der Probe durchmischt und in den Trockenschrank gestellt. Die Proben werden bei 103 °C ± 2 °C für eine Stunde vorgetrocknet und mit dem Probenfläschchen fein vermahlen. Die endgültige Trocknung erfolgt über Nacht bei 103 °C ± 2 °C. Die getrockneten Proben werden in den Exsikkator gestellt und eine Stunde auf Raumtemperatur abgekühlt und gewogen. Die Berechnung erfolgt nach folgender Gleichung: w = ((m – a) x 100)/m w = Trockenmassegehalt in g/100g m = Probeneinwaage a = durch Trocknung erfolgte Massenabnahme Die Trockenmasse der Granula wird zusätzlich in Reaktionsgefäßen bestimmt, da die in den Reaktionsgefäßen getrockneten Granula für die Mineralstoffanalyse weiter verwendet wird. Die Reaktionsgefäße werden im Trockenschrank bei 103 °C ± 2 °C über Nacht getrocknet. Dann werden sie in einem Exsikkator für eine Stunde auf Raumtemperatur abgekühlt und das Gewicht jedes Reaktionsgefäßes mit einer Feinwaage bestimmt. In die Reaktionsgefäße wird das Eigelb-Wassergemisch (siehe 3.1.1) gefüllt und in Plasma und Granula durch Zentrifugieren für 10 min bei einer RZB von 8000 getrennt. Nach der Zentrifugation wird das Plasma in einem Becherglas gesammelt. Die im Rektionsgefäß verbleibende Flüssigkeit wird mit einem Zellstofftuch aufgesaugt. Die Reaktionsgefäße werden nun gewogen und das 97 Material und Methoden Gewicht notiert. Anschließend werden sie über Nacht im Trockenschrank bei 103 °C ± 2 °C getrocknet. Im Exsikkator werden sie für eine Stunde auf Raumtemperatur abgekühlt und dann gewogen. Die Berechnung erfolgt wie zuvor beschrieben. 3.5 RASTERELEKTRONENMIKROSKOPIE 3.5.1 Probenvorbereitung Für die Rasterelektronenmikroskopie werden die Eigelbgranula wie unter 3.1.1 und 3.1.4 beschrieben aus dem Eigelb von Nativeiern und fünf Tage alten Bruteiern präpariert und dem Institut für Pathologie der Stiftung Tierärztliche Hochschule Hannover zur weiteren Bearbeitung übergeben. Dort erfolgt zunächst eine Vorfixation in 5 % iger Glutaraldehydlösung für 24 Stunden. Danach werden die Proben fünfmal mit 0,1 M Cacodylatpuffer gespült, der Vorgang dauert insgesamt fünf Stunden. Die Nachfixation erfolgt in 1 % iger Osmiumsäure für zwei Stunden. Die Proben werden danach wieder fünfmal über einen Zeitraum von 3 Stunden mit 0,1 M Cacodylatpuffer gespült. Zum Entwässern werden die Proben jeweils 30 min mit 30 % igem, 50 % igem, 70 % igem, zweimal 90 % igem und zweimal 100 % igem Alkohol behandelt. Ein Tropfen der Probe wird auf einen mit einem leitfähigen Tap beklebten Stiftprobenteller getropft und über Nacht im Exsikkator getrocknet. Die Proben werden entnommen und sind nach dem besputtern mit Gold fertig für die Messung. 98 Material und Methoden 3.5.2 Analyse Die Proben werden mit einem digitalen Rasterelektronenmikroskop (Zeiss DSM 940 Digital Scanning Electron Microscope, Carl Zeiss AG, Oberkochen) betrachtet am Institut für Pathologie der Stiftung Tierärztliche Hochschule Hannover betrachtet. 3.6 STATISTISCHE AUSWERTUNG Die statistische Auswertung der Daten erfolgte computerunterstützt mit dem Tabellenkalkulationsprogramm Excel®. 99 100 Ergebnisse 4. ERGEBNISSE 4.1 THIAMIN 4.1.1 Thiamingehalt in Plasma und Granula nativer Eier In Abbildung 7 ist ein Chromatogramm der Kalibrierlösung mit Thiamin (T), Thiaminmonophosphat (TMP) und Thiamindiphosphat (TDP) dargestellt. Die Retentionszeit von T beträgt 6 Minuten, von TMP 9 Minuten und von TDP 15 Minuten. Wie in Abbildung 8 und Abbildung 9 dargestellt, wird in der Granula- und Plasmafraktion des Eigelbs der Nativeier eine fluoreszierende Substanz registriert, bei der es sich anhand der Retentionszeit um Thiamin handelt. Die beiden Thiaminphosphate TMP und TDP konnten weder in den Plasmaproben, noch in den Granulaproben nachgewiesen werden. Da jeweils gleiche Probenmengen extrahiert und aufbereitet wurden, können die Chromatogramme direkt verglichen werden. In den Plasmaproben war mehr Thiamin als in den Granulaproben vorhanden. Durch den Extraktionsprozess und den selektiven Nachweis der derivatisierten Analyten werden wenig unerwünschte Substanzen in der Probenlösung registriert, die zudem gut von den Analyten getrennt sind, obwohl es sich bei der Granulafraktion und dem Plasma um komplexe Matrices handelt. 101 Ergebnisse Abbildung 7: Auftrennung der Reinsubstanzen Spannung mV Kalibrierlösung 180 TMP T 8,88 6,43 130 TDP 15,50 80 30 -20 0 5 10 15 20 25 Zeit min Von den untersuchten Proben wurde anhand einer am Computer erstellten Kalibriergeraden der Thiamingehalt bestimmt. Mit den parallel bestimmten Trockenmassegehalten wurde dieser auf die Trockensubstanz bezogen, da nur so ein Vergleich der Proben untereinander oder mit Literaturdaten möglich ist. Für die Nativeiproben lag die durchschnittliche Trockenmasse bei 22,4 % für Plasmaproben und bei 44,1 % für Granulaproben, wobei zu berücksichtigen ist, dass das Eigelb bei der Trennung der Fraktionen 1+1 mit Wasser verdünnt wurde. Die Mittelwerte des Thiamingehaltes der gemessenen Proben und die Standardabweichungen wurden in Tabelle 41 zusammengefasst. Im Plasma des Nativeies beträgt der Thiamingehalt 3431 ± 698 ng/g und in den Granula 1522 ± 135 ng/g. Somit konnte erstmalig gezeigt werden, dass Thiaminphosphate nicht im Eigelb nativer Eier vorhanden sind und das Thiaminverhältnis in Plasma und Granula nativen Eigelbs bestimmt werden. Die Thiaminkonzentration im Plasma ist mit einem Verhältnis von 2,25:1 etwa doppelt so hoch als in der Granulafraktion. 102 Ergebnisse Durch einen Signifikanztest (t-Test) wurde die Abweichung als hochsignifikant (P = 0,01) bestätigt. Tabelle 41: Thiamingehalt der Eigelbfraktionen im Nativei Nativei Thiamin ng/g Tr. M. 3431 ± 698 1522 ± 135 Plasma Granula n= 6 n= 6 n= untersuchte Probenanzahl Abbildung 8: Auftrennung des Nativeiplasmas Spannung mV 800 Plasma nativer Eier T 6,45 700 600 500 400 300 200 100 0 -100 0 5 10 103 15 20 25 Zeit min Ergebnisse Abbildung 9: Autftrennung der Nativeigranula Spannung mV Granula nativer Eier 800 700 600 500 400 T 300 6,43 200 100 0 -100 0 5 10 15 20 25 Zeit min 4.1.2 Thiamingehalt in Plasma und Granula 5 Tage embryonierter Eier In dem Eigelbplasma und der Eigelbgranula fünf Tage embryonierter Eier konnte, wie in den Proben der nativen Eier (Vergleiche 4.1.1), nur eine fluoreszierende Substanz registriert werden, bei der es sich ebenfalls um Thiamin handelt. Weder Thiaminmonophosphat, noch Thiamindiphosphat waren in den Proben vorhanden. Die Chromatogramme sind in Abbildung 10 und Abbildung 11 dargestellt. Erstmalig konnte damit gezeigt werden, dass Thiaminphosphate nicht im Eigelb embryonierter Eier vorhanden sind. Von allen gemessenen Proben wurden der Mittelwert und die Standardabweichung berechnet und als Gehalt in der Trockenmasse in Tabelle 42 zusammengefasst. Die Trockenmasse des Eigelbplasmas betrug 21,7 % und die Trockenmasse in der Eigelbgranula 44,1 %, wobei zu berücksichtigen ist, dass das Eigelb bei der Trennung der Fraktionen 1+1 mit Wasser verdünnt wurde. Der Thiamingehalt in der Trockenmasse im Plasma beträgt 4377 ± 1074 104 Ergebnisse ng/g und in den Granula 2132 ± 450 ng/g. Die Streuung um den Mittelwert ist in den Proben der embryonierten Eier in beiden Fraktionen höher als in den Fraktionen der Nativeier (Vergleiche Tabelle 41). Im Durchschnitt konnte sowohl für die Eigelbgranula als auch das Eigelbplasma der embryonierten Eier ein höherer Thiamingehalt festgestellt werden, als in den normalen Eiern. Das Verhältnis des Thiamingehaltes ist mit 2,05: 1 ebenfalls zugunsten des Plasmas verschoben. Die Abweichung im Gehalt ist mit P = 0,01 hochsignifikant. Tabelle 42: Thiamingehalt in den Fraktionen embryonierter Eier 5 Tage embryonierte Plasma Eier Granula n= untersuchte Probenanzahl Thiamin ng/g Tr. M. 4377 ± 1074 2132 ± 450 n= 6 n= 6 Um die Unterschiede im Thiamingehalt im Plasma und Granula von nativen, unembryonierten, zu fünf Tage embryonierten Eiern zu verdeutlichen sind die mittleren Gehalte und die Standardabweichung in Abbildung 12 vergleichend dargestellt. 105 Ergebnisse Abbildung 10: Auftrennung des Bruteiplasmas Spannung mV Plasma der 5. Tage Bruteier 1100 T 6,43 900 700 500 300 100 -100 0 5 10 15 20 25 Zeit min Abbildung 11: Auftrennung der Bruteigranula Spannun g mV Granula der 5. Tage Bruteier 1100 900 700 T 6,43 500 300 100 -100 0 5 10 106 15 20 25 Zeit min Ergebnisse Abbildung 12: Thiamingehalt in Nativeiern und Bruteiern Thiamingehalt ng/g Tr.M. Nativei Brutei 6000 4377 n=6 5000 3431 n=6 4000 3000 2132 n=6 1522 n=7 2000 1000 0 Plasma Granula Fraktionen Ein Signifikanztest verdeutlicht die Unterschiede im Thiamingehalt von Plasma und Granula der Nativeiproben und der Proben embryonierter Eier. Der signifikante Unterschied in den Granulaproben kann durch Fütterung, Alter der Hennen oder auch jahreszeitliche Schwankungen bedingt sein. Tabelle 43: Signifikanztest zum Thiamingehalt in Plasma und Granula F- Test Varianzen Plasma 0,3670667 gleich Granula 0,0192981 ungleich A = nicht signifikant (p > 0,05) B = signifikant (p = 0,05) t- test 0,0504769 0,0097824 Interpretation A B 4.1.3 Thiamingehalt in 5 und 7 Tage alten Embryos Um die Trennung des Thiamins und der Thiaminphosphate zu verbessern wurde die für die vorherigen Messungen verwendete NH2-Säule gegen eine NH2-Säule eines anderen Herstellers ausgetauscht. Die veränderten Retentionszeiten sind in 107 Ergebnisse Abbildung 13 dargestellt. Das Chromatogramm der Kalibrierlösung zeigt eine bessere Trennung, wobei sich die Retentionszeiten von T auf 9 Minuten, von TMP auf 14 Minuten und von TDP auf 24 Minuten verlängert haben. Der letzte Peak des Chromatogramms bei einer Retentionszeit von 41 Minuten ist als Thiamintriphosphat identifiziert worden. Wie bereits in 4.1.1 und 4.1.2 dargestellt konnten in den Eigelbgranula und dem Eigelbplasma der Nativeier und der embryonierten Eier keine Thiaminphosphate nachgewiesen werden. In den 5 Tage und 7 Tage alten Embryos wurden dagegen Peaks registriert, die in den Retentionszeiten dem Thiaminmonophosphat und dem Thiamindiphosphat der Kalibrierlösung entsprechen. In Abbildung 14 ist ein Chromatogramm der Probe eines 5 Tage alten Embryos dargestellt. Bei dem schwachen Peak nach 9 Minuten handelt es sich um Thiamin und bei dem stärkeren Peak nach 21 Minuten um Thiamindiphosphat. Thiaminmonophosphat wurde nicht nachgewiesen. Dieses taucht erst als schwacher Peak in den 7 Tage alten Embryoproben (Abbildung 15) nach einer Retentionszeit von 11 Minuten auf. Außerdem konnten, wie in den 5 Tage alten Embryos auch, Thiamin und Thiamindiphosphat nachgewiesen werden. In keiner der Proben war Thiamintriphosphat enthalten. Erstmalig wurden damit direkt das Vorhandensein und das Verhältnis der Thiaminphosphate in 5 und 7 Tage alten Embryos nachgewiesen. Zudem wurden die Reinsubstanzen, inklusive Thiamintriphosphat, erstmalig vollständig getrennt und auch in den Proben ohne Störung durch unerwünschte Peaks bestimmt. 108 Ergebnisse Abbildung 13: Auftrennung der Reinsubstanzen Spannung mV 750 TDP 650 25,5 550 450 TMP T 12,6 8,9 350 TTP 41,1 250 150 50 -50 0 10 20 30 40 Zeit min Abbildung 14: Chromatogramm der Probe 5 Tage alter Embryos Spannung mV Embryo 5. Tag 100 80 60 40 TDP 20 T 21,5 9,3 0 -20 0 10 20 109 30 40 Zeit min Ergebnisse Abbildung 15: Chromatogramm der Probe 7 Tage alter Embryos Spannung mV Embryo 7. Tag 100 80 TDP 19,5 60 T 40 8,9 TMP 20 11,3 0 -20 0 10 20 30 40 Zeit min Da es sich bei den gemessenen Proben um Sammelproben handelt, können die Chromatogramme nicht direkt miteinander verglichen werden. Der Gehalt an Thiamin, Thiaminmonophosphat und Thiamindiphosphat wurde auf die Trockenmasse bezogen und in Tabelle 44 vergleichend dargestellt. Die Trockenmasse betrug für 5 Tage alte Embryos durchschnittlich 6,0 % (n=12) und für 7 Tage alte Embryos durchschnittlich 6,1 % (n=6). In den Proben der 5 Tage alten Embryos wurde nicht in allen Proben Thiamin gefunden. Der Thiamindiphosphatgehalt ist außerdem höher als in den Proben der 7 Tage alten Embryos. In den Proben der 7 Tage alten Embryos wurde neben Thiamindiphosphat auch Thiamin und in geringer Konzentration Thiaminmonophosphat gefunden. 110 Ergebnisse Tabelle 44: Thiamingehalte in Proben der 5 und 7 Tage alten Embryos _______ Embryo Probe 1 2 3 4 Ø 5. Tag Embryos n= 4 n= 4 n= 4 n= 4 n= 16 ng/g Feuchtgewicht ________ T TMP TDP 1 1 517,9 1 1 528,9 1 92,9 446,9 1 55,5 408,1 1 74 ± 26 475 ± 58 7. Tag 1 n= 2 36,1 36,3 2 n= 2 48,2 12,7 3 n= 4 65,7 19,8 4 n= 4 63,5 20,6 Ø n= 12 53 ± 14 22 ± 10 n= Anzahl Embryos pro Sammelprobe Ø = Durchschnittlicher Gehalt und Standardabweichung 1= unter der Nachweisgrenze (siehe 4.1.4) _____________ 1547,8 924,3 1236 ± 441 ng/g Tr. M _____________ TMP TDP 1 8632 1 8815,2 1 7448,5 1 6800,8 1 7924 ± 963 591 790,7 1077,2 1041,6 875 ± 228 594,9 208,2 325,1 337,7 367±163 T 1 1 321,6 246,3 430,7 348,0 337 ± 76 5272,5 4037,2 7060,5 5704,4 5519±1247 Um den Gehalt der Proben besser vergleichen zu können, wurden die Thiamingehalte von ng/g in nmol/g umgerechnet und in Tabelle 45 gegenübergestellt. Tabelle 45: Thiamingehalte in 5 und 7 Tage alten Embryos 5 Tage alte Embryos _____ T TMP TDP Gesamt Probe nmol/g Tr. M. 1 1 1 18,74 18,74 1 1 2 19,13 19,13 1 3 4,59 16,17 20,76 1 4 2,74 14,76 17,5 Ø 19 ± 1,3 1= unter der Nachweisgrenze _____ _____ T Probe 1 2 3 4 Ø 1,75 2,34 3,19 3,09 7 Tage alte Embryos _____ TMP TDP Gesamt nmol/g Tr. M 1,56 0,55 0,85 0,89 11,44 8,76 15,33 12,38 14,76 11,65 19,37 16,36 15,5 ± 3,2 Ein Signifikanztest der Gesamththiamingehalte in nmol ergab, dass diese nicht signifikant voneinander abweichen. Somit ist das Verhältnis von Thiamin und den Thiaminphosphaten in 7 Tage alten Embryos, in denen Thiaminmonophosphat vorhanden ist, ein anderes als in 5 Tage alten Embryos, in denen kein Thiaminmonophosphat nachgewiesen wurde. 111 Ergebnisse 4.1.4 Wiederfindungsrate, Nachweis-, Erfassungs- und Bestimmungsgrenze Die Wiederfindungsrate der dotierten Proben ist in Tabelle 46 als Mittelwert für Plasma- und Granulaproben mit Standardabweichung angegeben. Tabelle 46: Wiederfindungsrate Plasma Granula n= Probenanzahl TMP % 71 ± 13 58 ± 15 TDP % 64 ± 16 47 ± 13 n= 16 n= 9 Die Nachweis-, Erfassungs- und Bestimmungsgrenze wurde mit der Blindwertmethode ermittelt (Gottwald, 2004). Durch die hohe Selektivität des Fluoreszenzdetektors waren Blindwerte nicht vom Grundrauschen zu unterscheiden, so dass die Erfassungsgrenze von der mittleren Peakhöhe des Rauschens und einer Regressionsgeraden abgeleitet wurde. Die Erfassungsgrenze wird als doppelte und die Bestimmungsgrenze als dreifache Nachweisgrenze angegeben. Tabelle 47: Nachweis-, Erfassungs- und Bestimmungsgrenze Thiamin TMP TDP Nachweisgrenze ng/mL 0,3 0,5 0,9 Erfassungsgrenze ng/mL 0,6 1,1 1,9 Bestimmungsgrenze ng/mL 0,9 1,6 2,8 112 Ergebnisse 4.2 MINERALSTOFFE 4.2.1 Trockenmassegehalt der Proben Die Ergebnisse der Trockenmassebestimmung für die Granulaproben sind in Tabelle 48 dargestellt. Tabelle 48: Trockenmassebestimmung Granula Nativeier Bruteier n = Probenanzahl Aluminiumschalen % 45,5 ± 2,1 n = 15 44,2 ± 2,2 n = 15 Reaktionsgefäße % 44,1 ± 1,3 n=5 44,1 ± 1,5 n = 10 Die Trockenmasse weicht nicht voneinander ab, so dass die in den Reaktionsgefäßen getrockneten Granula für die Mineralstoffbestimmung verwendet werden konnte. 4.2.2 Mineralstoffgehalt in Granula nativer Eier und von Bruteiern Soweit nicht anders angegeben, werden die mit interner Kalibrierung ermittelten Werte dargestellt. Die Bestimmung der Gehalte mit externer Kalibrierung diente zum Abschätzen von Matrixinterferenzen. Die Mineralstoffgehalte für die Granula der Nativeier und 5 Tage embryonierten Eier sind in Tabelle 49 zusammengefasst. Der Calciumgehalt und auch der Magnesiumgehalt sind in der Granulafraktion der embryonierten Eier erhöht. Der Eisen- und Zinkgehalt dagegen sind in den Granula embryonierter Eier leicht erniedrigt. Der Kupfergehalt ist in den Granula der nativen und der 5 Tage embryonierten Eier annähernd gleich. Die prozentuale Streuung der Werte liegt zwischen 10 und 20 %. 113 Ergebnisse Somit kann erstmalig der Mineralstoffgehalt in den Granula nativen Eigelbs mit dem Mineralstoffgehalt in den Granula embryonierter Eier verglichen werden. Tabelle 49: Mineralstoffgehalt in Granula nativer Eier und von Bruteiern Calcium Magnesium Eisen Zink Kupfer Nativeigranula* µg/g Tr. M. s in % 12900 ± 1400 10,6 1000 ± 120 12,3 520 ± 60 11,8 500 ± 100 19,4 9,3 ± 1,3 13,9 Granula 5 Tage embryonierter Eier* µg/g Tr. M s in % 14400 ± 1800 12,8 1500 ± 280 18,9 410 ± 60 14,9 450 ± 75 16,9 9,0 ± 1,0 10,6 s = Standardabweichung * = 6 Proben Zur Abschätzung, ob die ermittelten Werte signifikant voneinander abweichen, wird ein t-Test durchgeführt. Zuvor werden die Werte mit dem KolmogorovSmirnov-Test auf Normalverteilung überprüft und mit einem F-Test auf Varianzengleichheit geprüft, da dies die Vorraussetzungen für einen t-Test sind. Tabelle 50: Signifikanztest der Mineralstoffgehalte in den Granula F- Test Calcium Magnesium Eisen Zink Kupfer Varianzen gleich ungleich gleich gleich gleich zweiseitiger t- Test Interpretation A B B A A 0,46067 0,10704 0,04254 0,00103 0,99855 0,00565 0,97413 0,08723 0,49718 0,38849 Gleich = Wert > 0,05 bedeutet Gleichheit der Varianzen Ungleich = Wert = 0,05 bedeutet signifikante Heterogenität der Varianzen A = nicht signifikant (p > 0,05) B = hochsignifikant (p = 0,01) Der t-Test ergab für Calcium, Zink und Kupfer einen Wert für p > 0,05. Das bedeutet, dass die gemessenen Werte nicht signifikant voneinander abweichen, sondern eine Streuung um den Mittelwert aufweisen. Für Magnesium und Eisen ergab der t-Test einen Wert für p = 0,01. Für die gemessenen Gehalte in den Granula der nativen Eier und der embryonierten Eier zeigt dies eine hochsignifikante Abweichung der Werte vom Mittelwert und kann nicht als Streuung angesehen werden. Es konnte 114 daher eine Erhöhung des Ergebnisse Magnesiumgehaltes von 500 µg/g Tr. M. und eine Erniedrigung des Eisengehaltes von 110 µg/g Tr. M. in den Bruteiern festgestellt werden. Der Gehalt dieser Mineralstoffe in den Granula embryonierter Eier hat sich möglicherweise durch Mineralstofftransfer aus anderen Kompartimenten des Eies oder durch extraembryonalen Abbau der Granula während der Bebrütung verändert. 4.2.3 Mineralstoffgehalt im Plasma nativer Eier und von Bruteiern Der mittlere Mineralstoffgehalt im Eigelbplasma der Nativeier und der 5 Tage embryonierten Eier ist in Tabelle 51 zusammenfassend dargestellt. Der Gehalt aller gemessenen Mineralstoffe in der Trockenmasse des Plasmas embryonierter Eier ist höher als im Plasma der Nativeier. Die prozentuale Streuung beträgt zwischen 10 % und 90 % und ist für Calcium, Eisen und Kupfer in den Plasmaproben embryonierter Eier höher, als im Nativei. Die Streuung ist in den Proben, in denen nur geringe Gehalte gemessen wurden, wie Eisen, Zink und Kupfer, besonders ausgeprägt. Der Mineralstoffgehalt im Plasma embryonierter Eier war bislang nicht bekannt. Durch die gleichzeitige Bestimmung des Mineralstoffgehaltes im Plasma nativer Eier ist auch ein direkter Vergleich möglich. 115 Ergebnisse Tabelle 51: Mineralstoffgehalt im Plasma nativer Eier und von Bruteiern Calcium Magnesium Eisen Zink Kupfer Nativeiplasma1 µg/g Tr. M. s in % a 180 ± 20 11 32,2 ± 3,8 a 12 b 4,1 ± 0,6 15 1,08 ± 0,45 a, c 41 b 0,42 ± 0,36 84 Plasma 5 Tage embryonierter Eier1 µg/g Tr. M s in % a 290 ± 90 30 48,8 ± 4,7 a 10 b 20,3 ± 8,4 41 2,24 ± 0,66 a, c 30 b 2,18 ± 2,03 93 c= mit externer Kalibrierung a= mit Flammen-AAS gemessen b= mit Graphitrohr-AAS gemessen s = Standardabweichung 1 = 6 Proben Nur durch einen statistischen Signifikanztest kann abgeschätzt werden, inwieweit die Erhöhung der Mineralstoffkonzentration, die in den embryonierten Eiern vorhanden ist, durch die allgemeine Streuung der Werte um den Mittelwert bedingt ist. Wie auch bei den Granulaproben (siehe 4.2.2) wird zunächst mit dem Kolmogorov-Smirnoff-Test auf Normalverteilung und mit dem F-Test auf Varianzengleichheit getestet. Es konnte für jede Messreihe eine Normalverteilung bestätigt werden. In Tabelle 52 sind die Ergebnisse des F-Tests und des t-Tests aufgeführt. Tabelle 52: Signifikanztest der Mineralstoffgehalte im Plasma F-Test Calcium Magnesium Eisen Zink Kupfer 0,0052 0,6425 0,0001 0,4137 0,00128 A= nicht signifikant (p > 0,05) B= signifikant (p = 0,05) C= hochsignifikant (p = 0,01) Varianzen ungleich gleich ungleich gleich ungleich einseitiger t-Test 0,0244 0,0001 0,0060 0,0072 0,0596 Interpretation B C C C A Die Ergebnisse des t-Tests zeigen, dass die Erhöhung des Kupfergehaltes im Plasma embryonierter Eier, aufgrund der hohen Schwankung der Werte um den Mittelwert, nicht signifikant ist. Für Calcium konnte eine signifikante Erhöhung und für Magnesium, Eisen und Zink eine hochsignifikante Erhöhung festgestellt werden, die nicht durch die Schwankung der Werte um den Mittelwert bedingt 116 Ergebnisse ist. Die Ursache könnte ein Mineralstofftransfer, oder der in der Literatur angegebene extraembryonale Granulaabbau sein. 4.2.4 Kupfergehalt im Plasma von Eigelbproben mit Zusätzen 4.2.4.1 Gefriergetrocknete Proben mit Zusätzen Die Mineralstoffgehalte im Plasma von Eigelbproben, die vor der Gefriertrocknung mit verschiedenen Substanzen versetzt wurden, sind in nachfolgender Tabelle zusammenfassend dargestellt. In den Proben, denen vor der Gefriertrocknung Essigsäure und 0,75 % Phospholipase A2 zugesetzt wurde, konnte ein höherer Kupfergehalt verzeichnet werden als in den anderen Proben. Tabelle 53: Kupfergehalt in gefriergetrockneten Plasmaproben Ohne 1 % Salz1 3 % Zucker1 2 % Essigsäure1 0,5 % PLA21 0,75 % PLA22 Kupfergehalt µg/g Tr. M. 0,41 ± 0,15 0,5 ± 0,07 0,22 ± 0,15 1,42 ± 0,32 0,44 ± 0,05 1,04 ± 0,95 s in % 37 15 65 23 11 92 Probenumfang n=3 n=3 n=3 n=3 n=3 n=6 PLA2 = Phospholipase A2 s = Standardabweichung 1 = mit G-AAS gemessen 2 = drei Proben mit G-AAS und drei Proben mit ICP-OES gemessen In Abbildung 16 sind die Ergebnisse einander gegenübergestellt. Es ist eine Erhöhung des Kupfergehaltes bei denen mit Essigsäure und 0,75 % Phospholipase A2 versetzten Proben zu erkennen. 117 Ergebnisse Abbildung 16: Kupfergehalt in gefriergetrockneten Proben mit und ohne Zusatz Kupfergehalt Kupfer µg/g Tr. M. ohne + Zusatz 1,60 1,42 1,40 1,20 1,04 1,00 0,80 0,60 0,41 0,50 0,41 0,41 0,41 0,44 0,41 0,40 0,22 0,20 0,00 1 % Salz 3 % Zucker 2 % Essig 0,5 % PLA2 0,75 % PLA2 Der Kupfergehalt der Proben mit Zusätzen wurde mit den Proben ohne Zusatz mit einem einseitigen t-Test verglichen, um signifikante Erhöhungen feststellen zu können. Es wurde von einer Normalverteilung der Daten ausgegangen, aber kein Test auf Normalverteilung durchgeführt, da nur jeweils drei Proben vorlagen. Die Ergebnisse (Tabelle 54) zeigen, dass bei den Proben mit Essigsäurezusatz von einer hochsignifikanten Erhöhung des Kupfergehaltes ausgegangen werden kann. Bei allen anderen Proben liegt eine Veränderung des Gehaltes im Bereich der Schwankungsbreite vor. 118 Ergebnisse Tabelle 54: Signifikanztest der Erhöhung des Kupfergehaltes F-Test 1 % Salz 3 % Zucker 2 % Essigsäure 0,5 % PLA2 0,75 % PLA2 Varianzen gleich gleich gleich gleich ungleich t-Test 0,3821948 0,9589226 0,3621941 0,1738349 0,0496824 A = keine signifikante Abweichung (p > 0,05) B = hochsignifikante Abweichung (p = 0,01) PLA2 = Phospholipase A2 0,21636 0,09849 0,00402 0,37444 0,08541 Interpretation A A B A A 4.2.4.2 Native Eigelbproben mit Zusätzen Eine zusammenfassende Übersicht des Kupfergehaltes im Plasma der nicht gefriergetrockneten Proben mit Zusätzen ist im Folgenden dargestellt. Der Kupfergehalt in den Zusätzen war niedrig und wurde von den gemessenen Werten abgezogen. Der Kupfergehalt in den zum Aufschluss eingesetzten Säuren wurde ebenfalls bei der Berechnung berücksichtigt. Die mit G-AAS und ICP-OES ermittelten Gehalte sind einander gegenübergestellt und wurden dann zu einem Wert zusammengefasst. In den mit Essigsäure versetzten Proben, die mit ICP-OES gemessen wurden, war der Kupfergehalt höher, als in den Proben, die mit G-AAS gemessen wurden. Tabelle 55: Kupfergehalt im Plasma der Nativeiproben mit und ohne Zusätzen Kupfergehalt Proben ohne Ascorbinsäure Citronensäure Essigsäure Weinsäure PLA A2 G-AAS µg/g Tr. M. 0,15 ± 0,05 0,15 ± 0,07 0,70 ± 0,21 0,21 ± 0,02 0,84 ± 0,12 - n=6 n=3 n=3 n=3 n=3 - ICP µg/g Tr. M. 0,19 0,24 ± 0,03 1,22 ± 0,08 0,94 ± 0,30 1,49 ± 0,06 0,28 ± 0,04 n=2 n=3 n=3 n=3 n=3 n=6 G-AAS + ICP µg/g Tr. M. 0,16 ± 0,06 0,20 ± 0,07 0,96 ± 0,32 0,57 ± 0,45 1,17 ± 0,37 - s in % 38 36 34 78 32 14 n=8 n=6 n=6 n=6 n=6 - s = Standardabweichung In den nachfolgenden Abbildungen werden die Proben mit den Zusätzen und ohne Zusätze verglichen, um einen Effekt abschätzen zu können (Abbildung 17; 119 Ergebnisse Abbildung 18; Abbildung 19; Abbildung 20). In den ersten sechs Spalten sind die Einzelproben und in der siebten Spalte deren Mittelwert gegen den Wert der Vergleichsproben dargestellt. Abbildung 17: Kupfergehalte der Ascorbinsäureproben im Vergleich zu Proben ohne Zusatz Ascorbinsäure Kupfer µg/g Tr. M. ohne + Zusatz AM aus A1-A6 1,80 1,60 1,40 1,20 1,00 0,80 0,60 0,40 0,20 0,26 0,16 0,21 0,16 0,16 0,16 0,21 0,16 0,16 0,26 0,16 0,20 0,16 0,08 0,00 A1 A2 A3 A1-A3 = Messung mit G-AAS A4 A5 A6 A4-A6 = Messung mit ICP-OES 120 AM Ergebnisse Abbildung 18: Kupfergehalte der Citronensäureproben im Vergleich zu Proben ohne Zusatz Citronensäure Kupfer µg/g Tr. M. ohne + Zusatz AM aus C1-C6 1,80 1,60 1,31 1,40 1,13 1,20 1,00 0,89 0,80 0,60 0,96 1,24 0,71 0,48 0,40 0,16 0,16 0,16 0,20 0,16 0,16 0,16 0,16 0,00 C1 C2 C3 C4 C1-C3 = Messung mit G-AAS C5 C6 AM C4-C6 = Messung mit ICP-OES Abbildung 19: Kupfergehalte der Essigsäureproben im Vergleich zu Proben ohne Zusatz Essigsäure Kupfer µg/g Tr. M. ohne + Zusatz AM aus E1-E6 1,80 1,60 1,40 1,14 1,20 1,09 1,00 0,57 0,80 0,60 0,60 0,40 0,16 0,21 0,20 0,160,18 0,16 0,22 0,16 0,16 0,16 0,16 0,00 E1 E2 E3 E4 E1-E3 = Messung mit G-AAS E5 E6 E4-E6 = Messung mit ICP-OES 121 AM Ergebnisse Abbildung 20: Kupfergehalte der Weinsäureproben im Vergleich zu Proben ohne Zusatz Weinsäure Kupfer µg/g Tr. M. ohne + Zusatz AM aus W1-W6 1,80 1,53 1,60 1,53 1,17 1,42 1,40 1,20 1,00 0,98 0,78 0,80 0,76 0,60 0,40 0,16 0,16 0,16 0,20 0,16 0,16 0,16 0,16 0,00 W1 W2 W3 W1-W3 = Messung mit G-AAS W4 W5 W6 AM W4-W6 = Messung mit ICP-OES Abbildung 21: Kupfergehalt der Phospholipaseproben im Vergleich zu Proben ohne Zusatz Phospholipase Kupfer µg/g Tr. M. ohne + Zusatz AM aus P1-P6 1,80 1,60 1,40 1,20 1,00 0,80 0,60 0,40 0,31 0,16 0,27 0,20 0,28 0,16 0,21 0,16 0,16 0,32 0,16 0,31 0,28 0,16 0,16 0,00 P1 P2 P3 P4 P5 P1-P6 = Messung mit ICP-OES 122 P6 AM Ergebnisse Wie den Diagrammen zu entnehmen ist, ist kein deutlicher Effekt auf den Kupfergehalt bei den mit Ascorbinsäure versetzten Proben zu erkennen. Eine unzweifelhafte Erhöhung um das sechsfache des ursprünglichen Wertes, ist bei den mit Citronensäure versetzten Proben und eine Erhöhung um das siebenfache bei denen mit Weinsäure versetzten Proben zu erkennen. Die mit G-AAS gemessenen Werte konnten durch die Messung mit ICP-OES bestätigt werden. Die mit G-AAS gemessenen Werte, der mit Essigsäure versetzten und der mit Essigsäure versetzten und dann gefriergetrockneten Proben wichen mit 0,21 ± 0,02 µg/g Tr. M. und 1,42 ± 0,3 µg/g Tr. M. stark voneinander ab. Daher wurden mit Essigsäure versetzte Proben ebenfalls mittels ICP-OES gemessen. Der ermittelte Wert entspricht mit 0,94 ± 0,3 µg/g Tr. M. eher dem in den gefriergetrockneten Proben von 1,42 ± 0,3 µg/g Tr. M., so dass mit der ICP-OES die in den gefriergetrockneten Proben ermittelten Werte bestätigt wurden. Für die Berechnung einer signifikanten Abweichung wurden sowohl die mit G-AAS als auch die mit ICP-OES ermittelten Werte berücksichtigt. Zur Abschätzung einer signifikanten Abweichung wird ein t-Test durchgeführt. Zuvor werden die Werte mit dem Kolmogorov-Smirnov-Test auf Normalverteilung und mit dem F-Test auf Gleichheit der Varianzen getestet. Die Ergebnisse sind in Tabelle 56 dargestellt. Tabelle 56: Signifikanztest der Erhöhung des Kupfergehaltes F-Test Varianzen Ascorbinsäure Citronensäure Essigsäure Weinsäure PLA2 0,81941 gleich 0,00052 ungleich 0,00005 ungleich 0,00021 ungleich 0,33208 gleich A = keine signifikante Abweichung (p > 0,05) B = signifikante Abweichung (p = 0,05) C = hochsignifikante Abweichung (p = 0,01) PLA2 = Phospholipase A2 t-Test 0,18536 0,00076 0,03709 0,00050 0,00091 Interpretation A C B C C Bei den mit Ascorbinsäure versetzten Proben wurde keine signifikante Abweichung festgestellt. Bei denen mit Citronensäure, Weinsäure und 123 Ergebnisse Phospholipase A2 konnte eine hochsignifikante Erhöhung festgestellt werden. Trotz der Abweichung im Gehalt der mit G-AAS und ICP-OES gemessenen Essigsäureproben, konnte auch bei diesen eine signifikante Abweichung zu nicht mit Zusätzen versehenen Proben festgestellt werden. Der pH-Wert der Proben ist in nachfolgender Tabelle dargestellt. Tabelle 57: pH-Werte der Proben mit Zusätzen ohne Ascorbinsäure Citronensäure Essigsäure Weinsäure Phospholipase A2 pH-Wert 6,0 4,4 3,5 4,1 2,7 5,9 Die veränderten pH-Werte in den mit Säuren versetzten Proben und damit einhergehende strukturelle Veränderungen im Eigelb, könnte die Ursache für die erhöhten Kupferwerte sein. 4.2.5 Eisengehalt im Plasma von Eigelbproben mit verschiedenen Zusätzen 4.2.5.1 Gefriergetrocknete Proben mit Zusatz In der folgenden Tabelle sind die Eisengehalte im gefriergetrockneten Eigelbproben mit Zusätzen zusammengefasst. 124 Plasma der Ergebnisse Tabelle 58: Eisengehalt in gefriergetrockneten Plasmaproben Eisengehalt µg/g Tr. M. 7,07 ± 1,09 7,47 ± 1,99 4,49 ± 3,82 10,19 ± 1,42 7,75 ± 0,83 9,66 ± 2,19 Ohne1 1 % Salz1 3 % Zucker1 2 % Essig1 PLA2 0,5 %1 PLA2 0,75 %2 Probenumfang n=3 n=3 n=3 n=3 n=3 n=6 s in % 15 27 85 14 11 23 PLA2 = Phospholipase A2 s = Standardabweichung 1 = mit G-AAS gemessen 2 = drei Proben mit G-AAS und drei Proben mit ICP-OES gemessen In der Abbildung 22 sind die Ergebnisse der Tabelle 58 grafisch einander gegenübergestellt. Eine Abweichung des Eisengehaltes der gefriergetrockneten Proben mit Zusatz zu denen ohne Zusatz ist bei den mit Essigsäure und 0,75 % Phospholipase A2 behandelten Proben erkennbar. Abbildung 22: Eisengehalt in gefriergetrockneten Proben mit und ohne Zusatz Gefriergetrocknete Proben mit Zusätzen Eisen µg/g ohne + Zusatz 12,0 10,19 9,66 10,0 8,0 7,75 7,47 7,07 7,07 7,07 7,07 2% Essig 0,5% PLA2 7,07 6,0 4,49 4,0 2,0 0,0 1% Salz 3% Zucker 0,75% PLA2 Es wurde ein t-Test durchgeführt, anhand dessen signifikante Abweichungen im Eisengehalt der Proben festgestellt werden können. Des Weiteren wurde ein FTest durchgeführt in dem von normalverteilten Probenwerten ausgegangen 125 Ergebnisse wurde. Aufgrund der geringen Probenzahl wurde auf einen Normalverteilungstest verzichtet. Tabelle 59: Signifikanztest der Erhöhung des Eisengehaltes F-Test Salz Zucker Essig PLA2 0,5 % PLA2 0,75 % 0,46032 0,15012 0,74419 0,73156 0,42175 A= keine signifikante Abweichung B= Abweichung signifikant (p = 0,05) PLA2= Phospholipase A2 Varianzen gleich gleich gleich gleich gleich t-Test 0,38610 0,16231 0,01946 0,21846 0,0500 Interpretation A A B A B Durch den t-Test konnte die Einschätzung, dass sich der Eisengehalt in den mit Essigsäure und Phospholipase A2 behandelten Proben signifikant erhöht hat, bestätigt werden. 4.2.5.2 Native Eigelbproben mit Zusatz Der Eisengehalt im Plasma der Eigelbproben mit und ohne Zusatz, die nicht gefriergetrocknet wurden, unterscheidet sich deutlich und ist im Vergleich zu den Proben ohne Zusatz erhöht. Der Eisengehalt in den Zusätzen war niedrig und wurde von den gemessenen Werten abgezogen. Der Eisengehalt in den zum Aufschluss eingesetzten Säuren wurde ebenfalls bei der Berechnung berücksichtigt. 126 Ergebnisse Tabelle 60: Eisengehalt im Plasma der Nativeiproben mit und ohne Zusatz Eisengehalt Proben ohne Ascorbinsäure Citronensäure Essigsäure Weinsäure PLA A2 G-AAS µg/g Tr. M. 3,7 ± 0,9 29,2 ± 1,8 15,6 ± 0,3 7,8 ± 0,9 12,2 ± 1,4 - n=7 n=3 n=3 n=3 n=3 - ICP µg/g Tr. M. 3,5 46,3 ± 2,7 21,0 ± 0,5 8,8 ± 0,8 16,6 ± 1,8 2,7 ± 0,2 n=2 n=3 n=3 n=3 n=3 n=6 G-AAS + ICP µg/g Tr. M. 3,5 ± 0,9 37,7 ± 9,6 18,3 ± 2,9 8,3 ± 0,9 14,4 ± 2,8 - s in % 27 26 16 11 20 9 n=9 n=6 n=6 n=6 n=6 - s = Standardabweichung Der Unterschied im Eisengehalt wird auch in Abbildung 23; Abbildung 24; Abbildung 25; und Abbildung 26, in denen die unbehandelten mit den behandelten Proben verglichen werden, deutlich. In Abbildung 23 sind die mit Ascorbinsäure versetzten Proben der Vergleichsprobe gegenübergestellt. In den ersten sechs Spalten sind die Einzelproben und in der siebten Spalte deren Mittelwert gegen den Wert der Proben ohne Zusätze dargestellt. Die Grafik verdeutlicht, dass durch Ascorbinsäurezusatz zum Eigelb, im darauf folgend abgetrennten Plasma mehr Eisen gefunden wird, als in Proben, denen nichts zugesetzt wurde. Auch in den Proben, denen Citronensäure, Essigsäure und Weinsäure zugesetzt wurde, ist der Gehalt erhöht. Die gefundenen Werte sind bei Ascorbinsäure etwa 10 mal höher, bei Citronensäure etwa 5 mal höher, bei Essigsäure etwa 2 mal höher und bei Weinsäure etwa 4 mal höher, als bei den unbehandelten Proben. Bei den mit Phospholipase A2 versetzten Proben ist keine Erhöhung zu erkennen. 127 Ergebnisse Abbildung 23: Eisengehalte der Ascorbinsäureproben im Vergleich zu Proben ohne Zusatz Ascorbinsäure Eisen µg/g Tr. M. ohne + Zusatz AM aus A1-A6 60,0 47,3 50,0 48,4 43,3 37,7 40,0 29,5 27,1 30,0 30,8 20,0 10,0 3,5 3,5 3,5 3,5 3,5 3,5 3,5 0,0 A1 A2 A3 A4 A1-A3 = Messung mit G-AAS A5 A6 AM A4-A6 = Messung mit ICP-OES Abbildung 24: Eisengehalte der Citronensäureproben im Vergleich zu Proben ohne Zusatz Citronensäure Eisen µg/g Tr. M. ohne + Zusatz AM aus C1-C6 60,0 50,0 40,0 30,0 20,9 20,0 10,0 15,9 3,5 15,6 3,5 21,4 18,3 20,5 15,3 3,5 3,5 3,5 3,5 3,5 0,0 C1 C2 C3 C1-C3 = Messung mit G-AAS C4 C5 C6 C4-C6 = Messung mit ICP-OES 128 AM Ergebnisse Abbildung 25: Eisengehalte der Essigsäureproben im Vergleich zu Proben ohne Zusatz Essigsäure Eisen µg/g Tr. M. ohne + Zusatz AM aus E1-E6 60,0 50,0 40,0 30,0 20,0 10,0 8,0 6,8 3,5 3,5 8,5 3,5 3,5 8,1 8,6 9,7 3,5 3,5 8,3 3,5 0,0 E1 E2 E3 E4 E1-E3 = Messung mit G-AAS E5 E6 AM E4-E6 = Messung mit ICP-OES Abbildung 26: Eisengehalte der Weinsäureproben im Vergleich zu Proben ohne Zusatz Weinsäure Eisen µg/g Tr. M. ohne + Zusatz AM aus W1-W6 60,0 50,0 40,0 30,0 20,0 18,4 13,6 10,9 10,0 3,5 3,5 16,7 14,8 12,1 3,5 3,5 3,5 14,4 3,5 3,5 0,0 W1 W2 W3 W1-W3 = Messung mit G-AAS W4 W5 W6 W4-W6 = Messung mit ICP-OES 129 AM Ergebnisse Abbildung 27: Eisengehalt der Phospholipaseproben im Vergleich zu Proben ohne Zusatz Phospholipase Eisen µg/g Tr. M. ohne + Zusatz AM aus P1-P6 60,0 50,0 40,0 30,0 20,0 10,0 3,5 2,7 3,5 3,0 3,5 2,4 3,52,4 P3 P4 3,5 2,9 3,5 2,7 P5 P6 3,5 2,7 0,0 P1 P2 AM P1-P6 = Messung mit ICP-OES Mit einem t-Test soll geprüft werden, ob eine signifikante Erhöhung der Eisengehalte vorliegt. Zuvor wird mit einem Kolmogorov-Smirnov-Test auf Normalverteilung und mit einem F-Test auf Gleichheit der Varianzen getestet. Die Ergebnisse sind in Tabelle 61 zusammengefasst. Tabelle 61: Signifikanztest der Erhöhung des Eisengehaltes F-Test Varianzen Ascorbinsäure Citronensäure Essigsäure Weinsäure PLA2 0,0000008 ungleich 0,00538 ungleich 0,94032 gleich 0,00702 ungleich 0,00749 ungleich A = keine signifikante Abweichung (p > 0,05) B = signifikante Abweichung (p = 0,05) C = hochsignifikante Abweichung (p = 0,01) PLA2 = Phospholipase A2 t-Test 0,00015 0,00002 0,0000001 0,00006 0,01614 Interpretation C C C C B Eine hochsignifikante Erhöhung des Eisengehaltes konnte für die mit Ascorbinsäure, Citronensäure, Essigsäure und Weinsäure versetzten Proben 130 Ergebnisse festgestellt werden. Der Gehalt in den mit Phospholipase A2 versetzten Proben war nicht erhöht, sondern signifikant erniedrigt. Eine durch pH-Wert Erniedrigung hervorgerufene strukturelle Veränderung könnte für die Erhöhung des Eisengehaltes die Ursache sein. Die pH-Werte sind auf Seite 124 in Tabelle 57 dargestellt. 4.2.6 Rasterelektronenmikroskopie Die elektronenmikroskopischen Bilder der Granula unembryonierter Eier und der embryonierten Eier sind nachfolgend dargestellt. Auflösungserscheinungen der Granula sind nicht zu erkennen, allerdings scheinen weniger große Granula in den Proben der embryonierten Eier vorhanden zu sein. Ein extraembryonaler Granulaabbau während der Embryogenese könnte auch zu einer Verkleinerung der Granula führen. 131 Ergebnisse Abbildung 28: Granula aus dem Eigelb nativer Eier Abbildung 29: Granula aus dem Eigelb 5 Tage embryonierter Eier 132 133 134 Diskussion 5. DISKUSSION 5.1 THIAMIN 5.1.1 Methodenentwicklung und Thiaminanalytik In der Literatur werden für die Thiaminextraktion aus der Matrix unterschiedliche Konzentrationen für Trichloressigsäure zwischen 5 und 60 % verwendet. Um abschätzen zu können, welchen Einfluss die Säurekonzentration auf die Stabilität von Thiamin und Thiaminphosphaten hat, wurden vorab verschiedene Säurekonzentrationen bei der Methodenentwicklung getestet. Bei der Extraktion mit 20 % iger Trichloressigsäure war die Wiederfindung, im Vergleich zur Extraktion mit 8 % iger Trichloressigsäure bei TMP um 13 % und bei TDP um 20 % reduziert. Daher wurde eine möglichst niedrige Säurekonzentration von 4 % gewählt, die dennoch ausreichte um die Proteine zu fällen. Für die Festphasenextraktion wurde anfänglich eine C-18 Säule und eine Oasis MAX Säule benutzt. Diese wurden mit Methanol und anschließend mit tridestilliertem Wasser gewaschen. Dann wurden die Säulen mit einem sauren Phosphatpuffer konditioniert. Die Säulen wurden mit einem geeigneten Verbindungsstück verbunden und auf einer Vakuumkammer platziert. Durch einen Spritzenvorsatzfilter wurde der Probenextrakt, welcher nach der basischen Derivatisierung auf pH 3 eingestellt wurde, auf die oberste Säule gegeben und mit tridestilliertem Wasser gewaschen. Die Elution erfolgte dann mit einem Acetonitril: Phosphatpuffer-Gemisch 60:40 (v/v), 120 mM, pH 8,8. Bei dieser Methode wurden die Thiochromphosphate nicht vollständig auf den Säulen retardiert. Die Zugabe des sauren Phosphatpuffers führte vermutlich 135 Diskussion dazu, dass die positiven Bindungsstellen der Oasis MAX Säule auch mit Phosphaten, anstatt mit den Thiochromphosphaten belegt wurden. Zudem sind Thiochrome im sauren Milieu nicht stabil (Fayol, 1997). Aufgrund der aufgeführten Nachteile wurde die Festphasenextraktion verändert. Sowohl der Ansäuerungsschritt der Probe mit Phosphatpuffer, sowie der Säuerungsschritt der Säule wurden verworfen. Damit die Säulen beim Beladen durch den nun basischen pH-Wert der Probenlösung keinen Schaden nehmen, wurde diese mit 1 molarer Salzsäurelösung auf pH 7 eingestellt. Andernfalls wurden die Säulen schon während der Extraktion durch Auflösung der Silicapartikel unbrauchbar. Bei pH 7 allerdings wurden die Thiochromphosphate nicht mehr auf der Oasis MAX Säule retardiert, so dass stattdessen eine Supelco SAX Säule verwendet wurde. Auf dieser Säule wurden die Thichromphosphate sehr stark retardiert, so dass die Phosphatpufferkonzentration stark erhöht werden musste, um die Thiaminphosphate von den Bindungsstellen zu verdrängen. Die Elution der Analyten erfolgte daher mit einem Acetonitril: Phosphatpuffer-Gemisch 20:80 (v/v), 250 mM, pH 7,5. Durch Einzeluntersuchungen konnte bestätigt werden, dass Thiamin auf der C18 Säule und die Thiaminphosphate auf der SAX Säule zurückgehalten wurden. Es wurde keine Beschreibung einer Festphasenextraktion für eine gemeinsame Aufreinigung von Thiamin und seinen Phosphatestern gefunden, die aus der Literatur hätte entnommen werden können. Somit gelang es erstmalig eine Methode zu präsentieren, bei der Thiamin und seine Phosphatester durch eine Festphasenextraktion gemeinsam aufgereinigt und eluiert werden können, die für die Analytik von Proben mit komplizierten Matrices viele Vorteile enthält: Die Eiprobenmatrix beinhaltet Lipide, Proteine und fluoreszierende Stoffe in großer Menge (Ternes et al., 1994). Selbst nach der Zentrifugation war schon mit dem bloßen Auge durch eine Gelbfärbung der Probenlösung zu erkennen, dass noch gelöste Stoffe vorhanden waren, die durch die Festphasenextraktion 136 Diskussion entfernt werden konnten. Durch die Festphasenextraktion konnten außerdem HPLC-Säulen schädigende Substanzen, wie die für die Extraktion verwendete Trichloressigsäure, oder das Bromcyan für die Derivatisierung entfernt werden. Außerdem konnte die Probe, wie in den Chromatogrammen zu sehen ist (siehe 4.1), von fast allen unerwünschten Substanzen befreit werden. Die Proben konnten darüber hinaus durch Anpassung des bei der Festphasenextraktion verwendeten Eluenten in ein Medium verbracht werden, dass der des HPLC Eluenten ähnelte, so dass die Auftrennung und Peakform verbessert wurden. Die Trennung der Analyten mittels HPLC wurde zunächst isokratisch mit einem Acetonitril: Phosphatpuffer Gemisch (v/v) 40:60 mit einer Molarität von 75 mM und pH 8 durchgeführt. Da Methanol die Fluoreszenz der Thiochrome verbessert, wurde auch dieses zu Anfang getestet, aber abgesehen von den schlechteren Trennergebnissen, war der Pumpendruck sehr viel höher, da Mischungen aus Methanol und Wasser eine sehr viel höhere Viskosität als andere Gemische haben (Meyer, 1992). Obwohl das Thiamin und die Thiaminphosphate mit dem ioskratischen System gut getrennt werden konnten, war der pH-Wert zu hoch, um eine lange Haltbarkeit der mit Silicapartikeln gefüllten HPLC-Säulen zu garantieren. Bei einer Erniedrigung des pH-Wertes verschlechterte sich, durch Verringerung der Retentionszeiten, die Trennung der Analyten. Daher wurde ein Gradientensystem eingeführt, so dass die Puffer auf pH 7,15 und pH 7,25 abgesenkt werden konnten. Die Trennung konnte außerdem durch den Austausch der NH2-Säule gegen eine NH2-Säule eines anderen Herstellers verbessert werden, da diese kürzer war. Durch das System konnte eine vollständige Trennung des Thiamins und aller drei Thiaminphosphate in akzeptabler Zeit von 40 Minuten erreicht werden, die außerdem eine längere Lebensdauer der Trennsäulen ermöglicht. Durch die neu entwickelte Methodik ist es gelungen Thiamin und seine Phosphatester zusammen zu extrahieren, aufzutrennen und quantitativ zu bestimmen, obwohl sie unterschiedliche chemisch-physikalische Eigenschaften 137 Diskussion haben. Das zu Thiochrom derivatisierte Thiamin verhält sich apolar, wohingegen die Phosphatester durch die negativ geladenen Phosphatgruppen polar sind. Sie können daher bei Verwendung nur einer HPLC Säule nicht optimal getrennt werden. Diese Problematik konnte durch den Einsatz von zwei Säulen gelöst werden. Zwar war eine Trennung mit isokratischem System möglich, aber eine bessere Trennleistung und Haltbarkeit der HPLC-Säulen konnte durch ein Gradientensystem erreicht werden. Obwohl in der Literatur viele Methoden gefunden wurden, die eine Analyse der Thiamine und Thiaminphosphate präsentieren, wurde bei keiner eine zufrieden stellende Aufreinigung und Auftrennung aus komplizierteren Matrices gefunden. Bei der Analyse nicht ausreichend aufgereinigter Proben können Störpeaks, die den eigentlichen Analyten überlagern, zu falschen Ergebnissen führen, ohne das dies bemerkt wird. Auch die quantitative Analyse nicht vollständig getrennter Peaks kann zu falschen Werten führen. Daher stellt die hier präsentierte Methode eine Verbesserung dar: Thiamin und seine Thiaminphosphate können, inklusive dem selten analysierten Thiamintriphosphat, komplett getrennt und ohne Beeinträchtigung von Störpeaks analysiert werden. Obwohl der pH-Wert der Eluenten niedriger als der für die Fluoreszenz der Thiochrome als optimal angegebene ist (Ishii et al., 1979), liegt die Nachweis-, Erfassungs- und Bestimmungsgrenze im üblichen Bereich und ist teilweise sogar besser, als die von anderen Autoren angegebene. 138 Diskussion Tabelle 62: Nachweis-, Erfassungs- und Bestimmungsgrenze verschiedener Autoren eigene (Losa et al., 2005) (Viñas et al., 2003b) Thiamin NG BG ng/mL ng/mL 0,3 0,9 0,2 0,7 0,06 0,2 NG BG pg/20µL1 pg/20µL1 eigene 6 18 (Losa et al., 2005) 4 14 (Viñas et al., 2003b) 1,2 4 TMP: Thiaminmonophosphat TDP: Thiamindiphosphat NG: Nachweisgrenze BG: Bestimmungsgrenze 1 = absoluter Gehalt in der Probenschleife TMP TDP NG ng/mL 0,5 0,4 1 BG ng/mL 1,6 1,2 3,4 NG ng/mL 0,9 0,3 0,75 BG ng/mL 2,8 1 2,5 NG pg/20µL1 10 8 20 BG pg/20µL1 32 24 68 NG pg/20µL1 18 6 15 BG pg/20µL1 56 20 50 Die Nachweisgrenze für Thiamin wird außerdem von einigen anderen Autoren angegeben und beträgt 0,2 (Brunnekreeft et al., 1989); 0,6 (Schrijver et al., 1982); und 1 (Botticher und Botticher, 1986; Laschi-Loquerie et al., 1992) ng/mL. Die von Viñas et al. (2003b) angegebene Nachweisgrenze von 0,06 ng/mL für Thiamin liegt mit der von Bettendorff et al. (1986) angegebenen Nachweisgrenze von 0,08 ng/mL für Thiamin und 0,16 ng/mL für Thiamindiphosphat in einem sehr niedrigen Bereich und es konnten keine Literaturdaten gefunden werden, in denen niedrigere Nachweisgrenzen angeben werden. Der Vergleich von in der Literatur angegebenen Nachweisgrenzen ist schwierig, da wie auch in den beiden letztgenannten Fällen nicht immer bekannt ist, wie diese bestimmt wurden. Obwohl alle möglichen Ursachen für einen Thiaminabbau (Licht, Wärme, pHWert) in Betracht gezogen und vermieden wurden, war die Wiederfindungsrate von 71 % für TMP und 64 % TDP im Plasma und 58 % für TMP und 47 % für TDP in der Granulafraktion, verglichen mit Literaturdaten, niedrig. Dort werden Wiederfindungsraten für Thiaminmonophosphat und Thiamindiphosphat von über 85 % für Urin (Losa et al., 2005), Blut (Bettendorff et al., 1986; Brunnekreeft et al., 1989; Gerrits et al., 1997; Kimura und Itokawa, 1985; Losa et al., 2005; Tallaksen et al., 1991), Organproben (Batifoulier et al., 2005), Bier 139 Diskussion und Bierzutaten (Zapala, 2003), Erythrozyten (Baines, 1985; Herve et al., 1994; Losa et al., 2005), Nervengewebe (Bettendorff et al., 1991) und Rattengewebe (Sander et al., 1991) angegeben. Die Festphasenextraktion konnte als Ursache, nachdem dieselbe dotierte Probe vor und nach der Festphasenextraktion gemessen wurde, ausgeschlossen werden, da die Wiederfindungsrate bei über 85 % lag. Als mögliche andere Ursache kam außerdem die Eimatrix in Betracht, da mit derselben Methode analysierte Fleischproben eine Wiederfindungsrate von über 90 % aufwiesen. Auch Vanderslice und Huang, die Thiamin und Thiaminphosphate Wiederfindungsrate in in Lebensmitteln Fleisch- und untersuchten, hatten Getreideproben, eine gute nur eine aber Wiederfindungsrate von 60 % für Geflügelprodukte (Vanderslice und Huang, 1986). Allerdings verwendeten sie eine andere Art der Probenaufbereitung, so dass ein direkter Vergleich nicht gezogen werden kann. Die für die Fleisch- und Eiproben verwendeten Methoden erscheinen auf den ersten Blick identisch. Erst bei eingehender Betrachtung fiel ein Unterschied in der Filtration nach der Zentrifugation auf. Für Eiproben wurde, da es sich um feinere Filterrückstände handelt, ein Papierfilter verwendet, für die Fleischproben, da die Rückstände gröber waren Glaswolle. Ob durch unterschiedliche Filtermaterialien tatsächlich ein so großer Verlust der Thiaminphosphate verursacht werden kann erscheint unwahrscheinlich und könnte nur durch weiterführende Untersuchungen eindeutig geklärt werden. 140 Diskussion 5.1.2 Thiamin- und Thiaminphosphatgehalte in Proben 5.1.2.1 Thiamingehalt in Plasma und Granula In Plasma und Granula der nativen Eier und der 5 Tage embryonierten Eier wurde nur Thiamin gefunden und keine Thiaminphosphate. Aufgrund der sehr niedrigen Nachweisgrenze von 10 pg TMP und 18 pg TDP in 20 µL eingespritzter Probe konnte, bei Berücksichtigung der Wiederfindungsrate, davon ausgegangen werden, dass tatsächlich keine Thiaminphosphate vorhanden sind. Wird die Wiederfindungsrate zu der Nachweisgrenze addiert, hätten pro analysiertem Volumen von 20 µL 14 pg TMP und 28 pg TDP enthalten sein können. Verglichen mit den für Thiamin gefundenen Werten von etwa 900 pg in der 20 µL Probenschleife also sehr geringe Mengen. Ein Abbau von TDP oder TMP zu Thiamin hätte sich kaum in einer Erhöhung des Thiamingehaltes bemerkbar gemacht. In der Literatur konnten keine Angaben zu Thiaminphosphatgehalten im Eigelb oder Eigelbfraktionen gefunden werden und die vorliegenden Ergebnisse belegen, dass keine Thiaminphosphate in den Eigelbfraktionen und somit auch nicht im Gesamteigelb vorhanden sind. Da nun der Thiamingehalt pro Gramm Feuchtsubstanz bekannt ist und das Verhältnis von Plasma zu Granula im Eigelb etwa 75:25 beträgt, kann berechnet werden wie viel Prozent des Gesamtthiamins in den einzelnen Fraktionen enthalten ist. Demnach sind 87 % des Gesamtthiamins des Eigelbs im Plasma und 13 % in den Granula enthalten. In den Bruteiern ist dies Verhältnis mit 86:14 annähernd gleich. Daher kann das Plasma des Eigelbs als Thiaminspeicher weiter differenziert werden. Bei der Isolierung des thiaminbindenden Proteins aus dem Eigelb verdünnten Muniyappa und Agida (1981) dieses mit einer Mischung aus Phosphatpuffer und 0,2 molarer NaClLösung und zentrifugierten dieses anschließend. Laut Ternes et al. (1991) und 141 Diskussion Causeret (1991) reicht diese Ionenstärke nicht aus, um die Granula aufzubrechen. Daher ist es wahrscheinlich, dass Muniyappa und Agida (1981) nur die Plasmaproteine aus dem Eigelb isolierten und keine Granulaproteine und folglich auch das thiaminbindende Protein vor allem aus dem Plasma isolierten. Außerdem wird vermutet, dass die thiaminbindenden Proteine auch fast vollständig mit Thiamin gesättigt sind und Vitamine durch die Bindung an Transportproteine ins Ei eingelagert werden (White et al., 1976). Damit passen die aus der Literatur gewonnenen Erkenntnisse, dass Thiamin komplett an das thiaminbindende Protein gebunden ist und dass dieses im Plasma des Eigelbs lokalisiert ist, mit den hier vorliegenden Ergebnissen, dass Thiamin vor allem im Plasma gefunden wurde, überein. Somit konnte, die soweit bekannt bislang ungeklärte Frage, ob Thiaminphosphate im Eigelb und in den Eigelbfraktionen vorhanden sind, beantwortet werden und darüber hinaus Angaben zur Thiaminverteilung in den Eigelbfraktionen gemacht werden. Der Thiamingehalt im Plasma embryonierter Eier war nicht, der Gehalt in den Granula dagegen hochsignifikant (P = 0,01) erhöht. Da Thiamin zur Aufrechterhaltung des Energiestoffwechsels für die Embryogenese benötigt wird, ist eine Erhöhung, statt einer Erniedrigung des Gehaltes, ungewöhnlich da durch den Transfer von Thiamin zum Embryo ein niedrigerer Gehalt erwartet würde. Es gibt mehrere Möglichkeiten wie der erhöhte Thiamingehalt erklärt werden kann: Da die befruchteten und die unbefruchteten Eier von verschiedenen Bezugsquellen stammten, ist es möglich, dass der Thiamingehalt im Futter der Hennen unterschiedlich war. Dies würde zu einem unterschiedlichen Thiamingehalt in den Eiern führen (Leeson und Caston, 2003). Außerdem haben auch die Jahreszeit, das Alter der Hennen und vor allem die Rasse einen Einfluss auf den Thiamingehalt der Eier. Eine weitere Möglichkeit für den höheren 142 Diskussion Gehalt wäre ein Thiamintransport aus anderen Eikompartimenten, beispielsweise dem Eiklar. Der Transfer aus dem Eiklar kann zwar grundsätzlich nicht ausgeschlossen werden, würde aber den hohen Anstieg nicht erklären, da nur ein geringer Thiamingehalt von 0,29 µg/g F.S. im Eiklar vorhanden ist. Obwohl also externe Ursachen (Fütterung, Rasse, Jahreszeit) für den höheren Thiamingehalt in den Granula wahrscheinlich sind, kann dies ohne weitere Untersuchungen nicht vollständig geklärt werden. Da nur Thiamin in Plasma und Granula von Nativeiern gefunden wurde, kann das Vorhandensein von Thiaminphosphaten ausgeschlossen werden. Thiaminphosphate konnten auch nicht im Plasma und Granula von embryonierten Eiern nachgewiesen werden. Damit konnte geklärt werden, dass Thiaminphosphate nicht in Granula oder Plasma während der Embryogenese gebildet oder eingelagert werden. 5.1.2.2 Thiamingehalt in Embryos Im Gegensatz zu den Eigelbfraktionen der Nativeier und der embryonierten Eier konnten Thiaminphosphate im Embryo nachgewiesen werden. Da Thiaminphosphate in Plasma und Granula nicht vorhanden sind, deutet dies an, dass die Thiaminphosphate erst in der Eigelbmembran, oder im Embryo gebildet werden. Vor allem die biologisch aktive Form, das Thiamindiphosphat, lag sowohl in 5 Tage alten, als auch 7 Tage alten Embryos vor. Da auch Thiamin in nennenswerter Menge vorlag, spricht dies eher für eine Verstoffwechselung in den Zellen des Embryos, als in den extraembyonalen Membranen. Das Thiaminmonophosphat, für das bislang keine biologisch aktive Rolle festgestellt werden konnte, ist nur eine Zwischenstufe in der Metabolisierung zum Thiamindiphosphat und konnte in Übereinstimmung dazu auch nur in geringer Konzentration nachgewiesen werden. Es wurde zwar nur in 7 Tage alten 143 Diskussion Embryos nachgewiesen, aber da es eine Vorstufe in der Metabolisierung zum Thiamindiphosphat ist, ist es wahrscheinlich, dass der Gehalt in 5 Tage alten Embryos unter der Nachweisgrenze lag. Dem Thiamintriphosphat dagegen wird eine spezielle Funktion in Nerven zugesprochen und es ist mit 80 % die Hauptfraktion in der weißen Skelettmuskulatur des Huhnes. In der roten Skelettmuskulatur ist es noch zu 30 % vertreten (Miyoshi et al., 1990). Da es sich also um sehr differenzierte Gewebe handelt, könnte dies der Grund sein, dass in 5 und 7 Tage alten Embryos kein Thiamintriphosphat nachgewiesen werden konnte, da zu diesen Zeitpunkten noch keine Differenzierung zu Nerven- oder Muskelgewebe in den Embryos vorhanden ist. Der Gehalt an Gesamtthiamin im Vergleich 5 Tage alter Embryos zu 7 Tage alten Embryos scheint abgenommen zu haben. Ein t-Test zeigt allerdings keine ausgeprägte Signifikanz (p = 0,046). Es wäre also möglich, dass zu diesem Zeitpunkt das Wachstum des Embryos die Thiaminaufnahme übersteigt. Eine andere Erklärung wäre, dass die Dottersackmembran nicht nur für Mineralstoffe, sondern auch für Thiamin, eine regulatorische Funktion erfüllt. Da sie zuvor noch nicht voll entwickelt ist, könnte die Thiaminaufnahme erst am 7. Tag begrenzt sein. Der Thiamindiphosphatgehalt dagegen ist in den 7 Tage alten Embryos hochsignifikant erniedrigt (P = 0,01). Da weniger Thiamin zur Verfügung steht, könnte auch weniger Thiamindiphosphat metabolisiert werden. Zumindest führt ein bei Schafen induzierter Thiaminmangel im Gehirn ebenfalls zu einem Abfall von Thiamin und aller Thiaminphosphate in etwa gleichem Maßstab (Thornber et al., 1980). Olkowski und Classen (1999) führten Untersuchungen zum Einfluss der Fütterung auf den Thiamingehalt durch und bestimmten im Rahmen dieser Untersuchungen auch den Thiamindiphopshatgehalt im Herz von 20 Tage alten Embryos (Olkowski und Classen, 1999). Es konnte somit eine Brücke zu den in der Literatur vorhandenen Stützpfeilern gebaut werden, da gezeigt werden konnte, dass schon in 5 und 7 Tage alten Embryos Thiaminphosphate gebildet 144 Diskussion werden. Dass Thiamintriphosphat im undifferenzierten Embryogewebe nicht nachgewiesen wurde, bestätigt die Vermutung, dass es eine sehr spezielle Rolle im Stoffwechsel einnimmt und erst in späteren Entwicklungsphasen in differenzierten Geweben gebildet wird. 5.2 MINERALSTOFFE 5.2.1 Trockenmassebestimmung in Granulaproben Es konnte kein signifikanter Unterschied im Trockenmassegehalt der in den Aluschalen gemessenen und den in den Reaktionsgefäßen gemessenen Granula festgestellt werden. Daher konnte der in den getrockneten Granula bestimmte Mineralstoffgehalt als Gehalt in der Trockenmasse angenommen werden. 5.2.2 Mineralstoffgehalt in nativen Eiern in Plasma und Granula In dieser Versuchsanordnung sollte geklärt werden, wie die Mineralstoffe in Plasma und Granula embryonierter Eier verteilt sind, da diese nur für Nativeier bekannt ist. Darüber hinaus sollten Unterschiede im Vergleich zwischen Mineralstoffgehalt und Verteilung in Plasma und Granula von Nativeiern und embryonierten Eiern festgestellt werden. Für den Calciumgehalt in den Granula von Nativeiern fanden Wakamatu et al. (1982a) 9880 µg/g Tr. M. und Causeret et al. (1991) 11900 µg/g Tr. M. Die gefundenen Werte stimmen mit den Literaturdaten überein. Für den Calciumgehalt im Plasma lagen nur die Werte von Wakamatu et al. (1982a) vor, welche mit 580 µg/g Tr. M. einen über doppelt so hohen Gehalt fanden. Bei einer Schwankungsbreite von nur 10 % in den vorliegenden Proben und einer Mittelung von jeweils drei Messungen 145 derselben Probe können Diskussion Messungenauigkeiten als Ursache ausgeschlossen werden. Die Trennung von Plasma und Granula erfolgte ebenfalls annähernd zu der von Wakamatu et al. (1982a) beschriebenen Methode, wobei diese die Proben wesentlich länger zentrifugierten, so dass hier eine mögliche Ursache liegen könnte, wenn sich dadurch Plasma- und Granulabestandteile, vor allem die löslichen Plasmaproteine unterschiedlich getrennt haben. Dies würde auch den geringeren Calciumgehalt in den Granula von Wakamatu et al. (1982a) erklären. Der gefundene Magnesiumgehalt in den Granula entspricht mit 996 µg/g Tr. M. in etwa den Gehalten, die von Grau (1979) 749 µg/g Tr. M., Wakamatu (1982a) 790 µg/g und Causeret (1991) 715 µg/g angegeben werden. Der Mineralstoffgehalt im Plasma von 32,3 µg/g Tr. M. ist in den vorliegenden Proben geringer als der in der Literatur angegebene mit 74 µg/g Tr. M. (Grau und Roudybush, 1979a) und 110 µg/g (Wakamatu et al., 1982a). Die Unterschiede in der Technik der Trennung von Plasma und Granula könnte, wie bei Calcium, die Ursache für den unterschiedlichen Gehalt sein. Der Eisengehalt der Granula weicht mit 518 µg/g Tr. M. nicht von den in der Literatur angegebenen Werten von 400 und 480 µg/g Tr. M. (Grau und Roudybush, 1979a; Wakamatu et al., 1982a) ab. Der Eisengehalt von 4 µg/g Tr. M. liegt unter dem von Grau (Grau und Roudybush, 1979a) angegebenen Wert von 7,6 µg/g. Der Zinkgehalt in den Granula wird von Grau und Roudybush (1979a) mit 288 µg/g angegeben und liegt somit weit unter dem Gehalt von 515 µg/g in den vorliegenden Proben. Der Zinkgehalt im Plasma dagegen entspricht mit 1 µg/g Tr. M. dem von Grau angegebenen Wert von 2 µg/g Tr. M. Der Kupfergehalt in den Eigelbfraktionen wurde, soweit bekannt, nur von Grau und Roudybush (1979a) für Gesamteigelb mit 20,3 µg, für Granula mit 20,6 µg und für Plasma mit 20,5 µg angegeben. Diese Werte weichen erheblich von den hier vorliegenden Werten von 9,28 µg/g Tr. M. in der Granulafraktion und 0,42 µg/g Tr. M. Plasma ab. Von anderen Autoren wird ein wesentlich niedrigerer 146 Diskussion Kupfergehalt für Gesamteigelb zwischen 2,6 bis 4,8 µg/g Tr. M. angegeben (Cotterill et al., 1977; Romanoff und Romanoff, 1967). Man kann ein Verhältnis von Plasma zu Granula von 75:25, eine Trockenmasse für Eigelb von 50 %, für Eigelbplasma von 40 % und für die Granula von 45 % als Grundlage für eine grobe Einschätzung der Werte verwenden. Der aus den in dieser Arbeit gefundenen Werten berechnete Kupfergehalt von 3 µg/g Eigelbtrockenmasse liegt damit näher an den von anderen Autoren angegebenem Kupfergehalt, so dass die von Grau angegebenen Werte vermutlich nicht den tatsächlichen Gehalten entsprechen. 5.2.3 Mineralstoffgehalt in Plasma und Granula 5 Tage embryonierter Eier Da die Mineralstoffgehalte in den Nativeiern denen in der Literatur angegebenen Werten entsprechen, oder wie im Fall von Kupfer, als korrekt angesehen werden können, gilt dies ebenso für die in embryonierten Eiern gefundenen Gehalte. Für den Mineralstoffgehalt in Plasma und Granula embryonierter Eier ließen sich in der Literatur keine Angaben finden, so dass die hier präsentierten Daten erstmalig erhoben wurden. Außerdem sollte beurteilt werden, inwieweit die zwischen Nativeiern und embryonierten Eiern gefundenen Werte voneinander abweichen und worin die Ursache bestehen könnte. Der Calciumgehalt in den Granula unterscheidet sich in Nativeiern und embryonierten Eiern nicht signifikant. Im Plasma dagegen, konnte eine signifikante Erhöhung festgestellt werden. Daher gibt es drei Möglichkeiten, die Erhöhung zu erklären. Da Calcium während der Embryogenese aus der Eischale mobilisiert wird, könnte ein Transfer in das Eigelb vor der Aufnahme durch den Embryo eine Erhöhung im Plasma bewirken. Andererseits gilt als gesichert, dass eine Calciummobilisation aus der Eischale erst ab dem 10 bis 12 Inkubationstag in größerem Umfang über die extraembryonalen Häute stattfindet, so dass ein 147 Diskussion aktiver Transport vermutlich ausgeschlossen werden kann. Im Eiklar ist Calcium ebenfalls in größerer Menge vorhanden, so dass ein Transfer oder eine passive Diffusion auch aus diesem Kompartiment möglich wäre. Auch aus der Eischale gelöste Calciumionen könnten über das Eiklar in das Eigelb diffundieren. Da während der Embryogenese Wasser vom Eiklar ins Eigelb diffundiert, könnten gleichzeitig auch Calciumionen in das Eigelb gelangen. Als letzte Möglichkeit könnten auch in den Granula gebundene oder freie Calciumionen während der Embryogenese in das Plasma gelangen, da ein extrazellulärer Granulaabbau durch das Vorhandensein von Enzymen vermutet wird und Calciumionen zu 99 % in den Granula gebunden sind. Es ist bekannt, dass der Calciumgehalt im Gesamteigelb leicht vom 5. bis zum 7. Inkubationstag zunimmt, nicht aber ob diese Erhöhung in Plasma oder Granula stattfindet. Eine Erhöhung des Calciumgehaltes im Eigelb konnte somit durch die vorliegenden Ergebnisse bestätigt werden und außerdem weiter differenziert werden, dass diese Erhöhung in der Plasmafraktion stattfindet. Für Magnesium konnte in den Granula und im Plasma ein signifikant höherer Gehalt in embryonierten Eiern als in Nativeiern festgestellt werden. Daher ist es unwahrscheinlich, dass ein Transfer von Magnesiumionen zwischen diesen beiden Fraktionen stattgefunden hat. Magnesium ist mit 900 µg/g Tr. M. (Souci et al., 2000) auch im Eiklar in größerer Menge vorhanden. Daher wäre es möglich, dass eine Diffusion von Magnesiumionen aus dem Eiklar in das Eigelb stattgefunden hat. Da, wie schon erwähnt, während der Embryogenese Wasser vom Eiklar ins Eigelb gelangt, könnten gleichzeitig auch Magnesiumionen in das Eigelb gelangen. Eine weitere Möglichkeit wäre die Mobilisation aus der Eischale, da Experimente an schalenlosen Embryos vermuten lassen, dass auch ein Teil des Magnesiums aus der Eischale mobilisiert wird (Dunn und Boone, 1977). In beiden Fällen würden die Magnesiumionen vermutlich nicht von einer extraembryonalen Membran aufgenommen und dann zum Embryo transportiert, sondern über das Eiklar zunächst in die Granula gelangen, da erst ab dem 10. 148 Diskussion Tag ein Kontakt der Chorioallantoismembran mit der Eischalenmembran zu verzeichnen ist. Der Eisengehalt in den Granula ist gegenüber den Nativeiern in den embryonierten Eiern signifikant erniedrigt und im Plasma dagegen hochsignifikant erhöht. Da Eisenionen im Eiklar nur in Spuren vorhanden sind, kann diese Eifraktion als Eisenquelle mit hoher Wahrscheinlichkeit ausgeschlossen werden. Da keine Beeinträchtigung des Eisengehaltes in schalenlosen Embryos festgestellt werden konnte (Dunn und Boone, 1977) und Eisenionen nur in geringer Konzentration in der Eischale zu finden sind, ist die Eischale als Eisenquelle ebenfalls unwahrscheinlich. In den Granula sind Eisenionen zu 95 % im Phosvitin-Lipovitellin-Komplex gebunden (Richards, 1997; Ternes et al., 1994), wohingegen sich 33 % der Eisenionen in den Experimenten von Wakamatu et al. (1982a) dialysieren ließen. Ob eine Diffusion von Eisenionen möglich ist, kann daher nicht zufrieden stellend geklärt werden. Es besteht noch die Möglichkeit, dass im Komplex gebundene Eisenionen während des Brutvorganges durch extrazellulären Granulaabbau freigesetzt werden und daher im Plasma embryonierter Eier ein höherer Eisengehalt gefunden werden kann. Da auch im Darm Eisenionen nicht an Phosvitin gebunden aufgenommen werden, könnte dies für die Dottersackmembran ebenfalls gelten, so dass Eisenionen nicht nur mit den Granula per Endozytose, sondern auch über einen speziellen Eisentransportmechanismus aufgenommen werden könnten. Der Zinkgehalt in Granula embryonierter Eier ist, gegenüber Nativeiern, nicht verändert, im Plasma dagegen signifikant erhöht. Zink ist in der Granulafraktion zu 90 % an Lipovitellin gebunden. Ansonsten gelten ähnliche Bedingungen wie für Eisen. Es ist ebenfalls nur in geringen Konzentrationen in Eiklar und Eischale zu finden und es könnte somit ein Transfer aus den Granula in das Plasma stattgefunden haben. 149 Diskussion Der Kupfergehalt hat sich weder in den Granula, noch im Plasma signifikant im Vergleich von Nativei zu embryonierten Eiern verändert. Eine Freisetzung oder ein Transfer von Kupferionen aus anderen Kompartimenten des Eies ist daher unwahrscheinlich. Die Ergebnisse, dass einige Mineralstoffe in embryonierten Eiern im Plasma angereichert werden, legt nahe, dass durch den extraembryonalen Proteinabbau, auch die in den Proteinkomplexen gebundenen Mineralstoffe freigesetzt und von der Dottersackmembran aufgenommen werden. Dass zumindest Kupfer, Zink und Eisen von der Dottersackmembran aufgenommen werden, legten die Ergebnisse von Ridgway und Karnofsky (1952) nahe. Sie injizierten Metallsalze in den Dottersack und bestimmten anschließend den Mineralstoffgehalt in Hühnerembryos. Dies stellt einen indirekten Beweis für einen Mineralstofftransfer von freien Ionen aus dem Dotter in den Embryo dar. 5.2.4 Kupfer- und Eisengehalt in technologisch behandelten Proben 5.2.4.1 Veränderung des Kupfergehaltes in Plasmaproben In den Eigelbproben, denen vor der Gefriertrocknung Zusätze zugegeben wurden und die danach auf ihren Kupfergehalt im Plasma untersucht wurden, zeigten die mit 2 % Essigsäure eine Veränderung im Kupfergehalt im Plasma. Der Gehalt betrug das 3 fache im Vergleich zu den Proben ohne Zusatz und war hochsignifikant. Zur Abschätzung, ob die Gefriertrocknung einen Einfluss auf die Freisetzung hat, wurden die gefriergetrockneten Proben ohne Zusatz mit nativen Proben ohne Zusatz verglichen. Der Kupfergehalt im Plasma des Eigelbs von Nativeiern (siehe 4.2.3) beträgt, wie bei den gefriergetrockneten Proben, 0,42 µg/g (siehe 4.2.4.1). Somit kann angenommen werden, dass die Erhöhung des Kupfergehaltes im Plasma nur auf die Zugabe der Zusätze 150 Diskussion zurückzuführen ist und nicht auf die Gefriertrocknung. Da der Nomalgehalt an Kupfer im Eigelbplasma niedriger ist, als der Gehalt in den mit Zusätzen versetzten Proben, muss das zusätzliche Kupfer aus den Granula stammen. Ebenso wie Zink und Eisen sind auch Kupferionen im Phosvitin-LipovitellinKomplex der Granula gebunden. Zink und Eisen sind zu über 90 % gebunden, aber genaue Angaben zur Kupferbindung konnten in der Literatur nicht gefunden werden. Da durch die Bindung von Eisen und Kupfer eine Lipidoxidation verhindert werden soll, ist eine Bindung von Kupferionen zu einem hohen Prozentsatz wahrscheinlich (Richards, 1997). Daher kann angenommen werden, dass die Kupferionen aus den Granula und dort aus dem PvLv-Komplex stammen. Nach der Resuspension des gefriergetrockneten Eigelbs wich die Konsistenz von der bei Eigelb üblichen Konsistenz bei den Essigsäureproben ab. Bei unter pH 4,2 werden die Ionenbrücken der Granula aufgebrochen und die Granula destabilisiert. Dadurch nimmt die Löslichkeit der Granulaproteine zu. Da der pH-Wert durch Essigsäurezusatz auf pH 4,1 abgesenkt wurde wäre dies ein Grund für die Freisetzung der Kupferionen. Die Bildung von löslichen Kuferacetaten wäre eine andere Erklärung für den erhöhten Gehalt im Plasma. Bei denen mit 0,75 % Phospholipase A2 versetzten Proben konnte keine signifikante Erhöhung des Kupfergehaltes im Plasma festgestellt werden, obwohl der Gehalt gegenüber den Proben mit 0,5 % Phospholipase A2 tendenziell erhöht erschien. Da es sich bei der Phospholipase A2 um ein Enzym handelt, ist die Aktivität von Temperatur und Inkubationszeit abhängig. Ein geringerer Gehalt des Enzyms könnte daher, wie im vorliegenden Fall, keinen messbaren Effekt auf eine Kupferfreisetzung haben. Da das Phosvitin mit Lipovitellin, welches selbst Lipoproteine enthält und in welches Lipide eingelagert sind, einen Komplex bildet, könnte die Phospholipase A2 diesen Komplex durch ihre Aktivität destabilisieren. Dadurch könnten die Kupferionen ebenfalls frei werden, oder an Proteinfragmente 151 Diskussion gebunden mit diesen in Lösung gehen, was zu einem erhöhten Kupfergehalt im Plasma führen würde. Um den Effekt andere Zusätze auf eine Freisetzung von gebundenen Kupferionen feststellen zu können, wurden Eigelbproben mit Zusätzen versetzt und nicht gefriergetrocknet. Für die mit Ascorbinsäure behandelten Proben kann eine Wirkung anhand der Ergebnisse nahezu ausgeschlossen werden. Eine hochsignifikante Erhöhung um das sechsfache und siebenfache war bei den mit Citronensäure bzw. Weinsäure versetzten Proben zu erkennen. Die Überprüfung des pH-Wertes der mit Zusätzen versetzten Proben ergab eine Erniedrigung auf pH 3,5 bei den mit Citronensäure versetzten Proben und auf pH 2,7 bei den mit Weinsäure versetzten Proben. Es ist anzunehmen, dass die pH-Wert Absenkung die Granula denaturiert hat und dadurch die Kupferionen aus den Granula freigesetzt wurden, so dass sich der Gehalt im Plasma erhöht hat. Darüber, ob die Kupferionen als freie Ionen oder an Proteinfragmente im Plasma gelöst vorliegen, kann keine Aussage getroffen werden. Sowohl Citronensäure, als auch Weinsäure sind in der Lage lösliche Komplexe mit Metallionen zu bilden, so dass auch eine Umkomplexierung als Ursache des veränderten Gehaltes im Plasma ebenfalls in Betracht kommt. In den mit Essigsäure versetzen nativen Eigelbproben, konnte keine Erhöhung im Gegensatz zu den mit Essigsäure versetzten und danach gefriergetrockneten Proben festgestellt werden. Daher wurden nochmals Proben mit ICP-OES gemessen und in diesen, wie in den gefriergetrockneten Proben eine deutliche Erhöhung des Kupfergehaltes festgestellt. Obwohl die niedrigen mit G-AAS gemessenen Werte berücksichtigt wurden, war die Erhöhung des Kupfergehaltes in den nativen mit Essigsäure versetzten Proben signifikant. In Zusammenhang mit den für die gefriergetrockneten Proben gemessenen Werten, kann davon ausgegangen werden, dass auch Essigsäure, durch pH-Wert Absenkung zu einer Freisetzung von Kupferionen führt. Eine Umkomplexierung als Ursache kommt 152 Diskussion dagegen nicht in Betracht. Eine Bildung von löslichen Kupferacetaten könnte die erhöhten Kupferwerte im Plasma dagegen ebenfalls erklären. Eine Freisetzung von Kupfer in den nicht gefriergetrockneten Proben durch Phospholipase A2 konnte festgestellt werden und bestätigt die in den gefriergetrockneten Proben stattgefundene tendenzielle, aber nicht signifikante Erhöhung. Eine umfassende Kenntnis darüber, wie bestimmte Nahrungszusätze den Kupfergehalt oder die Verfügbarkeit der Kupferionen im Eigelb beeinflussen, ist bei der technologischen Verarbeitung wichtig, um zu garantieren, dass gesunde und ausgewogene Lebensmittel hergestellt werden. Die Wirkung von verschiedenen Säuren auf die Freisetzung von Kupferionen aus den Granula wurde, soweit bekannt, noch nicht untersucht, so dass die hier vorliegenden Erkenntnisse neue Möglichkeiten eröffnen, die technologisch bedingten Veränderungen nutzbar zu machen und weiter zu erforschen. 5.2.4.2 Veränderung des Eisengehaltes in Plasmaproben In den zuvor mit Zusätzen behandelten und anschließend gefriergetrockneten Eigelbproben, konnte im Plasma bei zwei Proben eine Veränderung des Eisengehaltes verzeichnet werden. In den mit Essigsäure und mit 0,75 % iger Phospholipase A2 behandelten Proben wurde eine signifikante Erhöhung des Eisengehaltes festgestellt. Das zuvor untersuchte Plasma von Nativeiern (siehe 4.2.3) wies nur einen Eisengehalt von 4,07 µg/g Tr. M. auf. Da der Eisengehalt der unbehandelten Proben allerdings bei 7,07 µg lag, ist es möglich, dass auch die Gefriertrocknung eine Freisetzung der Eisenionen hervorgerufen hat. Die durch Zugabe von Essigsäure erzeugte Absenkung auf pH 4,1 und damit verbundene Destabilisierung der Granula, oder die Bildung von löslichem Eisenacetat können zu einer Erhöhung der Eisenionen im Plasma der Proben geführt haben. 153 Diskussion Das Lipovitellin des PvLv-Komplexes der Granula besteht aus einer globulär gefalteten Proteinkette, in die Lipide eingelagert sind. Das Lipovitellin selbst ist ein Lipoprotein und die zu 23 % enthaltenen Lipide sind zu 85 bis 90 % Phospholipide. Wenn diese von der Phospholipase A2 angegriffen werden, dann könnte dies zur Zerstörung des Lipovitellinkomplexes und in der Folge des gesamten PvLv-Komplexes führen, in welchem die Eisenionen an Phosvitin gebunden sind. Die Eisenionen könnten dadurch vollständig vom Phosvitin gelöst werden, oder auch an Phosvitin gebunden mit diesem im Plasma in Lösung gehen. Ein geringer Zusatz an Phospholipase A2 führt zu keiner deutlichen Erhöhung des Eisengehaltes. Da es sich bei der Phospholipase A2 um ein Enzym handelt, welches seine Wirkung temperatur- und zeitäbhängig erfüllt, könnte eine Freisetzung mit der Menge der eingesetzten Phospholipase A2 und der Temperatur und Dauer der Inkubation korreliert sein. Wie auch schon von Morris und Greene 1972 postuliert, bewirkt Zugabe von Ascorbinsäure eine Freisetzung des an Phosvitin gebundenen Eisens (Morris und Greene, 1972). In der vorliegenden Arbeit wurde eine Erhöhung des Eisengehaltes im Plasma der mit Ascorbinsäure versetzten Eigelbproben um den Faktor 10 festgestellt. Für andere Zusätze, wie Citronensäure, Essigsäure und Weinsäure, ließen sich dagegen keine Quellen finden, die eine Freisetzung von Eisen diskutieren. Für diese Zusätze konnte durch die vorliegenden Ergebnisse ebenfalls eine Freisetzung des gebundenen Eisens festgestellt werden, da der Eisengehalt im Plasma anstieg. Die pH-Wert Absenkung, die bei allen mit Säure versetzten Proben stattfand, kann nicht allein die Ursache für die Freisetzung sein, da Castellani et al. (2004) herausfanden, dass einmal gebundene Eisenionen so leicht durch pH-Wert Absenkung nicht wieder von Phosvitin abzulösen sind. Die Ascorbinsäure reduziert Fe-(III)-Ionen zu Fe-(II)-Ionen und bildet mit ihnen einen Komplex (Ternes et al., 1994). Die Eisenfreisetzung konnte auch von anderen Autoren bestätigt werden (Jacobsen et al., 1999; 154 Diskussion Jacobsen et al., 2001; Nielsen et al., 2000). Jacobsen et al. (1999) diskutierten, dass die pH-Wert Absenkung bei Zugabe von Ascorbinsäure nicht der Hauptgrund für die Freisetzung ist, sondern die Reduzierung von Fe-(III)-Ionen zu Fe-(II)-Ionen und deren Komplexierung. Für Kupfer dagegen fanden sie keine Freisetzung durch Ascorbinsäure. Neben Ascorbinsäure sind auch Citronensäure und Weinsäure in der Lage Metallionen zu komplexieren. Es könnte also eine Umkomplexierung stattgefunden haben, die dann eine Erhöhung des Eisengehaltes im Plasma zur Folge hätte, da die gebildeten Komplexe löslich sind. In den mit Essigsäure versetzten Proben war ebenfalls ein hochsignifikanter Anstieg des Eisengehaltes zu verzeichnen. Der Gehalt war aber nur doppelt so hoch, wie in den nativen Proben. Essigsäure kann durch eine Absenkung des pH-Wertes zu einer Freisetzung des Eisens geführt haben. Da Eisen durch pHWert Änderung so leicht nicht vom Phosvitin zu lösen ist, wurden entweder lösliche Eisenacetate gebildet, oder die Granula wurden destabilisiert und die Eisenionen gingen an Proteinfragmente gebunden in Lösung. Durch Phospholipase A2 konnte, im Gegensatz zu den Kupferionen, keine Freisetzung von Eisen in nicht gefriergetrockneten Proben hervorgerufen werden. Da eine Erhöhung des Eisengehaltes in den gefriergetrockneten Phospholipaseproben festgestellt wurde, wäre eine Erklärung, dass erst die Kombination von Phospholipase und Gefriertrocknung zu einer Veränderung des Eisengehaltes führt. Erstmalig konnte gezeigt werden, dass Eisenionen auch durch andere Zusätze, wie Essigsäure, Citronensäure und Weinsäure aus den Granula freigesetzt werden. Eine weiterführende Untersuchung der Mechanismen der Freisetzung könnte neue Möglichkeiten in der technologischen Verarbeitung von Eigelb eröffnen. Inwieweit das neu entwickelte Gefriertrocknungsverfahren eine Freisetzung gebundener Ionen beeinflusst konnte ebenfalls geklärt werden. 155 Diskussion 5.2.5 Rasterelektronenmikroskopie Durch die elektronenmikroskopischen Aufnahmen der Granula, sollte geklärt werden, ob Auflösungserscheinungen, die einen extraembryonalen Abbau bestätigen würden, zu erkennen sind. Obwohl dies nicht der Fall ist, erscheinen die Granula der bebrüteten Eier etwas kleiner, so dass eine Auflösung der Granula zwar nicht stattfindet, aber dem extrazelluläreren Abbau der Granula möglicherweise andere Mechanismen zugrunde liegen, die zu einer Verkleinerung führen. Die Ursachen für die Verkleinerung der Granula kann nur durch weiterführende Untersuchungen geklärt werden. 156 Zusammenfassung 6. ZUSAMMENFASSUNG Sarina Bäckermann Untersuchungen zur Verteilung ausgewählter Kationen in Plasma und Granula von nativen, embryonierten und lebensmitteltechnologisch verarbeiteten Hühnereigelb In der vorliegenden Arbeit wurden die Kationen Magnesium, Calcium, Eisen, Kupfer und Zink, sowie Thiamin und Thiaminphosphate untersucht. Für die gleichzeitige Bestimmung des Thiamins und der Thiaminphosphate wurden eine neue Festphasenextraktion und eine neue HPLC-Methode entwickelt. Bei der Festphasenextraktion wurde eine C-18 Säule für die Retardierung des Thiamins und eine SAX Säule für die Retardierung der Thiaminphosphate gekoppelt. Mit dieser Methode gelang erstmalig eine gemeinsame Aufreinigung des Thiamins und der Thiaminphosphate aus der komplizierten Eimatrix, so dass die Selektivität der HPLC Analyse optimiert wurde. Bei der neuen HPLC Methode wurde ein C-8 Säule mit einer NH2-Säule kombiniert, so dass das zu Thiochrom derivatisierte Thiamin auf ersterer und die Thiochromphosphate auf letzterer retardiert wurden. Bei Verwendung einer Gradientenelution konnten Thiaminphosphate, inklusive dargestellt werden. Durch erstmals dadurch Thiamintriphosphat, die vorherige Thiamin und vollständig Aufreinigung alle separiert mittels Festphasenextraktion waren zudem keine die Messung störenden Peaks vorhanden. Die Nachweisgrenze lag für Thiamin bei 0,3 ng/mL, für 157 Zusammenfassung Thiaminmonophosphat bei 0,5 ng/mL und für Thiamindiphosphat bei 0,9 ng/mL. In Plasma und Granula des Eigelbs wurde der Thiamin und Thiaminphosphatgehalt untersucht. Sowohl in Plasma und Granula nativer, als auch 5 Tage embryonierter Eier konnten keine Thiaminphosphate nachgewiesen werden. Es wurde nur Thiamin in Plasma und Granula nachgewiesen und ein Verhältnis des Thiamingehaltes von 2:1 bestimmt. Im Plasma des Nativeies wurde ein Thiamingehalt von 3431 ± 698 ng/g Tr. M. und in den Granula von 1522 ± 135 ng/g Tr. M. bestimmt. Im Plasma der 5 Tage embryonierten Eier beträgt der Thiamingehalt 4377 ± 1074 ng/g Tr. M. und in den Granula 2132 ± 450 ng/g Trockenmasse. Der Thiamin und Thiaminphosphatgehalt in 5 und 7 Tage alten Embryos wurde ebenfalls untersucht. Im Gegensatz zu Granula und Plasma des Eigelbs nativer und embryonierter Eier konnten in den Embryos Thiaminmonophosphat und Thiamindiphosphat nachgewiesen werden. Der Gehalt betrug in 5 Tage alten Embryos für Thiamin 1236 ± 441 ng/g Tr. M und für Thiamindiphosphat 7924 ± 963 ng/g Trockenmasse. Thiaminmonophosphat wurde nicht nachgewiesen. In 7 Tage alten Embryos betrug der Gehalt an Thiamin 875 ± 228 ng/g Tr. M und an Thiamindiphosphat 5519 ± 1247 ng/g Trockenmasse. Thiaminmonophosphat wurde ebenfalls mit einem Gehalt von 367 ± 163 ng/g Tr. M. gefunden. Es wurde somit belegt, dass Thiaminphosphate nicht im Eigelb nativer oder embryonierter Eier vorhanden sind und erst während der Embryogenese im Embryo gebildet werden. In einer weiteren Versuchsreihe wurde der Mineralstoffgehalt in nativen, embryonierten und technologisch bearbeiteten Eiern bestimmt. Für den Mineralstoffgehalt in Fraktionen nativen Eigelbs lagen nur wenige Literaturdaten vor, die Bestimmung in embryonierten Eiern dagegen erfolgte erstmalig. 158 Zusammenfassung Da ein Gefriertrocknungsverfahren am Institut neu entwickelt wurde, lagen auch hierüber keine Literaturdaten vor und die Bestimmung der Mineralstoffgehalte lieferte Erkenntnisse zur Beeinflussung der Verteilung von Eisen und Kupfer in derart behandelten Proben. Native Eigelbproben wurden ebenfalls mit Ascorbinsäure, Citronensäure, Essigsäure, Weinsäure und Phospholipase A2 versetzt und der Kupfer- und Eisengehalt im Plasma bestimmt. Für die Verteilung von Kupfer und Zink in Plasma und Granula nativer unbehandelter Eier konnte nur eine Quelle gefunden werden, so dass die in dieser Arbeit ermittelten Werte zum Vergleich älterer Daten herangezogen können. Der in der Literatur angegebene Kupfergehalt für Plasma und Granula nativen Eigelbs scheint, aufgrund der neu gewonnenen Erkenntnisse, nicht dem tatsächlichen Gehalt zu entsprechen. Es konnte für einige Mineralstoffe in Plasma und Granula embryonierter Eier eine höhere Konzentration als in nativen Eiern festgestellt werden. In den Granula embryonierter Eier waren der Magnesiumgehalt mit 1500 ± 280 µg/g Tr. M. hochsignifikant erhöht und der Eisengehalt mit 410 ± 60 µg/g Tr. M. hochsignifikant erniedrigt. Im Plasma embryonierter Eier war der Calciumgehalt mit 290 ± 90 µg/g Tr. M. signifikant und der Magnesiumgehalt mit 48,8 ± 4,7 µg/g Tr. M., der Eisengehalt mit 20,3 ± 8,4 µg/g Tr. M und der Zinkgehalt mit 2,24 ± 0,7 µg/g Tr. M hochsignifikant erhöht. Ein extraembryonaler Granulaabbau, der zu einem erhöhten Mineralstoffgehalt im Plasma führen könnte, konnte in elektronenmikroskopischen Aufnahmen nicht bestätigt werden. Die Granula aus Eigelb nativer und embryonierter Eier unterschied sich kaum und Auflösungserscheinungen waren nicht zu erkennen. In einer weiteren Versuchsanordnung wurde der Mineralstoffgehalt im Plasma mit Zusätzen versehener und anschließend gefriergetrockneter Eigelbproben bestimmt. In den Proben mit 2 % Essigsäure war der Kupfer- und Eisengehalt und in denen mit 0,75 % Phospholipase A2 der Eisengehalt signifikant erhöht. 159 Zusammenfassung Der Kupfergehalt im Plasma von mit Citronensäure, Weinsäure und Phospholipase A2 versetzten Proben wich hochsignifikant von den Proben ohne Zusatz ab. Der Kupfergehalt in den Citronensäureproben war 6-mal höher und in den Weinsäureproben 7-mal höher, als im Plasma nativen Eigelbs. Der Gehalt in den Essigsäureproben war signifikant erhöht, der in den Ascorbinsäureproben dagegen nicht. Der Eisengehalt im Plasma der mit Ascorbinsäure, Citronensäure, Essigsäure und Weinsäure versetzten Proben war hochsignifikant erhöht. Der Gehalt der Ascorbinsäureproben war 10-mal höher, der in den Citronensäureproben 5-mal höher, der in den Essigsäureproben 2 mal höher und der in den Weinsäureproben 4 mal höher als im Plasma nativer Eigelbproben. Es konnte gezeigt werden, dass einige Zusätze den Kupfer- und Eisengehalt im Plasma vom Eigelb verändern. 160 Summary 7. SUMMARY Sarina Bäckermann Analyses of the distribution selected cations in plasma and granules of native, embryonated and technologically processed egg yolk In this dissertation the cations magnesium, calcium, iron, copper and zinc, as well as thiamin and thiaminphosphates were analysed. For the simultaneous determination of thiamin and the thiaminphosphates a new solid phase extraction and HPLC method was developed. For solid phase extraction retention of thiamin was achieved on a C-18 cartridge and of thiaminphosphates on a SAX (strong-anion-exchange) cartridge, which were closely connected. With this method a separation of thiamin and thiaminphosphates from the other egg components was achieved and therefore selectivity of the following HPLC analysis optimized. For the new HPLC method a C-8 column was connected to a NH2 column, so the derivated thiamin was held on the first column and the derivated thiaminphosphates on the latter. With gradient elution thiamin and thiaminphosphates, including thiamintriphosphat, were separated completely from each other. Due to the prior solid phase extraction no interfering peaks were present. The limit of detection was 0,3 ng/mL for thiamin, 0,5 ng/mL for thiaminmonophosphate and 0,9 ng/mL for thiamindiphosphate. In plasma and granules of egg yolk the content of thiamin and thiaminphosphat was determined. In plasma and granules of native eggs as well as in 5 days embryonated eggs no thiaminphosphates could be detected. Only thiamin was 161 Summary present in plasma and granules. The relation in plasma and granules was 2:1. The thiamin content in plasma of native eggs was 3431 ± 698 ng/g dry mass and in granules 1522 ± 135 ng/g dry mass. In plasma of 5 days embryonated eggs thiamin content was 4377 ± 1074 ng/g dry mass and in granules 2132 ± 450 ng/g dry mass. The thiamin content of 5 and 7 day old embryos was also analysed. In contrary to the findings in plasma and granules of native and embryonated eggs thiaminphosphates as well as thiamin were found in embryos. Thiamin content in 5 day old embryos was 1236 ± 441 ng/g dry mass and thiamindiphosphat content was 7924 ± 963 ng/g dry mass. Thiaminmonophosphate was not detected. In 7 day old embryos thiamin content was 875 ± 228 ng/g dry matter and thiamindiphosphat content was 5519 ± 1247 ng/g dry matter. Thiaminphosphat was also present with 367 ± 163 ng/g dry matter. No thiamintriphosphat was detected. It could be demonstrated that thiaminphosphates are not present in plasma and granules of native and embryonated eggs and that they are synthesized by the embryo during embryogenesis. In another experimental series the mineral content in native, embryonated and technologically treated egg yolk was studied. For the distribution of iron, copper and zinc in plasma and granules in egg yolk only few references could be found. Only one for copper and zinc was found, so the presented data in this work could be used for comparison with older references. For copper we found different concentrations in plasma and granules and there are reasons to believe that older references may not be accurate. Apparently determination of minerals in plasma and granules of embryonated eggs has not performed in the past. For minerals in plasma and granules of embryonated eggs higher concentrations were found than in native eggs. Magnesium content in granules of embryonated eggs was 1500 ± 280 µg/g dry matter and the iron content 410 ± 60 µg/g dry 162 Summary matter and therefore highly significantly higher for magnesium and lower for iron. In plasma of embryonated eggs calcium content was 290 ± 90 µg/g dry matter and magnesium contend was 48,8 ± 4,7 µg/g dry matter both significantly higher. The iron content was 20,3 ± 8,4 µg/g dry matter and the zinc content was 2,24 ± 0,7 µg/g dry matter, both highly significantly higher. A degradation of granules could be an explanation for the raised mineral content but could not be confirmed in electron micrographs of granules of native and embryonated eggs. In another experimental series the variation in mineral content in plasma of eggs which were treated with additives and freeze dried was determined. As the freeze drying method was newly invented, the analysis of mineral distribution provided new information to which extent this method affected mineral contents in plasma and granules. The mineral content in plasma and granules of native egg yolk which was treated with ascorbic acid, citric acid, acetic acid, tartaric acid and phospholipase A2, was also determined. In samples with addives which were freeze dried iron and copper content in plasma of samples with acetic acid and iron content in samples with phospholipase A2 was significantly higher. The release of minerals due to food additives in native egg yolk could be demonstrated: It was found that copper contend increased highly significantly in samples which were treated with citric acid, tartaric acid and phospholipase A2. The content for citric acid was 6 times higher and for tartaric acid 7 times higher than in plasma of native egg yolk. The copper contend in samples with acetic acid was significantly higher. The samples with ascorbic acid showed no different copper contend. The iron content in plasma of samples with ascorbic acid, citric acid, acetic acid and tartaric acid was highly significantly higher. For ascorbic acid the content was 10 times higher, for citric acid 5 times higher, for acetic acid 2 times higher and for tartaric acid 4 times higher than in plasma of native egg yolk. 163 Summary It could be shown that several food additives alter the copper and iron content in plasma of egg yolk. 164 Anhang 8. ANHANG 8.1 CHEMIKALIENVERZEICHNIS Bezeichnung Summenformel Reinheit Bezugsquelle Acetonitril CH3CN für UV Analyse Ascorbinsäure C6H8O6 p.a. puriss. >99% Bromcyan BrCN Fisher Scientific GmbH, Schwerte, Deutschland Fluka (Sigma- Aldrich Laborchemikalien GmbH), Seelze, Deutschland Sigma- Aldrich Laborchemikalien GmbH, Seelze, Deutschland CitronensäureMonohydrat Dikaliumhydrogenphosphat C6H8O7 x H2O p.a. >99,5% ACS ISO K2HPO4 p.a.; >99% Essigsäure 100%ig C2H4O2 p.a. >99,8% Kaliumchlorid KCl p.a. >99,5% Kaliumdihydrogenphosphat KH2PO4 p.a.; >99% ACS Carl Roth GmbH & Co KG, Karlsruhe, Deutschland Merck KGaA, Darmstadt, Deutschland Carl Roth GmbH & Co KG, Karlsruhe, Deutschland Merck KGaA, Darmstadt, Deutschland Palladium MatrixModifier Pd(NO3)2 x 2H2O Carl Roth GmbH & Co KG, Karlsruhe, Deutschland Fluka (Sigma- Aldrich p.a. puriss. Laborchemikalien GmbH), >99% Seelze, Deutschland AppliChem GmbH, Darmstadt, p.a. >99% Deutschland für HPLC ACROS organics (Thermo Gradientenan Fisher Scientific Inc.) Geel, alyse Belgium Merck KGaA, Darmstadt, p.a. 99% ISO Deutschland Fluka (Sigma- Aldrich Laborchemikalien GmbH), p.a. puriss. Seelze, Deutschland Perchlorsäure 70%ig HClO4 suprapur Salpetersäure 65%ig HNO3 suprapur Merck KGaA, Darmstadt, Deutschland Merck KGaA, Darmstadt, Deutschland Salpetersäure 65%ig HNO3 p.a. ISO Carl Roth GmbH & Co KG, Karlsruhe, Deutschland Lanthanchlorid MagnesiumnitratHexahydrat LaCl3 Methanol NatriumhydroxidPlättchen CH3OH Mg(NO3)2 x 6H2O NaOH 165 Anhang Merck KGaA, Darmstadt, Deutschland Salzsäure 25%ig HCl Seesand SiO2 p.a. p.a. gereinigt, geglüht Thiamindiphosphat Thiaminchloridhydrochlorid C12H18ClN4O7P2 S > 95 % BioChemika (AppliChem GmbH), Darmstadt, Deutschland C12H18Cl2N4OS > 99 % Merck KGaA, Darmstadt, Deutschland C12H18ClN4O4P S > 99 % Sigma- Aldrich Laborchemikalien GmbH, Seelze, Deutschland C12H18ClN4O10P3 S CaCl2 in 6,5%iger HCl FeCl3 in 15%iger HCl > 99 % Wako Chemicals GmbH, Neuss, Germany; www.wako-chemicals.de für G-AAS VWR International GmbH, Darmstadt, Deutschland für G-AAS VWR International GmbH, Darmstadt, Deutschland Thiaminmonophosphat Thiamintriphosphat Titrisol Calcium Standard Titrisol Eisen Standard Titrisol Kupfer Standard CuCl2 in H2O ZnCl2 in 0,06% iger Titrisol Zink Standard HCl Trichloressigsäure CCl3COOH tridestilliertes Wasser (Umkehrosmose MilliQ Wasser) Triton X-100 t- Octylphenoxypolyethoxyethanol Weinsäure C4H6O6 Carl Roth GmbH & Co KG, Karlsruhe, Deutschland für G-AAS VWR International GmbH, Darmstadt, Deutschland für G-AAS Merck KGaA, Darmstadt, Deutschland p.a. > 99% Carl Roth GmbH & Co KG, Karlsruhe, Deutschland > 18MOhm Millipore, Massachusetts, USA für G-AAS p. a. 166 Sigma- Aldrich Laborchemikalien GmbH, Seelze, Deutschland Riedel de Haen (Sigma-Aldrich Laborchemikalien GmbH), Seelze, Germany Anhang 8.2 GERÄTELISTE Tischzentrifuge, Hettich Universal, 1200 Zeeman-Graphitrohr-Atomabsorptionsspektrometer 4100ZL Perkin-Elmer LAS GmbH RodgauJügesheim, Deutschland LOT-Oriel GmbH & Co. KG, Darmstadt, Deutschland G. Kern & Sohn GmbH, Albstadt, Deutschland Merck KGaA, Darmstadt, Deutschland Macherey-Nagel GmbH & Co. KG, Düren, Deutschland Supelco, Sigma-Aldrich Chemie GmbH, München, Deutschland Philips GmbH, Hamburg, Deutschland Perkin-Elmer LAS GmbH RodgauJügesheim, Deutschland Dr. Ing. H. Knauer GmbH, Berlin, Deutschland Dr. Ing. H. Knauer GmbH, Berlin, Deutschland Dr. Ing. H. Knauer GmbH, Berlin, Deutschland Alltech-Grom GmbH, RottenburgHailfingen, Deutschland Dr. Ing. H. Knauer GmbH, Berlin, Deutschland Dr. Ing. H. Knauer GmbH, Berlin, Deutschland Dr. Ing. H. Knauer GmbH, Berlin, Deutschland Varian Deutschland GmbH, Darmstadt, Deutschland Siemens Aktiengesellschaft, München, Deutschland Janke-Kunkel GmbH & Co. KG-IKA, Labortechnik, Staufen, Breisgau Andreas Hettich GmbH & Co KG, Tuttlingen, Deutschland Perkin-Elmer LAS GmbH RodgauJügesheim, Deutschland Zentrifuge, 3200 Eppendorf Eppendorf Vertrieb Deutschland GmbH, Wesseling-Berzdorf, Deutschland Autosampler AS70 Einelementlampen Feinwaage Kern 770 Festphase, LiChrolut Festphasensäulen, Chromabond C-18 ec Festphasensäulen, Discovery DSC SAX Flammen-Atomabsorptionsspektrometer PU9100x Fluoreszenzdetektor LC 240 HPLC-Vorsäule Eurospher-100, C-8 30 mm x 4,6 mm HPLC-Säule Eurospher-100, C-8, 250 x 4 mm, 5 µm Ø HPLC-Säule LiChrospher-100, NH2, 250 x 4 mm, 5 µm Ø HPLC-Säule Grom Saphir 110 NH2, 150 x 4 mm, 5 µm Ø HPLC-Mischkammer HPLC-Probenschleife HPLC-Pumpen Modell 64 ICP-OES, vista pro Schreiber, Kompensograph III Stabrührer, Ultra Turrax, TP 18-10, 167 Abkürzungsverzeichnis 9. ABKÜRZUNGSVERZEICHNIS AAS ATP BG bzw. DGE DNA EDTA EG engl. F.S. FEP HDL HPLC ICP-OES L LDL n/a NADH NG PE PFA PLA PMP PP PTFE PvLv RNA RZB SAX SPF T TDP TMP Tr. M. TTP VLDL Atomabsorptionsspektrometrie Adenosintriphosphat Bestimmungsgrenze beziehungsweise Deutsche Gesellschaft für Ernährung Desoxyribonukleinsäure Ethylendiamintetraessigsäure Erfassungsgrenze englisch Feuchtsubstanz Copolymer aus Hexaflourpropylen und Tetraflourethylen engl. = high density lipoprotein = Lipoprotein hoher Dichte engl. = High pressure liquid chromatography = Hochdruckflüssigchromatographie engl. = inductively coupled plasma optical emission spectrometry = induktiv gekoppelte plasma optische Emissionsspetrometrie Lipovitellin engl. Low density lipoprotein = Lipoprotein geringer Dichte nicht angegeben Nicotinamid-Adenin-Dinucleotid-Wasserstoff Nachweisgrenze Polyethylen Perflouralkoxy-Polymere Phospholipase Polymethylpenten Polypropylen Polytetrafluorethylene Phosvitin-Lipovitellin-Komplex Ribonukleinsäure Relative Zentrifugationsbeschleunigung engl.: strong anion exchanger = starker anionen Austauscher spezifisch pathogenfrei Thiamin Thiamindiphosphat Thiaminmonophosphat Trockenmasse Thiamintriphosphat engl. Very low density lipoprotein = Lipoprotein sehr geringer Dichte 168 Tabellenverzeichnis 10. TABELLENVERZEICHNIS Tabelle 1: Zusammensetzung des Eigelbs Tabelle 2: Gehalt und Schwankung einiger Mineralstoffe im Ei Tabelle 3: Gehalt, Verteilung und Dialysierbarkeit der Mineralstoffe in Eigelbfraktionen Tabelle 4: Mineralstoffgehalt im gesamten Ei Tabelle 5: Mineralstoffgehalt im Eigelb Tabelle 6: Mineralstoffgehalt im Eiklar Tabelle 7: Calciumgehalt im Ei Tabelle 8: Verteilung und Dialysierbarkeit der Calciumionen im Ei Tabelle 9: Magnesiumgehalt im Ei Tabelle 10: Magnesiumgehalt in Eigelbfraktionen Tabelle 11: Verteilung und Dialysierbarkeit der Magnesiumionen im Ei Tabelle 12: Absoluter Spurenelementgehalt im Ei Tabelle 13: Eisengehalt im Ei Tabelle 14: Eisengehalt in Eigelbfraktionen Tabelle 15: Verteilung und Dialysierbarkeit der Eisenionen im Ei Tabelle 16: Kupfergehalt in Eigelbfraktionen Tabelle 17: Zinkgehalt im Ei Tabelle 18: Zinkgehalt in Eigelbfraktionen Tabelle 19: Enzyme mit Thiaminpyrophosphat Tabelle 20: Zusammensetzung der Proben zur Mineralstoffbestimmung Tabelle 21: Proben für die Thiaminanalytik Tabelle 22: Gradientensystem Tabelle 23: Analysenplan für die Mineralstoffbestimmung mit F-AAS und G-AAS 169 Tabellenverzeichnis Tabelle 24: Analysenplan für die Mineralstoffbestimmung mit G-AAS und ICP-OES Tabelle 25: Kalibrierlösungen für die Calciumbestimmung in Granulaproben Tabelle 26: Kalibrierlösungen für die Calciumbestimmung in Plasmaproben Tabelle 27: Kalibrierlösungen für die Calciumbestimmung in Eiklarproben Tabelle 28: Kalibrierlösungen für die Magnesiumbestimmung in Granulaproben Tabelle 29: Kalibrierlösungen für die Magnesiumbestimmung in Plasmaproben Tabelle 30: Kalibrierlösungen für die Magnesiumbestimmung in Eiklarproben Tabelle 31: Kalibrierlösungen für die Eisenbestimmung in Granulaproben Tabelle 32: Standardaddition der Granulaproben für die Zinkbestimmung Tabelle 33: Standardaddition der Plasmaproben für die Zinkbestimmung Tabelle 34: Standardaddition der Eiklarproben für die Zinkbestimmung Tabelle 35: Standardaddition der gefriergetrockneten Plasmaproben Tabelle 36: Standardaddition der Proben A1-A3, C1-C3, E1-E3, W1-W3 Tabelle 37: Standardaddition der Proben AC und EW Tabelle 38: Zusammensetzung der Lösungen für die Kupferbestimmung Tabelle 39: Zusammensetzung der Lösungen für die Eisenbestimmung Tabelle 40: Analysenplan der mit ICP-OES gemessenen Proben Tabelle 41: Thiamingehalt der Eigelbfraktionen im Nativei Tabelle 42: Thiamingehalt in den Fraktionen embryonierter Eier Tabelle 43: Signifikanztest zum Thiamingehalt in Plasma und Granula Tabelle 44: Thiamingehalte in Proben der 5 und 7 Tage alten Embryos Tabelle 45: Thiamingehalte in 5 und 7 Tage alten Embryos Tabelle 46: Wiederfindungsrate Tabelle 47: Nachweis-, Erfassungs- und Bestimmungsgrenze Tabelle 48: Trockenmassebestimmung 170 Tabellenverzeichnis Tabelle 49: Mineralstoffgehalt in Granula nativer Eier und von Bruteiern Tabelle 50: Signifikanztest der Mineralstoffgehalte in den Granula Tabelle 51: Mineralstoffgehalt im Plasma nativer Eier und von Bruteiern Tabelle 52: Signifikanztest der Mineralstoffgehalte im Plasma Tabelle 53: Kupfergehalt in gefriergetrockneten Plasmaproben Tabelle 54: Signifikanztest der Erhöhung des Kupfergehaltes Tabelle 55: Kupfergehalt im Plasma der Nativeiproben mit und ohne Zusätzen Tabelle 56: Signifikanztest der Erhöhung des Kupfergehaltes Tabelle 57: pH-Werte der Proben mit Zusätzen Tabelle 58: Eisengehalt in gefriergetrockneten Plasmaproben Tabelle 59: Signifikanztest der Erhöhung des Eisengehaltes Tabelle 60: Eisengehalt im Plasma der Nativeiproben mit und ohne Zusatz Tabelle 61: Signifikanztest der Erhöhung des Eisengehaltes Tabelle 62: Nachweis-, Erfassungs- und Bestimmungsgrenze verschiedener Autoren 171 Abb. Verzeichnis 11. ABB. VERZEICHNIS Abbildung 1: Schematischer Aufbau des Eies nach Schnorr (Schnorr, 1996) mit Änderungen nach Ternes (Ternes et al., 1994) Abbildung 2: Schematische Darstellung der Eigelbpartikel Abbildung 3: Schematische Aufbau eines Embryo am 10 bis 11 Bebrütungstag (Schnorr, 1996) Abbildung 4: Thiamin und Thiaminphosphate Abbildung 5: Thiochrom-Reaktion Abbildung 7: Auftrennung der Reinsubstanzen Abbildung 8: Auftrennung des Nativeiplasmas Abbildung 9: Autftrennung der Nativeigranula Abbildung 10: Auftrennung des Bruteiplasma Abbildung 11: Auftrennung der Bruteigranula Abbildung 12: Thiamingehalt in Nativeiern und Bruteiern Abbildung 13: Auftrennung der Reinsubstanzen Abbildung 14: Chromatogramm der Probe 5 Tage alter Embryos Abbildung 15: Chromatogramm der Probe 7 Tage alter Embryos Abbildung 16: Kupfergehalt in gefriergetrockneten Proben mit und ohne Zusatz Abbildung 17: Kupfergehalte der Ascorbinsäureproben im Vergleich zu Proben ohne Zusatz Abbildung 18: Kupfergehalte der Citronensäureproben im Vergleich zu Proben ohne Zusatz Abbildung 19: Kupfergehalte der Essigsäureproben im Vergleich zu Proben ohne Zusatz Abbildung 20: Kupfergehalte der Weinsäureproben im Vergleich zu Proben ohne Zusatz Abbildung 21: Kupfergehalt der Phospholipaseproben im Vergleich zu Proben ohne Zusatz 172 Abb. Verzeichnis Abbildung 22: Eisengehalt in gefriergetrockneten Proben mit und ohne Zusatz Abbildung 23: Eisengehalte der Ascorbinsäureproben im Vergleich zu Proben ohne Zusatz Abbildung 24: Eisengehalte der Citronensäureproben im Vergleich zu Proben ohne Zusatz Abbildung 25: Eisengehalte der Essigsäureproben im Vergleich zu Proben ohne Zusatz Abbildung 26: Eisengehalte der Weinsäureproben im Vergleich zu Proben ohne Zusatz Abbildung 27: Eisengehalt der Phospholipaseproben im Vergleich zu Proben ohne Zusatz Abbildung 28: Granula aus dem Eigelb nativer Eier Abbildung 29: Granula aus dem Eigelb 5 Tage embryonierter Eier 173 Lit. Verzeichnis 12. LIT. VERZEICHNIS ABDEL-KADER, Z. M. (1992). Comparison of AOAC and high- performance liquid chromatographic methods for thiamin determination in foods. Food Chem. 43:393-397. ALBRIGHT, K. J., D. T. GORDON, und O. J. COTTERILL. (1984). Release of Iron from Phosvitin by Heat and Food-Additives. J. Food Sci. 49:78-81. ALYABIS, A. M. und K. L. SIMPSON. (1993). Comparison of reverse- phase c-18 open column with the bio- rex 70 column in the determination of thiamin. J. Food Compos. Anal. 6:166-171. ARIAEY-NEJAD, M. R., M. BALAGHI, E. M. BAKER, und H. E. SAUBERLICH. (1970). Thiamin Metabolism in Man. Am. J. Clin. Nutr. 23:764-778. BAINES, M. (1985). Improved high performance liquid chromatographic determination of thiamin diphosphate in erythrocytes. Clin. Chim. Acta 153:43-48. BALL, G. F. M. (2004). Thiamin (Vitamin B1). in Vitamins- Their Role in the Human Body. Blackwell, Science. 274-288 BATIFOULIER, F., M. A. VERNY, C. BESSON, C. DEMIGNE, und C. REMESY. (2005). Determination of thiamine and its phosphate esters in rat tissues analyzed as thiochromes on a RP-amide C16 column. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 816:67-72. BELLAIRS, R. (1958). The conversion of yolk into cytoplasm in the chick blastoderm as shown by electron microscopy. J. Embryol. Exp. Morphol. 6:129-161. BELLAIRS, R. (1961). The structure of the yolk of the hen's egg as studied by electron microscopy. I. The yolk of the unincubated egg. J. Biophys. Biochem. Cytol. 11:207-225. BERG, G. G. und J. SZEKERCZES. (1962). Trimetaphosphatase in Developing Chick. J. Exp. Zool. 149:147-152. 174 Lit. Verzeichnis BETTENDORFF, L., C. GRUNDFILS, R. C. DE, und E. SCHOFFENIELS. (1986). Determination of thiamine and its phosphate esters in human blood serum at femtomole levels. J. Chromatogr. 382:297-302. BETTENDORFF, L., M. PEETERS, C. JOUAN, P. WINS, und E. SCHOFFENIELS. (1991). Determination of Thiamin and Its Phosphate-Esters in Cultured Neurons and Astrocytes Using An Ion-Pair Reversed-Phase High-Performance Liquid-Chromatographic Method. Anal. Biochem. 198:52-59. BETTENDORFF, L., P. WINS, und E. SCHOFFENIELS. (1990). Regulation of ion uptake in membrane vesicles from rat brain by thiamine compounds. Biochem. Biophys. Res. Commun. 171:1137-1144. BIAGI, - (1964). Proteins of the high density fraction of the fluid and granules of yolk during embryogenesis. Biochim. Biophys. Acta 93:421-422. BICKARDT, K. (1992). Kompendium der allgemeinen inneren Medizin und Pathophysiologie für Tierärzte. Parey, Berlin. BITSCH, R. (1997). Vitamin B1. in H. K. BIESALSKI, J. SCHREZENMEIR, P. WEBER, und H. WEISS, (Hrsg.). Vitamine Physiologie, Pathophysiologie, Therapie. 67-73 Georg Thieme Verlag, Stuttgart, New York. BJOERN-RASMUSSEN, E. und L. HALLBERG. (1979). Effect of Animal Proteins on Iron Absorption of Food in Man. Nutr.Metabol. 23; 192-202 BONTEMPS, J., L. BETTENDORFF, J. LOMBET, C. GRUNDFILS, G. DANDRIFOSSE, E. SCHOFFENIELS, F. NEVEJANS, und J. CROMMEN. (1984a). Poly(Styrene Divinylbenzene) As Reversed-Phase Adsorbent for the High-Performance Liquid-Chromatographic Analysis of Thiochrome Derivatives of Thiamine and Phosphorylated Esters. J. Chromatogr. 295:486-491. BONTEMPS, J., P. PHILIPPE, L. BETTENDORFF, J. LOMBET, G. DANDRIFOSSE, E. SCHOFFENIELS, und J. CROMMEN. (1984b). Determination of thiamine and thiamine phosphates in excitable tissues as thiochrome derivatives by reversed-phase high-performance liquid chromatography on octadecyl silica. J. Chromatogr. 307:283-294. BOTTICHER, B. und D. BOTTICHER. (1986). Simple rapid determination of thiamin by a HPLC method in foods, body fluids, urine and faeces. Int. J. Vitam. Nutr. Res. 56:155-159. 175 Lit. Verzeichnis BRUNNEKREEFT, J. W., H. EIDHOF, und J. GERRITS. (1989). Optimized determination of thiochrome derivatives of thiamine and thiamine phosphates in whole blood by reversed-phase liquid chromatography with precolumn derivatization. J. Chromatogr. 491:89-96. BURCH, H. B., O. A. BESSEY, R. H. LOVE, und O. H. LOWRY. (1952). The Determination of Thiamine and Thiamine Phosphates in Small Quantities of Blood and Blood Cells. J.Biol. Chem. 198:477-490. BURLEY, R. W. und D. V. VADEHRA.(Hrsg.) (1989). The Avian Egg - Chemistry and Biology. John Wiley, New York. CALLENDER, S. T., S. R. MARNEY, und G. T. WARNER. (1970). Eggs and iron absoprtion. Br. J. Haematol. 19;6:657-665 CASTELLANI, O., C. GUERIN-DUBIARD, E. VID-BRIAND, und M. ANTON. (2004). Influence of physicochemical conditions and technological treatments on the iron binding capacity of egg yolk phosvitin. Food Chem. 85:569-577. CAUSERET, D., E. MATRINGE, und D. LORIENT. (1991). Ionic-Strength and Ph Effects on Composition and Microstructure of Yolk Granules. J. Food Sci. 56:1532-1536. CAUSERET, D., E. MATRINGE, und D. LORIENT. (1992). Mineral Cations Affect Microstructure of Egg Yolk Granules. J. Food Sci. 57:1323-1326. CHANG, C. M., W. D. POWRIE, und O. FENNEMA. (1977b). Studies on the Gelation of Egg Yolk and Plasma upon Freezing and Thawing. J. Food Sci 42:1658-1165 . CHANG, C. M., W. D. POWRIE, und O. FENNEMA. (1977a). Microstructure of Egg-Yolk. J. Food Sci. 42:1193-1200. CHASE, G. W., W. O. LUNDEN, Jr., A. G. SOLIMAN, und R. R. EITENMILLER. (1993). Method modification for liquid chromatographic determination of thiamine, riboflavin, and pyridoxine in medical foods. J. AOAC Int. 76:1276-1280. COTTERILL, O. J., W. W. MARION, und E. C. NABER. (1977). A nutrient re-evaluation of shell eggs. Poult. Sci. 56:1927-1934. 176 Lit. Verzeichnis DEGUISEPPE, L. und G. RINDI. (1958). Chromatographic Separation and Determination of Thiamine and Thiamine Phosphoric Esters on Ion-ExCHANGe Resins. J. Chromatogr. 1:545-551. DEWAR, W. A., P. W. TEAGUE, und J. N. DOWNIE. (1974). The transfer of minerals from the egg to the chick embryo from the 5th to 18th days of incubation. Br. Poult. Sci. 15:119-129. DUNN, B. E. und M. A. BOONE. (1977). Growth and mineral content of cultured chick embryos. Poult. Sci. 56:662-672. EGI, Y. und T. KAWASAKI. (2003). Thiamin - Properties and Determination. in B. CABALLERO, (Hrsg..) Encyclopedia of food sciences and nutrition 5767-5780. Academic Press, Amsterdam. EICHENBAUM, J. W. und J. R. Cooper. (1971). Restoration by thiamine of the action potential in ultraviolet irradiated nerves. Brain Res. 32:258-260. EISENBRAND, G.(Hrsg.) (2006). Römpp Online. www.roempp.com Online. ELMADFA, I; D. FRITZSCHE (Hrsg.) (1985). Die große Vitamin- und Mineralstoff- Tabelle. Die Vitamine und Mineralstoffe unserer Lebensmittel. Gräfe, Unzer, München. ENGELHARDT, W. v. und G. BREVES. (Hrsg.) (2000). Physiologie der Haustiere. Enke im Hippokrates Verlag, Stuttgart. FAYOL, V. (1997). High-performance liquid chromatography determination of total thiamin in biological and food products. Methods Enzymol. 279:57-66. FOX, J. M. und W. DUPPEL. (1975). The action of thiamine and its di- and triphosphates on the slow exponential decline of the ionic currents in the node of Ranvier. Brain Res. 89:287-302. FREEMAN, B. M. und M. A. Vince. (1974). Development of the avian embryo. John Wiley, New York. GARLAND, T. D. und W. D. POWRIE. (1978). Isolation of Myelin Figures and Low- Density Lipoproteins from Egg Yolk Granules. J. Food Sci. 43:592-597. 177 Lit. Verzeichnis GECKELER, K. E.; (Hrsg.) (1998). Bioanalytische und biochemische Labormethoden. Vieweg Verlagsgesellschaft, Braunschweig/Wiesbaden. GENNARO, M. C. (1991). Separation of water soluble vitamins by reversed- phase ion- interaction- reagent highperformance liquid chromatography: Application to multivitamin pharmaceuticals. J. Chromatogr. Sci. 29:410-415. GERRITS, J., H. EIDHOF, J. W. BRUNNEKREEFT, und J. HESSELS. (1997). Determination of thiamin and thiamin phosphates in whole blood by reversed-phase liquid chromatography with precolumn derivatization. Methods Enzymol. 279:74-82. GLASER, O. und E. PIEHLER. (1934). The mobilization of calcium during development. Biol. Bull. Wood`s Hole 66:351-356. GOTTWALD, W. (Hrsg.) (2004). Statistik für Anwender. Wiley-VCH, Weinheim. GRAU, C. R. (1976). Ring Structure of Avian Egg-Yolk. Poult. Sci. 55:1418-1422. GRAU, C. R. und T. E. ROUDYBUSH. (1979b). Mineral composition of yolk fractions and whole yolk from eggs of restricted ovulator hens. Poult. Sci. 58:1143-1148. GRAU, C. R. und T. E. ROUDYBUSH. (1979a). Mineral Composition of Yolk Fractions and Whole Yolk from Eggs of Restricted Ovulator Hens. Poult. Sci. 58:1143-1148. GREENGARD., O., A. SENTENAC., und N. MENDELSOHN. (1964) Phosvitin the iron carrier of egg yolk. Biochim. Biophys. Acta 90:406-407. GROGAN, J. und G. TABORSKY. (1986). Iron binding by phosvitin: variation of rate of iron release as a function of the degree of saturation of iron binding sites. J. Inorg. Biochem. 26:237-246. GUERRERO, A., J. A. CARMONA, I. MARTINEZ, F. CORDOBES, und P. PARTAL. (2004). Effect of pH and added electrolytes on the thermal- induced transitions of egg yolk. Rheol Acta 43:539-549. 178 Lit. Verzeichnis HASIAK, R. J., D. V. VADEHRA, R. C. BAKER und L. HOOD. (1972). Effect of certain physical and chemical treatments on the microstructure of egg yolk. J. Food Sci.913-917. HERVE, C., P. BEYNE, und E. DELACOUX. (1994). Determination of Thiamine and Its Phosphate-Esters in Human Erythrocytes by HighPerformance Liquid-Chromatography with Isocratic Elution. J. Chromatogr. B-Biomed. Appli. 653:217-220. HISIL, Y. und S. ÖTLES. (1997). Changes of Vitamin B1 Concentrations during Storage of Hen Eggs. Lebensm.-Wiss.u.Technol.30:320-323 ICHINOSE, N. und M. MITSUI. (1988). Fluorescence High-Performance Liquid-Chromatography of Trace Microamounts of Phosphate by Oxidation of Thiamine to Thiochrome. Fresenius’ J. Anal. Chem. 330:634-636. ISHII, K., K. SARAI, H. SANEMORI, und T. KAWASAKI. (1979). Analysis of thiamine and its phosphate esters by high-performance liquid chromatography. Anal. Biochem. 97:191-195. IWATA, H., T. MATSUDA, und H. TONOMURA. (1988). Improved high-performance liquid chromatographic determination of thiamine and its phosphate esters in animal tissues. J. Chromatogr. 450:317-323. JACOBSEN, C., J. DLER-NISSEN, und A. S. MEYER. (1999). Effect of ascorbic acid on iron release from the emulsifier interface and on the oxidative flavor deterioration in fish oil enriched mayonnaise. J. Agric. Food Chem. 47:4917-4926. JACOBSEN, C., M. TIMM, und A. S. MEYER. (2001). Oxidation in fish oil enriched mayonnaise: ascorbic acid and low pH increase oxidative deterioration. J. Agric. Food Chem. 49:3947-3956. JOHNSTON, P. M. und C. L. COMAR (1955). Distribution and contribution of calcium from the albumen, yolk and shell to the developing chick embryo. Am. J. Physiol 183:365-370. JUURLINK, B. H. und M. A. GIBSON. (1973). Histogenesis of the yolk sac in the chick. Can. J. Zool. 51:509-519. KAWASAKI, T. und Y. EGI. (2000a). Thiamine. in LEENHEER, A. P (Hrsg.) Modern chromatographic analysis of the vitamins. 365-389 179 Lit. Verzeichnis KIM, H.-S., D.-K. JANG, D.-K. WOO, und K.-L. WOO. (2002). Simultaneous determination of water soluble vitamins in multi nutrient tablets by RP-HPLC. J. Food Sci. Nutr. 7:12-17. KIMURA, M. und Y. ITOKAWA. (1985). Determination of Thiamine and Its Phosphate-Esters in Human and Rat-Blood by HighPerformance Liquid-Chromatography with Post-Column Derivatization. J. Chromatogr. 332:181-188. KIMURA, M. und Y. ITOKAWA. (1983). Determination of Thiamin and Thiamin Phosphate-Esters in Blood by LiquidChromatography with Post-Column Derivatization. Clin. Chem. 29:2073-2075. LAMBSON, R. O. (1970). An electron microscopic study of the entodermal cells of the yolk sac of the chick during incubation and after hatching. Am. J. Anat. 129:1-19. LASCHI-LOQUERI, A., S. VALLAS, J. VIOLLET, M. LECLERCQ, und V. FAYOL. (1992). High performance liquid chromatographic determination of total thiamine in biological and food products. Int. J. Vitam. Nutr. Res. 62:248-251. LEESON, S. und L. J. CASTON. (2003). Vitamin enrichment of eggs. J. Appl. Poult. Res. 12:24-26. LEHNINGER, A. L., D. L. NELSON, und M. M. COX. (Hrsg.) (1998). Prinzipien der Biochemie. 2. Aufl., Studienausg. Spektrum Akad. Verl. LI, L. J., H. CHENG, C. ZHAO, und X. G. HU. (2005). Determination of vitamin B-1 in pharmaceutical preparations by flow-injection analysis with biamperometric detection. Chem. Res.Chin. Univ. 21:650-653. LI, Y. und P. R. BROWN (2003). The optimization of HPLC-UV conditions for use with FTIR detection in the analysis of B vitamins. J. Chromatogr. Sci. 41:96-99. LONSDALE, D. (2006). A Review of the Biochemistry, Metabolism and Clinical Benefits of Thiamin(e) and Its Derivates. Evidence-Based Complement. Altern. Med. 3:49-59 180 Lit. Verzeichnis LOSA, R., M. I. SIERRA, A. FERNANDEZ, D. BLANCO, und J. M. BUESA. (2005). Determination of thiamine and its phosphorylated forms in human plasma, erythrocytes and urine by HPLC and fluorescence detection: a preliminary study on cancer patients. J: Pharm. Biomed. Anal. 37:1025-1029. LOTTSPEICH, L. und J. W. ENGELS (Hrsg.) (1998). Bioanalytik. Spektrum Akademischer Verlag, Heidelberg, Berlin. MANSON, J. M., K. J. PICKEN, M. H. DRAPER, und R. THOMPSON. (1993). Variation among individual White-Leghorn hens in the concentration of minerals in the albumen and yolk content of their eggs. Br. Poult. Sci. 34:899-909. MASCHER, H. J. und C. KIKUTA. (1997). High-performance liquid chromatography determination of total thiamin in human plasma. Methods Enzymol. 279:83-90. MATSUDA, T. und J. R. COOPER. (1981). The separation and determination of thiamine and its phosphate esters in brain. Anal. Biochem. 117:203-207. MATSUO, T. und Z. SUZUOKI. (1969). The Occurrence of 4- Methylthiazole-5-Acetic Acid as a Thiamine Metabolite in Rabbit, Dog, Man and Rat. J. Biochem. 65:953-960. MEYER, V. R. (Hrsg.) (1992). Praxis der Hochleistungs- Flüssigchromatographie. 7. ed. Otto Salle Verlag; Frankfurt. MINEKI, M. und M. KOBAYASHI. (1997). Microstructure of yolk from fresh eggs by improved method. J. Food Sci. 62:757-761. MIYOSHI, K., Y. EGI, T. SHIODA, und T. KAWASAKI. (1990). Evidence for in vivo synthesis of thiamin triphosphate by cytosolic adenylate kinase in chicken skeletal muscle. J. Biochem. (Tokyo) 108:267-270. MOBBS, I. G. und D. B. McMILLAN. (1979). Structure of the endodermal epithelium of the chick yolk sac during early stages of development. Am. J. Anat. 155:287-309. MOORE, C. V. (1965). Iron nutritients and requirements Ser. Haematol 6:1-14 181 Lit. Verzeichnis MORIARTY, C. M. (1973). Serum-dependent transcellular active calcium transport. Exp. Cell Res. 79:79-86. MORITA, M., T. KANAYA, und T. MINESITA. (1969). Simultaneous determination of thiamine and 2-(1-hydroxyethyl) thiamine in biological materials. J. Vitaminol. (Kyoto) 15:116-125. MORRIS, E. R. und F. E. GREENE. (1972). Utilization of the iron of egg yolk for hemoglobin formation by the growing rat. J. Nutr. 102:901-908. MUNIYAPPA, K. und P. R. ADIGA. (1981). Nature of the Thiamin-Binding Protein from Chicken Egg-Yolk. Biochem J. 193:679-685. NDWA, S., M. BERGAENTZLÉ, D. AOUDÉ-WERNER, und C. HASSELMANN. (2000). Extraction procedures for the liquid chromatographic determination of thiamin riboflavin and vitamin B6 in foodstuffs. Food Chem. 71:129-138. NIELSEN, J. H., G. H. KRISTIANSEN, und H. J. UNDERSEN. (2000). Ascorbic acid and ascorbic acid 6-palmitate induced oxidation in egg yolk dispersions. J. Agric. Food Chem. 48:1564-1568. OBERLEAS, D., B. F. HARLUND, und D. J. BOBILYA. (Hrsg.) (1999). Minerals: Nutrition and Metabolism. Vantage Press, New York. OLKOWSKI, A. A. und H. L. CLASSEN. (1999). The effects of maternal thiamine nutrition on thiamine status of the offspring in broiler chickens. Int. J. Vitam. Nutr. Res. 69:32-40. RATANAUBOLCHAI, K., J. JAREONSANTI, und B. PANIJPAN. (1981). Cyanogen-Bromide, A Good Reagent for Assay of Thiamine in Biological Extracts. Clin. Chem. 27:1777-1778. RATANAUBOLCHAI, K. und B. PANIJPAN. (1979). Cyanogen-Bromide, A Good Reagent for Assay of Thiamine in Urine. Clin. Chem. 25:1670-1671. RATANAUBOLCHAI, K., S. PIKULKARNTALERT, und B. PANIJPAN. (1980). A comparison of 3 reagents in converting thiamine to thiochrome in the presence of plant extracts and polyphenols. Experientia 36:825. RETTENMAIER, R., J. P. VUILLEUMIER, und W. MULLER-MULOT. (1979). Zur quantitativen B1 Bestimmung in Nahrungsmitteln und biologischem Material. Z. Lebensm. Unters. Forsch. 168:120-124. 182 Lit. Verzeichnis RICHARDS; M. P. (1997). Trace mineral metabolism in the avian embryo. Poult. Sci. 76:152-164. RICHARDS, M. P. und N. C. STEELE. (1987). Trace element metabolism in the developing avian embryo: a review. J. Exp. Zool. Suppl 1:39-51. RIDGWAY, L. P. und D. A. KARNOFSKY. (1952). The Effects of Metals on the Chick Embryo - Toxicity and Production of Abnormalities in Development. Ann. N Y Acad. Sci. 55:203-215. RINDI, G. und L. D. GIUSEPPE. (1961). A New Chromatographic Method for Determination of Thiamine and Its Mono-, Di- and TriPhosphates in Animal Tissues. Biochem. J. 78:602-606&. ROMANOFF, A. L. (Hrsg.) (1967). Biochemistry of the avian embryo : a quantitative analysis of prenatal development. Wiley, New York. ROSSANDER, L., L. HALLBERG, und E. BJOERN-RASMUSSEN. (1979). Absorption of iron from breakfast meals. Am. J. Clin. Nutr. 32:2484-2489 SAITO, K., Y. HAGIWARA, T. HASEGAWA, und E. OZAWA. (1982). Indispensability of Iron for the Growth of Cultured Chick Cells. Develop. Growth and Differ. 24:571-580. SANCHEZ-MACHADO, D. I., J. LOPEZ-CERVANTES, J. LOPEZ-HERNANDEZ, und P. PASEIRO-LOSADA. (2004). Simultaneous determination of thiamine and riboflavin in edible marine seaweeds by highperformance liquid chromatography. J. Chromatogr. Sci. 42:117-120. SANDER, S., A. HAHN, J. STEIN, und G. REHNER. (1991). Comparative-Studies on the High-Performance Liquid-Chromatographic Determination of Thiamine and Its Phosphate-Esters with Chloroethylthiamine As An Internal Stundard Using Precolumn and Postcolumn Derivatization Procedures. J. Chromatogr. 558:115-124. SANDERS, E. J. (1980). The Golgi body and thiamine pyrophosphatase localization in embryonic cells in culture. Exp. Cell Res. 126:458-461. SANEMORI, H., H. UEKI, und T. KAWASAKI. (1980). Reversed-phase high-performance liquid chromatographic analysis of thiamine phosphate esters at subpicomole levels. Anal. Biochem. 107:451-455. 183 Lit. Verzeichnis SASA, M., I. TAKEMOTO, und Y. ITOKAWA. (1976). The role of thiamine on exitable membrane of crayfish giant axon. J. Nutr. Sci. Vitaminol. 22 (Suppl.):21-46. SAVAGE, J. E. (1968). Trace minerals and avian reproduction. Fed. Proc. 27:927-931. SAWANO, F. und H. FUJITA. (1981). Cytochemical studies on the internal polarity of the Golgi apparatus and the relationship between this organelle and GERL. Histochem. 71:335-348. SCHLESINGER, A. B. (1958). The Structural Significance of the Avian Yolk in Embryogenesis. J. Exp. Zool. 138:223-258. SCHNORR, B. (1996). Embryologie der Haustiere. 3. ed. Enke, Stuttgart. SCHRIJVER, J., A. J. SPEEK, J. A. KLOSSE, H. J. VAN RIJN, und W. H. SCHREURS. (1982). A reliable semiautomated method for the determination of total thiamine in whole blood by the thiochrome method with high-performance liquid chromatography. Ann. Clin. Biochem. 19:52-56. SCHULZ, J. und N. J. SMITH. (1958). Quantitative Study of the Absorption of Iron Salts in Infants and Children. Ama Journal of Diseases of Children 95:120-125. SCHÜMANN, K. (2002). Kupfer. in H. K. BIESALSKI, J. KÖHRLE, und K. SCHÜMANN (Hrsg.), Vitamine, Spurenelemente und Mineralstoffe 147-151 Thieme, Stuttgart, New York. SCHÜMANN, K. und G. WEISS. (2002). Eisen. in H. K. BIESALSKI, J. KÖHRLE, und K. SCHÜMANN (Hrsg.), Vitamine, Spurenelemente und Mineralstoffe 137-147 Thieme, Stuttgart, New York. SHENSTONE, F. S. (1968). The gross composition, chemistry and physiochemical basis of organization of the yolk and white. in T. C. CARTER (Hrsg.), Egg Quality. A study of the hen's egg. Oliver & Boyd, Edinburgh. 184 Lit. Verzeichnis SIMKISS, K. (1991). Fluxes during embryogenesis. in D. C. DEEMING und M. W. J. FERGUSON (Hrsg.), Egg incubation : its effects on embryonic development in birds and reptiles 47-51 Univ. Press, Cambridge. SOUCI, S. W., W. FACHMANN, und H. KRAUT. (2000). Food composition and nutrition tables. 6. Aufl. medpharm Scientific Publ., Stuttgart. TABORSKY, G. (1980). Iron binding by phosvitin and its conformational consequences. J. Biol. Chem. 255:2976-2984. TALLAKSEN, C. M., T. BOHMER, H. BELL, und J. KARLSEN. (1991). Concomitant determination of thiamin and its phosphate esters in human blood and serum by high-performance liquid chromatography. J. Chromatogr. 564:127-136. TERNES, W., L. ACKER, und S. SCHOLTYSSEK. (1994). Ei und Eiprodukte. Verlag Paul Parey, Berlin und Hamburg. TERNES, W. (1991). Model of the functional propeties of egg yolk proteins in the preaparaion of foams for sauces and sweet desserts. in A. OOSTERWOUD und A. W. DE VRIES (Hrsg.), Quality of Poultry Products: II Eggs and Egg Products 191-200 Spelderholt Centre for Poultry Res. and Inform. Services, Beekbergen TERNES, W. und K. DAUTEL. (2007). Der "Punkt der Rose" - Wahrung der technofunktionellen Eigenschaften von Eigelbproteinen. Forschung fürs Leben: Forschung, Dienstleistung, Lehre Tiho 52-56 THORNBER, E. J., R. H. DUNLOP, und J. M. GAWTHORNE. (1980). Thiamin Deficiency in the Lamb - Changes in Thiamin Phosphate-Esters in the Brain. J. Neurochem. 35:713-717. TOLONEN, M. (1990). Vitamins and minerals in health and nutrition. Ellis Horwood, New York. VANDERSLICE, J. T. und M.-H. A. HUANG. (1986). Liquid Chromatographic Analysis of Thiamin and its Phosphates in Food Products Using Amprolium as an Internal Stundard. J. Micronutrient Anal. 2:189-199. 185 Lit. Verzeichnis VIÑAS, P., C. LOPEZ-ERROZ, N. BALSALOBRE, und M. HERNANDEZ-CORDOBA. (2001). Comparison of ion-pair and amide-based column reversed-phase liquid chromatography for the separation of thiamine-related compounds. J. Chromatogr. B Biomed. Sci. Appl. 757:301-308. VIÑAS, P., C. LOPEZ-ERROZ, N. BALSALOBRE, und M. HERNANDEZ-CORDOBA. (2003a). Reversed-phase liquid chromatography on an amide stationary phase for the determination of the B group vitamins in baby foods. J. Chromatogr. A 1007:77-84. VIÑAS, P., C. LOPEZ-ERROZ, N. BALSALOBRE, und M. HERNANDEZ-CORDOBA. (2003b). Determination of thiamine and its esters in beers and raw materials used for their manufacture by liquid chromatography with postcolumn derivatization. J. Agric. Food Chem. 51:3222-3227. WAHEED; S., I. FATIMA, A. MANNAN, M. S. CHAUDHARY, und I. H. QURESHI. (1985). Trace element concentration in egg yolk and egg white of farm and domestic eggs. J. Environ. Anal. Chem. 21:333-344. WAKAMATU, T., Y. SATO, und Y. SAITO. (1982a). Determination of Main Mineral Contents in Hen's Egg Yolk Fractions. Agric. Biol. Chem. 46:577-578. WELZ, B. und M. SPERLING. (1999). Atomic Absorption Spectrometry. 3. ed. Wiley-VCH Verlag, Weinheim. WHITE, H. B., B. A. DENNISON, M. A. DELLAFERA, C. J. WHITNEY, J. C. McGUIRE, H. W. MESLAR, und P. H. SAMMELWITZ. (1976). Biotin-Binding Protein from Chicken Egg-Yolk - Assay and Relationship to Egg-White Avidin. Biochem. J. 157:395-400. WINDISCH, P. und C. LEITZMANN. (1984). Beeinflussung der Eisen- Bioverfügbarkeit durch Inhaltsstoffe in Nahrungsmitteln. Verbraucherdienst 29:201-207. WOODWARD, S. A. und O. J. COTTERILL. (1987). Texture and Microstructure of cooked whole egg yolk and heat formed gels of stirred egg yolk. J. Sci. 52:63-67. ZAPALA, W. (2003). Influence of mobile phase composition on retention factors in different HPLC systems with chemically bonded stationary phases. J. Chromatogr. Sci. 41:289-294. 186 Danksagung Danksagung Den lieben Menschen die hinter mir und dieser Arbeit standen möchte ich an dieser Stelle ganz herzlich danken. Herrn Prof. Ternes für die Vergabe des interessanten Themas und außerdem für die stets freundliche und fachliche Betreuung. Aus dem Institut für Geflügelkunde, Frau Prof. Dr. Rautenschlein Ph.D und Frau Haase, für die freundliche Bereitstellung der embryonierten Eier und als Zweitgutachter PD Dr. G. Glünder. Aus dem Institut für Pathologie, Herrn Prof. Dr. med. vet. Baumgärtner, Ph.D. und Frau Rohn, für die Anfertigung der elektronenmikroskopischen Aufnahmen. Dem Arbeitskreis, insbesondere Nicole, Susi, Kirsten, Thomas und Frau Matthias, da sie mich von Anfang an begleitet haben, danke ich für die anregenden wissenschaftlichen Disskusionen und die Schaffung eines außergewöhnlich guten Arbeitsklimas. Der Fritz Ahrberg Stiftung, die diese Arbeit teilweise finanziell unterstützt hat. Lieber Thorsten, für alles was du mir bist danke ich dir. Meinen Eltern danke ich für die gute Pflege und Aufzucht und insbesondere für die großartige Unterstützung während dieser Arbeit. Ihr habt mir die Möglichkeit gegeben mich zu dem zu enwickeln was ich bin und dafür danke ich euch von ganzem Herzen. Meinem Bruder danke ich dafür, dass er mein Bruder ist. Ich könnte mir keinen besseren vorstellen. All den anderen lieben Menschen die mir während dieser Zeit zur Seite standen danke ich ebenfalls von ganzem Herzen. 187