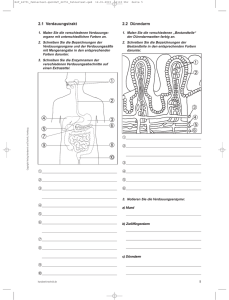
Energiegewinnung aus Nahrungsbestandteilen
Werbung

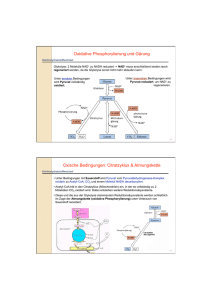
Energiegewinnung aus Nahrungsbestandteilen Kohlenhydrate Fett Fettsäuren und Glycerol Glucose und andere Zucker PROTEIN Stadium I Aminosäuren Stadium II Acetyl CoA ATP O2 ADP CoA eOxidative Phosphorylierung Stadium III Citrat Zyklus 2 CO2 Stadien des Katabolismus I I. Komplexe Biomoleküle Polysaccharide Proteine Lipide Hexosen II. Monomere Bausteine Aminosäuren Glucose Glykolyse Glycerinaldehyd-3-P Pyruvat III. Gemeinsames Zwischenprodukt Acetyl-CoA Fettsäuren, Glycerol Stadien des Katabolismus II III. Gemeinsames Zwischenprodukt Acetyl-CoA Citrat Zyklus Oxidative Phosphorylierung Einfache Endprodukte NH3 H2 O CO22 Allgemeine Aspekte zu Stoffwechsewegen 1. Organisationsprinzipien 2. Kontrollierter Verlauf und Regulationsmechanismen Organisation von Stoffwechselwegen Zyklisch (Intermediate werden recycled) Beispiel: Citratcyklus Linear (Reaktionsprodukte sind Substrate für die folgenden Reaktionen) Beispiel: Synthese von Serin Spirale (Enzymkomplexe werden wiederholt durchlaufen) Beispiel: Fettsäuresynthese Stoffwechselwege verlaufen in geordneten Schritten •Die Enzymspezifität bestimmt den Verlauf der Stoffwechselwege. •Erlaubt eine gute Bilanzierung der zu gewinnenden Energieäquivalente, da diese schrittweise gewonnen werden (ATP, NADH). •Erlaubt die Etablierung von Kontrollpunkten zur Regulation. •Erlaubt die Interaktion mit anderen Stoffwechselwegen. G = Gibbs´sche freie Energie = Freie Enthalpie H = Enthalpie („Wärmetönung“) T = Temperatur S = Entropie („Ordnungszustand des Systems“) ∆G = ∆H - T∆S ∆H < 0 - exotherm - Wärmeabgabe ∆H > 0 – endotherm - Wärmeufnahme ∆G < 0 - spontan, exergon ∆G > 0 – nicht spontan, endergon Welche Faktoren bestimmen die Richtung einer chemischen Reaktion ? A + B <-> C + D [C][D] K = -------[A][B] ∆G = ∆G0 + RT ln K R = Gaskonstante T = Temperatur ∆G0 (kJ mol-1) +17,1 +11,4 +5,7 0 -5,7 -11,4 -17,1 Keq 0,001 0,01 0,1 1 10 100 1000 Aerobe Glykolyse • In allen Zellen, die eine gute Sauerstoffversorgung besitzen, um Pyruvat und NADH oxidativ zu CO2 und H2O abzubauen. • Durch den oxidativen Abbau von Glucose werden mehr als 30 Moleküle ATP erzeugt, gegenüber 2 Molekülen bei der anaeroben Glykolyse. Anaerobe Glykolyse • • • • In Erythrozyten In Zellen unter Bedingung einer unzureichenden Sauerstoffversorgung, z.B. bei Hypoxie und in der Muskulatur bei der initialen Phase der Muskelarbeit oder bei Überanstrengung. Da NAD+ als Elektronenakzeptor in den Zellen nur in sehr geringer Konzentration vorhanden ist, muß es für den reibungslosen Fortgang der Glykolyse regeneriert werden. Dies geschieht durch die Reduktion von Pyruvat zu Lactat. Lactat kann bei besserer Sauerstoffversorgung der Zelle oxidativ weiterverwertet werden oder wird aus der Zelle in das Blut ausgeschleust. Dies erklärt den diagnostischen Wert des Blutlactats im Leistungssport. Alkoholische Gärung CH3COCOO- + H+ → CH3CHO + CO2 • • Pyruvat-Decarboxylase • CH3CHO + NADH + H+ → CH3CH2OH + NAD+ Alkohol-Dehydrogenase • Wo? In Hefen Pyruvat wird hierbei im ersten Schritt durch die Pyruvat-Decarboxylase zu Acetaldehyd umgesetzt. Acetaldehyd wird durch die Alkohol-Dehydrogenase unter Verbrauch von NADH zu Alkohol reduziert. Hemmstoffe der Glykolyse wie z.B. Natriumfluorid hemmen daher auch die alkoholische Gärung Bevor es in die Details der Glykolysereaktionen geht, sollen 2 Moleküle vorgestellt werden, die für die Bilanzierung des Stoffwechselwegs eine wichtige Rolle spielen 1. ATP „Energiewährung“ 2. NAD(P)H Elektronendonor bzw. -akzeptor • • • • ATP ist die “Energiewährung” der Zelle Adenosin-5’-Triphosphat In Säugetierzellen wird ATP durch katabole Stoffwechselschritte erzeugt, welche die energieverbrauchenden Aktivitäten der Zellen ermöglichen: Biosynthesen Transportvorgänge molekulare Motoren (Muskel, Zellteilung) Chemisch ist ATP ein Phosphorsäureanhydrid Hoher negativer G0 Wert nach Hydrolyse der Phosphorsäureanhydridbindungen ATP Nicotinamid Coenzyme Pyridinnucleotide • • Diese Coenzyme sind Überträger und Akzeptoren von 2 Elektronen Sie übertragen ein Hydridanion (H-) von bzw. auf Substrate – • Beispiel: NADH liefert H:- für die Reduktion von Pyruvat zu Lactat Es gibt 2 wichtige Coenzyme in dieser Klasse: 1. Nicotinamid-Adenine-Dinucleotid (NAD+) 2. Nicotinamid-Adenine-Dinucleotid-Phosphat (NADP+) NAD(P)+ and NAD(P)H Nicotinamid (oxidiert) Nicotinamid (reduziert) Übersicht Glykolyse 1 1. Investment Phase (ATP Verbrauch) 2. Splitting Phase (C6 → 2 C3) Übersicht Glykolyse 2 3. Gewinn Phase (Substratkettenphosphorylierung) Glykolyse – Hexokinase/Glucokinase • • • Die Phosphorylierung von Glucose an C-6 geschieht unter Verbrauch von ATP = Investment für die Einleitung der „Substratkettenphosphorylierung“. Die Hexokinase (HK) ist in allen Zellen des Organismus nachweisbar. In der Leber und den insulinsezernierenden Beta-Zellen des Pankreas wird D-Glucose durch die Glucokinase (GK) phosphoryliert. Die Glucokinase besitzt im Gegensatz zur Hexokinase eine niedrige Affinität für Glucose (Km GK 10 mM vs. HK 50 µM) und wird nicht durch das Produkt Glucose-6-phosphat gehemmt. Vergleich Hexokinase - Glucokinase 1. 2. 3. 4. 5. 6. Hexokinase In allen Körperzellen vorhanden Km Glucose 0,1 mM = hohe Substrataffinität Produkthemmung durch Glucose6-phosphat Michaelis-Menten Kinetik Keine Regulation durch Hormone Einschleusung von Glucose in den Stoffwechsel ist unabhängig von den physiologischen Glucosekonzentrationen (Enzym arbeitet im Bereich der Substratsättigung) 1. 2. 3. 4. 5. 6. Glucokinase Nur in der Leber und den BetaZellen des Pankreas vorhanden Km Glucose 10 mM = niedrige Substrataffinität Keine Produkthemmung durch Glucose-6-phosphat Sigmoidale Reaktionskinetik Induktion durch Insulin, Repression durch Glucagon in der Leber Einschleusung von Glucose in den Stoffwechsel ist abhängig von den physiologischen Glucosekonzentrationen (Steuerung der Glucoseverwertung in der Leber!) Allosterische Regulation der Hexokinase • Das Substrat (Glucose) bindet über eine Konformationsänderung des Enzyms (“Induced Fit”) – verhindert ATPase Aktivität in Abwesenheit des Substrats • Die Hexokinase wird reguliert – Allosterische Produkthemmung durch Glucose-6-Phosphat – Diese allosterische Hemmung spielt keine entscheidende Rolle für die Regulation des glykolytischen Stoffwechselwegs Glucose-6-phosphat spielt eine zentrale Rolle im Glucosemetabolismus Glucose Glykogen Pentose Phosphat Pathway NADPH & 4-C, 5-C, & 7-C Zucker Glucose-6phosphat Glucose-1-phosphat Glucuronat Fructose-6phosphat Glykolyse Energiespeicher in Leber & Muskel Glucosamine-6-phosphat Synthese von komplexen Kohlenhydraten Phosphoglucoisomerase Glucose-6-P zu Fructose-6-P • Warum ist diese Reaktion notwendig? – Der nächste Reaktionsschritt (Phosphorylierung an C-1) verläuft energetisch ungünstig an einem Halbazetal -OH, jedoch sehr günstig an einer primären -OH Gruppe – Die Isomerisierung aktiviert C-3 für die Spaltung in der Aldolase Reaktion —C=CH • Ene-diol Intermediat: | | HO OH Phosphoglucoisomerase O H H C1 Aldehyd H-C-OH H-C-OH HO-C-H G6P C=O HO-C-H H-C-OH H-C-OH H-C-OH H-C-OH CH2OP-O3 2- CH2OPO3 2O Ketogruppe OH CH2OP-O3 2- -2O 3POCH2 O F6P CH2OH H HO OH OH H HO OH OH H Phosphofructokinase Typ 1 PFK-1 = der zentrale Schritt der Glykolyse! • Die zweite Priming Reaktion der Glykolyse • Zentraler Reaktionsschritt und hohes -∆G – PFK zeigt eine ausgeprägte Regulation! • ATP inhibiert, AMP hebt die Inhibierung auf • Citrat ist ein allosterischer Inhibitor • Fructose-2,6-bisphosphate ist ein allosterischer Aktivator Merkschema: • PFK Aktivitätsstatus ist hoch, wenn der Energiestatus der Zelle niedrig ist (ATP Mangel!) Aktivitätsstatus ist niedrig, wenn der Energiestatus der Zelle hoch ist (hohe ATP Spiegel!) ADP F-6-P PFK-1 Reaktion PFK PFK + ATP + ADP Mg2+ Fructose-6-phosphat Fructose-1,6-bisphosphat Hohe negative freie Energie, wirkt als Schrittmacher des Glykolysestoffwechselwegs! ∆Gº´ = -14.2 kJ/mol ∆Gerythrocyte = -18.8 kJ/mol Fructose 2,6-bisphosphat Ein starker Aktivator der Phosphofructokinase-1 • Generiert durch die PFK Typ 2, ein bifunktionelles Enzym 2-O POH C 3 2 OPO32- O H HO H – Fructose-2,6-Kinase – Fructose-2,6-Bisphosphatase OH CH2OH H Fructose 2,6-bisphosphat (F-2,6-P) Stimuliert durch Fructose 6-phosphat Dephosphoryliertes Enzym Niedriger Blutzucker Fructose 6-phosphat + Fructose 2,6-bisphosphat Phosphoryliertes Enzym Achtung bei MC-Fragen: Dieses Enzym ist nicht identisch mit der PFK-1 in der Glykolyse Via cAMP Gehemmt durch Fructose 6-phosphat Regulatory domain +H 3N– 1 Kinase domain 32 Phosphatase domain –COO250 Phosphofructokinase Typ 2 470 Fructose-2,6-bisphosphat ist ein wichtiger allosterischer Regulator der Glykolyse und Gluconeognese Fructose-2,6-bisphosphat • stimuliert die Phosphofructokinase und somit die Glykolyse • hemmt die Fructose-1,6bisphosphatase und somit die Gluconeogenese Regulation der PFK Fructose-2,6-bisphosphat als Stimulator der Enzymaktivität Enzymaktivität [ATP] niedrig 1.0 µM F-2,6-BP 1.0 µM F-2,6-BP 0.1 µM 0.1 µM [ATP] hoch 0 [F-6-P] Negative Regulation durch ATP 0 [ATP] (µM) Stimulation durch Fructose-2,6-P in Abhängigkeit von ATP [F-6-P] (µM) Stimulation durch Fructose-2,6-P in Abhängigkeit von F-6-P Aldolase – Vorraussetzung für die (reverse) Aldolkondensation 1 • • • In dieser Reaktion kondensieren ein Aldehyd und ein Keton zu einem Aldol Die Reaktion ist energetisch reversibel und kann daher als Kondensation oder Splitting verlaufen Durch ein Aldolsplitting wird der C-6 Körper der Glucose in 2 C3-Körper gesplittet, die für die Netto-Energiegewinnung der Glykolyse von entscheidender Bedeutung sind Glykolyse – Vorraussetzung für die (reverse) Aldolkondensation 2 • Glucose-6-phosphat besitzt nicht die Voraussetzung für ein Aldolsplitting. • Hierzu ist die Umwandlung in Fructose6-phosphat, einem Keton, notwendig. • Diese Umwandlung wird durch die PhosphoglucoseIsomerase katalysiert. Aldolase C6 (F-1,6-BP) zu 2 C3 (DHAP & Gly-3-P) • Klasse I Aldolasen (in Säugetieren) bilden kovalente Schiff’sche Basen-Intermediate zwischen dem Substrat und einer Lysinseitengruppe im aktiven Zentrum des Enzyms aus Fructose bisphosphat Aldolspaltung aldolase D-Fructose-1,6-bisphosphat (FBP) + Dihydroxyaceton Phosphat (DHAP) D-Glyceraldehyd 3-phosphat (G-3-P) Aldolasereaktion Formation einer Schiff’schen Base CH2OPO32+ H+ E-NH2 + O=C CH2OH DHAP 2CH OPO + 2 3 H E-N=C H-C-OH H CH2OPO32+ + H2O E-N=C H CH2OH Schiff’sche Base CH2OPO32E-N = C + H+ H-C-O Enolat Anion H+ H δ+ C=O δH-C-OH CH2OPO32Glyceraldehyd 3-phosphat Glykolyse – Übersicht Aldolsplitting • • Bevor es durch die Aldolase zu einem Aldolsplitting kommt wird durch die Phosphofructokinase Fructose-6-phosphat in der C1 Position durch die Phosphofructokinase zu Fructose1,6-bisphosphat unter Verbrauch von ATP phosphoryliert. Dieser zweite Phosphorylierungsschritt ist notwendig, da die Nettosyntheseschritte von ATP (also die positive Enegiebilanz der Glykolyse) 2 phosphorylierte C-3 Körper in den nachfolgenden Reaktionen erfordert. Interconversion von Dihydroxyacetonphosphat und Glycerinaldehyd-3-phosphat durch die Triosephosphat-Isomerase • Vom energetischen Aspekt der enzymatischen Reaktion sind beide Moleküle im Equilibrium. • Da durch die folgende Reaktion Glycerinaldehyd-3phosphat kontinuierlich verbraucht wird, findet in der Glykolyse eine Konversion von Dihydroxyacetonphosphat zu Glycerinaldehyd-3-phosphat statt. Triosephosphat Isomerase DHAP zu Gly-3-P • En-diol Reaktionsmechanismus • Glutamat-Seitengruppe im aktiven Zentrum wirkt als Base • Unter physiologische Bedingungen wird nahezu die maximale Reaktionsgeschwindigkeit erreicht (“Diffusion Controlled”) Triosephosphat Isomerase Reaktionsmechanismus Glykolyse Glycerinaldehyd-3-phosphat-Dehydrogenase - Generierung eines energiereichen Substrats zur Gewinnung von ATP durch die 3-Phosphoglycerat-Kinase Glycerinaldehyd-3-phosphat-Dehydrogenase Mechanismus der Katalyse • • • Eine Cysteinseitengruppe des Enzyms bildet mit der Aldehydgruppe des G-3-P ein Halbazetal. Der Enzym-Substrat Komplex wird nun oxidiert wobei die Elektronen auf NAD+ übertragen werden und ein Thioester entsteht. Der energiereiche Thioester kann mit anorganischem Phosphat 1,3 Bisphosphoglycerat bilden, wobei das Cystein des Enzyms regeneriert wird. Glycerinaldehyd-3-phosphat-Dehydrogenase H O C HCOH + NAD+ + HPO42- G-3-P ∆Gº´ = +6.3 kJ/mol HCOH + NADH + H+ 1,3-BPG 2 wichtige Anmerkungen zu dieser Glykolysereaktion: 1. Es entsteht mit 1,3-Bisphosphoglycerat eine Vebindung mit hohem Gruppenübertragungspotential, die in der folgenden Reaktion zur ATP Generierung genutzt wird . 2. Die Reaktion ist vom energetischen Aspekt her reversibel und kann auch in der Glucoseneubildung aus Pyruvat durchlaufen werden. Glykolyse- Substratkettenphosphorylierung durch die 3-Phosphoglycerat-Kinase • • Der Begriff „Substratkettenphosphorylierung“ bedeutet, dass die energiereiche Phosphatgruppe, die auf ADP übertragen wird, von dem „Substrat“ 1,3-Bisphosphoglycerat stammt. Das Enzym heißt Phosphogyceratkinase, weil Kinasen immer aus der Sicht der ATP Reaktion, also dem Substrat das phosphoryliert wird, benannt werden. 3-Phosphoglycerat-Kinase 1,3-Bisphosphoglycerat zu 3-Phosphoglycerat • “Substratkettenphosphorylierung" – ATP Synthese von einem hochenergetischen Phosphat = Freie Energie für die Hydrolyse der C-1 Phosphatgruppe des 1,3-BPG beträgt 49.4kJ/mol ! ADP 1,3-BPG 3-PG Glykolyse – Phosphoglycerat-Mutase • • Die C-3 Phosphatgruppe des 3-Phosphoglycerats ist nicht energiereich genug für eine weitere „Substratkettenphosphorylierung“ von ADP. Die enzymatische Umwandlung zu 2-Phosphogycerat erlaubt in dem nächsten Schritt die Bildung einer energiereicheren Phosphatgruppe Glykolyse – Die letzten Schritte zur Bildung von Pyruvat • • • • Durch die Enolase wird ein Wassermolekül entfernt, so dass Phosphoenolpyruvat, ein substituiertes „Enol“ entsteht. Die Enolase wird sehr effektiv durch Natriumfluorid gehemmt. Mit einer freien Energie von – 62,3 kJ/mol für die Hydrolyse der Phosphatgruppe ist eine Übertragung auf ADP möglich. Dies geschieht durch die Pyruvatkinase unter Bildung von Pyruvat. Die Pyruvatkinase-Reaktion ist irreversibel (? Go – 31,4 kJ/mol). Enolase 2-Phosphoglycerat zu Phosphoenolpyruvat • ∆G beträgt 1.8 kJ/mol • "Energiegehalt" von 2-PG und PEP ist vergleichbar • Die Enolasereaktion überführt 2-PG in eine Form von der mehr Energie durch Hydrolyse gewonnen werden kann (für die Generierung von ATP) Enolase 2-PG ∆Gº´ = +1.8 kJ/mol PEP Pyruvat Kinase PEP zu Pyruvat generiert ATP • 2 ATP (pro Glucosemolekül) in dieser Reaktion sind der “Nettogewinn" der Glykolyse • Hoher, negativer ∆G Wert à Regulation! • Allosterische Aktivierung durch AMP & F-1,6-bisP • Allosterische Hemmung durch ATP & Acetyl-CoA • Pyruvat zeigt eine Keto-Enol Tautomerisierung Pyruvatkinase PEP ∆Gº´ = -31.7 kJ/mol Pyruvat Der hohe -∆G Wert ist durch die Enol-Keto Umwandlung von Enolpyruvat zu Pyruvat verursacht. Tautomere Formen von Pyruvat Enol Keto Glykolyse – Welche Reaktionen verlaufen irreversibel ? 1. Hexokinase 2. Phosphofructokinase 3. Pyruvatkinase • Diese Reaktionen müssen bei der Glucoseneubildung (Gluconeogenese) durch andere (z.T. ATP-verbrauchende) Reaktionswege umgangen werden. Glykolyse: Freie Energien und Konzentrationen der Metabolite Die mit blauen Pfeilen gekennzeichneten Reaktionen zeigen stark negative rG Werte und sind unter physiologischen Bedingungen nicht reversibel Glykolyse – Nettobilanz der ATP Generierung • • • • Hexokinase Phosphofructokinase 3-Phosphoglyceratkinase Pyruvatkinase - 1 ATP - 1 ATP + 2 ATP + 2 ATP • Nettogewinn 2 ATP Moleküle Alle Werte sind auf 1 Glucosemolekül bezogen Energiewerte der Glykolyse ∆Gº´ und ∆G sind nicht identisch ! Free energy, kJ/mol 40 ∆Gº´ ∆G in Zellen 20 0 -20 -40 1 2 3 4 5 6 7 8 9 10 LDH 1 2 3 4 5 6 7 8 9 10 LDH Glykolyseschritte Aldolase 3-Phosphoglycerat-Kinase Glucose Mannose G6P Mannose-6-P Aldolase Fructose Glyceraldehyde UDP-Glucose F6P UDP-Gal FBP Galactose-1-P DHAP Triose kinase Glucose-1-P Galactose G3P BPG 3PG 2PG PEP 2 Pyruvat Wie werden die Hexosen Galactose, Fructose und Mannose in die Glykolyse eingeschleust ? ATP ADP Glucose G6P ATP ATP Verbrauch F6P ADP FBP DHAP Pi G3P 2 NAD+ 2 NADH + H+ BPG 2 ADP 2 ATP ATP Produktion NADH Produktion 3PG NADH Verbrauch 2PG PEP 2 ADP 2 ATP 2 Pyruvat 2NADH + H+ NAD+ 2 Lactat Wo und wie wird die Glykolyse reguliert ? 1. Hexokinase Allosterische Produkthemmung durch Glucose-6-phosphat (Anhäufung bei Hemmung der PFK-1) 2. Phosphofructokinase Typ 1 (PFK-1) Allosterische Aktivierung durch AMP, ADP und Fructose-2,6bisphosphat Allosterische Hemmung durch ATP und Citrat 3. Pyruvatkinase Allosterische Aktivierung durch Fructose-1,6-bisphosphat („Feed-Forward“ Aktivierung) Der Energiestatus der Zelle ist unabhängig von der hormonellen Regulation der sensitivste Parameter für die Regulation der Glykolyse. Niedriger Energiestatus = Aktivierung der Schlüsselenzyme Hoher Energiestatus = Hemmung der Schlüsselenzyme Regulatoren glykolytischer Enzyme Wichtig für Physikumsfragen: Glucose ist kein direkter (allosterischer) Regulator der Glykolyse. Enzymdefekte Glykolyse 1. Phosphoglucose Isomerase (Glucose-6-phosphat-Isomerase-Defekt) 2. Pyruvatkinase • Betroffenes Organ: Erythrozyten • Folge: Verkürzung der Lebenszeit enzymopathische hämolytische Anämie = Blutarmut • Symptome: Blässe, körperliche Schwäche Milzvergrösserung (Abbauort der zerstörten Erythrozyten) Glucose-6-phosphatIsomerase-Defekt Pyruvatkinase-Defekt Verminderte allosterische Aktivierung durch Fructose-1,6-bisphosphat = unzureichende Feed-Forward Aktivierung der Pyruvatkinase Hemmstoffe der Glykolyse mit Relevanz für die Klinik 1. • • • 2. • • Arsen → Toxikologie ähnliche chemische Eigenschaften wie Phosphat bildet in der Glycerinaldehyd-3-phosphat-dehydrogenase Reaktion 1-Arseno-3-phosphoglycerat, welches instabil ist und durch Hydrolyse zerfällt. Es wird daher kein ATP gebildet! Arsen ist daher ein Entkoppler der ATP-Generierung in der Glykolyse Natrium-Fluorid → Klinische Analytik Hemmt kompetitiv die Enolase-Reaktion der Glykolyse Da Natrium-Fluorid ein kostengünstiges Reagenz ist, wird es eingesetzt um die Glykolyse in Blutproben zur Glucosebestimmung zu hemmen.