c) Schritte der Biosynthese der Fettsäuren α) Bildung eines
Werbung
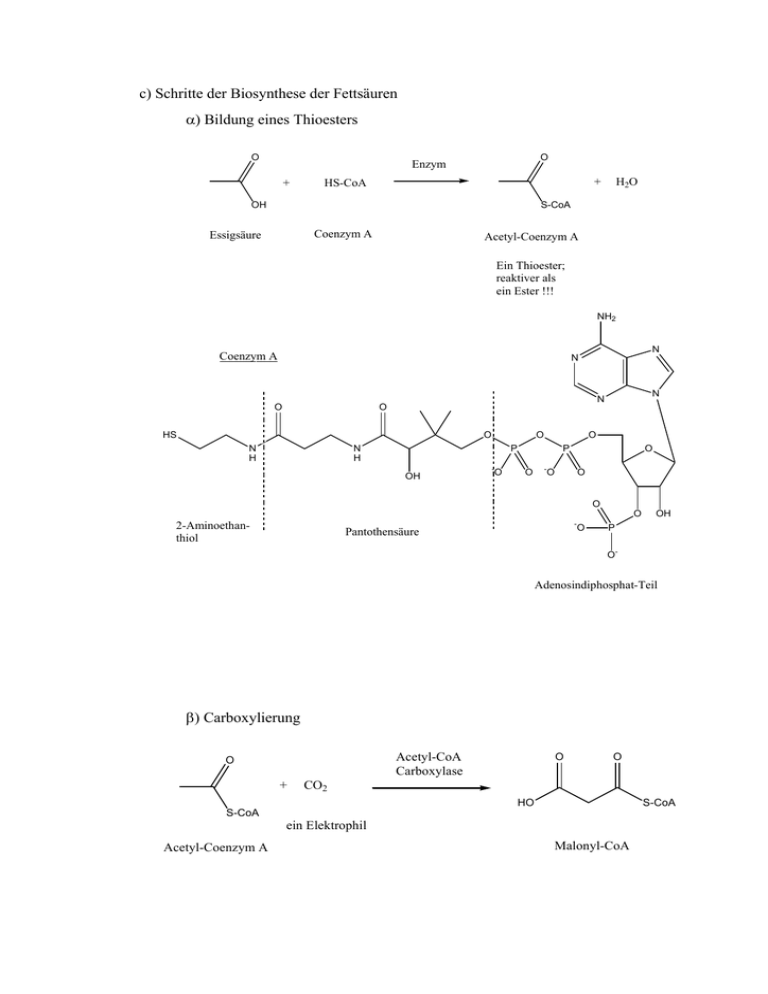
c) Schritte der Biosynthese der Fettsäuren α) Bildung eines Thioesters O O Enzym + + HS-CoA OH H2O S-CoA Coenzym A Essigsäure Acetyl-Coenzym A Ein Thioester; reaktiver als ein Ester !!! NH2 Coenzym A N N O HS O N H N N O O N H O P - OH O O P O - O O O O - 2-Aminoethanthiol Pantothensäure O OH P O- Adenosindiphosphat-Teil β) Carboxylierung Acetyl-CoA Carboxylase O + O O CO2 HO S-CoA S-CoA ein Elektrophil Acetyl-Coenzym A Malonyl-CoA γ) Transfer von Alkanoyl-Gruppen O O + HS-Protein + HS-CoA S-Protein S-CoA Acyl-Carrier-Protein Acetyl-Coenzym A O O O + HO O HS-Protein S-CoA HO S-Protein Acyl-Carrier-Protein Malonyl-CoA + HS-CoA δ) Kupplung O O HO S-Protein H O O O O + HO S-Protein O O HS-Protein S-Protein H O vergleiche Malonester-Synthese S-Protein vergleiche Claisen-Kondensation O S-Protein HO O S-Protein O ε) Reduktion O enzymatische Reduktion O S-Protein OH O "+ H2" S-Protein Eliminierung vergleiche Aldolkondensation O + H2O S-Protein enzymatische Reduktion "+ H2" O S-Protein Wiederholung der Kupplung und Reduktion mit diesem Thioester mit C4-Kette => C6-Kette .... usw. => Die Kohlenstoffkette wird schrittweise um je einen C2-Baustein verlängert => Enzyme bewirken, daß alle Reaktionsschritte unter physiologischen Bedingungen stattfinden können d) Synthese des Isopentenyl-Pyrophosphats (der Baustein zur Synthese der Terpene) Ähnlich wie die Fettsäuren wird das Isopentenyl-pyrophosphat synthetisiert: CO2H O Enzym 3 OH OH CO2H Enzym - CO2 OH CO2H Enzym - H 2O enzymatische Reduktion CO2H OH enzymatische Phosphorylierung OO P O OO P O O- Polymerisation auf der Basis von Polykondensationsreaktionen: Polyester O O + HO OH H3CO OCH3 ein Dicarbonsäurediester ein Diol säurekatalysierte Umesterung H+ ∆ zum Entfernen des Methanols HO O O O OCH3 n Polyester als lineares, unverzweigtes Polymer zum Beispiel: H3CO2C + HO CO2CH3 OH Ethylenglycol Terephtalsäuredimethylester H+ ∆ O O O O HO n Carbonsäurederivate 1. Übersicht O Carbonsäure-Derivat R X O R O R Cl O O O X R R R OR SR O O R OH NH2 R Carbonsäurechlorid Carbonsäureanhydrid Carbonsäurethioester Carbonsäureester Reaktivität STEIGT Carbonsäure Carbonsäureamid 2. Synthese der Carbonsäurechloride O O + R O Cl OH Carbonsäure O R S Cl O + HCl S Cl Thionylchlorid ein gemischtes Anhydrid isolierbare Zwischenstufe O H R O Cl O + nucleophile Addition O R O S tetraedrische Zwischenstufe H Cl- Cl O S Cl Eliminierung O O + R Cl + S HCl O Da SO2 und HCl Gase sind, bleibt im Reaktionsgefäß bei Einhaltung der Stöchiometrie nur reines Säurechlorid zurück !! Kann dirket weiter verwendet werden. O R O- NuR Cl das Säurechlorid ist elektrophiler als eine Carbonsäure O Cl Nu Cl- ist die bessere Austrittsgruppe R + Nu Cl- 3. Synthese von Carbonsäureamiden: Chemie der Aminosäuren α-Aminocarbonsäuren O R R=H * Glycin achiral OH NH2 R=H O alle anderen proteinogene Aminosäuren sind chiral (3 DNA-Basen codieren eine Aminosäure) OH H2N H R L-Reihe alle Aminosäuren gehören der L-Reihe an ! O- O Betain-Form; ein Zwitterion (Kation und Anion in einem) + H3N H R bei einem bestimmten pH-Wert liegen alle Teilchen so vor (isoelektrischer Punkt; wandern nicht im elektrischen Feld) Die Peptidbindung Aminosäuren bauen über eine Amidbindung Peptide auf: O- O R' R R' + N R N H H Grenzstruktur mit partiellem Doppelbindungscharakter; wichtiger als bei Carbonsäuren, weil Stickstoff weniger elektronegativ als Sauerstoff ist und daher die positive Partialladung besser toleriert. Alle Substituenten an der C=N-Doppelbindung befinden sich in einer Ebene => eine planare Teilstruktur als experimentell beobachtbares Resultat dieser elektronischen Struktur registriert man eine stark verlangsamte Rotation um die C=N-Doppelbindung O- O H R N R' + R N R' H Die Peptidkette R1 H R3 O H N O N N N H R2 O H N O R4 H Die Proteinstruktur ist insgesamt sehr komplex und hängt unter anderem von den Diederwinkeln an den beiden Bindungen (C-N und C-C), um die gedreht werden kann, ab. Die günstigsten und daher bevorzugten Kombinationen beider Winkel kann man aus dem sogenannten Ramachandran-Plot ablesen. - Primärstruktur (Sequenz, Abfolge der Aminosäuren im Peptidstrang) - Sekundärstruktur (räumliche Anordnung des Strangs) . α-Helix . β-Faltblatt . Turn ......... - Tertiärstruktur (relative räumliche Anordnung der Sekundärstruktur) - Quartärstruktur (relative Anordnung mehrerer Peptide zueinender) kann strukturbildend oder funktional sein O H2N N CO2CH3 H CO2H Asparaginsäure Phenylalaninmethylester ASPARTAM, ein Süßstoff, der etwa 200 Mal so süß wie Rohrzucker ist !! Peptidsynthese - biochemisch (DNA für das zu Synthetisierende Peptid wird in den Zellkern eingeschleust .....) - auf chemischen Weg im Reagenzglas Die Ausbeute einer Reaktion ist immer < 1 (d.h. kleiner 100%) Bei einer n-stufigen Synthese ist die Gesamtausbeute (<1)n Die Merrifield-Synthese (1984 Nobel-Preis) Mechanisierung der Schritte im “Synthesizer” O n n H H H+ Cl- + + H Cl - elektrophile aromatische Substitution durch den durch Säure aktivierten Formaldehyd Teilstruktur des Polystyrols OH Aktivierung der benzylischen OH-Gruppe und anschließende Substitution durch das Chlorid-Anion n n + + H2O Cl- + Cl OH2 nur ein Gewisser Teil der Phenylreste des Polystyrols wird auf diese Weise mit CH2Cl-Gruppen versehen ("Belegung"). Das Polystyrol besteht mikroskopisch betrachtet aus kleinen Kügelchen. Schritte: a) Anknüpfen an Polystyrol n O das nucleophilere Stichstoffatom der Aminosäure würde mit dem benzylischen Chlorid reagieren + O- H2N => die Aminogruppe muß über eine Schutzgruppe desaktiviert werden (man will eine Anknüpfung über die Carboxylat-Gruppe, weil damit zum Schluß die Abspaltung am besten funktioniert) Cl Beispiele für solche Schutzgruppen für die Aminogruppe: O O O Cl O Cl Chlorameisensäure-tert-butylester Chlorameisensäurebenzylester O O O Cl + O- H2N O OO N H O jetzt ist das freie Elektronenpaar des Amins durch die Beteiligung an der Amid-Mesomerie desaktiviert, nucleophilste Stelle des Moleküls ist die Carboxylatgruppe n - Cl- n Cl O O O N H Schutzgruppe O 1. Aminosäure fester Träger b) “Entschützen” n O O O N H O n H2 / Palladium-Katalysator O O H HO N H O eine Carbaminsäure (Kohlensäure-ähnliches Derivat; CO2 wird leicht abgespalten) Toluol - CO2 n H O N H O damit wird das nucleophile Aminoende der jetzt festphasen-gebundenen Aminosäure wieder freigesetzt c) Kupplung mit der zweiten Aminosäure n O + H2N O - H O N H O Erneut zwei Schwierigkeiten: a) das Carboxylat-Ende der zweiten Aminosäure muß aktiviert werden, sonst reagiert es mit dem Amino-Ende der ersten, ihrerseits über die Carboxylat-Gruppe an die feste Phase gebundenen Aminosäure nicht b) außerdem muß wie zuvor bei der ersten Aminosäure zunächst die reaktive Aminogruppe der zweiten Aminosäure durch schützen desaktiviert werden. Es soll nur die Aminogruppe der bereits festphasen-gebundenen Aminosäure als Nucleophil reagieren können. O O N NH OH Dicylcohexylcarbodiimid (DCC) C + O N dieses Mal aus rein didaktischen Gründen die zweite Schutzgruppe verwendet O O N NH O aktivierte Carbonsäure O C N H n + H O N H O n H N H O + O N O O NH N O H O Dicyclohexylharnstoff (Nebenprodukt) Entschützen mit HBr / HOAc oder F3CCO2H / H2O H +O NH O n H die Carbaminsäure decarboxyliert wieder O NH + O O O H2N Eliminierung oder nucleophile Addition von Wasser N H O d) Wiederholung von b) “Entschützen” und c) Kupplung mit der nächsten Aminosäure e) Die fertige Peptidkette vom Polymer abspalten n O O H2N N n H O die Esterbindung am Anknüpfungspunkt an der festen Phase ist reaktiver als die Amidbindungen im Peptidstrang und kann daher selektiv gespalten werden. So wird das fertige Peptid von dem Polystyrol-Kügelchen getrennt.











