39. Kongreß der Deutschen Gesellschaft für Pneumologie vom 11
Werbung

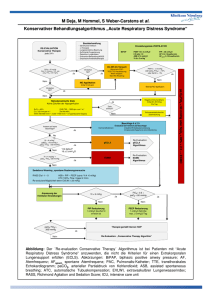
1 39. Kongreß der Deutschen Gesellschaft für Pneumologie vom 11. bis 14. März 1998 in Leipzig. (III) Differentialdiagnose und Therapie des ARDS – Frühseminar am 12. 03. 98 K. Lewandowski (Berlin), G. Hoheisel (Leipzig) Definition, Ätiologie, Pathologie, Diagnostik • Definition d. ARDS (American-European consensus Conference on ARDS, 1994) − akutes Auftreten − paO2 / FiO2 < 200 mmHg unabhängig vom PEEP − bds. Lungeninfiltrate − pulmonalkapillärer Verschlußdruck (pulmonary capillary wedge pressure, PCWP) < 18 mmHg (falls gemessen) oder keine klinischen Zeichen einer linksartrialen Hypertonie Ursachen − direkte Lungenschädigungen wie Lungenkontusion, Aspiration von Magensaft, Beinaheertrinken, Pneumonie, Inhalationstrauma, parapneumonisch (bakt., viral, pneumocystis carinii), auch hoher O2Partialdruck − Medikamente (u. a. Amiodarone –sehr selten), Drogen − indirekte Lungenschädigungen wie Sepsis, Schock, Polytrauma, Pankreatitis, Notfall-Polytransfusionen, kardiopulmonaler Bypass − potentiell i. R. e. jeden schweren Erkrankung • • insges. seltenes Krankheitsbild Letalität mehr als 50% • Pathologie − akutes Stadium: ∗ ausgedehnte Zerstörungen von Typ I- Zellen des Alveolarepithels; interstit. Ödem; Alveolen sind durchlässig für proteinreiche Flüssigkeit, Erys, Leukos → formieren sich zu „hyalinen Membranen“ ∗ in kleineren Lungengefäßen hyaline Mikrothromben − chronisches Stadium ∗ nach wenigen Tagen ∗ Typ I-Zellen des Alveolarepithels werden durch Typ II- Zellen ersetzt, die zwar proliferieren, sich aber nicht differenzieren ∗ Verbreiterung des Interstitium durch Einlagerung von Ödem, Fibrin, prolif. Zellen ∗ nach 1 Woche Organisation d. alveolären Exsudates (→ Fibrose, hyaline Membranen) mit Zerstörung der Alveolarstruktur • Pathophysiologie − nicht cardiales Ödem infolge der erhöhten kapillar-alveolären Permeabilität und des erhöhten pulmonalarteriellen Druckes − schwere Hypoxämie (Ursache: intrapulmonaler Rechts-Links-Shunt infolge Perfusion nicht ventilierter Lungenareale), die durch eine Erhöhung der FiO2 nicht entscheidend gebessert wird − verminderte Compliance • inhomogene Verteilung der Veränderungen: − die Verdichtungen treten vor allem in den abhängigen Lungenabschnitten auf − Konzept der Baby-Lunge (Gattioni et al.): ∗ Zone H (healthy): gesunde Areale – in schweren Fällen nur noch 20-30% ∗ Zone R (recruitable): bedürfen der Entfaltung durch geeignete Atemzugvolumina (VT) und/oder M. Ulrich 24 .05 - 06. 06. 98 2 ∗ Zone D (diseased): PEEP kein Gasaustausch mehr • Diagnostik − i. d. R. „catastrophic event“ (auslösendes Ereignis wie Sepsis) − Zyanose, Dyspnoe, Tachypnoe − persist. Hyperventilation mit Hyperkapnie − durch Zufuhr von 100% O2 keine deutliche Erhöhung des paO2 − Rö-Thorax: alveoläre Infiltrate in allen Lungenabschnitten – Bild wie bei einem Lungenödem, jedoch ohne Herzvergrößerung, ohne pulmonalvenöse Stauung und i. d. R. ohne Pleuraergüsse → Verdichtung und Verschmelzung der Infiltrate: „weiße Lunge“ − CT für Diagnose von untergeordneter Bedeutung, jedoch von Nutzen für Nachweis von Komplikationen (z. B. Pneumothoraces in dorsalen oder ventralen Abschnitten, Abszesse) Befunde: assymm., teilweise lageabhängige Konsolidierungsareale, teilweise initial reticuläre Zeichnungsvermehrung − Messung des PCWP wichtig (ist bei einigen ARDS-Pat. jedoch erhöht bei präexistenten oder gleichzeitigen Linksherzversagen) − Compliance↓, intrapulmonaler rechts-links-Shunt oft > 30% • DD: ∗cardiale Dekompensation ∗ Pneumonie – evtl. fließende Übergänge bei diffuser Pneumonie ∗ diffuse alveoläre Hämorrhagie - selten, diffuse feinfleckige Infiltrate - BAL: je mehr Aliquots, desto hämorrhagischer (normalerweise umgekehrt) - andere Ursache: Goodpasture-Syndrom - DD: Mykoplasenpneumonie (fleckige Verschattungen wie bei interstitieller Pneumonie) ∗ interstitielle Pneumonitis nach KMT Aktuelle Therapieverfahren • • • • bisher Anwendung großer Atemzugvolumina: → bei herabgesetzter Compliance hohe Beatmungsspitzendrücke (PIP: peak inspiratory pressure) tierexperimentell konnte gezeigt werden, daß große Atemzugvolumina (Volutrauma) die Lunge mehr als hohe Beatmungsdrücke (Barotrauma) schädigen P2R2 (Steward und Slutsky): „Protect the ventilated lung; Prevent oxygen toxicity; Recruit the infiltrated, atelectatic und consolidated lung; Reduce the anatomic and alveolar dead space“. Durch eine druckkontrollierte Beatmung (pcCMV: pressure controlled continuous mandatory ventilation): in der Lunge wird ein bestimmter Druck während der Inspiration aufrechterhalten: Dies erlaubt Alveolen unterschiedlicher Dehnbarkeit sich zu füllen, ohne daß es bei geringerer Dehnbarkeit zu Überdehnungen kommt. Auf diesem Prinzip basieren mehrere Beatmungsformen: ∗ pcCMV-IRV (pressure controlled inverse ratio ventilation): Inspitation : Exspiration 2 : 1, 3 : 1 oder in seltenen Fällen auch 4 : 1. Durch die verlängerte Inspiration verlängert sich der Kontakt des Atemgases mit den Alveolen, die auch über längere Zeit offengehalten werden. Durch die verkürzte Exspirationsphase wird verhindert, daß sich die Alveolen unterhalb ihres „closing volume“ (das Volumen, bei dem die kleinen Atemwege kollabieren) entleeren: dem Alveolarkollaps wird entgegengewirkt („intrinsic PEEP“). Dadurch wird im Vgl. zu normalem I/E-Verhältnis eine bessere Oxygenierung bei niedrigeren Beatmungsspitzendrücken erreicht. JEDOCH: oft zur Synchronisierung einer noch vorhandenen Spontanatmung mit der Beatmungsmaschnine tiefe Sedierung, evtl. auch Relaxierung notwendig. Ob das Barotrauma-Risiko erhöht ist, ist noch nicht geklärt. ∗ APRV (Airway pressure release ventilation): wie bei CPAP wird ein vorwählbarer Atemwegsdruck erzeugt, bei dem der Patient spontan atmen kann. In bestimmten Abständen wird der Atemwegsdruck für kurze Zeit freigegeben („release“) und fällt dadurch auf ein niedrigeres Druckniveau ab, wodurch die Ventilation des Pat. unterstützt wird. 3 Durch APRV und ihre Modifikationen, die Spontanatmung ermöglichen, sind wahrscheinlich viele mögliche Nebenwirkungen der kontrollierten Beatmungsformen wie ♦ Behinderung des venösen Rückflusses ♦ Beeinträchtigung der Nierenfunktion ♦ Beeinträchtigung des Gastrointestinaltraktes zu vermeiden Eine Muskelrelaxierung ist nicht notwendig; ob die Inzidenz von Barotraumen niedriger ist als bei den traditionellen Beatmungsformen, ist noch nicht geklärt ∗ BIPAP (Biphasic positive airway pressure): druckkontrollierter Beatmungsmodus mit jeweils variabel (bzgl. Dauer und Höhe) einstellbarem oberen (inspiratorischem) und unterem (exspiratorischem) Druckniveau. Innerhalb eines bestimmten Zeitraumes kann der Patient den Wechsel zwischen beiden Druckniveaus triggern. Die charakteristische BIPAP-Ventilation erfordert die Spontanatmung des Patienten auf beiden CPAP-Niveaus. Anders ausgedrückt: BIPAP bedeutet Spontanatmung auf 2 unterschiedlich hohen Atemdruckniveaus. Die Beatmung kann mandatorisch oder assistiert erfolgen. ∗ IMPRV: Das Absenken des Druckniveaus erfolgt jeweils in der Exspirationsphase eines patienten-getriggerten druckunterstüzten Atemzuges (BIPAP-APRV) → bei Pat. mit respir. Insuffizienz durch diese Beatmungsform gesteigertes AMV, verbesserte CO2-Elimination und Reduktion der Atemfrequenz. ∗ PEEP ♦ Reexpansion teilweise oder völlig verschlossener Gasräume ♦ z. B. im Rahmen eines ARDS schwer geschädigte Lungenareale können durch PEEP weiter geschädigt werden, da sich das maschinell verabreichte Atemvolumen bevorzugt in nicht abhängige Lungenareale mit noch rel. guter Compliance verteilt ♦ „best PEEP“: der PEEP wird nach Auswertung individueller DruckVolumenverhältnise titriert (sehr aufwendig!) - die klin. Erfahrung zeigt aber, daß bei I : E von 1 : 1 selbst bei ausgeprägtem ARDS selten PEEP-Werte > 12 – 15 cm H2O in Hinblick auf einen besseren Gasaustausch notwendig sind 4 „best PEEP“ : Druck-Volumen-Kurve VT • VT sollte in diesem Bereich liegen • PEEP sollte 2 cm H2O überhalb des unteren Umschlagspunktes liegen Atemwegsdruck ∗ permissive Hyperkapnie ♦ die traditionellen Beatmungsformen hatten möglichst normale pulmonale Gasaustauschwerte zum Ziel wobei ein normaler paCO2 und ein normaler pH angestrebt wurden; speziell bei ARDS-Pat. ist zur CO2- Elimination ein erhöhtes AMV notwendig, was jedoch nach neueren Erkenntnissen (s. o.) eher ungünstig ist ♦ deshalb heute Beatmung mit: - kleine VT von 4 – 8 ml/kg - individuell titriertem PEEP („best PEEP“) - niedrigen Beatmungsspitzendrücken (< 35 cm H20) - möglichst niedrige FiO2 (paO2 55 – 60 mmHg) - I : E initial 1 : 1 → 2 : 1, wenn keine ausreichende Besserung der Oxygenierung - f = 12 – 16/Min da insbes. bei schwerem Lungenversagen infolge der Limitierung des PIP und VT eine Normalisierung der paO2-Werte nicht möglich ist spricht man von einer „permissiven Hyperkapnie“ (PHC) ♦ Nebenwirkungen akut aufgetretener Hyperkapnien: − Hypoxie − Hyperkaliämie − Vasodilatation − kardiozirkulatorische Depression − veränderte elektr. Membraneigenschaften mit veränderter Wirkuiing von Medikamenten für die ungünstigen Begleiteffekte der akuten Hyperkapnie ist jedoch nicht der extrazelluläre pH entscheidend, sondern das Ausmaß der intrazellulären Azidose; durch intrazelluläre Pufferung normalisiert sich jedoch der intrazelluläre pH innerhalb von 3 Std. ♦ entwickelt sich eine Hyperkapnie über einen längeren Zeitraum, treten somit die o. a. a. Nebenwirkungen i. d. R. nicht auf ♦ die gute Toleranz der permissiven Hyperkapnie beruht zum großen Teil auf dem schnellen Ausgleich der intrazellulären Azidose – nur in sehr ausgeprägten Fällen (pH < 7,2) sollte eine vorsichtige Pufferung mit NaHCO3 erwogen werden ♦ Kontraindiaktionen der PHC: - Hirnödem und erhöhter intrakranieller Druck (bei unbedingt notwendiger PHC evtl. kontinuierl. Monitoring des intrakraniellen Druckes; hyperkapniebedingte Krampfanfälle treten i. d. R. nur bei extrem hohen paCO2-Werten von 150 – 200 mm Hg, bei vorgeschädigtem Hirn oder Krampfschwellen-senkender Medikation auch früher auf) - wegen kardiodepressiver Wirkung - falls Katecholamine nicht ausreichend sind - evtl. Ausmaß der PHC begrenzen 5 - evtl. cardiale Arrhyhthmien - da die PHC zum Anstieg des pulmonalarteriellen Druckes führt, kann es zu einer Rechtsherzdekompensation kommen ∗ Reduktion des Lungenödems ♦ Flüssigkeitszufuhr ↓ ♦ Diuretika ♦ Hämodialyse / -filtration ♦Zielgrößen: + Hb 14 – 15 g/dl (evtl. Ery-Konz. geben!) + PCWP < 10 mm Hg + ZVD 5 – 8 mm Hg + KOD 25 – 29 mm Hg + Urinausscheidung/h 1 ml/kg KG ♦ Erfolgskontrolle: + Rö-Thorax + Messung des Gasaustausches ∗ Lagerungsmaßnahmen ♦„down with the good lung“: ist für Patienten mit asymmetrischen bilateralen Lungenerkrankungen zu fordern (weil die dann unten liegende gesunde Lunge der Schwerkraft folgend besser durchblutet wird) ♦ bei schwerem ARDS kam es bei Patienten nach 30‘ Bauchlagerung zu einem signifikantem Anstieg des paO2 (> 10 mm Hg: „responder“), der sich nach 2stündiger Bauchlagerung weiter besserte; die Soforteffekte sind durch eine Umverteilung der Perfusion in weniger geschädigte Lungenbezirke und das „Recruitment“ von Kompressionsatelektasen zu erklären ⇒ also alle ARDS-Patienten für eine Testperiode in Bauchlagerung bringen ! - das Abdomen sollte frei durchhängen - auf Augenschutz achten - bei Umlagerung auf den Tubus achten ! ∗ Inhalation von Stickstoffmonixid (NO) ♦ eine Inhalation von NO steigert bei ARDS-Patienten selektiv die Perfusion ventilierter Lungenbezirke; der pulmonalarterielle Druck wird gesenkt, die Oxygenierung verbessert ♦ wegen Bedenken über mögliche toxische Effekte werden derzeit nur kleinstmögliche Dosen eingesetzt, die zu einer Verbesserung der Oxygenierung, aber nicht zum Absenken des pulmonalarteriellen Druckes führen ♦ ob durch die Anwendung von NO die Überlebensrate von ARDS-Pat. gebessert wird, ist noch nicht geklärt ∗ Extrakorporale Membranoxygenierung Durch optimierte Technologie in Europa günstigere Ergebnisse als in den USA 6 • Algorithmus zur Behandlung des ARDS Ablehnung • inkurables Grundleiden • Immunsuppression • ZNS-Schädigung • chron. pulm. Erkrankung • PCW > 18 mm Hg Aufnahme: • ARDS • über 48h paO2 >0,6 und PEEP > 18 mmHg „fast entry“-Kriterien erfüllt: • PaO2/FiO2 < 50 mmHg • PEEP >10 cm H2O für > 2h NEUES BEHANDLUNGSKONZEPT: pcCMV +m PEEP, CO2↑ Lagerungsmaßnahmen, Lungenödem↓ * NO, DLV Evaluationsphase: 24-120h keine Verbesserung Verbesserung „slow entry“-Kriterien erfüllt: • PaO2/FiO2 < 150 mmHg • PEEP > 10 cm H2O • QsQT > 30% • EVLW > 15 ml/kg KG • CTstat < 30ml/cm H2O oder rez. Barotraumen vv-ECMO plus NEUES Behandlungskonzept Nicht erfolgreich verstorben * DLV = seitengetrennte Beatmung Entwöhnung erfolgreich überlebt