IgG - INSTAND eV
Werbung

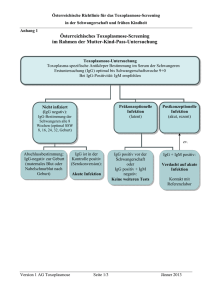
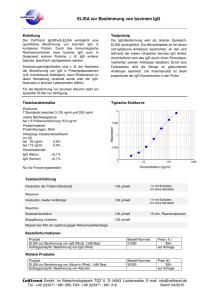
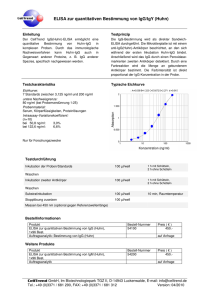
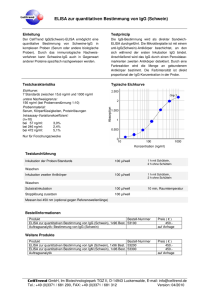
Die Diagnostik der Toxoplasmose. Wo stehen wir? I. Reiter-Owona, A. Hoerauf Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie (IMMIP), Universitätsklinikum Bonn I N S T A N D e. V. Externe Qualitätsk. INSTAND e.V Toxoplasmose-Serologie seit 1985 RV 452, 4 Proben/Jahr 1988: IFAT, DA, KBR, EIA-IgG, EIA-IgM, IIF-,ISAGA- IgM Heute: ► Qual. und quant. Ig IgG IgM IgA andere IgG-Avidität Immer: ► Testinterpretation ► II. Toxoplasma-GenomNachweis (seit 2003) (RV 457, 6 Proben/Jahr) Qual. und quant. Ergebnisse Die Standardisierung und Qualitätskontrolle wird als notwendige Voraussetzung angesehen (Eurotoxo Conference, Bordeaux, 2005) IN S T A N D T o xo pla s m o s e B e s t e he ns quo t e n 19 9 3 - 2 0 0 1 INSTAND Toxoplasmose Bestehensquote 1993-2001 M a xim a l- , M inim a l- und M e dia nwe rt e Maximal-, Minimal- und Medianwerte Neg. Seren Pos. Seren % 100 90 80 70 60 KBR IIF-IgM ISAGA-IgM IIF-Ig EIA-IgM EIA-IgG KBR IIF-IgM ISAGA-IgM IIF-Ig EIA-IgM 40 EIA-IgG 50 Bewertung: qualitativ oder qualitativ und quantitativ? Wenn quantitativ: AK-Klassen/Assay oder AK-Klassen/Assay/Hersteller? Gr. 452 Testsystem IgG 8 ELISA AB AX .... 9 CLIA DO RO ... 10 ELFA .... 13 IFAT Reag.Chargen No Reag. Gerät Gerät Probe x quant. Probe x qual. Probe y quant. Probe y qual. Welche Assays werden von RV-TN eingesetzt ? Anzahl der Teilnehmer RV 452 pro Testverfahren EIA poliv. 9% 10% 24% 14% 7% 7% 4% 2% 6% 2% 2005 61% 2009 IFAT poliv. DA/LA EIA IgG CLIA IgG 54% IFA IgG Der Anteil der als Suchtest geeigneten Assays ist rückläufig bei den RV-TN!! EBM der KBV 2009 1. 2. 3. 4. 32569 Toxoplasma-Antikörper – Suchtest (6.90 EUR) 32570 Toxoplasma-IgM-Antikörper quantitativ nach positivem Suchtest (10.60 EUR) 32571 Toxoplasma-Antikörper quantitativ nach positivem Suchtest (8.30 EUR) 32640 Toxoplasma-IgG-Antikörper Avidität als Abklärungstest nach positiver IgM-AK-Bestimmung (25,90 EUR) Die Bestimmung von Toxo-IgA-AK nach 32571 ist nicht neben der 32640 berechnungsfähig??? Frische Infektionen, 10.-12. SSW 32570 Quant. Bestimmung von Toxo-IgM nach positivem Suchtest 32571 Quant. Bestimmung von Toxo-AK nach positivem Suchtest Tag p.i. x x+14 SFT 1:1000 (+) 1:16000 IFT poliv. 1:64 (+) 1:256 IgG-ELISA 1 O IU/ml 34 IU/ml (+) IgG-ELISA 2 O IU/ml 2-5 IU/ml (-) IgM-ELISA 2.304 Ind. (+) 6.130 Ind. IgM-ISAGA 1:4096 (+) 1:16000 IgG-Avidität nicht messb. ?? IgA-ISAGA negativ ≥1:16000 INSTAND 452/April 09/IgG 300 80 30 (IFAT) 21 RO* DO' 27 BG/SI* ‘ = ELISA, * = CLIA BW' 16 AX' 0 26 2835 138 110 DO* 100 Oh n 153 133 90 AB' IU/ml 200 171 150 50 256 250 250 eB ew er tu ng Meßergebnisse sind assay- und/oder herstellerspezifisch mit Abweichungen bei quantitativen Ergebnissen Probe 31 Probe 32 Hersteller Änderung der EBM ?? 1. 32569 Toxoplasma-Antikörper – IgG- (Such) test (? EUR) 325xx Toxoplasma-Antikörper – IgM- (Such) test (? EUR) (32570 Toxoplasma-IgM-Antikörper quantitativ nach positivem Suchtest (10.60 EUR)) 2. 32571 Toxoplasma-Antikörper IgG quantitativ nach positivem Suchtest (8.30 EUR) 2. 32640 Toxoplasma-IgG-Antikörper Avidität als Abklärungstest nach positiver IgM-AK-Bestimmung (25,90 EUR) Die Bestimmung von Toxo-IgA-AK nach 32571 ist nicht neben der 32640 berechnungsfähig??? eB ew er tu ng Meßergebnisse sind assay- und/oder herstellerspezifisch und zeigen Abweichungen bei qualitativen Ergebnissen (latente Infektion) INSTAND 452/Probe 32/09, IgM-Antikörper qualitativ TN-Ergebnisse Oh n 70 60 negativ grenzwertig positiv Anzahl 50 40 30 20 10 0 ‘ = ELISA, * = CLIA AB' AX' BW' DO' DO* RO* Ungenaue Diagnostik? BG/SI* Hersteller IgG Avidität = entscheidend für Testinterpretation und Therapie 32640 T.-IgG-AK Avidität als Abklärungstest nach positiver IgM-AK-Bestimmung IgG Avidität hoch: Infektion mindestens 2- 4 Monate 40 35 30 Teilnehmer Oh ne B ew ert un g 40 25 20 hoch interm. gering 15 10 10 5 6 2 9 5 3 1 2 0 0 AX DO ER 0 1 VR Hersteller INSTAND-RV 04/08, Infektion > 6 M. Lymphadenitis, immunkomp. Testinterpretation: ►bleibt schwierig bei persistierenden IgM-Antikörpern und einem IgG-Aviditätsbefund, der keine ältere Infektion bestätigt (ca. 5%-10%) ►verlangt ggf. eine multistep-Analyse und Verlaufskontrollen ►Verlaufskontrollen müssen im gleichen Labor (Herstellersystem) erfolgen Ig-/IgG qual.-quant. SpezialLaboratorien: IgA, IB etc, Verlaufskontrollen, PCR ? + IgM qual.qual.-quant. quant. + IgGAvidität Eignen sich Toxoplasmose-Tests zur Vorsorge bei Schwangeren? ► Frische Infektionen können bei Schwangeren durch die zur Zeit verfügbaren Tests nicht zuverlässig entdeckt werden ► Durch die ungenaue Diagnostik würde die mit Nebenwirkungen behaftete Toxopolasmose-Therapie vermutlich einer großen Zahl von Schwangeren falsch und unnötig verordnet werden. ► Es gibt kein einheitliches Vorgehen, wann, in welcher Reihenfolge und welchen zeitlichen Abständen diese Untersuchungen durchgeführt werden sollten. Fazit des mds: Toxoplasmose-Tests sind bei gesunden Schwangeren nicht sinnvoll! Med. Dienst der Spitzenverbände der Krankenkassen e.V. (www.mds-ev.de), Sept. 2003 AOK: Individuelle Gesundheits-Leistungen IGeL - sinnvoll oder überflüssig? Labor A: Toxoplasmose Abrechnungsart 2001 2006 Gesamt: 14014 17868 Kasse 61,2% 38,9% Privat 16,7% 25,5% IGeL 21,8% 35,6% Labor B: Toxoplasmose und Schwangerschaft Tests 2002 2004 2006 Sucht. 858 2066 1900 IgG pos. IgM pos IGeL 27% 26% 24% 2,2% 3,3% 1,8% 36% 29% 27% Auswertungen LISA V-Daten 2005 (AOK-Versicherte, bereichseigen, nach Quartalen differenziert) EBM Ziffer 1770 Betreuung einer Schwangeren Frequenz 2005 2. Quartal 3. Quartal 203.551 209.872 1770+32569 7.103 8.055 1770+32570 4.315 5.259 1770+32571 3.352 3.394 1770+32570 +32571 2.632 3.306 3,4% 3,8% Suchtest Toxo bei SS Wissenschaftliches Institut der AOK (WIdO)" 2005 /Uhlemann Zusammenfassung: ► Ist das diagnostische Prinzip: ein Suchtest (= Goldstandard) noch zeitgemäß? ► Neue Leitsysteme zur Regulierung der zunehmenden Divergenz von quantitativen und qualitativen Testsergebnissen sind wünschenswert = bessere Standardisierung! ► Bei der externen Qualitätskontrolle INSTAND e.V. sollten möglichst die quantitativen Ergebnisse aller Assays bewertet werden. Danksagung: Referenzlaboratorien: Prof. Dr. W. Presber, Charité, Institut f. Mikrobiologie und Hygiene, Abteilung Parasitologie, Berlin Dr. T. Junghanss/Frau H. GehringFeistel Abteilung für Tropenhygiene, Heidelberg Dr. C. P. da Costa, Med. Mikrobiologie TU München Dr. H. Hlobil, Laborärzte Sindelfingen IMMIP, Bonn Sabine Nachtsheim Helene Neufeld Sybille Martin INSTAND ev Düsseldorf