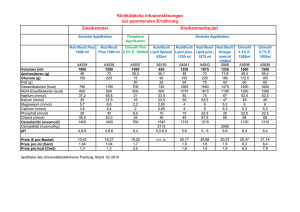
Recormon ® PS
Werbung

Fachinformation des Arzneimittel-Kompendium der Schweiz® Recormon® PS Roche Pharma (Schweiz) AG AMZV Zusammensetzung Wirkstoff: Epoetinum beta (rekombinantes humanes Erythropoetin [rhEPO]: gentechnologisch hergestellt in CHO-Zellen). Hilfsstoffe Recormon PS, Fertigspritze Ureum, natrii chloridum, natrii dihydrogenphosphas, dinatrii phosphas, calcii chloridum, polysorbatum 20 (aus gentechnisch verändertem Mais hergestellt), glycinum, leucinum, isoleucinum, threoninum, acidum glutamicum, phenylalaninum, aqua ad injectabilia. Galenische Form und Wirkstoffmenge pro Einheit Recormon PS 2000 1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 2000 IE entsprechend 16,6 µg Epoetin beta. Excip. q.s. ad solutionem 0,3 ml. Recormon PS 3000 1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 3000 IE entsprechend 24,9 µg Epoetin beta. Excip. q.s. ad solutionem 0,3 ml. Recormon PS 4000 1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 4000 IE entsprechend 33,2 µg Epoetin beta. Excip. q.s. ad solutionem 0,3 ml. Recormon PS 5000 1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 5000 IE entsprechend 41,5 µg Epoetin beta. Excip. q.s. ad solutionem 0,3 ml. Recormon PS 10’000 1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 10’000 IE entsprechend 83 µg Epoetin beta. Excip. q.s. ad solutionem 0,6 ml. Recormon PS 30’000 1 Fertigspritze mit gebrauchsfertiger Injektionslösung enthält 30’000 IE entsprechend 249 µg Epoetin beta. Excip. q.s. ad solutionem 0,6 ml. Indikationen/Anwendungsmöglichkeiten Anämie bei Patienten mit chronischer Nierenerkrankung Behandlung der symptomatischen, transfusionsbedürftigen, renalen Anämie bei chronischer Nierenerkrankung bei dialysierten und nicht dialysierten erwachsenen Patienten und Kindern über 2 Jahre (für Hb-Grenzwerte, siehe «Dosierung/Anwendung»). Tumorpatienten Behandlung der symptomatischen Anämie bei erwachsenen Patienten mit nicht-myeloiden malignen Erkrankungen, die eine Chemotherapie erhalten (für HbGrenzwerte, siehe «Dosierung/Anwendung»). Gewinnung von Eigenblut (Eigenblutspendeprogramm) Steigerung der Menge an Eigenblut bei Patienten, die in ein Eigenblutspendeprogramm zur Vermeidung von Fremdbluttransfusionen einbezogen sind. Die Anwendung in dieser Indikation muss gegenüber dem berichteten erhöhten Risiko für thromboembolische Ereignisse abgewogen werden. Die Behandlung ist bei Patienten mit mässiggradiger Anämie (Hb 10–13 g/dl (6,21–8,07 mmol/l), kein Eisenmangel) indiziert, falls blutsparende Verfahren nicht verfügbar oder unzureichend sind, sofern der geplante grössere chirurgische Eingriff grosse Mengen an Blut erfordert (4 oder mehr Blutkonserven bei Frauen bzw. 5 oder mehr bei Männern) oder die Zeitspanne zu kurz ist, um die benötigte Eigenblutmenge zu gewinnen. Dosierung/Anwendung Eine Therapie mit Recormon sollte von Ärztinnen oder Ärzten eingeleitet werden, die Erfahrung in den oben genannten Indikationen haben. Anämie bei Patienten mit chronischer Nierenerkrankung Patienten sollten engmaschig überwacht werden, um sicherzustellen, dass die niedrigste zugelassene wirksame Dosis von Recormon angewandt wird um die Symptome der Anämie adäquat zu kontrollieren und dabei einen Hämoglobinwert unter oder gleich 12 g/dl (7.5 mmol/l) einzuhalten. RecormonDosissteigerungen bei Patienten mit chronischer Niereninsuffizienz sollten mit Vorsicht erfolgen. Bei Patienten mit schlechtem Ansprechen des Hämoglobinwerts auf Recormon sollten verschiedene Ursachen für das schlechte Ansprechen abgeklärt werden (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»). Die Anämiesymptome und ihre Folgeerscheinungen können sich abhängig von Alter, Geschlecht und allgemeinem Schweregrad der Erkrankung unterscheiden; daher ist eine Beurteilung des klinischen Verlaufs und des Zustandes des jeweiligen Patienten durch eine Ärztin oder einen Arzt erforderlich. Alle Recormon Formulierungen können sowohl subkutan als auch intravenös verabreicht werden, um das Hämoglobin auf einen Wert von maximal 12 g/dl (7,5 mmol) anzuheben. Dabei wird bei subkutaner im Vergleich zu intravenöser Verabreichung das Ziel eines maximalen Hämoglobinwertes von 12 g/dl (7,5 mmol) mit einer um etwa 20–25% geringeren Dosis erreicht. Aufgrund intraindividueller Schwankungen bei den Patienten können gelegentlich einzelne Hämoglobinwerte beobachtet werden, die über oder unter dem erwünschten Hämoglobinspiegel liegen. Derartige Hämoglobin-Schwankungen sollten mittels Anpassung der Dosis ausgeglichen werden, wobei der Hämoglobin-Zielbereich von 10 g/dl (6,2 mmol/l) bis 12 g/dl (7,5 mmol/l) zu berücksichtigen ist. Ein anhaltender Hämoglobinspiegel über 12 g/dl (7,5 mmol/l) sollte vermieden werden; Leitlinien für die richtige Anpassung der Dosis bei Auftreten von Hämoglobinwerten über 12 g/dl (7,5 mmol/l) werden weiter unten beschrieben. Ein Hämoglobin-Anstieg um mehr als 2 g/dl (1,25 mmol/l) innerhalb eines Zeitraums von vier Wochen ist zu vermeiden. Falls es dazu kommt, ist wie vorgesehen eine geeignete Dosisanpassung vorzunehmen. Falls die Anstiegsrate von Hämoglobin 2 g/dl (1,25 mmol/l) in einem Monat überschreitet oder wenn der Hämoglobinspiegel ansteigt und sich dem Grenzwert von 12 g/dl (7,45 mmol/l) nähert, sollte die Dosis um ca. 25% gesenkt werden. Falls der Hämoglobinspiegel weiter ansteigt, sollte die Therapie unterbrochen werden, bis der Hämoglobinspiegel wieder zu sinken beginnt; an diesem Punkt sollte die Therapie mit einer Dosis, die um ca. 25% unter der zuvor verabreichten Dosis liegt, erneut begonnen werden. Zur Aufrechterhaltung des Hämoglobinzielwertes soll sichergestellt werden, dass die niedrigste effektive Dosis zur Kontrolle der Anämie-Symptome von Recormon verwendet wird. Bei Vorliegen einer Hypertonie oder kardiovaskulären, zerebrovaskulären oder peripheren vaskulären Erkrankungen sollten der wöchentliche Hämoglobinanstieg und der Hämoglobin-Zielwert individuell unter Berücksichtigung des klinischen Zustandsbilds ermittelt werden. Die Therapie mit allen Recormon Formulierungen unterteilt sich in zwei Behandlungsphasen: Korrekturphase Subkutane Verabreichung Die Anfangsdosis beträgt 3× 20 IE/kg Körpergewicht pro Woche. Bei nicht ausreichendem Anstieg des Hämoglobinwertes (<0,25 g/dl pro Woche), kann die Dosis in Abständen von 4 Wochen um jeweils 3× 20 IE/kg/Woche erhöht werden. Die wöchentliche Dosierung kann auch auf tägliche Gaben verteilt verabreicht werden. Intravenöse Verabreichung Die Anfangsdosis beträgt 3× 40 IE/kg Körpergewicht pro Woche. Die Dosis kann nach 4 Wochen auf 80 IE/kg Körpergewicht, 3× pro Woche, und, falls erforderlich, in monatlichen Abständen um weitere 20 IE/kg Körpergewicht, 3× pro Woche, erhöht werden. Die maximale Wochendosis sollte unabhängig von der Art der Verabreichung 720 IE/kg Körpergewicht nicht überschreiten. Erhaltungsphase Zur Aufrechterhaltung eines Hämoglobinspiegels zwischen 10–12 g/dl wird die Dosierung zunächst auf 50% der zuletzt eingesetzten Dosis der Seite 1 Fachinformation des Arzneimittel-Kompendium der Schweiz® Korrekturphase reduziert. Anschliessend wird die Dosierung in ein- bis zweiwöchigen Abständen individuell entsprechend dem Bedarf des Patienten eingestellt (Erhaltungsdosis). Die Verabreichung der Erhaltungsdosis kann in einer einmal wöchentlichen subkutanen Gabe oder verteilt auf drei bis sieben Einzeldosen pro Woche erfolgen. Patienten, die in der einmal wöchentlichen Anwendung stabil sind, können auf eine Anwendung alle zwei Wochen umgestellt werden. In diesem Fall können Dosiserhöhungen nötig werden. Erfahrungsgemäss benötigen Patienten mit einem anfänglichen Hämoglobinwert unter 6 g/dl höhere Erhaltungsdosen als solche mit einem höheren anfänglichen Hämoglobinwert. Ein Hämoglobinwert von 12 g/dl sollte nicht überschritten werden. Kinder über 2 Jahre und Jugendliche Klinische Studien mit Kindern und Jugendlichen haben ergeben, dass die Erhaltungsdosis im Mittel bei jüngeren Kindern höher als bei älteren war. Trotzdem wird empfohlen, sich an das angeführte Dosierungsschema zu halten, da die individuelle Ansprechbarkeit nicht vorhersagbar ist. Therapiedauer Die Behandlung mit allen Recormon Formulierungen ist normalerweise eine Langzeittherapie. Die Unterbrechung der Therapie ist möglich und kann jederzeit erfolgen. Tumorpatienten Recormon sollte den Anämiepatienten (z.B. Hämoglobinwert ≤10 g/dl [6,2 mmol/l]) subkutan verabreicht werden. Die Anämiesymptome und ihre Folgeerscheinungen können sich je nach Alter, Geschlecht und allgemeinem Schweregrad der Erkrankung unterscheiden; daher ist eine Beurteilung des klinischen Verlaufs und des Zustands des jeweiligen Patienten durch einen Arzt erforderlich. Die Wochendosis kann in einer einzigen Injektion oder verteilt auf 3 bis 7 Einzeldosen verabreicht werden. Die empfohlene Anfangsdosis beträgt 450 IE/kg Körpergewicht pro Woche. Dabei kann eine fixe Dosis von 30’000 IE einmal pro Woche, basierend auf einem Durchschnittsgewicht der Patienten um 67 kg, bei Patienten ohne grössere Gewichtsabweichungen gegeben werden. Bei ungenügendem Ansprechen mit der Notwendigkeit einer Dosiserhöhung ist aber auf eine gewichtsbezogenen Dosierung zurückzugreifen. Aufgrund intraindividueller Schwankungen bei den Patienten können gelegentlich einzelne Hämoglobinwerte beobachtet werden, die über oder unter dem erwünschten Hämoglobinspiegel liegen. Derartige Hämoglobin-Schwankungen sollten mittels Anpassung der Dosis ausgeglichen werden. Der Hämoglobin Zielbereich liegt zwischen 10 g/dl (6,2 mmol/l) bis 12 g/dl (7,5 mmol/l). Ein anhaltender Hämoglobinspiegel über 12 g/dl (7,5 mmol/l) sollte vermieden werden. Dosisanpassungen Wenn nach 4-wöchiger Therapie der Hämoglobinwert um mindestens 1 g/dl (0,62 mmol/l) gestiegen ist, sollte die derzeitige Dosis beibehalten werden. Die Dosis sollte verdoppelt werden, wenn nach 4 Wochen der Hämoglobinwert nicht um mindestens 1 g/dl (0,62 mmol/l) gestiegen ist. Wenn nach 8-wöchiger Therapie der Hämoglobinwert nicht um mindestens 1 g/dl (0,62 mmol/l) angestiegen ist, ist ein weiterer Therapieerfolg fraglich. Die maximale Dosis von 900 IE/kg Körpergewicht pro Woche sollte nicht überschritten werden. Ist das individuelle Therapieziel eines Patienten erreicht, sollte die Dosis um 25 bis 50% reduziert werden, um diese Hämoglobinkonzentration zu erhalten. Eine entsprechende Dosistitration sollte in Erwägung gezogen werden. Beträgt der Anstieg des Hämoglobinwertes mehr als 2 g/dl (1,3 mmol/l) in 4 Wochen, sollte die Dosis um 25 bis 50% reduziert werden. Falls der Hämoglobinwert 12 g/dl (7,5 mmol/l) überschreitet, sollte die Dosis um ca. 25 bis 50% gesenkt werden. Die Behandlung mit Recormon ist vorübergehend zu unterbrechen, wenn der Hämoglobinspiegel 13 g/dl (8,1 mmol/l) überschreitet. Nachdem der Hämoglobinspiegel wieder auf ≤12 g/dl (7,5 mmol/l) abgesunken ist, sollte die Therapie mit einer Dosis, die um ca. 25% unter der zuvor verabreichten Dosis liegt, erneut begonnen werden. Nach Beendigung der Chemotherapie sollte die Behandlung mit Recormon bis zu 3 Wochen weitergeführt werden. Zur Aufrechterhaltung des Hämoglobinzielwertes soll sichergestellt werden, dass die zur Kontrolle der Anämie-Symptome niedrigste effektive Dosis von Recormon verwendet wird. Gewinnung von Eigenblut (Eigenblutspendeprogramm) Die Recormon-Lösung wird intravenös über zwei Minuten verabreicht. Besteht die Möglichkeit einer Blutspende (Hämatokrit >33 Vol.-%), so ist die Recormon Formulierung nach der Blutabnahme zu applizieren. Ein Hämatokrit von 48 Vol.-% sollte während des gesamten Behandlungszeitraumes nicht überschritten werden. Die individuelle Dosis soll vom behandelnden Arzt in Abhängigkeit von der erforderlichen Menge an zu spendendem Eigenblut und der endogenen Erythrozytenreserve des jeweiligen Patienten ermittelt werden. 1. Die erforderliche Menge an zu spendendem Eigenblut hängt vom erwarteten Blutverlust, dem Einsatz von blutsparenden Massnahmen und dem körperlichen Zustand des Patienten ab. Diese Menge soll so bemessen sein, dass sie ausreicht, homologe Transfusionen zu vermeiden. Sie ist in der Regel identisch mit der Anzahl angeforderter Blutkonserven. Die erforderliche Menge an zu spendendem Eigenblut wird in Einheiten ausgedrückt. Hierbei entspricht eine Einheit 450 ml Vollblut mit einem Hämatokrit von 40%. 2. Die Blutspendefähigkeit des Patienten ist in erster Linie abhängig von seinem Blutvolumen und dem Ausgangshämatokritwert. Diese beiden Variablen bestimmen die endogene Erythrozytenreserve, die wie folgt berechnet wird: Endogene Erythrozytenreserve (ml) = Blutvolumen (ml) × (Hkt-33) : 100. Berechnung des Blutvolumens Männer Blutvolumen (ml) = 44 (ml/kg) × Körpergewicht (kg) + 1600 (ml). Frauen Blutvolumen (ml) = 41 (ml/kg) × Körpergewicht (kg) + 1200 (ml) (Körpergewicht >45 kg). Die Notwendigkeit für eine Behandlung mit einer Recormon Formulierung sowie, falls gegeben, die Einzeldosis wird aus der erforderlichen Menge an zu spendendem Eigenblut und der endogenen Erythrozytenreserve bestimmt (anhand der folgenden Nomogramme). Die so bestimmte Einzeldosis wird zweimal wöchentlich über 4 Wochen verabreicht. Eine maximale Dosis von 1600 IE/kg Körpergewicht/Woche sollte nicht überschritten werden. Spezielle Anweisungen für die Applikation Da in Einzelfällen anaphylaktoide Reaktionen beobachtet wurden, sollte die erste Verabreichung nur unter klinischen Bedingungen und unter Einhaltung einer Nachbeobachtungszeit von mindestens 4 Stunden erfolgen. Anämie bei Patienten mit chronischer Nierenerkrankung Alle Recormon Formulierungen können subkutan oder intravenös verabreicht werden. Bei intravenöser Anwendung von Recormon sollte die Lösung über ca. 2 Minuten injiziert werden, z.B. den Hämodialyse-Patienten über die arteriovenöse Fistel im Anschluss an die Dialyse. Seite 2 Fachinformation des Arzneimittel-Kompendium der Schweiz® Bei nicht hämodialysierten Patienten mit renaler Anämie ist die subkutane Anwendung zu bevorzugen, um die Venen zu schonen. Die subkutane Injektion sollte ebenfalls langsam erfolgen. Dabei sollte nach Möglichkeit nicht mehr als 1 ml Injektionslösung an der gleichen Stelle verabreicht werden, weil bei empfindlichen Patienten lokale Schmerzreaktionen auftreten können. Grössere Volumen sollten an mehreren Stellen injiziert werden, oder die Injektionsnadel sollte intracutan zurückgezogen werden, und die weitere Injektion in eine andere Richtung erfolgen. Sollte die subkutane Verabreichung vom Patienten selbst durchgeführt werden, so muss dieser über die Selbstverabreichung genau aufgeklärt und instruiert werden. Regelmässige Kontrollen durch den Arzt sind notwendig. Bei gleichzeitiger Verabreichung von Eisen ist gegebenenfalls die Dosierung von rhEPO zu reduzieren, um einen zu raschen und zu starken Anstieg des Hämoglobins zu verhindern. Kontraindikationen Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung. Recormon darf bei unbehandelter oder schwer kontrollierbarer Hypertonie nicht eingesetzt werden. Recormon darf zur Gewinnung von Eigenblut (Eigenblutspendeprogramm) nicht angewendet werden bei Patienten, die innerhalb eines Monats vor der Behandlung einen Herzinfarkt oder Schlaganfall erlitten haben, bei Patienten mit instabiler Angina pectoris oder bei Patienten mit einem Risiko für die Entstehung tiefer Venenthrombosen, z.B. solchen Patienten mit bereits bekannten venösen Thromboembolien. Recormon darf während der Schwangerschaft und der Stillzeit sowie bei Kindern, die jünger als zwei Jahre sind, nicht eingesetzt werden, da hierzu bisher noch keine ausreichenden klinischen Erfahrungen vorliegen. Warnhinweise und Vorsichtsmassnahmen Bei Vorliegen einer schweren akuten Anämie, die einer sofortigen Korrektur bedarf, stellte Recormon keinen Ersatz für eine Notfalltransfusion dar. Recormon sollte mit Vorsicht angewendet werden bei refraktärer Anämie mit Blastenexzess in Transformation, bei epileptiformen Erkrankungen, bei Thrombozytose, bei chronischer Leberinsuffizienz und bei ischämischen Gefässerkrankungen. Folsäure-, Vitamin B12- und Eisenmangel sollten ausgeschlossen sein, da hierdurch die Wirksamkeit von Recormon vermindert wird. Patienten mit chronischer Niereninsuffizienz Recormon-Dosissteigerungen bei Patienten mit chronischer Niereninsuffizienz sollten mit Vorsicht erfolgen, da hohe kumulative Epoetin-Dosen mit einem erhöhten Mortalitätsrisiko, schweren kardiovaskulären und cerebrovaskulären Ereignissen assoziiert sein können. Bei Patienten mit schlechtem Ansprechen des Hämoglobinwerts auf Epoetine sollten verschiedene Ursachen für das schlechte Ansprechen abgeklärt werden(siehe Abschnitte «Dosierung/Anwendung» und «Eigenschaften/Wirkungen»). Untersuchungen Um eine wirksame Erythropoese sicherzustellen, sollte bei allen Patienten vor und während der Behandlung der Eisenwert bestimmt werden und gegebenenfalls eine Eisenersatztherapie gemäss den therapeutischen Richtlinien durchgeführt werden. Die Wirksamkeit von Recormon kann durch eine Aluminiumüberladung infolge der Therapie der chronischen Nierenerkrankung oder durch andere Ursachen einer Anämie, wie z.B. okkulten Blutverlust, hämatologische Krankheiten (z.B. Thalassämie, Myelodysplasien), Osteitis fibrosa cystica abgeschwächt werden. Serum-Kaliumspiegel sollten während der Behandlung mit Recormon regelmässig überprüft werden. Erhöhte Kaliumspiegel wurden bei einigen urämischen Patienten unter einer Behandlung mit Recormon berichtet, ohne dass ein kausaler Zusammenhang gezeigt wurde. Sollten erhöhte oder ansteigende Kaliumspiegel beobachtet werden, dann sollte eine Unterbrechung der Behandlung mit Recormon in Betracht gezogen werden, bis die Hyperkaliämie korrigiert ist. Nephrosklerose Die Anwendung von Recormon bei Prädialyse-Patienten mit Nephrosklerose sollte individuell entschieden werden, da eine beschleunigte Progression der Niereninsuffizienz bei diesen Patienten nicht mit Sicherheit ausgeschlossen werden kann. Fehlendes Ansprechen In Verbindung mit einer Therapie mit ESA, einschliesslich der Gabe von Recormon, wurde über eine durch neutralisierende Antikörper gegen Erythropoietin hervorgerufene Erythroblastopenie (PRCA = pure red cell aplasia) berichtet. Für diese Antikörper konnte eine Kreuzreaktivität mit allen erythropoietischen Proteinen gezeigt werden. Patienten, bei denen der Verdacht auf neutralisierende Antikörper gegen Erythropoietin besteht oder bei denen diese nachgewiesen wurden, sollen nicht auf Recormon umgestellt werden (siehe «Unerwünschte Wirkungen»). Blutdruck Bei Patienten mit chronischer Nierenerkrankung und bei Krebspatienten kann eine Erhöhung des Blutdrucks erfolgen bzw. die Verstärkung einer bereits bestehenden Hypertension auftreten, insbesondere in Fällen eines schnellen Hämatokrit-Anstiegs. Diese Blutdruckerhöhungen lassen sich medikamentös behandeln. Wenn der Blutdruckanstieg nicht durch medikamentöse Therapie kontrolliert werden kann, wird eine vorübergehende Unterbrechung der Therapie mit Recormon empfohlen. Insbesondere zu Beginn der Behandlung wird darüber hinaus eine regelmässige Blutdruckkontrolle empfohlen, auch zwischen den Dialysen. Eine hypertonische Krise mit Enzephalopathie-ähnlicher Symptomatik kann vereinzelt auftreten, auch mit Patienten mit initial normalem oder niedrigem Blutdruck, die eine sofortige ärztliche Untersuchung und intensivmedizinische Massnahmen erfordert. Plötzlich auftretende stechende migräneartige Kopfschmerzen sind als mögliches Warnzeichen besonders zu beachten (siehe «Unerwünschte Wirkungen»). Thrombozyten Bei Patienten mit chronischer Nierenerkrankung kann es insbesondere bei intravenöser Anwendung zu einem mässiggradigen dosisabhängigen Anstieg der Thrombozytenzahl innerhalb des Normbereiches kommen, der im Verlauf der Therapie wieder zurückgeht. Es wird empfohlen, die Thrombozytenzahl in den ersten 8 Wochen der Therapie regelmässig zu kontrollieren. Erhaltungs-Hämoglobinkonzentration Bei Patienten mit chronischer Nierenerkrankung sollte die Erhaltungs-Hämoglobinkonzentration die unter Dosierung/Anwendung empfohlene obere Grenze der Hämoglobin-Zielkonzentration nicht überschreiten. In klinischen Studien wurde bei der Anwendung von Erythropoese stimulierenden Wirkstoffen (ESAs) zur Erzielung eines Hämoglobin-Zielwerts über 12 g/dl (7,5 mmol/l) ein erhöhtes Risiko für Todesfälle und schwerwiegende kardiovaskuläre Ereignisse beobachtet. Kontrollierte klinische Studien zeigten keine signifikanten Vorteile, wenn die Hämoglobin-Konzentration über das für die Beherrschung der Anämiesymptome und zur Vermeidung einer Bluttransfusion erforderliche Mass hinaus erhöht wurde. Krebspatienten ESAs sind Wachstumsfaktoren, welche in erster Linie die Produktion von roten Blutkörperchen stimulieren. Erythropoietin-Rezeptoren können auf der Oberfläche verschiedenster Tumorzellen gebildet werden. Wie bei allen Wachstumsfaktoren besteht die Vermutung, dass auch ESAs das Wachstum von Tumoren stimulieren könnten. In mehreren kontrollierten Studien konnte kein Nachweis für eine Veränderung des Gesamtüberlebens oder des Risikos für eine Tumorprogression bei Patienten mit krebsbedingter Anämie erbracht werden. In kontrollierten klinischen Studien wurden bei der Anwendung von Recormon und anderen ESAs folgende Beobachtungen gemacht: Eine kürzere Zeit bis zur Tumorprogression bei Patienten mit fortgeschrittenen Kopf-und-Hals-Tumoren, die eine Strahlentherapie erhielten, wenn die Verabreichung bis zum Erreichen eines Hämoglobin-Zielwertes über 14 g/dl (8,7 mmol/l) erfolgte. Ein kürzeres Gesamtüberleben und mehr Todesfälle, die auf die Krankheitsprogression zurückzuführen waren, nach 4 Monaten bei Patientinnen mit metastasierendem Brustkrebs, die eine Chemotherapie erhielten, wenn die Verabreichung bis zum Erreichen eines Hämoglobin-Zielwertes von 12–14 g/dl (7,5–8,7 mmol/l) erfolgte. Ein höheres Todesrisiko bei Verabreichung bis zu einem Hämoglobin-Zielwert von 12 g/dl (7,5 mmol/l) bei Patienten mit aktiven malignen Erkrankungen, die weder eine Chemotherapie noch eine Strahlentherapie erhielten. ESAs sind zur Anwendung bei dieser Patientenpopulation nicht angezeigt. Thrombozytenzahl und Hämoglobinkonzentration sollten bei Krebspatienten in regelmässigen Abständen überprüft werden. Vor dem Einsatz von Epoetin-Präparaten bei symptomatischen anämischen Tumor-Patientinnen und -Patienten unter myelosuppressiver Chemotherapie, sollte eine sorgfältige individuelle Evaluation des Nutzen/Risiko-Verhältnisses, unter besonderer Berücksichtigung der Prognose in Absprache mit der Patientin/dem Patienten erfolgen. Bei kurativer Therapie sollen Epoetin-Präparate nicht eingesetzt werden. Heparin Bei Patienten mit chronischer Nierenerkrankung ist im Verlauf der Therapie mit Recormon aufgrund des gesteigerten Hämatokritwertes häufig eine Erhöhung der Heparin-Dosis während der Hämodialyse notwendig. Bei nicht optimaler Heparinisierung ist ein Verschluss des Dialyse-Systems möglich. Besonders bei Patienten, die zu hypotonen Reaktionen neigen oder deren arteriovenöse Fisteln Komplikationen (z.B. Stenosen, Aneurysmen o.ä.) aufweisen, können Shunt-Thrombosen auftreten. Eine frühzeitige Shunt-Revision und auch eine Thrombose-Prophylaxe durch Gabe von z.B. Acetylsalicylsäure wird bei diesen Patienten empfohlen. Seite 3 Fachinformation des Arzneimittel-Kompendium der Schweiz® Die Erfahrung der Anämiebehandlung mit Recormon bei multiplem Myelom, non-Hodgkin-Lymphom und chronischer lymphatischer Leukämie ist beschränkt auf erwachsene Patienten. Eigenblutspende Bei Patienten in einem Eigenblutspendeprogramm kann es zu einem Anstieg der Thrombozytenzahl, in der Regel innerhalb des Normbereiches, kommen. Es wird daher empfohlen, die Thrombozytenzahl mindestens einmal wöchentlich zu kontrollieren. Beträgt die Steigerung mehr als 150× 109/l oder liegt die Thrombozytenzahl über dem Normbereich, sollte die Therapie mit Recormon abgebrochen werden. Für den Einsatz von Recormon im Rahmen der Eigenblutspende müssen die offiziellen Richtlinien zur Blutspende berücksichtigt werden, insbesondere: Patienten mit einem Hämatokritwert von >33 Vol.-% (Hämoglobinwert >11 g/dl [6,83 mmol/l]) dürfen Blut spenden. Patienten mit einem Körpergewicht unter 50 kg sollten besonders sorgfältig beobachtet werden. Das Volumen einer einzelnen Blutspende sollte nicht grösser sein als ca. 12% des Blutvolumens des Patienten. Phenylalanin Recormon enthält Phenylalanin als Hilfsstoff. Dieses sollte bei Patienten mit schweren Formen der Phenylketonurie berücksichtigt werden. Missbrauch Missbrauch von Gesunden (z.B. für Dopingzwecke) kann zu einem übermässigen Anstieg des Hämatokritwertes führen. Dies ist mit dem Risiko lebensbedrohlicher Komplikationen des Herz-Kreislauf-Systems (Thromboserisiko durch Hämokonzentration bei Polyglobulie) verbunden. Interaktionen Die erythropoetische Wirkung von rhEPO kann durch gleichzeitige Anwendung von hämatopoetisch wirksamen Substanzen, wie z.B. Ferrosulfat, Cyanocobalamin und Folsäure, verstärkt werden, wenn ein Mangelzustand besteht. Bei Aluminiumintoxikation oder Infektionen kann die Wirkung von Recormon verzögert oder abgeschwächt auftreten. Durch die mittels Recormon erzielte Erhöhung der Hämoglobinkonzentration können Substanzen gegen Angina pectoris in ihrer Wirkung verstärkt werden. Die Wirkung gleichzeitig verabreichter Antihypertensiva kann reduziert sein. Bei gleichzeitiger antikonvulsiver Therapie kann es zu einer Erhöhung der Krampfneigung kommen. Weil Ciclosporin A an Erythrozyten gebunden wird, ist eine potentielle Interaktion mit Ciclosporin A gegeben. Dabei sollte bei gleichzeitiger Gabe von Ciclosporin A und Recormon die Konzentration von Ciclosporin A im Blut bestimmt werden. Gegebenenfalls ist die Ciclosporin-A-Dosierung anzupassen. Untersuchungen am Tier haben gezeigt, dass Recormon die Knochenmarkstoxizität bezüglich Neutrophilen und Thrombozyten von Zytostatika wie Etoposid, Cisplatin, Cyclophosphamid, Fluorouracil nicht erhöht. Schwangerschaft/Stillzeit Reproduktionstudien bei Tieren haben keine Risiken für die Feten gezeigt, aber man verfügt über keine Studien bei schwangeren Frauen. Aufgrund fehlender Studien bei schwangeren oder stillenden Frauen ist Recormon während der Schwangerschaft und Stillzeit kontraindiziert (siehe «Kontraindikationen»). Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen Es wurden keine Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen beobachtet. Unerwünschte Wirkungen Folgende unerwünschte Wirkungen wurden beobachtet: Anämie bei Patienten mit chronischer Nierenerkrankung Die häufigste Nebenwirkung (21,9%) unter der Therapie mit Recormon ist eine dosisabhängige Erhöhung des Blutdrucks bzw. die Verstärkung einer bereits bestehenden Hypertonie, insbesondere in Fällen eines schnellen Hämoglobin-Anstiegs (siehe «Warnhinweise und Vorsichtsmassnahmen»). Vereinzelt können auch bei Patienten mit initial normalem oder niedrigem Blutdruck, hypertensiven Krisen mit Enzephalopathie-ähnlicher Symptomatik (z.B. Kopfschmerzen, Verwirrtheitszustände, sensomotorische Störungen – wie Sprachstörungen, Gangstörungen usw. – bis hin zu generalisiert tonisch-klonischen Krämpfen) auftreten (siehe «Warnhinweise und Vorsichtsmassnahmen»). Shunt-Thrombosen können auftreten, insbesondere bei Patienten, die zu hypotonen Reaktionen neigen oder deren arteriovenöse Fisteln Komplikationen (z.B. Stenosen, Aneurysmen) aufweisen (siehe «Warnhinweise und Vorsichtsmassnahmen»). Parallel zum Anstieg des Hämatokritwertes kommt es in den meisten Fällen zu einer Abnahme der Serum-Ferritin-Werte (siehe «Warnhinweise und Vorsichtsmassnahmen»). Weiterhin wurde vereinzelt eine vorübergehende Erhöhung des Kalium- und Phosphat-Spiegels beobachtet (siehe «Warnhinweise und Vorsichtsmassnahmen»). Insbesondere bei intravenöser Anwendung von Recormon kann es zu einem mässiggradigen, dosisabhängigen Anstieg der Thrombozytenzahl innerhalb des Normbereiches kommen, der im Verlauf der Therapie wieder zurückgeht. Die Entwicklung einer Thrombozytose ist sehr selten (siehe «Warnhinweise und Vorsichtsmassnahmen»). In sehr seltenen Fällen traten bei Patienten mit chronischem Nierenversagen unter Therapie mit rhEPO neutralisierende Anti-Erythropoietin-Antikörper mit oder ohne Erythroblastopenie (PRCA) auf. Im Falle einer diagnostizierten PRCA muss die Epoetin-Therapie abgesetzt werden. Die Patienten sollten keinesfalls auf ein anderes ESA umgestellt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die Häufigkeiten von Nebenwirkungen aus klinischen Studien in Verbindung mit der Recormon Behandlung sind in der nachfolgenden Tabelle aufgeführt. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben. Gefässe Häufig (≥1%, <10%): Bluthochdruck. Gelegentlich (≥0,1%, <1%): Hypertensive Krise. Nervensystem Häufig (≥1%, <10%): Kopfschmerzen. Blut und Lymphsystem Selten (≥0,01%, <0,1%): Shunt-Thrombose. Sehr selten (<0,01%): Thrombozytose. Tumorpatienten Kopfschmerzen und Bluthochdruck bedingt durch eine Behandlung mit Epoetin beta, die medikamentös behandelt werden können, wurden bei 1–10% der Fälle beobachtet (siehe «Warnhinweise und Vorsichtsmassnahmen»). Bei einigen Patienten wurde eine Abnahme der Serum-Eisen-Parameter beobachtet (siehe «Warnhinweise und Vorsichtsmassnahmen»). In klinischen Studien bei Patienten wurde ein leicht vermehrtes Auftreten thromboembolischer Ereignisse beobachtet bei mit Recormon behandelten Krebspatienten im Vergleich zu unbehandelten Kontroll- oder Placebo-Patienten. Bei Patienten, die mit Recormon behandelt wurden, traten diese Ereignisse in 7% der Fälle auf im Vergleich zu 4% bei den Kontroll-Patienten; verglichen mit der Kontrollgruppe ist dies jedoch nicht verbunden mit einem Anstieg der Mortalität aufgrund thromboembolischer Ereignisse. Die Häufigkeiten von Nebenwirkungen aus klinischen Studien in Verbindung mit der Recormon Behandlung sind in der nachfolgenden Tabelle aufgeführt. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben. Gefässe Häufig (≥1%, <10%): Bluthochdruck. Blut und Lymphsystem Häufig (≥1%, <10%): Thromboembolische Ereignisse. Nervensystem Häufig (≥1%, <10%): Kopfschmerzen. Gewinnung von Eigenblut (Eigenblutspendeprogramm) Bei Patienten in einem Eigenblutspendeprogramm wurde über eine leichte Zunahme von thromboembolischen Ereignissen berichtet. Ein kausaler Zusammenhang mit der Recormon Behandlung konnte jedoch nicht gezeigt werden. In Placebo-kontrollierten Studien war ein zeitweiser Eisenmangel bei mit Recormon behandelten Patienten ausgeprägter als in der Kontrollgruppe (siehe «Warnhinweise und Vorsichtsmassnahmen»). Seite 4 Fachinformation des Arzneimittel-Kompendium der Schweiz® Die Häufigkeiten von Nebenwirkungen aus klinischen Studien in Verbindung mit der Recormon Behandlung sind in der nachfolgenden Tabelle aufgeführt. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben. Nervensystem Häufig (≥1%, <10%): Kopfschmerzen. Alle Indikationen Selten (≥0,01%, <0,1%) kann es zu Hautreaktionen wie Ausschlag, Juckreiz, Nesselsucht oder Reaktionen an der Injektionsstelle kommen. In sehr seltenen Fällen (<0,01%) wurde in Verbindung mit einer Epoetin beta-Behandlung über anaphylaktoide Reaktionen berichtet. In kontrollierten klinischen Studien ergab sich jedoch kein Hinweis auf ein vermehrtes Auftreten von Überempfindlichkeitsreaktionen. In sehr seltenen Fällen (<0,01%) wurden insbesondere zu Beginn der Behandlung Grippe-ähnliche Symptome wie Fieber, Frösteln, Kopfschmerzen, Gliederschmerzen, Unwohlsein und/oder Knochenschmerzen berichtet. Diese Reaktionen waren mild bis mässiggradig und verschwanden nach wenigen Stunden oder Tagen. Überdosierung Das Ansprechen auf rhEPO ist dosisabhängig und individuell unterschiedlich. Von einer einmalig verabreichten Überdosis sind keine unerwünschten Wirkungen zu erwarten, doch kann eine wiederholte Überdosierung zu Hypertonie und Polyglobulie führen. Eigenschaften/Wirkungen ATC-Code: B03XA01 Wirkungsmechanismus/Pharmakodynamik Rekombinantes, humanes Erythropoetin (rhEPO) ist ein gereinigtes Glykoprotein, welches die Erythropoese stimuliert. Das gentechnologisch gewonnene Epoetin beta ist in seiner Aminosäure- und Kohlenhydrat-Zusammensetzung identisch mit Erythropoetin, das aus dem Urin anämischer Patienten isoliert wurde. Rekombinantes humanes Erythropoetin (rhEPO) hat ein Molekulargewicht von 32’000–40’000 Dalton. Der Proteinanteil des Moleküls beträgt ca. 58% und besteht aus 165 Aminosäuren. Die vier Kohlehydratketten sind über drei N-glykosidische und eine O-glykosidische Bindung mit dem Protein verknüpft. Erythropoetin wird bei gesunden Menschen von der Niere gebildet und entsprechend dem Grad der Sauerstoffsättigung der Gewebe in die Blutbahn abgegeben. Mit dem Blut gelangt Erythropoetin zum Zielorgan, dem Knochenmark. Bei therapeutischer Verabreichung von rhEPO an anämischen Patienten beginnt der Anstieg des Hämoglobins im Allgemeinen 2–6 Wochen nach dem Beginn der Behandlung. Bei Kindern konnte bisher nicht nachgewiesen werden, dass dabei auch das retardierte Wachstum beschleunigt wird. Studien bei Krebspatienten Erythropoietin ist ein Wachstumsfaktor, welcher in erster Linie die Produktion von roten Blutkörperchen stimuliert. Erythropoietin-Rezeptoren können auf der Oberfläche verschiedenster Tumorzellen gebildet werden. Die Überlebensdauer und die Tumorprogression wurden in fünf grossen kontrollierten Studien mit insgesamt 2833 Patienten untersucht. Vier dieser Studien waren doppelblinde, placebokontrollierte Studien, in einem Fall handelte es sich um eine offene Studie. Zwei Studien rekrutierten Patienten, die eine Chemotherapie erhielten. Die Hämoglobin-Zielkonzentration betrug in zwei Studien >13 g/dl; in den anderen drei Studien betrug sie 12–14 g/dl. In der offenen Studie gab es bezüglich des Gesamtüberlebens keinen Unterschied zwischen den Patienten, die mit einem ESA behandelt wurden, und den Kontrollen. In den vier placebokontrollierten Studien betrug die Hazard Ratio für das Gesamtüberleben 1,25 bis 2,47 zugunsten der Kontrollen. Diese Studien zeigten gegenüber den Kontrollgruppen einen durchgehenden, ungeklärten, statistisch signifikanten Anstieg der Mortalität bei den Patienten, die eine Anämie im Zusammenhang mit verschiedenen häufigen Karzinomen aufwiesen und ein ESA erhielten. Das Resultat des Gesamtüberlebens in den Studien liess sich durch Unterschiede in der Inzidenz von Thrombosen und damit zusammenhängenden Komplikationen zwischen den Patienten, die ein ESA erhielten und den Patienten in den Kontrollgruppen nicht zufriedenstellend erklären. Eine Metaanalyse (basiert auf individuellen Patienten Werten), die Daten aus allen 12 kontrollierten klinischen Studien an anämischen Krebspatienten umfasste, die mit Recormon durchgeführt wurden (n= 2301), zeigte eine Punktschätzung für die Hazard Ratio des Gesamtüberlebens von 1,13 zugunsten der Kontrollen (95% KI: 0,87, 1,46). Bei Patienten mit einem Hämoglobin-Ausgangswert von ≤10 g/dl (n= 899) betrug die Punktschätzung für die Hazard Ratio des Überlebens 0,98 (95% KI: 0,68 bis 1,40). In der Gesamtpopulation wurde ein erhöhtes relatives Risiko für thromboembolische Ereignisse beobachtet (RR 1,62, 95% KI: 1,13; 2,31). Es wurde eine systematische Überprüfung von mehr als 9000 Krebspatienten vorgenommen, die an 57 klinischen Studien teilnahmen. Eine Metaanalyse der Daten für das Gesamtüberleben ergab eine Punktschätzung für die Hazard Ratio des Gesamtüberlebens von 1,08 zugunsten der Kontrollen (95% KI: 0,99; 1,18; 42 Studien und 8167 Patienten). Ein erhöhtes relatives Risiko für thromboembolische Ereignisse (RR 1,67, 95% KI: 1,35; 2,06, 35 Studien und 6769 Patienten) wurde bei Patienten beobachtet, die mit einem ESA behandelt wurden. Es gibt daher eine einheitliche Evidenz, die darauf schliessen lässt, dass Krebspatienten, die mit einem ESA behandelt werden, keine Vorteile bezüglich Gesamtüberleben haben. Das Ausmass, in dem diese Ergebnisse auf Krebspatienten unter einer Chemotherapie zutreffen könnten, die ein ESA zur Etablierung eines Hämoglobinwertes von weniger als 13 g/dl erhalten, ist unklar, da das überprüfte Datenmaterial nur wenige Patienten mit diesen Merkmalen enthielt. Die Wirksamkeit von Recormon bei Patienten mit multiplem Myelom, niedrig-malignem Non-Hodgkin-Lymphom oder chronisch lymphatischer Leukämie wurde bei Patienten mit einem relativen Erythropoetinmangel belegt, welche wie folgt definiert war: Serum-Erythropoietin-Spiegel ≤100 mE/ml bei einem Hämoglobinwert von >9 bis <10 g/dl (>5,58 bis <6,2 mmol/l). Serum-Erythropoietin-Spiegel ≤180 mE/ml bei einem Hämoglobinwert von >8 bis <9 g/dl (>4,96 bis <5,58 mmol/l). Serum-Erythropoietin-Spiegel ≤300 mE/ml bei einem Hämoglobinwert von ≤8 g/dl (≤4,96 mmol/l). Studien bei CRF-Patienten In einer randomisierten Studie (CREATE) mit Epoetin beta an 603 Patienten mit renaler Anämie wurde in der Gruppe mit Normalisierung der Hämoglobinwerte auf 13 und 15 g/dl im Vergleich zur Gruppe mit niedrigeren Zielwerten von 10,5–11,5 g/dl eine Tendenz zu erhöhten kardiovaskulären Ereignissen beobachtet, die aber nicht statistisch signifikant war (58 vs. 47 Fälle, p= 0,20). Die Häufigkeit thromboembolischer Ereignisse war 11,3% bei Patienten, die mit den höheren Hämoglobin-Zielwerten (13–15 g/dl) behandelt wurden, gegenüber 7,3% bei Patienten mit einem niedrigerem Hämoglobinzielwert (10,5–12,5 g/dl) (p= 0,06). Die Rate von Thrombosen des arteriovenösen Zugangs bei den Patienten, die einer Dialyse zugeführt wurden war bei höheren Hämoglobinzielwerten ebenfalls höher (4% gegenüber 3%) (p= 0,42). Die Zeit bis zum Beginn einer Dialyse war in der Gruppe mit höheren Hämoglobin-Zielwerten verkürzt (p= 0,034), obwohl keine Unterschiede in der medianen Kreatinin-Clearance festgestellt werden konnten. Insgesamt sprechen diese Resultate jedoch eher für eine partielle Korrektur als für eine routinemässige Normalisierung des Hämoglobins mit Recormon. In einer randomisierten Studie mit Epoetin alpha bei Prädialyse-Patienten (CHOIR), in der 1432 Patienten in einem Studienarm mit hohem HämoglobinZielwert von 13,5 g/dl oder einem solchen mit tiefem Hämoglobin-Zielwert von 11,5 g/dl zugeteilt wurden, gab es in der Gruppe mit höheren Hämoglobinwerten signifikant mehr kardiovaskuläre Ereignisse als in derjenigen mit tieferen Hämoglobin-Zielwerten (17% gegenüber 14%; 125 bzw. 97 Fälle; p= 0,03). Die Häufigkeit thromboembolischer Ereignisse betrug im Studienarm mit hohem Hämoglobin 18% und in demjenigen mit tiefem Hämoglobin 17% (p= 0,65). Zusammenfassende Post-hoc-Analysen von klinischen Sudien mit Erythropoese-stimulierenden Wirkstoffen (ESAs) wurden bei Patienten mit chronischer Niereninsuffizienz (dialysepflichtigen Patienten, Diabetikern und nicht-Diabetikern) durchgeführt. Mit höheren kumulativen ESA-Dosen wurde, unabhängig vom Diabetes- oder Dialyse-Status, ein Trend zu erhöhten Risikoereigniswahrscheinlichkeiten für Gesamtmortalität, kardiovaskuläre und cerebrovaskuläre Ereignisse beobachtet (siehe Abschnitte «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»). Pharmakokinetik Absorption Nach subkutaner Gabe von Epoetin beta bei urämischen Patienten führte die verzögerte Aufnahme aus dem Gewebe zu einem plateauartigen Verlauf der Serumkonzentration. Maximale Konzentrationen wurden im Mittel nach 12 bis 28 Stunden erreicht. Es besteht keine direkte Beziehung zwischen Serumkonzentration von rhEPO und seiner therapeutischen Wirkung. Die Bioverfügbarkeit von Epoetin beta nach subkutaner Gabe liegt zwischen 23 und 42% im Vergleich zur intravenösen Gabe. Distribution Das Verteilungsvolumen entspricht etwa dem Ein- bis Zweifachen des Plasmavolumens. Es ist nicht bekannt, ob rhEPO die Plazentaschranke passiert oder in die Muttermilch übertritt, doch passiert es die Blut-Hirn-Schranke nicht. Elimination Die pharmakokinetischen Untersuchungen an gesunden Probanden und urämischen Patienten zeigen, dass die Halbwertszeit von intravenös verabreichtem Seite 5 Fachinformation des Arzneimittel-Kompendium der Schweiz® Epoetin beta zwischen 4 und 12 Stunden liegt. Die terminale Halbwertszeit nach subkutaner Applikation ist länger als bei der i.v. Applikation und beträgt durchschnittlich 13 bis 28 Stunden. Präklinische Daten Karzinogenität Epoetin beta beeinflusst weder die Proliferation von nicht-hämatologischen normalen oder malignen Zelllinien in vitro noch die von transplantierbaren «Modelltumoren» in vivo. Ergebnisse einer Karzinogenitätsstudie mit homologem Erythropoietin bei Mäusen ergaben keine Hinweise auf ein proliveratives oder tumorigenes Potential. Mutagenität In der Mutagenitätsprüfung nach Ames, im Micronucleus-Test, im in vitro HGPRT-Punktmutationstest sowie im Chromosomen-Aberrationstest an kultivierten menschlichen Lymphozyten erwies sich Epoetin beta als nicht genotoxisch. Reproduktionstoxikologie Studien an Ratten und Kaninchen erbrachten keinen Hinweis auf embryotoxische, fetotoxische oder teratogene Eigenschaften. Fertilitätsstörungen wurden nicht beobachtet. Eine peri-postnatale Toxizitätsstudie zeigte keine schädlichen Auswirkungen auf die Schwangerschaft und Laktation der Muttertiere sowie die prä- und postnatale Entwicklung der Nachkommen. Sonstige Hinweise Inkompatibilitäten Um einen Wirkungsverlust auszuschliessen, sind folgende Hinweise zu beachten: Kein anderes Lösungsmittel verwenden! Nicht mit anderen Arzneimitteln oder Infusionslösungen mischen. Zur Injektion oder Kurzzeitinfusion nur das beigefügte Kunststoffmaterial verwenden! Haltbarkeit Das Arzneimittel darf nur bis zu dem auf der Verpackung mit «EXP» bezeichneten Datum verwendet werden. Besondere Lagerungshinweise Die Recormon Fertigspritzen vor Licht geschützt in der verschlossenen Originalverpackung bei einer Temperatur zwischen 2–8 °C (im Kühlschrank) lagern. Die Kühlkette darf nicht unterbrochen werden. Die Lagerung von Recormon PS muss bei der Lieferfirma, dem Grossisten und dem Apotheker ständig im Kühlschrank (2–8 °C) gelagert werden. Auch der Patient muss das Präparat ständig im Kühlschrank (2–8 °C) lagern. Im Rahmen der ambulanten Behandlung kann das Präparat einmalig für einen Zeitraum von maximal 3 Tagen ausserhalb des Kühlschranks bei Raumtemperatur (nicht über 25 °C) gelagert werden. Hinweise für die Handhabung Spezielle Anweisungen für die Applikation Recormon PS Fertigspritzen sind gebrauchsfertig. Es dürfen nur Lösungen injiziert werden, die klar oder leicht opaleszent, farblos und frei von sichtbaren Partikeln sind. Recormon PS Fertigspritzen sind sterile, jedoch nicht konservierte Produkte. Es darf keinesfalls mehr als 1 Dosis je Fertigspritze verabreicht werden. Anleitung zur Zubereitung und Injektion der Recormon PS Fertigspritzen Für die Anwendung der Recormon PS Fertigspritzen siehe Gebrauchsanweisung am Ende der Patienteninformation. Zulassungsnummer 54766 (Swissmedic). Zulassungsinhaberin Roche Pharma (Schweiz) AG, 4153 Reinach. Stand der Information Januar 2017. Packungen Menge CHF Abgabekat. Rückerstattungskat. RECORMON PS Inj Lös 2000 E/0.3ml Fertigspritze 6 Stk 166.70 A SL (LIM) RECORMON PS Inj Lös 3000 E/0.3ml Fertigspritze 6 Stk 241.80 A SL (LIM) RECORMON PS Inj Lös 4000 E/0.3ml Fertigspritze 6 Stk 316.95 A SL (LIM) RECORMON PS Inj Lös 5000 E/0.3ml Fertigspritze 6 Stk 392.10 A SL (LIM) RECORMON PS Inj Lös 10000 E/0.6ml Fertigspritze 6 Stk 738.50 A SL (LIM) RECORMON PS Inj Lös 30000 E/0.6ml Fertigspritze 4 Stk 1441.20 A SL (LIM) Beschreibung mit Kanülen 27 G½ Publiziert am 10.02.2017 Seite 6