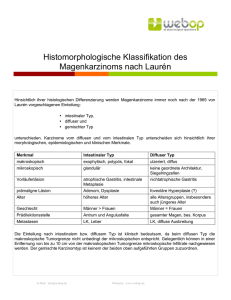
INAUGURAL DISSERTATION Birte Vogel
Werbung

Aus dem Universitätsklinikum Münster Klinik und Poliklinik für Allgemeine Chirurgie - Direktor: Univ.-Prof. Dr. N. Senninger - Therapie des Magenkarzinoms im Wandel der Zeit (1881 - 2000) INAUGURAL-DISSERTATION zur Erlangung des doctor medicinae der Medizinischen Fakultät der Westfälischen Wilhelms-Universität Münster vorgelegt von Birte Vogel aus Simmern 2004 Gedruckt mit Genehmigung der Medizinischen Fakultät der Westfälischen WilhelmsUniversität Münster Dekan: Univ.-Prof. Dr. H. Jürgens 1. Berichterstatter: Univ.-Prof. Dr. N. Senninger 2. Berichterstatter: Univ.-Prof. Dr. J. Kienast Tag der mündlichen Prüfung: 25. 03 2004 Aus dem Universitätsklinikum Münster Klinik und Poliklinik für Allgemeine Chirurgie - Direktor: Univ.-Prof. Dr. N. Senninger – Referent: Univ.-Prof. Dr. N. Senninger Koreferent: Univ.-Prof. Dr. J. Kienast Zusammenfassung Therapie des Magenkarzinoms im Wandel der Zeit (1881 bis 2000) Birte Vogel Die Arbeit gibt einen Überblick über den Verlauf der innerhalb des letzten Jahrhunderts entwickelten Therapieansätze des Magenkarzinoms und deren Relevanz für den heutigen klinischen Alltag. Es werden sowohl die operativen als auch adjuvanten Therapiemöglichkeiten, die ausschließlich das Karzinom der distalen zwei Drittel des Magens betreffen, aufgezeigt. Bezüglich der operativen Verfahren wird deutlich, dass sich das Spektrum im Laufe der Jahrzehnte deutlich gewandelt hat. Um die Jahrhundertwende stellte die distale Magenresektion das Mittel der Wahl dar. Seit den vierziger Jahren ist die Gastrektomie zunehmend in den Vordergrund getreten. Die Operationsmortalität hat sich bei beiden Verfahren drastisch reduziert. Sammelstatistiken zeigen außerdem eine zunehmende Verbesserung der 5-JahresÜberlebensraten. In den letzten drei Jahrzehnten ist jedoch eine Stagnation zu verzeichnen, die Anlass für die intensive Auseinandersetzung mit multimodalen Therapiekonzepten gibt. Was die adjuvante Chemotherapie anbelangt, liegen bisher kaum erfolgsversprechende Studien vor. Durch die neoadjuvante Chemotherapie ist ein deutlicher Anstieg an R0-Resektionen zu erzielen. Randomisierte Studien bezüglich eines Überlebensvorteils durch die neoadjuvante Chemotherapie und auch durch die intraoperative Radiotherapie (IORT) stehen noch aus. Des weiteren wird die Rolle der Lymphknotendissektion behandelt, die in den letzten Jahren in Form von der systematischen erweiterten Lymphknotendissektion (SELD) eine zunehmende Akzeptanz gefunden hat. Ebenso findet eine Auseinandersetzung mit der Thematik der Splenektomie und erweiterten Resektion statt. Abschließend werden Ergebnisse vorgestellt, die auf der retrospektiven Auswertung der Krankenblätter von 115 Patienten, die in der Klinik für Allgemeine Chirurgie der Universität Münster wegen eines Magenkarzinoms behandelt wurden, beruhen. Es wurden die Parameter Alter, Geschlecht, Datum der Erstdiagnose, Laurén-Typ, Datum der Operation, Art der Operation, Art der Rekonstruktion nach Gastrektomie, postoperatives Tumorstadium, Durchführung einer Splenektomie, Operationsmortalität und postoperative Komplikationen in die Auswertung einbezogen. Tag der mündlichen Prüfung: 25. März 2004 Inhaltsverzeichnis I. Einleitung 1 II. Material und Methoden 3 III. Phasen der Magenkarzinomtherapie 5 1. Pionierphase 5 1.1. Die Entwicklung verschiedener chirurgischer Verfahren zur Bekämpfung des Magenkarzinoms und seiner Folgen Die experimentellen Vorreiter Die Pylorusresektion Die Gastrektomie Billroth I: Die erste erfolgreiche Pylorusresektion am Menschen Palliative Operationstechniken Die Gastroenterostomie nach Wölfer nach Braun nach von Hacker Die Gastrostomie Die Witzel-Fistel Weitere Resektionsverfahren Billroth II Methode nach Kocher Ein Wagnis: Die Totalexstirpation des Magens 7 8 8 8 8 9 10 10 11 11 11 13 1.2.1. 1.2.2. 1.2.3. Pathologisch-anatomische Kenntnisse um die Jahrhundertwende und Behandlungskonsequenzen Die Verbreitungswege des Magenkarzinoms Die Borrmann-Klassifikation Die Lymphknotenbeteiligung 15 15 16 17 1.3. 1.3.1. 1.3.2. 1.3.3. 1.3.4. Resultate in der Anfangsphase Welche Verfahren wurden bevorzugt angewendet? Operationsmortalitäten und Überlebenszeiten Todesursachen Resektionsraten 19 19 21 24 25 2. Phase der Weiterentwicklung 26 2.1. Verschiedene Rekonstruktionsverfahren nach Gastrektomie Die Ösophagoduodenostomie Die Ösophagojejunostomie nach Roux 26 27 27 27 1.1.1. 1.1.1.1. 1.1.1.2. 1.1.2. 1.1.3. 1.1.3.1. 1.1.3.1.1. 1.1.3.1.2. 1.1.3.1.3. 1.1.3.2. 1.1.3.2.1. 1.1.4. 1.1.4.1. 1.1.4.2. 1.1.5. 1.2. 2.1.1. 2.1.2. 2.1.2.1. 5 5 5 6 2.1.2.2. 2.1.2.3. 2.1.2.4. 2.1.2.5. 2.1.3. 2.1.3.1. 2.1.4. 2.2. 2.2.1. 2.2.2. 2.2.2.1. 2.2.2.2. 2.2.2.3. nach Hoffmann nach Schloffer/Graham nach Engel nach Hunt Die Jejunuminterposition nach Longmire-Gütgemann Welche Rekonstruktionsverfahren wurden bevorzugt angewendet? 27 27 28 28 29 29 31 Resultate Resektionsraten Operationsmortalitäten und 5-Jahres-Überlebensraten Gastrektomie Subtotale Magenresektion Vergleich der beiden Resektionsverfahren hinsichtlich ihrer Endresultate Postoperative Komplikationen und Todesursachen Subtotale Magenresektion versus Gastrektomie Trends in der Wahl der kurativen Resektionsmethoden Subtotale Magenresektion oder Gastrektomie? – Indikationen 32 32 34 34 36 2.3. Die Rolle der Lymphknotendissektion 42 2.4. Die „gastrectomie totale de principe“ 47 3. Phase der Systematisierung und Präzisierung 48 3.1. 3.1.1. 3.1.2. 3.1.3. Klassifizierungssysteme Laurén-Klassifikation des Magenkarzinoms TNM-System beim Magenkarzinom UICC-Stadieneinteilung beim Magenkarzinom 48 48 49 49 3.2. Therapeutische Konsequenz des Staging und Typing: Gastrektomie „de principe“ oder Gastrektomie „de nécessité“? Die Vertreter der Gastrektomie „de nécessité“ Die Vertreter der Gastrektomie „de principe“ Resultate Resektionsraten Operationsmortalitäten und 5-Jahres-Überlebensraten Gastrektomie Subtotale Magenresektion Postoperative Komplikationen und Todesursachen Vergleich der Komplikationsraten nach subtotaler Magenresektion und Gastrektomie Welche Komplikationen stehen im Vordergrund? Indikationen zur Gastrektomie bzw. subtotalen Magenresektion: Aktueller Stand 2.2.3. 2.2.4. 2.2.4.1. 2.2.4.2. 3.2.1. 3.2.2. 3.2.3. 3.2.3.1. 3.2.3.2. 3.2.3.2.1. 3.2.3.2.2. 3.2.3.2.3. 3.2.3.2.4. 3.2.3.2.5. 3.2.4. 37 38 39 39 41 50 51 52 54 54 56 56 58 60 60 60 62 3.2.5. Magenersatz: Bevorzugte Rekonstruktionsverfahren 62 3.3. 3.3.1. 3.3.1.1. 3.3.2. Lebensqualität nach Magenresektion Subtotale Magenresektion versus Gastrektomie Studienergebnisse Gastrektomie: Verbesserte Lebensqualität durch die Oesophago-Jejunoplicatio? Studienergebnisse 64 64 65 3.3.2.1. 3.4. 3.4.1. 3.4.1.1. 3.4.1.2. 3.4.1.3. 3.4.1.4. 3.5. Die Bedeutung der Lymphknotendissektion Die systematische Lymphadenektomie Das japanische Klassifizierungssystem der Lymphknoten des Magens Definition der systematisch erweiterten Lymphknotendissektion Zur Frage der erhöhten Morbidität und Letalität durch die SELD – Studienergebnisse 5-Jahres-Überlebensraten nach SELD 66 66 68 69 69 71 74 76 Indikationen zur Splenektomie im Rahmen der Gastrektomie Pathoanatomische Grundlagen Studienergebnisse Morbidität und Letalität 5-Jahres-Überlebensraten Derzeitige Richtlinien zur Splenektomie 79 79 80 80 81 82 3.6.1. 3.6.1.1. Die multiviszerale Resektion des fortgeschrittenen Magenkarzinoms Studienergebnisse Letalität und Überlebenszeiten 83 84 84 3.7. 3.7.1. 3.7.2. Palliative Eingriffe beim inkurablen Magenkarzinom Die palliative Tumorresektion Verfahren ohne Tumorresektion 86 86 88 3.8. 3.8.1. Multimodale Therapiekonzepte Die systemische adjuvante Chemotherapie des Magenkarzinoms Monochemotherapie Erste Versuche mit Thiotepa bzw. 5-Fluorodeoxyuridin 5-Fluorouracil Mitomycin C Polychemotherapie 5-FU/MeCCNU FAM Neuere Regimen Cisplatin-Kombinationen 89 3.5.1. 3.5.2. 3.5.2.1. 3.5.2.2. 3.5.3. 3.6. 3.8.1.1. 3.8.1.1.1. 3.8.1.1.2. 3.8.1.1.3. 3.8.1.2. 3.8.1.2.1. 3.8.1.2.2. 3.8.1.3. 3.8.1.3.1. 89 89 89 90 92 93 93 94 96 96 3.8.1.3.2. 3.8.1.3.3. 3.8.2. 3.8.2.1. FAMTX EAP Präoperative Chemotherapie des Magenkarzinoms Theoretische Grundlagen der neoadjuvanten Chemotherapie Phase II-Studien zur neoadjuvanten Chemotherapie des Magenkarzinoms Neoadjuvante Chemotherapie beim potentiell resektablen Magenkarzinom Beurteilung der adjuvanten und neoadjuvanten Chemotherapie Adjuvante Chemotherapie nach kurativer Resektion des Magenkarzinoms Neoadjuvante Chemotherapie Intraperitoneale adjuvante Chemotherapie Theoretische und experimentelle Grundlagen Studienergebnisse Intraoperative Strahlentherapie (IORT) Theoretische Grundlagen Studienergebnisse Risiken und Nebenwirkungen der IORT Frei zirkulierende Tumorzellen Vorkommen und Isolierung frei zirkulierender Tumorzellen Studienergebnisse Prognostische Bedeutung frei zirkulierender Tumorzellen 102 104 107 107 108 109 109 110 111 111 111 112 113 Daten der Klinik für Allgemeine Chirurgie der Universität Münster 116 5. Diskussion 127 6. Literaturverzeichnis 137 Lebenslauf 163 3.8.2.2. 3.8.2.3. 3.8.3. 3.8.3.1. 3.8.3.2. 3.8.4. 3.8.4.1. 3.8.4.2. 3.8.5. 3.8.5.1. 3.8.5.2. 3.8.5.3. 3.8.6. 3.8.6.1. 3.8.6.1.1. 3.8.6.2. 4. 97 97 98 99 99 101 102 I. Einleitung Trotz abnehmender Inzidenz in vielen industrialisierten Ländern während der letzten Jahrzehnte zählt das Magenkarzinom weiterhin zu den häufigsten malignen Erkrankungen des Menschen und befindet sich folglich im Blickfeld allgemeinen klinischen Interesses. In seiner geographischen Häufigkeitsverteilung bestehen erhebliche Unterschiede. So ist und war Japan schon immer das Land mit der höchsten Magenkarzinominzidenz. In der Bundesrepublik Deutschland sind im direkten Vergleich mit Japan deutlich niedrigere Inzidenzraten zu verzeichnen, und die USA finden sich mittlerweile sogar am Ende der Häufigkeitsskala wieder. Bemerkenswert ist außerdem ein eindeutiges Geschlechterungleichgewicht zuungunsten der Männer, die in allen Ländern der Welt etwa doppelt so häufig wie Frauen am Magenkarzinom erkranken [210]. Unter den Todesursachen steht das Magenkarzinom in der Bundesrepublik Deutschland bei Männern derzeit an vierter und bei Frauen sogar an dritter Stelle der malignen Erkrankungen [27], nicht zuletzt, weil es sich hier um einen Tumor handelt, der bei den meisten Patienten aufgrund anfänglicher uncharakteristischer Missempfindungen erst im fortgeschrittenen Stadium diagnostiziert wird [10, 193, 234]. Unbehandelt führt das Magenkarzinom nach einer mittleren Überlebensdauer von etwa 5,5 und höchstens 30 Monaten zum Tode [269]. Diese Tatsachen machen die Wichtigkeit der intensiven Auseinandersetzung mit kurativen bzw., im Falle eines fortgeschrittenen Stadiums, palliativen Therapiemaßnahmen deutlich. Wie diese heutzutage im Detail aussehen, genaugenommen wie es zu ihrer Entwicklung kam und welche Erfolge im Laufe der letzten Jahrzehnte in der Behandlung des Magenkarzinoms erzielt werden konnten, soll das Thema der vorliegenden Arbeit sein. Dabei wird ausschließlich auf das fortgeschrittene Karzinom der distalen zwei Drittel des Magens Bezug genommen. Die Behandlung des Kardiakarzinoms findet an dieser Stelle keine Beachtung, sie muß gesondert betrachtet werden. Ebenso wird nicht auf die Therapie des auf die Mukosa und Submukosa beschränkten Magenfrühkarzinoms eingegangen. 1 Im letzten Kapitel werden in einem im Vergleich zum Literaturteil verschwindend geringen Ausmaß Daten der Klinik für Allgemeine Chirurgie der Universität Münster zur aktuellen Therapie des Magenkarzinoms vorgestellt. Sie sollen abschließend lediglich den derzeitigen „Ist-Zustand“ an einer deutschen Klinik nach über hundert Jahren der Magenkarzinomtherapie aufzeigen. „Wird man in 100 Jahren über unsere anatomischen und klinischen Definitionen lächeln, wie wir es jetzt tun, wenn wir den guten alten Heister reden hören, wer weiß?“[272] Theodor Billroth war es, der 1881 mit seiner ersten gelungenen Teilresektion des Magens die Ära der chirurgischen Therapie des Magenkarzinoms einläutete und diese Frage in den Raum stellte. Mit der vorliegenden Arbeit wird versucht, unter anderem auch eine Antwort hierauf zu geben. 2 II. Material und Methoden Ziel der vorliegenden Übersichtsarbeit ist es, anhand der seit Ende des 19. Jahrhunderts publizierten Literatur einen Verlauf in der Therapie des Magenkarzinoms von 1881, dem Jahr, in dem Billroth seine erste erfolgreiche Magenteilresektion durchführte, bis in die heutige Zeit aufzuzeigen. Die Literaturrecherche erfolgte zunächst durch die gezielte Suche alter Artikel zum Thema „Chirurgie des Magenkarzinoms“ in Werken, die um die Jahrhundertwende 1900/2000 erschienen sind und in der Fachbibliothek der Chirurgischen Universitätsklinik Münster zur Einsicht bereitstehen (Bruns Beiträge zur klinischen Chirurgie, Langenbecks Archiv für Chirurgie, Verhandlungen der Deutschen Gesellschaft für Chirurgie, Zentralblatt für Chirurgie). Anhand der in den Artikeln erwähnten Zitate wurden daraufhin weitere Veröffentlichungen zum Thema ausfindig gemacht und diese in den archivierten Bänden der Zentralbibliothek für Medizin der Universitätsklinik Veröffentlichungen, Köln die eingesehen. Aussagen Von über den besonderem damaligen Interesse waren Kenntnisstand der Operationsverfahren in der Chirurgie des Magenkarzinoms beinhalteten und aus denen Daten zur Resektionsrate, Operationsmortalität und Überlebenszeit nach subtotaler Magenresektion bzw. Gastrektomie hervorgingen. Auf die Erfüllung besonderer Kriterien wie z.B. einer Mindestanzahl an Patienten in den untersuchten Gruppen oder dem Vorliegen randomisierter Bedingungen musste bei der Aufnahme der älteren Daten in die Arbeit verzichtet werden, da in den ersten Jahrzehnten häufig keine im heutigen Sinne statistisch auswertbaren Studienbedingungen vorlagen. Bei den Publikationen aus den letzten 40 Jahren konnte unter Eingabe gezielter Suchbegriffe wie „gastric cancer and neoadjuvant chemotherapy“ oder „gastric cancer and splenectomy“ eine computergestützte Literaturrecherche (Medline) betrieben werden. Hier wurde die Auswahl der in die Arbeit eingehenden Studien nach folgenden Kriterien getroffen: 1. Vorliegen randomisierter Bedingungen 2. Vorhandensein eines rein chirurgischen Kontrollarms bei adjuvanten Studien bzw. Studien zur Bedeutung der SELD oder Splenektomie. 3 Nach Durchsicht sämtlicher gesammelter Literatur wurde anhand der sich herauskristallisierenden Meilensteine in der Therapie des Magenkarzinoms eine Aufteilung der Arbeit in drei große Zeitabschnitte (Phasen) vorgenommen. Einen dieser Meilensteine stellte der sichere Umgang mit der Gastrektomie und ihren Rekonstruktionsverfahren Anfang des 20. Jahrhunderts dar. Hier beginnt nach der sogenannten „Pionierphase“ die „Phase der Weiterentwicklung“. Diese wird wiederum mit der Einführung der TNM-Klassifikation und Laurén-Typisierung und dem hieraus resultierenden systematischen Umgang mit den Therapieansätzen des Magenkarzinoms in den 70-iger Jahren von der „Phase der Systematisierung und Präzisierung“ abgelöst. Innerhalb dieser festgelegten Zeitabschnitte wurde versucht, systematisch die Entwicklung der chirurgischen Therapie des Magenkarzinoms bzw. ihrer additiven adjuvanten und neoadjuvanten Therapiemöglichkeiten zu beschreiben und die Erfolge und Misserfolge anhand von Daten zu belegen. Das letzte Kapitel der Arbeit weist Ergebnisse auf, die auf der retrospektiven Auswertung der Krankenblätter von 114 Patienten beruhen, die sich zwischen dem 01.01.1996 und 30.09.1999 in der Klinik für Allgemeine Chirurgie der Universität Münster einem operativen Eingriff aufgrund eines Magenkarzinoms unterzogen. In die Auswertung wurden folgende Daten, sofern sie aus den Krankenblättern der chirurgischen Universitätsklinik zu entnehmen waren, einbezogen: Alter, Geschlecht, Diagnose, Datum der Erstdiagnose, Laurén-Typ, Datum der Operation, Art der Operation, Art der Rekonstruktion nach Gastrektomie, postoperatives Tumorstadium (UICC-Klassifikation), Durchführung einer Splenektomie, Operationsmortalität und postoperative Komplikationen. Anhand dieser Daten wurde die Geschlechts- und Altersverteilung bei Erstdiagnose sowie die durchschnittlich vergehende Zeit zwischen Bekanntwerden der Diagnose und Zeitpunkt der Operation errechnet. Des weiteren wurde die Häufigkeitsverteilung der einzelnen Laurén-Typen und postoperativen Tumorstadien in den jeweiligen Altersklassen (20- bis 30–Jährige bis 70- bis 80-Jährige) bestimmt, das am häufigsten vorkommende Rekonstruktionsverfahren nach Gastrektomie sowie die Anzahl der durchgeführten Splenektomien ermittelt und zuletzt die Operationsmortalität und postoperativen Komplikationen mit Zahlen belegt. 4 III. Phasen der Magenkarzinomtherapie 1. Pionierphase Will man einen kompletten Verlauf in der Geschichte der Magenkarzinomtherapie aufzeigen, so dürfen vor allem diejenigen Personen nicht unerwähnt bleiben, die durch zahlreiche Versuche den Weg für die später erfolgreichen magenchirurgischen Eingriffe am Menschen ebneten. Die Pionierphase beginnt somit genaugenommen schon um 1800 und reicht bis in die Anfänge des 20. Jahrhunderts hinein. Sie ist geprägt von den Erforschungen und Erprobungen operativer Eingriffe an am Magenkarzinom erkrankten Patienten. 1.1. Die Entwicklung verschiedener chirurgischer Verfahren zur Bekämpfung des Magenkarzinoms und seiner Folgen 1.1.1. Die experimentellen Vorreiter 1.1.1.1. Die Pylorusresektion Von dem Chirurgen Jones aus Philadelphia soll die Idee der Entfernung des Pylorus stammen. Er führte um 1800 erste Pylorusresektionen an Hunden und Kaninchen durch, die jedoch nicht von Erfolg gekrönt waren [116]. Der Giessener Merrem war es dann, dem erstmalig eine Pylorusresektion an drei Hunden gelang und dessen Hunde außerdem die Operation überlebten [116]. Auch Torelli unternahm 1865 Tierversuche zur Pylorusresektion [276], gefolgt von Gussenbauer und Winiwarter, welche 1876 über die partielle Magenresektion an 7 Hunden berichteten. Sie wagten damals in ihrer Veröffentlichung die Empfehlung, die Entfernung des Magenkarzinoms, hier in erster Linie des Pyloruskarzinoms, auch beim Menschen anzuwenden [104]. 5 Diesen Versuch unternahm Péan als erster am 9. April 1879 in Paris. Nach der Pylorusresektion versorgte er seinen Patienten mit einer End-zu-End- Gastroduodenostomie. Der Patient überlebte den Eingriff 5 Tage [276]. Ein Jahr später führte Rydigier eine Pylorusresektion wegen eines Pyloruskarzinoms mit oberer End-zu-End-Gastroduodenostomie durch. Sein Patient starb schon nach 12 Stunden [276]. 1.1.1.2. Die Gastrektomie Was die Gastrektomie anbelangt, so ist diese im Verlauf der Geschichte der Magenoperationen ein Eingriff, der im Vergleich zur Teilresektion erst relativ spät auftaucht. Die Idee soll von Czerny stammen, der seine Assistenten Kaiser und Scriba mit der Beschäftigung der Magenexstirpation an 5 Versuchstieren beauftragte. Tatsächlich überlebte ein Hund nach der Operation am 22. Dezember 1876 5 Jahre lang, allerdings mit einem kleinen zurückgebliebenen Magenrest, wie man bei der Sektion feststellte [136]. Dieser galt derzeit als Bedingung für das Überleben. 1880 empfahl Albert, die Exstirpation des Magens gelegentlich am Menschen auszuführen [136]. Auch Nicoladoni verfolgte in den achtziger Jahren diesen Gedanken [136]. Er hatte sogar die Idee der Interposition eines Teils des Colon transversums zwischen Pylorus und Kardia. So war es Connor, der in Cincinnati 1883 erstmalig versuchte, den ausgedehnt krebsig erkrankten Magen einer 50-jährigen Frau total zu exstirpieren. Es war die erste Gastrektomie am Menschen in der Welt. Die Patientin starb jedoch noch vor Beendigung der Operation [274]. 6 1.1.2. Billroth I: Die erste erfolgreiche Pylorusresektion am Menschen Billroth sollte am 29.1.1881 der erste sein, dessen Patientin nach einer Resektion eines Pyloruskarzinoms die unmittelbaren Folgen der Operation überlebte, jedoch 4 Monate später ihrem Grundleiden aufgrund diffuser Metastasierung erlag [72, 116]. Dennoch war der Beweis für die erfolgreiche Durchführbarkeit der partiellen Magenresektion erbracht, wenn auch zu einem anfänglich sehr hohen Preis. Die Operationsletalität lag in den ersten zwei Jahren bei 77% [276]. Das Verfahren, welches Billroth für seine Resektion verwendete, die termino-terminale Gastroduodenostomie mit superiorer Anastomose im Bereich der kleinen Kurvatur, erhielt jedoch Eingang in die Geschichte der Magenchirurgie. Abbildung 1. Billroth I-Resektion. 7 1.1.3. Palliative Operationstechniken 1.1.3.1. Die Gastroenterostomie 1.1.3.1.1. nach Wölfler Im selben Jahr wie Billroth (1881) entwickelte Wölfler die Gastroenterostomie als palliative Maßnahme bei einem am stenosierenden Pyloruskarzinom erkrankten Patienten und ermöglichte ihm hiermit die weitere orale Nahrungsaufnahme und Magen-Darmpassage unter Umgehung des Magenausganges. Hierfür zog er eine Dünndarmschlinge an den im Bereich der großen Kurvatur 5cm längs eröffneten Magen hoch, spaltete diese an ihrer dem Mesenterium gegenüberliegenden Fläche in gleicher Länge und anastomosierte Dünndarm- und Magenlumen (Gastroenterostomia anterior antecolica) [295]. Seine Operation wurde in den folgenden Jahren zum Standardverfahren in der Behandlung des stenosierenden Magenkarzinoms. 1.1.3.1.2. nach Braun Immer wieder auftretende Passagestörungen veranlaßten Braun 1892 zur Weiterentwicklung der Wölflerschen Methode der Gastroenterostomie. Er legte eine gleichzeitige Entero-Anastomose an, mit der er die negativen Folgen der Fistel verhindern wollte, wie das fehlerhafte Abfließen des Mageninhaltes in den zuführenden Darmteil mit folglichem Zurückgelangen in den Magen und Erbrechen, das er bei verschiedener seiner Patienten beobachtet hatte. Durch Schaffen einer EnteroAnastomose zwischen den beiden hochgezogenen Jejunumschlingen (sogen. FusspunktAnastomose) beseitigte er dieses Problem, welches derzeit als „Circulus vitiosus“ beschrieben wurde [41, 46]. 8 1.1.3.1.3. nach von Hacker Eine weitere gebräuchliche Methode der Gastroenterostomie um die Jahrhundertwende war die von von Hacker 1885 entwickelte Gastroenterostomia posterior retrocolica. Dieser empfahl, die Dünndarmschlinge an die hintere Magenwand anzunähen, um eine Einklemmung des Colon transversums durch die darübergelagerte Dünndarmschlinge zu vermeiden. Hierzu wurde, nach Hochschlagen des Colons und des Netzes, von hinten her ein Schlitz in eine gefäßlose Stelle des Mesocolon gemacht, dessen Ränder an die hintere Magenwand angeheftet und schließlich die Dünndarmschlinge in diesem Spalt mit der hinteren Magenwand vernäht [72]. a) nach Wölfler b) nach Braun Abbildungen 2a)-c) Gastroenterostomien 9 c) nach v. Hacker 1.1.3.2. Die Gastrostomie Die Gastrostomie zur Ernährung des Kranken bei Verengungen der Kardia durch raumfordernde Tumoren wurde bis 1891 von verschiedenen Operateuren in der Weise vorgenommen, dass man den Magen in eine kleine Lücke der Bauchdecken einnähte und an dieser Stelle eine Öffnung nach außen herstellte. Derartige Magenfisteln waren jedoch gewöhnlich schon nach kurzer Zeit nicht mehr kontinent, so dass Ekzem- und Geschwürbildungen die Folge waren. Auch war der Zweck dieses Eingriffs, die Ernährung des Kranken, nur unvollständig erreicht. 1.1.3.2.1. Witzel-Fistel Erst die Methode von Witzel (1891) garantierte eine sichere Schlußfähigkeit der Magenfistel. Er schuf einen mehrere Zentimeter langen Kanal aus der Magenwand selbst, indem er die Wand des zunächst uneröffneten Magens über ein dünnes Gummiröhrchen in zwei Falten emporhob und durch Nähte über demselben fixierte. Danach führte er das Gummiröhrchen am unteren Ende des Kanals durch eine kleine Öffnung in das Magenlumen ein, um daraufhin die Magenwand über dem Röhrchen und der Öffnung durch einige Serosanähte zu vereinigen und das obere Ende des Kanals in die Bauchdecken einzunähen [294]. Abbildung 3. Witzel-Fistel [aus 294] 10 1.1.4. Weitere Resektionsverfahren 1.1.4.1. Billroth II In Anlehnung an Wölflers Gastroenterostomie entstand 1885 Billroths zweite Resektionsform. Er verschloß das Duodenum und den Magen nach Pylorusresektion blind und stellte eine neue Verbindung zwischen Magenrest und Jejunum her. Hierfür verwendete er wie Wölfler die vordere Gastroenterostomie, wollte seine II. Methode jedoch selbst nur als Verlegenheitsoperation ausgeführt wissen [8, 105]. Grund waren die beschriebenen Passagestörungen (Circulus vitiosus), die bei seiner wie auch bei Wölflers vorderer Gastroduodenostomie auftraten. 1.1.4.2. Methode nach Kocher Kocher forderte, nach der Exzision des Magenkarzinoms, prinzipiell den Magen vollkommen zu schließen und eine Gastroenterostomie hinzuzufügen. Er vernähte den Magen blind und implantierte hierauf das Duodenum in die hintere Magenwand. Die zuweilen bei der II. Billrothschen Methode beobachteten Komplikationen, die Gastroenterostomie betreffend, konnten somit sicher vermieden und zufriedenstellende Resultate erzielt werden. Allerdings teilte sein Verfahren mit der I. Billrothschen Methode den Nachteil, dass man sie nur bei spannungsfreier Näherung von Duodenum und Magenrest anwenden konnte [155]. 11 a) Methode nach Billroth II b) Methode nach Kocher Abbildungen 4a) und b). Resektionen nach Billroth II und Kocher 12 1.1.5. Ein Wagnis: Die Totalexstirpation des Magens Nach einem ersten erfolglosen Versuch am Menschen durch Connor im Jahre 1884 war es Schlatter, der sich 1897 gezwungen sah, bei einer 56-jährigen Patientin mit vollständigem karzinomatösem Befall des Magens eine Totalresektion durchzuführen. Die Gastroenterostomie als andere Alternative kam nicht in Frage, da sich keine gesunde Stelle am Magen für die Anlage dieser finden ließ. Nach komplikationsloser Entfernung des Magens war es ihm nicht möglich, die Lumina des Ösophagus und des Duodenums zusammenzuführen, um sie aneinanderzunähen. Auf diese Weise hatte Schuchardt zwei Jahre zuvor einen Patienten operativ versorgt, allerdings damals einen 2-3 fingerbreiten Stumpf der Kardia stehengelassen. Aus der Not entstand ein genialer Einfall, nämlich die erste Ösophagoenterostomie, die Ausgang war für zahlreiche folgende operative Varianten nach der Gastrektomie. Schlatter zog eine Dünndarmschlinge antecolisch an das Lumen des Ösophagus heran und vereinigte die beiden, nach einem ca. 1,5cm langem Längsschnitt am Dünndarm, durch fortlaufende zirkuläre Nähte miteinander. Seine Patientin nahm innerhalb von 9 Monaten 8,5 kg an Gewicht zu, starb jedoch 14 Monate nach der Operation an einem Rezidiv [263]. Auch wenn bei der Sektion ein winziger Magenrest aufgefunden wurde, so war doch trotzdem der Beweis erbracht, dass der Mensch ohne Magen lebensfähig ist. Ein Jahr nach Schlatters erster Totalresektion führte der Amerikaner MacDonald eine Gastrektomie bei einem 38-jährigen Patienten erfolgreich durch. Dieser war nach einem komplikationslosen Verlauf in der Lage, am 13. Tag das Krankenhaus zu verlassen. Wie lange der Patient überlebte, ist nicht bekannt. Im gleichen Jahr, 1898, gelang Brigham als drittem die Gastrektomie. Er schaffte es, bei einer 66-jährigen Frau eine Anastomose zwischen Ösophagus und Duodenum herzustellen. Die Patientin überlebte zwei Jahre [78]. Es folgten eine Reihe weiterer erfolgreicher Fälle von Gastrektomie bis schließlich dem Eingriff ein definitiver Platz in der Chirurgie eingeräumt wurde. Diskutiert wurde jedoch, welches Ausmaß der Resektion dem Begriff „totale Gastrektomie“ gerecht wird. Billroth verstand unter der totalen Resektion des Magens die Entfernung des Corpus mit 13 anschließender Naht zwischen Pylorus und Kardia. Krönlein hingegen ließ den Begriff nur gelten, wenn sowohl Kardia als auch Pylorus komplett mitentfernt wurden, eine Definition, die mehr Anhänger fand [78, 285]. Abbildung 5. Gastrektomie nach Schlatter [aus 263] 14 1.2. Pathologisch-anatomische Kenntnisse um die Jahrhundertwende und Behandlungskonsequenzen 1.2.1. Die Verbreitungswege des Magenkarzinoms Nach einer etwa 20-jährigen intensiven Beschäftigung mit den operativen Behandlungsmethoden des Magenkarzinoms war schon um die Jahrhundertwende erkennbar, dass das Magenkarzinom besonders hohe Ansprüche an den Therapeuten stellte. 1898 bemerkte von Mikulicz in einer Veröffentlichung, dass die Erfolge der Chirurgie des Magenkarzinoms im Vergleich zu Karzinomen anderer Organe „noch viel zu wünschen übrig lassen“ [196]. Ein Grund war auch damals schon, dass viele der Patienten erst im fortgeschrittenen Stadium auffällig wurden und sich einer Operation unterzogen. Wichtig war deshalb die Kenntnis der Verbreitungswege des Magenkarzinoms. Ein Thema, mit dem sich bis zu diesem Zeitpunkt nur Gussenbauer und Winiwarter im Jahre 1876 beschäftigt hatten. Aus seinem Erfahrungsschatz schöpfend zeigte Mikulicz folgende Wege des Magenkarzinoms auf: „ 1. Continuierlich in der Magenwand 2. Durch die größeren Lymphbahnen und Lymphdrüsen außerhalb der Magenwand 3. Transperitoneal, d.h. durch Vermittlung des vom Carcinom ergriffenen Peritoneums auf benachbarte und entfernte Abschnitte des Peritoneums und die von ihm eingeschlossenen Organe 4. Auf dem Wege der Blutbahn“ [196]. Punkt 3 und 4 stellten für Mikulicz eine Kontraindikation gegen den radikalen Eingriff dar. Er bevorzugte in diesen Fällen, bei zusätzlich vorhandener Pylorusstenose, die Gastroenterostomie. Größere Bedeutung schenkte er den unter Punkt 1 und 2 genannten Verbreitungswegen für die operative Konsequenzen. Schon 1898 war ihm bewußt, dass die Prognose entscheidend von dem Ausmaß der Resektion der Magenwand abhängt. Rezidive, die er nach Magenresektionen in der Magenwand hatte auftreten sehen, hatten ihn zu dieser Erkenntnis gebracht. Er schlug deshalb eine Resektion der gesunden 15 Magenwand von 5 bis 10 Zentimetern vor. Die Exstirpation des Magens stand seiner Meinung nach bei Karzinomen der kleinen Kurvatur an, die bis in die Nähe der Kardia reichten. Außerdem unterschied er bezüglich der Verbreitungswege des Magenkarzinoms zwei verschiedene Formen: Zum einen das breitbasig aufsitzende, scharf begrenzte, nur von der Mukosa ausgehende, ins Lumen vorspringende Karzinom, welches er als prognostisch günstiger, aber auch seltener erachtete. Zum anderen das die Magenwand diffus infiltrierende Karzinom mit schlechter Prognose. Ersteres wurde von ihm mit einem Sicherheitsabstand im Gesunden von 1-2 cm entfernt, letzteres war häufig nicht mehr chirurgisch angehbar. 1.2.2. Die Borrmann-Klassifikation Borrmann unternahm 1901 erstmalig den Versuch, das Magenkarzinom anhand seiner Wachstumsformen zu klassifizieren und unterschied demnach 4 Gruppen. - Gruppe I umfaßte circumskripte, polypöse, solitäre Karzinome ohne erhebliche Ulzeration, die breitbasig, gestielt oder pilzförmig der Magenmucosa aufsitzen. - Gruppe II beschrieb die sogenannten schüsselförmigen Karzinome, d.h. ulzerierende Karzinome mit wallartigem Rand und scharfer Begrenzung. - Gruppe III beinhaltete jene Fälle von ulzerierenden Karzinomen, die wallartig begrenzt oder sich diffus ausbreitend wachsen und in die Submucosa infiltrieren und - Gruppe IV erfaßte die diffus wachsenden Karzinome. 16 a) polypös b) schüsselförmig ulzerierend c) wallartig begrenzt d) diffus infiltrierend Abbildung 6a)-d). Borrmann-Klassifikation [34] 1.2.3. Die Lymphknotenbeteiligung Folgende Lymphknotenstationen waren Mikulicz im Jahre 1898 bekannt: 1. die Drüsen der kleinen Kurvatur, 2. die Drüsen der großen Kurvatur, 3. die Drüsen des Ligamentum gastro-colicum und 4. die pankreatischen Lymphdrüsen. Prinzipiell entfernte er die sich an der kleinen Kurvatur befindlichen, palpablen Lymphknoten. Inwiefern mit der Entfernung der restlichen Lymphknotenstationen verfahren wurde, geht aus seinen Erläuterungen nicht hervor [196]. Most jedenfalls konnte ein Jahr später aufgrund seiner Forschungen über die 17 Lymphgefäße des Magens den Rat für ein radikales operatives Vorgehen geben, das neben der totalen Exstirpation des Magens die Entfernung sämtlicher von Mikulicz erwähnter Lymphknotengebiete beinhalten sollte [204]. Seine Studien an 22 Magenpräparaten ergaben, dass der Magen ein in sich relativ abgeschlossenes Lymphgebiet darstellt. Bisherige Vermutungen, die lymphogenen Verbreitungswege des Magenkarzinoms betreffend, bestätigte er anhand seiner anatomischen Ergebnisse. So widmete er sich dem derzeit wichtigstem Karzinom, dem Pyloruskarzinom, und konnte aufzeigen, dass hier besondere Aufmerksamkeit den Lymphknoten im Bereich der kleinen Kurvatur und des Pylorus selbst sowie den Lymphknoten über dem Pankreas gelten mußte. Auch war ihm bereits bewußt, dass im fortgeschrittenen Falle weitere Lymphknoten, so die im Bereich der Porta hepatis, der Arteria lienalis und dem Netz häufig betroffen waren. Most konnte zwar zur totalen Gastrektomie raten, wußte aber gleichzeitig auch, dass diese noch in den Kinderschuhen steckte und dass das Gros der Operateure immer noch die Teilresektion bevorzugte. Deshalb machte er die Notwendigkeit deutlich, die Pylorusresektion möglichst auf die Magenwand im Bereich der kleinen Kurvatur auszudehnen. 18 1.3. Resultate in der Anfangsphase 1.3.1. Welche Verfahren wurden bevorzugt angewendet? Im Grunde genommen kann in dieser ersten Phase der Magenkarzinomchirurgie nicht die Rede von angewendeten Standardverfahren sein. Dazu war man noch zu sehr mit der Erforschung von Methoden und deren Weiterentwicklung beschäftigt. Ganz allgemein läßt sich jedoch feststellen, dass die Gastroenterostomie und die Pylorusresektion etwa gleichrangig im Vordergrund in der Behandlung des Magenkarzinoms standen, etwas zugunsten der Gastroenterostomie, v.a. in den allerersten Jahren bis etwa 1900 [164, 201]. Allein die unzähligen Variationen der Gastroenterostomie, die hier gar nicht alle erwähnt werden konnten [274], zeigen den Stellenwert, den dieser Eingriff Ende des 19. Jahrhunderts hatte, nicht zuletzt, weil eine Großzahl der Patienten erst im fortgeschrittenen Stadium symptomatisch wurde und den Arzt erstmalig aufsuchte. Hier stellte sich dann sogar häufiger die Frage, ob die Palliativoperation denn überhaupt noch anzustreben sei. Ein Thema, bei dem die Meinungen führender Operateure der damaligen Zeit auseinandergingen. Krönlein hatte schon früh den Standpunkt vertreten, die Gastroenterostomie nur auf die Fälle nicht mehr exstirpierbarer Magenkarzinome beschränkt wissen zu wollen, die auch gleichzeitig unter Stenoseerscheinungen litten [164]. Er befand sich damit längere Zeit in konträrer Meinung zu vielen anderen Chirurgen wie Lücke, König, Müller und Mikulicz, die die Grenzen der Indikation für die Gastroenterostomie nicht so eng zogen, konnte jedoch gegen Anfang des 19. Jahrhunderts letztlich die Mehrheit der Chirurgen von seiner Auffassung überzeugen [165]. Eine Aussicht auf Heilung, dessen war man sich bewußt, bestand natürlich nur durch die Exzision des Karzinoms, d.h. durch resezierende Verfahren wie die Pylorusresektion [231]. Und somit wurde, wie aus den Ergebnissen von Punkt 4.4. hervorgeht, auch eine recht große Anzahl operabler Karzinomkranker der Gastroduodenostomie oder Gastrojejunostomie zugeführt. Möller resezierte z.B. in allen Fällen, in denen die Resektion überhaupt möglich war, sofern keine Fernmetastasen vorhanden waren. 19 Dabei bestand keine eindeutige Indikation für eine der beiden Verfahrensrichtungen, es sei denn, die Gastroduodenostomie verbot sich aufgrund einer erschwerten Mobilisation des Duodenums oder weil ein größerer Teil des Magens geopfert werden mußte. In solchen Fällen war die II. Billrothsche Operation die radikalere Vorgehensweise und garantierte außerdem spannungsfreiere Verhältnisse an den Nahtstellen. War das Bestreben eine weitestgehende Wiederherstellung der normalen anatomischen Verhältnisse, so wurde der I. Billrothschen und der Kocherschen Methode der Vorzug gegeben [201]. Letztlich hing die Entscheidung für die Methode von den Vorlieben und Erfahrungswerten des Operateurs ab. Die Gastrektomie spielte derzeit noch eine sehr untergeordnete Rolle. Sie war zwar von einigen bekannten Operateuren mit Erfolg ausgeführt worden, konnte aber in der breiten Masse der Chirurgen Anfang des Jahrhunderts aufgrund technischer Schwierigkeiten wenige Anhänger finden. Vereinzelt wurden sogar Stimmen laut, dass die Exstirpation des Magens wohl keine Zukunft hätte [197]. Diese recht stiefkindliche Behandlung der Gastrektomie wird unter anderem durch die Tatsache bestätigt, dass in einem Lehrbuch der speziellen Chirurgie von 1918 das Thema „Totalexstirpation des Magens“ nur in ein paar Sätzen abgehandelt wurde: „.....Denn die Fälle sind enorm rar, wo ein infiltrierendes Karzinom den größten Teil des Magens ergriffen hat, ohne zu so ausgedehnten Verwachsungen und Drüsenschwellungen geführt zu haben, dass an eine radikalen Eingriff überhaupt noch gedacht werden kann. Wir dürfen uns daher auf die Erwähnung des Eingriffes beschränken und auf den Hinweis, dass naturgemäß die Vereinigung des Ösophagus mit dem Darm nur schwer zu überwindende Schwierigkeiten bereitet.“[127] 20 1.3.2. Operationsmortalitäten und Überlebenszeiten Die Beurteilung der Ergebnisse in den ersten Jahren / Jahrzehnten muß mit Vorsicht angegangen werden, da anfänglich, nach der Einführung der Resectio pylori durch Billroth, ausschließlich Mitteilungen über einzelne positiv verlaufende Operationen bekannt gegeben wurden. Es folgten zwar Ende des 19. Jahrhunderts größere Statistiken über die Erfolge der Magenresektionen, die im folgenden erwähnt werden, jedoch scheinen in diese auch „geschönte“ Zahlen aus der Anfangsphase eingeflossen zu sein. Haberkant veröffentlichte 1894 die Ergebnisse einer Sammelstatistik über sämtliche bis dahin bekannt gewordene Magenkarzinomresektionen. Demnach betrug die Operationsmortalitäten und durchschnittliche Operationsletalität bei 257 Operationen 54,4% [116]. Aus einem Festvortrag von Wölfler sind die Überlebenszeiten bei der Pylorusresektion und im Vergleich dazu bei der Gastroenterostomie in den Jahren 1888-1896 zu entnehmen [296]. Wölfler hatte die Daten anhand der Ergebnisse führender Operateure wie Billroth, Czerny, Gussenbauer, Mikulicz, Kocher, Kroenlein u.a. erstellt. Hiernach ergab sich eine durchschnittliche Letalität nach der Pylorusresektion wegen Magenkarzinom von 31,9% und im Gegensatz dazu nach der Gastroenterostomie von 30%. Was die durchschnittliche Lebensdauer postoperativ anbelangt, so betrug sie nach der Pylorusresektion 1,5 Jahre und nach der Gastroenterostomie 9 Monate. Die kürzere Überlebensdauer nach der Gastroenterostomie erklärt sich durch die Tatsache, dass die Mehrzahl der Chirurgen zu dieser Zeit die Gastroenterostomie auf nicht zu exstirpierende Pyloruskarzinome sowie auf Karzinome, die bereits eine Metastasierung aufwiesen, beschränkt wissen wollte. Bis 1902 konnte von Herczel weltweit 21 Fälle von Exstirpation des Magens wegen eines Karzinoms zusammentragen [117]. Bei einer Gesamtmortalität von 19,5% muß jedoch davon ausgegangen werden, dass der positive Schein trügt und etliche tödlich ausgegangene Fälle wahrscheinlich nicht veröffentlicht worden sind, so auch damals schon von Herczels Annahme. Ebenso zog Krönlein um die Jahrhundertwende Bilanz über den Verlauf des 21 Magenkarzinoms bei operativer und nicht operativer Behandlung. Er bezog sich dabei auf ein von ihm zwischen 1881 und 1902 behandeltes Patientengut, welches 264 Fälle von Magenkarzinomen umfaßte. Die folgenden Daten sind seiner Veröffentlichung entnommen: 264 Fälle: nicht operiert in 25,3% operiert in 74,7% Probelaparotomien in 27,6% Gastroenterostomien in 28,0% Gastrektomien in 18,9% Operationsmortalität: Probelaparotomie 9,5% Gastroenterostomie 24,3% Gastrektomie 28,0% mittlere Lebensdauer nach dem Auftreten erster Symptome: bei den Nichtoperierten ca. 12,5 Monate bei den Operierten 1. Probelaparotomien ca. 13 Monate 2. Gastroenterostomien ca. 15,5 Monate 3. Gastrektomien ca. 26,5 Monate Daraus schloß Krönlein, dass 1. das Magenkarzinom ohne Operation durchschnittlich nach ca. 1 Jahr zum Tode führt, 2. die Gastroenterostomie das Leben des Karzinomkranken durchschnittlich um 3 Monate und 3. die Gastrektomie, sofern sie vom Rezidiv gefolgt ist, das Leben durchschnittlich um 14 Monate verlängert [165]. 22 Finney und Rienhoff kamen auf 122 von 1884 bis 1929 in der Literatur erwähnte Fälle von Exstirpationen des Magens wegen eines Magenkarzinoms. Als echte „totale Gastrektomie“ ließen sie jedoch nur 67 Fälle gelten, nämlich diejenigen, bei denen von einer vollständigen Entfernung des Magens mit Einbeziehung der Kardia und des Pylorus ausgegangen werden konnte (Tab.1). Die von Finney und Rienhoff erfaßten Daten zeigten, dass das Zurücklassen eines, wenn auch sehr kleinen, Magenrestes die Gefahr des operativen Eingriffs drastisch reduzierte. Im direkten Vergleich mit der Gruppe der Totalresektionen ergab sich eine Abnahme der Mortalitätsrate von 28,8% [78]. Tabelle 1. Zusammenstellung veröffentlichter Fälle von Gastrektomien zwischen 1884 und 1929 [78] Gesamtzahl an Fällen 122 Zahl an veröffentlichten Fällen in der Literatur 116 eigene Fälle 8 unzweifelhafte Fälle von totaler Gastrektomie 67 Todesfälle 36 (53,8%) Genesungen 31 (46,2%) längste Überlebenszeit nach totaler Gastrektomie 4 Jahre, 8 Monate zweitlängste Überlebenszeit 4 Jahre danach fällt die Überlebenszeit auf 2,5 Jahre Subtotale Magenresektion (d.h. 3cm oder mehr Magenrest sind an den jeweiligen Enden zu finden) Gesamtzahl an Fällen 55 Todesfälle 14 (25%) Genesungen 41 (75%) 23 1.3.3. Todesursachen In die Interpretation der Todesursachen muß miteinbezogen werden, dass die Narkose, gerade mal ein halbes Jahrhundert jung, noch nicht ausgereift und somit sicherlich Ursache für viele operative Zwischenfälle war. Zudem wußte man zwar mit dem Begriff der Asepsis seit 1847 etwas anzufangen, die antiseptischen Bedingungen waren jedoch noch längst nicht so streng wie heutzutage. So wurde zum Beispiel bis 1890, als Halsted die Op-Gummihandschuhe einführte, mit bloßen Händen operiert. Mundschutz und Kittel wurden noch später erst zum Bestandteil jeder Operation [49]. Trotz der relativen Unerfahrenheit auf den Gebieten der Hygiene und der Anästhesie standen Peritonitis und Schock an erster Stelle der Todesursachen. Sie waren v.a. durch technische Mängel begründet. [78]. Die meisten Chirurgen bedienten sich zur Anlegung der Anastomosen der zweireihigen fortlaufenden Naht. Jedoch stellte die Nahtinsuffizienz ein schwer zu beherrschendes Problem dar [125]. Eine weitere häufige Todesursache war die Pneumonie, oftmals mit Lungengangrän kombiniert [13]. Je länger sich die Operation gestaltete, desto größer war die Gefahr der Entwicklung einer Pneumonie. 24 1.3.4. Resektionsraten Was die Resektionsrate für das Magenkarzinom anbelangt, so sind aus Möllers Artikel folgende Zahlen für die Anfänge des 20. Jahrhunderts zu entnehmen [201]: KrogiusElving 13,5%, Garré 16,3%, Krönlein 19%, Poncet 24%, Weil 24,6% und Mayo 32%. Möller selbst lag mit seinen Resektionsraten von über 30% über dem Durchschnitt der damaligen Zeit. Schlüsselt man die Resektionsquoten nach den verschiedenen Zeitspannen auf, wie es Möller getan hat , so ist in seinem Patientengut eine deutliche Entwicklungstendenz im Sinne einer Zunahme des Resektionsprozentsatzes (von 20,8% bis 1911 auf 36,7% bis 1918) im Laufe der Jahre zu verzeichnen. Zunehmende Erfahrung und verbesserte Techniken, was die Resektion des Magens betrifft, führten zu einer erweiterten Indikationsstellung dieses Eingriffes. So lag die Resektionsrate in den zwanziger und dreißiger Jahren laut folgender gesammelter Daten verschiedener Operateure im Durchschnitt zwischen 20 und 30 Prozent. Tabelle 2. Resektionsraten beim Magenkarzinom zwischen 1920 und 1940 – Sammelstatistik verschiedener Operateure Autoren Zeitraum Resektionsrate (%) Welch u. Allen* 1927-1936 25,0 Saypol u. Hinton* 1920-1939 25,5 Pack u. McNeer* 1931-1936 7,7 Wilson* 1919-1928 21,0 Wilson* 1929-1938 25,0 Guiss* 1930-1939 7,7 Lawrence u. McNeer [170] [* aus 140] 1931-1940 15,5 25 2. Phase der Weiterentwicklung Anfang des 20. Jahrhunderts war die Chirurgie des Magenkarzinoms in einer ziemlichen Gleichförmigkeit verlaufen. Die operative Vorgehensweise war zumeist auf mehr oder weniger hochreichende aborale Teilresektionen beschränkt geblieben, die weitgehend denjenigen bei Ulkusresektionen glichen. Nun setzte in den späten 30-iger Jahren langsam ein Umdenken hin zu der Erkennung der Notwendigkeit einer radikaleren Vorgehensweise gegen das Magenkarzinom ein. Sämtliche bis dato entwickelten Methoden hatten nicht die entsprechenden Späterfolge gebracht, v.a. waren immer wieder anastomosennahe Lokalrezidive am Magenstumpf beobachtet worden. Es machte sich eine Unzufriedenheit unter den Operateuren breit, deren Folge die Auseinandersetzung mit einem Eingriff war, vor dem man sich lange Zeit gescheut hatte, der Gastrektomie. Bislang hatte man die Effektivität der Gastrektomie vielerorts in Frage gestellt. Hohe Operationsmortalitätsraten und die Tatsache, dass auch die Gastrektomie keine Garantie für Heilung geben konnte waren Gründe für den verhaltenen Umgang mit dieser Methode gewesen. Jetzt wurde jedoch aus der Not eine Tugend gemacht und man setzte sich erneut mit der Gastrektomie auseinander, in der Hoffnung, die Operationsmortalität in den Griff zu bekommen und die 5-Jahresüberlebensraten auf längere Sicht verbessern zu können. Verlangte die Lebensphilosophie des Operateurs alle Anstrengungen, dann mußte die Gastrektomie unter Inkaufnahme der bekannten Risiken das Mittel der Wahl sein [98]. 2.1. Verschiedene Rekonstruktionsverfahren nach Gastrektomie An den zahlreich in den vierziger und fünfziger Jahren erschienen Veröffentlichungen zur Gastrektomie und seinen Rekonstruktionsmöglichkeiten wird deutlich, wie intensiv man sich in diesem Zeitraum mit dem Thema befaßte. Im folgenden sollen nur einige Methoden stellvertretend für eine Reihe weiterer Variationen beschrieben werden, die sich drei Hauptgruppen zuordnen lassen. 26 2.1.1. Die Oesophagoduodenostomie Diese von Brigham 1898 erstmals erfolgreich durchgeführte Methode [zit. n. 224] der direkten Anastomose zwischen proximalem Duodenum und distalem Oesophagus verlangt keine weitere Erläuterung. Wichtige Voraussetzung zur komplikationslosen Durchführung ist eine spannungsfreie Näherung der beiden Enden. 2.1.2. Die Oesophagojejunostomie 2.1.2.1. nach Roux Roux hatte bereits 1907 die End-zu-Seit-Anastomose der zuführenden Schlinge eingeführt. Nach Verschluß des Duodenalstumpfes skeletierte er etwa 20-30cm aboral der Flexura duodenojejunalis ein Jejunalsegment und durchtrennte das Darmrohr. Den aboralen Dünndarm brachte er daraufhin retrocolisch hoch an die Speiseröhre, um ihn mit dieser zu anastomosieren. Eine Sicherung der Naht erfolgte durch einfache segmentäre Jejunoplikation. Das Dünndarmrohr wurde durch terminolaterale Anastomose unterhalb des Quercolons wieder geschlossen [241]. 2.1.2.2. nach Hoffmann Von Hoffmann stammt der Gedanke eines plastischen Magenersatzes aus dem Jahre 1922. Durch Schaffen einer Anastomose zwischen den hochgezogenen Jejunumschenkeln, die direkt hinter der Ösophagusanastomosenstelle beginnt und über eine Strecke von 15 cm verläuft, entwickelte er das erste in der Literatur veröffentlichte Ersatzreservoir des Magens [128]. 2.1.2.3. nach Schloffer/Graham Von Schloffer bereits 1917 beschrieben, veröffentlichte Graham 1940 seine Technik der Gastrektomie [98]. Sie bestand in einer Ösophagojejunostomie mit kurzer Seit-zu-Seit- 27 Enteroanastomose der hochgezogenen Jejunalschlinge. Von Allen übernahm er den Vorschlag, das Jejunum an der Unterfläche des Diaphragmas mit ein paar unterbrochenen Nähten zu fixieren, um somit die Zugbelastung auf die ösophagojejunale Anastomose zu reduzieren [9]. 2.1.2.4. nach Engel Die Erfahrung zeigte, dass man mit den bisher entwickelten Techniken agastrische Zustände schuf, die mit Problemen wie Völlegefühl, Übelkeit und evtl. Erbrechen des Patienten einhergingen. Ursache war die zu kleine Reservoirbildung des Jejunums, das häufig schon geringe Nahrungsmengen nicht bewältigen konnte. Engel entwickelte aus diesem Grunde 1945 die sogenannte Pantaloon-Anastomose, d.h. eine Verbindung zwischen afferentem und efferentem Schenkel des Jejunums, die sich über eine Länge von 8cm erstreckte und den Wendepunkt der Schlinge miteinbezog. Hierdurch gelang es ihm, einen Hohlraum („Pouch“) zu schaffen, der dem Magen in seiner Reservoirfunktion näherkam [70]. 2.1.2.5. nach Hunt 1952 verband Hunt Rouxs Schlingenbildung mit der Pouchbildung. Seine Absicht war es, den Reflux in den Ösophagus verhindern zu wollen. Er verschloß den Duodenalstumpf nach Entfernung des Magens blind und durchtrennte das Jejunum etwa 30 bis 35 cm unterhalb des Treitzschen Bandes, um daraufhin den distalen Schenkel antecolisch hoch in Richtung Ösophagus zu ziehen. Diesen formte er dann an seinem Ende zu einer Art Schlinge, welche er auf einer Länge von etwa 15 cm Seit-zu-Seit anastomosierte. Er erhielt somit einen Hohlkörper, den er End-zu-Seit mit dem Ösophagus verband. Schließlich anastomosierte er das proximale Jejunum seitlich an das distale [133]. 28 2.1.3. Die Jejunuminterposition Die oben beschriebenen Methoden der Ersatzmagenbildung aus oberen Jejunum- oder Dickdarmsegmenten galten in den Augen einiger Chirurgen als unnötig komplizierte Eingriffe, durch welche die Funktion nicht wesentlich verbessert werden konnte. Deshalb suchte man in den vierziger und in den folgenden Jahren nach neuen Verfahren der Magenrekonstruktion, die den Passageweg auf möglichst einfache Weise wiederherstellten und außerdem in funktioneller Hinsicht bessere Resultate lieferten. Um letzteres zu erreichen, galt die Erhaltung der Duodenalpassage als unabdingbare Voraussetzung. Diese war bei der einfachen Ösophagoduodenostomie gewährleistet, jedoch hatte man hier häufig den für den Patienten sehr lästigen ösophagealen Reflux beobachtet. Aus all den Überlegungen entstand die Idee der Dünndarminterposition zwischen Ösophagus und Duodenalstumpf, die erstmalig 1942 von Seo beschrieben wurde [271]. 2.1.3.1. nach Longmire-Gütgemann Longmire griff 1952 die ursprünglich von Seo angegebene Zwischenschaltung eines kurzen Dünndarmsegments zwischen Ösophagus und Duodenalstumpf auf. Er isolierte ein ca. 10-15 cm langes Segment aus dem oberen Jejunum unter Erhaltung der ernährenden Gefäße, anastomosierte die beiden Jejunallumina und lagerte schließlich das Jejunalsegment zwischen Ösophagus und Duodenum. Bei allen drei Anastomosen handelte es sich um End-zu-End-Vereinigungen [177]. 29 a) Oesophagoduodenostomie nach Brigham (1898) b) Oesophagojejunostomie nach Roux (1907) nach Engel (1945) nach Hoffmann (1922) nach Schloffer/Graham (1917/1940) nach Hunt (1952) c) Jejunuminterposition nach Longmire-Gütgemann (1952) Abbildungen 7a)–c) Verschiedene Rekonstruktionsverfahren nach Gastrektomie 30 2.1.4. Welche Rekonstruktionsverfahren wurden bevorzugt angewendet? Pack und McNeer konnten anhand einer Sammelstatistik verschiedener Operateure die Häufigkeitsverteilung der operativen Verfahren der Passagewiederherstellung nach der Gastrektomie aufzeigen [213]. Über den Zeitraum von 1884 bis 1942 stand demnach die Ösophagojejunostomie von Jahrzehnt zu Jahrzehnt deutlicher bei der Wahl der operativen Methode im Vordergrund. Konkurrierte sie zwischen 1884 und 1920 noch relativ gleichwertig mit der Ösophagoduodenostomie, so wurde sie zwischen 1921 und 1930 bereits mit 64,9 % mehr als doppelt so häufig als diese eingesetzt und erreichte mit 95,1 % in den Jahren 1931 bis 1942 die absolute Priorität (Abb. 8). 95,1 100 64,9 Prozent (%) 41,3 50 44 29,8 14,7 5,3 1,2 3,7 0 1884-1920 1921-1930 1931-1942 Jahre andere Techniken Ösophagoduodenostomie Ösophagojejunostomie Abbildung 8. Häufigkeitsverteilung der operativen Verfahren der Passagewiederherstellung nach totaler Gastrektomie zwischen 1884 und 1942 [aus 213] 31 2.2. Resultate 2.2.1. Resektionsraten 100 80 54 60 40 43 28 28 21 17,5 20 0 bis 1940 1940-1955 Resektionsquote 1955-1964 Relative 5-Jahresheilung Abbildung 9. Sammelstatistik von 45 Autoren zur Resektionsquote in Gegenüberstellung mit der 5-Jahres-Überlebensrate zwischen 1940 und 1964 [228] Der Anteil der Resektionen an der Gesamtzahl der behandelten Patienten nahm im Laufe der Jahrzehnte kontinuierlich zu: lag die Resektionsrate bis 1940 bei 28%, konnte sie über 43% in den vierziger und fünfziger Jahren auf 54 % im Zeitraum zwischen 1955 und 1964 gesteigert werden (Abb. 9). Im Umkehrschluß läßt sich somit folgern, dass die Anwendung der palliativen Verfahren immer mehr in den Hintergrund trat. Hatte man vor 1940 noch häufig wegen des höheren Risikos, das mit der Magenresektion einherging, eine Gastroenterostomie angelegt, so ging man mit der Zeit sogar dazu über, auch dann noch zu resezieren, wenn die völlige Entfernung des Magenkarzinoms wegen einer allzu großen Ausdehnung auf die Nachbarorgane oder wegen nicht mehr entfernbarer Metastasen von vornherein als aussichtslos angesehen werden mußte. Hierdurch gelang es, die Beschwerden des Kranken zu lindern, und zwar oftmals über einen wesentlich längeren Zeitraum als mit der Gastroenterostomie [114]. Aber auch durch den verstärkten Einsatz von kurativen Resektionsmethoden waren 32 Erfolge zu verzeichnen. So stiegen die 5-Jahres-Überlebensraten der resezierten Patienten parallel zu den Resektionsraten an (Abb. 9). Der Wandel in der Magenkarzinomchirurgie hin zu den resezierenden Verfahren wird außerdem durch die Daten eines exemplarisch herausgegriffenen Krankenhauses deutlich (Tab. 3). Hiernach drängten die Magenresektionen nicht nur die Gastroenterostomien, sondern v.a. auch die Gastro- und Jejunostomien in den Hintergrund. Tabelle 3. Resektionsquoten einzelner Perioden am Städtischen Krankenhaus Wilmersdorf, Berlin-Halensee [227] Zeitraum Zahl explorative Laparotomie (%) Gastro- und Jejunostomie 1934-1937 156 18,6 (%) 19,2 1938-1940 157 28,0 1941-1942 145 1943-1950 139 Gastroentero- Resektionsstomie quote (%) (%) 31,4 30,8 7,7 28,6 35,7 28,9 0 23,5 47,6 24,5 1,4 19,4 54,7 33 2.2.2. Operationsmortalitäten und 5-Jahres-Überlebensraten 2.2.2.1. Gastrektomie Tabelle 4. Operationsmortalitätsraten bei der Gastrektomie zwischen 1921 und 1966 – Sammelstatistik verschiedener Operateure Autor Zeitraum Operationsmortalität Pack u. McNeer [213] 1921-1930 (%) 31,6 Pack u. McNeer [213] 1931-1943 34,3 Holder [129] 1947-1955 33,6 Maki [181] 1941-1950 20,0 Aanesen [256] 1946-1950 13,6 Holder [129] 1953-1957 12,8 Holder [129] 1955-1957 10,0 Gütgemann [102] 1948-1962 33,0 Gütgemann [102] 1956-1962 27,0 Lefevre u. Lortat-Jacob 1950 [167] Lawrence u. McNeer [170] 1951-1954 29,0 22,2 Maki [181] 1951-1960 12,1 Kuntzen [167] 1957 26,9 Ungeheuer [284] 1957 43,0 Winkelbauer [167] 1950-1957 25,0 White [292] 1953-1966 18,2 Öhmann [277] 1952-1963 30,0 34 Tabelle 5. 5-Jahres-Überlebensraten nach Gastrektomie zwischen 1917 und 1966 – Sammelstatistik verschiedener Operateure Autor Zeitraum Laheyklinik [181] 1927-1950 5-Jahres-Überlebensrate (%) 12,5 Mayoklinik [181] 1917-1961 9,9 Cohn [42] 1948-1963 2,0 Gütgemann [102] 1949-1963 20,0 Martin-Laval [132] 1950 8,0 Lawrence u. McNeer [170] 1951-1954 21,4 Winkelbauer [167] 1950-1957 21,2 White [292] 1953-1966 9,1 Öhmann [277] 1952-1963 10,0 Burian [132] 1963 18,0 35 2.2.2.2. Subtotale Magenresektion Tabelle 6. Operationsmortalitätsraten bei der subtotalen Magenresektion zwischen 1926 und 1964 – Sammelstatistik verschiedener Operateure Autor Zeitraum Simon [167] 1927-1943 Operationsmortalität (%) 15,1 Chirurg. Uniklinik Bonn [Schreiber 1972] Marshall [1947] 1926-1947 22,8 1936-1945 11,5 Ransom [167] 1934-1946 17,4 Edlund [167] 1939-1949 21,5 Beal-Hill [167] 1932-1954 12,8 Maki [181] 1936-1945 13,3 Fromme [167] 1950-1056 10,1 Nöller [167] 1950-1956 19,7 Winkelbauer [167] 1950-1956 3,6 Kuntzen [167] 1951-1955 13,5 Chirurg. Uniklinik Bonn [269] Öhmann [277] 1948-1964 22,8 1952-1963 21,0 Tabelle 7. 5-Jahres-Überlebensraten nach subtotaler Magenresektion zwischen 1928 und 1964 –Sammelstatistik verschiedener Operateure Autor Zeitraum Gütgemann [102] 1928-1948 5-Jahres-Überlebensrate (%) 13,2 Gütgemann [102] 1948-1957 17,5 Martin-Laval[132] 1950 8,0 Öhmann [277] 1952-1963 21,0 Lahey [132] 1959 10,0 Burian [132] 1963 29,0 36 2.2.2.3. Vergleich der beiden Resektionsverfahren hinsichtlich ihrer Endresultate Vergleicht man die oben erwähnten Daten der subtotalen Magenresektion und der Gastrektomie miteinander, so ist erkennbar, dass sich die Gastrektomie in ihren Ergebnissen hinsichtlich der Operationsmortalitäten und der 5-Jahres-Überlebensraten deutlich der subtotalen Magenresektion angenähert hat. Dies ist nicht zuletzt erklärbar durch den Wandel in der Wahl der kurativen Resektionsmethoden seit 1940 (siehe Punkt 2.4.1.). Der vermehrte Einsatz der Gastrektomie führte zu einem erfahreneren Umgang mit dieser Methode und schlug sich in einer Verbesserung der Heilergebnisse nieder. Die jedoch in der direkten Gegenüberstellung der Zahlen immer noch besseren Resultate nach subtotaler Magenresektion lassen sich durch die Tatsache erklären, dass der hohe Anteil an Gastrektomien letztlich zu einer relativen Besserung der Ergebnisse der Teilresektion führte, und zwar aus dem Grunde, weil für die Teilresektion von Vornherein die für den Gesamtverlauf günstigeren Befunde in Frage kamen. 37 2.2.3. Postoperative Komplikationen und Todesursachen Steingräber stellte aus den Berichten von 36 Autoren 219 Todesfälle nach Gastrektomie zwischen 1927 und 1952 zusammen [256]. Demnach stand in diesem Zeitraum die Peritonitis an erster Stelle der Todesursachen (Tab. 8). Ihr lagen sehr häufig technische Mängel zugrunde. Vor allem die Insuffizienz, zumeist an der oesophagealen Anastomose, muß hier ursächlich benannt werden [106]. Tabelle 8. Todesursachen nach Gastrektomie (1927-1952) – Sammelstatisitik von 36 Autoren [aus 256] Todesursachen Todesfälle (n) Todesfälle (%) Schock 7 3,2 subphrenischer Abszeß 8 3,6 Embolie 11 5,0 Mediastinitis 12 5,5 Kreislaufversagen 19 8,7 Nahtinsuffizienz 32 14,6 Pneumonie 41 18,7 Peritonitis u. Pleuraempyem 59 27,0 Auch nach McNeer und Pack, die den Tod von 50 zwischen 1931 und 1954 nach Gastrektomie verstorbener Patienten erforschten, hatte die Peritonitis einen Anteil von 52% an den Todesursachen, davon war bei 36% der Fälle eine Anastomoseninsuffizienz nachweisbar [186]. Die restlichen 48% der Todesfälle waren nicht durch technische Mängel begründet und verteilten sich mit 38% auf pulmonale, mit 8% auf kardiale und mit 2% auf renale Komplikationen. 38 2.2.4 Subtotale Magenresektion versus Gastrektomie 2.2.4.1. Trends in der Wahl der kurativen Resektionsmethoden 100 89,2 77 45,6 Prozent (%) 46,4 50 18,1 10,8 4,9 0 8 0 1931-1940 1941-1950 1951-1954 Jahre subtotale Gastrektomie einfache totale Gastrektomie erweiterte totale Gastrektomie Abbildung 10. Wandel in der Häufigkeitsverteilung der kurativen Resektionsmethoden zwischen 1931 und 1954 [aus 170] Die Indikationsstellung zur Gastrektomie nahm nach 1940 mehr und mehr zu und verdrängte die subtotale Magenresektion letztendlich in den fünfziger Jahren auf einen 2. Platz in der Wahl der kurativen Resektionsmethode. In dieser Zeit war ein deutlicher Vorzug der erweiterten Gastrektomie zu verzeichnen, die mit einer zusätzlichen Resektion des Omentums sowie des distalen Pancreas und der Milz einherging (Abb. 10). Von insgesamt 287 Patienten, die zwischen 1951 und 1954 am Memorial Center in New York behandelt wurden, waren 263 und somit 91,6% operabel, 112 von ihnen konnten kurativ reseziert werden (39%) (Abb. 11). Die 5-Jahres-Überlebensrate der kurativ Resezierten betrug zwischen 1951 und 1954 23,2% für alle Patienten und 26,8% für die 39 Patienten, die die Operation überlebten. Im Vergleich betrug die 5-JahresÜberlebensrate im Zeitraum 1931-1950 21,6%, unterschied sich also kaum, obwohl zwischen 1951 und 1954 die erweiterte Gastrektomie vergleichsweise häufiger durchgeführt wurde (Abb. 10). 100 85,9 91,6 65,8 Prozent (%) 50 43 39 15,5 3,6 0 1931-1940 9,1 1941-1950 9,1 1951-1954 Jahre Operabilität Resektionsrate 5-Jahresüberlebensrate Abbildung 11. Trends in bezug auf Operabilität, Resektionsrate sowie 5-Jahres-Überlebensrate beim Magen-Ca [aus 170] 40 2.2.4.2. Subtotale Magenresektion oder Gastrektomie? - Indikationen Holle und Heinrich versuchten in einer Veröffentlichung Kriterien für die Indikation zur partiellen und totalen Resektion aufzuführen [131]. Um die Entscheidung für die entsprechende Maßnahme zu erleichtern, wendeten sie eine Einteilung der Fälle in verschiedene Gruppen (A,B,C,) an: A-Fall: In diese Gruppe gehörten Tumoren, die auf den Magen begrenzt waren und noch keine sicht- oder tastbaren Metastasen in den Lymphabflußgebieten gesetzt hatten. Hier kam nach Meinung der Autoren im allgemeinen die partielle Resektion in Frage, wenn der Anspruch auf radikale Entfernung wirklich erfüllt werden konnte. B-Fall: In dieser Gruppe wurden die größeren, noch beweglichen Tumoren zusammengefaßt, die ebenfalls auf den Magen begrenzt waren, aber sichtbare Metastasen in einem bis zwei Lymphabflußgebieten gesetzt hatten. Für B-Fälle bot sich laut Holle und Heinrich besonders gut die Totalresektion mit anschließender Dünndarmzwischenschaltung nach Longmire an. C-Fall: Diese Gruppe beherbergte die fortgeschrittenen Fälle. Der Tumor hatte die Magengrenzen in mindestens eine Richtung überschritten und regionäre Metastasen oder gar Fernmetastasen gesetzt. Die Operation konnte nur noch die Absicht einer Palliativmaßnahme mit Beschwerdelinderung haben. Die Autoren vertraten die Auffassung, dass im Zuge der zurückgehenden Operationsmortalitätsraten bei der totalen Gastrektomie auf derzeit 10% (mancherorts sogar 3-4%) eine Anwendung dieser bei den sogenannten B-Fällen gerechtfertigt erschien. Die Operationsmortalitätsrate unterschied sich kaum mehr von der der partiellen Resektionen, was in der direkten Konkurrenz der Methoden nun ein Grund sein sollte, der totalen Gastrektomie den Vorrang zu geben. Schließlich galt auch schon bei Krebserkrankungen anderer Organe seit langem das Prinzip, so radikal wie möglich zu operieren. Die primären Mortalitätsraten bei der totalen Gastrektomie hatten mit bis zu 50% jedoch bisher gegen dieses radikale Vorgehen gesprochen. 41 2.3. Die Rolle der Lymphknotendissektion Coller, Kay und McIntyre veröffentlichten Anfang der vierziger Jahre eine Studie über die Untersuchung aller regionaler Lymphknoten, die vielen Chirurgen die Augen öffnete [53]. Sie konnten in 40 von 53 Fällen von Magenkarzinom einen positiven Lymphknotenbefall feststellen. Die am häufigsten befallenen Lymphknotengruppen waren nach ihrer Erkenntnis die „inferior gastric-subpyloric“ und die „superior-gastric“Lymphknoten. Es war keine Beziehung zwischen der Dauer der Symptome und dem Auftreten von Lymphknotenmetastasen und auch keine Beziehung zwischen der Größe des Tumors und dem Vorhandensein von Lymphknotenmetastasen nachzuweisen. Jedoch konnten sie aufzeigen, dass die Wahrscheinlichkeit der Metastasierung in die regionalen Lymphknoten mit der Tiefe der Tumorinfiltration in die Magenwand zunahm (Tab.9) In der Mehrheit der Fälle, in denen regionale Lymphknoten nicht palpabel waren oder, wenn palpabel, dann aber vom Chirurgen für unverdächtig gehalten wurden, konnte trotzdem eine Metastasierung nachgewiesen werden. Deshalb schlugen die Autoren vor, die 4 Lymphknotenzonen mit in die Resektion einzubeziehen, unabhängig davon ob Lymphknoten tastbar waren oder nicht, um die Heilungschancen zu erhöhen. Tabelle 9. Abhängigkeit des regionalen Lymphknotenbefalls von der Tumorinfiltrationstiefe. [aus:53] Tiefe der Tumorinfiltration Fälle gesamt (n) Fälle mit LymphknotenMetastasen (n) (%) durch die gesamte Wand mit Einbeziehen der Serosa Infiltration der Muscularis 47 5 38 2 80,8 40,0 Infiltration der Submucosa 1 0 0 Longmire und Scott wiesen in ihrem Patientengut bei 72% der totalgastrektomierten Patienten Lymphknotenmetastasen nach (Tab.10) [243]. Die Autoren folgerten aus ihrer Studie, dass der Chirurg zum Zeitpunkt der Operation nicht in der Lage war, selbst bei 42 anscheinend gut lokalisierten Magenkarzinomformen, das Ausmaß der Invasion des Tumors makroskopisch zu bestimmen. Sie bestätigten hiermit die schon 1941 von Coller et al. gemachte Aussage, dass die wirkliche Grenze des Tumors leicht unterschätzt wurde. Tabelle 10. Lymphknotenbefall in Abhängigkeit vom Karzinomtyp. [aus 243] Karzinomtyp neg. Lymphknoten pos. Lymphknoten „begrenzt“ 9 15 pos. Lymphknoten % 62 „infiltrativ“ 6 25 80 gesamt 15 40 72 („begrenzt“ oder „infiltrativ“ nach Schindler = modifizierte Borrmann-Klassifikation) Auch Sunderland et al. führten zwischen November 1950 und Januar 1953 eine Studie über den Lymphknotenbefall beim Magenkarzinom durch, ähnlich wie dies schon Coller et al. zehn Jahre vorher getan hatten [261]. Sie kamen anhand von 41 untersuchten Präparaten zu folgenden Ergebnissen: - Eine Lymphknotenmetastasierung war in 85% der Fälle eingetreten. - Tumoren des proximalen Drittels des Magens metastasierten bevorzugt in die superioren, paracardialen und pancreaticolienalen Lymphknotengruppen. Die des distalen Drittels zeigten gehäuft eine Metastasierung in die superioren, subpylorischen und inferioren Lymphknotengruppen. Tumoren des mittleren Drittels sowie solche, die den ganzen Magen befielen, metastasierten zu ähnlichen Anteilen in alle regionalen Lymphknotengruppen. - Es konnten mehr Lymphknotenmetastasen in Präparaten gefunden werden, in denen das Magenkarzinom im proximalen oder mittleren Drittel lokalisiert war. Am meisten befallene Lymphknoten fanden sich jedoch bei Tumoren, die den gesamten Magen mit einbezogen hatten. - Die Infiltrationstiefe des Karzinoms schien einen signifikanten Einfluß auf das Ausmaß der Lymphknotenmetastasierung zu haben. 43 Remine und Priestley erforschten den Zusammenhang zwischen der Lokalisation befallener Lymphknoten und der Überlebenschance und berichteten 1953 über ihre Resultate (Tab. 11). Auffallend war, dass in der Gruppe der 5-Jahres-Überlebenden nur 6% betroffene subpylorische Lymphknoten hatten, während in der Gruppe der früher Verstorbenen 71% betroffene subpylorische Lymphknoten aufwiesen. Tabelle 11. Abhängigkeit der Überlebenschance von der Lokalisation befallener Lymphknoten. [229] kleine Kurvatur betroffene LK (%) bei 5Jahres-Überlebenden 65 betroffene LK (%) bei nach 1 Jahr Verstorbenen 38 große Kurvatur 15 3 beide Kurvaturen 20 59 subpylorisch 6 71 Lokalisation Fly et al. befaßten sich 1956 mit dem Thema der Beziehung zwischen dem Lymphknotenbefall und der Lokalisation des Magenkarzinoms. Ihre Ergebnisse deuteten auf eine Abhängigkeit dieser beiden Parameter hin (Tab. 12). Karzinome der proximalen Magenhälfte oder solche, die über 80% des Magens befielen, gingen mit einer höheren Anzahl betroffener Lymphknoten einher als Karzinome der distalen Magenhälfte. 44 Tabelle 12. Abhängigkeit des Lymphknotenbefalls von der Lokalisation des Magenkarzinoms .[aus 82] Lokalisation des Karzinoms im Magen Gesamt Milzhilus Fälle n 20 betroffene LK % 75 Fälle n 6 betroffene LK % 30 proximale Hälfte 66 85 25 38 > 80 % betroffen 16 88 6 38 distale Hälfte Aus den beiden zuletzt erwähnten Studien schloß man, mehr Gewicht auf die Entfernung der regionalen Lymphknoten legen zu müssen. Unter „radikaler subtotaler Gastrektomie“ bei distalen malignen Magenläsionen verstand man von nun an die Resektion des Magens zu 80-85% sowie des gesamten Omentums und der Milz mit ihren hilären Lymphknoten. Außerdem verlangte die Methode die Mitentfernung des proximalen Teils des Duodenums und aller benachbarter Lymphknoten um den Pankreaskopf herum sowie der subpylorischen und superioren retropankreatischen Lymphknoten, gefolgt von den Lymphknoten entlang der A. hepatis bis hin zu denen um den Truncus coeliacus herum. Anhand ihrer Daten bestätigten Remine et al., dass sowohl die Operationsmortalität als auch die 5-Jahresüberlebensrate bei positivem Lymphknotenbefall beeinflußt wurden (Abb. 12) [230]. Die Operationsmortalität war zwischen 1907 und 1939 bei vorhandenen Lymphknotenmetastasen mit 18 % um ca. 4 % höher als ohne Lymphknotenbefall. Sie konnte in den Jahren 1940-1959 auf 8,9 % gesenkt werden und lag dann nur noch um 1 % höher als ohne Lymphknotenbefall. 45 18 20 13,8 15 8,9 7,9 Op-Mortalität (%) 10 5 0 1907-1939 1940-1959 Jahre pos. Lymphknotenbefall neg. Lymphknotenbefall Abbildung 12. Operationsmortalität in Abhängigkeit von positivem bzw. negativem Lymphknotenbefall [aus 230] 46 2.4. Die „gastrectomie totale de principe“ Die französischen Chirurgen Lefèvre und Lortat-Jacob stellten 1950 die Forderung nach der „gastrectomie totale de principe“ auf, hinter der sich der Grundsatz verbarg, in jedem Fall von Magenkarzinom eine Gastrektomie als prinzipielle Gastrektomie auszuführen. Sie kehrten damit dem von vielen Chirurgen vertretenen Prinzip den Rücken, nur bei völligem Befall des Magens die Gastrektomie anzuwenden („gastrectomie totale de nécessité“) und fanden viele Anhänger, aber auch Gegner [102]. Lefèvre und Lortat-Jacob sahen ihre Vorgehensweise aufgrund einer in der Literatur bestätigten abnehmenden Letalität nach Gastrektomie berechtigt [176, 178]. Ihr Grundgedanke bestand darin, durch erhöhte Radikalität die Anzahl lokaler Rezidive zu senken und damit die Überlebensraten zu verbessern [53]. 47 3. Phase der Systematisierung und Präzisierung Aus der Erkenntnis, dass die Prognose des Magenkarzinoms bedeutend von der Infiltrationstiefe des Tumors sowie dem Vorhandensein bzw. der Abwesenheit von Lymphknotenmetastasen beeinflußt wurde, resultierte in den sechziger und siebziger Jahren der Gedanke an eine stadienorientierte Chirurgie [145, 230]. Dieser entstand im wesentlichen auf dem Boden des in etwa zur gleichen Zeit eingeführten und fortan für das Magenkarzinom weiterentwickelten TNM-Systems und der Laurén-Klassifikation [169]. Nur durch eine einheitliche, reproduzierbare Stadieneinteilung konnten sich Vergleiche von Therapieergebnissen anstellen lassen, adäquate Therapiemaßnahmen ergriffen und prognostische Schlüsse hinsichtlich des Krankheitsverlaufes gezogen werden. 3.1. Klassifizierungssysteme 3.1.1. Laurén-Klassifikation des Magenkarzinoms Die Klassifikation nach Laurén unterscheidet zwei verschiedene Typen des Magenkarzinoms aufgrund morphologischer Kriterien: 1. den Intestinaltyp, der durchweg scharf gegen die Umgebung abgegrenzt ist. Er bildet Drüsen aus Zylinderepithel, das dem intestinalen Epithel gleicht und Schleim produziert. 2. den diffusen Typ, bei dem es sich um entdifferenzierte Adenokarzinome, um Tumoren mit erheblicher Zelldissoziation oder um Siegelzellkarzinome handelt, die jeweils unscharf zur Umgebung abgegrenzt sind [169]. 48 3.1.2. TNM-System beim Magenkarzinom T-Primärtumor TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor Tis Carcinoma in situ: intraepithelialer Tumor ohne Infiltration der Lamina propia T1 Tumor infiltriert Lamina propria oder Submucosa T2 Tumor infiltriert Muscularis propria oder Subserosa T3 Tumor penetriert Serosa (viscerales Peritoneum), infiltriert aber nicht benachbarte Strukturen T4 Tumor infiltriert benachbarte Strukturen N-Regionäre Lymphknoten NX Regionäre Lymphknoten können nicht beurteilt werden N0 Keine regionären Lymphknotenmetastasen N1 Metastasen in perigastrischen Lymphknoten weniger als 3 cm vom Rand des Primärtumors N2 Metastasen in perigastrischen Lymphknoten weiter als 3 cm vom Rand des Primärtumors oder in Lymphknoten entlang den Aa.gastrica sinistra, hepatica communis, lienalis oder coeliaca M-Fernmetastasen MX Das Vorliegen von Fernmetastasen kann nicht beurteilt werden M0 Keine Fernmetastasen M1 Fernmetastasen 3.1.3. UICC-Stadieneinteilung beim Magenkarzinom Tabelle 13. UICC-Stadieneinteilung beim Magenkarzinom (p) M0 (p) M1 (p) N0 (p) N1 (p) N2 (p) T1 IA IB II IV (p) T2 IB II IIIA IV (p) T3 II IIIA IIIB IV (p) T4 IIIA IIIB IV IV 49 3.2. Therapeutische Konsequenz des Staging und Typing: Gastrektomie „de principe“oder Gastrektomie „de nécessité“? Diese Frage zog sich aufgrund von Unsicherheiten hinsichtlich der Ausbreitungsgrenzen des Primärtumors und der Erfassung von Lymphknotenmetastasen seit der durch Lefèvre und Lortat-Jacob 1950 gestellten Forderung der Gastrektomie „de principe“ durch mehrere Jahrzehnte und teilte die Chirurgen der ganzen Welt in zwei Gruppen auf. Im folgenden sollen die beiden verschiedenen Standpunkte wiedergegeben werden. Dabei handelt es sich lediglich um Argumente der einen oder anderen Seite. Beweise konnten mangels prospektiver, randomisierter Studien von den Vertretern beider Gruppen kaum erbracht werden und die Ergebnisse, die zur Verteidigung der eigenen Ansicht herangezogen wurden, waren zwangsläufig durch die Bevorzugung der jeweiligen Methode beeinflußt. Abbildung 13. Gastrectomie de principe und Gastrectomie de nécessité [aus 218] 50 3.2.1. Die Vertreter der Gastrektomie „de nécessité“ Die Vertreter der Gastrektomie „de nécessité“ waren der Ansicht, dass es einen Regeleingriff, eine „Standardoperation“, nicht geben konnte, da „das“ Magenkarzinom an sich nicht existierte. Es existierten in ihren Augen nur verschiedene pathohistologische und klinische Formen des Magenkarzinoms, die einer individuelleren, stadienorientierten Behandlung bedurften [23, 121]. Neben dem präoperativen Staging spielte die Kenntnis der Histomorphologie des Magenkarzinoms seit der durch Laurén 1964 eingeführten histologischen Tumorklassifikation eine immer bedeutendere Rolle in der Wahl der chirurgischen Therapiemethode. Entscheidend für die richtige Wahl war demnach die durch verschiedene histologische Beobachtungen an Tumorresektaten gewonnene Kenntnis der vom jeweiligen Tumortyp abhängigen unterschiedlichen Tumorausbreitung. Während sich der Intestinaltyp und der auf die Mukosa und Submukosa begrenzte diffuse Typ nur wenige mm jenseits der makroskopisch erkennbaren Tumorgrenze ausbreiteten, ließen sich beim fortgeschrittenen diffusen Karzinom in makroskopisch unauffälliger Tumorwand mehrere cm weit vom makroskopischen Tumorrand entfernt noch Tumorzellverbände histologisch nachweisen [119]. So wurden orale und aborale Sicherheitsabstände für die distale Magenresektion formuliert, die den unterschiedlichen histomorphologischen Befunden nach Laurén gerecht werden sollten (Tabelle 14). Man resezierte den Primärtumor mit dem notwendigen Sicherheitsabstand, jedoch ohne Mitentfernung unauffälliger Lymphknoten. Dabei stand außer Frage, dass die Gastrektomie bei Tumoren des oberen Magendrittels und bei Karzinomen vom diffusen Typ aller Magenabschnitte Mittel der Wahl war, um die peritumoralen Sicherheitszonen einhalten zu können [218]. Die Gastrektomie „de principe“ wurde nur in Fällen von Magenkarzinomen des unteren und bei einem Teil von Karzinomen des mittleren Drittels, denen vom intestinalen Typ, abgelehnt [277]. Hauptargumente gegen die Gastrektomie „de principe“ waren die mit ihr einhergehende höhere Operationsmortalität sowie die schlechtere Lebensqualität, die durch einen Restmagen eher garantiert werden konnte [113, 163, 281]. 51 Tabelle 14. Peritumorale Sicherheitszonen in cm. [aus 113* , 121**] Autoren Jahr intestinaler Typ/oral intestinaler Typ/aboral diffuser Typ/ oral 10 diffuser Typ/ aboral 2 Baumgartl et al.* 1969 4 2 Junginger et al* 1980 5 Allgöwer, Neff* 1982 5 3 10 10 Kümmerle* 1982 6-8 6-8 >10 >10 Peiper, Castrup* 1982 5 3 >8 >8 Herfarth* 1983 6 6 >6 >6 Kieler Klinik* 1983 6-8 6-8 10 10 Hermanek** 1989 >4-5 5 >8-10 3.2.2. Die Vertreter der Gastrektomie „de principe“ Die Vertreter der Gastrektomie „de principe“ wollten diese nicht als das Nonplusultra in der Behandlung des Magenkarzinoms sehen, erklärten sie jedoch in Fällen, in denen eine radikalere Vorgehensweise zu einer Verbesserung der Gesamtergebnisse führen konnte, als indiziert [190, 191, 220]. Diese Situation war bei Tumoren des Stadiums T12 N0-1 M0 im Bereich der distalen Magenhälfte gegeben [218]. Immer wieder beschriebene locoregionäre Rezidive nach distaler Magenresektion unterstützten die Annahme, dass die Radikalität bei der partiellen Magenresektion häufig unzureichend war (Tab. 15). Nach den 1984 von der British Stomach Cancer Study Group publizierten Untersuchungen wurde die 5-Jahresüberlebensrate nach subtotaler Magenresektion durch mangelnde Radikalität, die durch tumorbefallene Schnittränder bewiesen wurde, von 20 auf 10% gesenkt [43]. Auch Bozzetti konnte in 7,3% der Fälle positive Schnittränder feststellen [35]. Größere Radikalität war außerdem im Zusammenhang mit der Lymphadenektomie, v.a. im Bereich des Milzhilus, notwendig. Die vollständige Exstirpation aller Lymphknoten war nach Meinung der Vertreter der Gastrektomie „de principe“ nur durch die Gastrektomie garantiert. Zusätzlich sollten die Milz und das große und kleine Netz entfernt werden. 52 Im Gegensatz zu den Befürwortern der Gastrektomie „de nécessité“ schätzte man die Letalität sowie die funktionellen Ergebnisse aufgrund eigener positiver Erfahrungen als vertretbar ein [220]. Tabelle 15. Lokale Rezidive nach subtotalen aboralen Resektionen wegen eines Magenkarzinoms. [aus 220] Autoren Rezidiv im Magenstumpf Kuru (1943; 1952) 49,0% Rezidiv der perigastrischen Lymphknoten 21,7% McNeer (1958) 62,2% 25,7% Hamaguchi (1959) 65,4% 19,2% Inuzuka (1960) 45,5% 13,6% Berne (1961) 78,6% 10,7% Schreiber (1964) 65,9% 34,1% Koga (1969) 64,5% 22,5% 53 3.2.3. Resultate 3.2.3.1. Resektionsraten Tabelle 16. Resektionsraten zwischen 1965 und 1993 – Sammelstatistik verschiedener Operateure Autor Zeitraum Keller u. Kinsey* 1965 Resektionsrate (%) 38,7 Gilbertsen [96] 1969 45,6 Nielsen* 1974 50,0 Inberg [135] 1975 31,0 Kenter u. Zwaveling* 1975 54,0 Cassell u.Robinson* 1976 45,7 Svennevig u. Nysted* 1976 45,0 Gall u. Hermanek [87] 1969-1977 60,8 Costello* 1977 66,4 Pichlmayr [219] 1968-1978 71,9 Häring [1994] 1969-1980 55,5 Adashek* 1979 44,0 Gall u. Hermanek [87] 1978-1982 75,9 Stewart* 1982 39,0 Nelson u. Collier* 1982 56,0 Yap* 1982 50,5 Meyer [192] 1979-1983 75,9 Diehl [62] 1983 58,0 Nagata et al.* 1983 77,7 Häring [108] 1981-1985 75,9 Günther [101] 1981-1985 70,0 Roukos [239] 1979-1986 72,7 Armstrong u. Dent* 1986 45,3 Viste [287] 1988 65,0 Mitsudomi [199] 1989 84,6 54 Meyer [194] 1984-1990 79,5 Gebhardt [92] 1985-1990 71,0 Böttcher [27] 1982-1991 88,3 Siewert [250] 1986-1989 82,7 Häring [108] 1986-1993 87,0 Nürnberger [212] 1988-1993 82,0 [* aus 42] Im Laufe der letzten dreißig Jahre ist es zu einer deutlichen Zunahme der Resektionsrate gekommen. Diese lag in den sechziger und siebziger Jahren bei ca. 50%, nahm in den achtziger Jahren auf über 60% zu und konnte in den neunziger Jahren mit durchschnittlichen Werten über 80% noch gesteigert werden (Tab. 16). 55 3.2.3.2. Operationsmortalität und 5-Jahres-Überlebensraten 3.2.3.2.1. Gastrektomie Tabelle 17. Operationsmortalitätsraten nach der Gastrektomie zwischen 1968 und 1995 – Sammelstatistik verschiedener Operateure. Autor Zeitraum Pichlmayr [220] 1968-1971 Operationsmortalität (%) 18,2 Pichlmayr [220] 1972-1975 13,9 Pichlmayr [220] 1976-1977 6,3 Häring [108] 1969-1980 27,0 Gall [87] 1969-1977 22,5 Diehl [62] 1970-1980 7,0 Gall [87] 1978-1982 11,5 Bittner [23] 1982-1987 2,4 Häring [108] 1981-1985 15,1 Häring [108] 1986 1,5 Bittner [23] 1969-1987 9,3 Roukos [239] 1979-1986 8,9 Braga [40] 1980-1991 2,8 Gouzi [97] 1988 1,3 Meyer [192] 1968-1988 7,9 Bozetti [37] 1992 4,7 Msika [205] 1984-1995 7,9 Deguili [58] 1994-1995 4,5 56 Tabelle 18. 5-Jahres-Überlebensraten nach Gastrektomie zwischen 1964 und 1990 – Sammelstatistik verschiedener Operateure. Autor Zeitraum Hartmann [277] 1964 5-Jahres-Überlebensrate (%) 8,0 ReMine [277] 1966 9,9 Mouchet [132] 1967 13,0 Maki [181] 1969 7,7 Giuli [132] 1972 33,0 Öhmann [277] 1972 8,0 Cohn [42] 1963-1973 18,0 Maillet [132] 1977 17,0 Gall [87] 1969-1977 29,7 Schwemmle [277] 1975 15,9 Lortat-Jacob [178] 1975 33,3 Guivarch [277] 1976 17,0 Cassell [42] 1976 8,0 Diehl [62] 1970-1980 13,0 Pichlmayr [37] 1979 37,0 Cohn [42] 1973-1983 33,0 Gall [87] 1978-1983 41,7 Meyer [37] 1968-1990 36,2 57 3.2.3.2.2. Subtotale Magenresektion Tabelle 19. Operationsmortalitätsraten nach der subtotalen Magenresektion zwischen 1956 und 1995 – Sammelstatistik verschiedener Operateure. Autor Zeitraum Schwemmle [277] 1956-1973 Operationsmortalität (%) 9,7 Maki [181] 1961-1967 2,1 Gall [87] 1969-1977 11,3 Pichlmayr [220] 1968-1978 12,6 McNeer [37] 1974 18,8 Lortat-Jacob [37] 1975 16,8 Peiper [218] 1978 13,5 Pichlmayr [37] 1979 14,2 Häring [108] 1969-1980 14,7 Diehl [62] 1970-1980 4,0 Bittner [23] 1969-1987 7,8 Gall u. Hermanek [87] 1978-1982 3,2 Roukos [239] 1979-1986 3,2 Häring [108] 1980-1985 13,7 Häring [108] 1986 4,2 Gouzi [97] 1988 3,2 Meyer [37] 1989 10,1 Braga [40] 1980-1991 1,1 Bozzetti [37] 1992 1,9 Deguili [58] 1994-1995 1,3 58 Tabelle 20. 5-Jahres-Überlebensraten nach subtotaler Magenresektion zwischen 1956 und 1990 – Sammelstatistik verschiedener Operateure. Autor Zeitraum Mouchet [132] 1967 5-Jahres-Überlebensrate (%) 30,0 Schwemmle [277] 1956-1973 32,8 Giuli [132] 1972 20,0 Maillet [132] 1977 25,0 Diehl [62] 1970-1980 33,0 Bittner [23] 1969-1982 15,0 Hollender [132] 1983 26,0 Meyer [37] 1969-1990 34,5 Ziel der Auflistung der obigen Daten ist es nicht, einen Vergleich der subtotalen Magenresektion mit der Gastrektomie anzustellen, um die Effektivität der einen oder anderen Methode zu unterstreichen. Eine Wertung der Ergebnisse der subtotalen Magenresektion gegenüber der Gastrektomie ist auf diese Weise nicht möglich. Hierzu wären größere randomisierte Studien mit gleichen Ausgangsbedingungen, v.a. hinsichtlich des Tumorstadiums, notwendig, die jedoch fehlen. Allein eine Entwicklung der prognosebestimmenden Parameter Operationsmortalität und 5-Jahres- Überlebensrate im Laufe der letzten 30 Jahre ist den Tabellen zu entnehmen. Demnach haben die Operationsmortalitätsraten sowohl bei der subtotalen Magenresektion als auch bei der Gastrektomie abgenommen und die 5-Jahres-Überlebensraten konnten bei beiden Verfahren verbessert werden. 59 1.2.3.3. Postoperative Komplikationen und Todesursachen 3.2.3.3.1. Vergleich der Komplikationsraten nach subtotaler Magenresektion und Gastrektomie Wie aus der Zusammenstellung der in Tabelle 21 aufgeführten Studien hervorgeht ist die Gastrektomie heutzutage immer noch mit um ca. 10 bis 15% höheren Komplikationsraten verbunden als die subtotale Magenresektion. Tabelle 21. Komplikationsrate nach subtotaler distaler Gastrektomie und totaler Gastrektomie Autor Zeitraum Komplikationsrate (%) Yan u. Brooks [298] 1958-1982 distale subtotale Gastrektomie 22,8 totale Gastrektomie 34,0 Viste [287] 1982-1984 19,0 38,0 Böttcher [27] 1986-1989 19,9 30,0 Mendes de Almeida 1980-1991 [189] Braga [40] 1980-1991 6,5 23,3 19,0 22,4 3.2.3.3.2. Welche Komplikationen stehen im Vordergrund? Auch in den sechziger und siebziger Jahren hatte die Insuffizienz der oesophagojejunalen Anastomose den größten Anteil an der Letalität nach der Gastrektomie [203, 215]. Dies wird u.a. aus den von Peiper und Siewert zusammengestellten Zahlen verschiedener Autoren deutlich. Hiernach kam es bei durchschnittlich 17,4% aller Rekonstruktionen zu einer Nahtinsuffizienz, die in 42,6% der Fälle die Todesursache darstellte [217]. In den folgenden zwei Jahrzehnten konnte die Komplikationsrate der Anastomoseninsuffizienz zunehmend gesenkt werden (Tab. 22). Zwischen 1980 und 1987 betrug sie z.B. an der chirurgischen Universitätsklinik Köln 7,6% und an der 60 chirurgischen Universitätsklinik Mainz 6,5%. [147]. In der deutschen Magenkarzinomstudie 1992 wurde in 7,2% der Fälle eine Anastomoseninsuffizienz im Bereich der Oesophagojejunostomie festgestellt. Dietl und Rumpf berichteten von 5,5% und Braga und Mitarbeiter von 4,9% [40, 63, 234]. Tabelle 22. Insuffizienz der oesophagojejunalen Anastomose nach Gastrektomie – Zusammenstellung der Ergebnisse einiger Kliniken im Zeitverlauf. Klinik Zeitraum Proximale Anastomoseninsuff. (%) Med. Hochschule Hannover [219] Chirurg. Uniklinik Köln [147] Chirurg. Uniklinik Mainz [147] Deutsche MagencarcinomStudie [27] Städtische Kliniken Fulda [63] Chirurg. Uniklinik Milan [40] 1968-1973 4,8 1974-1978 12,1 1978-1983 12,5 1984-1989 3,6 1980-1987 7,6 1980-1987 6,5 1986-1989 7,2 1984-1994 5,5 1980-1991 4,9 Weitere ernst zu nehmende Komplikationen waren und sind bis heute kardiopulmonale Störungen [27] sowie intraabdominelle Abszesse [27, 40, 63]. 61 3.2.4. Indikation zur Gastrektomie bzw subtotalen Magenresektion: Aktueller Stand Entsprechend den 1995 verabschiedeten Richtlinien zur multimodalen Therapie des Magenkarzinoms durch die 3 Arbeitsgemeinschaften der Deutschen Krebsgesellschaft (CAO, AIO und ARO) erfordert die chirurgische Therapie eine Einhaltung eines adäquaten Sicherheitsabstandes von 5 bzw. 8 cm in situ. Die Entscheidung für die Gastrektomie oder die subtotale Resektion wird von der Tumorlokalisation, dem histomorphologischen Typ und der individuellen Risikobeurteilung abhängig gemacht. Dabei ist beim diffusen Typ in der Regel die Indikation für die Gastrektomie gegeben. Solange ein oraler Sicherheitsabstand von 5 cm gewährleistet bleibt sind die subtotale Resektion und die Gastrektomie bei Karzinomen des intestinalen Typs im unteren und mittleren Magendrittel als gleichwertig anzusehen [148]. 3.2.5. Magenersatz: Bevorzugte Rekonstruktionsverfahren Nach einer Umfrage von Kieninger und Koslowski wurden 1982 in deutschen Kliniken vorzugsweise folgende drei Rekonstruktionsverfahren verwendet [152]: das Jejunuminterponat nach Longmire-Gütgemann (31,8%), die Roux-Y-Schlinge (30,3%) und die termino-laterale Ösophagojejunostomie nach Schloffer-Graham (27,2%) (Abb.14 a-c). Abb. 14a) Longmire-Gütgemann b) Roux-Y 62 c) Schloffer-Graham Die Jejunuminterposition trat jedoch in den folgenden Jahren immer mehr zugunsten der Oesophagojejunostomie in den Hintergrund. Ein Großteil der Chirurgen zieht seit Ende der achtziger Jahre die Roux-Y-Rekonstruktion der Jejunuminterposition nach der Gastrektomie vor [118, 172, 208, 282]. 1988 ergaben die Ergebnisse einer europäischen Multicenterstudie, dass die Roux-Y-Methode an 56 von 62 Kliniken (90%) angewendet wurde, davon in 34 Kliniken (55%) sogar ausschließlich [115]. Die Jejunuminterposition fand hingegen in 25 von 62 Kliniken (40%) Anwendung, davon ausschließliche nur an einer Klinik (2%). Der Grund ist die Tatsache, dass sie technisch schwieriger und, wie aus einer neueren Studie bekannt wurde, auf längere Sicht noch nicht einmal für den Patienten gewinnbringender ist [84]. Sie verlangt eine Anastomose mehr als die Roux-Y-Methode und birgt zudem die Gefahr einer Minderdurchblutung des jejunalen Segmentes in sich. Zwei Risiken für unerwünschte Komplikationen, denen man mit der Oesophagojejunostomie aus dem Wege gehen kann. Immer mehr Popularität gewann auch seit ihrer Erstbeschreibung im Jahre 1973 die Oesophago-Jejunoplicatio (Abb.) [115, 247, 270]. Dabei steht heutzutage weniger die Refluxprävention im Vordergrund der Argumentation als vielmehr der Vorteil der Sicherung der oesophago-jejunalen Anastomose durch die Jejunummanschette. Über eine Kombination der Roux-Y-Rekonstruktion mit dem sogenannten Pouch liegen positive Ergebnisse einer randomisierten Studie aus Japan vor [209]. 63 3.3. Lebensqualität nach Magenresektion Operationsletalität, Morbidität und 5-Jahresüberlebensraten sind die entscheidenden Prognosefaktoren in der chirurgischen Behandlung des Magenkarzinoms. Nachdem in den letzten Jahren die technischen Probleme weitgehend gelöst und die Letalität und Morbidität, v.a. auch bei der Gastrektomie, auf kaum zu verbessernde Werte gesenkt werden konnten, gilt einem weiteren Beurteilungskriterium bei der Suche nach einer geeigneten Behandlungsmethode vermehrtes Interesse, der postoperativen Lebensqualität. Ziel eines jeden Chirurgen muß es sein, die eventuell kurze verbleibende Zeit des Patienten so erträglich wie möglich zu gestalten. Eine einheitliche Definition des Begriffes der „Lebensqualität“ existiert bisher nicht. Er umfaßt eine Vielzahl von Aspekten, die man durch verschiedene Meßmethoden zu bestimmen versuchte [73, 123, 299]. 3.3.1. Subtotale Magenresektion versus Gastrektomie Die subtotale Magenresektion und die Gastrektomie zeigen bei der kurativen Resektion des Magenkarzinoms unter Beachtung der Radikalitätsprinzipien mittlerweile keine prognostischen Unterschiede mehr [37, 233]. Um so bedeutsamer ist der Faktor der Lebensqualität zur Bestimmung des Erfolges der operativen Eingriffe. Dabei wird die subtotale Magenresektion weitläufig als die physiologischere Verfahrensweise angesehen, unterstützt durch postoperative Gastrektomiebefunde wie DumpingSyndrom, postprandiale Blähungen oder Schmerzen und fehlendes Hungergefühl [59, 291]. In einigen neueren Studien wurde nun versucht, diese Beschwerden zu objektivieren und mit Hilfe verschiedener Scores einen Vergleich der Lebensqualität nach subtotaler Resektion und Gastrektomie anzustellen [45, 141, 235, 262]. 64 3.3.1.1. Studienergebnisse Die Resultate bisheriger Studien differieren sehr. Buhl und Mitarbeiter schlossen 1995 aus ihren Untersuchungen, dass sich die Lebensqualität hinsichtlich funktioneller und psychosozialer Parameter nach Gastrektomie mit Pouchrekonstruktion und nach subtotaler Magenresektion nicht unterscheidet [45]. Hingegen kam man in einer anderen Studie anhand von drei standardisierten Fragebögen (Beschwerdeliste nach von Zerssen, Fragebogen zur Belastung von Krebspatienten, Fragen zur Lebenszufriedenheit) zu dem Ergebnis, dass die Patienten nach subtotaler Magenresektion signifikant mehr Beschwerden hatten und allgemein unzufriedener, v.a. mit der Funktion des Verdauungstraktes, waren als die Patienten nach Oesophago-Jejunoplicatio und Pouch-Versorgung [235]. Was die Analyse der Einzelbeschwerden anbelangt, so traten folgende Symptome signifikant häufiger in der Gruppe der subtotal Resezierten auf: Rückenschmerzen, Überempfindlichkeit gegen Kälte und Wärme, Schlaflosigkeit, Sodbrennen und postprandiale Übelkeit. Die geringere Lebensqualität wurde auf einen vermehrt vorhandenen intestinoösophagealen Reflux bei inkompetenter Kardia und Billroth-II-Resektion zurückgeführt. Diese Ergebnissse konnten wiederum in zwei weiteren Studien nicht bestätigt werden [141, 262]. Anhand des Gastrointestinalen Lebensqualitätsindexes nach Eypasch (1993) ermittelte Jentschura signifikant bessere Resultate bei Patienten nach subtotaler Resektion als nach Gastrektomie v.a. was die krankheits- und therapiebezogenen Symptome sowie den funktionellen Aspekt anbelangte. Keine Unterschiede ließen sich hinsichtlich des psychosozialen Status zwischen den beiden Patientengruppen feststellen [141]. Ebenso konnte Svedlund signifikant häufiger auftretende gastrointestinale Beschwerden bei Patienten mit Gastrektomie als bei denen mit subtotaler Resektion aufzeigen. Diese ließen sich auch nicht durch eine PouchRekonstruktion nach Gastrektomie verbessern [262]. 65 3.3.2. Gastrektomie: Verbesserte Lebensqualität durch die OesophagoJejunoplicatio Unabhängig von der Art der Passagerekonstruktion bedeutet die Gastrektomie einen beträchtlichen Eingriff in die Funktion des oberen Gastrointestinaltraktes. Hauptauswirkungen sind Gewichtsverluste, die aufgrund von fehlendem Appetit und Hunger durch eine reduzierte Nahrungsaufnahme begründet sind [38]. Gibt es Unterschiede hinsichtlich der Lebensqualität von gastrektomierten Patienten in Abhängigkeit vom jeweiligen Rekonstruktionsverfahren (Oesophagojejunostomie oder Oesophago-Jejunoplicatio)? Mit diesem Thema setzte man sich bisher in einigen Studien auseinander. 3.3.2.1. Studienergebnisse Roder et al. (1992) erhoben die Daten von 178 mit Oesophago-Jejunoplicatio mit Pouch oder mit einfacher Oesophago-Jejunostomie ohne Pouch versorgten Patienten zur Beurteilung der Lebensqualität anhand von drei bewährten Fragebögen: „allgemeine körperliche Beschwerden“, „Lebenszufriedenheit“ und „psychosoziale Belastungen“. Bei der Auswertung ergab sich ein signifikant geringeres Beschwerdebild bei den Patienten mit Pouch-Versorgung im Vergleich zu denen mit einfacher OesophagoJejunostomie. Der Summenwert der Pouch-Gruppe zeigte sogar keinen signifikanten Unterschied zu demjenigen einer repräsentativen Stichprobe aus der Bevölkerung. Auch die Fragen zur Lebenszufriedenheit wurden in der Pouch-Gruppe signifikant positiver beantwortet. Hinsichtlich der psychosozialen Belastung unterschied sich der Summenwert zwischen beiden Gruppen nicht signifikant. Auffällig war darüberhinaus, dass bei der Nachuntersuchung das Körpergewicht der Pouch-Gruppe signifikant geringer vom nach Broca berechneten Normalgewicht abwich (–2,1 ± 7,7 kg) als in der Vergleichsgruppe (–7,3 ± 7,8 kg). Die Lebensqualität und der Ernährungszustand korrelierten also bedeutsam, eine Tatsache, die den Stellenwert der ungehinderten Nahrungsaufnahme nach totaler Gastrektomie unterstreicht [233]. In einer neueren Studie kam auch die Arbeitsgruppe um Buhl zu dem Schluß, dass die 66 einfache Ösophagojejunostomie einen signifikanten Nachteil hinsichtlich der Lebensqualität gegenüber der Pouchrekonstruktion hat [45]. Diese Aussage konnte durch die Ergebnisse von Nakane und Mitarbeitern unterstützt werden, die in einer randomisierten Studie die einfache Roux-Y-Rekonstruktion, die Roux-Y- Rekonstruktion mit Pouch und die Jejunuminterposition mit Pouch verglichen [209]. Demnach war die Inzidenz postprandialer Symptome wie Völlegefühl, Übelkeit und Erbrechen in der Gruppe der Patienten mit Roux-Y-Rekonstruktion und Pouch am geringsten, die tägliche Nahrungsaufnahme signifikant höher als in den beiden anderen Gruppen und folglich auch das Körpergewicht am höchsten. Die Resultate deuteten also darauf hin, dass eine Verbesserung der postoperativen Beschwerden und der Lebensqualität am besten durch die Roux-Y-Methode mit Pouch erreicht werden konnte. 67 3.4. Die Bedeutung der Lymphknotendissektion In über 2/3 der Fälle von resektablem Magenkarzinom mußte von einer positiven Lymphknotenbeteiligung ausgegangen werden [243, 261]. Lymphknotenmetastasen waren neben der Serosainfiltration ein vieluntersuchter Faktor, der, wie aus zahlreichen Studien [50, 187, 198, 292] hervorging, die Resultate der chirurgischen Behandlung des Magenkarzinoms signifikant beeinflußte (Tab. 23 und Abb. 15). Tabelle 23. Einfluß regionaler Lymphknotenmetastasen auf die 5-Jahres ÜLR [aus 292] Gesamtzahl 5-Jahres-Überlebende (n) Gesamtzahl an Patienten 242 45 Überlebende (%) 18,6% Patienten mit neg. LK 84 32 38,1% Patienten mit pos. LK 158 13 8,2% 100 73,3 52 5-JahresÜberlebensrate (%) 43,3 50 33,3 0 n neg. n1 pos n2 pos n3 pos Lymphknotenbefall Abb. 15. 5-Jahres-Überlebensrate nach unterschiedlichem Lymphknotenbefall [aus 44] 68 3.4.1. Die systematische Lymphadenektomie Obwohl die Rolle der Lymphknotendissektion bereits in den vierziger und fünfziger Jahren erkannt worden war, waren die Resultate nicht überzeugend genug gewesen, um einer radikaleren Verfahrensweise einen Stellenwert in der operativen Behandlung des Magenkarzinoms einzuräumen. Dieser wurde erst nach und nach durch die Daten japanischer Studien deutlich. Über mehr als 2 Jahrzehnte führten japanische Chirurgen die systematische erweiterte Lymphknotendissektion (SELD) beim Magenkarzinom durch und unterstrichen anhand ihrer Ergebnisse die Bedeutung der systematischen Lymphadenektomie für das Erreichen besserer 5-Jahres-Überlebensraten [142, 156, 185, 200, 254, 255]. 3.4.1.1. Das japanische Klassifizierungssystem der Lymphknoten des Magens Bei der Lymphknotensuche stützten sich die Japaner auf die durch die Japanese Research Society for Gastric Cancer (1981) beschriebene Katalogisierung der unterschiedlichen Lymphknoten (Abb. 16). Demnach besitzt jeder Lymphknoten eine Nummer (1-16), ist einer anatomischen Region zugeordnet und entsprechend seiner Entfernung zum Magen mit anderen Lymphknoten in einer Gruppe zusammengefaßt. Insgesamt existieren 3 Gruppen (sogen. Kompartments). Kompartment I umfaßt die der Magenwand am dichtesten anliegenden Lymphknoten mit den Nummern 1-6. Kompartment II schließt die Lymphknoten mit den Nummern 7-11 ein, während das Kompartment III die weiter vom Magen entfernten Lymphknoten beinhaltet, die die Nummern 12-16 tragen. 1 - rechts parakardial 9 - Truncus coeliacus 2 - links parakardial 10 - Milzhilus 3 - kleine Kurvatur 11 - A. lienalis 4 - großeKurvatur 12 - Lig. hepatoduodenale 5 - suprapylorisch 13 - retropankreatisch 6 - subpyorisch 14 - Mesenterialwurzel 7 - A. gastrica sinistra 8 - A. hepatica communis 15 - A. colica media 16. - Aorta abdominalis Abbildung 16. LK-Klassifizierungssystem / Magen 69 Die Wahl der entsprechenden Lymphknoten bei der Lymphknotendissektion ist abhängig von der Lokalisation des Primärtumors. Mit dem jeweiligen Sitz des Primärtumors im oberen, mittleren oder unteren Drittel des Magens können sich die zugehörigen regionären Lymphabflußbahnen ändern.(Tab. 24). Tabelle 24. Abhängigkeit der regionalen Lymphknotenstationen von der Lokalisation des Primärtumors [60] Lymphknoten parakardial rechts Gruppe Antrum 1 Tumor in (Stationen): Corpus Kardia 3 1 1 parakardial links 2 3 kleine Kurvatur 3 1 1 1 große Kurvatur 4 1 1 1 suprapylorisch 5 1 1 2 subpylorisch 6 1 1 2 A.gastrica sinistra 7 2 2 2 A.hepatica 8 2 2 2 Truncus coeliacus 9 2 2 2 Milzhilus 10 3 2 2 A.lienalis 11 3 2 2 2 1 communis Die Magenresektionen beim Magenkarzinom werden anhand des Grades der Ausdehnung der Lymphknotendissektion in 3 verschiedene Kategorien (R1-, R2-, R3Resektion) eingeteilt (Tab.25). Synonym zu diesen Abkürzungen existieren in der westlichen Welt mittlerweile zur besseren Abgrenzung gegenüber der Tumorresektion (R0, R1, R2) häufiger die für den Begriff „Dissektion“ stehenden Abkürzungen D1, D2 und D3. 70 Tabelle 25. Definitionen der R1-, R2- und R3-Resektionen. [198] Art der Magenresektion Ausmaß der Lymphknotendissektion R1-Resektion ---subtotale Resektion Lymphknoten 3-6 ---proximale Resektion Lymphknoten 1-4 ---totale Resektion Lymphknoten 1-6 R2-Resektion ---subtotale Resektion Lymphknoten 3-8 ---proximale Resektion Lymphknoten 1-4,7 und 8 ---totale Resektion Lymphknoten 1-8 R3-Resektion ---subtotale Resektion alle Lymphknoten, unabhängig von ---proximale Resektion der Art der Gastrektomie ---totale Resektion 3.4.1.2. Definition der systematisch erweiterten Lymphknotendissektion In der folgenden Zeit mußte man sich im Zuge der immer häufiger angewendeten SELD mit der Definition dieses Eingriffes auseinandersetzen. Bisher war das Ausmaß der zu entfernenden Lymphknoten meist vom Chirurgen bestimmt worden. Dieser orientierte sich anfänglich häufig an einem durch Soga und Mitarbeiter im Rahmen von 530 Gastrektomien herausgefundenen Mittelwert von 30 Lymphknoten, der auch in etwa von Siewert und Mitarbeitern 1986 bestätigt wurde. Eine Lymphadenektomie beim Magenkarzinom konnte nach ihren Ergebnissen dann als ausreichend gelten, wenn mindestens 28 Lymphknoten zu entfernen waren. Des weiteren stellten sie fest, dass durch die alleinige Splenektomie zusätzlich zur Lymphadenektomie keine bemerkenswerte Verbesserung der Ergebnisse im Sinne der Radikalität erzielt werden konnte. Bei der sogenannten einfachen Gastrektomie wurden durchschnittlich 26,2 ± 1,9 Lymphknoten entfernt. Die Gastrektomie mit Splenektomie konnte die Anzahl nur auf 29,3 ± 2,3 erhöhen. Allerdings ließ sich ein deutlicher Zugewinn an Radikalität durch 71 die anatomische Linksresektion des Pankreas verzeichnen (39,5 ± 3,6 Lymphknoten) [248, 254]. Tabelle 26 Präparierbare und befallene Lymphknoten beim Magenkarzinom. [248] Anzahl der Patienten n = 105 Mittelwert ± SE Anzahl der pro Patient insgesamt entfernten LK 28,02 ± 1,49 Anzahl der pro Patient insgesamt befallenen LK 9,38 ± 1,11 Anzahl der pro Patient entfernten LK an der kleinen Kurvatur 14,28 ± 0,97 Anzahl der pro Patient entfernten LK an der großen Kurvatur 8,06 ± 0,61 Anzahl der pro Patient an sonstigen Lokalisationen entfernten LK 5,66 ± 0,53 Wagner ermittlelte 1990 in einer Autopsiestudie die Anzahl der regionären Lymphknoten an den für die Lymphadenektomie beim Magenkarzinom relevanten Stationen im Oberbauch. Er legte seinen Untersuchungen die von der Japanese Research Society for Gastric Cancer (JRSGC) beschriebenen Stationen N 1-16 zugrunde und machte so im Mittel 43 Lymphknoten ausfindig (Tab.27). Aufgrund der festgestellten großen individuellen Schwankungen hinsichtlich der Gesamtzahl der Lymphknoten konnte die bisher von vielen Chirurgen praktizierte Exstirpation von 25 bis 30 Lymphknoten nicht garantieversprechend für eine gründliche Lymphknotendissektion sein. Die häufig nicht entfernten Lymphknoten mußten, laut Wagner, vorwiegend den Stationen N7, 8 und N13-16 zugeordnet werden [290]. Diese Erkenntnis führte bei einigen Chirurgen zu der Entscheidung, als SELD nur diejenigen Operationen zu betrachten, bei denen der Pathologe Lymphknoten vom Stamm der A.gastrica sinistra (Nr.7), von der A.hepatica communis (Nr.8), der A.lienalis (Nr.10, 11) und vom Truncus coeliacus (Nr.9) identifizieren konnte [88]. . 72 Tabelle 27. Normalwerte der Lymphknoten im Oberbauch. [290] Stations-Nr. Ort insgesamt Mittelwert minimal maximal parakardial rechts 2,2 0 4 parakardial links 2,0 0 5 kleine Kurvatur 4,5 0 14 große Kurvatur 1,2 0 7 suprapylorisch 2,2 0 8 infrapylorisch 2,7 0 8 A.gastrica sin. A.hepatica comm. Truncus coeliacus 4,6 4,2 1 0 11 15 Milzhilus 2,2 0 6 A.lienalis 2,0 0 9 Lig.hepatoduodenale 5,5 2 12 retropankreatisch 4,7 0 11 A., V.mesenterica superior A.colica media 2,0 0,3 0 0 7 4 paraaortal 2,5 0 8 paraoesophageal, kaudal N1-16 2,2 43 0 25 6 64 N1-110 45 25 67 N1-11 27 17 44 73 3.4.1.3. Zur Frage der erhöhten Morbidität und Mortalität durch die SELD - Studienergebnisse Trotz der in der japanischen Literatur berichteten beeindruckenden Resultate bestanden in den westlichen Ländern weiterhin lange Zeit erhebliche Einwände gegen die SELD [18, 20, 146]. Ein 1988 ermittelter Prozentsatz an systematischen Lymphadenektomien in Europa von nur 27% verdeutlichte die zögernde Akzeptanz der Methode [115]. Man befürchtete durch die Erweiterung des Eingriffes vor allem einen Anstieg der Morbidität und Mortalität. Diese Bedenken wurden anhand der Ergebnisse einiger prospektiver Studien bestätigt (Tab. 28) [31, 56, 61, 232]. Eine erste randomisierte Studie, die die Auswirkungen der SELD auf die Morbidität und Mortalität untersuchen sollte, führten Dent und Mitarbeiter durch [61]. Sie stellten eine signifikant höhere Morbidität nach D2-Resektionen im Vergleich zu D1-Resektionen fest, die auch nicht durch eine eventuell bessere 5-Jahresüberlebensrate zugunsten der D2-Resektion ausgeglichen werden konnte. Aus diesem Grunde schlugen die Autoren vor, die D2-Resektion nicht außerhalb kontrollierter klinischer Studien durchzuführen. Die Studie von Dent et al. stieß jedoch aufgrund einer zu geringen Zahl an Patienten und niedrigen Operationsfrequenz auf starke Kritik. So versuchte man 1989 in einer niederländischen Studie bessere Ausgangsbedingungen zu schaffen [30]. Auch hier lautete die Fragestellung: Geht die D2-Resektion mit einer erhöhten Morbidität und Mortalität als die D1-Resektion einher? Man schuf standardisierte Vorgehensweisen in jeder Gruppe, indem die Chirurgen von einem erfahrenen japanischen Chirurgen in die Technik der D2-Resektion eingewiesen und auch während der anschließenden studienrelevanten Operationen kontrolliert wurden. Die ersten veröffentlichten Resultate zeigten zwar einen längeren postoperativen Krankenhausaufenthalt in der D2-Gruppe, jedoch keinen signifikanten Unterschied zwischen den beiden Gruppen (D1 und D2) hinsichtlich der Komplikationen und der postoperativen Mortalität. Sie ließen somit keine negative Beeinflussung der D2-Resektion auf den postoperativen Verlauf vermuten. In der folgenden Zeit zeichnete sich aber eine höhere Operationsmortalitätsrate nach D2- als nach D1-Resektionen ab (10% vs.4%). Zudem waren nach D2-Resektionen, anders als 74 1992 bekanntgegeben, doch mehr Komplikationen (43% vs.25%) und längere Krankenhausaufenthalte (25 vs.18 Tage) zu vermerken [31]. Die Autoren mußten infolgedessen aus ihren Daten schließen, dass die D2-Resektion bei westlichen Patienten keine standardisierte Anwendung finden sollte. Sie befanden sich damit im Einklang mit Cuschieri und Mitarbeitern, die in ihrer Studie zu vergleichbaren Ergebnissen gekommen waren. Bei ihnen lag die Operationsmortalität in der D2-Gruppe bei 13% und in der D1-Gruppe bei 6,5%. Ebenso zeigte sich mit 46% gegenüber 28% eine signifikant höhere Morbiditätsrate unter den D2-resezierten Patienten, deren postoperativer Krankenhausaufenthalt sich zudem durchschnittlich länger gestaltete [56]. Im Gegensatz zu den oben berichteten Resultaten standen die Ergebnisse einiger im etwa gleichen Zeitraum stattgefundener Studien (Tab. 28) [58, 74, 250, 253]. Smith und Mitarbeiter setzten sich ebenfalls bei ihrer zwischen 1985 und 1989 prospektiv durchgeführten Studie den Vergleich der Morbiditäten und Mortalitäten bei radikaler und weniger radikaler Lymphadenektomie zum Ziel. Sie stellten in bezug auf die Morbidität keine signifikanten Unterschiede zwischen den beiden Gruppen fest (Tab. 28). Ebenso zeigte sich bei den Patienten, bei denen eine radikale Lymphadenektomie durchgeführt wurde, keine signifikant höhere Operationsmortalitätsrate [253]. Diese Resultate wurden von den Mitgliedern der Deutschen MagenkarzinomStudiengruppe 1993 bestätigt. In der zwischen 1986 und 1989 gelaufenen prospektiven Multicenter-Studie waren bei insgesamt 1654 resezierten Patienten keine Unterschiede bezüglich der Morbiditäts- und Mortalitätsraten zwischen der Gruppe mit StandardLymphknotendissektion und derjenigen mit radikaler Lymphknotendissektion aufgetreten [250]. Desweiteren zeigten sich in einer italienischen multizentrischen Studie besonders niedrige Morbiditäts- und Mortalitätsraten nach D2-Resektionen, die vergleichbar waren mit den in der japanischen Literatur berichteten Resultaten und Anlaß für eine Empfehlung der systematischen Lymphknotendissektion gaben. Die Operationsmortalität lag bei der Gastrektomie mit 4,5% ein wenig höher als bei der distalen Gastrektomie (1,3%). Zu postoperativen Komplikationen kam es in 20,3 % der Fälle [58]. 75 Tabelle 28. Vergleich der Morbititäts- und Mortalitätsraten nach R1- und R2Lymphadenektomie - Zusammenstellung einiger wichtiger europäischer Studien. Autor Patientenanzahl (n) Morbidität (%) Mortalität (%) D1 D2 D1 D2 D1 D2 Dent [61] 22 21 --- --- --- --- Smith [253] 62 123 35,0 44,0 0 1,1 GGCS *[250] 558 1096 29,0 30,6 5,2 5,0 Bonenkamp [31] 380 331 25,0 43,0 4,0 10,0 Cuschieri [56] 200 200 28,0 46,0 6,5 13,0 Deguili [58] --- 118 --- 20,3 --- 2,5 * German Gastric Cancer Study Group 3.4.1.4. 5-Jahres-Überlebensraten nach SELD Ziel der erweiterten Lymphadenektomie war eine Steigerung der R0-Resektionen sowie das Erreichen eines lymphogenen Sicherheitsabstandes von resezierten tumorbefallenen zu nicht resezierten tumorfreien Lymphknoten des Kompartments III. Daraus folgernd war eine Prognoseverbesserung in einer einzigen Untergruppe zu erwarten, und zwar in derjenigen, die einen ausschließlichen Lymphknotenbefall des Kompartments I zeigte. Diese wurde tatsächlich durch prospektive Studien [28, 88, 138, 149, 250, 251] bestätigt. Im Rahmen der deutschen Multicenterstudie zwischen 1986 und 1989 stellte sich heraus, dass durch eine radikale Lymphknotendissektion die 5-JahresÜberlebensraten in den Tumorstadien II und IIIA signifikant verbessert werden konnten (Tab. 29). Die Prognoseverbesserung war unabhängig von der Größe des Primärtumors und betraf Patienten in den Stadien pN0 und pN1, d.h. mit fehlender oder beginnender Lymphknotenmetastasierung. Lag eine fortgeschrittene Metastasierung vor, so war dieser prognostische Gewinn durch radikale Lymphknotendissektion nicht zu erzielen. Innerhalb der pT2- und pT3-Kategorien führte eine radikale Lymphknotendissektion jedoch signifikant häufiger zu einer R0-Resektion [250]. Ähnliche Ergebnisse wurden auch aus retrospektiven Analysen der 5- Jahresüberlebensraten bekannt. So konnten Jähne et al. eine deutliche stadienabhängige 76 Verbesserung der 5-Jahresüberlebensraten (Stadium II/IIIA) in ihrem Patientengut nach Einführung der systematischen Lymphadenektomie im Jahr 1978 verzeichnen [138] (Abb. 17). Ebenso berichteten Faß et al. über eine signifikante Prognoseverbesserung in den Stadien II und IIIA als Folge der an ihrer Klinik im Jahre 1986 eingeführten systematischen Lymphadenektomie. Bemerkenswert war hier aber die Tatsache, dass lediglich Patienten ohne Lymphknotenbefall (pN0) im Hinblick auf ihr Langzeitüberleben profitierten. Bei Patienten mit dem Lymphknotenstatus pN1 war nur eine Verlängerung des redizivfreien Intervalls zu erzielen, was jedoch laut Autoren eventuell auf die Auswertung der Daten einer zu geringen Patientenzahl zurückzuführen war. Keine prognostischen Konsequenzen hatte die SELD bei N2-Fällen [74]. Die Daten der niederländischen und britischen Multicenterstudie belegten hingegen keinen Überlebensvorteil nach SELD. In beiden Studien hatte man sich u.a. den Vergleich der 5-Jahres-Überlebensraten nach D1- bzw. D2-Lymphknotendissektion zum Ziel gesetzt und konnte von nahezu gleichen 5-Jahres-Überlebensraten in beiden Gruppen berichten. Ergebnis der niederländischen Studie war eine 5-JahresÜberlebensrate von 45% in der D1-Gruppe gegenüber 47% in der D2-Gruppe. Die 5Jahres-Überlebensrate in der britischen Studie betrug 35% in der D1-Gruppe und 33% in der D2-Gruppe [33, 57]. 77 100 61,8 5-JahresÜberlebensrate (%) 41,8 40,2 50 19,5 0 Stadium II Stadium IIIA UICC-Stadium 1968-1977 1978-1990 Abbildung 17. Stadienabhängige Verbesserung der 5-Jahresüberlebensraten nach Einführung der SELD [aus 138] Tabelle 29. Überlebenszeiten in Abhängigkeit vom UICC-Stadium und der Anzahl entfernter Lymphknoten bei 1654 resezierten Patienten [aus 28] UICCStadium IA Anzahl entfernter Lymphknoten > 25 LK (n =130) < 25 LK (n = 99) Mediane ÜLZ Monate ----- 5-Jahres-ÜLR Signifikanz % ± SD p 85,7 ± 3,1 = 0,38 83,4 ± 4,3 IB > 25 LK (n = 137) < 25 LK (n = 84) ----- 69,0 ± 5,7 69,6 ± 4,9 = 0,2 II > 25 LK (n = 141) < 25 LK (n = 89) --25,6 (20,5-31,4) 54,9 ± 4,8 25,0 ± 5,3 < 0,001 IIIA > 25 LK (n = 177) < 25 LK (n = 85) 24,5 (16,7-30,1) 13,5 (10,2-16,8) 32,0 ± 3,9 20,4 ± 6,1 = 0,04 IIIB > 25 LK (n = 160) < 25 LK (n = 44) 14,1 (11,7-17,8) 13,0 (9,9-17,4) 14,6 ± 3,4 29,4 ± 7,3 = 0,74 IV > 25 LK (n = 351) < 25 LK (n = 157) 8,7 (7,7-9,8) 7,5 (6,5-9,6) 8,7 ± 1,7 8,7 ± 2,6 = 0,26 78 3.5. Indikationen zur Splenektomie im Rahmen der Gastrektomie Eng mit der systematischen Lymphadenektomie verbunden ist die Frage nach der Splenektomie „en principe“ beim Magenkarzinom. Diese wurde bereits Anfang der siebziger Jahre unter dem Gesichtspunkt der Radikalität empfohlen [21], wird jedoch seit den achtziger Jahren im Zuge einer differenzierteren Indikationsstellung zunehmend kritisiert [39, 99, 158, 180, 195, 212, 260, 287]. 3.5.1. Pathoanatomische Grundlagen Die Milz selbst ist selten tumorös befallen, jedoch wurde von einer Infiltration der Lymphknoten im Hilusbereich in bis zu 40% der Fälle von Magenkarzinom berichtet [15, 82, 94]. Aufgrund dieser Tatsache war in den siebziger Jahren die Methode der Enbloc-Resektion der Milz zusammen mit dem Magen in der kurativen Chirurgie des Magenkarzinoms weit verbreitet. Unterstützt wurde das Vorgehen, v.a. bei Karzinombefall des oberen Magendrittels, durch den Nachweis des Lymphabflusses aus der linken oberen Magenregion über den Milzhilus und entlang der A.lienalis zum Truncus coeliacus anhand von Lymphogrammen [zit n 180]. In neueren Studien wurde die Inzidenz von Milzhiluslymphknotenmetastasen bei Karzinomen des proximalen Magendrittels mit bis zu 26,3% und bei Antrumkarzinomen mit 0-7% beschrieben [51, 185, 195, 212]. Nürnberger et al. konnten außerdem eine Abhängigkeit der Milzhilusinfiltration vom Tumorstadium feststellen. Demnach zeigten fortgeschrittene proximale Tumoren überdurchschnittlich häufig eine Milzhilusinfiltration (Tab. 30). Tabelle 30. Milzhilus- und Milzinfiltration in Abhängigkeit vom Tumorstadium [aus 212] Infiltration n % UICC I/II keine Infiltration n % 81 100 Gesamt n 81 UICC III/IV 69 75 23 25 92 Gesamt 150 87 23 13 173 79 3.5.2 Studienergebnisse 3.5.2.1. Morbidität und Letalität Was die perioperative Morbidität anbelangt, so scheint diese nach Splenektomie erhöht zu sein. Brady et al. konnten in einer retrospektiven Studie an 392 Patienten, die sich einer kurativen Resektion des Magenkarzinoms unterzogen hatten, zeigen, dass in der Gruppe der Splenektomierten signifikant höhere Komplikationsraten als in der Gruppe der Nicht-Splenektomierten auftraten (45% vs. 21%). Dabei war auch ein signifikanter Unterschied in Bezug auf die Infektionsraten zuungunsten der splenektomierten Patienten (75% vs. 47%) festzustellen [39]. Eine mit der Splenektomie einhergehende erhöhte Komplikationsrate wurde im folgenden auch in zwei prospektiven Studien bestätigt. Viste et al. berichteten von 41,9% bei Splenektomierten gegenüber 25,4% bei Nicht-Splenektomierten und Griffith et al. von 41% gegenüber 14% (p<0,01) [99, 287]. Die Ergebnisse einer deutschen prospektiven Magenkarzinomstudie (1986-1989) wiesen hingegen keine signifikanten Unterschiede in der Komplikationsrate zwischen den beiden Patientenkollektiven auf [195]. Mit 8,4% vs. 7,9% war in Vistes Studie die Mortalitätsrate unter den splenektomierten Patienten nur unwesentlich höher, bei Griffith ergab sich allerdings eine Operationsmortalitätsrate von 12% bei der Gastrektomie mit Splenektomie und von nur 2,5% bei der Gastrektomie mit Milzerhalt [99, 287]. Ähnliche Ergebnisse stammen aus einer retrospektiven Studie aus Korea. Kwon et al. belegten anhand ihrer Daten, dass sowohl Morbidität als auch Mortalität nach Splenektomie signifikant von 12,9% bzw. 0,4% auf 21,5% bzw. 2,7% ansteigen [168]. Gleiches wurde von Schmid et al. bestätigt. Auch sie beschrieben ein vermehrtes Vorkommen an Komplikationen in der Gruppe der Splenektomierten. Die Morbidität lag hier bei den splenektomierten Patienten bei 52,2% gegenüber 35,4% bei den Patienten, die sich ausschließlich einer D2-Lymphadenektomie unterzogen hatten [266]. 80 3.5.2.2. 5-Jahres-Überlebensraten Japanische Studien aus den sechziger und siebziger Jahren hatten einen Überlebensvorteil für Patienten, die sich einer Splenektomie unterzogen hatten, aufzeigen können [zit n 180]. Sugimachi et al. erklärten jedoch 1980 erstmals, dass die Prognose des Magenkarzinompatienten durch die Splenektomie nicht positiv beeinflußt wird. In ihrer zwischen 1964 und 1976 durchgeführten Studie zeigte sich sogar für die nicht-splenektomierte Gruppe eine signifikant höhere 4-Jahres-Überlebensrate von 63% als für die splenektomierte Gruppe (36%) [259]. Ähnliche Resultate konnten von einigen Autoren in Folgestudien beschrieben werden [5, 39, 52, 158] Von Koga liegen zwischen 1960 und 1978 gewonnene Ergebnisse nach Gastrektomie mit Splenektomie bzw. Pankreatikosplenektomie sowie nach Gastrektomie mit Milzerhalt vor. Demnach waren die 5-Jahresüberlebensraten in den Stadien I und II mit 86% in der Gruppe der Nicht-Splenektomierten höher als in der Gruppe der Splenektomierten (65%). Wenn der Unterschied auch nicht statistisch signifikant war, so deuteten die Ergebnisse jedoch darauf hin, dass ein Erhalt der Milz in den Stadien I und II sinnvoll erschien [158]. Hinsichtlich der Überlebenszeit hatte sich ebenso bei Brady et al sowie Adachi et al. kein statistisch signifikanter Unterschied zwischen den Fällen mit Milzerhalt und Splenektomie aufzeigen lassen [5, 39]. Selbst im direkten Vergleich der Patienten mit gleichem Lymphknotenstatus konnte dieser nicht bewiesen werden [5]. Auch aus einer deutschen retrospektiven Studie ging kein Einfluß der Splenektomie auf die Überlebenszeit hervor [266]. Dagegen berichteten Griffith und Mitarbeiter über signifikant höhere 5-JahresÜberlebensraten bei Patienten, die nicht splenektomiert worden waren (71% vs. 45%) [99]. 81 3.5.3. Derzeitige Richtlinien zur Splenektomie Zur definitiven Bestimmung des Stellenwertes der Splenektomie in der chirurgischen Therapie des Magenkarzinoms sind weitere prospektive randomisierte Studien notwendig. Bisher gilt die Splenektomie bei T2-T4-Tumoren des mittleren und proximalen Magendrittels sowie bei direkter Infiltration der Milz und bei fortgeschrittenen T3/4-Tumoren als indiziert [195, 212, 240, 266]. 82 3.6. Die multiviszerale Resektion des fortgeschrittenen Magenkarzinoms 120 100 m sm 80 relative Überlebensrate (%) pm ss 60 s1 40 s2 s3 20 0 1 2 3 4 5 Intervall nach Gastrektomie (Jahre) Abbildung 18. Absterbekurve in Abhängigkeit von der mikroskopischen Infiltrationstiefe eines Magenkarzinoms (m = Mukosa, sm = Submukosa, pm = Muscularis propria, ss = Subserosa, S1 = Teile der Serosa, S2 = gesamte Serosa, S3 = über Serosa in Nachbarorgane). [aus 66, nachKajitani) In der Literatur wird die Infiltration benachbarter Organe beim fortgeschrittenen Magenkarzinom mit einer Häufigkeit von 10 bis 23 % beschrieben [68, 159, 245]. Dabei ist das Pankreas am häufigsten betroffen, gefolgt von Organen wie Kolon, Mesokolon, Leber und Diaphragma [36, 92, 157, 159]. Die 5-Jahres-Überlebensraten dieser T4-Tumoren liegen bei ca 7% (Abb. 18). Auf dem Boden der Tatsache, dass sich ein prognostischer Gewinn für den Patienten nur durch eine lokale Tumorfreiheit (R0Resektion) erzielen läßt, hat man sich in den letzten 20 Jahren vereinzelt mit der Frage der Prognoseverbesserung durch die erweiterte Gastrektomie, die die Mitresektion benachbarter Organe beinhaltet, beschäftigt. Außerhalb Japans sind bisher nur wenige Publikationen zu diesem Thema erschienen, deren Resultate im folgenden erwähnt werden sollen. 83 3.6.1. Studienergebnisse T4-Tumoren sind nicht generell als inoperable Tumoren anzusehen. Anhand einiger Studienergebnisse konnte vielmehr gezeigt werden, dass nicht die T-Kategorie, sondern die Lymphknotenmetastasierung bzw. das Vorhandensein von inkurablen Faktoren wie der Peritonealkarzinose und Fernmetastasen die Prognose am bedeutendsten beeinflußt [26, 36, 159]. Demnach haben Patienten mit einem fortgeschrittenen T4-Tumor ohne Lymphknotenmetastasen eine signifikant bessere Prognose als diejenigen mit Lymphknotenbefall [36]. 3.6.1.1. Letalität und Überlebenszeiten Die in der Literatur bisher veröffentlichten Letalitätszahlen nach erweiterter Gastrektomie sind sehr unterschiedlich. Dobroschke bezeichnete 1984 die Zunahme der Letalität durch die erweiterte Magenresektion noch als unvermeidbar. Er selbst berichtete von einem Anstieg von insgesamt 17,3% auf 44% in seinem Patientengut. Bei Köckerling et al., zehn Jahre später, war die Mortalitätsrate nach erweiterter Resektion mit 12% zwar doppelt so hoch wie nach einfacher Gastrektomie (6%) [157]. Sie sahen diese Tatsache jedoch in einer verhältnismäßig hohen Komplikationsrate von 15% (4 von 26 Patienten) bei den subtotal Gastrektomierten begründet, wobei in 3 von den 4 genannten Fällen die Ursache der Komplikationen als nicht-chirurgisch anzusehen war, und waren demnach der Meinung, dass die erweiterte Gastrektomie, von erfahrenen Operateuren durchgeführt, kein vermehrtes Risiko mit sich bringen muß. Dies bestätigten Gebhardt und Schultheis anhand ihrer Ergebnisse, die keine signifikanten Unterschiede der Komplikationsraten und der 30-Tage-Letalität zwischen der kurativ resezierten und der erweitert resezierten Gruppe aufzeigten [92]. 84 Tabelle 31. 5-Jahres-Überlebensrate nach Magenresektion und benachbarter infiltrierter Organe [aus 36] reseziertes Organ und 5-Jahres-Überlebensrate (%) Autor Mesocolon Milz Leber Pankreas Colon Maruyama 38,6 29,7 24,3 20,1 14,9 Papachristou und Shiu Koga 7,0 31,0* Kishimoto und Koga Takahashi 29,9 Sugimachi 36,0** Korenaga 50,0 43,0 Takagi 21,4 25,0 31,3 3,7 12,0 35,7 4,7*** 31,1 *kombinierte Splenektomie oder Pankreatikosplenektomie **4-Jahres-Überlebensrate ***Pankreaskopf Die Frage der Prognoseverbesserung durch die multiviszerale Resektion läßt sich nur anhand von Ergebnissen prospektiver randomisierter Studien beantworten. Hier ist jedoch die derzeit vorhandene Literatur nicht besonders ergiebig. Von Korenaga und Mitarbeitern liegen 5-Jahres-Überlebensraten von 281 Magenkarzinompatienten mit Tumorinvasion benachbarter Organe vor, die anhand prognostischer Faktoren (vorhandene Peritonealkarzinose oder Lebermetastasen: ja oder nein) in zwei Gruppen aufgeteilt wurden. Innerhalb dieser beiden Gruppen wurden komplette oder inkomplette Exzisionen benachbarter betroffener Organe durchgeführt. Hiernach ergaben sich statistisch signifikant höhere 5-Jahres-Überlebensraten in der Gruppe ohne inkurable Faktoren bei den Patienten mit kompletter Exzision (36,7%) gegenüber denjenigen mit inkompletter Exzision (17,4%). Dieser signifikante Unterschied konnte mit 5-JahresÜberlebensraten von 5,4% nach kompletter gegenüber 2,8% nach inkompletter Exzision in der Gruppe mit vorhandener Peritonealkarzinose bzw. Fernmetastasen nicht ausgemacht werden [159]. 85 3.7. Palliative Eingriffe beim inkurablen Magenkarzinom Der radikale chirurgische Eingriff ist nicht in jedem Fall von Magenkarzinom angemessen. Gründe für den Verzicht auf eine kurative Resektion können sein: ein lokal weit fortgeschrittener Tumor, das Vorhandensein von Fernmetastasen oder ein schlechter Allgemeinzustand des Patienten, wobei insbesondere kardiopulmonale, renale und cerebrale Funktionsstörungen von Bedeutung sind [85, 110]. Ziel ist es dann, eine subjektive Besserung der Beschwerden zu erreichen und dem Patienten das Leben so erträglich wie möglich zu machen. Dies kann durch die Verhütung von Tumorperforation und -blutung, die Reduktion von Tumormasse bei Stenosen und eine garantierte normale Nahrungsaufnahme gelingen. Hierfür stehen prinzipiell zwei Arten des Eingriffes zur Verfügung: zum einen die Verfahren ohne Tumorresektion wie die Gastroenterostomie, die Ernährungsfistel oder der Stent, zum anderen die palliative Tumorresektion, bei der auf die Prinzipien der Radikalität verzichtet wird. 3.7.1. Die palliative Tumorresektion Sinn der palliativen Tumorresektion ist es, lokale Komplikationen wie Blutungen, Tumorzerfallserscheinungen und Obstruktionen zu verhindern bzw. zu beseitigen, das Leben des Patienten dadurch erträglicher zu gestalten und um einige Monate zu verlängern. McNeer und Lawrence zeigten bereits in den fünfziger Jahre, dass Patienten mit inkurablem Magenkarzinom, die sich einer palliativen subtotalen Gastrektomie unterzogen hatten durchschnittlich 9,5 Monate überlebten und im Vergleich dazu Patienten nach bloßer Laparotomie nur 4,6 Monate [187]. Ähnliche Ergebnisse wurden auch in einer Reihe späterer Studien erzielt [25, 69, 107, 110, 135, 188]. Eine Überlegenheit in der Milderung der Symptome wurde der palliativen Resektion u.a. durch Ekbom und Mitarbeiter zugesprochen, die diese bei 88% ihrer Patienten feststellten [69]. Lawrence und McNeer erreichten in 56% der Fälle eine zufriedenstellende Palliation durch die subtotale Resektion [187]. In einer 86 niederländischen Studie wurde eine Besserung der präoperativen Symptome bei 50% der Patienten beobachtet [188]. Im direkten Vergleich mit der radikalen Resektion scheint die palliative Resektion jedoch mit einem erhöhten Risiko für Komplikationen einherzugehen. An der chirurgischen Universitätsklinik Göttingen fiel zwischen 1971 und 1983 ein gehäufteres Auftreten von Komplikationen bei der palliativen Resektion auf [19] (Tab. 32). Tabelle 32. Postoperative Komplikationen nach Resektion wegen eines Magenkarzinoms. Operation Radikal Palliativ (n = 170) (n = 99) Pulmonale Komplikationen 36 (21,2%) 42 (42,4%) Kardiale Komplikationen 22 (12,9%) 18 (18,2%) Intraabdomineller Abszeß 18 (10,9%) 12 (12,1%) Postoperative Blutung 10 (5,9%) 11 (11,1%) Nierenversagen 12 (7,0%) 9 (9,1%) Anastomoseninsuffizienz 4 (2,3%) 6 (6,1%) Duodenalstumpfinsuffizienz 4 (2,3%) 5 (5,1%) 12 (7,1%) 15 (15,2%) Postoperative Letalität Mit 33,1% ist außerdem in der Deutschen Magenkarzinom-TNM-Studie eine doppelt so hohe Komplikationsrate bei der palliativen Resektion wie bei den nichtresezierenden Verfahren beschrieben worden (16,2%) Was die Letalitätsraten anbelangt, so unterschieden diese sich hingegen nicht [154]. 87 3.7.2. Verfahren ohne Tumorresektion Verbietet sich die Tumorresektion aufgrund vorhandener Risikofaktoren, müssen andere lebensverbessernde Maßnahmen ergriffen werden. Zu ihnen zählen insbesondere die oben erwähnten Verfahren der Gastroenterostomie, der Witzel-Fistel und des Stents [22, 161, 283, 294]. Laut den Ergebnissen der Deutschen Magen-TNM-Studie nahmen diese in den achtziger Jahren 49,4% der palliativen Eingriffe ein. Dabei verteilten sich die nichtresezierenden Verfahren mit 27,4% auf die Laparotomie/Fistel, mit 11,7% auf die Gastroenterostomie, mit 6,4% auf die Perturbation und mit 3,8% auf andere Techniken [154]. Mit einer medianen Überlebenszeit von 3 Monaten wird keine Lebensverlängerung wie bei der palliativen Resektion erzielt, jedoch eine verbesserte Nahrungsaufnahme unter Umgehung des Tumors geschaffen. 88 3.8. MultimodaleTherapiekonzepte Zwar war die komplette Resektion des Tumors als einzige potentiell kurative Therapie des Magenkarzinoms allgemein anerkannt, aber trotz steigender Tumorresektionsraten [193] gaben die Entwicklung lokaler Rezidive in 10-30% der Fälle und die somit weiterhin sehr deprimierenden 5-Jahres-Überlebensraten von 20-30% Anlaß, sich mit der Erprobung neuer ergänzender Behandlungsmethoden auseinanderzusetzen [126, 134, 135, 158, 216, 237]. Zu ihnen zählten die Chemotherapie und die intraoperative Strahlentherapie. 3.8.1. Die systemische adjuvante Chemotherapie des Magenkarzinoms 3.8.1.1. Monochemotherapie 3.8.1.1.1. Erste Versuche mit Thiotepa bzw. 5-Fluorodeoxyuridin Als Pioniere in dieser Hinsicht gelten die Mitglieder der Studiengruppe „the Veterans Administration“ sowie der „University Oncology Group“, die eine Großzahl an Studien zwischen 1960 und 1970 durchführten, in denen sie einzelne Chemotherapeutika wie Thiotepa und 5-Fluorodeoxyuridin nach Magenresektionen erprobten, jedoch ohne Erfolg (Tab.33). In keiner der Studien konnte ein signifikanter Unterschied in der Überlebenszeit zwischen den behandelten Patienten und der Kontrollgruppe gefunden werden [65, 244]. Im Gegenteil, man riskierte aufgrund der Toxizität der Substanzen eine Verschlechterung der Überlebenschancen. So war zum Beispiel die Operationsmortalität nach Gabe von Thiotepa in der Zielgruppe mit mehr als 20% etwa doppelt so hoch wie in der Kontrollgruppe und konnte auch durch eine Reduktion der Dosis nicht wesentlich verbessert werden [244]. 89 Tabelle 33. Adjuvante Chemotherapie mit Thiotepa beim Magenkarzinom [aus 207] Autor Regimen Longmire TSPA-Hochdosis Anzahl an Patienten 5-JahresÜberlebensrate (%) 82 24 (1968) Kontrolle 89 19 Dixon (1971) TSPA-Niedrigdosis 177 24 Kontrolle 182 24 TSPA-Hochdosis 43 16 Kontrolle 112 16 TSPA-Niedrigdosis 152 18 Kontrolle 138 24 FUDR 217 17 Kontrolle 241 15 Serlin (1969) Zahlreiche Zytostatika wurden in Phase-II-Studien bei Patienten mit Magenkarzinom, die noch nicht chemotherapeutisch vorbehandelt waren, getestet. Mit einigen Substanzen konnten Ansprechraten von über 15% erreicht werden. Hierzu zählten 5Fluorouracil, Mitomycin, Cisplatin, Doxorubicin, Epirubicin und Etoposid [77]. 3.8.1.1.2. 5-Fluorouracil Die am meisten erforschte Substanz in der Behandlung des Magenkarzinoms war in den sechziger und siebziger Jahren das 5-Fluorouracil [54]. Bis 1974 stellten Comis und Carter die Daten von 450 mit 5-Fluorouracil behandelten Patienten zusammen, die allerdings mit verschiedenen Schemata behandelt worden waren (Tab.34). Am weitesten verbreitet war dasjenige von Ansfield und Curreri, die eine Dosis von 15mg/kg/d x 5 empfahlen, gefolgt von der halben Dosis an jedem zweiten Tag bis zum Auftreten von Symptomen, die durch die Toxizität der Substanz bedingt waren [54]. 90 Tabelle 34. Adjuvante Chemotherapie mit 5-Fluorouracil [54] Dosierschema 15 mg/kg/d x 5 i.v, dann 7,5 mg/kg jeden 2. Tag insgesamt 15 mg/kg/w x 4 i.v., dann 20 mg/kg/w insgesamt 15 mg/kg/w x 4 p.o., dann 20 mg/kg/w insgesamt Patienten Responder Ansprechrate Autor 3 7 3 1 100% 50% Cornell (1960) Choy (1962) 7 3 42% Kennedy (1961) 10 4 40% Weiss (1961) 14 5 36% Rochlin (1965) 3 1 33% Groesbeck (1963) 14 4 29% Eyerly (1962) 67 18 27% Moertel (1973) 8 2 25% Ansfield (1962) 4 1 25% Allaire (1961) 4 1 25% Olson (1960) 24 6 25% Wilson (1963) 25 6 24% Moore (1968) 9 2 22% Knoepp (1961) 54 11 20% Brennan (1964) 60 12 20% Hurley (1964) 38 3 8% Ellison (1961) 38 1 3% Nadler (1968) 6 0 0% Staley (1961) 2 0 0% Hall (1962) 392 84 21% 4 42 0 12 0% 29% 46 12 26% 6 4 1 0 17% 0% 10 1 10% Bateman (1971) Jacobs (1971) Bateman (1971) Staley (1961) Die weite Spannbreite der Ansprechraten konnte laut Carter und Comis durch Unterschiede in der Auswahl der Patienten und der Intensität der Therapie begründet sein. Obwohl, wie aus Tabelle 34 hervorgeht, für 5-Fluorouracil eine Aktivität in der Behandlung fortgeschrittener gastrointestinaler Tumoren nachzuweisen war, zeigte es 91 als Monotherapie keinen Nutzen im Falle von kurativen Resektionen. 3.8.1.1.3. Mitomycin C Am zweithäufigsten wurde das aus Kulturen von Streptomyces caespitosus isolierte Mitomycin C angewendet [7, 54]. Tabelle 35. Mitomycin C-Aktivität gegen das Magenkarzinom. [54] Regimen variabel (0,5-2 mg/kg x 2-40 Tage) Patienten (n) 113 Ansprech- Autor rate 39 35% Frank 0,05 mg/kg/d 3 2 67% Miller 0,015 mg/kg/d x 5 alle 8-10 Wochen 2 1 50% Reitemeier 7 3 43% Moertel 0,05 mg/kg/d x 6; dann jeden 2. Tag bis zu einer Gesamtmenge von 50 mg; 0,15 mg/kg/d x 5 alle 8-10 Wo 0,005 mg/kg/d x 6; dann jeden 2. Tag bis zu einer Gesamtmenge von 50 mg 30 mg am 1.Tag, 20 mg am 3.-6.Tag dann 10-30 mg jede Woche 0,05 mg/kg/d bis zur Toxizität 16 5 31% Moore 9 14 2 3 22% 21% Godfrey Manheimer 0,05-0,1 mg/kg/d x 10-25 10 2 20% Whittington 36 6 17% Olson 1 0 0 211 63 30% 0,05-0,075 mg/kg, 1 mg/kg oder 2 mg/kg alle 6-8 Wochen 0,05 mg/kg/d x 6; dann jeden 2.Tag bis zu einer Gesamtmenge von 50 mg oder bis zur Toxizität insgesamt 92 Ferguson 3.8.1.2. Polychemotherapie 3.8.1.2.1. 5-FU/MeCCNU Anfang der siebziger Jahre ließen die Resultate bei einer Anzahl von gastrointestinalen Tumoren vermuten, dass man mit der Kombination aus 5-Fluorouracil und Chloroethylnitrosourea-methyl-CCNU auch beim fortgeschrittenen Magenkarzinom Erfolge erzielen könnte [160, 202]. Eine Reihe von Forschungsgruppen testeten diese Substanzen als adjuvante Therapiemaßnahme, jedoch konnte nur die „Gastrointestinal Tumor Study Group“ (GITSG) eine geringe Verbesserung der Überlebensrate um ca. 15% bei Patienten, die diese Chemotherapeutika erhalten hatten, nachweisen [89, 90]. Von keiner anderen Gruppe wurde das Ergebnis bestätigt [71, 124] (Tab. 36). Da zudem die Langzeittoxizität des Methyl-CCNU mit Folgeschäden wie dem myelodysplastischen Syndrom bekannt war, verließ man die Substanz recht bald wieder [71, 151]. Tabelle 36. 5-Jahresüberlebensraten nach adjuvanter Chemotherapie mit 5-FU/MeCCNU. Studie Regimen Anzahl an Pat. GITSG [89] 5-FU/MeCCNU 71 5-Jahres-ÜLR (%) 45 Kontrolle 71 32 5-FU/MeCCNU 66 38* Kontrolle 68 39 5-FU/MeCCNU 91 27 Kontrolle 89 34 VASOG [124] ECOG [71] *3-Jahres-Überlebensrate Es folgte Ende der siebziger Jahre die Erprobung einer Reihe weiterer Substanzen in Kombination mit Fluorouracil. Die Remissionsrate, die bei der Monotherapie mit Fluorouracil bei ca. 20% lag, konnte durch Kombination mit Mitomycin, Carmustin und Doxorubicin gesteigert werden. 93 3.8.1.2.2. FAM Über eine signifikante Verbesserung der Ergebnisse durch die Kombination von Fluorouracil, Adriamycin und Mitomycin (FAM) berichteten 1979 erstmals Macdonald und Mitarbeiter. Die Ansprechrate in ihrer Phase II- Studie lag bei 50%. Die mediane Überlebenszeit betrug für alle behandelten Patienten 5,5 Monate, für Patienten mit partieller Remission 13,5 Monate. Es wurden keine kompletten Remissionen erzielt. Die mediane Remissionsdauer lag bei 9,5 Monaten [179]. Abbildung 19 bestätigt, dass mit der FAM-Kombination bei primär nicht resezierbaren Magenkarzinomen eine Verbesserung der Überlebenszeit erreicht werden konnte. Einzelne Verläufe wurden bis zu 36 Monaten verfolgt. Hingegen verlief die Absterbekurve bei Patienten mit Chemotherapie-Resistenz sehr ungünstig. Abbildung 19. [aus 179] 94 FAM erreichte in den frühen achtziger Jahren den Stellenwert einer Standardtherapie beim fortgeschrittenen Magenkarzinom, auch wenn die Erfolge, die man sich von dieser Kombination versprochen hatte, ausblieben (Tab. 37). Tabelle 37. 5-Fluorouracil, Mitomycin C oder Adriamycin enthaltende adjuvante Chemotherapie. [207] Studie Anzahl an Patienten 5-FU/VCR/CPA/MTX 140 Regimen Fielding (1983) 5-Jahres-ÜLR (%) 60* dann 5-FU/MMC Schein (1985) 5-FU/MMC 141 66 Kontrolle 130 57 5-FU/ADM/MMC 156 76** Kontrolle Allum (1989) Coombes (1990) Krook (1991) 72 5-FU/ADM/MMC 145 27 Radiotherapie 153 20 Kontrolle 145 24 5-FU/ADM/MMC 133 46 Kontrolle 148 36 5-FU/ADM 61 32 Kontrolle 64 33 *1-Jahres-Überlebensrate **2,5-Jahres-Überlebensrate Auch durch FAM-Modifikationen ließen sich die Behandlungsergebnisse nicht verbessern [225]. Es wurde eine Reihe von Versuchen in dieser Hinsicht unternommen: - Dosissteigerung von 5-Fluorouracil und Adriamycin - Ersetzen des 5-Fluorouracil durch Ftorfur und des Mitomycin C durch Cyclophosphamid oder BCNU - Hinzufügen einer 4. Substanz wie Methyl-CCNU oder BCNU zu dem Originalschema. 95 Die Remissionsraten lagen zwischen 9% und 65% und waren vergleichbar mit denen nach Verwendung von FAM (Remissionsraten von 11% bis 60%) [225]. Keine der erwähnten Modifikationen brachte demnach Vorteile gegenüber der Originalzusammensetzung. 3.8.1.3. Neuere Regimen In den achtziger Jahren wurden neue Chemotherapie-Kombinationen entwickelt, die den älteren Regimen wie FAM überlegen zu sein schienen. Vielversprechende Resultate wurden mit FAMTX (5-FU, Adriamycin, Methotrexat), EAP (Etoposid, Adriamycin, Cisplatin) und Cisplatin/5-FU-Kombinationen erzielt [153, 223]. Tabelle 38. Kombinierte Chemotherapie des fortgeschrittenen Magenkarzinoms.[207] Autor Patienten Therapie komplette (n) Remission protokoll (n) Macdonald 62 FAM 0 (1980) Klein 30 FAMTX 2 (1982) Preusser 145 EAP 22 (1989) Stahl 51 ELF 6 (1989) Cervantes 90 FLEP 8 (1993) partielle Remission (n) 26 gesamte Remission (%) 42 Überlebens -zeit (Monate) 5,5 17 63 9 61 57 10 21 52 11 24 35 8 3.8.1.3.1. Cisplatin-Kombinationen Da man mit der Cisplatin-Monotherapie Remissionsraten von über 20% erreicht hatte [225], die mit einem Anteil von kompletten Remissionen von 6% einhergingen [173], erhoffte man sich Anfang der achtziger Jahre eine Verbesserung der Resultate durch den Einsatz von Cisplatin anstelle von Mitomycin innerhalb des FAM-Regimes. In sechs Studien in den achtziger Jahren lagen die Ansprechraten von FAP zwischen 29% und 96 55% und die mediane Überlebenszeit bei 4 bis 12 Monaten [202, 238, 278, 288, 289, 297]. Die Ergebnisse waren vergleichbar mit denen der FAM-Studien. 3.8.1.3.2. FAMTX Desweiteren beschäftigte man sich mit dem Einsatz von Methotrexat als Fluorouracilmodulierende Substanz in einem FAMTX-Protokoll. Die Ansprechrate lag laut Autoren bei 63% und wurde in Folgestudien mit 41% beschrieben. Klein und Mitarbeiter konnten eine komplette Remissionsrate von 6% verzeichnen [153]. Aufgrund der erheblichen Toxizität war Methotrexat jedoch nur bei Patienten in gutem Allgemeinzustand anwendbar. 3.8.1.3.3. EAP Anfang der achtziger Jahre erwies sich die Kombination aus Etoposid, Doxorubicin und Cisplatin (EAP) in der Behandlung des lokal fortgeschrittenen Magenkarzinoms als aktiv [223]. Eine Reihe von Studien in den folgenden Jahren konnten diese Aktivität bestätigen [17, 91, 109, 150, 174] (Tab. 39). Die komplette Remissionsrate lag im Durchschnitt bei 9% [109], jedoch wurde immer wieder eine hohe, häufig lebensbedrohliche Toxizität dieser Therapieform beschrieben [109, 150, 174, 286]. Im direkten Vergleich mit FAMTX wurde deshalb FAMTX bei ähnlichen Ansprechraten der Vorzug gegeben [150]. 97 Tabelle 39. veröffentlichte Resultate mit EAP beim Magenkarzinom [aus 109] Studie Wilke Patientenanzahl (n) 145 Ansprechrate (%) 57 Todesfälle (n) 3 Katz 25 72 2 Taguchi 29 45 2 Taal 26 15 3 Sparano 8 13 2 Villar-Grimalt 16 6 3 Lerner 36 33 4 Ajani 48 31 1 Di Bartolomeo 74 38 1 Tononi 12 50 --- Kelsen 30 20 4 Clark 31 23 --- Haim 13 46 3 insgesamt 13 46 3 3.8.2. Präoperative Chemotherapie des Magenkarzinoms Nachdem man Mitte der achtziger Jahre bei verschiedenen Zytostatikaregimen unter palliativem Aspekt Erfolge nachweisen konnte, setzte man nun die Idee der neoadjuvanten Chemotherapie in die Praxis um mit dem Ziel, präoperativ eine Verkleinerung von partiell resektablen oder nicht resektablen Magenkarzinomen im Stadium T3/4 N1 zu erreichen („Downstaging“), die kurativen Resektionsraten zu erhöhen und die Langzeitprognose der chirurgischen Therapie zu verbessern [249]. Außerdem erhoffte man sich, dass die Patienten präoperativ eher in der Lage wären, die Toxizitäten der applizierten Substanzen zu tolerieren. 98 3.8.2.1. Theoretische Grundlagen der neoadjuvanten Chemotherapie Untermauert wurde der Glaube an die Effektivität der neoadjuvanten Chemotherapie durch die Ergebnisse verschiedener experimenteller Untersuchungen, die u.a. darauf hindeuteten, dass das operative Trauma einen Stimulus für verbliebene Tumorzellen bildet [79, 81, 103]. Dieser manifestierte sich in einem Anstieg der Proliferationsrate, einer Verkürzung der Tumorverdopplungszeit und einer rapiden Zunahme der Größe und Anzahl von Fernmetastasen. In experimentellen Studien konnte nun gezeigt werden, dass die zur Tumorreduktion eingesetzte präoperative Chemotherapie den Proliferationsstimulus verhinderte und eine Verlängerung der Überlebenszeit zu erzielen war [79, 81]. Ein weiteres Argument, das für die präoperative Chemotherapie sprechen sollte, war die durch Studien belegte Tatsache, dass die Blutzufuhr postoperativ zuungunsten der adjuvanten Chemotherapiemaßnahmen verändert wurde. Die Konzentrationen, die die Tumorrückstände erreichten, waren demnach nicht ausreichend [76]. 3.8.2.2. Phase II-Studien zur neoadjuvanten Chemotherapie des Magenkarzinoms Wilke und Mitarbeiter berichteten 1990 über erstaunliche Ergebnisse bei insgesamt 145 Patienten mit fortgeschrittenem bzw. fernmetastasiertem Magenkarzinom. Sie hatten diese mit einer neuen Kombination aus Etoposid, Adriamycin und Cisplatin (EAP) behandelt [293]. Tabelle 40. Remissionsraten nach EAP-Therapie [aus 293] Gesamtpatientenzahl lokal fortgeschrittener Tumor metastasierter Tumor Patientenanzahl n 145 49 96 99 CR (%) 15 CR + PR (%) 57 KV/P/TT (%) 43 29 8 73 49 27 51 Die mediane Überlebenszeit aller Patienten betrug 10 Monate, bei Patienten mit lokal fortgeschrittenem Tumor waren es 17 Monate, bei denjenigen mit metastasiertem Tumor 8,5 Monate. Patienten, die nicht auf die Chemotherapie ansprachen, lebten durchschnittlich 5 Monate. Keine der folgenden Studien konnte derart überzeugende Ergebnisse liefern [76, 150, 174, 226]. In Anbetracht der Tatsache, dass zwei Drittel der Magenkarzinompatienten über 60 Jahre alt waren und somit häufig zusätzliche nicht-Tumor-assoziierte Erkrankungen aufwiesen, kam man zu dem Schluß, in dieser Altersgruppe Regimen mit geringerer Toxizität einsetzen zu müssen und entwickelte eine Kombination aus Etoposid, Leukovorin und 5-Fluorouracil. ELF wurde, wie Wilke und Preusser (1990) in ihrer Studie beweisen konnten, gut toleriert. Bei Hochrisiko-Patienten (fortgeschrittenes Alter, kardiale Erkrankungen) induzierte es Remissionsraten und mediane Überlebenszeiten, die mit denen von Patienten mit weniger Risikofaktoren aus EAPStudien vergleichbar waren. Die Ansprechrate betrug 53%. Bei 7 von 10 Patienten (70%) mit lokal fortgeschrittenem Tumor kam es zu Remissionen, 5 partiellen und 2 kompletten. Außerdem erreichten von insgesamt 41 Patienten mit Fernmetastasen 16 Patienten eine partielle und 4 eine komplette Remission. Die mediane Überlebenszeit aller Patienten lag bei 11 Monaten [293]. Plukker war einer der nächsten Autoren, die über eine positive Wirkung der präoperativen Chemotherapie bei Patienten mit operativ nachgewiesenen nicht resektablen Magenkarzinomen berichteten. Er verabreichte eine Kombination aus 5-FU und Methotrexat, die ihm eine Resektion des Tumors in 8 von 17 Fällen ermöglichte. Die mediane Überlebenszeit betrug für alle Patienten 11,5 Monate, nach R0-Resektion 23,5 Monate [221]. 100 Tabelle 41. Ergebnisse neoadjuvanter Chemotherapie und „second look-Operationen“ bei lokal fortgeschrittenem Magenkarzinom. [16] Chemotherapie Second Look-OP Resektabilitätsrate Autoren Patienten anzahl (%) Plukker 17 FMTX 14 8 (47) Wilke 35 EAP 21 19 (54) Lasser 29 FU/Cisplatin 25 21 (72) Wils 13 FAMTX 7 3 (23) Lerner 13 EAP 5 1 (8) Kelsen 10 EAP 2 2 (22) Kelsen 11 FAMTX 3 1 (9) Conroy 14 FEMTX-P 5 5 (36) Rosen 20 EEP 10 7 (37) Fink 30 EAP 27 24 (80) Gesamt 192 99 (52) 3.8.2.3. Neoadjuvante Chemotherapie beim potentiell resektablen Magenkarzinom Ende der achtziger Jahre kam die Idee der präoperativen Chemotherapie bei potentiell kurativ resektablen Magenkarzinomen auf. Man erhoffte sich, durch diese therapeutische Maßnahme die Resektabilitätsrate und somit auch die Langzeitprognose des Magenkarzinoms zu verbessern. Insbesondere von Ajani und von Leichman existieren bisher Ergebnisse primär präoperativ behandelter Patienten (Tabelle 42). Unter Verwendung von Etoposid/Adriamycin/Cisplatin, Etoposid/5-FU/Cisplatin oder Etoposid/Leukovorin/5FU kamen die Autoren auf Resektionsraten von 85 bis 100%, mit einem Anteil an R0Resektionen von über 70% [6]. 101 Tabelle 42. Phase II-Studien zur neoadjuvanten Therapie des potentiell resektablen Magenkarzinoms [aus 151] Autor Regimen EAP Anzahl Pat. n 48 Resektionen R0Resekt. (%) (%) 41 (85) 37 (77) mediane ÜLZ (Mon) 16 2-JahresÜLR (%) 42 Ajani Ajani EFP 25 25 (100) 18 (72) 15 44 Leichman FP-IP FUDR-P FAMTXIP FP 38 35 (92) 29 (76) 17 --- 56 50 (89) 34 (61) 15 40 Kelsen 3.8.3. Beurteilung der adjuvanten und neoadjuvanten Chemotherapie 3.8.3.1. Adjuvante Chemotherapie nach kurativer Resektion des Magenkarzinoms Hermans und Mitarbeiter bestätigten 1993 anhand ihrer durch eine Metaanalyse erhobenen Daten die vorherrschende Meinung, dass die adjuvante Chemotherapie beim kurativ resezierten Magenkarzinom keine Vorteile bringen würde [10, 71, 122, 166]. Mit Hilfe einer computergestützen Literatursuche hatten sie 14 randomisierte Studien ausfindig gemacht, die sich mit dem Vergleich der postoperativen adjuvanten Chemotherapie gegenüber der alleinigen chirurgischen Vorgehensweise beschäftigten. Insgesamt wurden über 2000 mit verschiedenen Chemotherapieregimen behandelte Patienten erfaßt. Tabelle 43 gibt einen Überblick über die von 1980 bis 1991 publizierten Studienergebnisse. 102 Tabelle 43. Adjuvante, Magenkarzinom systemische Chemotherapie versus Operation Erstautor Vergleichsgruppen Patientenanzahl Ergebnisse Douglas [16] MeCCNU/5-FU 71 vs Operation alleine 71 Alcobendas [7] MMC Higgins [124] Engstrom [71] Jakesz [16] Allum [10] Allum [10] 33 vs Operation alleine 37 MeCCNU/5-FU 66 vs Operation alleine 68 MeCCNU/5-FU 91 vs Operation alleine 89 MMC/5-FU/AraC 53 vs Operation alleine 34 5-FU/MMC/Induktion 140 vs 5-FU/MMC 141 vs Operation alleine 130 5-FU/Doxorubicin/ 119 MMC vs Strahlentherapie allein beim Überlebensverbesserung in der CT-Gruppe adjuvante Therapie evtl sinnvoll keine Überlebensverbesserung; keine Risikoreduktion des Wiederauftretens keine Überlebensverbesserung der CT-Gruppe keine Überlebensverbesserung der CT-Gruppe keine Überlebensverbesserung der CT-Gruppe bei adjuvanter Anwendung der CT keine Überlebensverbesserung 129 vs Operation alleine Coombes [16] 5-FU/Doxorubicin/ 133 MMC Krook [166] vs Operation alleine 148 5-FU/Doxorubicin 61 vs Operation alleine 64 103 FAM als Routinebehandlung des operablen Magen-Ca nicht indiziert kein substantieller Erfolg dieses CT-Regimes Beim kurativ resezierten Magenkarzinom konnte bis auf die Therapieverfahren mit Pici/MFC/MF und MCC kein positiver Effekt der adjuvanten Chemotherapie aufgezeigt werden, so dass die Autoren von einer Anwendung dieser Therapieform im klinischen Alltag abrieten. Bis heute gibt es keinen überzeugenden Hinweis, dass durch adjuvante Therapiemaßnahmen ein Überlebensvorteil oder eine Verlängerung des rezidivfreien Intervalls zu erreichen wäre [24, 122]. Die Ergebnisse der oben erwähnten Metaanalyse müssen nach Meinung verschiedener Autoren kritisch betrachtet werden, da die Patientenrekrutierung nicht einheitlich erfolgte [137, 182, 273]. Zwar wurde von kurativen Resektionen gesprochen, es gingen letztendlich aber auch Patienten mit palliativer Ausgangssituation in die Analyse mit ein. Zudem waren Resektionstechnik und Radikalität von Fall zu Fall unterschiedlich gewesen und nicht als Prognosefaktoren berücksichtigt worden. Schließlich waren die Staging-Untersuchungen in den achtziger Jahren, aus denen die ersten Studien stammen, noch nicht so fortgeschritten und somit ungenauer als Anfang der neunziger Jahre, so dass von keinem definierten, für die adjuvante Therapie geeigneten Stadium ausgegangen werden kann. 3.8.3.2. Neoadjuvante Chemotherapie Dem Anspruch, durch Reduktion der Tumormasse eine Voraussetzung zur kompletten Resektion auch laparoskopisch als nicht resezierbar eingeschätzter Tumoren zu schaffen, kann die neoadjuvante Chemotherapie in der überwiegenden Zahl der Fälle gerecht werden. Bei 60 bis 90% der Magenkarzinompatienten ist diese nach der chemotherapeutischen Behandlung möglich. Eine komplette histopathologische Remission wird allerdings selten beobachtet (Tab.44). 104 Tabelle 44. Ansprech- und Resektionsrate nach präoperativer Chemotherapie. [aus 75] Studie komplette klinische komplette histopathol. komplette Ansprechrate Resektionsrate Antwort (%) (%) (n) resektabler Tumor Ajani et al. 24 0 72 Ajani et al. 31 0 90 Leichman et al. 48 3/50 77 neoadjuvante Th. --- --- 75 primäre Resektion --- --- 56 Rougier et al. 50 0 64 Kelsen et al. --- --- 62 MRIC 63 0 89 lokal fortgeschr.Tu Kang et al. Tabelle 45. Gründe für inkomplette Tumorresektionen nach präoperativer Chemotherapie. [aus 75] Studie Anzahl an Peritoneal- Fernpositive irresektabler Patienten karzinose metastasen Resektions- Tumor oder ränder Lymphknoten resektabler Tu Ajani et al. 25 6/25 1/25 --- 1/25 Ajani et al. 48 --- --- 2/48 2/48 Leichman et al. lokal fortgeschr. Tu Kang et al. 50 7/50 --- 4/50 --- 24 --- --- --- --- Rougier et al. Kelsen et al. 30 5/30 --- 5/30 --- 44 --- 3/44 7/44 4/44 MRIC 30 --- 1/30 2/30 --- 105 Tabelle 45 macht die Rolle der Ergebnisse des prätherapeutischen Stagings als Prognosefaktoren deutlich. Die Peritonealkarzinose, die mit relativer Sicherheit in den oben erwähnten Fällen schon vor Beginn der Chemotherapie bestanden hat, war einer der Hauptgründe für inkomplette Tumorresektionen. Fink und Mitarbeiter begründen ihre hohe komplette Resektionsrate von 89% (siehe MRIC Tabelle 44) mit dem von ihnen praktizierten Ausschluß von Patienten mit Peritonealkarzinose aus ihrer Studie. Lediglich Patienten mit lokal fortgeschrittenen, jedoch noch nicht metastasierten Tumoren können von der neoadjuvanten Chemotherapie profitieren. Sie haben die Chance einer R0-Resektion im Rahmen einer „Second look“-Operation. Wichtiger Parameter zur Beurteilung der Effektivität der neoadjuvanten Therapie mit nachfolgendem chirurgischen Vorgehen ist die mediane Überlebenszeit (Tab. 46). Mit 20 bis 25 Monaten wird der neoadjuvanten Therapie heutzutage im Vergleich zur primären R0-Resektion ein Überlebensvorteil zugesprochen [75], der jedoch noch mit Hilfe von größeren, randomisierten, prospektiven Studien bewiesen werden muß. Bisher erhobenen Daten prätherapeutisches lagen keine Staging zur einheitlichen Beurteilung Kriterien des zugrunde. Tumorstadiums Genaues und der Resektionsfähigkeit, Klassifikation der Tumoren nach Typ und Lokalisation und standardisierte Resektionsverfahren sind Bedingungen, um Behandlungsergebnisse vergleichen und daraus prognostische Schlüsse ziehen zu können. Tabelle 46. Überlebenszeiten nach neoadjuvanter Chemotherapie. [aus 75] Studie Anzahl an mediane ÜLZ mediane ÜLZ 2-JahresPatienten aller Patienten nach R0-Resekt. ÜLR (Monate) (Monate) (%) resektabler Tu Ajani et al. 25 15 Ajani et al. 48 16 Leichman et al. 50 18 lokal fortgeschr. Tu Kang et al. 24 --Rougier et al. 30 16 Kelsen et al. 44 --MRIC 30 18 ÜLR Überlebensrate; ÜLZ Überlebenszeit 106 25 20 --- --42 --- ------23 --42 --44 3.8.4. Intraperitoneale adjuvante Chemotherapie 3.8.4.1. Theoretische und experimentelle Grundlagen Therapeutisches Fehlschlagen nach durch neoadjuvante oder primär präoperative Chemotherapie ermöglichten R0-Resektionen manifestierte sich hauptsächlich in peritonealen Rezidiven [268]. Basierend auf dieser Erkenntnis beschrieb Markman 1987 die pharmakokinetischen Vorteile der intraperitonealen Chemotherapie bei malignen Erkrankungen des Gastrointestinaltraktes [183]. 1989 erörterte auch Sugarbaker die theoretischen Vorteile einer sofort einsetzenden postoperativen intraperitonealen Chemotherapie [258]. Präklinische Versuche unterstützten diesen Gedanken. So konnten Archer und Gray anhand eines Rattenmodells zeigen, dass sowohl peritoneale als auch Lebermetastasen auf die intraperitoneale Chemotherapie ansprachen [14]. In einer Studie verglich Sugarbaker die Ergebnisse der intraperitonealen mit denen der intravenösen Chemotherapie beim Colonkarzinom. Er konnte im Gegensatz zur intravenösen Therapie eine beträchtliche Abnahme der peritonealen Metastasen durch intraperitoneale Chemotherapie aufzeigen. Diese Überlegungen und Beobachtungen führten zu Studien über die intraperitoneale Chemotherapie bei Magenkarzinompatienten. Substanzen wie Mitomycin C, 5-FU, Floxuridin und Cisplatin kamen zum Einsatz. Jedoch waren erste Resultate nicht besonders ermutigend [242]. Takahashi und Mitarbeiter sahen eine mögliche Ursache für das Versagen intraperitonealer Therapieformen im Trägermedium. Ihre Vermutung war, dass die wasserlöslichen Trägermedien, bis dato Kochsalzlösungen, aufgrund zu schneller Transmigration durch die Serosa des Peritoneums die zytostatischen Substanzen nicht zur Entfaltung und Wirkung kommen ließen [279, 280]. Aufgrund dieser Annahme entwickelten sie eine neue Behandlungsmethode, die Konjugation von Mitomycin C an aktivierte Carbonpartikel (MMC-CH). Diese aktivierten Carbonpartikel sollten einen direkten Transport des Zytostatikums an den Ort der Aufnahme in das Peritoneum, das lymphatische Gewebe, gewährleisten und außerdem eine verzögerte Freisetzung der Substanz (Mitomycin C) garantieren. 107 3.8.4.2. Studienergebnisse Bisher sind wenige Publikationen zu diesem Thema erschienen. Die folgenden zwei Studien können jedoch als richtungsweisend in der Behandlung der Peritonealkarzinose des lokal fortgeschrittenen Magenkarzinoms gelten. In einer prospektiven, randomisierten Studie zwischen 1987 und 1992 wurde die unter Punkt 8.4.1. beschriebene Methode (MMC-CH) im Hinblick auf die Verhinderung von intraperitonealen Rezidiven und die Verbesserung der Überlebenszeiten getestet [280]. 113 Patienten, die sich einer radikalen Resektion wegen eines Magenkarzinoms unterzogen hatten und außerdem eine definitive serosale Infiltration des Tumors aufwiesen, wurden in die Studie aufgenommen und zufallsbedingt der MMC-CHGruppe bzw. der Kontrollgruppe zugeteilt. Die 2-und 3-Jahresüberlebensraten der MMC-CH-Gruppe lagen bei 42 und 38% und betrugen in der Kontrollgruppe 28 und 20%. Der Unterschied zwischen den beiden Gruppen war sowohl für die 2-als auch für die 3-Jahresüberlebensrate statistisch signifikant (p < 0,05). Betrachtete man nur die Patienten mit makroskopischer Peritonealkarzinose, so war hier kein Unterschied in der Überlebenszeit zwischen den beiden Gruppen zu verzeichnen. Bei den kurativ Resezierten wurden wiederum bei den 2- und 3-Jahresüberlebensraten mit 66 und 66% gegenüber 35 und 20% statistisch signifikante Ergebnisse (p < 0,01) erreicht. Die Resultate zeigen somit, dass die intraperitoneale Chemotherapie mit Mitomycin Cgebundenen Carbonpartikeln eine effektive Methode gegen die peritonealen Rezidive des „kurativ“ resezierten, lokal fortgeschrittenen Magenkarzinoms mit serosaler Infiltration zu sein scheint. Sie verbessert jedoch nicht die Überlebenszeiten von palliativ resezierten Patienten mit makroskopisch sichtbarer Peritonealbeteiligung. Auch Hamazoe et al. konnten über die erfolgreiche Behandlung des peritonealen Rezidivs berichten. Sie verwendeten bei 42 von 82 Magenkarzinompatienten mit nachgewiesener Serosainfiltration die Technik der hyperthermen peritonealen Perfusion. Mitomycin C wurde auf diese Weise unmittelbar nach der Resektion appliziert. Als 108 Kontrollgruppe dienten 40 Patienten mit bloßer radikaler Resektion. Die 5-Jahresüberlebensrate der Patienten, die die intraperitoneale Chemotherapie erhalten hatten, betrug 64,3%, während sie für die Kontrollgruppe bei 52,5% lag. Der Unterschied war allerdings nicht statistisch signifikant [112]. 3.8.5. Intraoperative Strahlentherapie (IORT) 3.8.5.1. Theoretische Grundlagen Die intraoperative Strahlentherapie des Magenkarzinoms wurde in den achtziger Jahren von dem Japaner Abe eingeführt. Mit Hilfe der IORT wollte er v.a. diejenigen Bezirke erreichen, die chirurgisch schwer zugänglich waren wie die Lymphknotenmetastasen entlang der A.gastrica sinistra, der A.hepatica communis und des Truncus coeliacus. Dem häufigen Zurücklassen dieser Lymphknoten sowie der Tatsache, dass auch mikroskopische Läsionen unerkannt blieben schrieb er einen wesentlichen Anteil an den mäßigen chirurgischen Erfolgen zu [Abe 1, 2, 3]. Durch seine neu entwickelte Methode bestand nun die Möglichkeit, mit Hilfe eines aufsetzbaren Conus die gewünschten Strukturen direkt zu bestrahlen ohne die umliegenden Organe gleichzeitig zu beschädigen, wie dies bei der externen Bestrahlung der Fall war [83]. Indiziert sah Abe die IORT in folgenden Fällen von Magenkarzinom: - keine vorhandenen Leber- oder Peritonealmetastasen - vorangegangene chirurgische Exstirpation des Primärtumors - Lymphknotenmetastasen beschränkt auf die Lymphknotengruppe II [1]. 109 3.8.5.2. Studienergebnisse In der direkten Gegenüberstellung der Resultate von rein chirurgisch behandelten und mit einer Kombination aus Operation und IORT behandelten Patienten zeigte sich 1987 [2] eine Verbesserung der 5-Jahresüberlebensraten durch die zusätzlich angewendete IORT in den Stadien II, III und IV, die jedoch nicht statistisch signifikant war (Abb. 20). Die Resultate konnten auch in einer Folgestudie bestätigt werden [4]. Während die Zugehörigkeit zu den einzelnen Stadien in der 1987 erschienen Publikation Abes von makroskopischen Kriterien abhängig gemacht worden war, lagen der Stadienzuteilung beim darauffolgenden Mal histopathologische Kriterien zugrunde. Demnach ließ sich, anders ausgedrückt, durch die IORT ein Überlebensvorteil bei Patienten mit Tumoren aufzeigen, die die Serosa infiltriert hatten oder bei Patienten mit Lymphknotenmetastasen der Lymphknotengruppen 2 und 3 (nach den General Rules for Gastric Cancer in Japan). Dieser ergab sich nicht bei Magenkarzinomen ohne Serosainfiltration oder mit Befall der 1.Lymphknotengruppe. Abbildung 20. [aus 2] 110 Auch andernorts konnten die Ergebnisse mit der IORT Abes These der Verbesserung der Überlebensrate von Patienten mit fortgeschrittenem Magenkarzinom (Stadium III) unterstützen [48, 67, 108, 252]. Kraemling et al sowie Sindelar et al fanden hingegen keinen Überlebensvorteil in der Patientengruppe, die einer zusätzlichen IORT unterzogen wurden [162, 252]. Es fehlen bisher die Resultate größerer prospektiver randomisierter Multicenterstudien, um konkrete prognostische Kriterien aufzuweisen. 3.8.5.3. Risiken und Nebenwirkungen der IORT Wie Abe schon 1974 bemerkte, erweist sich das Pankreas aufgrund seiner Nähe zum Bestrahlungsfeld als kritisches Organ. Eine Strahlenexposition läßt sich kaum vermeiden und manifestiert sich letztlich in erhöhten Leber- und Pankreaswerten, die aber meistens reversibel sind. In einzelnen Fällen geht die IORT mit Pankreatitiden einher [1, 55, 211]. Diese halten sich jedoch in kalkulierbaren Grenzen, so dass sowohl von der „Radiation Therapy Oncology Group“ (RTOG) als auch von der NCI der Schluß gezogen wurde, dass die IORT keinen zusätzlichen Risikofaktor für die Entwicklung postoperativer Komplikationen darstellt [55, 211]. 3.8.6. Frei zirkulierende Tumorzellen 3.8.6.1. Vorkommen und Isolierung frei zirkulierender Tumorzellen Hohe Raten intraperitonealer Rezidive limitieren trotz radikaler Tumorresektion mit entsprechender erweiterter Lymphknotendissektion und Resektion infiltrierter Nachbarorgane den chirurgischen Erfolg in der Behandlung des Magenkarzinoms und legen den Gedanken einer bereits zum Zeitpunkt des operativen Eingriffs stattgefundenen hämatogenen Mikrometastasierung nahe. Da die Eliminierung dieser Mikrometastasen Ziel zahlreicher adjuvanter Therapiekonzepte ist, erscheint eine frühzeitige Erkennung der Mikrometastasierung des Magenkarzinoms sinnvoll. Diese war mit Hilfe der konventionellen Diagnostik bisher nicht möglich. Neuere Methoden 111 wie die immunzytologischen Nachweisverfahren zeigen jedoch in einzelnen Studien deutliche Erfolge im Nachweis mikrometastatischer Zellen [144]. Der Einsatz monoklonaler Antikörper, die gegen epitheliale Antigene gerichtet sind, ermöglicht eine Identifizierung individueller epithelialer Tumorzellen im Knochenmark bzw. in der Bauchhöhle [143, 265, 267]. 3.8.6.1.1. Studienergebnisse Juhl und Mitarbeiter fanden bei 52% ihrer untersuchten Patienten Antikörper-positive Zellen, wobei mit 43% ein deutlich häufigerer Befall der Bauchhöhle mit Tumorzellen gegenüber dem Knochenmark (25%) zu verzeichnen war. Knochenmetastasen sind beim Magen-, Kolon- und Pankreaskarzinom, wie bereits von Doerr et al. 1973 beschrieben, bekanntermaßen eher selten [144]. Da das Knochenmark jedoch als Filtersystem des Blutstroms angesehen werden kann und somit dort nachgewiesene Tumorzellen einen Anhalt für eine hämatogene Dissemination des Primärtumors geben, wurde es in einige Untersuchungen miteinbezogen [264]. Im Gegensatz zu der früher vorherrschenden Vorstellung, dass eine hämatogene Dissemination von Tumorzellen erst in fortgeschrittenen Tumorstadien stattfindet, stehen die Ergebnisse neuerer Studien [144]. Bereits in den Stadien IA und IB konnten Juhl und Mitarbeiter bei 33% der Patienten disseminierte Tumorzellen nachweisen. Sie bestätigten hiermit die schon von Nakajima in den siebziger Jahren veröffentlichte Beobachtung der frühzeitigen Mikrometastasierung des Magenkarzinoms [206]. In seiner Studie waren mit damals konventionellen Methoden bei 3% der Patienten im Stadium I Tumorzellen in der Peritonealhöhle entdeckt worden. 112 3.8.6.2. Die prognostische Bedeutung frei zirkulierender Tumorzellen Zwangsläufig drängt sich die Frage nach der prognostischen Bedeutung des Auftretens frei zirkulierender Tumorzellen auf. Zu ihrer Klärung wurden in einigen Studien der letzten Jahre die immunzytologischen Ergebnisse mit den Tumorstadien bzw. der Serosainvasion des Tumors sowie der Überlebenszeit korreliert [139, 144, 268]. Juhl et al. konnten eine Abhängigkeit des Nachweises zirkulierender Tumorzellen vom Tumorstadium beschreiben (Abb. 21). Hiernach wurden Tumorzellen in der Bauchhöhle wesentlich häufiger in fortgeschrittenen als in frühen Stadien vorgefunden. 100 77,7 pos. Immunzytologie (%) 37,5 50 25 25 23 23,5 0 Knochenmark Stadium IA+IB Bauchhöhle Stadium II+III Stadium IV Abbildung 21. Korrelation des Tumorstadiums (UICC-Klassifikation) und einer positiven Immunzytologie in der Bauchhöhle bzw. dem Knochenmark bei Magenkarzinompatienten [144] Für das Knochenmark ließen sich keine entsprechenden Ergebnisse aufzeigen. Wenn auch nicht statistisch signifikant, so war jedoch anhand der Daten von Jauch et al. eine deutliche Korrelation zwischen den Tumorzellbefunden im Knochenmark und den etablierten prognostischen Parametern ersichtlich (Tab. 47). 113 Tabelle 47. Korrelation zwischen CK2-positiven Tumorzellen im Knochenmark und Prognoseparametern bei 219 Magenkarzinompatienten [aus 139] Prognosefaktor CK2-positive Patienten Anzahl % p UICC IA 12/32 36 IB 13/29 46 II 15/27 56 IIIA 20/38 53 IIIB 16/24 67 IV 43/69 62 T1 14/40 35 T2 50/89 53 T3 34/57 60 T4 21/33 64 N0 33/70 43 N1 18/33 54 N2 68/116 57 1 3/6 50 2 36/37 54 3 80/146 56 < 20 12/38 43 21-50 41/74 55 > 51 66/117 56 intestinal 54/109 49 diffus/gemischt 59/101 58 nicht klassifiziert 6/9 67 polypös 19/27 70 ulzerierend 52/114 45 ulzerierend/infiltier. 17/25 68 infiltrierend 31/52 60 vorhanden 82/141 58 nicht vorhanden 19/42 45 0.155 Tumorstadium 0.047 LK-Stadium 0.314 Grading 0.967 Tumorgröße (mm) 0.423 Laurén-Klassifikation 0.326 Borrmann-Klassifikation 0.326 Lymphangiosis 114 0.193 Was die Abhängigkeit der peritonealen Dissemination von der Serosainvasion des Tumors anbelangt, bestätigten Boku und Mitarbeiter die bereits von Koga Anfang der achtziger Jahre mit Hilfe konventioneller Methoden der Zytologie festgestellten Resultate [29, 158]. In der S0-Gruppe betrug die peritoneale Tumordissemination 0%, in der S1-Gruppe 3,3%, in der S2-Gruppe 15,7% und in der S3-Gruppe 34,8%. Die Differenz zwischen dem Ergebnis der S3-Gruppe und den Ergebnissen der anderen Gruppen war statistisch signifikant. Der Klassifikation der Serosainvasion lag dabei folgende Definition zugrunde: S0 = keine Serosainvasion, S1 = Verdacht auf Serosainvasion, S2 = definitive Serosainvasion, S3 = Infiltration benachbarter Strukturen. Schlimok und Mitarbeiter wiesen eine eindeutig höhere Inzidenz von Tumorzellen im Knochenmark bei Patienten mit lokoregionärem Lymphknotenbefall (38,9%) als bei Patienten ohne Lymphknotenbefall (21,6%) nach. Außerdem stellten sie in Anlehnung an die Laurén-Klassifikation ein gehäufteres Auftreten von Tumorzellen im Knochenmark beim diffusen (44,0%) als beim intestinalen Typ (29,8%) fest [265]. Bei der Betrachtung der R0-resezierten Patienten zeigte sich bei Juhl et al. in 48% der Fälle ein immunzytologischer Nachweis disseminierter Tumorzellen im Knochenmark (22%) bzw. in der Bauchhöhle (40%). Jauch et al. wiesen bei 55 von 109 kurativ operierten Patienten (51%) Tumorzellen im Knochenmark nach [144]. In einem Beobachtungszeitraum von 4 Jahren war in der Kieler Studie eine signifikante Korrelation der Überlebensrate mit dem immunzytologischen Tumorzellnachweis in der Bauchhöhle aufzuzeigen, die sich für das Knochenmark jedoch nicht nachweisen ließ [268]. Ebenso konnte in einer niederländischen Studie eine signifikant höhere Überlebensrate bei Patienten mit negativem Tumorzellnachweis in der Bauchhöhle im Vergleich zu denen mit positivem Tumorzellnachweis bestätigt werden [32]. 115 4. Daten der Klinik für Allgemeine Chirurgie der Universität Münster An der chirurgischen Universitätsklinik Münster wurden im Zeitraum vom 01.01.1996 bis 30.09.1999 114 Patienten mit einem Karzinom im mittleren bzw. distalen Magendrittel operiert. Es handelte sich um 57 Frauen und 57 Männer. Bei 96 der 114 Patienten war das Datum der Erstdiagnose bekannt und somit das Lebensalter zum Zeitpunkt der Erstdiagnose ermittelbar (Abb. 27). Es schwankte zwischen 26 und 89 Jahren und lag im Mittel bei 60,5 Jahren. Folgende Häufigkeitsverteilung nach der Laurén-Klassifikation konnte im Rahmen der präoperativen Diagnostik bei insgesamt 100 Patienten bestimmt werden: in 55 Fällen lag der diffuse Typ, in 31 Fällen der intestinale Typ und in 14 Fällen der gemischte Typ vor (Abb. 28). In der Altersgruppe der 30- bis 39-Jährigen war der Anteil des diffusen Typs mit 82% am größten (Abb. 29). Mit zunehmendem Alter war in der Patientengruppe ein deutlicher Rückgang im Auftreten des diffusen Typs zugunsten des intestinalen Typs zu verzeichnen (Abb. 30-34). Durchschnittlich 30 Tage nach Bekanntwerden der Diagnose erfolgte der operative Eingriff. In 12 Fällen wurde eine subtotale Magenresektion, in 30 Fällen eine Gastrektomie und in 13 Fällen eine erweiterte Gastrektomie durchgeführt. 24 Patienten wurden zusätzlich splenektomiert. Bei 26 Patienten erfolgte lediglich die explorative Laparotomie, und in 3 Fällen wurde die vordere Gastroenterostomie im Sinne eines palliativen Eingriffes durchgeführt (Abb. 42). Das Rekonstruktionsverfahren der Wahl nach Gastrektomie war in 41 von 43 Fällen die Methode nach Y-Roux. Jeweils einmal wurde die Rekonstruktion nach Hunt-Lawrence und die End-zu-End-Öosophago-Jejunostomie angewendet. Das postoperativ durch den Pathologen bestimmte Tumorstadium war in 109 Fällen der Patientenakte zu entnehmen. Bei 68 Patienten (62,4%) lag bereits ein fortgeschrittenes Stadium IIIA/B bzw. IV nach der UICC-Klassifikation vor (Abb. 35). Auf die einzelnen Altersgruppen gesehen war die Gruppe der 40- bis 49-Jährigen mit 50% am geringsten vom fortgeschrittenen Magenkarzinom betroffen, die Gruppe der 50-bis 59-Jährigen mit 73% am häufigsten (Abb. 37 u. 38). Die Operationsmortalität betrug nach der Gastrektomie 1,7%, nach der erweiterten 116 Gastrektomie 7,7% (Tab. 48). Todesursachen waren eine fulminante Sepsis nach zunächst unauffälligem Verlauf bzw. ein hirnischämischer Insult. Von den subtotal Resezierten überlebten alle Patienten die ersten 30 Tage nach der Operation (Tab. 48). Zwei der bei fortgeschrittenem Magenkarzinom explorativ laparotomierten Patienten erlagen im stationären Verlauf ihrem Grundleiden. In 7 Fällen wurden Komplikationen beschrieben, die unmittelbar auf den operativen Eingriff, hier ausschließlich die einfache bzw. erweiterte Gastrektomie, zurückzuführen waren und in 6 Fällen mindestens eine Relaparotomie zur Folge hatten. Bei den Komplikationen handelte es sich in 3 Fällen um eine Wundheilungsstörung im Bereich der medianen Laparotomie, in einem Fall um eine Anastomoseninsuffizienz, in einem Fall um eine 4-Quadrantenperitonitis ohne Anastomoseninsuffizienz und in einem weiteren Fall um eine Stenose der hochgezogenen Jejunalschlinge im Mesocolonschlitz (Tab. 49). Altersverteilung bei Erstdiagnose 35 Häufigkeit (n) 30 30 25 20 19 20 15 12 10 7 7 5 1 0 < 30 30-39 40-49 50-59 60-69 70-79 80-89 Lebensalter (J) Abb. 22 117 Häufigkeit (n) Häufigkeitsverteilung der Laurén-Typen 60 50 55 40 30 31 20 10 14 0 diffus intestinal gemischt Laurén-Klassifikation Abb. 23 Verteilung der Laurén-Typen bei den 30- bis 39-Jährigen gemischt 9% intestinal 9% diffus 82% Abb. 24 118 Verteilung der Laurén-Typen bei den 40- bis 49-Jährigen gemischt 14% diffus 57% intestinal 29% Abb. 25. Verteilung der Laurén-Typen bei den 50- bis 59-Jährigen gemischt 6% intestinal 31% diffus 63% Abb. 26. 119 Verteilung der Laurén-Typen bei den 60- bis 69-Jährigen gemischt 23% diffus 50% intestinal 27% Abb. 27. Verteilung der Laurén-Typen bei den 70- bis 79-Jährigen gemischt 18% diffus 47% intestinal 35% Abb. 28. 120 Verteilung der Laurén-Typen bei den 80- bis 89-Jährigen gemischt 0% intestinal 50% diffus 50% Abb. 29. postoperative Tumorstadienverteilung Häufigkeit (n) 45 39 40 35 30 25 19 20 19 14 15 10 10 8 5 0 IA IB II IIIA IIIB IV UICC-Stadium Abb. 30. 121 UICC-Stadienverteilung bei den 30- bis 39-Jährigen IA 9% IB 27% IV 55% II 0% IIIB 9% IIIA 0% Abb. 31. UICC-Stadienverteilung bei den 40- bis 49-Jährigen IA 0% IB 33% IV 50% IIIA 0% IIIB 0% Abb. 32. 122 II 17% UICC-Stadienverteilung bei den 50- bis 59-Jährigen IA 10% IV 22% IB 5% II 11% IIIB 11% IIIA 41% Abb. 33. UICC-Stadienverteilung bei den 60- bis 69-Jährigen IA 7% IB 17% IV 42% II 14% IIIA 10% IIIB 10% Abb. 34. 123 UICC-Stadienverteilung bei den 70- bis 79-Jährigen IA 5% IB 20% IV 35% II 15% IIIB 10% IIIA 15% Abb. 35. UICC-Stadienverteilung bei den 80- bis 89-Jährigen IA 17% IV 33% IB 17% IIIB 0% II 0% IIIA 33% Abb. 36. 124 70 60 60 50 40 26 30 13 12 10 erweiterte Gastrektomie Gastrektomie subtotale Magenresektion 0 3 vordere Gastroenterostomie 20 explorative Laparotomie Häufigkeit (n) Häufigkeitsverteilung der operativen Verfahren Abb. 37. Tab. 48 Operationsverfahren und Operationsmortalität Insgesamt Operationsmortalität n % n % Subtotale Resektion 12 10,5 0 0 Gastrektomie 60 52,6 1 1,7 Erweiterte Gastrektomie 13 11,4 1 7,7 29 25,4 2 6,9 Resektionen: Palliative Verfahren: (Gastroenterostomie, explorative Laparotomie) 125 Tab. 49 Komplikationen nach einfacher bzw. erweiterter Gastrektomie Anzahl der Relaparotomien Art der Komplikation Vorausgegangene Operation Wundheilungsstörung Gastrektomie 2 mediane Laparotomie Pankreasfistel und erweiterte Gastrektomie 1 Bauchdeckenabszeß Fistel mediane Laparotomie Gastrektomie 0 Bauchwandabszeß Gastrektomie 0 Anastomoseninsuffizienz Gastrektomie 4 4-Quadrantenperitonitis Gastrektomie 2 Stenose der erweiterte Gastrektomie 1 mediane Laparotomie hochgezogenen Jejunalschlinge im Mesocolonschlitz 126 5. Diskussion Man könnte annehmen, dass über hundert Jahre der Magenkarzinomtherapie eine breite Palette an Neuerungen hervorgebracht haben. Aber ist dies tatsächlich der Fall? Beim Studium der alten Veröffentlichungen wird eines sehr bald deutlich: mit kaum einem Thema, das uns heutzutage beschäftigt, hat man sich nicht auch schon um die Jahrhundertwende auseinandergesetzt. Zumindest was die chirurgische Seite in der Behandlung des Magenkarzinoms anbelangt, ist nichts prinzipiell neu. Das Bestreben nach ausreichender Radikalität stand schon immer im Vordergrund der Tumorchirurgie. So formulierten Billroth und Winiwarter bereits 1892/96 folgende Thesen für die Behandlung des Magenkarzinoms [272]: 1. Aufklärung der Bevölkerung 2. Präoperative roborierende Allgemeinbehandlung 3. Problematik der Aufklärung 4. Wichtigkeit der Frühdiagnose 5. Systematische histologische Klassifizierung jedes Magenkarzinoms 6. Radikale Entfernung weit im Gesunden 7. Entfernung aller gastralen und weiteren Lymphknoten, gleichgültig ob verändert, vergrößert oder nicht 8. Langfristige postoperative Kontrollen 9. Dokumentation aller Befunde Diese Punkte haben bis heute ihre Gültigkeit nicht verloren, im Gegenteil, sie bilden die absolute Grundlage für eine erfolgversprechende Therapie des Magenkarzinoms. In diesem Wissen findet seit Jahrzehnten eine intensive Auseinandersetzung v.a. mit den unter Punkt 4 bis 7 erwähnten Therapieprinzipien statt. Problematik der Frühdiagnose Mit dem alten Dilemma der zu spät gestellten Diagnose sieht man sich heute wie vor hundert Jahren konfrontiert [13, 117]. Statistiken belegen, dass beim Magenfrühkarzinom 5-Jahres-Überlebensraten von weit über 80% erreicht werden 127 können [26, 138, 208, 214]. Der Anteil der in den westlichen Ländern frühzeitig entdeckten Magenkarzinome ist jedoch aufgrund der anfänglichen Symptomarmut sehr gering. Zwar führte eine Verfeinerung der endoskopischen Untersuchungstechniken in den letzten Jahren zu einer Steigerung der Rate der Frühkarzinome an vielen Kliniken [236]. Diese kann aber mit durchschnittlich 5% bis 24% immer noch nicht als zufriedenstellend bewertet werden und reicht vor allem noch lange nicht an die Inzidenz der über Screening-Programme ermittelten Magenfrühkarzinome in der japanischen Bevölkerung heran (25% bis 46%) [111]. Wie auch die eigenen Daten (siehe Kapitel 4) belegen, ist heutzutage Tatsache, dass sich zum Zeitpunkt der Diagnosestellung bereits 70 bis 80% der Patienten in einem Stadium III oder IV befinden und somit in der Behandlung des Magenkarzinoms zwangsläufig Therapiekonzepte für fortgeschrittene Tumorstadien im Vordergrund stehen [137]. Diagnostische Mittel Das Wissen um die beträchtlichen prognostischen Unterschiede des Magenfrühkarzinoms und des fortgeschrittenen Magenkarzinoms beeinflußt heutzutage die Entscheidung für einen operativen Eingriff bzw. eine nicht-chirurgische palliative Maßnahme sehr. Bei der Wahl der entsprechenden Behandlungsmethode des Magenkarzinoms spielt infolgedessen das prätherapeutische Staging zunehmend eine bedeutende Rolle. Technische Fortschritte in der Diagnostik haben in den letzten Jahrzehnten ihren Beitrag zu einer immer präziseren Beurteilung des Tumors und seiner Ausbreitung geleistet. Im Rahmen der Gastroskopie können nicht nur Läsionen entdeckt, sondern vor allem auch Biopsien entnommen werden, deren Aufarbeitung eine genaue histopathologische Beurteilung des Tumors erlaubt. Die Endosonographie ist seit ihrer Einführung Anfang der achtziger Jahre zu der Methode der Wahl für das locoregionäre Staging des Magenkarzinoms avanciert [64, 257]. Der hohe Stellenwert dieses Verfahrens liegt in einer Treffsicherheit der Charakterisierung des Primärtumors von 67% bis 92% begründet [47, 175, 222]. Des weiteren kommt dem radiologischen Staging in Form von der Computertomographie (CT) und Magnetresonanztomographie (MRT) heutzutage eine große Bedeutung zu. Mit Hilfe der CT und MRT werden Lebermetastasen, vergrößerte Lymphknoten sowie die Infiltration benachbarter 128 Strukturen durch das Magenkarzinom ausfindig gemacht. Billroth und seine Zeitgenossen mußten sich hingegen mit weitaus weniger diagnostischen Möglichkeiten begnügen. Sie waren anfänglich im wesentlichen auf die Palpation von Tumormassen, die Auskultation von Passagegeräuschen und die von Einhorn 1889 eingeführte Gastrodiaphonoskopie angewiesen. Zwar existierte seit 1869 bereits die von Kußmaul und auch von von Mikulicz entwickelte Methode der Gastroskopie mittles eines starren Rohres, man scheute sich jedoch aufgrund von Problemen in der Handhabung davor, diese anzuwenden. Das eigentliche Ausmaß des Tumorbefalls ließ sich folglich erst intraoperativ feststellen. So war die Einführung des Magen-Röntgens durch Becher, 1896, und die Weiterentwicklung zur Anwendung am Menschen durch Connor, 1898, und Holzknecht, 1902, ein entscheidender Schritt in der präoperativen Diagnostik des Magenkarzinoms. Nach Verabreichung einer Wismuthmahlzeit konnten Aussagen über Größe, Form, Lage und pathologische Veränderungen des Magens sowie seine Motilitätsverhältnisse gemacht werden, wenngleich die Röntgenaufnahmen natürlich aufgrund qualitativer Mängel noch diagnostische Unsicherheiten in sich bargen [276]. Vor diesem Hintergrund sind die chirurgischen Eingriffe und Ergebnisse aus den Anfängen dieses Jahrhunderts mit größtem Respekt zu betrachten. Chirurgisches Resektionsausmaß Für Billroth und seine Mitstreiter stand bereits 1892 fest, dass die Resektion des Magenkarzinoms im Gesunden die Basis jeglichen chirurgischen Wirkens mit kurativer Zielsetzung darstellt. Allein das Ausmaß der Radikalität war über das folgende Jahrhundert hinweg umstritten. Das Spektrum der kurativen Eingriffe unterlag einem starken Wandlungsprozeß: stellte die distale Magenresektion Anfang des Jahrhunderts nahezu konkurrenzlos das Mittel der Wahl dar, war ab den vierziger Jahren ein deutlicher Trend hin zu den Verfahren der Gastrektomie zu verzeichnen. Der Anteil der distalen Resektion reduzierte sich laut Lawrence und McNeer von 89,2% in den Jahren 1931-1940 auf 45,6% in den Jahren 1951-1954 zugunsten der Gastrektomie (Kapitel 2.4.1.). An deutschen Kliniken beschrieben Gall et al. einen Rückgang der distalen Resektion von knapp 64% zwischen 1949 und 1964 auf 33,3% zwischen 1977 und 1981 bei gleichzeitiger Verdoppelung der Zahl der Gastrektomien [86]. 129 Das größte Ziel in der Behandlung des Magenkarzinoms war und ist das Erreichen einer R0-Resektion durch die Operation. Hierbei ist es im Grunde genommen unerheblich, welches Operationsverfahren zu diesem Ergebnis führt. Im Laufe der letzten Jahre hat sich - nach einem langjährigen Disput um die Indikationsstellung zur Gastrektomie de nécessité oder de principe - die Gastrektomie in folgenden Fällen als Standard-operation bewährt [108]: - prinzipiell bei allen Karzinomen vom diffusen Laurén-Typ, unabhängig von ihrer Lokalisation, - prinzipiell bei allen Karzinomen im mittleren oder proximalen Magendrittel, gleich welchen Laurén-Typs sowie - prinzipiell bei nahezu totalem Karzinombefall des Magens. Die distale subtotale Resektion findet Anwendung: - bei distalen Antrumkarzinomen vom intestinalen Laurén-Typ, - bei Risikopatienten und sehr alten Patienten sowie - evtl. als palliatives Verfahren bei T4-Tumoren mit ausgedehnter Metastasierung. Leistungszahlen Die Berechtigung zur Anwendung des standardisierten radikalen Vorgehens leitet sich von deutlich verbesserten Leistungszahlen ab. Die chirurgischen Erfolgsziffern, welche sich in den Zahlen der Operationsmortalität und der relativen 5-Jahres-Überlebensrate widerspiegeln, haben im Laufe der Jahre einen respektablen Standard erreicht. Ein erheblicher Fortschritt in der Behandlung des Magenkarzinoms ist in der Reduzierung des operativen Risikos zu sehen. Trotz eines kontinuierlichen Anstiegs der Resektionsquote (Abb. 38) ist ein eklatanter Rückgang der Operationsmortalität zu verzeichnen. Lag diese Anfang des Jahrhunderts für die subtotale Magenresektion bei ca. 25% und für die Gastrektomie sogar bei über 50%, sind die Eingriffe heutzutage mit einem Risiko von unter 2% für die subtotale Resektion und von ca. 5% für die Gastrektomie behaftet (siehe auch eigene Daten, Kapitel 4). Diese positive Entwicklung hat ihre Gründe sicherlich in der mittlerweile standardisierten operativen Vorgehensweise, die zu einer Minimierung der perioperativen Komplikationen beiträgt. Beim Vergleich der Anastomoseninsuffizienz-Raten wird zumindest über die letzten 130 Jahrzehnte, aus denen konkrete Zahlen existieren, ein Abfall von ca.17% in den sechziger und siebziger Jahren auf 7% in den achtziger und neunziger Jahren ersichtlich. 90 80 78,2 70 60 60 50 54,7 Resektionsrate (%) 40 44,6 30 20 21,6 23,3 10 0 bis 1920 1920-1940 1940-1950 1950-1960 1960-1980 1980-heute Abbildung 38. Zeitprofil der Resektionsraten beim Magenkarzinom. Was die Überlebenszeit als dem Parameter anbelangt, an dem sich die Ergebnisse der Magenkarzinomchirurgie in erster Linie messen, sind hier über einen Zeitraum von fast 120 Jahren ebenso deutliche Erfolge erzielt worden. Das Zeitprofil läßt anhand verschiedener Studien, die über Jahre hinweg an gleichen Kliniken durchgeführt wurden, einen kontinuierlichen Anstieg der relativen 5-Jahres-Überlebensraten erkennen [108]. Auch zeigen die in den jeweiligen Kapiteln dieser Arbeit zusammengestellten Sammelstatistiken verschiedener Operateure eine über die Jahre hinweg zunehmende Verbesserung der 5-Jahres-Überlebensraten. Um hieraus allerdings Rückschlüsse auf allgemein gültige Richtwerte in den einzelnen Zeitabschnitten ziehen zu können, wären zumindest vergleichbare Daten wie Aussagen über wichtige Prognosefaktoren wie das Tumorstadium notwendig. Diese liegen jedoch frühestens seit der bei dem UICC und AJCC im Jahre 1977 eingeführten nahezu identischen 131 Klassifikation der Tumorausbreitung vor [95], so dass aus Gründen der mangelnden Vergleichbarkeit auf einen graphisch dargestellten Zeitverlauf der 5-Jahres- Überlebensraten über ein gesamtes Jahrhundert verzichtet wird. Ausschließlich die letzten zwei bis drei Jahrzehnte betrachtend, wird von den Chirurgen der westlichen Welt einstimmig eine Stagnation der 5-Jahres-Überlebensraten beklagt. Eine Aussicht auf Heilung haben bei kurativer Resektion im Stadium I und II etwa 5080% der Patienten. Hingegen beträgt die 5-Jahres-Überlebensrate im Stadium III dann nur noch 15-20%, und weniger als 5% der Patienten im Stadium IV leben noch nach 5 Jahren [137]. Multimodale Therapiekonzepte finden aufgrund dieser Tatsache in den letzten Jahren zunehmend ihre Berechtigung. Lymphknotendissektion Stand über Jahrzehnte hinweg die Diskussion um das luminale Resektionsausmaß im Vordergrund, so hat sich der Schwerpunkt in den letzten 10 Jahren hin zu der Frage der Prognoseverbesserung durch die systematische erweiterte Lymphknotendissektion (SELD) verlagert. Ein Thema, das, wie oben erwähnt, im Kern auch schon von Billroth um die Jahrhundertwende als wichtig erachtet wurde. Billroth wußte bereits um die Notwendigkeit der „Entfernung aller gastralen und weiteren Lymphknoten, gleichgültig ob verändert, vergrößert oder nicht.“ Die nachfolgenden Generationen setzten sich dann erst in den vierziger und fünfziger Jahren intensiv mit der Rolle der Lymphknotendissektion auseinander. Insbesondere konnten Autoren wie Remine und Priestley anhand einer Reihe von Studien die Abhängigkeit der 5-JahresÜberlebensraten vom jeweiligen Ausmaß des Lymphknotenbefalls herausarbeiten und somit schon früh auf die Wichtigkeit einer standardisierten Lymphknotendissektion hinweisen. In den westlichen Ländern mit einem relativ geringen Anteil an Magenfrühkarzinomen am Gesamtpatientengut muß in ca. 80% aller Fälle von resektablen Magenkarzinomen mit Lymphknotenmetastasen gerechnet werden [138] (Abb. 39). Aufgrund dieser Tatsache und in dem Wissen um die prognostische Bedeutung des Lymphknotenbefalls fand die SELD in den letzten Jahren zunehmende Akzeptanz. 132 94 100 84 84 59 LK-Befall (%) 50 8 0 insgesamt pT1 Abbildung 39. pT-Klassifikation Lymphknotenmetastasen [aus 88]. pT2 und pT3 Häufigkeit pT4 histologisch nachweisbarer Auch wenn der Stellenwert der systematischen Lymphadenektomie in europäischen Studien nicht mit der Deutlichkeit wie in japanischen Studien bestätigt werden konnte, ja sogar in einzelnen Studien aufgrund einer negativen Beeinflussung der Resultate angezweifelt wurde, herrscht zumindest in Deutschland eine überwiegende Befürwortung der SELD vor [28, 138, 214]. Die in den erwähnten Studien angegebenen vermehrten Komplikationen durch die D2-Lymphadenektomie wird auf zu kleine Patientenkollektive [61, 232] sowie auf eine vor allem von den Niederländern häufig gleichzeitig durchgeführte Splenektomie und Pankreaslinksresektion zurückgeführt [zit n 138, 246]. Ebenso sehen die Befürworter der SELD die höheren Komplikationsraten in einer Unerfahrenheit der Operateure mit dieser Methode begründet, unterstützt durch die Tatsache, dass die Komplikationsrate direkt mit der Eingriffshäufigkeit korreliert [28]. Letztendlich bewirkten die im Rahmen der deutschen Multicenter-Studie und, nicht zu vergessen, auch die durch japanische Forschungsgruppen veröffentlichten Ergebnisse der nicht negativ beeinflußbaren Morbidität und Mortalität sowie der Prognoseverbesserung bei Patienten mit einem Magenkarzinom im Stadium II und IIIA 133 eine Empfehlung der radikalen Lymphknotendissektion (Kompartment I und II) als Therapieprinzip durch die drei Arbeitsgemeinschaften der deutschen Krebsgesellschaft (Arbeitsgemeinschaft für Onkologie der Deutschen Gesellschaft für Chirurgie (CAO), Arbeitsgemeinschaft für Internistische Onkologie (AIO) und Arbeitsgemeinschaft für Radiologische Onkologie (ARO) [148]. Wie von Padberg et al. beschrieben, erscheint die SELD außerdem aus folgenden Gründen gerechtfertigt [214]: 1. die Korrelation des Lymphknotenstatus mit bestimmten histomorphologischen Parametern ist unsicher und sollte deswegen nicht alleiniger Grund für eine radikale Lymphknotendissektion sein; 2. weder prä- noch intraoperativ können eindeutige Aussagen über den nodulären Status gemacht werden [267]; 3. einem genaueren Staging können gezieltere adjuvante Therapiemaßnahmen folgen. Erweiterte Resektionen Zur definitiven Bestimmung des Stellenwertes der Splenektomie in der chirurgischen Therapie des Magenkarzinoms sind weitere prospektive randomisierte Studien notwendig. Bisher deuten die Ergebnisse einiger vorwiegend retrospektiver Studien auf eine höhere Morbidität nach der Splenektomie hin. Die Operationsmortalitätsraten scheinen nicht signifikant anzusteigen, jedoch differieren die Aussagen über Langzeitergebnisse nach erfolgter Splenektomie sehr. Im Gegensatz zu den Anfang der achtziger Jahre aus Japan berichteten positiven Resultaten stehen die in jüngerer Zeit veröffentlichten Daten [200]. In einigen Untersuchungen wurde eine deutlich schlechtere Prognose für splenektomierte Patienten festgestellt [39, 158, 180, 233]. Demzufolge wird die Indikationsstellung zur Splenektomie heutzutage ausschließlich von tumorspezifischen Kriterien wie der Infiltrationstiefe und Lokalisation abhängig gemacht und gilt bisher bei T2-T4-Tumoren des mittleren und proximalen Magendrittels sowie bei direkter Infiltration der Milz und bei fortgeschrittenen T3/4Tumoren, die häufiger mit einer Metastasierung des Milzhilus einhergehen, als indiziert. [195, 212, 266]. Bei den vorherrschenden Tumorkonstellationen in den westlichen Ländern kann somit derzeit in 60% der Fälle von Magenkarzinom von einer notwendigen Splenektomie ausgegangen werden [195]. 134 Aber auch die Resektion weiterer infiltrierter Nachbarorgane kann bei fehlender Peritonealkarzinose und Fernmetastasierung bei T4-Tumoren gerechtfertigt sein, sei es zur Erzielung einer R0-Resektion oder unter palliativen Gesichtspunkten als sogenannter „Ultima-Ratio-Eingriff“ [108]. Neben der Splenektomie ist hier die Entfernung des Pankreasschwanzes ein häufiger durchgeführtes Verfahren. Multimodale Therapiekonzepte Zahlreiche adjuvante Therapieverfahren wie die systemische und intraperitoneale Chemotherapie oder die intraoperative Radiotherapie wurden in den letzten Jahren mit dem Ziel der Prognoseverbesserung nach kurativer Resektion von Magenkarzinomen in einem Stadium > I erprobt. Die vom Konzept her verheißungsvollen Studien erwiesen sich bisher als eher enttäuschend. Was die adjuvante Chemotherapie anbelangt, wurde lediglich in einer von 10 in Europa und den USA publizierten Studien mit jeweils über 100 Patienten ein statistisch signifikanter Überlebensvorteil beschrieben, hier durch die Applikation von 5FU/MeCCNU [89]. Keine weitere Studie konnte einen eindeutigen Hinweis auf einen Überlebensvorteil oder eine Verlängerung des rezidivfreien Intervalls durch adjuvante systemische Chemotherapie liefern. Resultate einzelner Studien zur intraperitonealen Chemotherapie mit Mitomycin C zeigten Erfolge hinsichtlich der Vermeidung peritonealer Rezidive nach Resektion lokal fortgeschrittener Magenkarzinome mit serosaler Infiltration, die keinen palliativen Charakter hatten [112, 280]. Durch die neoadjuvante Chemotherapie ließen sich zwar nicht die Raten kompletter Tumorresektionen bei Patienten mit resektablen Tumoren steigern, jedoch war ein deutlicher Anstieg an R0-Resektionen nach präoperativer Chemotherapie bei Patienten mit lokal fortgeschrittenen Tumoren zu verzeichnen [75]. Ergebnisse randomisierter Studien bezüglich eines Überlebensvorteils dieser Patientengruppe stehen noch aus. Ebenso wären weitere kontrollierte klinische Studien zur Klärung des Einflusses der zusätzlichen IORT beim fortgeschrittenen Magenkarzinom sinnvoll. Die Ergebnisse der letzten Jahre hinsichtlich eines Überlebensvorteils durch IORT differieren sehr. Gesichert scheint allerdings die Verminderung lokaler Rezidive durch IORT [252]. 135 Zirkulierende Tumorzellen Ein größeres Patientenkollektiv, vorzugsweise im Rahmen einer Multicenterstudie, wäre notwendig, um konkrete Schlüsse aus den Ergebnissen der oben genannten Studien ziehen zu können. Der Nachweis der disseminierten Tumorzellen und die positive Korrelation mit dem Tumorstadium, dem Ausmaß des Lymphknotenbefalls sowie der Überlebensrate, v.a. was die Befunde der Bauchhöhle betrifft, lassen jedoch eine hohe klinische Relevanz dieser Resultate in der Zukunft vermuten. 136 6. Literaturverzeichnis 1. Abe M , Yabumoto E, Takahashi M , Tobe T, Mori K (1974) Intraoperative radiotherapy of gastric cancer. Cancer 34: 2034-2041 2. Abe M, Shibamoto Y, Takahashi M, Manabe T, Tobe T, Inamoto T (1987) Intraoperative radiotherapy in carcinoma of the stomach and pancreas. World J Surg 11: 459-464 3. Abe M, Takahashi M, Ono K, Tobe T, Inamoto T (1988) Japan gastric trials in intraoperative radiation therapy. Int J Rad Oncol Biol Phys 15: 1431-1433 4. Abe M, Nishimura Y, Shibamoto Y (1995) Intraoperative radiation therapy for gastric cancer. World J Surg 19: 554-557 5. Adachi Y; Kamakura T, Mori M, Baba H, Maehara Y, Sugimachi K (1994) Prognostic significance of the number of positive lymph nodes in gastric carcinoma. Br J Surg 81: 414-416 6. Ajani AJ, Ota DM, Jessup JM, Ames FC et al. (1991) Resectable gastric cancer. An evaluation of preoperative and postoperative chemotherapy. Cancer 68: 1501-1506 7. Alcobendas F, Milla A, Estape J, Curto J, Pera C (1983) Mitomycin C as an adjuvant in resected gastric cancer. Ann Surg 198: 13-17 8. Aldini NN (1995) The first Billroth II gastric resection as reported by an Italian medical journal. Gesnerus 52: 290-302 9. Allen AW (1938) Total gastrectomy for carcinoma of the stomach. Amer J Surg 40: 35-41 10. Allum WH, Hallissey MT, Ward SC, Hockey MS (1989) A controlled, prospective, randomised trial of adjuvant chemotherapy or radiotherapy in resectable gastric cancer: interim report. Br J Cancer 60: 739-744 11. Allum WH, Powell DJ, McConkey CC, Fielding JWL (1989) Gastric cancer: a 25year review. Br J Surg 76: 535-540 137 12. Allum WH, Hallissey M, Kelly KA (1989) Adjuvant chemotherapy in operable gastric cancer. Lancet 1: 571-574 13. Altschul W (1913) Beitrag zur Chirurgie des Magenkarzinoms. Bericht über 612 in der Zeit von 1895-1911 beobachtete Fälle. Bruns Beiträge 84: 421-471 14. Archer SG, Gray BN (1990) Intraperitoneal 5-fluorouracil infusion for treatment of both peritoneal and liver metastases Surgery 108: 502-507 15. Aretxabala de X, Konishi K, Yonemura Y, Ueno K, Yagi M, Noguchi M, Miwa K, Miyazaki I (1987) Node dissection in gastric cancer. Br J Surg 74: 770-773 16. Ausch C, Rosen HR, Schiessel R (1996) Die Bedeutung der adjuvanten und neoadjuvanten Chemotherapie in der Behandlung des Magenkarzinoms. Wien Klin Wschr 108: 496-504 17. Bajetta E, di Bartolomeo M, de Braud F, Bozetti F et al. (1994) Etoposide, Doxorubicin and Cisplatin (EAP). Treatment in advanced gastric carcinoma: a multicentre study of the Italian Trials in Medical Oncology (I.T.M.O.) Group. Eur J Cancer 30A: 596-600 18. Baker RR (1984) Argumente gegen die systematische Lymphadenektomie in der Behandlung von Patienten mit Magenkarzinom. In: Rohde H, Troidl H (Hrsg) Das Magenkarzinom. Methodik klinischer Studien und therapeutische Ansätze. Thieme, Stuttgart, 2. Aufl, S 150-155 19. Becker HD, Börger H, Lepsien G, Peitsch W (1984) Die primär palliative Gastrektomie. In: Häring R (Hrsg) Therapie des Magenkarzinoms. edition medizin, 1. Aufl, S 293-299 20. Becker HD (1991) Radikalitätsprinzipien beim Magencarcinom - eine kritische Betrachtung. Chirurg 62: 878-880 21. Bengmark S, Domellöf L Olsson AM (1971) The role of splenectomy in stomach cancer operations. Digestion 4: 314 22. Bethge M, Sommer A, Beckord W, von Kleist D, Vakil N (1994) Palliativtherapie der malignen inoperablen Magenausgangsstenose mit Metallendoprothese. Endoskopie heute 3: 225-229 138 23. Bittner R (1987) Gastrectomie de nécessité. Langenbecks Arch Chir 372: 577-582 24. Bleiberg H, Gerard B, Deguiral P (1990) Adjuvant therapy in resectable gastric cancer. Br J Cancer 66: 987-999 25. Boddie AW, McMurtrey MJ, Giacco GG, McBride CM (1983) Palliative total gastrectomy and esophagogastrectomy. Cancer 51: 1195-1200 26. Böttcher K, Becker K, Busch R, Roder JD, Siewert JR (1992) Prognosefaktoren beim Magencarcinom. Chirurg 63: 656-661 27. Böttcher K, Roder JD, Busch R, Fink U, Siewert JR, Hermanek P, Meyer HJ für Deutsche Magencarcinom-Studiengruppe (1993) Risiko der chirurgischen Therapie des Magenkarzinoms in Deutschland - Ergebnisse der Deutschen Magen-Ca-Studie 1992. Dtsch med Wschr 118: 729-736 28. Böttcher K, Roder JD, Siewert JR für Deutsche Magenkarzinom-Studiengruppe (1996) Wertigkeit der radikalen Lymphknotendissektion (Compartment I und II) beim Magenkarzinom. Zentralbl Chir 121: 131-138 29. Boku T, Nakane Y, Minoura T, Takada H, Yamamura M, Hioki K, Yamamoto M (1990) Prognostic significance of serosal invasion and free intraperitoneal cancer cells in gastric cancer. Br J Surg 77: 436-439 30. Bonenkamp JJ, Velde van de CJH, Sasako M, Hermans J (1992) R2 compared with R1 resection for gastric cancer: morbidity and mortality in a prospective, randomized trial. Eur J Surg 158: 413-418 31. Bonenkamp JJ, Songun I, Hermans J, Sasako M et al. (1995) Randomised comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients. Lancet 345: 745-748 32. Bonenkamp JJ, Sogun I, Hermans J, van de Velde CJH (1996) Prognostic value of positive cytology findings from abdominal washings in patients with gastric cancer. Br J Surg 83: 672-674 139 33. Bonenkamp JJ, Hermans J, Sasako M, van de Velde CJH et al. (1999) Extended lymph-node dissection for gastric cancer. N Engl J Med 340: 908-914 34. Borrmann R (1926) Geschwuelste des Magens und Duodenums. In: Henke, Lubarsch (Hrsg), Handbuch der speziellen pathologischen Anatomie und Histologie, Springer, Berlin, Bd 4, 1.Aufl, S 865-885 35. Bozzetti F, Bonfanti G, Bufalino R, Menotti V, Persano S, Andreola S, Doci R, Gennari L (1982) Adequacy of margins of resection in gastrectomy for cancer. Ann Surg 196: 685-690 36. Bozzetti F, Regalia E, Bonfanti G, Doci R, Ballarini D, Gennari L (1990) Early and late results of extended surgery for cancer of the stomach. Br J Surg 77: 53-56 37. Bozzetti F, Bonfanti G, Gennari L (1992) Subtotal gastrectomy or „en principle“ total gastrectomy in cancer of the lower half of the stomach. Onkologie 15: 84-91 38. Bradley EL, Isaacs JT, Mazo JD, Hersh T, Chey WY (1977) Pathophysiology and significance of malabsorption after Roux-en Y reconstruction. Surgery 81: 684-691 39. Brady MS, Rogatko A, Dent LL Shiu MH (1991) Effect of splenectomy on morbidity and survival following curative gastrectomy for carcinoma. Arch Surg 126: 359-364 40. Braga M, Molinari M, Zuliani W, Foppa L, Gianotti L; Radaelli G, Cristallo M, Carlo di M (1996) Surgical treatment of gastric adenocarcinoma: impact on survival and quality of life, a prospective ten year study. Hepato-Gastroenterol 43: 187-193 41. Braun H (1892) Über die Gastro-Enterostomie und gleichzeitig ausgeführte EnteroAnastomose. Verh Dtsch Ges Chir 21: 515-518 42. Breaux JR, Bringaze W, Chappuis Cohn I (1990) Adenocarcinoma of the stomach: a review of 35 years and 1,710 cases. World J Surg 14: 580-586 43. British Stomach Cancer Group (1984) Resection line disease in stomach cancer. Br Med J 289: 601-603 44. Brünner H, Krieg H, Daniels V (1982) Ergebnisse nach Gastrektomie mit Passagewiederherstellung nach Longmire. Med Welt 33: 34-39 140 45. Buhl K, Lehnert T, Schlag P, Herfarth C (1995) Reconstruction after gastrectomy and quality of life. World J Surg 19: 558-564 46. Bundschuh E (1920) Über den Circulus vitiosus nach Gastroenterostomie. Bruns Beiträge 119: 62-85 47. Caletti G, Ferrari A, Brocchi E, Barbara L (1993) Accuracy of endoscopic ultrasonography in the diagnosis and staging of gastric cancer and lymphoma. Surgery 113: 14-27 48. Calvo FA, Henriquez I, Santos M, Escude L et al. (1989) Intraoperative and external beam radiotherapy in advanced resectable gastric cancer: technical description and preliminary results. I J Rad Oncol Biol Phys 17: 183-189 49. Cameron JL (1997) William Stewart Halsted. Our surgical heritage. Ann Surg 225: 445-458 50. Cantrell EG (1971) The importance of lymph-nodes in the assessment of gastric carcinoma at operation. Br J Surg 58: 384-386 51. Chew-Wun W, Maw-Jye H, Su-Shun L, Shyh-Haw T, Wing-Yiu L, Fang-Ku P (1994) Lymph node metastasis from carcinoma of the distal one-third of the stomach. Cancer 73: 2059-2064 52. Clark JL, Saenz RH, Nava HR, Douglass HO (1977) Impact of splenectomy on survival following gastrectomy for adenocarcinoma. Am J Surg 57: 496-501 53. Coller FA, Kay EB, McIntyre RS (1941) Regional lymphatic metastases of carcinoma of the stomach. Arch Surg 43: 748-761 54. Comis CL, Carter SK (1974) A review of chemotherapy in gastric cancer. Cancer 34: 1576-1586 55. Cromack DT, Maher MM, Hoekstra H (1989) Are complications in intraoperative radiation therapy more frequent than in conventional treatment? Arch Surg 124: 229-234 56. Cuschieri A, Fayers P, Fielding J, Craven, Bancewicz J, Joypaul V, Cook P (1996) Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: preliminary results of the MRC randomised controlled surgical trial. Lancet 347: 995-999 141 57. Cuschieri A, Weeden S, Fielding J et al. (1999) Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Surgical Co-operative Group. Br J Cancer 79: 1522-1530 58. Degiuli M, Sasako M, Ponzetto A, Allone T, Soldati T, Calgaro M, Balcet F, Bussone R, Olivieri F, Scaglione D, Danese F, Morino M, Calderini P, Capussotti L, Fronda G, Garavoglia M, Locatelli L, Dellepiane M, Rossini FP, Calvo F (1997) Extended lymph node dissection for gastric cancer: results of a prospective, multicentre analysis of morbidity and mortality in 118 consecutive cases. Eur J Surg Oncol 23: 310-314 59. Delbrück H, Severin M, Jansen G (1991) Postgastrektomiebefunde in der Nachsorge von 227 Patienten mit Magenkarzinom. Z Gastroenterol 29: 222-226 60. Denecke H (1989) Lymphadenektomie beim Magencarcinom. Chirurg 60: 133-138 61. Dent DM, Madden MV, Price SK (1988) Randomized comparison of R1 and R2 gastrectomy for gastric carcinoma. Br J Surg 75: 110-112 62. Diehl JT, Hermann RE, Cooperman AM, Hoerr SO (1983) Gastric carcinoma. A ten-year review. Ann Surg 198: 9-12 63. Dietl F, Rumpf KD (1995) Früh- und Spätergebnisse der Gastrektomie de principe. Zentralbl Chir 120: 800-803 64. DiMagno EP, Buxton JL, Regan PT et al. (1980) Ultrasonic endoscope. Lancet 1: 629-631 65. Dixon, WJ (1971) Use of triethylenethiophoramide as an adjuvant to the surgical treatment of gastric and colorectal carcinoma. Ann Surg 173: 26-39 66. Dobroschke J, Kunze HH (1984) Die Gastrektomie und gleichzeitige Resektion benachbarter Organe. In: Häring R (Hrsg) Therapie des Magenkarzinoms. edition medizin, 1. Aufl, S 285-291 67. Dulce M-C, Kaiser J, Boese-Landgraf J, Scheffler A, Häring R, Ernst H (1991) Erfahrungen mit der intraoperataiven Strahlentherapie beim Magenkarzinom (Berliner Methode). Strahlenther Onkol 167: 581-590 142 68. Dupont JB, Lee JR, Burton GR, Cohn I (1978) Adenocarcinoma of the stomach: review of 1,497 cases. Cancer 41: 941-947 69. Ekbom GA, Gleysteen JJ (1980) Gastric malignancy: resection for palliation. Surgery 33: 476-481 70. Engel GC (1945) The creation of a gastric pouch following total gastrectomy. Surgery 17: 512-523 71. Engstrom PF, Lavin PT, Douglass HO, Brunner KW (1985) Postoperative adjuvant 5-fluorouracil plus methyl-CCNU therapy for gastric cancer patients. Cancer 55: 1868-1873 72. Esmarch v F, Kowalzig E. (1892) Die Gastroenterostomie (Wölfler). In: Esmarch v F, Kowalzig E (Hrsg) Chirurgische Technik. Lipsius&Tischer, S 229-234 73. Eypasch E, Wood-Dauphinée S, Williams JI, Ure B, Neugebauer E, Troidl H (1993): Der Gastrointestinale Lebensqualitätsindex (GLQI). Chirurg 64: 264-274 74. Faß J, Hungs M, Reineke Th, Nachtkamp J, Schumpelick V (1994) Zur Frage der Prognoseverbesserung durch R1- und R2-Lymphadenektomie beim Magenkarzinom. Chirurg 65: 867-872 75. Fink U, Stein HJ, Schuhmacher C, Wilke HJ (1995) Neoadjuvant chemotherapy for gastric cancer: update. World J Surg 19: 509-516 76. Fink U, Schuhmacher C, Stein HJ, Busch R, Feussner H, Dittler HJ, Helmberger A, Böttcher K, Siewert JR (1995) Preoperative chemotherapy for stage III-IV gastric carcinoma, response and outcome after complete resection. Br J Surg 82: 1248-1252 77. Finke J, Engelhardt R (1994) Chemotherapy for advanced gastric cancer. Dig Surg 11: 118-120 78. Finney JM, Rienhoff WF (1929) Gastrectomy. Arch Surg 2: 141-162 79. Fisher B, Gunduz N, Saffer EA (1983) Influence of the interval between primary tumor removal and chemotherapy on kinetics and growth of metastases. Cancer Res 43: 1488-1492 143 80. Fisher B, Saffer EA, Rudock C, Coyle J, Gunduz N (1989) Effect of local or systemic treatment prior to primary tumor removal on the production and response to a serum growth-stimulating factor in mice. Cancer Res 49: 2002-2004 81. Fisher B, Gunduz N, Coyle J (1989) Presence of a growth stimulating factor in serum following primary tumor removal in mice. Cancer Res 49: 1996-2001 82. Fly OA, Dockerty MB, Waugh JM (1956) Metastasis to the regional nodes of the splenic hilus from carcinoma of the stomach. Surg Gyn Obstet 1: 279-286 83. Fraass B, Miller AW, Kinsella TJ, Sindelar WF, Harrington FS, Yeakel K (1985) Intraoperative radiation therapy at the National Cancer Institute: Technical innovations and dosimetry. Int J Radiat Oncol Biol Phys 11 : 1299-1311 84. Fuchs K-H, Thiede A, Engemann R, Deltz E, Stemme O, Hamelmann H (1995) Reconstruction of the food passage after total gastrectomy: randomized trial. World J Surg 19: 698-706 85. Gall FP (1982) Operative Methodenwahl bei Palliativeingriffen. Langenbecks Arch Chir 358: 85-90 86. Gall FP, Altendorf A, Hermanek P, Gentsch HH (1982) Chirurgische Therapie des Magenkrebses – Stagnation oder Fortschritte? Ergebnisse bei 2665 MagenkrebsPatienten. Fortschr Med 40: 1876-1882 87. Gall FP, Hermanek P (1985) New aspects in the surgical treatment of gastric carcinoma - a comparative study of 1636 patients operated on between 1969 and 1982. Eur J Surg Oncol 11: 219-225 88. Gall FP, Hermanek P (1993) Die systematische erweiterte Lymphknotendissektion in der kurativen Therapie des Magencarcinoms. Chirurg 64: 1024-1031 89. Gastrointestinal Tumor Study Group (1982) A comparison of combination chemotherapy and combined modality therapy for locally advanced gastric carcinoma. Cancer 49: 1771-1777 90. Gastrointestinal Tumor Study Group (1984) Randomized study of combination chemotherapy in unresectable gastric cancer. Cancer 53: 13-17 144 91. Gebbia V, Valenza R, Testa A, Sciume C, Longo A et al. (1994) Etoposide, doxorubicin and cisplatin regimen in advanced gastric adenocarcinoma: experience with a lower dose schedule. J Cancer Res Clin Oncol 120: 550-552 92. Gebhardt C, Schultheis KH (1993) Die multiviszerale Resektion des fortgeschrittenen Magenkarzinoms. Langenbecks Arch Chir 378: 68-72 93. Gennari L, Bozzetti F, Bonfanti G, Bufalino R, Menotti V, Persano S, Andreola S, Doci R (1986) Subtotal versus total gastrectomy for cancer of the lower two-thirds of the stomach: a new approach to an old problem. Br J Surg 196: 685-690 94. Giedl J, Hermanek P, Husemann B (1980) Häufigkeit und Typ der lymphogenen Metastasierung des Magenkrebses. Langenbecks Arch Chir: 191-197 95. Giedl J, Hermanek P (1984) Der Einfluß histopathologischer Befunde auf die Wahl der chirurgischen Therapiemethode und die Überlebenszeiten beim Magenkarzinomkranken. In: Rhode H, Troidl H (Hrsg) Das Magenkarzinom. Methodik klinischer Studien und therapeutischer Ansätze. Thieme, Stuttgart, 2. Aufl, S 155-161 96. Gilbertsen VA (1969) Results of treatment of stomach cancer. An appraisal of efforts for more extensive surger and a report of 1,983 cases. Cancer 23: 1305-1308 97. Gouzi JL, Huguier M Fagniez PL, Launois B, Flamant Y, Lacaine F, Paquet JC Hay JM (1988) Total versus subtotal gastrectomy for adenocarcinoma of the gastric antrum. Ann Surg 209:162-166 98. Graham RR (1940) A technique for total gastrectomy. Surgery 8: 257-264 99. Griffith JP, Sue-Ling HM, Martin I, Dixon MF, McMahon MJ, Axon ATR, Johnston D (1995) Preservation of the spleen improves survival after radical surgery for gastric cancer. Gut 36: 684-690 100. Grimm H, Binmoeller KF, Hamper K, Koch J, Henne-Bruns D, Soehendra N (1993) Endosonography for preoperative locoregional staging of esophageal and gastric cancer. Endoscopy 25: 224-230 145 101. Günther B, Teichmann RK, Demmel N, Krämling HJ, Heberer G (1987) Aktuelle Chirurgie des Magenkarzinoms. Münch med Wschr 129: 285-288 102. Gütgemann A, Schreiber HW, Bernhard A (1963) Erfahrungen mit der totalen Gastrektomie. Langenbecks Arch Chir 303: 73-93 103. Gunduz N, Fisher B, Saffer EA (1979) Effect of surgical removal on the growth and kinetics of residual tumor. Cancer Res 39: 3861-3865 104. Gussenbauer C, Winiwarter A (1876) Die partielle Magenresection. Zentralbl Chir 33: 347-380 105. Hacker v (1885) Zur Kasuistik und Statistik der Magenresektionen und Gastroenterostomien. Zentralbl Chir 12: 60-68 106. Häring R, Eckart J, John St, Perez P, Stallkamp B, Tung LC, Waldschmidt J (1971) Die Nahtinsuffizienz der oesophagealen Anastomose nach Gastrektomie und Kardiaresektion. Langenbecks Arch Chir 328: 295-310 107. Häring R (1981) Zur chirurgischen Therapie des fortgeschrittenen Magenkarzinoms. Zentralbl Chir 106: 1016-1024 108. Häring R, Germer Ch, Albrecht D, Diermann J (1994) Fortschritte der Magenkarzinom-Therapie in den letzten 25 Jahren. Verdauungskrankheiten 12: 226-233 109. Haim N, Tsalik M, Robinson E (1994): Treatment of gastric adenocarcinoma with the combination of etoposide, adriamycin and cisplatin (EAP): comparison between two schedules. Oncology 51: 102-107 110. Hallissey MT, Allum WH, Roginski C, Fielding JWL (1988) Palliative surgery for gastric cancer. Cancer 62: 440-444 111. Halvorsen RA, Yee J, McCormick VD (1996) Diagnosis and staging of gastric cancer. Sem Oncol 23: 325-335 146 112. Hamazoe R, Maeta M, Kaibara N (1994) Intraperitoneal thermochemotherapy for prevention of peritoneal recurrence of gastric cancer. Cancer 73: 2048-2052 113. Hamelmann H. (1985) Stadiengerechte Chirurgie: Magenresektion und Relation zur Lokalisation, dem Tumortyp und der Ausdehnung. In: Bünte (Hrsg) Aktuelle Therapie des Magenkarzinoms. Springer, Berlin Heidelberg New York, S 47-59 114. Harms E (1938) Das Ergebnis chirurgischer Behandlung beim nicht mehr resezierbaren Magen- und Speiseröhrenkrebs. Langenbecks Arch Chir 191: 606-617 115. Heberer G, Teichmann RK, Kramling HJ, Günther B (1988) Results of gastric resection for carcinoma of the stomach: the European experience. World J Surg 12: 374-381 116. Helmer F (1982) Der Einfluß Theodor Billroths auf die heutige Abdominalchirurgie. Zentralbl Chir107: 1469-1480 117. Herczel v E (1902) Beitrag zur totalen Exstirpation des carcinomatösen Magens. Bruns Beiträge klin Chir 34: 336-350 118. Herfarth Ch, Schlag P, Buhl K (1987) Surgical procedures for gastric substitution. World J Surg 11: 689-698 119. Hermanek P (1982) Chirurgische Pathologie-TNM-System. Langenbecks Arch Chir 358: 57-63 120. Hermanek P, Wittekind C (1995) News of TNM and its use for classification of gastric cancer. World J Surg 19: 491-495 121. Hermanek P (1996) Differenziertes chirurgisches Vorgehen bei der kurativen Therapie des Magenkarzinoms. Leber Magen Darm 26: 64-72 122. Hermans J, Bonenkamp JJ, Boon MC, Bunt AMG, Ohyama S (1993) Adjuvant therapy after curative resection for gastric cancer: meta-analysis of randomized trials. J Clin Oncol 11: 1441-1447 123. Herschbach P, Henrich G (1991) Der Fragebogen als methodischer Zugang zur Erfassung von Lebensqualität in der Onkologie. Aus: Schwartz R, Bernhard J, Flechtner H, Küchler Th, Hürny Ch (Hrsg.) Lebensqualität in der Onkologie, Zuckschwerdt: München, 34-46 147 124. Higgins GA, Amadeo JH, Smith DE (1983) Efficacy of prolonged intermittent therapy with combined 5-FU and methyl-CCNU following resection for gastric carcinoma. A veterans administration surgical oncology group report. Cancer 52: 1005-1012 125. Hinz R (1924) Zur Technik der totalen Magenexstirpation. Arch klin Chir 132: 635-645 126. Hirner A, Häring R, Kania U, Weber (1984) Maßnahmen beim Lokalrezidiv des Magenkarzinoms. In: Häring R (Hrsg.) Therapie des Magenkarzinoms. edition medizin, 1. Aufl, S 715-722 127. Hochenegg-Payr (1918) Die Operationen amMagen. In: Hochenegg-Payr (Hrsg) Lehrbuch der speziellen Chirurgie, Urban & Schwarzenberg, Bd 2, 2. Aufl, S 100-118 128. Hoffmann V (1922) Eine Methode des plastischen Magenersatzes. Zentralbl Chir 40: 1477-1478 129. Holder E (1957) Die Gastrektomie. Indikation, Methodik und Prognose. Langenbecks Arch Chir 287: 388-397 130. Holle F (1957) Technik und postoperative Funktion der Totalresektion mit Dünndarmzwischenschaltung nach Longmire. Langenbecks Arch 287: 382-385 131. Holle F (1960) Über die Indikation zur partiellen und totalen Resektion des Magens bei Carcinom. Chirurg 3: 103-110 132. Hollender LF (1984) Retrospektive Studie über 384 Magenresektionen beim Magenkarzinom. In: Häring R (Hrsg) Therapie des Magenkarzinoms. edition medizin, 1. Aufl, S 249-261 133. Hunt CJ (1952) Construction of food pouch from segment of jejunum as substitute for stomach in total gastrectomy. Arch Surg 64: 601-608 134. Husemann B, Giedl J (1980) Das Magenkarzinomrezidiv. Therapiewoche 30: 8560-8561 135. Inberg MV, Heinonen R, Rantakokko V, Viikari SJ (1975) Surgical treatment of gastric carcinoma. Arch Surg 110: 703-707 148 136. Ito H, Asahare S (1905) Beitrag zur totalen resp. subtotalen Exstirpation des carcinomatösen Magens. Zentralbl Chir 50: 135-149 137. Jäger E, Knuth A (1995) Adjuvante und palliative Chemotherapie des Magenkarzinoms. Dtsch MedWschr 120: 491-497 138. Jähne J, Maschek H, Meyer HJ, Pichlmayr R (1996) Systematische Lymphadenektomie beim Magenkarzinom - Staging und Therapie. Zentralbl Chir 121: 126-130 139. Jauch K-W, Heiss MM, Grützner U, Funke I, Pantel K, Babic R, Eissner H-J, Riethmüller G, Schildberg F-W (1996) Prognostic significance of bone marrow micrometastases in patients with gastric cancer. J Clin Oncol 14: 1810-1017 140. Jemerin EE, Colp R (1952) Gastric Carcinoma. Surg Gyn Obstet 95: 99-112 141. Jentschura D, Winkler M Stohmeier N, Rumstadt B, Hagmüller E (1997) Qualityof-life after curative surgery for gastric cancer: a comparison between total gastrectomy and subtotal gastric resection. Hepato-Gastroenterol 44 : 1137-1142 142. Jinnai D (1968) Evaluation of extended radical operation for gastric cancer, with regard to lymph node metastasis and follow-up results. Gann 3: 225-231 143. Juhl H (1989) New approaches in gastric cancer research: monoclonal antibodies in diagnosis and therapy. Hepato-gastroenterol 36: 27-32 144. Juhl H, Kalthoff H, Krüger U, Henne-Bruns D, Kremer B (1995) Immunzytologischer Nachweis mikrometastatischer Zellen bei Patienten mit gastrointestinalen Tumoren. Zentralbl Chir 120: 116-122 145. Junginger Th, Müller J, Pichlmaier H (1976) Chirurgische Behandlung des Magenkarzinoms. Leber Magen Darm 6: 113-120 146. Junginger Th, Muschong N, Raab M (1984) Gefahren und Grenzen der systematischen Lymphadenektomie bei Magenkarzinom. In: Rohde H, Troidl H (Hrsg) Das Magenkarzinom, Thieme, 2. Aufl, S 176-182 149 147. Junginger Th, Walgenbach S (1988) Postgastrectomy reconstruction by esophagojejunostomy Roux-en-Y. Nutrition 4: 239-241 148. Junginger Th (1995) Konsensus der CAO, AIO und ARO: Multimodale Therapie bei Magenkarzinom. Onkologie 18: 488-489 149. Keller E (1996) Vorteile des Lymphknotenstaging bei 872 Magenkarzinompatienten. ZentralblChir 121: 139-143 150. Kelsen DA, Atiq OT, Saltz L, Niedzwiecki D, Ginn D, Chapman D, Heelan R, Lightdale CH, Vinciguerra VI, Brennan MU (1992) FAMTX versus etoposide, doxorubicin and cisplatin: a random assignment trial in gastric cancer. J Clin Oncol 10: 541-548 151. Kelsen DP (1996) Adjuvant and neoadjuvant therapy for gastric cancer. Sem Oncol 23: 379-389 152. Kieninger G, Mayer R (1985) Abgestuftes Konzept der Passagerekonstruktion nach Gastrektomie. In: Bünte H (Hrsg) Aktuelle Therapie des Magenkarzinoms. Springer, Berlin Heidelberg New York, 2. Aufl, S 80-84 153. Klein HO, Dias Wickramanayake P, Dieterle F, Mohr R, Oekermann H, Brock J, Beyer D, Gross R (1982) Chemotherapieprotokoll zur Behandlung des metastasierenden Magenkarzinoms. Dtsch Med Wschr 107: 1708-1712 154. Kirchner R, Stützer H, Farthmann EH (1992) Palliative Eingriffe. Langenbecks Arch Chir Suppl: 142-151 155. Kocher T (1894) Zur Technik und zu den Erfolgen der Magenresektion. Zentralbl Chir 10: 221-223 156. Kodama Y, Sugimachi K, Soejima K, Matsusaka T, Inokuchi K (1981) Evaluation of extensive lymph node dissection for carcinoma of the stomach. World J Surg 5: 241-248 157. Köckerling MD, Reck T, Gall FP (1995) Extended gastrectomy: who benefits? World J Surg 19: 541-545 158. Koga S, Kaibara N, Kimura O, Nishidoi H, Kishimoto H (1981) Prognostic significance of combined splenectomy of pancreaticosplenectomy in total and proximal gastrectomy for gastric cancer. Am J Surg 142: 546-550 150 159. Korenga D, Tsujitani S, Haraguchi M, Okamura T, Tamada R, Sugimachi K, Akazawa K, Nose Y (1988) Long-term survival in Japanese patients with far advanced carcinoma of the stomach. World J Surg 12: 236-240 160. Kovack JS, Moertel CG, Schutt AJ, Hahn RG, Reitemeier RJ (1974) A controlled study of combined 1,3-bis-(2-chloroethyl)-1-nitrosourea and 5-fluorouracil for advanced gastric and pancreatic cancer. Cancer 33: 563-567 161. Kozarek RA (1994) Expandable endoprotheses for gastrointestinal stenoses. Experimental and Invest Endoscopy 4: 279-295 162. Krämling HJ, Wilkowski R, Duhmke E, Cramer C, Willich N, Schildberg FW (1996) Adjuvante intraoperative Strahlentherapie (IORT) beim Magenkarzinom. Langenbecks Arch Chir (Suppl) 113: 211-213 163. Kraft-Kinz J, Kronberger L, Stadler H (1984) Indikation und Ergebnisse der subtotalen Resektion nach Billroth II beim Magenkarzinom. In: Häring R (Hrsg) Therapie des Magenkarzinoms. edition medizin, 1. Aufl., S 221-224 164. Kroenlein (1896) Chirurgische Erfahrungen über das Magencarcinom. Bruns Beiträge 15: 311-350 165. Kroenlein (1902) Über den Verlauf des Magencarcinoms bei operativer und bei nicht operativer Behandlung. Eine Bilanzrechnung. Verh Dtsch Ges Chir 31: 88-104 166. Krook JE, O`Connell R, Wieand HS (1991) A prospective randomized evaluation of intensive course 5-flourouracil plus doxorubicin as surgical adjuvant chemotherapy for resected gastric cancer. Cancer 67: 2454-2458 167. Kuntzen H (1957) Indikation und Ergebnisse der erweiterten Magenresektion. Langenbecks Arch Chir 287: 352-377 168. Kwon SJ (1997) Prognostic impact of splenectomy on gastric cancer: Results of the Korean Gastric Cancer Study Group World J Surg 21: 837-844 169. Laurén P (1964) The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. Acta Pathol Microbiol Scand 64: 31-49 170. Lawrence W, McNeer G (1960) An analysis of the role of radical surgery for gastric cancer. Surg Gyn Obstet 111: 691-696 151 171. Lawrence W (1962) Reservoir construction after total gastrectomy. Ann Surg 155: 191-198 172. Lawrence W (1996) Reconstruction after total gastrectomy: what is preferred technique? J Surg Oncol 63: 215-220 173. Leichmann L, Macdonald B, Dindogru A, Samson M (1982) Platinum: A clinically active drug in advanced adenocarcinoma of the stomach. Proc. Amer. Ass. Cancer Res. 110: 430-436 174. Lerner A, Gonin R, Steel GD, Mayer AJ (1992) Etoposide, doxorubicin and cisplatin chemotherapy for advanced gastric adenocarcinoma a phase II trial. J Clin Oncol 10: 536-540 175. Lightdale CJ (1992) Endoscopic ultrasonography in the diagnosis, staging and follow up of esophageal and gastric cancer. Endoscopy (Suppl 1) 24:297-303 176. Longmire WP (1947) Total gastrectomy for carcinoma of the stomach. Surg Gyn Obstet 84: 21-30 177. Longmire WP (1952) Construction of a substitute gastric reservoir following total gastrectomy. Ann Surg 135: 637-645 178. Lortat-Jacob J, Giuli R, Estenne B, Clot P (1975) Value of total gastrectomy for treatment of cancers of the stomach. Study of 482 radical operations. Chirurgie 101: 59-67 179. Macdonald JS (1979) 5-fluorouracil, adriamycin and mitomycin-C - (FAM) combination chemotherapy in the treatment of advanced gastric cancer. Cancer 44: 42-47 180. Maehara Y, Moriguchi S, Yoshida M, Takahashi I, Korenaga D, Sugimachi K (1991) Splenectomy does not correlate with length of survival in patients undergoing curative total gastrectomy for gastric carcinoma. Cancer 67: 3006-3009 181. Maki T (1969) Ergebnisse der totalen Gastrektomie beim Magencarcinom. Langenbecks Arch Chir 325: 450-458 182. Mari E, Floriani I, Tinazzi A, Buda A, Belfiglio M, Valentini M, Cascinu S, Barni S, Labianca R, Torri V (2000) Efficacy of adjuvant chemotherapy after curative resection for gastric cancer: a meta-analysis of published randomised trials. A study of the GISCAD Ann Oncol 11: 837-43 152 183. Markman M (1987) Intraperitoneal chemotherapy for malignant diseases of the gastrointestinal tract. Surg Gynec & Obst 164: 89-93 184. Marshall SF, Welch ML (1947) Carcinoma of the stomach - rate of operability. Surg Clin North Am 27: 631-635 185. Maruyama K, Okabayashi K, Kinoshita T (1987) Progress in gastric cancer surgery in Japan and its limits of radicality. World J Surg 11:418-425 186. McNeer G (1954) Postoperative mortality after total gastrectomy. Cancer 7: 1010-1016 187. McNeer G, Lawrence W, Ashley MP, Pack GT (1958) End results in the treatment of gastric cancer. Surgery 43: 879-896 188. Meijer S, Bakker de OJGB, Hoitsma HFW (1983) Palliative resection in gastric cancer. J Surg Oncol 23: 77-80 189. Mendes de Almeida , Bettencourt A, Costa CS, Mendes de Almeida JM (1994) Curative surgery for gastric cancer: study of 166 consecutive patients. World J Surg 18: 889-895 190. Meyer H-J, Pichlmayr R, Geerlings H (1985) Die Gastrektomie als Regeloperation beim Magenkarzinom. In: Bünte H (Hrsg) Aktuelle Therapie des Magenkarzinoms. Springer, Berlin Heidelberg New York, 2. Aufl, S 60-67 191. Meyer H-J, Jähne J, Pichlmayr R (1987) Magencarcinom: Gastrektomie de principe. Langenbecks Arch Chir 372: 571-576 192. Meyer H-J, Jähne J, Wilke H, Pichlmayr R (1991) Surgical treatment of gastric cancer: retrospective suvery of 1,704 operated cases with spcial reference to total gastrectomy as the operation of choice. Sem Surg Oncol 7: 356-364 193. Meyer H-J, Jähne J, Wilke H (1993) Perspectives of surgery and multimodality treatment in gastric carcinoma. J Cancer Res Clin Oncol 119: 384-394 153 194. Meyer H-J, Jähne J, Pichlmayr R (1994) Strategies in the surgical treatment of gastric carcinoma. Ann Oncol 5 (Suppl.3): 33-36 195. Meyer H-J, Jähne J, Weimann A, Pichlmayr R (1994) Chirurgische Therapie des Magenkarzinoms - Indikationen zur Splenektomie bei der Gastrektomie. Chirurg 65: 437-440 196. Mikulicz v (1898) Beiträge zur Technik der Operation des Magencarcinoms. Verh Dtsch Ges Chir 27: 252-260 197. Mikulicz v (1901) Chirurgische Erfahrungen über Magencarcinom. Centralbl Chir 48: 1197-1201 198. Mine M, Majima S, Harada M, Etani S (1970) End results of gastrectomy for gastric cancer: effect of extensive lymph node dissection. Surgery 68: 753-758 199. Mitsudomi (1989) A clinicopathological study of gastric cancer with special reference to age of patients. World J Surg 13: 225-230 200. Miwa K (1979) Cancer of the stomach in Japan. Gann Monogr Cancer Res 22: 61-75 201. Möller W (1920) Die Resultate bei Magenresektion wegen Krebs in der chirugischen Klinik Lund 1898-1918. Bruns Beiträge 120: 65-88 202. Moertel CG, Mittelman JA, Bakemeier RF, Engstrom P, Hanley J (1976) Sequential and combination chemotherapy of advanced gastric cancer. Cancer 38: 678-682 203. Moritz E, Wense G (1973) Ergebnisse der chirurgischen Behandlung des Magenkarzinoms. MMW 115: 1518-1523 204. Most A (1899) Über die Lymphgefässe und die regionären Lymphdrüsen des Magens in Rücksicht auf die Verbreitung des Magencarcinoms. Langenbecks Arch Chir 59: 175-180 205. Msika S, Benhamiche AM, Tazi MA, Rat P, Faivre J (2000) Improvement of operative mortality after curative resection for gastric cancer: population-based study. World J Surg 24 (9): 1137-42 154 206. Nakajima T, Harashima S Hirata M, Kajitani T (1978) Prognostic and therapeutic values of peritoneal cytology in gastric cancer. Acta Cytol 22: 225-229 207. Nakajima T (1995) Review of adjuvant chemotherapy for gastric cancer. World J Surg 19: 570-574 208. Nakamura K, Ueyama T, Yao T, Xin Xuan Z, Ambe K, Adachi Y, Yakeishi Y, Matsukuma A, Enjoji M (1992) Pathology and prognosis of gastric carcinoma. Cancer 70: 1030-1037 209. Nakane S, Okumura S, Akehira K, Okamura S, Boku T, Okusa T, Tanaka K, Hioki K (1995) Jejunal pouch reconstruction after total gastrectomy for cancer. Ann Surg 222: 27-35 210. Neugut AI, Hayek M, Geoffrey H (1996) :Epidemiology of gastric cancer. Sem Oncol 23: 281-291 211. Noyes RD, Weiss SM, Krall JM (1992) Surgical complications of intraoperative radiation therapy: The Radiation Therapy Oncology Group experience. J Surg Oncol 50: 209-215 212. Nürnberger HR (1996) Ist die Splenektomie „en principe“ für die Radikalität der Gastrektomie mit systematischer Lymphadenektomie beim Magenkarzinom notwendig? Zentralbl Chir 121: 144-147 213. Pack GT, McNeer G (1943) Total gastrectomy for cancer. Surg Gynecol Obstet 77: 265-299 214. Padberg WM, Doerr U, Buhr J, Kelm Ch., Henneking K (1996) Die Bedeutung der systematischen Lymphadenektomie beim Magenkarzinom. Zentralbl Chir 121: 116-120 215. Papachristou DN, Fortner JG (1979) Anastomotic failure complicating total gastrectomy and esophagogastrectomy for cancer of the stomach. Am J Surg 138: 399-403 216. Papachristou DN, Fortner JG (1981) Local recurrence of gastric adenocarcinomas after gastrectomy. J Surg Oncol 18: 47-53 217. Peiper HJ und Siewert R (1978) Magenersatz. Chirurg 49: 81-88 218. Peiper HJ (1982) Prinzipielle Gastrektomie beim Magenkarzinom - Pro und Kontra. Med Welt 33: 241-245 155 219. Pichlmayr R, Meyer H-J, Guthy E (1980) Subtotale oder totale Resektion beim Magenkarzinom: Vertreter des Pro. Therapiewoche 30: 8549-8557 220. Pichlmayr R., Meyer HJ, Van Alste HE (1980) Die Gastrektomie als Standardoperation beim Magenkarzinom. In: Beger HG, Bergermann W, Oshima H (Hrsg) Das Magenkarzinom. Thieme, Stuttgart, 1. Aufl, S 238-246 221. Plukker JT, Mulder NH, Sleifjfer DTH (1991) Chemotherapy and surgery for locally advanced cancer of the cardia and fundus: Phase II study with methotrexate and 5-fluorouracil. Br J Surg 78: 955-958 222. Pollack BJ, Chak A, Sivak MV (1996) Endoscopic Ultrasonography. Sem Oncol 23: 336-346 223. Preusser P (1990) Chemotherapie des Magenkarzinoms. In: Bünte, Meyer, Preusser, Gastrointestinale Malignome. Interdisziplinäre Therapiekonzepte, Dtsch Ärzte-Verlag, Köln, 1. Aufl., S 74-93 224. Priestley JT, Kumpuris F (1948) Total gastrectomy with esophagoduodenal anastomosis. Arch Surg 56: 145-152 225. Queißer W (1986) Chemotherapy of advanced gastric carcinoma. Onkologie 9: 319-331 226. Räth U, Flechtner H, Selbach J, Harjung H, Manegold c, Kabelitz K, Trux FA, Edler L, Schlag P, Queißer W (1990) Etoposide, adriamycin and cisplatinum (EAP) combination chemotherapy for advanced gastric cancer. Onkologie 13: 194-197 227. Regensburger K (1954) Resektionsquote und Mortalität bei Magenkrebsoperationen aus einem 16jährigen Zeitabschnitt. Bruns Beiträge 180: 557-564 228. Reifferscheid M (1969) Die untere Magenteilresektion : Indikation und Ergebnisse. Langenbecks Arch Chir 325: 439-450 229. ReMine WH, Priestley JT (1952) Late results after total gastrectomy. Surg Gyn Obst 94: 519-525 230. ReMine WH, Priestley JT (1966) Trends in prognosis and surgical treatment of cancer of the stomach. Ann Surg 163: 736-745 156 231. Ringel (1903) Die Resultate der operativen Behandlung des Magencarcinoms. Bruns Beiträge 38: 585-600 232. Robertson CS, Chung SCS, Woods SDS (1994) A prospective randomized trial comparing R1 subtotal gastrectomy with R3 total gastrectomy for antral cancer. Ann Surg 220: 176 233. Roder JD, Herschbach P, Henrich G, Nagel M Böttcher K, Siewert JR (1992) Lebensqualität nach totaler Gastrektomie wegen Magenkarzinoms. Dtsch med Wschr 117: 241-247 234. Roder JD, Böttcher K, Siewert JR, Hermanek P, Meyer HJ and the German Gastric Cancer Study Group (1993) Prognostic factors in gastric carcinoma. Results of the German Gastric carcinoma Study 1992. Cancer 72: 2089-2097 235. Roder JD, Stein HJ, Eckel F, Herschbach P, Henrich G, Böttcher K, Busch R, Siewert JR (1996) Vergleich der Lebensqualität nach subtotaler und totaler Gastrektomie beim Magenkarzinom. Dtsch med Wschr 121: 543-549 236. Rösch T (1995) Endosonographic staging of gastric cancer: a review of literature results. Gastrointest Endosc Clin of North Am 5: 549-557 237. Rohde H, Gebbensleben B, Bauer P, Stützer H, Zieschang J (1989) Has there been any improvement in the staging of gastric cancer? Cancer 64: 2465-2481 238. Rougier P, Droz JP, Piot G, Theodore C, Ruffie P, Kac J (1986) Phase II trial of combined 5-FU-adriamycin-cisplatin (FAP) in gastric carcinoma. Cancer Chemother Pharmacol 18 (Suppl. 1): A 62 239. Roukos D, Lorenz M, Hottenrott C (1988) Operative Behandlung und Prognose des Magenkarzinoms unter besonderer Berücksichtigung der Gastrektomie als Regeloperation. Schweiz med Wschr 118: 783-786 240. Roukos D (2000) Current status and future perspectives in gastric cancer management. Cancer Treat Rev 26: 243-255 241. Roux C (1907) L’esophago-jejune-gastrome. Nouvelle Opération Pour Retricissement Infranchissable de L’ésophage. Semaine Med 27: 37-42 157 242. Sautner T, Hofbauer f, Depisch D, Schiessel R, Jakesz R (1994) Adjuvant intraperitoneal cisplatin chemotherapy does not improve long-term survival after surgery for advanced gastric cancer. J Clin Oncol 12: 970-974 243. Scott HW, Longmire WP (1949) Total Gastrectomy. Surgery 26: 488-498 244. Serlin O, Keehn RJ, Higgins GA (1977) Factors related to survival following resection for gastric carcinoma. Cancer 40: 1318-1329 245. Shiu MH, Papachristou DN, Kosloff C, Eliopoulos G (1980) Selection of operative procedure for adenocarcinoma of the midstomach. Ann Surg 192: 730-737 246. Sendler A, Böttcher K, Etter M, Siewert JR (2000) Das Magenkarzinom. Internist 41: 817-830 247. Siewert R, Meyer H, Peiper H-J (1976) Klinische Ergebnisse der OesophagoJejunoplicatio. Langenbecks Arch Chir 343: 45-58 248. Siewert JR, Lange J, Böttcher K, Becker K, Stier A (1986) Lymphadenektomie beim Magencarcinom. Langenbecks Arch Chir 368: 137-148 249. Siewert JR, Fink U (1992) Multimodale Therapiekonzepte bei Tumoren des Gastrointestinaltraktes. Chirurg 63: 242-250 250. Siewert JR, Böttcher K, Roder JD, Busch R, Hermanek P, Meyer HJ (1993) Prognostic relevance of systematic lymph node dissection in gastric carcinoma. Br J Surg 80: 1015-1018 251. Siewert JR, Böttcher K, Stein HJ, Roder JD (1998) Relevant prognostic factors in gastric cancer: ten-year results of the German Gastric Cancer Study. Ann Surg 228: 449-61 252. Sindelar WF, Kinsella TJ, Tepper JE, DeLaney TF, Maher MM, Smith R, Rosenberg SA, Gatstein E (1993) Randomized trial of intraoperative radiotherapy in carcinoma of the stomach. Am J Surg 165: 178-186 253. Smith JW, Shiu MH, Kelsey L, Brennan MF (1991) Morbidity of radical lymphadenectomy in the curative resection of gastric carcinoma. Arch Surg 126: 1469-1473 158 254. Soga J (1979) The role of lymphadenectomy in curative surgery for gastric cancer. World J Surg 3: 701-708 255. Soga J (1988) A statistical evaluation of advancement in gastric cancer surgery with special reference to the significance of lymphadenectomy for cure. World J Surg 12: 398-405 256. Steingräber M (1954) Operationsmortalität und Überlebensdauer nach der Gastrektomie. Zentralbl Chir 79: 1089-1095 257. Strohm WD, Phillip J, Hagenmüller, et al. (1980) Ultrasonic tomography by means of an ultrasonic fiberendoscope. Endoscopy 12: 241-244 258. Sugarbaker PH (1989) Management of peritoneal carcinomatosis Acta Med Austriaca 16: 57-60 259. Sugimachi K, Kodama Y, Kumashiro R, Kanematsu T, Noda S, Inokuchi K (1980) Critical evaluation of prophylactic splenectomy in total gastrectomy for the stomach cancer. Gann 71: 704-709 260. Suehiro S, Nagasue N, Ogawa Y, Sasaki Y, Hirose S, Yukaya H (1984) The negative effect of splenectomy on the prognosis of gastric cancer. Am J Surg 148: 645-648 261. Sunderland DA, McNeer G, Ortega LG Pearce LS (1953) The lymphatic spread of gastric cancer. Cancer 6: 987-996 262. Svedlund J, Sullivan M; Sjödin I, Liedman B, Lundell L (1996) Quality of life in gastric cancer prior to gastrectomy. Qual Life Res 5: 255-264 263. Schlatter (1897) Über Ernährung und Verdauung nach vollständiger Entfernung des Magens – Ösophagoenterostomie – beim Menschen. Bruns Beiträge Klin Chir 19: 757-776 264. Schlimok G, Funke I, Holzmann B, et al. (1987) Micrometastatic cancer cells in bone marrow: in vitro detection with anti-cytokeratin and in vivo labeling with anti-17-1A monoclonal antibodies. Proc Natl Acad Sci 84: 8672-8676 159 265. Schlimok G, Funke I, Pantel K, Strobel F, Lindemann F, Witte J, Riethmüller G (1991) Micrometastatic Tumour Cells in bone Marrow of Patients with Gastric Cancer: methodological Aspects of Detection and Prognostic Significance. Eur J Cancer 27: 1461-1465 266. Schmid A, Thybusch A, Kremer B, Henne-Bruns D (2000) Differential effects of radical D2-lymphadenectomy and splenectomy in surgically treated gastric cancer patients. Hepato-Gastroenterol 47 (32): 579-585 267. Schmidt-Matthiesen A, Beyer PA (1996) Zuverlässigkeit der intraoperativmakroskopischen Evaluation der Lymphknotenmetastasierung und der Effektivität der Lymphadenektomie beim Magenkarzinom. Zentralbl Chir 121: 121-125 268. Schott A, Vogel I, Krüger U, Kalthoff H, Schreiber H-W, Schmiegel W, HenneBruns D, Kremer B, Juhl H (1998) Isolated tumor cells are frequently detectable in the peritoneal cavity of gastric and colorectal cancer patients and serve as a new prognostic marker. Ann Surg 227: 372-379 269. Schreiber HW, v Ackeren H, Rehner M (1972) Chirurgische Behandlung bösartiger Geschwulstkrankheiten des Magens. Chirurg 43: 551-558 270. Schreiber HW, Eichfuss HP, Farthmann E, Eckert P (1975) Ösophagojejunostomie. Langenbecks Arch Chir 338: 159-167 271. Schreiber HW, Eichfuss H-P, Schumpelick V (1978) Magenersatz. Chirurg 49: 72-80 272. Schreiber HW (1982) Wo steht die Carcinom-Chirugie des Magens 100 Jahre nach der ersten erfolgreichen Magenresektion durch Th. Billroth? Langenbecks Arch Chir 358: 53-55 273. Schuhmacher C, Fink U, Siewert JR (2000) Präoperatives Down-staging beim fortgeschrittenen Magenkarzinom – Wunschdenken oder Realität? Zentralbl Chir 125: 333-340 274. Schumpelick V, Farthmann H, Schreiber HW (1976) Chirurgie des Magens Historisches und Entwicklungstendenzen. Teil 1 Med Welt 27: 2349-2362 275. Schumpelick V, Farthmann H, Schreiber HW (1976) Chirurgie des Magens Historisches und Entwicklungstendenzen. Teil 2 Med Welt 27: 2440-2451 160 276. Schumpelick V, Schreiber HW (1985) Entwicklung der Chirurgie des Magenkarzinoms. In: Bünte H (Hrsg) Aktuelle Therapie des Magenkarzinoms. Springer, Berlin Heidelberg New York, 2. Aufl, S 33-46 277. Schwemmle K (1980) Subtotale oder totale Resektion beim Magenkarzinom: Vertreter des Contra. Therapiewoche 30: 8557-8559 278. Tagliagambe A, Lombardi M, Troiani R (1986) FAP regimen in advanced gastric cancer: our experience. Cancer Chemother Pharmacol 18 (Suppl. 1): A 67 279. Takahashi T, Hagiwara A, Shimotsuma M (1994) Intraperitoneal chemotherapy with mitomycin C bound to activated carbon particles with advanced gastric cancer. Eur J Surg Oncol 20: 183-184 280. Takahashi T, Hagiwara A, Shimotsuma M, Sawai K, Yamaguchi T (1995) Prophylaxis and treatment of peritoneal carcinomatosis: intraperitoneal chemotherapy with mitomycin C bound to activated carbon particles. World J Surg 19: 565-569 281. Troidl H (1981) Chirurgische Therapie beim Magencarcinom MMW 123: 730-736 282. Troidl H; Kusche J, Vestweber K-H; Eypasch E, Maul U (1987) Pouch versus esophagojejunostomy after total gastrectomy: a randomized clinical trial. World J Surg 11: 699-712 283. Turnbull A, Kussin S, Kurtz RC, Bains M (1980) Palliative prosthetic intubation in gastric cancer. J Surg Oncol 15: 37-42 284. Ungeheuer E (1957) Ergebnisse mit der Kardiaresektion und der totalen Magenexstirpation bei 100 Carcinomkranken. Langenbecks Arch Chir 287: 385-388 285. Unger E (1913) Über totale Entfernung des Magens. Dtsch Med Wschr 11: 500-502 286. Villar-Grimalt A, Candel MT, Garcia J, Bernacer B, Jimeno J (1991) Combination of etoposide, adriamycin and cisplatin (EAP) in gastric cancer: association with severe toxicity. Ann Oncol 2: 310-311 161 287. Viste A, Haugstvedt T, Eide GE, Soreide O (1988) Postoperative complications and mortality after surgery for gastric cancer. Ann Surg 207: 7-13 288. Vogl SE, Engstrom PR (1984) Cisplatin, doxorubicin and 5-FU in combination for advanced gastric cancer. Cancer Treat Rep 68: 1273-1275 289. Wagener DJT, Yap SH, Wobbes T (1985) Phase II trial of 5-fluorouracil, adriamycin and cisplatin (FAP) in advanced gastric cancer. Cancer Chemother Pharmacol 15: 86-87 290. Wagner PK, Ramaswamy A, Sitter H, Rüschoff J, Schmitz-Moormann P (1990) Normalwert der Lymphknotenzahl im Oberbauch - Eine anatomische Studie zur Lymphadenektomie beim Magencarcinom. Chirurg 61: 286-288 291. Wechsler JG, Wenzel H, Splitt S, Swobodnik W, Ditschneit H (1989) Diätetische Grundsätze nach Gastrektomie. Dtsch Med Wsch 114: 142-144 292. White RR, Mackie JA, Fitts WT (1975) An analysis of twenty years’ experience with operations for carcinoma of the stomach. Ann Surg 181: 611-614 293. Wilke H, Preusser P, Fink U, Achterrath W, Meyer H-J et al. (1990) New developments in the treatment of gastric carcinoma. Sem Oncol 17: 61-70 294. Witzel O (1891) Zur Technik der Magenfistelanlegung. Zentralbl Chir 32: 601-604 295. Wölfler A (1881) Gastro-Enterostomie. Zentralbl Chir 8: 705-708 296. Wölfler A (1896): Über Magen-Darmchirurgie. ZentralblChir 23: 76-95 297. Wooley PV, Smith F, Estevez R (1981) A phase II trial of 5-FU, adriamycin and cisplatin (FAP) in advanced gastric cancer. Proc Am Soc Clin Oncol 22: 455-460 298. Yan C, Brooks JR (1985) Surgical Management of Gastric Adenocarcinoma. Am J Surg 149: 771-774 299. Zerssen v D (1971) Die Beschwerden-Liste als Test. Therapiewoche 21: 1908-1914 162 Lebenslauf Persönliche Daten: Name: Birte Vogel Geburtsdatum: 27.09.1969 Geburtsort: Simmern Eltern: Vater: Klaus Vogel Mutter: Ute Vogel, geb. Wietfeld Schulausbildung: 1775 – 1980: Hans – Thoma – Grundschule, Heddesheim 1980 – 1983: Internationale Schule – Deutsche Abteilung, S.H.A.P.E., Belgien 1983 – 1989: Staatliches Gymnasium, Bad Bergzabern Mai 1989: Abitur Berufsausbildung: 1989 – 1991: Ausbildung zur Krankengymnastin an der staatlich anerkannten Lehranstalt für Krankengymnastik am Kreiskrankenhaus Detmold 1991 – 1992: Anerkennungsjahr am Malteser Krankenhaus, Bonn 1992 – 1993: Tätigkeit als Krankengymnastin am St. Elisabeth Krankenhaus, Bonn 163 Hochschulausbildung: April 1993: Aufnahme des Studiums der Humanmedizin an der Rheinischen Friedrich–Wilhelms–Universität, Bonn April 1995: Ärztliche Vorprüfung Fortsetzen des Studiums an der WestfälischenWilhelms-Universität, Münster April 1996: Erster Abschnitt der ärztlichen Prüfung September 1998: Zweiter Abschnitt der ärztlichen Prüfung Dezember 1999: Dritter Abschnitt der ärztlichen Prüfung Ärztliche Tätigkeit: Januar 2000 – Juli 2001: Ärztin im Praktikum, Städtische Kliniken Bielefeld–Mitte, Abteilung für Unfallchirurgie 1. Juli 2001 Approbation Juli 2001 – heute: Assistenzärztin, Paracelsus–Klinik derStadt Marl, Abteilung für Orthopädie 164