Lipopeptid-Antibiotika
Werbung

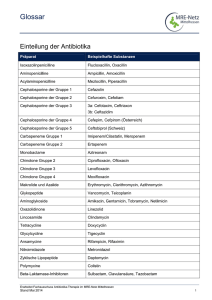
Allgemeine Pharmakologie Antibiotika Therapie der Infektionskrankheiten: Geschichte • Salvarsan: Paul Ehrlich (1909) • Penicillin G: Alexander Fleming (ab 1928) - therap. Anwendung: Florey und Chain (ab 1939) P. Ehrlich 1854-1915 A. Fleming 1881-1955 Therapie der Infektionskrankheiten: Geschichte • Sulfonamide: Gerhard Domagk (Prontosil, 1935) • Streptomycin: Salomon Abraham Waksman (1944) • erstes Oralpenicillin (1952) • Tetrazyklin, Erythromycin (1950er) • Cephalosporine: Guiseppe Brotzú (1960er) • >50 Aminopenicilline & Cephalosporine (1970er) GJP. Domagk 1895-1964 1985 Carbapeneme 1983 Fluorchinolone Angriffspunkte von Antibiotika bei Bakterien Bacitracin, Cycloserin Daptomycin: Lipopeptid-Antibiotikum (Tuberkulosebehandlung) (Linezolid) Bindung an 30SUntereinheit Wirkungstypen von Antibiotika: Bakteriostase: (reversible) Hemmung der Bakterienvermehrung MHK: minimale Hemmkonzentration Bakterizidie: Keimabtötung MBK: minimale bakterizide Konzentration Wirkungstypen von Antibiotika: Zellwandsynthese: ß-Lactamantibiotika Glykopeptide bakterizid + bakteriolytisch bakterizid Proteinsynthese: Aminoglykoside Sulfonamide Tetrazykline Macrolide Lincosamide bakterizid bakteriostatisch bakteriostatisch bakteriostatisch bakteriostatisch Nucleinsäuresynthese bzw. -integrität: Gyrasehemmer bakterizid Nitroimidazole bakterizid Antibiotika-Wirkspektrum Schmalspektrum-Antibiotika: → nur wirksam gegen wenige Erreger → gezielte Therapie (z.B. nach mikrobiol. Diagnostik) Bsp.: Penicillin G gegen Streptokokken Breitspektrum-Antibiotika: → gegen diverse Bakterienspezies → kalkulierte Initial-Therapie (Blindtherapie) Bsp.: Piperacillin bei Atemwegsinfekten Kombinationen bei lebensbedrohlichen Infekten Resistenz: MHK höher als die höchste erreichbare (und nicht toxische) Serum- bzw. Gewebekonzentration des Antibiotikums • natürliche Resistenz: „Lücke im Wirkspektrum“ • mutationsbedingte Resistenz: • spontan: vor der der Therapie erworbene Resistenz • sekundär: während der Therapie erworbene Resistenz (Transposons, Plasmide) Antibiotikaresistenz: Mechanismen • Veränderung Bakterium der Zielstruktur des AB im • Verringerung der Konzentration des AB im Bakterium (Vermindertes Eindringen durch z.B. modifizierte Porine, Efflux-Pumpen) • Inaktivierung des AB Antibiotikaresistenz: Mechanismen PBP2a: geringe Bindungsaffinität Inaktivierung reduzierte Zellwandpermeabilität Inaktivierung des Antibiotikums Zeitliche Entwicklung der Resistenzlage Verbrauch von Makroliden u. vgl. Substanzen Antibakterielle Chemotherapie •Auswahl der Substanz nach Art der Infektion, vermutetes Erregerspektrum, Antibiogramm •Kritische Indikationsstellung, keine Routine-Anwendung, strenge Indikation bei Reserve-Antibiotika und Breitspektrum-Antibiotika! •Richtige Dosis und Dauer einhalten! Gefahr des Überlebens weniger empfindlicher Keime, Reinfektion, Resistenzentwicklung! Behandlung auch nach Abklingen der akuten Symptome fortführen! Hauptangriffspunkte von Antibiotika Zellwandsynthese: ß-Lactame Fosfomycin Cycloserin Bacitracin Glykopeptide Zellwand Zytoplasmamembran Proteinsynthese: Aminoglykoside Tetrazykline Macrolide Lincosamide RNA Protein Nucleinsäuresynthese bzw. -integrität: Gyrasehemmer Nitroimidazole DNA β-Lactam-Antibiotika Penicilline Cephalosporine Carbapeneme Monobactame Cephamycine Aufbau der Bakterienzellwand Murein PBP1 A B, 2, 3: Transpeptidasen PBP4, 5, 6: Carboxypeptidasen Mureinaufbau: Wirkmechanismus der β-Lactame D-Ala Lys D-Ala Lys Transpeptidase β−Lactame: Penicilline 6-Aminopenicillansäure Penicillin D-Ala-D-Ala Penicillin bindet an die Transpeptidase und blockiert sie irreversibel durch eine kovalente Reaktion Penicillin G: Bakterizidie, Lyse Wirkungslos bei Zellwandlosen Keimen! (Mykoplasmen) ! Penicilline – Schmalspektrum-P. Säurestabilität Benzylpenicilline - Penicillin G - Depotpenicilline Phenoxypenicilline - Penicillin V - Propicillin Isoxazolylpenicilline - Oxacillin - Dicloxacillin - Flucloxacillin nein Penicillinasestabilität nein Wirkspektrum Gr+ Kokken und Stäbchen (Streptokokken, Pneumokokken, Bacillus anthracis, Corynebacterium) Gr- Kokken (Gono-, Meningokokken) Spirochäten (Treponema, Borelia) Gr- Anaerobier (Clostridien) ja nein wie Benzylp. ja ja wie Benzylp. (<10% Wirkstärke) Staphylokokken (nicht MRSA) Penicilline – Breitspektrum-P. Säurestabilität Aminopenicilline - Ampicillin (i.v.) - Amoxycillin - Bacampicillin Penicillinase- Wirkspektrum stabilität ja nein wie Benzylp. nur schwächer Enterokokken Gr- Stäbchen (E. coli, Haemophilus) Acylaminopenicilline - Azlocillin - Mezlocillin - Piperacillin nein wie Benzylp. nur schwächer erweiterter GramBereich nein (Pseudomonas, Klebsiella) Penicilline + ß-Lactamaseinhibitoren + Amoxycillin = Augmentan® Ampicillin + = Unacid® Piperacillin = Tazobac® + Penicilline - Pharmakokinetik BHS wichtige Barriere Penicillin G: säurelabil - parenteral Penicillin V: säurestabil - oral Aminopenicilline: oral wirkungslos bei intrazellulären Keimen! (z.B. Chlamydien) Aminopenicilline auch biliär Penicilline - Nebenwirkungen sehr große therapeutische Breite Allergie (1-10 % !) Anaphylaxie (0,05%, in 10% letal) Exanthem Vaskulitis Darmflora ↓ Durchfälle, Pseudom. Kolitis Vitamin K-Mangel (*) Pseudoallergie Exanthem, Neutro, Granulopenie, Schüttelfrost, Myalgie („drug fever“) Neurotoxizität Krampfanfälle (intrathekale Gabe, Meningitis, Epilepsie, Niereninsuff.) (*) Beeinträchtigung Vit. K-produzierender Darmkeime Cephalosporine - Grundgerüst Störung der Mureinsäuresynthese und damit der Bakterienzellwandsynthese →Wirkung nur auf proliferierende Keime → bakterizide Wirkung Verteilung: im Extrazellulä Extrazellulärraum, Elimination überwiegend renal, renal, Ausnahme: Ceftriaxon 40% biliä biliär b a a: Dihydrothiazinring b: β-Lactamring . Cephalosporine (i.v.) Wirkspektrum Basiscephalosporine Cefazolin (nur Staph. Penicillase-stabil) Übergangscephalosporine Cefuroxim u.a. Anaerobiercephalosporine Cefoxitin Breitspektrumcephalosporine Cefotaxim, Ceftriaxon (stabil gegenüber zahlreichen βLactamasen) PseudomonasPseudomonas-Cephalosporine Ceftazidim Gram- Gram+ Oral-Cephalosporine: Anwendung Wirkspektrum Gruppe 1 - Cefalexin Gruppe 2 - Cefachlor - Cefadroxil 3. Generation - Cefuroxim-Axetil - Cefpodoxim-Proxetil - Cefixim - Cefibuten Atemwege, Haut/Weichteile, HNO-Bereich, Harnwege w.o., dazu versch. SpezialIndikationen gr+ gr- β-Lactame: Cephalosporine 1. CefazolinCefazolin-Gruppe (BasisBasis-Cephalosporine) Cephalosporine) 2. CefuroximCefuroxim-Gruppe (IntermediärIntermediär-Cephalosporine) Cephalosporine) 3. CefoxitinCefoxitin-Gruppe (Cephamycine, Cephamycine, AnaerobierAnaerobier-wirksam) wirksam) 4. CefotaximCefotaxim-Gruppe (BreitspektrumBreitspektrum-Cephalosporine) Cephalosporine) 5. CeftazidimCeftazidim-Gruppe (PseudomonasPseudomonas-Cephalosporine) Cephalosporine) 6. CefalexinCefalexin-Gruppe (klassische Oralcephalosporine) Oralcephalosporine) 7. CefiximCefixim-Gruppe (Oralcephalosporine mit erweitertem Spektrum) Cephalosporine – Nebenwirkungen • große therapeutische Breite MRSA, intrazelluläre Erreger) (nicht: Enterokokken. • Allergien, Kreuzallergie Penicilline/Cephalosporine 5% • Diarroe (Oralceph.: nur selten pseudomembranöse Kolitis) • Alkoholintoleranz Hautrötung (Antabus): Übelkeit, Erbrechen, • Gerinnungsstörung (Vitamin K-Antagonismus) Hauptangriffspunkte von Antibiotika Zellwandsynthese: ß-Lactame Fosfomycin Cycloserin Bacitracin Glykopeptide Proteinsynthese: Aminoglykoside Tetrazykline Macrolide Lincosamide Nucleinsäuresynthese bzw. -integrität: Gyrasehemmer Nitroimidazole Zellwand Zytoplasmamembran RNA Protein DNA Angriffspunkt Zellwandsynthese Fosfomycin • breites Wirkspektrum: v.a. gram positive Keime • sehr gute Gewebegängigkeit • Staphyloccocus aureus Infektionen: bei schwer erreichbarem Infektionsherd (z.B. Osteomyelitis) bei multiresistenten Erregern bei β-Lactam-Allergie • UAWs: Exantheme, Kopfschmerzen, Leberenzymerhöhung Cycloserin •wasserlöslich, aber sehr pH-labil •wirksam gegen gr+ und gr—Keime •I: Tuberkulosestämme, die gegen Mittel der 1. Wahl resistent sind •UAWs: ZNS: Kopfschmerzen, Tremor, Psychosen und Krämpfe Bacitracin •Cyclisches Peptid aus Bacillus subtilis •Aktiv gegen gr+-Keime •Lokale Anwendung in Gelenken, offenen Wunden und in der Pleurahöhle •UAWs: Nephrotoxisch Glykopeptide (Vancomycin, Teicoplanin) Gly Lys D-Ala Bindung an D-ALA-D-ALA verhindert Quervernetzung Vancomycin Glykopeptide (Vancomycin, Teicoplanin) RESERVEANTIBIOTIKA! • keine orale Resorption (für systemische Therapie parenterale Gabe erforderlich) • orale (=lokale) Therapie der pseudomembranösen Colitis (Clostridium difficile) • systemische Therapie: multi-resistente gr+ Erreger (MRSA, Amp.-resistente Enterokokken) Nebenwirkungen • Nephrotoxizität, Ototoxizität • Allergie, Histaminfreisetzung • Blutruckabfall • Phlebitis (Entzündung venöser Gefäße) bei i.v.-Gabe Wirkort Zellmembran:Lipopeptid-Antibiotika Daptomycin •aerobe und anaerobe gr+ Erreger, einschließlich Staphylococcus aureus, MRSA, Peptostreptococcen, Clostridien •i.v.: nach oraler Gabe keine ausreichende Resorption •Ausscheidung: renal •Ind.: komplizierte Erwachsenen Haut- und Weichgewebeinfektionen Lipopeptid-Antibiotika: Daptomycin Wirkmechanismus: •Eindringen mit Lipidkette in Membran •Oligomerisation •Ausbildung von Transmembran-Poren/Kanäle •Ausstrom von K+ •Depolarisation und Zelltod bei Hauptangriffspunkte Antibiotika: Zellwandsynthese: ß-Lactamantibiotika Glykopeptide u.a. Zellwand Zytoplasmamembran Proteinsynthese: Aminoglykoside Tetrazykline Macrolide Lincosamide Nucleinsäuresynthese bzw. -integrität: Gyrasehemmer Nitroimidazole RNA Protein DNA Antibiotika: Interferenz mit Translation 30S UE 50S UE