Die verschiedenen Augentypen
Werbung

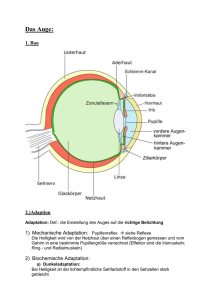
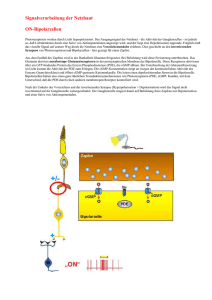
DIE VERSCHIEDENEN AUGENTYPEN Truden Christian 6c BRG-Viktring Klagenfurt/ Viktring, 2005 Klagenfurt/ Viktring, am 20. November 2005 Vorwort Mit der folgenden Arbeit möchte ich Ihnen die verschiedensten, unbekannten Augentypen und die Funktionsweiße eines Photorezeptors näher bringen. Wer etwas über das menschliche Auge wissen möchte, der wird gebeten sich im Lehrbuch der 6. Klasse ab Seite 40 darüber zu informieren. Wer etwas über das fast allgemein bekannte Komplexauge wissen möchte, der soll sich selbst informieren oder für immer schweigen. Da dort jedoch immer nur von Photorezeptoren, Stäbchen und Zapfen gesprochen wird, habe ich es mir zur Aufgabe gemacht deren Funktionsweise genauesten zu erklären. Da diese Arbeit einige äußerst komplizierte Themen beinhaltet, habe ich mich bemüht und versucht es möglichst einfach und verständlich aufzubereiten. Jedoch war dies nicht immer möglich. Deshalb bitte ich Sie, werte Leser, dieser Arbeit bei Verständnisproblemen nicht gleich zu kapitulieren, sondern denn Text mehrmals zu lesen. Anhand der zahlreichen bildlichen Erklärungen müsste es jedoch für jedermann verständlich sein. Fachbegriffe sind im Anhang erklärt und um Ihnen die Arbeit zu erleichtern, diese zu suchen, habe ich sie für sie verknüpft. Truden Christian Seite 2 INHALTSVERZEICHNIS 1 EINLEITUNG: DIE BEDEUTUNG DES OPTISCHEN SINNES ....................... 5 2 EINZELNE PHOTOREZEPTOREN ................................................................. 6 3 DAS FLACHAUGE .......................................................................................... 7 4 PIGMENTBECHEROCHELLEN(BECHERAUGE) .......................................... 8 4.1 Das einfache Becherauge ................................................................................ 8 4.2 Das zusammengesetzte Becherauge .............................................................. 8 5 DAS GRUBENAUGE..................................................................................... 10 6 DAS LOCHKAMERAAUGE .......................................................................... 11 7 DAS BLASENAUGE ..................................................................................... 12 8 AUFBAU UND FUNKTIONSWEIßE EINES PHOTOREZEPTORS .............. 13 8.1 Aufbau eines Photorezeptors ......................................................................... 13 8.1.1 Stäbchen(Scharz- Weiß- Sehen) ................................................................... 13 8.1.2 Zapfen(Farbsehen) ........................................................................................ 13 8.1.3 Membranen des Außensegments(Bei Stäbchen) .......................................... 14 8.2 Die Photo- chemische Transduktion .............................................................. 14 8.3 Zyklen eines Photorezeptors.......................................................................... 14 8.3.1 Der Reaktionzyklus von G-Proteinen ............................................................. 14 8.3.2 Die Funktion von Calcium bei der Erholung eines Photorezeptors ................ 15 Seite 3 8.3.3 Der Rhopsin- Zyklus....................................................................................... 16 8.4 Der Aufbau von Rhodopsin ............................................................................ 17 8.4.1 Aufbau eins Rhodopsinmoleküls .................................................................... 17 8.4.2 Die Isomerisierung des Retinals .................................................................... 18 9 ANHANG ....................................................................................................... 19 9.1 Erklärung der Fachbegriffe............................................................................. 19 9.2 Aufbau der Arbeit ........................................................................................... 21 9.3 Äußere Gestaltung ......................................................................................... 21 10 QUELLEN ...................................................................................................... 22 11 ABBILDUNGEN ............................................................................................ 25 Seite 4 1 EINLEITUNG: DIE BEDEUTUNG DES OPTISCHEN SINNES Der optische Sinn ist für den Menschen von besonders großer Bedeutung. Er ermöglicht eine sichere Orientierung und nimmt somit die Funktion des Leitsinnes ein. Schließt man die Augen, so verliert man die sichere Orientierung. Doch die Augen alleine ermöglichen keine räumliche Wahrnehmung, denn das Gehirn nutzt besonders in Zweifelsfällen auch andere Informationsquellen um die Umwelt dreidimensional zu rekonstruieren. Die verfügbaren Informationen werden kombiniert, dabei werden die verschiedenen Sinnesreize nach ihrer Verlässlichkeit gewichtet. So tragen die verschiedenen Sinne verschieden stark zur Rekonstruktion der Umwelt bei. Das beweisen Forschungen des Tübingers Max- Planck. Instituts für Kybernetik gemeinsam mit Forschen der University of California mit dem Ergebnis, dass manuelles Abtasten die visuelle Wahrnehmung gezielt und nachhaltig beeinflussen kann. Das räumliche Sehen kann weiters auf das Gehirn zurückgeführt werden, da es die verschiedenen zweidimensionalen Netzhaut- Bilder der beiden Augen kombiniert und vergleicht und erst somit das räumliche Sehen ermöglicht. Seite 5 2 EINZELNE PHOTOREZEPTOREN Einzelne Photorezeptoren dienen vielen Wirbellosen wie Ringelwürmer, Hohltiere, Muschel und Seesternen zur Lichtwahrnehmung. Die Lichtsinneszellen liegen dabei verstreut über die gesamte Körperoberfläche oder an exponierten Körperteilen. Über Nervenfortsätze sind diese Sinneszellen mit dem Nervensystem verbunden, somit werden die Reize zu übergeordneten Zentren geleitet, dort werden sie ausgewertet und verarbeitet. Dies ermöglicht ein Hell- Dunkelsehen und ein grobes Richtungssehen. Seite 6 3 DAS FLACHAUGE Bei Flachaugen auch Plattenaugen genannt, treten die Lichtsinneszellen bereits in Gruppen auf und kommen z.B. bei Quallen vor. Diese Augenform reagiert auf Licht mit unterschiedlicher Wellenlänge und Intensität. Es besteht aus einer Reihe aus dem Licht zugewandten Sehzellen, die von Photorezeptoren umgeben sind. Das Licht trifft direkt auf die lichtempfindlichen Bereiche der Sehzellen auf(evers). Das Flachauge ist leicht gewölbt. Dadurch wird nicht nur ein Hell- Dunkelsehen ermöglicht sondern auch ein eingeschränktes Richtungssehen. Dieses Richtungssehen ist soweit eingeschränkt, dass flach einfallendes Licht nicht richtig erkannt wird, da zum Beispiel Licht, das flach von links einfällt die linken Sehzellen nicht bestrahlt, die rechten Sehzellen dagegen schon. Seite 7 4 PIGMENTBECHEROCHELLEN(BECHERAUGE) Eine weitere Verbesserung des Richtungsehens stellt das Becherauge (oder Pigmentbecherocellen) dar. Man unterscheidet zwei Typen, nämlich das einfache Becherauge und das zusammengesetzte Becherauge. 4.1 Das einfache Becherauge Das einfache Becherauge wird von verschiedenen Lebewesen wie dem Lanzettenfisch oder einigen Strudelwürmern (z.B der negativ photoaktische Strudelwurm) zur Wahrnehmung optischer Reize genutzt. Eine Lichtsinneszelle wird von einer lichtabsorbierenden Pigmentzelle siehe Pigment), dem Pigmenbecher;. halbkreisförmig umgeben, dieser ist nur nach einer Seite offen. Nur Licht, das durch die Becheröffnung fällt, erregt die Sinneszelle. Durch diese Bauweise wird jeder Rezeptor zu einem „Spezialisten“ für eine bestimmte Richtung. Je mehr solcher Pigmentbecheraugen in verschiedener Öffnungsrichtung vorhanden sind desto genauer kann die Richtung des Lichts festgestellt werden. Weiters wird die Sehleistung durch die neurale (siehe neural) Verrechnung der Erregung der verschiedenen Becheraugen verbessert. Das bedeutet, dass die Informationen der verschiedenen Pigmentcherochellen komplex vom Gehirn verrechnet werden Dadurch entsteht ein verbessertes Richtungssehen. 4.2 Das zusammengesetzte Becherauge Diese Form des Bechrauges wird von Blutegeln sowie von bestimmten Strudelwürmern genutzt. Dierbei handelt es sich um mehrere Lichtsinneszellen, die von einem absorbierenden Pigmentepithel (nicht durchsichtige Schicht) becherartig umgeben. Das Licht, das durch die Becheröffnung einfällt, erzeugt von der Einfallsrichtung abhängiges spezifisches Erregungsmuster der Sinneszellen. Dies Seite 8 ermöglicht mit nur einem Becherauge ein gutes Richtungssehen zu erreichen und somit mit nur einem Sinnesorgan die Lichtquelle zu lokalisieren. Seite 9 5 DAS GRUBENAUGE Das Gruben- oder auch Napfauge ist die nächste Entwicklungsstufe nach dem Becherauge. Es kommt bei der Napfschnecke vor. Bei diesem Augentyp ist eine grubenförmige Sehzellenschicht körperwärts durch lichtundurchlässige Pigmente abgeschirmt. Das Ganze ist grubenförmig nach oben gewölbt (evers). Die Pigmente können entweder ein Bestandteil der Sehzellenschicht sein oder ein eigenes Epithel bilden. Die Zellen in der Grube sind durch einen Sekretpolster geschützt. Die Grube beschränkt den Lichteinfall ähnlich wie ein Pigmentbecher. Das einfallende Licht erregt immer eine Gruppe von Sinneszellen. Es wird aber kein differenziertes Erregungsmuster erzeugt. Somit ist ein gutes Richtungssehen, sowie ein Bewegungssehen und ein Hell- Dunkelsehen möglich, aber kein Bildsehen möglich. Seite 10 6 DAS LOCHKAMERAAUGE Das Lochkamera Auge oder auch Lochauge genannt, ist eine Weiterentwicklung des Grubenauges. Es kommt beim Nautilus vor. Es ist stärker gewölbt als das Grubenauge. Es bildet eine Blase, die nur noch ein kleines Sehloch besitzt, dieses funktioniert als Blende. Die Blase ist mit einem Netz (Sehepithel), einem Epithel aus Lichtsinneszellen und Pigmentzellen) ausgestattet. Es entsteht ein lichtschwaches, kleines, umgekehrtes Bild auf der Netzhaut. Je mehr Sinneszellen erregt werden desto schärfer ist das Bild. Ein Gegenstand kann deswegen auf der Netzhaut abgebildet werden, weil das von einem benachbarten Punkt des Gegenstands ausgehende Licht auch die entsprechende benachbarte Lichtsinneszelle erregt. Außerdem kann die Menge der erregten Lichtsinneszellen mit dem Abstand zwischen Sehloch und Gegenstand korreliert (siehe Korrelation) werden. Dadurch kann bereits ein schlechtes Entfernungssehen gewährleistet werden. Weiters ist zu bemerken: je kleiner das Sehloch desto schärfer Seite 11 7 DAS BLASENAUGE Das Blasenauge kommt bei Hohltieren, Schnecken und Ringelwürmern vor. Es arbeitet nach dem selbem Prinzip wie das Lochkameraauge. Jedoch ist ein besseres Entfernungssehen gewährleistet. Es besteht aus einer blasenartigen Einstülpung der Oberhaut (Epidermis), ausgekleidet mit einem Pigmentepithel und einer Sehzellenschicht. Abhängig vom Durchmesser der Sehöffnung ist ein lichstarkes aber unscharfes Bild oder ein scharfes aber lichtschwaches Bildsehen möglich. Bei manchen Schnecken wird eine Verbesserung erreicht indem der Hohlraum in der Augenblase mit einem glaskörperähnlichen, lichtdurchlässigen Sekret ausgefühlt wird. Dem Sekret kommt eine Art Linsenfunktion zu, jedoch ist die Wirkung begrenzt. Grund dafür ist, dass das Sekret nicht akkommodieren (siehe Akkommodation) kann. Das heißt, dass das Sekret sich nicht aktiv bewegen, wölben oder verändern kann. Seite 12 8 AUFBAU UND FUNKTIONSWEIßE EINES PHOTOREZEPTORS 8.1 Aufbau eines Photorezeptors Photorezeptoren existieren als Stäbchen- und Zapfen. Stäbchen ermögliche Schwarz- weiß- Sehen, Zapfen das Farbsehen. Das menschliche Auge erkennt Wellenlängen von 300nm (Nanometer, 10-9) bis 780nm (Apsorptionmaximum des Pigments). 8.1.1 Stäbchen(Scharz- Weiß- Sehen) (siehe Abbildung1) Der lichtempfindliche Teil der Stäbchen, das sogenannte Außensegment, enthält ein dickgepacktes Membransystem, es dient zur Vergrößerung der lichtempfindlichen Oberfläche, dieser Teil eines Photorezeptors werden Disks genannt. Die einzelnen Disks sind durch die Plasmamembran getrennt. In den Disks ist das lichtempfindliche Pigment Rhodopsin enthalten. Im Innensegment befinden sich der Kern und die Mitochondrien, hier findet die Proteinsyntese und der Energiestoffwechsel statt. Die Synapse enthält Glutamat hältige Vesikel, diese enthalten einen Neurotransmitter, welcher ausgeschüttet wird wenn das Membranpotenzial depolarisiert wird. Der Neurotransmitter überträgt dann das Signal an die nachgeschlatete Zelle. Bei Stäbchen wird eine sehr hohe Lichtempfindlichkeit festgestellt, dies ermöglicht Sehen bei sehr wenig Licht. Das Absorptionsmaximum des Rhodopsins bei Stäbchen liegt bei 500nm. 8.1.2 Zapfen(Farbsehen) (siehe Abbildung1) Bei Photorezeptoren mit Zapfen- Bauweise sind die Disk durch die Plasmamembran nicht getrennt, jedoch sind die Disks durch Einfaltung der Plasmamembran entstanden. Es gibt drei verschiedene Arten von Zapfen, nämlich für das Sehen von rot, blau und grün. Sie unterscheiden sich durch ihre unterschiedlichen Pigmente (Zapfenopsine). Die Lichtempfindlichkeit bei Zapfen beträgt nur rund ein Zwanzigstel (1/20) der Lichtempfindlichkeit der Stäbchen. Die Absorptionsmaxima liegen bei 420nm bei der Farbe blau, 540nm bei der Farbe grün und 700nm bei der Farbe rot. Seite 13 8.1.3 Membranen des Außensegments(Bei Stäbchen) Auf der nebenstehenden Abbildung (siehe Abbildung2) ist der Längsschnitt eines Außensegments eines Stäbchens zu sehen. Man sieht ganz außen die Plasmamembran und die davon isolierte Membran der Disks. Der Abstand der Disks zur Plasmamembran beträgt ungefähr 50 nm. Das Pigment Rhodopsin in die Membran der Disk eingebaut und zwar mit einer extremen Dichte von an die 30.000 pro m2(m= Mikrometer 10-6). Auf Grund der hohen Dichte wird ein Photon entlang der Längsachse des Außensegments bewegt, wahrscheinlich trifft es auf ein Rhodopsinmolekül. Dies ist Voraussetzung für die Fähigkeit des Auges einzelne Photonen wahrzunehmen. Beim Menschen befinden sich ungefähr 800 Disks in einem Außensegment. 8.2 Die Photo- chemische Transduktion (siehe Abbildung3) Ein Photon hat eine Welleneigenschaft, diese Welleneigenschaft liefert das Lichtsignal. Wird das Photon durch Rhodopsin absorbiert, wird das Lichtsignal als erstes in chemische Infromation umgewandelt. Das Photon wird durch Retinal absorbiert, dies ist der Chromophor des Rhodopsinmoleküls. Als Chromophor versteht man den Teil eines Farbstoffes (Pigment) in dem anregbare Elektronen verfügbar. Ein Chromphor ist der Grund weshalb ein Farbstoff überhaupt eine Farbe hat, denn es wirkt als eine Art Indikator. Eine durch eine chemische Reaktion zweier Stoffe eingeleitete Isomerisierung (Umlagerung von chemischen Verbindungen) wird durch Rhodopsin(Rho) das GTPbindende Protein „Transducin“ aktiviert. Es besteht aus drei Untereinheiten, nähmlich α, β und γ. Beim Aktivieren des Transducin trennt sich die GTP- bindende Untereinheit α vom βγ- Komplex. Dies aktiviert das Enzym „Phosphodiesterase“ (PDE). PDE spaltet den zellurären Botenstoff der Phototransduktion „cGMP“ (second messenger) unter Anlagerung eines Wassermoleküls. Die Folge ist der Abfall der cGMP- Konzentration im Außensegment. Dies ist die erste Folge der Belichtung eines Photorezeptors. Die Aktivierung eines Rhodopsinmoleküls kann zur Aktivierung von 3000 PDEMolekülen führen. Jedes PDE- Molekül kann wiederrum bis zu 2000 cGMP Moleküke spalten. Dadurch entsteht theoretisch ein Vertstärkungsgrad von 6 Millionen cGMP pro Photon. 8.3 Zyklen eines Photorezeptors 8.3.1 Der Reaktionzyklus von G-Proteinen (siehe Abbildung4) Seite 14 Ein Rezeptor wird durch einen Reiz stimuliert, das können Licht, Hormone oder Transmitter sein. Der aktivierte Rezeptor aktiviert ein GTP- bindendes Protein(z.B. Trandsducin). Dieses Protein besteht aus den drei Untereinheiten(α, β, γ). GTP-α-Untereinheiten können beispielsweise die Adenylylcyclase(Enzyme, die an die Zellmembran gebunden sind. Sie entsprechen der Klasse der Lyasen) aktivieren oder hemmen, Phospholipasen und Proteinkinasen (Enzyme, die den Transfer einer Phosphatgruppe von einem Donor (meist ATP) auf einen Aminosäurerest von Proteinen katalysiert aktivieren) oder Ionenkanäle modulieren. Die βγ-Untereinheit kann bei der Aktivierung von Second messengern (z.B. cGMP) von Bedeutung sein; manche Effektoren, wie beispielsweise bestimmte Ionenkanäle, werden direkt von βγ-Untereinheiten reguliert. Das GTP- bindende Protein hat im Ruhezustand(nicht aktiviert) GDP gebunden. Wird nun das GTP- bindende Protein an den aktivierten Rezeptor gebunden, erfolgt ein Austausch des GDP gegen energiereiches GTP. Die Gegenwart von Mg2+ löst eine Änderung der räumlichen Anordnung (Konformation) des GTP- Proteins aus. Dadurch wird das GTP- Protein aktiviert und teilt sich in seine Untereinheiten. Es entsteht ein α- Komplex und ein βγ- Komplex. Beide Teile können die Aktivität der Zielproteine, den Effektoren steuern und regulieren. Kurze Zeit später hydrolysiert (siehe Hydrolyse) die α- Einheit das gebundene GTP zu GDP und anorganischem Pospaht (Pi). Das α- GDP bindet den βγ- Komplex. Damit ist das GDP (G- Protein) Protein wieder inaktiv. Nun kann der Zyklus wieder wiederholt werden und von vorne neue beginnen. Dank diesem Zyklus werden Signale von Außen in das Zellinnere geleitet um dort biochemische Reaktionen einzuleiten. 8.3.2 Die Funktion Photorezeptors von Calcium bei der Erholung eines (siehe Abbildung5) 8.3.2.1 Der cGMP- Zyklus Die Konzentration von cGMP im Außensegment wird durch die Balance aus Synthese und Hydrolyse bestimmt. Die cGMP- Synthese durch das Enzym Guanylylzyklase(kurz GC) wird vom Regulator Protein GCAP (guanylyl cyclase activating protein) kontrolliert. Das GCAPProtein aktiviert das GC- Enzym nur unter der Voraussetzung, dass die Ca2+Konzentration niedrig ist. Somit unterliegt die Synthese von cGMP der Ca 2+Konzentration im Außensegment. DAS cGMP wird durch Phosphodiestersase(PDE), die bei der Belichtung von Rhodopsin und Transducin aktiviert wird Seite 15 8.3.2.2 Der Calcium- Zyklus Die Ca2+- Konzentration im Außensegment hängt hauptsächlich von der Aktivität der von cGMP- gesteuerten Kanäle. Die Aktivität der Kanäle wird von der cGMPKonzentration gesteuert. Ist es nun Dunkel sind die Kanäle aktiv und leiten Ca 2+ in die Zelle, es wird eine relativ hohe Ca2+- Konzentration von ca. 400nM aufrechterhalten. Diese hohe Ca 2+Konzentration reicht aus um das GCAP zu hemmen. Dies verhindert die cGMPSynthese. Ein übermäßiger Anstieg der cGMP- Konzentration wird verhindert. Werden die Kanäle durch eine Belichtung des Rezeptors geschlossen, fällt die Ca2+Konzentration auf ungefähr 50nM. Der Grund dafür liegt bei der andauernden Aktivität eines Proteins, dem Austauscher. Der Austauscher koppelt den Einstrom von Na+ an den Ausstrom von Ca2+ und K+. Ist nun die Ca2+- Konzentration wird das GCAP- Protein nicht mehr gehemmt und das GCAP kann das GC- Enzym aktivieren, welches die cGMP- Synthese kontrolliert. Somit wird bei Licht, folglich einer niedrigen Ca 2+- Konzentration, die cGMP- Synthese wieder verstärkt. Man sieht also dass die Konzentration von cGMP und Ca 2+ im Außensegment eng verknüpft sind. Die gegenseitige Kontrolle dieser Signalstoffe, gewährleistet eine stabile und reproduzierbare Funktion der hochempfindlichen Photorezeptoren 8.3.3 Der Rhopsin- Zyklus (siehe Abbildung6) 8.3.3.1 Der Rhodopsin- Zyklus Nach der Aktivierung durch Licht bindet Rhodopsin (R*) sich an Transducin (T) setzt sich die Signalkaskade in Gang. Um die Kaskade wieder abzuschalten wird R* phosphoryliert (siehe Phosphorylierung). Am phosphorylierten C- terminus bindet das Protein Arrestin. Arrestin verhindert, dass noch weitere in der Signalkaskade stehende Tansducinmoleküle T vom Rhodopsin aktiviert werden. Somit wird das aktive R* komplett abgeschalten. Die Signalkaskade kommt zum Stehen. Wird nun all-trans gegen ein 11-cis-Retinal ausgetauscht kann das Rhodopsin wieder auf Licht reagieren. (siehe Isomeriserung von Retinal) 8.3.3.2 Der Transducin-Zyklus Wenn R* an Transducin bindet wird GDP gegen GTP getauscht, das GTP- Protein zerfällt in die Untereinheiten α-GTP und den βγ-Komplex. Das α-GTP bindet eine hemmende Untereinheit (I) der Phosphotdiesterase (PDE). Durch die Spaltung des GTP inaktiviert sich die α-Einheit selbst und bindet den βγ- Komplex. Das GTP kann nun wieder aktiviert werden. Somit kann der Zyklus wieder von vorne beginnen. Seite 16 8.3.3.3 Der PDE-Zyklus Wird die hemmende Untereinheit I durch α-GTP aus der Phosphodiesterase PDE aktiviert. PDE hydrolysiert (siehe Hydrolyse) nun cGMP. Sinkt nun die Konzentration von α-GTP durch die Wiedervereinigung mit dem βγ-Komplex ab, wird ein PDEHemmer (Inhibitor) frei. Dieser PDE- Hemmer hemmt die Aktivität des PDE, es wird inaktiv. Nun kann es durch α-GTP erneut aktiviert werden. 8.4 Der Aufbau von Rhodopsin 8.4.1 Aufbau eins Rhodopsinmoleküls (siehe Abbildung7) Auf der Zeichnung ist ein Raummodel der Faltung eines Rhodopsinmoleküls in der Diskmembran zu sehen. Das Rhodopsinmolekül besteht aus 7 Membranregionen (gelbe Säulen). Der N-terminus liegt im Diskinnenraum. Als N-Terminus bezeichnet man den Anfang eines Proteins. Er besteht aus einer Aminosäure und einer freien Aminogruppe (NH2). Mit dem N-Terminus startet die Proteinbiosynthese am Ribosom. Die Aminogruppe bleibt frei, während die Carboxylgruppe durch eine Peptidbindung an die nächste Aminosäure geknüpft wird. Die freie Aminogruppe gibt dem N-Terminus den Namen. Der C-Terminus liegt im Zytoplasma. Als C-Terminus bezeichnet man das Ende eines Proteins. Der C-Terminus besteht aus einer Aminosäure, welche eine freie Carboxylgruppe (COOH) trägt. Mit dem C-Terminus endet die Proteinbiosynthese. Damit hat das Protein einen unterscheidbaren Anfang und ein Ende. Durch die Peptidbindung, bei der immer eine Carboxylgruppe mit einer Aminogruppe verknüpft wird, bleibt am Anfang eine Aminogruppe und am Ende eine Carboxylgruppe frei. Der Chromphor Retinal ist ein dieser Zeichnung in der 11-cis- Konformation dargestellt(DunkelPosition) Weiters stabilisiert ein Fettsäurerest (Myristoyl, gelb gezeichnet) das Rhodopsin in seiner Membran. Die Phosphorylierungsstellen sind mit P gekenzeichnet, sie haben eine Bedeutung bei der Abschaltung der Transduktion. 8.4.1.1 Unterschiede der verschiedenen Farb-Rhodopsiner Stäbchen absorbieren am besten blaugrünes Licht. Die drei verschiedenen Zapfentypen hingegen teilen sich das sichtbare Spektrum. Dazu dienen drei unterschiedliche Opsinproteine: Blau-, Grün- und Rotopsin. Je nachdem in welchem Opsin das Retinalmolekül eingelagert ist, absorbiert des Retinal im blauen, grünen oder gelb/roten Bereich des Spektrums. Seite 17 8.4.2 Die Isomerisierung des Retinals (siehe Abbildung8) Retinal ist der Chromophor (Anregbare Elektronen eines Farbstoffes) des Rhodopsin. Retinal ist ein abgeleiteter Stoff dessen Struktur ähnlich der Struktur des Vitamin A (Retinol) ist Ist es dunkel, liegt das Retinal als 11-cis- Isomer vor. Bei Absorbierung kommt es zur Umlagerung des Moleküls. Durch eine Drehung der Bindung zwischen dem 11. und 12. Kohlenstoffatoms gelangt das Molekül in die all-trans Konfiguration, diese Konfiguration löst die Aktivierung des Rhodopsins aus. Ist es nun erneut Dunkel, isomerisiert (siehe Isomeriesierung) das all-trans Retinal wieder in die 11-cis-Form zurück. Dabei verbindet es sich mit einem Opsinmolekül (Proteinanteil des Rhodopsin) zu Rhodopsin. Seite 18 9 ANHANG 9.1 Erklärung der Fachbegriffe Akkommodation: Anpassung. Gegenstandsweiten. Einstellung des Auges auf verschiedene aktive Verränderung der Brechkraft. Entweder durch Änderung des Abstands zwischen einer starren Linse und der Netzhaut oder durch eine Änderung der Krümmung einer elastischen Linse Anorganisch: Als anorganisch bezeichnet man chemische Verbindungen, die keinen Kohlenstoff (C) enthalten. Jedoch gelten elementarer Kohlenstoff (C) (als Graphit oder Diamant), Kohlenmonoxid (CO), Kohlendioxid (CO2) sowie die Kohlensäure (H2CO3) und ihre Salze (also Ionenverbindungen mit Karbonat- oder Hydrogenkarbonat- Anion und Kohlenstoffmonoxid- Katiom ebenfalls als anorganisch. Differenzierung(biologisch): Differenzierung nennt man das Entstehen von Unterschieden zwischen ursprünglich gleichartigen Zellen, Geweben oder Organen sowohl in der Individualentwicklung als auch in der Stammesentwicklung. Epithel: Sammelbegriff für Deck- und Drüsengewebe. Ein – oder Mehrschichtig Evers: verkehrt, auf dem Rucken, feindlich, gegen, nach- hinten Hydrolyse: ist die Spaltung einer chemischen Verbindung unter Anlagerung eines Wassermoleküls Inhibition: Hemmung Kaskade: Kette, Verknüpfung Korrelation: Positive Korrelation: je mehr desto mehr, Negativer Korrealtion: je mehr desto weniger Anders als bei er Proportion kann dir Zu- oder Abnahme nur ungefähr prognostiziert werden. z.B: Gibt man einer Kuh die doppelte Menge Futter, so gibt sie 30% mehr Milch. Neural: die Nerven betreffend, von einem Nerv ausgehend Seite 19 Phosphorylierung: Unter Phosphorylierung versteht man in der Biochemie das kovalente Binden einer Phosphatgruppe an einen Aminosäurerest eines Proteins oder eines andern Moleküls, beispielsweise Zuckermoleküle oder Nukleophasen. Die Enzyme, die diese Reaktion katalysieren, heißen Kinasen. Phosphorylierungen haben oft Konformationsänderung des Proteins zur Folge, so dass es zwei verschiedene Formen des Proteins gibt. Je nach Einzelfall kann die Phosphorylierung zur aktivierten oder inaktivierten Form führen bzw. die Dephosphorylierung zur aktivierten oder inaktivierten Form führen. Photon: Einzahl von Photonen: Dies sind die "Bausteine" elektromagnetischer Strahlung, so etwas wie "Lichtteilchen". Allerdings darf dabei nicht vergessen werden, dass alle (Elementar-) Teilchen einschließlich der Photonen auch Welleneigenschaften besitzen. induzieren Reaktion zwischen zwei Stoffen, die nur bei Anwesenheit eines dritten Stoffes (z.B. eines Katalysators) ausgelöst wird. Pigment: Farbstoff im Gewebe von Lebewesen Rhodopsin: ist eine Verbindung des Proteins Opsin und Retinal (Aldehydvon Vitamin A). Es bildet den Sehfarbstoff in der Netzhaut bei Menschen und Tieren in den Photorezeptoren von Evertebraten. Sekret: organische Flüssigkeit, Ausscheidung körpereigener chemischer Stoffe, aus Drüsen Spezifisch: kennzeichnend, arteigen, charakteristisch Synthese: die Vereinigung von zwei oder mehr Elementen (Bestandteilen) zu einer neuen Einheit. Seite 20 9.2 Aufbau der Arbeit 9.3 Äußere Gestaltung Ränder: links: 3 cm rechts: 2 cm oben: 3 cm unten: 3 cm Bundsteg: 0 cm Abstand der Kopfzeile vom Seitenrand: 1,25 cm Abstand der Fußzeile vom Seitenrand: 1,25 cm Zeilenabstand 1,5fach : Schrift: Text: Arial, Schriftgröße 12 Absatz: Text: 6 pt Ausrichtung: Blocksatz mit Silbentrennung Seitenzahl: unten, zentriert, arabische Ziffern (Deckblatt wird mitgezählt, aber nicht numeriert) Umfang: Acht Textseiten. Der Umfang von Anhang und Verzeichnissen ist nicht begrenzt. Seite 21 10 QUELLEN Vorlage für Literaturangaben Internet: http://de.wikipedia.org/wiki/Farbwahrnehmung+absorptionsmaximum+rot&hl=de&cli ent=firefox-a 03.11.2005 http://de.wikipedia.org/wiki/Punktauge 11.10.2005 http://elearning.studmed.unibe.ch/augenheilkunde/systematik/anatomie/pigmentepithel.htm l 07.11.2005 http://virtuelles-praxisnetz.de/index.php/Auge 28.10.2005 http://www.biologie.de/biowiki/Bild:Facettenauge_einer_Libelle_MK1888.png 10.10.2005 http://www.biologie.de/biowiki/Nauplius 04.09.2005 http://www.eurekalert.org/staticrel.php?view=mpg0519 11.10.2005 http://www.farbenlehre.com/rgb-farben/farben.htm 06.11.2005 http://www.faunistik.net/DETINVERT/MORPHOLOGY/LICHTSINNESORGANE/ocel len.html 04.09.2005 http://www.fbv.fh-frankfurt.de/mhwww/CHP/CP1-V5.htm 07.11.2005 http://www.heilpraktikerverband.de/heilv/natur_296.php?sid=&s_von=para 18.10.2005 http://www.merian.fr.bw.schule.de/beck/skripten/12/bs12-33.htm 11.10.2005 http://www.mpg.de/bilderBerichteDokumente/dokumentation/pressemitteilungen/200 0/pri6_00.html 28.10.2005 http://www.sinnesphysiologie.de 09.11.2005 http://www.sinnesphysiologie.de/hvsinne/auge/zopf.htm 05.11.2005 http://www.sinnesphysiologie.de/photor/phorein.htm 10.10.2005 http://www.uni-tuebingen.de/abot/versuche/vers1.html 15.10.2005 http://www.uni-ulm.de/elektronenmikroskopie/page.html 27.09.2005 http://www.vobs.at/bio/physiologie/a-augen.htm 25.09.2005 http://www.wissenschaft-online.de/abo/lexikon/neuro/1090 11.10.2005 http://www.wissenschaftonline.de/sixcms/detail.php?template=d_lex_treffer&sucht_schon=ja&lexikon%5Bbi o%5D=WOLEX0009&_suche=auge&senden.x=0&senden.y=0&qnum=20 08.11.2005 http://www2.inf.fh-rhein-sieg.de/mi/lv/biovis/aktuell/farbmetrik/schmitz/Auge.PDF 28.10.2005 www.bestimmungsbuecher.de/staatsexamen/AUGE.DOC 04.10.2005 www.bestimmungsbuecher.de/staatsexamen/AUGE.DOC 12.11.2005 Seite 22 www.spektrum.de 26.10.2005 Seite 23 Seite 24 11 ABBILDUNGEN Abbildung 1: Seite 25 Seite 26 Abbildung2: Seite 27 Abbildung3: Seite 28 Abbildung4: Seite 29 Abbildung5: Seite 30 Abbildung6: Seite 31 Abbildung7: Dreidimensionale Struktur von Rhodopsin Seite 32