Die Substratspezifität der Enzyme Trypsin und Chymotrypsin
Werbung

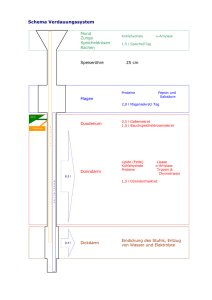
Proteine Anleitung nach R. Deuber, Kantonsschule Baden Die Substratspezifität der Enzyme Trypsin und Chymotrypsin Einleitung Die Proteine, die wir in Form von Fleisch und anderen Nahrungsmitteln zu uns nehmen, können vom Darm nicht ins Blut gelangen, weil sie zu gross sind. Aus diesem Grund werden sie von Enzymen in die Aminosäuren zerlegt und in dieser Form mit dem Blut verteilt. Enzyme sind selber Proteine. Proteine zerlegen also Proteine. Wenn das nicht verwirrend ist! Trypsin und Chymotrypsin sind proteinspaltende Enzyme, sogenannte Proteasen. Und weil im aktiven Zentrum die Aminosäure Serin wichtig ist, werden sie SerinProteasen genannt. Die beiden Enzyme haben eine ähnliche Aminosäure-Sequenz: 40% der insgesamt 245 Aminosäuren sind in beiden Proteasen sogar identisch; das heisst: an derselben Stelle befindet sich dieselbe Aminosäure. Es ist deshalb nicht verwunderlich, dass sich auch die dreidimensionalen Strukturen der beiden Enzyme gleichen. Trotzdem bevorzugen sie unterschiedliche Substrate: Während das eine Enzym die Proteine bevorzugt nach Aminosäuren schneidet, die grosse, apolare Reste aufweisen, spaltet das andere die Proteine nach positiv geladen Aminosäuren. Die unterschiedliche Vorliebe (= Spezifität) kann anhand der dreidimensionalen Struktur am Computer erklärt werden. Experimenteller Teil a) Die Reaktionsgleichungen Die Abbildung zeigt die Reaktionsgleichungen des Experiments. Die Serin-Proteasen sind Verdauungsenzyme. Sie beschleunigen die Reaktionen der Verdauung. Weil sie dabei nicht verbraucht werden, werden sie weder als Ausgangs- noch als Endstoff in der Reaktionsgleichung erwähnt und Sie finden sie deshalb in der Abbildung nicht. Fachdidaktik Chemie Seite 1 Proteine Abb: Anleitung nach R. Deuber, Kantonsschule Baden Serin-Proteasen zerlegen Ester. Das freigesetzte H+ wird mit Hilfe eines Indikators (Phenolrot) nachgewiesen. Das Experiment wird mit Estern und nicht mit Proteinen durchgeführt. Die meisten Serin-Proteasen zerlegen Ester ebenso gut wie Proteine. Werden Ester verwendet, so entstehen Alkohole, welche Säure-Base-Reaktionen nicht beeinflussen. Deshalb gibt die Carbonsäure ein H+ an den Indikator Phenolrot ab und ändert dessen Farbe. Aufträge: 1. Markieren Sie die Esterbindungen in der Abbildung. 2. Vergleichen Sie die Moleküle der Abbildung mit einer Liste der Aminosäuren. a In der Abbildung sind die Aminosäuren leicht abgeändert. Markieren Sie die Teile, die einer Aminosäure entsprechen mit Farbe. b Um welche Aminosäuren handelt es sich? c Ergänzen Sie die Wasserstoffatome, die an den Stickstoffatomen hängen. d Ergänzen Sie die Ladungen 3. Warum entsteht bei der Spaltung der Ester ein H+? 4. Warum würde der Indikator die Farbe nicht ändern, wenn das Experiment mit Proteinen und nicht mit Estern durchgeführt würde? Fachdidaktik Chemie Seite 2 Proteine Anleitung nach R. Deuber, Kantonsschule Baden b) Vorgehen Es werden 4 Reagenzgläser beschriftet und mit folgenden Volumina (ml oder gleiche Teile) beschickt. Lösung A B C D Puffer Tris 2 2 2 2 Argininester 2 – 2 – Tyrosinester – 2 – 2 Je 2 Tropfen zugeben und mischen Je 2 Tropfen zugeben und mischen Je 2 Tropfen zugeben und mischen Je 2 Tropfen zugeben und mischen Trypsin 1 1 – – Chymotrypsin – – 1 1 Phenolrot Farbänderung ja/nein Farbe am Ende Mischen, ins 40°C Wasserbad stellen und Farbänderung beobachten. Die Proben müssen am Anfang rötlich gefärbt sein, andernfalls muss der Versuch mit frisch hergestellter Tris-HCl-Lösung wiederholt werden. Farbe nach Ablauf von 5-10 Minuten feststellen und die Ergebnisse in die Tabelle eintragen. Aufträge: 5. Erklären Sie das Resultat des Experiments. 6. Welche Farbe hat der Indikator Phenolrot bei pH 5, pH 8 und bei pH 10? Kontrollieren Sie Ihre Überlegungen mit einem kleinen Versuch: 3 Reagenzgläser mit etwas Hahnenwasser versehen und mit Phenolrot färben. Einige Tropfen Essigsäure in ein Reagenzglas geben und mischen. Einige Tropfen Ammoniak in ein anderes Reagenzglas geben und mischen. Mit pH-Papier die pH-Werte bestimmen. 7. Warum werden die Reagenzgläser in einem Wasserbad von 40 °C erwärmt? Fachdidaktik Chemie Seite 3 Proteine Anleitung nach R. Deuber, Kantonsschule Baden Proteine entstehen aus folgenden Aminosäuren: Fachdidaktik Chemie Seite 4 Proteine Anleitung nach R. Deuber, Kantonsschule Baden Material: Spezifität von Trypsin und Chymotrypsin Datum: Zeit: Klasse: Anzahl Gruppen .............................................................................................................................. .............................................................................................................................. Allgemeines: • Chymotrypsin-Lösung: 0,005 g Chymotrypsin (Fluka Nr. 27270 oder 27272) in 10 ml 0.001 M HCl lösen; im Tiefkühlfach aufbewahren (unmittelbar vor dem Gebrauch 0,8 ml dieser Stammlösung mit 19 ml H2O verdünnen) • Trypsin-Lösung 0,005 g Trypsin (Fluka Nr. 93612) in 10 ml 0.001 M HCl lösen; im Tiefkühlfach aufbewahren (unmittelbar vor dem Gebrauch 0,8 ml dieser Stammlösung mit 19 ml H2O verdünnen) Bitte jede der folgenden Lösungen in 3 Flaschen verteilen: • Tris pH 9: 0,048g Tris (Fluka, Nr. 93352) in 100 ml Wasser lösen und mit HCI auf pH 9.0 einstellen • N-Benzoyl-L-argininethylester-Lösung: 0,11 g N-Benzoyl-L-argininethylester (Fluka, Nr. 12880) in 20 ml Methanol und 20 ml Wasser lösen • N-Benzoyl-L-thyrosinethylester-Lösung: 0,10 g N-Benzoyl-L-thyrosinethylester (Fluka, Nr. 13110) in 20 ml Methanol und 20 ml Wasser lösen • Indikator Phenolrot: eine Spatelspitze Phenolrot mit 30 ml deion. Wasser mischen, eine Viertelstunde rühren und - falls sich nicht alles gelöst hat - filtrieren • 2 Flaschen 2 M Essigsäure • 2 Flaschen 2 M Ammoniak Pro Arbeitsplatz • Reagenzglasgestell mit 7 Reagenzgläsern • Wasserbad 40 ° C: 400 ml Becherglas und Alkohol-Thermometer . Es wird warmes Wasser aus der Leitung verwendet • Mikropipetten 1 ml mit Pipettenspitzen Fassung vom 28. Mai 2013 Fachdidaktik Chemie Seite 5 Proteine Anleitung nach R. Deuber, Kantonsschule Baden Bemerkungen: Die Farbe von pH-Papier und Phenolrot haben nichts miteinander zu tun eventuell graduierte Wegwerfpipetten statt Mikropipetten verwenden Demonstration: Mikropipetten wenig pH-Papier; Probe mit Glasstab den RGs entnehmen Fachdidaktik Chemie Seite 6 Proteine Anleitung nach R. Deuber, Kantonsschule Baden R. E. Dickerson erklärt die Spezifität ausführlich: aus R. E. Dickerson & I. Geis, Chemie - eine lebendige und anschauliche Einführung, Verlag Chemie, Weinheim (1981) Fachdidaktik Chemie Seite 7 Proteine Anleitung nach R. Deuber, Kantonsschule Baden Literatur Laboranleitung von Roger Deuber http://www.swisseduc.ch/chemie/labor/tryp_chymotryp/index.html • Generelle Einführung bezüglich Serin-Proteasen : Stryer, L., Biochemie, 4. Auflage (1996), Spektrum Akademischer Verlag, Seiten 233239, 259-264 • Einfache Einführung Proteinkristallographie : Rhodes, G., Crystallography Made Crystal Clear: A Guide for User's of Macromolecular Models, 2. Auflage (1999), Academic Press • Einführung und Beispiele für Molecular Modelling für Chemie- und Biologielehrer: http://www.swisseduc.ch/chemie/ • Datenbank für Proteinstrukturen http:// www.rcsb.org/pdb/ • Klassifizierung von Proteinstrukturen nach Proteinfamilien. Sehr vollständige und übersichtliche Beschreibung der Evolution von Proteinen. http://scop.mrc-lmb.cam.ac.uk/scop/ • MEROPS Datenbank der Proteasen bietet eine strukturbasierende Einteilung der Proteasen sowie zusatzliche Informationen. http:// www.merops.co.uk/ Fachdidaktik Chemie Seite 8