Gliederung1
Werbung

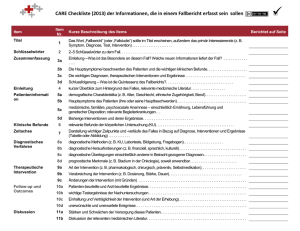
Seite 1 von 7 Gliederung des Antrags zur Förderung eines Vorhabens zum „Leuchtturmprojekt Demenz“ im Themenfeld 1 „Therapie- und Pflegemaßnahmen: Wirksamkeit unter Alltagsbedingungen“ Bitte beachten sie, dass die Unterschriften des Antragstellers/Koordinators sowie des verantwortlichen Biostatistikers obligatorisch sind. Falls Sie einen systematischen Review zu Erhebungsinstrumenten für patienten- und angehörigen-relevante Endpunkte in Effektivenessstudien zu demenziellen Erkrankungen beantragen wollen, passen Sie bitte den folgenden Leitfaden entsprechend Ihrer Fragestellung an. 1. ZUSAMMENFASSUNG DER STUDIE Antragsteller/ Koordinator Im Falle mehrerer Antragsteller muss hier nur der Projektleiter/in, der die Verantwortung für die Durchführung des Projekts übernimmt benannt werden. Sie muss identisch mit den Angaben im Online-Formular sein. Vorname, Nachname, Akademische Titel Institution und Abteilung (kompletter Name) Adresse Titel der Studie Der Titel des Projekts, ACRONYM Themenfeld (Nr.) / ggf. Krankheitsstadium Zuordnung zum Themenfeld der Bekanntmachung und ggf. Krankheitsstadium Untersuchungsziel / Hypothese Primäres Untersuchungsziel? Spezifizieren Sie die primäre Hypothese der Studie, die für die Stichprobenkalkulation herangezogen wurde. Intervention(en) Beschreiben Sie die experimentelle Intervention und die Kontroll-Interventionen Experimentelle Intervention: Kontroll-Intervention: Dauer der Intervention pro Patient/Proband: Dauer des Follow-up pro Patient/Proband Einschluss- und Ausschlusskriterien Einschlusskriterien: Outcome (Abhängige Variablen) Primäre Variable: Ausschlusskriterien: Sekundäre Variablen: Beurteilung der Sicherheit: Studientyp z.B. randomisierte/nicht-randomisierte, Art der Maskierung (einfach, dopelblind), Kontrolle (Placebo), Parallelgruppen/cross-over Statistische Analyse Wirksamkeit unter Alltagsbedingungen: Beschreibung der primären Analyse und der Population: Sicherheits-Aspekte: Sekundäre Variablen: Stichprobengröße Notwendige Anzahl geeigneter Patienten(Probanden (n = …) Notwendige Teilnehmer an der Studie (n = …) Notwendige Anzahl geeigneter Datensätze (n = …) Studiendauer Einschluss des ersten bis Abschluss des letzten Patienten/Probanden: Gesamtdauer der Studie: Wie viele Zentren sind beteiligt? Beteiligte Zentren Seite 2 von 7 1.1. Zusammenfassung der Projektinhalte Fassen Sie die wichtigsten Aspekte der Studie zusammen (max. 15 Zeilen, max. 1600 Zeichen). Sollte das Projekt gefördert werden, wird ggf. die Zusammenfassung im Internet publiziert. Sie sollte daher prägnant und verständlich für ein breites Publikum geschrieben sein. Das Vermeiden von Abkürzungen sowie die Angabe von Schlüsselwörtern erleichtern die elektronische Suche. 2. Medizinische Fragestellung 2.1 Zielsetzung und Fragestellung Welche medizinische Fragestellung wird bearbeitet? Was ist der neue Aspekt der Klinischen Studie? Listen Sie Ihre Hypothesen und Ziele nach Bedeutung innerhalb der Studie. Welche konkreten Auswirkungen werden die Ergebnisse auf die klinische Praxis und das Verständnis der vorgeschlagenen Intervention haben? 2.2 Wissenstand Welche Klinische Studien wurden bereits durchgeführt und von wem? Welche Relevanz haben die Ergebnisse bisheriger Studien? Listen Sie bitte relevante Übersichtsarbeiten (systematic review) und/oder (eigene) Pilotstudien, Untersuchungen zur Durchführbarkeit, relevante laufende und abgeschlossene Studien, Einzelfalluntersuchungen und Messreihen. Sollten Sie der Auffassung sein, dass es bisher keine Klinischen Studien zur Fragestellung gibt, geben Sie bitte Details Ihrer Suchstrategie an. Diese Recherche sollte sowohl Grundlage für die Ausgangshypothese sein als auch zur Beurteilung der Durchführbarkeit herangezogen werden. 2.3 Vorarbeiten und Vorleistungen Einschlägige Vorarbeiten des Projektleiters und der beteiligten Personen/Institutionen sowie die vorhandene Expertise in Bezug auf das beantragte Projekt sind darzulegen. Bitte geben Sie maximal 5 Publikationen oder Projekte an, die für das beantragte Vorhaben einschlägig sind. 2.4 Strategien für die Verbreitung der Ergebnisse Welche Strategien werden angewendet zur Verbreitung der Ergebnisse? Beschreiben Sie bitte, wie die erwarteten Ergebnisse genutzt werden sollen. Diskutieren Sie die Verbreitung der Ergebnisse, insbesondere über die Publikation in wissenschaftlichen Zeitschriften hinausgehend. Beschreiben Sie bitte potentielle Maßnahmen und wirtschaftliche Auswirkungen. 3. Begründung der Methode/des Designs 3.1 Kontrolle/Vergleiche Begründen Sie bitte die Wahl der Kontrollen/Vergleiche. 3.2 Intervention Beschreiben Sie die geplante Intervention anhand der folgenden Leitfragen: Was beinhaltet die Intervention? Wie liegt die geplante Häufigkeit und der Aufwand der Untersuchungen und, sofern vorgesehen, wie lange dauern die follow-up Untersuchungen? Welchen Umfang hat die Intervention? Wer ist für die Durchführung verantwortlich? Soweit vorhanden bitte Manuale oder ähnliche Beschreibungen der Intervention elektronisch beifügen. Gibt es Daten zur Akzeptanz der Intervention bei Professionellen, Angehörigen und Betroffenen (z. B. Test durch Pilotstudien)? Fertigen Sie bitte ein Flussdiagramm an, in welchem Design, Prozeduren und Stadien erkennbar sind. 3.2 Einschluss-/ Ausschlußkritertien Begründen Sie bitte die gewählte Grundgesamtheit und die Stichprobe. Wie und wo werden die PatientInnen rekrutiert (z. B. Setting, Region, Einrichtung)? Wie sind die Kriterien operationalisiert? Wie generalisierbar und repräsentativ sind die erzielten Ergebnisse? 3.3 Outcome (abhängige Variablen) Begründen Sie bitte die gewählten Endpunkte. Wurden die Endpunkte bereits in anderen Studien gewählt? Gibt es Richtlinien, in denen die gewählten Endpunkte vorgeschlagen werden? Beschreiben Sie bitte die klinische Relevanz der „Outcome“-Variablen für die Zielpopulation. Wurden die Erhebungsinstrumente validiert? Seite 3 von 7 3.4 Bestimmung von primären und sekundären Variablen Wie werden die primären und sekundären Endpunkte aus den Messungen abgeleitet? Welche Eingangsmessungen werden z.B. bei den Teilnehmerinnen und Teilnehmern erhoben und wie werden diese Daten statistisch analysiert und in der Studie berücksichtigt? 3.5 Durchführung unter Alltagsbedingungen „Effektiveness-Studie“ Entspricht die Vergleichsintervention dem derzeitig angewandten Versorgungsstandard? Werden alle Patienten unter Routinebedingungen behandelt? Ist gewährleistet, dass Patienten eingeschlossen werden, die die für die Fragestellung typische Fallschwere aufweisen? Entsprechen das Setting und die beteiligten Ärzte der Versorgungsrealität. Wird eine größere Breite von Endpunkten erfasst? 3.6 Kontrolle systematischer Fehler Ist eine Randomisierung möglich? Welche prognostischen Faktoren müssen bei der Randomisierung und der Analyse berücksichtigt werden? Wie ist die praktische Vorgehensweise für die Zuordnung der Teilnehmerinnen und Teilnehmer auf die Gruppen? Ist eine Verblindung möglich? Falls nicht, erklären Sie bitte warum und beschreiben Sie detailliert alternative Methoden, um systematische Fehler zu vermeiden. 3.7 Vorgeschlagene Stichprobengröße / Power-Kalkulation Wie hoch ist die vorgeschlagene Stichprobe und wie wird diese begründet? Bitte fügen Sie eine verständliche und überprüfbare Beschreibung der Power-Kalkulationen und Stichproben bei, aus der hervorgeht, wie die Stichprobengröße der Gruppen (Experimental- und Kontrollgruppen) berechnet wurde. Begründen Sie bitte angenommene Effektstärken und die gewünschte Power der Klinischen Prüfung. Bitte geben Sie die minimale Gruppendifferenz an, die in einer Prüfung entdeckt werden soll, bzw. im Falle einer Äquivalenzstudie die maximale Gruppendifferenz, die ausgeschlossen werden soll. Für die Berechnung der Power-Kalkulationen sind die voraussichtlichen Ausfallquoten zu berücksichtigen. 3.7.1 Erwartete Zustimmungs-/Ausfallquoten Bitte begründen Sie Ihre Annahmen. Auf welcher Basis basieren die Annahmen der Zustimmungs- und Ausfallquoten. Wie liegen die erwarteten Ausfallquoten für „follow-up“ Untersuchungen und wie wurde die Schätzung erstellt? Wie werden die Ausfallquoten in der statistischen Analyse berücksichtigt? 3.7.2 Rekrutierung und Durchführbarkeit Welche Belege liegen für die geplante Rekrutierungsrate vor (z.B. Pilotstudie)? a) Pilotstudie Wurden Pilotstudien durchgeführt, in denen das vorgeschlagene Design verwendet wurde? b) Erreichbarkeit der Rekrutierungsrate Welche Belege liegen für die geplante Rekrutierungsrate vor? Erläutern Sie bitte schlüssig das Potential, die notwendige Anzahl an Teilnehmerinnen und Teilnehmern rekrutieren zu können (der beste Beleg sind Pilotstudien und vergleichbare Studien mit der gleichen Population in den gleichen Institutionen). Wie wurde überprüft, ob die notwendige Anzahl an Patienten/Probanden rekrutiert werden kann? Listen Sie bitte die Zahl der zu rekrutierenden Teilnehmerinnen und Teilnehmer tabellarisch für jeden Standort, begründen Sie alle Zahlen und beschreiben Sie die Selektionskriterien. Internationale Kooperation: Sollte die Klinische Studie eine Kooperation mit ausländischen Zentren beinhalten, nennen Sie bitte Details der Absprachen unter Berücksichtigung des Studienprotokolls. Beschreiben Sie den Anteil der deutschen Beteiligung an der internationalen Studie. 4. Statistische Analysen Beschreiben Sie bitte die vorgeschlagene Strategie der statistischen Analyse. Wie soll der primäre Effekt analysiert werden? Sollte eine Zwischenauswertung vorgesehen sein, beschreiben Sie diese bitte. Werden Subgruppen analysiert? Wie wird mit fehlenden Daten und Studienabbrechern in der statistischen Analyse verfahren? 5. Ethische Gesichtspunkte Seite 4 von 7 Beschreiben Sie bitte ethische Gesichtspunkte der Klinischen Studie: Bewertung der Risiken und des Nutzens, Pflege und Schutz der Teilnehmerinnen und Teilnehmer, Datenschutz, Prozess der Einwilligung, Ethikvotum. 6. Qualitätssicherung / Monitoring 6. 1 Vorgehensweise Welche Maßnahmen zur Qualitätssicherung werden vorgeschlagen? Beschreiben und begründen Sie bitte die geplante Vorgehensweise des Monitoring (Prozentsatz der Verifikation von Quelldateien, Anzahl der monitorierten Items, Anzahl der Monitor-Besuche pro Studienstandort). 6.2 Sicherheit Bitte kommentieren Sie die geplante Supervision der Studie (DMSC); nennen Sie bitte Namen und Institutionen der unabhängigen DMSC Mitglieder. Die Planung des Studien-Managements ist unterschiedlich und hängt von der Natur der Studie ab. Es sollte jedoch immer ein von Studienkoordinator und beteiligten Institutionen unabhängiger Expertenrat (Monitoring) eingerichtet werden. Normalerweise wird dies in der Form eines wissenschaftlichen „trial steering committee“ (TSC) und/oder eines unabhängigen „data monitoring and safety committee“ (DMSC) realisiert. Es wird anerkannt, dass solche Planungen eventuell nicht immer angemessen sind und die Kommission je nach Art der Studie sehr unterschiedlich aussehen kann. Daher sollten Aspekte der Supervision detailliert beschrieben und begründet werden. Die Aufgabe der unabhängigen Kommission kann umfassen: Supervision des Studienfortschritts (inklusive der Sicherheitsaspekte und der kritischen Endpunkte), Überprüfen relevanter Informationen aus anderen Quellen, Sicherstellen der Einhaltung des Protokolls, Abwägen einer Zwischenauswertung, Beratung bei Fortsetzung, Modifizierung oder Beendigung der Studie und Informationsvermittlung an die Förderinstitution. Die Antragsteller sollten das vorgeschlagene Vorgehen zur Überwachung der Studie beschreiben und mindestens drei Mitglieder der Kommission benennen (Name, Titel, Adresse und Telefonnummer im Studienprotokoll). 7. Meilensteinplanung Reichen Sie bitte einen Vorschlag für eine Meilensteinplanung ein, inklusive Planung, Stand der Rekrutierung und der Datenanalyse. Legen Sie bitte ein Diagramm bei, aus dem die Studienphasen und Meilensteine hervorgehen. 8. Beteiligte SPONSOR der Studie STUDIENMANAGEMENT # Name Institut Verantwortlichkeit / Rolle Unterschrift STATISTIKER # Name Institut Unterschrift UNTERSTÜTZENDE EINRICHTUNGEN # Name Institut Verantwortlichkeit / Rolle Seite 5 von 7 REKRUTIERENDE ZENTREN # Name Institut Erwartete Zahl der für die Studie rekrutierte Patienten DATA MONITORING AND SAFETY BOARD (DMSB) # Name Institut WEITERE TEILNEHMENDE GRUPPEN # Name Institut Verantwortlichkeit / Rolle UNABHÄNGIGER REVIEW DES STUDIENPROTOKOLLS # Name 9. Institut Finanzierungsplan (Details) Die Gesamtausgaben sollen in der unten stehenden Tabelle zusammengefasst werden. Mittel für die Grundausstattung des Antragstellers sind nicht zuwendungsfähig. Ebenfalls können Leistungen der Regelversorgung nicht bewilligt werden. Grundsätzlich wird davon ausgegangen, dass auch für neue Interventionen eine Finanzierung außerhalb der Projektförderung zur Verfügung steht. Abweichungen davon sind zu begründen. Die Notwendigkeit der beantragten Mittel muss sich in jedem Fall aus dem Arbeitsprogramm ergeben. 2008 Personal (Qualifikation, Vergütungsgruppe, Dauer der Beschäftigung) Verbrauchsmaterial und Geschäftsbedarf Geräte Dienstreisen Vergabe von Aufträgen Sonstige Sachausgaben TOTAL 9.1. 2009 Summe € € € € € € € € Personal Geben Sie bitte neben den Angaben in der obigen Tabelle für jede Stelle eine kurze Tätigkeitsbeschreibung unter Hinweis auf das Arbeitsprogramm an. 9.2. Verbrauchsmaterial, Geschäftsbedarf Auflistung des benötigten Materials nach einzelnen Posten (z. B. Verbrauchsmaterial, Aufwendungen für Fragebogen, Post- und Fernmeldegebühren etc.). jeweils mit beantragter Summe und ggf. Mengenangabe. Hierunter sind auch Aufwandsentschädigungen einzuordnen. Höhe und Art der Aufwandsentschädigungen bitten wir zu begründen. 9.3. Geräte Erläutern Sie für die benötigten Geräte den Einsatz im Vorhaben. Es ist anzugeben, ob es sich jeweils um Ausgaben für Beschaffung, Leasing, Wartungsverträge oder um welche anderen Ausgaben handelt. Seite 6 von 7 9.4. Aufwendungen für (Dienst-) Reisen Die Notwendigkeit und Kalkulation der Reisen ist darzulegen, sie muss sich direkt aus den geplanten Arbeiten ableiten. In dieser Position können nur projektgebundene Aufwendungen für Reisen (Dienstreisen) des Personals (vgl. 7.1) berücksichtigt werden; Aufwendungen für Reisen und Aufenthalt anderer Personen im Rahmen der jeweiligen Maßnahmen sind bei "Sonstige Sachausgaben" auszuweisen. 9.5. Vergabe von Aufträgen Eine Vergabe von Aufträgen ist dann erforderlich, wenn ein Teil der vorgesehenen Arbeiten gegen Entgelt von einer anderen Institution durchgeführt werden muss. Bitte geben Sie an: 9.6 welche Teilaufgabe(n) in Auftrag gegeben werden sollen warum Sie diese Teilaufgabe(n) nicht selbst bearbeiten wer diese Teilaufgabe(n) bearbeiten soll wie hoch die Vergütung ist. Sonstige Sachausgaben Bitte führen Sie in dieser Position Sachausgaben an, die sich nicht den anderen Positionen zuordnen lassen (z.B. Durchführung von Veranstaltungen, Mitgliedsbeiträge) und begründen Sie die Notwendigkeit. 9.7 Co-Finanzierung durch Dritte Eine Co-Finanzierung durch Dritte ist möglich, falls die Unabhängigkeit des Untersuchers sichergestellt ist und die Bedingungen und Konditionen des finanziellen Engagements beigefügt wird. Sollte eine Co-Finanzierung beabsichtigt sein, beschreiben Sie bitte die Art und die Höhe der geplanten CoFinanzierung sowie die Bedingungen und Konditionen und nennen Sie die Krankenkasse, Firma bzw. andere Vertragspartner. Bitte beachten Sie, dass die Ergebnisse des Vorhabens für Leistungserbringer und Leistungsträger im Gesundheitswesen frei zugänglich sein müssen. Bestätigen Sie bitte, dass der Projektsprecher/Koordinator von Interessen der Co-Finanzierer unabhängig ist, insbesondere bezüglich der Studienanalyse und der Publikation der Ergebnisse. Details sind im Studienprotokoll zu beschreiben: Beschreiben Sie bitte die Art und die Höhe der Unterstützung (einschließlich jeder Dienstleistung oder umsonst zur Verfügung gestelltes Material wie z.B. Medikation). Bestätigen Sie bitte schriftlich die Unterstützung durch Dritte, nennen Sie das Ausmaß der Unterstützung sowie die Bedingungen und Konditionen. Bestätigen Sie bitte, dass der Studien-Sprecher/Koordinator unabhängig ist, insbesondere bezüglich der Studien-Analyse und der Publikation der Ergebnisse. Eine entsprechende Erklärung wird von der Förderorganisation eingefordert, nachdem die Begutachtung abgeschlossen ist. Bitte treffen Sie keine Vereinbarungen vor der Antragstellung, sondern kontaktieren Sie zuerst die Förderorganisation! Es sollten angemessene Vereinbarungen über das geistige Eigentum, Vertraulichkeit, Publikation der Ergebnisse und Eigentumsrechte zwischen allen an der Klinischen Studie beteiligten Parteien abgeschlossen werden. 9.8 Weitere Förderungen Sollte der vorliegende Antrag ganz oder in Teilen bei anderen Institutionen eingereicht worden sein, erwähnen Sie es bitte hier. Nennen Sie bitte Parteien, die Förderungen, kostenlose Dienstleitungen oder Material zur Verfügung stellen. Sollte dies nicht der Fall sein, erklären Sie bitte: "Für dieses Projekt wurde bei keiner anderen Stelle ein Antrag zur Förderung gestellt. Sollte ein solcher Antrag gestellt werden, werde ich den zuständigen Projektträger unverzüglich informieren.“ 10.0 Zitierte Literatur Einfache Auflistung der Quellen auf maximal 1 DinA4-Seite. Bitte sehen Sie davon ab, Literatur mitzuschicken. Seite 7 von 7 Anlagen Bitte ergänzen Sie folgende Anlagen. 1. Registrierung Bitte bestätigen Sie, dass Sie die klinische Studie unmittelbar nach Erhalt des Zuwendungsbescheids in einem öffentlichen frei zugänglichen Register eintragen werden (wie z.B. http://www.controlled-trials.com) 2. Sponsoren Erklärung Die Sponsoren-Erklärung muss dem Antrag beigefügt werden. Bitte nutzen Sie dazu den auf der Internetseite abrufbaren Text, der von einem Verantwortlichen Ihrer Institution und dem Studienleiter unterschrieben werden muss. Die Sponsoren-Erklärung kann nachgereicht werden, muss dem Förderer aber vor der Bewilligung vorliegen. Link zur Sponsorerklärung 3. Erklärung der beteiligen Zentren Die beteiligten Zentren müssen ihre Bereitschaft zur Teilnahme auf einem separaten Blatt mir ihrer Unterschrift bestätigen, wobei folgende Informationen enthalten sein müssen. Die Erklärungen der beteiligten Zentren können nachgereicht werden, müssen dem Förderer aber vor der Bewilligung vorliegen. Name des beteiligten Untersuchers Institution Studientitel Studiendauer Ein- und Ausschlusskriterien Zahl der Patienten, die von der Einrichtung für die Studie unter den genannten Kriterien rekrutiert werden soll Angaben zu Interessenskonflikten Unterschrift 4. Erklärung zu Interessenskonflikten Jeder mögliche Interessenskonflikt muss angegeben werden. Die Regeln, die in den „Uniform Requirements for Manuscripts Submitted to Biomedical Journals“ niedergelegt sind, sind entsprechend anzuwenden. (www.thelancet.com)