FACHINFORMATION 1. BEZEICHNUNG DER
Werbung

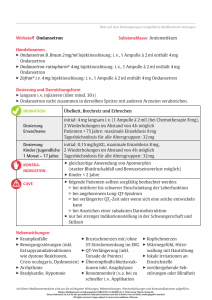
FACHINFORMATION 1. BEZEICHNUNG DER ARZNEIMITTEL Ondansetron Winthrop® 4 mg Filmtabletten Ondansetron Winthrop® 8 mg Filmtabletten 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Ondansetron Winthrop 4 mg Filmtabletten 1 Filmtablette enthält 4 mg Ondansetron (als Ondansetronhydrochlorid-Dihydrat). Sonstige Bestandteile: Jede Filmtablette enthält 84,50 mg Lactose-Monohydrat (siehe Abschnitt 4.4). Ondansetron Winthrop 8 mg Filmtabletten 1 Filmtablette enthält 8 mg Ondansetron (als Ondansetronhydrochlorid-Dihydrat). Sonstige Bestandteile: Jede Filmtablette enthält 169 mg Lactose-Monohydrat (siehe Abschnitt 4.4). Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1. 3. DARREICHUNGSFORM Filmtablette. Ondansetron Winthrop 4 mg Filmtabletten Blassgelbe, runde, bikonvexe Filmtabletten mit der Prägung „41“ auf einer Seite und einem Durchmesser von 7,2 mm. Ondansetron Winthrop 8 mg Filmtabletten Blassgelbe, runde, bikonvexe Filmtabletten mit der Prägung „42“ auf einer Seite und einem Durchmesser von 9,2 mm. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Erwachsene – Behandlung von Übelkeit und Erbrechen hervorgerufen durch zytotoxische Chemotherapie oder Strahlentherapie, – Vorbeugung und Behandlung von Übelkeit und Erbrechen nach Operationen (PONV). Pädiatrische Population – Behandlung von Übelkeit und Erbrechen infolge von Chemotherapie (CINV) bei Kindern ab 6 Monaten, – Vorbeugung und Behandlung von Übelkeit und Erbrechen nach Operationen bei Kindern ab 1 Monat. Mat.‐Nr.:328960 1 4.2 Dosierung und Art der Anwendung Zum Einnehmen. Für die unterschiedlichen Behandlungsschemata stehen geeignete Wirkstärken und Darreichungsformen zur Verfügung. Übelkeit und Erbrechen hervorgerufen durch Chemotherapie und Strahlentherapie Erwachsene Das emetogene Potenzial der Tumorbehandlung ist abhängig von der Dosis und der Kombination des angewendeten Chemo- und Strahlentherapieschemas. Die Art der Anwendung und die Dosis von Ondansetron sollten flexibel sein und wie im Folgenden aufgeführt gewählt werden. Emetogene Chemotherapie und Strahlentherapie Patienten, die eine emetogene Chemotherapie oder Strahlentherapie erhalten, kann Ondansetron entweder in der oralen oder intravenösen Darreichungsform gegeben werden. Bei den meisten Patienten, die eine emetogene Chemotherapie oder Strahlentherapie erhalten, sollte Ondansetron zunächst unmittelbar vor der Chemo- oder Strahlentherapie intravenös gegeben werden, gefolgt von 8 mg oral alle 12 Stunden. Orale Anwendung: 8 mg Ondansetron 1–2 Stunden vor der Chemo- oder Strahlentherapie, gefolgt von 8 mg oral nach 12 Stunden. Zur Vorbeugung von verzögertem oder anhaltendem Erbrechen nach den ersten 24 Stunden sollte die orale Gabe von Ondansetron nach einem Behandlungszyklus über bis zu 5 Tage fortgesetzt werden. Die empfohlene orale Dosis beträgt zweimal täglich 8 mg. Hoch emetogene Chemotherapie Bei Patienten, die eine hoch emetogene Chemotherapie, z. B. hoch dosiertes Cisplatin, erhalten, kann Ondansetron intravenös gegeben werden. Die empfohlene orale Dosis beträgt 24 mg, die zusammen mit 12 mg oralem DexamethasonNatriumphosphat 1 bis 2 Stunden vor der Chemotherapie einzunehmen ist. Zur Vorbeugung von verzögertem oder anhaltendem Erbrechen nach den ersten 24 Stunden sollte die orale Gabe von Ondansetron nach einem Behandlungszyklus über bis zu 5 Tage fortgesetzt werden. Die empfohlene Dosis zur oralen Anwendung beträgt zweimal täglich 8 mg. Pädiatrische Population Übelkeit und Erbrechen infolge von Chemotherapie (CINV) bei Kindern ab 6 Monaten und Jugendlichen Die gegen Übelkeit und Erbrechen infolge von Chemotherapie einzusetzende Dosis kann auf der Grundlage der Körperoberfläche oder des Körpergewichts berechnet werden (siehe unten). Eine Dosierung nach Körpergewicht führt zu höheren Tagesgesamtdosen als eine Dosierung nach Körperoberfläche – siehe Abschnitte 4.4 und 5.1. Ondansetron Injektionslösung sollte mit 5 %iger Glucoselösung oder 0,9 %iger Natriumchloridlösung oder einer anderen kompatiblen Infusionslösung verdünnt und über mindestens 15 Minuten intravenös infundiert werden. Es liegen keine Daten aus kontrollierten klinischen Studien zur Anwendung von Ondansetron bei der Vorbeugung von verzögerter oder lang anhaltender CINV vor. Ebenso liegen keine Daten aus kontrollierten klinischen Studien zur Anwendung von Ondansetron gegen Übelkeit und Erbrechen infolge von Strahlentherapie bei Kindern vor. Dosierung nach Körperoberfläche: Ondansetron sollte unmittelbar vor der Chemotherapie als intravenöse Einmalgabe von 5 mg/m2 verabreicht werden. Die intravenöse Dosis darf 8 mg nicht überschreiten. Mat.‐Nr.:328960 2 Mit der oralen Verabreichung kann zwölf Stunden später begonnen werden, und diese kann bis zu 5 Tage fortgesetzt werden – siehe Tabelle 1 unten. Die Tagesgesamtdosis darf die Erwachsenendosis von 32 mg nicht überschreiten. Tabelle 1: Dosierung bei Chemotherapie nach Körperoberfläche – Kinder ab 6 Monaten und Jugendliche Körperoberfläche Tag 1a, b Tage 2–6b 2 2 < 0,6 m 5 mg/m i. v. plus 2 mg Sirup alle 12 Stunden 2 mg Sirup nach 12 Stunden ≥ 0,6 m2 5 mg/m2 i. v. plus 4 mg Sirup oder Tablette alle 4 mg Sirup oder Tablette nach 12 Stunden 12 Stunden a Die intravenöse Dosis darf 8 mg nicht überschreiten. b Die Tagesgesamtdosis darf die Erwachsenendosis von 32 mg nicht überschreiten. Dosierung nach Körpergewicht: Eine Dosierung nach Körpergewicht führt zu höheren Tagesgesamtdosen als eine Dosierung nach Körperoberfläche (siehe Abschnitte 4.4 und 5.1). Ondansetron sollte unmittelbar vor der Chemotherapie als intravenöse Einmalgabe von 0,15 mg/kg verabreicht werden. Die intravenöse Dosis darf 8 mg nicht überschreiten. In 4-stündigen Abständen können zwei weitere intravenöse Gaben verabreicht werden. Die Tagesgesamtdosis darf die Erwachsenendosis von 32 mg nicht überschreiten. Mit der oralen Gabe kann zwölf Stunden später begonnen werden, und diese kann bis zu 5 Tage fortgesetzt werden (siehe Tabelle 2 unten). Tabelle 2: Dosierung bei Chemotherapie nach Körpergewicht – Kinder ab 6 Monaten und Jugendliche Gewicht Tag 1a, b Tage 2–6b ≤ 10 kg bis zu 3 Gaben von 0,15 mg/kg alle 2 mg Sirup alle 12 Stunden 4 Stunden > 10 kg bis zu 3 Gaben von 0,15 mg/kg alle 4 mg Sirup oder Tablette alle 4 Stunden 12 Stunden a Die intravenöse Dosis darf 8 mg nicht überschreiten. b Die Tagesgesamtdosis darf die Erwachsenendosis von 32 mg nicht überschreiten. Ältere Patienten Ondansetron wird bei oraler Anwendung von Patienten über 65 Jahren gut vertragen. Eine Anpassung der Dosis, des Dosierungsintervalls und der Art der Anwendung ist nicht erforderlich. Patienten mit eingeschränkter Nierenfunktion Eine Anpassung der Tagesdosis, des Dosierungsintervalls und der Art der Anwendung ist nicht erforderlich. Patienten mit eingeschränkter Leberfunktion Bei Patienten mit mäßiger bis schwerer Einschränkung der Leberfunktion ist die OndansetronClearance signifikant vermindert und die Halbwertszeit im Serum signifikant verlängert. Bei diesen Patienten darf die Tagesgesamtdosis 8 mg nicht überschreiten, weshalb die parenterale oder orale Verabreichung empfohlen wird. Patienten mit schlechtem Spartein-/Debrisoquin-Metabolismus Die Eliminationshalbwertszeit von Ondansetron ist bei langsamen Spartein- und DebrisoquinMetabolisierern unverändert. Bei diesen Patienten entsprechen somit die Expositionsspiegel nach wiederholter Anwendung denen der allgemeinen Bevölkerung. Eine Anpassung der Tagesdosis oder des Dosierungsintervalls ist nicht erforderlich. Mat.‐Nr.:328960 3 Übelkeit und Erbrechen nach Operationen (PONV) Erwachsene Vorbeugung von Übelkeit und Erbrechen nach Operationen Zur Vorbeugung von Übelkeit und Erbrechen nach Operationen kann Ondansetron zum Zeitpunkt der Narkoseeinleitung oral gegeben oder intramuskulär oder langsam intravenös injiziert werden. Die empfohlene orale Dosis ist 16 mg Ondansetron 1 Stunde vor der Narkose. Alternativ 8 mg Ondansetron 1 Stunde vor der Narkose, gefolgt von zwei weiteren 8-mg-Dosen im Abstand von 8 Stunden. Zum Zeitpunkt der Narkoseeinleitung können alternativ 4 mg Ondansetron als intramuskuläre oder langsame intravenöse Einmalgabe angewendet werden. Behandlung von bestehender Übelkeit und bestehendem Erbrechen nach Operationen (PONV) Zur Behandlung von Übelkeit und Erbrechen nach Operationen wird eine Einmalgabe von 4 mg Ondansetron als intramuskuläre oder langsame intravenöse Injektion empfohlen. Pädiatrische Population Übelkeit und Erbrechen nach Operationen bei Kindern ab 1 Monat und Jugendlichen Zur Anwendung von oral verabreichtem Ondansetron zur Vorbeugung oder Behandlung von Übelkeit und Erbrechen nach Operationen gibt es keine Studien; zu diesem Zweck wird die langsame intravenöse Gabe empfohlen. Zur Vorbeugung von PONV bei pädiatrischen Patienten, die unter Vollnarkose einer Operation unterzogen werden, kann entweder vor, während oder nach der Narkoseeinleitung eine Einmalgabe Ondansetron langsam (mindestens 30 Sekunden) über eine Vene appliziert werden, und zwar in einer Dosierung von 0,1 mg/kg bis maximal 4 mg. Zur postoperativen Behandlung von PONV bei pädiatrischen Patienten, die unter Vollnarkose einer Operation unterzogen wurden, kann eine Einmalgabe Ondansetron langsam (mindestens 30 Sekunden) über eine Vene appliziert werden, und zwar in einer Dosierung von 0,1 mg/kg bis maximal 4 mg. Zur Anwendung von Ondansetron bei der Behandlung von Übelkeit und Erbrechen nach Operationen bei Kindern unter 2 Jahren liegen keine Daten vor. Ältere Patienten Die Erfahrung zur Anwendung von Ondansetron zur Vorbeugung und Behandlung von Übelkeit und Erbrechen nach Operationen (PONV) bei älteren Patienten ist begrenzt. Ondansetron wird jedoch von Patienten über 65 Jahren, die eine Chemotherapie erhalten, gut vertragen. Besondere Patientengruppen Patienten mit eingeschränkter Nierenfunktion Eine Anpassung der Dosis, des Dosierungsintervalls und der Art der Anwendung ist nicht erforderlich. Patienten mit eingeschränkter Leberfunktion Bei Patienten mit mäßiger bis schwerer Einschränkung der Leberfunktion ist die OndansetronClearance signifikant vermindert und die Halbwertszeit im Serum signifikant verlängert. Bei diesen Patienten darf die Tagesgesamtdosis 8 mg nicht überschreiten, weshalb die parenterale oder orale Verabreichung empfohlen wird. Patienten mit schlechtem Spartein-/Debrisoquin-Metabolismus Die Eliminationshalbwertszeit von Ondansetron ist bei langsamen Spartein- und DebrisoquinMetabolisierern unverändert. Bei diesen Patienten entsprechen somit die Expositionsspiegel nach wiederholter Anwendung denen der allgemeinen Bevölkerung. Eine Anpassung der Tagesdosis oder des Dosierungsintervalls ist nicht erforderlich. Mat.‐Nr.:328960 4 4.3 Gegenanzeigen Überempfindlichkeit gegen Ondansetron oder andere selektive 5-HT3-Rezeptorantagonisten (z. B. Granisetron, Dolasetron). Gleichzeitige Anwendung mit Apomorphin (siehe Abschnitt 4.5). Überempfindlichkeit gegen einen sonstigen Bestandteil. 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Überempfindlichkeitsreaktionen wurden bei Patienten mit Überempfindlichkeit gegenüber anderen selektiven 5-HT3-Rezeptorantagonisten beobachtet. Unerwünschte Ereignisse im Bereich der Atemwege sind symptomatisch zu behandeln und sollten vom behandelnden Arzt als Vorboten einer Überempfindlichkeitsreaktion sehr ernst genommen werden. Ondansetron verlängert dosisabhängig das QT-Intervall (siehe Abschnitt 5.1). Außerdem wurden bei Patienten, die Ondanseton erhielten, in der Post-Marketing-Spontanberichtserfassung Fälle von Torsade de pointes berichtet. Bei Patienten mit angeborenem Long-QT-Syndrom sollte die Anwendung von Ondansetron zu vermieden werden. Bei Patienten, die eine verlängerte QTc-Zeit aufweisen oder bei denen sich eine verlängerte QTc-Zeit entwickeln kann, sollte Ondansetron mit Vorsicht angewendet werden. Zu dieser Gruppe gehören Patienten mit Elektrolytstörungen, kongestiver Herzinsuffizienz, Bradyarrhythmien oder Patienten, die andere Arzneimittel einnehmen, die eine Verlängerung des QT-Intervalls oder Elektrolytstörungen hervorrufen. Eine Hypokaliämie oder Hypomagnesiämie sollte vor der Anwendung von Ondansetron korrigiert werden. In Post-Marketing-Berichten wurden Patienten mit Serotonin-Syndrom (einschließlich verändertem Bewusstseinszustand, autonomer Instabilität und neuromuskulären Auffälligkeiten) nach gleichzeitiger Anwendung von Ondansetron mit anderen serotenergen Arzneimitteln (wie selektiven SerotoninWiederaufnahmehemmern [SSRIs] und Serotonin-Noradrenalin-Wiederaufnahmehemmern [SNRIs]) beschrieben. Wenn die gleichzeitige Behandlung mit Ondansetron und anderen serotenergen Arzneimitteln klinisch notwendig ist, wird eine entsprechende Überwachung des Patienten empfohlen. Da Ondansetron bekanntermaßen die Dickdarmpassage verlängert, müssen Patienten mit Anzeichen einer subakuten Darmobstruktion nach Anwendung von Ondansetron überwacht werden. Bei Patienten mit Rachenmandeloperationen kann die Behandlung mit Ondansetron zur Prävention von Übelkeit und Erbrechen okkulte Blutungen maskieren. Diese Patienten sind deshalb nach Anwendung von Ondansetron sorgfältig zu überwachen. Aufgrund der bisher nur geringen Erfahrungen mit der Anwendung von Ondansetron bei Herzpatienten ist bei der gleichzeitigen Anwendung von Ondansetron und Anästhetika bei Patienten mit Herzrhythmusstörungen oder Leitungsstörungen und bei Patienten, die Antiarrhythmika oder Betablocker erhalten, Vorsicht geboten. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder GlucoseGalactose-Malabsorption sollten Ondansetron Winthrop 4 mg bzw. 8 mg Filmtabletten nicht einnehmen. Pädiatrische Population Bei pädiatrischen Patienten, die Ondansetron zusammen mit lebertoxischen Chemotherapeutika erhalten, sollte die Leberfunktion engmaschig überwacht werden. Übelkeit und Erbrechen infolge von Chemotherapie (CINV) Wird die Dosis nach Körpergewicht in mg/kg berechnet und dreimal in 4-stündigen Abständen verabreicht, ergibt sich eine höhere Tagesgesamtdosis als bei der Einmalgabe von 5 mg/m2 mit anschließender oraler Einnahme. Die Wirksamkeit dieser beiden unterschiedlichen Mat.‐Nr.:328960 5 Dosierungsschemata wurde bislang nicht in klinischen Studien verglichen. Ein Vergleich verschiedener Studien deutet darauf hin, dass beide Verabreichungsarten ähnlich gut wirksam sind (siehe Abschnitt 5.1). 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Es gibt keinen Hinweis darauf, dass Ondansetron die Metabolisierung von anderen Arzneimitteln, mit denen es häufig gleichzeitig angewendet wird, induziert oder inhibiert. In spezifischen Studien kam es nicht zu Wechselwirkungen zwischen Ondansetron und Alkohol, Temazepam, Furosemid, Alfentanil, Tramadol, Morphin, Lidocain, Propofol und Thiopental. Ondansetron wird über mehrere Isoenzyme des hepatischen Cytochrom-P450-Systems verstoffwechselt: CYP3A4, CYP2D6 und CYP1A2. Aufgrund der verschiedenen Enzyme, die an der Verstoffwechslung von Ondansetron beteiligt sind, wird die Hemmung oder verminderte Aktivität eines Enzyms (z. B. genetisch bedingter CYP2D6-Mangel) in der Regel durch andere Enzyme kompensiert und sollte einen nur geringen bzw. nicht relevanten Einfluss auf die Gesamtclearance oder die benötigte Dosis von Ondansetron haben. Phenytoin, Carbamazepin und Rifampicin: Bei Patienten, die potente CYP3A4-Induktoren (Phenytoin, Carbamazepin und Rifampicin) erhielten, waren die orale Clearance von Ondansetron erhöht und die Blutspiegel vermindert. Tramadol: Daten aus klein angelegten Studien weisen darauf hin, dass Ondansetron den analgetischen Effekt von Tramadol mindern kann. Die Anwendung von Ondansetron zusammen mit Arzneimitteln, die die QT-Zeit verlängern, kann die QT-Zeit-Verlängerung weiter verstärken. Die gleichzeitige Gabe von Ondansetron und kardiotoxischen Arzneimitteln (z. B. Anthracycline, wie Doxorubicin, Daunorubicin oder Trastuzumab), Antiinfektiva (wie Erythromycin oder Ketoconazol), Antiarrhythmika (wie Amiodaron) und Betablocker (wie Atenolol oder Timolol) kann das Risiko für Herzrhythmusstörungen erhöhen (siehe Abschnitt 4.4). In Post-Marketing-Berichten wurden Patienten mit Serotonin-Syndrom (einschließlich verändertem Bewusstseinszustand, autonomer Instabilität und neuromuskulären Auffälligkeiten) nach gleichzeitiger Anwendung von Ondansetron mit anderen serotonergen Arzneimitteln (wie SSRIs und SNRIs) beschrieben (siehe Abschnitt 4.4). Apomorphin: Aufgrund von Berichten über starken Blutdruckabfall und Bewusstseinsverlust bei Anwendung von Ondansetron zusammen mit Apomorphinhydrochlorid ist die gleichzeitige Anwendung mit Apomorphin kontraindiziert. 4.6 Schwangerschaft und Stillzeit Schwangerschaft Über die Anwendung in der Schwangerschaft liegen keine hinreichenden Daten vor. Daher wird eine Anwendung in der Schwangerschaft nicht empfohlen. Relevante epidemiologische Studien sind nicht vorhanden. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte schädigende Wirkungen in Hinblick auf die Schwangerschaft, die embryo-fetale Entwicklung, den Geburtsvorgang oder die postnatale Entwicklung. Ondansetron darf während der Schwangerschaft, vor allem in den ersten drei Monaten, nur nach sorgfältiger Nutzen/Risiko-Abwägung angewendet werden. Mat.‐Nr.:328960 6 Stillzeit Untersuchungen haben gezeigt, dass Ondansetron bei laktierenden Tieren in die Milch übergeht (siehe Abschnitt 5.3). Es wird daher empfohlen, dass Mütter, die Ondansetron einnehmen, ihre Säuglinge nicht stillen. 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen Bei psychomotorischen Tests hat Ondansetron weder zu einer Leistungsminderung geführt noch sedierend gewirkt. Von den pharmakologischen Eigenschaften des Wirkstoffs Ondansetron kann eine nachteilige Wirkung auf diese Fähigkeiten nicht abgeleitet werden. 4.8 Nebenwirkungen Die unerwünschten Ereignisse sind weiter unten aufgeführt und nach Organklassen und Häufigkeit gelistet. Die Häufigkeiten sind folgendermaßen definiert: sehr häufig (≥ 1/10), häufig (≥ 1/100 bis < 1/10), gelegentlich (≥ 1/1.000 bis < 1/100), selten (≥ 1/10.000 bis < 1/1.000) und sehr selten (< 1/10.000), einschließlich gemeldeter Einzelfälle. Sehr häufig, häufig und gelegentlich auftretende Ereignisse wurden im Allgemeinen in klinischen Studien beobachtet. Die Häufigkeit dieser Ereignisse unter Placebo wurde berücksichtigt. Selten und sehr selten auftretende Ereignisse wurden im Allgemeinen nach Marktzulassung spontan gemeldet. Die folgenden Häufigkeitsangaben stützen sich auf die empfohlenen Standarddosierungen von Ondansetron bezogen auf Indikation und Darreichungsform. Das Nebenwirkungsprofil bei Kindern und Jugendlichen ist dem, das bei Erwachsenen beobachtet wird, vergleichbar. Erkrankungen des Immunsystems Selten: allergische, manchmal schwere Sofortreaktionen, einschließlich Anaphylaxie. Erkrankungen des Nervensystems Sehr häufig: Kopfschmerzen. Gelegentlich: Krampfanfälle, Bewegungsstörungen (einschließlich extrapyramidale Reaktionen wie okulogyre Krise, dystonische Reaktionen und Dyskinesien)1. Selten: Schwindel bei schneller intravenöser Injektion. Augenerkrankungen Selten: vorübergehende Sehstörungen (z. B. Verschwommensehen) bei intravenöser Injektion2. Sehr selten: vorübergehende Erblindung, vor allem bei intravenöser Anwendung. Herzerkrankungen Gelegentlich: Arrhythmien, Brustschmerz mit oder ohne ST-Strecken-Senkung, Bradykardie. Selten: QTc-Verlängerung (einschließlich Torsade de pointes). Gefäßerkrankungen Häufig: Wärmegefühl oder Flush. Gelegentlich: Hypotonie. Erkrankungen der Atemwege, des Brustraums und Mediastinums Gelegentlich: Schluckauf. Erkrankungen des Gastrointestinaltrakts Häufig: Obstipation. Leber- und Gallenerkrankungen Mat.‐Nr.:328960 7 Gelegentlich: asymptomatischer Anstieg der Leberwerte3. Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig: lokale Irritation an der Einstichstelle bei i. v.-Injektion 1 Ohne eindeutigen Hinweis auf dauerhafte klinische Folgeerscheinungen beobachtet. 2 In den meisten Fällen ging die Erblindung innerhalb von 20 Minuten wieder zurück. Die meisten Patienten hatten Chemotherapeutika erhalten, darunter auch Cisplatin. In einigen Fällen war die vorübergehende Erblindung kortikalen Ursprungs. 3 Diese Nebenwirkung wurde häufig bei Patienten unter Chemotherapie mit Cisplatin beobachtet. Pädiatrische Population Das Nebenwirkungsprofil bei Kindern und Jugendlichen war dem von Erwachsenen vergleichbar. Meldung des Verdachts auf Nebenwirkungen Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de anzuzeigen. 4.9 Überdosierung Anzeichen und Symptome Die Erfahrungen über eine Überdosierung mit Ondansetron sind begrenzt. In der Mehrzahl der Fälle stimmten die Symptome mit denjenigen überein, die bei der Gabe von empfohlenen Dosierungen beobachtet wurden (siehe Abschnitt 4.8). Die gemeldeten Manifestationen waren Sehstörungen, schwere Obstipation, Hypotonie und eine vasovagale Episode mit vorübergehendem AV-Block 2. Grades. Ondansetron verlängert dosisabhängig das QT-Intervall. Im Fall einer Überdosierung wird eine EKG-Überwachung empfohlen. Therapie Es gibt kein spezifisches Antidot für Ondansetron. Bei Verdacht auf eine Überdosierung ist daher, falls notwendig, eine geeignete symptomatische und unterstützende Therapie einzuleiten. Die Anwendung von Ipecacuanha zur Behandlung einer Ondansetron-Überdosierung wird nicht empfohlen, da eine Wirkung bei den Patienten aufgrund der antiemetischen Wirkung von Ondansetron nicht zu erwarten ist. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Antiemetika und Mittel gegen Übelkeit, Serotonin(5-HT3-)Antagonisten, ATC-Code: A04AA01. Ondansetron ist ein potenter, hoch selektiver 5-HT3-Rezeptorantagonist. Mat.‐Nr.:328960 8 Der genaue Wirkmechanismus von Ondansetron gegen Übelkeit und Erbrechen ist nicht bekannt. Chemotherapeutika und Strahlentherapie können eine Freisetzung von 5-HT im Dünndarm verursachen und so durch die Aktivierung afferenter Vagusnerven über 5-HT3-Rezeptoren einen Brechreiz auslösen. Ondansetron blockiert die Auslösung dieses Reizes. Die Aktivierung afferenter Vagusnerven kann auch zu einer Freisetzung von 5-HT in der Area postrema am Boden des 4. Ventrikels führen, die über einen zentralen Mechanismus Erbrechen provozieren kann. Die Wirkung von Ondansetron bei der Behandlung von Übelkeit und Erbrechen, die durch zytotoxische Chemotherapie und Strahlentherapie hervorgerufen werden, beruht daher vermutlich auf der Antagonisierung der 5-HT3-Rezeptoren an Neuronen, die sowohl im peripheren als auch im zentralen Nervensystem zu finden sind. Der Wirkmechanismus bei Übelkeit und Erbrechen nach Operationen ist nicht bekannt, ist jedoch wahrscheinlich derselbe wie bei Übelkeit und Erbrechen, die durch Zytostatika hervorgerufen werden. In einer pharmakopsychologischen Studie mit Probanden hatte Ondansetron keinen sedierenden Effekt. Ondansetron hat keinen Einfluss auf die Prolaktinkonzentrationen im Plasma. Die Rolle von Ondansetron bei Opiat-induziertem Erbrechen wurde noch nicht untersucht. Klinische Studien Pädiatrische Population Übelkeit und Erbrechen infolge von Chemotherapie (CINV) Die Wirksamkeit von Ondansetron gegen Übelkeit und Erbrechen infolge von Chemotherapie bei Krebserkrankungen wurde in einer doppelblinden, randomisierten Studie mit 415 Patienten im Alter von 1 bis 18 Jahren untersucht. An den Chemotherapietagen erhielten die Patienten entweder Ondansetron 5 mg/m2 i. v. + Ondansetron 4 mg p. o. nach 8–12 Stunden oder Ondansetron 0,45 mg/kg i. v. + Placebo p. o. nach 8–12 Stunden. Nach der Chemotherapie erhielten beide Gruppen drei Tage lang zweimal täglich 4 mg Ondansetron-Sirup. Das Erbrechen konnte damit jeweils am schlimmsten Tag der Chemotherapie bei 49 % mit 5 mg/m2 i. v. + Ondansetron 4 mg p. o. bzw. bei 41 % mit 0,45 mg/kg i. v. + Placebo p. o. vollständig unterdrückt werden. Nach der Chemotherapie erhielten beide Gruppen drei Tage lang zweimal täglich 4 mg Ondansetron-Sirup. In einer doppelblinden, randomisierten, placebokontrollierten Studie mit 438 Teilnehmern im Alter von 1 bis 17 Jahren konnte das Erbrechen am jeweils schlimmsten Tag der Chemotherapie bei73 % der Patienten vollständig unterdrückt werden, wenn Ondansetron intravenös in einer Dosis von 5 mg/m2 i. v. zusammen mit 2–4 mg Dexamethason p. o. verabreicht wurde, sowie bei 71 % der Patienten, denen Ondansetron an den Chemotherapietagen als Sirup in einer Dosierung von 8 mg + 2–4 mg Dexamethason p. o. verabreicht wurde. Nach der Chemotherapie erhielten beide Gruppen zwei Tage lang zweimal täglich 4 mg Ondansetron-Sirup. Die Wirksamkeit von Ondansetron wurde in einer unverblindeten, nicht vergleichenden, einarmigen Studie (S3A40320) an 75 Kindern im Alter von 6 bis 48 Monaten untersucht. Alle Kinder erhielten drei Gaben von 0,15 mg/kg Ondansetron i. v., und zwar 30 Minuten vor dem Beginn der Chemotherapie sowie vier Stunden und acht Stunden nach der ersten Dosis. Das Erbrechen konnte bei 56 % der Patienten vollständig unterdrückt werden. In einer weiteren unverblindeten, nicht vergleichenden, einarmigen Studie (S3A239) wurde die Wirksamkeit einer einmaligen intravenösen Gabe von 0,15 mg/kg Ondansetron mit darauffolgender zweimaliger oraler Gabe von 4 mg Ondansetron bei Kindern unter 12 Jahren bzw. von 8 mg Ondansetron bei Kindern über 12 Jahren (insgesamt n = 28 Kinder) untersucht. Das Erbrechen konnte bei 42 % der Patienten vollständig unterdrückt werden. Mat.‐Nr.:328960 9 Vorbeugung von Übelkeit und Erbrechen nach Operationen (PONV) Die Wirksamkeit einer Einmalgabe Ondansetron bei der Vorbeugung von Übelkeit und Erbrechen nach Operationen wurde in einer randomisierten, doppelblinden, placebokontrollierten Studie mit 670 Kindern im Alter von 1 bis 24 Monaten (Konzeptionsalter ≥ 44 Wochen, Gewicht ≥ 3 kg) untersucht. Die Teilnehmer unterzogen sich unter Vollnarkose einer geplanten, elektiven Operation und hatten einen ASA-Status ≤ III. Innerhalb von 5 Minuten nach der Narkoseeinleitung wurde eine Einmalgabe Ondansetron von 0,1 mg/kg verabreicht. Der Anteil der Patienten, die während des 24-stündigen Untersuchungszeitraums (ITT) unter mindestens einer emetischen Episode litten, war bei den mit Placebo behandelten Patienten größer als bei den mit Ondansetron behandelten (28 % vs. 11 %, p < 0,0001). 5.2 Pharmakokinetische Eigenschaften Ondansetron wird nach oraler Gabe passiv und vollständig aus dem Magen-Darm-Trakt resorbiert und unterliegt einem First-Pass-Metabolismus (die Bioverfügbarkeit liegt bei etwa 60 %). Die Spitzenkonzentration im Plasma von etwa 30 ng/ml wird etwa 1,5 Stunden nach Anwendung von 8 mg Ondansetron erreicht. Bei Dosierungen über 8 mg ist der Anstieg der systemischen Exposition überproportional; dies kann eine Minderung des First-Pass-Metabolismus bei höherer oraler Dosierung widerspiegeln. Die orale Bioverfügbarkeit ist bei Vorliegen von Nahrung geringfügig gesteigert, bleibt jedoch unbeeinflusst durch Antacida. Studien mit gesunden, älteren Probanden zeigten eine geringfügige, aber klinisch nicht signifikante, altersbezogene Steigerung der oralen Bioverfügbarkeit (65 %) und eine Verlängerung der Halbwertszeit (5 Stunden) von Ondansetron. Geschlechtsspezifische Unterschiede zeigten sich hinsichtlich der Verfügbarkeit von Ondansetron. Bei Frauen waren nach oraler Gabe das Ausmaß und die Rate der Resorption höher und die systemische Clearance sowie das Verteilungsvolumen (bezogen auf das Gewicht) niedriger. Die Verfügbarkeit von Ondansetron nach oraler, intramuskulärer und intravenöser Gabe ist vergleichbar bei einer terminalen Halbwertszeit von etwa 3 Stunden und einem Verteilungsvolumen von etwa 140 l im Steady State. Die systemische Exposition ist nach intramuskulärer und intravenöser Anwendung von Ondansetron gleich. Ondansetron bindet zu 70–76 % an Plasmaproteine. Ein direkter Zusammenhang zwischen der Plasmakonzentration und dem antiemetischen Effekt wurde nicht nachgewiesen. Die systemische Clearance von Ondansetron erfolgt hauptsächlich über verschiedene Leberenzyme. Weniger als 5 % der resorbierten Dosis werden unverändert mit dem Urin ausgeschieden. Ein Mangel an dem Stoffwechselenzym CYP2D6 hat keinen Einfluss auf die Pharmakokinetik von Ondansetron. Die Pharmakokinetik von Ondansetron bleibt bei wiederholter Anwendung unverändert. Spezielle Patientengruppen: Pädiatrische Population Kinder und Jugendliche (1 Monat bis 17 Jahre) Bei pädiatrischen Patienten im Alter von 1 bis 4 Monaten (n = 19), die einer Operation unterzogen wurden, war die körpergewichtsnormierte Clearance im Vergleich zu Patienten im Alter von 5 bis 24 Monaten (n = 22) um 30 % verlangsamt, jedoch vergleichbar mit Patienten im Alter von 3 bis 12 Jahren. Die Halbwertszeit betrug bei den 1 bis 4 Monate alten Patienten durchschnittlich 6,7 Stunden, verglichen mit 2,9 Stunden bei den Patienten, die 5 bis 24 Monate bzw. 3 bis 12 Jahre alt waren. Die Unterschiede der pharmakokinetischen Parameter bei der Altersgruppe von 1 bis 4 Monaten lassen sich teilweise anhand des höheren Gesamtkörperwasser-Anteils bei Neugeborenen und Säuglingen sowie des größeren Verteilungsvolumens für wasserlösliche Arzneimittel wie Ondansetron erklären. Bei pädiatrischen Patienten im Alter von 3 bis 12 Jahren, die unter Vollnarkose einer elektiven Operation unterzogen wurden, waren die Absolutwerte sowohl der Clearance als auch des Verteilungsvolumens für Ondansetron niedriger als bei erwachsenen Patienten. Beide Parameter nahmen linear mit dem Gewicht zu. Ab einem Alter von 12 Jahren näherten sich die Werte denen junger Erwachsener an. Bei Normierung der Werte für Clearance und Verteilungsvolumen nach Mat.‐Nr.:328960 10 Körpergewicht waren die Werte für die genannten Parameter beim Vergleich der verschiedenen Altersgruppen ähnlich. Durch gewichtsbezogene Dosierung lassen sich altersbedingte Veränderungen ausgleichen und die systemische Belastung bei Kindern normalisieren. Pharmakokinetische Populationsanalysen wurden bei 74 pädiatrischen Krebspatienten im Alter von 6 bis 48 Monaten und 41 operierten Patienten im Alter von 1 bis 24 Monaten nach intravenöser Ondansetron-Gabe durchgeführt. Ausgehend von den pharmakokinetischen Parametern der Patientenpopulation im Alter von 1 bis 48 Monaten würde die Verabreichung einer auf dem Gewicht eines Erwachsenen basierenden Dosis (3 Dosen mit 0,15 mg/kg i. v. alle 4 Stunden) eine systemische Exposition (AUC) zur Folge haben, die derjenigen bei pädiatrischen operierten Patienten (5 bis 24 Monate), pädiatrischen Krebspatienten (4 bis 18 Jahre) und operierten Patienten (3 bis 12 Jahre) unter ähnlichen Dosierungen vergleichbar ist, wie aus Tabelle C zu entnehmen ist. Diese Exposition (AUC) entspricht der bei pädiatrischen Krebspatienten bereits vorher beschriebenen Dosis-WirkungsBeziehung, die eine Ansprechrate von 50–90 % bei AUC-Werten von 170 bis 250 ng.h/ml zeigte. Tabelle C. Pharmakokinetik bei pädiatrischen Patienten im Alter von 1 Monat bis 18 Jahre AUC Patientengruppe (intravenöse Dosis) Studie S3A403191 S3A403192 S3A40320 & S3A40319 Pop PK2, 3 S3KG024 Operation (0,1 oder 0,2 mg/kg) Operation (0,1 oder 0,2 mg/kg) Krebs/Operation (0,15 mg/kg alle 4 h/ 0,1 oder 0,2 mg/kg) Operation (2 mg oder 4 mg) Alter N CL Vdn (ng.h/ (L/h/kg) (L/kg) L) geometrischer Mittelwert t1/2 (h) Mitte lwert 1 bis 4 Monate 19 360 0,401 3,5 6,7 5 bis 24 Monate 22 236 0,581 2,3 2,9 1 bis 48 Monate 115 257 0,582 3,65 4,9 21 240 0,439 1,65 2,9 3 bis 12 Jahre S3A-150 Krebs 4 bis 18 21 247 0,599 1,9 2,8 (0,15 mg/kg alle Jahre 4 h) 1 Ondansetron-Einmalgabe i. v.: 0,1 oder 0,2 mg/kg. 2 Pharmakokinetische Patientenpopulation: 64 % Krebspatienten und 36 % operierte Patienten. 3 Gezeigt sind Schätzungen für die Population; AUC basiert auf einer Dosis von 0,15 mg/kg. 4 Ondansetron-Einmalgabe i. v.: 2 mg (3 bis 7 Jahre) oder 4 mg (8 bis 12 Jahre). Patienten mit eingeschränkter Nierenfunktion Bei Patienten mit mäßiger Einschränkung der Nierenfunktion (Kreatinin-Clearance 15–60 ml/min) ist sowohl die systemische Clearance als auch das Verteilungsvolumen vermindert. Dies führt zu einer geringfügigen, aber klinisch nicht signifikanten Verlängerung der Eliminationshalbwertszeit (5,4 Stunden). In einer Studie mit Patienten mit schwerer Einschränkung der Nierenfunktion, die eine regelmäßige Hämodialyse benötigten (und zwischen den Dialysesitzungen untersucht wurden), war die Pharmakokinetik von Ondansetron im Wesentlichen unverändert. Mat.‐Nr.:328960 11 Patienten mit eingeschränkter Leberfunktion Bei Patienten mit schwerer Einschränkung der Leberfunktion ist die systemische Clearance von Ondansetron nach oraler, intravenöser oder intramuskulärer Gabe deutlich vermindert mit verlängerter Eliminationshalbwertszeit (15–32 Stunden) und einer oralen Bioverfügbarkeit von etwa 100 % infolge der verminderten präsystemischen Verstoffwechslung. 5.3 Präklinische Daten zur Sicherheit Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, chronischen Toxizität, Genotoxizität und zum kanzerogenen Potenzial lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Ondansetron und dessen Metaboliten werden bei Ratten in der Milch in einem Milch/PlasmaVerhältnis von 5,2 :1 angereichert. Eine Studie an geklonten, menschlichen kardialen Ionenkanälen hat gezeigt, dass Ondansetron das Potenzial besitzt, die kardiale Repolarisierung über eine Blockade der HERG-Kaliumkanäle zu beeinflussen. Die klinische Relevanz dieses Befundes ist unklar. 6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile Tablettenkern: Mikrokristalline Cellulose Lactose-Monohydrat Vorverkleisterte Maisstärke Magnesiumstearat (Ph. Eur.) Filmüberzug: Hypromellose Hyprolose Propylenglycol Sorbitanoleat Sorbinsäure (Ph. Eur.) Vanillin Titandioxid (E 171) Chinolingelb (E 104) 6.2 Inkompatibilitäten Nicht zutreffend. 6.3 Dauer der Haltbarkeit 3 Jahre. 6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich. Mat.‐Nr.:328960 12 6.5 Art und Inhalt des Behältnisses PVC/Al-Blisterpackungen. 4 mg: Packungen mit 6, 10, 30, 50 und 100 Filmtabletten. 8 mg: Packungen mit 10, 15, 30, 50 und 100 Filmtabletten. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. 6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung Keine besonderen Anforderungen. 7. INHABER DER ZULASSUNG Winthrop Arzneimittel GmbH 65927 Frankfurt am Main Mitvertrieb Zentiva Pharma GmbH 65927 Frankfurt am Main Telefon: (01 80) 2 02 00 10* Telefax: (01 80) 2 02 00 11* 8. ZULASSUNGSNUMMERN Ondansetron Winthrop 4 mg Filmtabletten Ondansetron Winthrop 8 mg Filmtabletten 65392.00.00 65393.00.00 9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 20.06.2006/24.05.2011 10. STAND DER INFORMATION Dezember 2013 11. VERKAUFSABGRENZUNG Verschreibungspflichtig. ______________________________ *0,06 €/Anruf (dt. Festnetz); max. 0,42 €/min (Mobilfunk). Mat.‐Nr.:328960 13