Zusammenfassung
Werbung

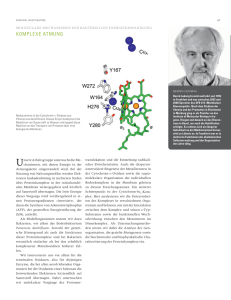
Zusammenenfassung der von Dipl.-Biol. Caroline E. Chwieralski eingereichten Dissertation mit dem Titel "Untersuchungen zur biologischen Funktion von TFF-Peptiden in vivo und in vitro" Die "TFF-Domäne" ("Trefoil Factor Family"-Domäne; früher: P-Domäne, "trefoil"-Domäne) besteht aus etwa 40 Aminosäureresten, in denen sechs konservierte Cystein-Reste durch intramolekulare Disulfidbrücken in einer 1 - 5, 2 - 4 und 3 - 6 Konfiguration verbunden sind. Sie lassen in einer zweidimensionalen Darstellung eine Kleeblatt-ähnliche Struktur erkennen. Der 7. Cysteinrest von TFF1 und TFF3 bildet eine intermolekulare Disulfidbrücke und ist für die Dimerisierung dieser Peptide verantwortlich. In der Klasse der Mammalia wurden bisher drei TFF-Peptide nachgewiesen, die beim Menschen als TFF1, TFF2 und TFF3 bezeichnet werden. TFF-Peptide sind typische Produkte von Muzin-sezernierenden Zellen und dienen dem Schutz und dem Erhalt der Oberflächenintegrität muköser Epithelien. Einerseits interagieren TFFPeptide mit Muzinen und andererseits aktivieren sie bestimmte Signalkaskaden; damit steuern sie diverse molekulare Prozesse wie Zellmigration (Restitution), Apoptose, Entzündungen und Angiogenese. TFF-Peptide werden bei chronisch entzündlichen Krankheiten wie z. B. Morbus-Crohn und Colitis ulcerosa abnormal exprimiert. Ausserdem sind sie Neuropeptide, die auch das Verhalten steuern können. Die zentrale Fragestellung zu Beginn dieser Arbeit war daher, welche molekulare Wirkungen TFF-Peptide haben können (diverse Zell-Linien als in vitro-Modelle); parallel dazu wurde die Biosynthese von TFF-Peptiden im Mäusestamm C57BL/6- und transgenen TFF3(-/-)-Mäusen sowie einem murinen Asthmamodell untersucht (in vivo-Modelle). Im ersten Teil dieser Arbeit wurde die Wirkung an einem in vitro-Differenzierungsmodell getestet, nämlich der Zell-Linie PC12. Es konnte gezeigt werden, dass die Kombination von EGF und TFF-Peptiden zu einem differenzierten Phänotyp von PC12Zellen führte, der nach drei Tagen neuriten-ähnliche Fortsätze ausbildete. Bei alleiniger Zugabe von EGF oder einem TFFPeptid konnte dieser Effekt nicht beobachtet werden. Durch Kombination von TFF3 und EGF konnte eine vermehrte Expression der klassischen Differenzierungsgene MMP-3 und VGF nachgewiesen werden, sowie eine erhöhte ERK-1/2Aktivierung. Als in vitro-Modell für multiple-endokrine Neoplasien wurden PC12/ret+MEN-Transfektanten untersucht; sie wiesen eine geänderte TFF-Expression im Vergleich zu den nicht-transfizierten PC12-Zellen auf. In einem weiteren Ansatz wurde der motogene Effekt auf die epitheliale bronchiale Zell-Linie BEAS-2B untersucht. Mittels haptotaktischer Migration in modifizierten Boyden-Kammern konnte ein chemokinetischer sowie eine -taktischer Effekt beobachtet werden. Unter Verwendung entsprechender Inhibitoren und verschiedener ECM-Substrate konnte eine Abhängigkeit von PKCa und Integrinen nachgewiesen werden. Ebenso wurde ein synergistischer, bzw. additiver motogener Effekt von EGF und TFF2 sowie von hTNF-a und TFF2 beobachtet. Außerdem konnte mit Hilfe des MTT-Testes gezeigt werden, dass die Zugabe vollständiger TFF-Peptide die Zellvitalität steigerte, die Verwendung C-terminaler TFF3-Fragmente diese dagegen senkte. Parallel dazu konnte mit diesen TFF3-Fragmenten die Interleukin 6- und IL-8- Sekretion induzieren werden; auch hier ergab sich ein additiver Effekt mit hTNF-a. Diese Ergebnisse weisen auf eine mögliche entzündungsmodulierende Funktion von TFF-Peptiden hin. Als TFF-aktivierte Signalwege wurden vor allem ERK-1/2 und JNK in BEAS-2B-Zellen erkannt; im Gegensatz dazu konnte in der intestinalen epithelialen Zell-Linie IEC-6 gezeigt werden, dass vermutlich PKCµ, ERK-1/2- sowie der NF-kB/IkB-Signalweg nach TFF-Stimulation involviert sind. Parallel dazu wurde untersucht, ob TFFPeptide die Expression typischer Entzündungsvorgänge beeinflussen können. Dabei konnte keine vermehrte Expression der untersuchten Gene nachgewiesen werden. Nur in der intestinalen Zell-Linie IEC-6 konnte eine vermehrte MIP-2Expression nach TFF3- und hTNF-a- Stimulation beobachtet werden. Im zweiten Teil dieser Arbeit wurde die TFFBiosynthese in C57BL/6- und transgenen TFF3(-/-)-Mäusen, sowie in einem murinen Asthma-Modell untersucht. Im Rahmen dieser Untersuchungen erfolgte auch eine Kartierung der TFF-Expression in der Maus. Dabei zeigten sich Unterschiede zum menschlichen Expressionsmuster. Die mit Aspergillus fumigatus (AF)-Extrakten behandelten Mäuse zeigten neben asthmatischen und entzündlichen Merkmalen auch eine erhöhte TFF1- und verminderte Ependymin/MERP2-Expression. Ebenso ist die Sekretion von TFF1 und TFF2 in den Bronchien der AF-Mäuse induziert. Somit sind erste Hinweise für eine direkte Involvierung von TFF-Peptiden bei entzündlichen Vorgängen in der Lunge an einem in vivoModell gesammelt worden. Im Rahmen dieser Arbeit konnten auch zum ersten Mal Unterschiede in der Wirkungsweise von TFF2 und TFF3 gesammelt werden. Ebenso konnte gezeigt werden, dass es offensichtlich Unterschiede in der TFFvermittelten Signalkaskade bei einzelnen in vitro-Zellkulturmodellen gibt. Dies könnte die unterschiedlichen und teils widersprüchlicher Literaturangaben erklären. Die vielfältigen molekularen Funktionen von TFF-Peptiden lassen die Existenz eines TFF-Rezeptors vermuten, dessen molekulare Charakterisierung steht aber noch aus. Zukünftige Untersuchungen sollten die genauen Vorgänge an TFF-Rezeptoren aufklären.