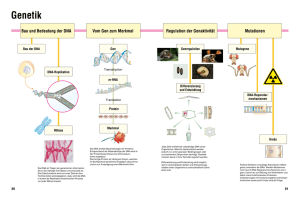
Pränataldiagnostik
Werbung

20.11.2002 Katja Rey, Jan Grolmus, Christian Menzel Biochemisches Praktikum Kurstag: Pränatale Diagnostik I. Aufgaben und Ziele pränataler Diagnostik Als pränatale Diagnostik (PND) bezeichnet man invasive oder nicht-invasive Untersuchungen des ungeborenen Kindes. Auf diese Weise können fötale Fehlentwicklungen und Anomalien frühzeitig erkannt und wenn möglich noch im Mutterleib (z.B. medikamentös) behandelt werden. Im Idealfall wird so die Manifestation einer Krankheit verhindert. Da allerdings vor allem bei den invasiven Methoden der PND auch gewisse Risiken bestehen, sollte eine PND nur unter bestimmten Vorraussetzungen durchgeführt werden. Dazu gehören: - hohes Alter der Mutter - vererbbare Krankheiten bei Eltern, Geschwistern oder anderen Verwandten - frühere Aborte unklarer Ursache - u.a. Eltern, bei denen eine sog. Risikoschwangerschaft nach den o.g. Punkten vorliegt, können somit schon in einer frühen Schwangerschaftsphase Gewissheit darüber erlangen, ob die Entwicklung des Kindes normal verläuft oder nicht. Bei einem pathologischen Befund mit Hilfe der PND stellt sich je nach Schwere der diagnostizierten Krankheit die Frage eines Schwangerschaftsabbruches, wobei die Entscheidungskompetenz darüber allein bei den betroffenen Eltern liegt. Die Vorteile einer möglichst frühen Krankheitsdiagnose sind offensichtlich - dennoch sollen im Verlauf des Protokolls auch Risiken der pränatalen Diagnostik und ethische Probleme zur Sprache kommen. II. Methodik und Ethik Invasive Methoden der PND: Amniozentese: Punktion der Amnionhöhle und Entnahme von Fruchtwasser. Der Eingriff wird entweder durch die Bauchdecke oder transzervical durchgeführt. Meist wird von den im Fruchtwasser befindlichen embryonalen Zellen zu diagnostischen Zwecken eine Kurz- oder Langzeitkultur angelegt. Die Amniozentese kann ab der 15. Schwangerschaftswoche durchgeführt werden. Mögliche Komplikationen sind Verletzungen von Fötus, Nabelschnurgefäßen oder Plazenta, was wiederum zu einer Fehlgeburt führen kann. Die Gefahr eines Aborts kann durch ständige Ultraschallkontrolle während des Eingriffes jedoch auf ein Minimum reduziert werden. Neben der Feststellung von numerischen oder strukturellen Chromosomenaberrationen können mit Hilfe der Amniozentese bis zu 60 Stoffwechselkrankheiten diagnostiziert werden. 1 Chorionzottenbiopsie: Transcervicale oder transabdominale Biopsie des Chorion frondosum der Plazenta in der 7. – 12. Schwangerschaftswoche mit Hilfe spezieller Katheter unter Ultraschallkontrolle zur Gewinnung von Trophoblastzellen. Diese Methode hat den Vorteil, dass man sie früher als die Amniozentese durchführen kann und dass keine langwierigen Zellkultivierungen nötig sind. Sie ist jedoch für den Embryo und den weiteren Verlauf der Schwangerschaft riskanter. So liegt das Abortrisiko bei der Chorionzottenbiopsie etwa 8 mal höher als bei der Amniozentese. Nabelschnurpunktion (Chordozentese): Transabdominale Punktion der Nabelschnurgefäße ab der 19. Schwangerschaftswoche. Dadurch ist unter anderem möglich: - Bestimmung des Hämoglobingehalt - Blutgruppenfeststellung - Untersuchung auf Antikörper und evtl. Viren-DNA - Erstellung eines Karyogramms (Feststellung von Chrmosomenaberrationen). Fetoskopie: Direkte intrauterine Betrachtung des Fötus mit Hilfe eines Glasfasertubus. Die Gefahr eines Aborts liegt bei ca. 3 – 5%. Die Fetoskopie wurde jedoch weitgehend durch Ultraschalldiagnostik ersetzt. Die Fetoskopie dient dem Ausschluss von morphologisch erkennbaren Besonderheiten der äußeren Körperform und wird meist zwischen der 18. und der 20. Schwangerschaftswoche durchgeführt. Nicht-invasive Methoden: Ultraschalldiagnostik: Mit dem Ultraschallgerät können Körperstrukturen unterschiedlicher Dichte (und der daraus resultierenden unterschiedlichen Reflexion der Schallwellen) sichtbargemacht werden. Mit Ultraschall kann bereits ab der 5. Schwangerschaftswoche die Morphologie und Biometrie der Amnion- und Chorionhöhle untersucht werden. Embryonale Strukturen lassen sich ab der 7. Schwangerschaftswoche erkennen, ebenso wie Skelettanomalien oder Fehlbildungen der inneren Organe. Diese Art der Untersuchung stellt keinerlei Gefahr für Fötus oder Mutter dar. Nebenwirkungen oder negative Langzeitwirkungen sind nicht bekannt. Blutuntersuchung des mütterlichen Serums: Eine Proteinbestimmung im mütterlichen Serum kann Hinweise auf eine mögliche Entwicklungsstörung des Fötus geben. Hier muss besonders das Alpha-Fetoprotein genannt werden, da erhöhte AFP-Werte auf schwere Fehlbildungen im Bereich des Gehirns und des Neuralrohrs hinweisen. Ein erniedrigter AFP-Spiegel deutet hingegen auf eine chromosomale Aberration hin, wie z.B. die Trisomie 21 (Down-Syndrom). Ethische Probleme der PND Die Meinungen bezüglich pränataler Diagnostik divergieren extrem. In engem Zusammenhang mit dieser Problematik steht auch die Frage der Zulässigkeit von Schwangerschaftsabbrüchen. Nicht ohne Grund wird der §218 StGB immer wieder heftig diskutiert. 2 Dank der PND können heute Krankheiten vor der Geburt ausgeschlossen werden. Abtreibungen, die bisher auf bloßen Verdacht hin durchgeführt wurden, werden auf diese Weise verhindert. Kritiker hingegen argumentieren, dass PND häufig einen Schwangerschaftsabbruch zur Folge hat. Diese bedenkliche Entwicklung wirft die Frage auf, ob Menschen überhaupt in der Lage sind, zu beurteilen, ab wann Leben lebenswert ist. Bei dieser Thematik spielen auch religiöse Aspekte eine nicht zu unterschätzende Rolle. Auch wenn dies beinahe unmöglich erscheint, so ist es doch Aufgabe des Gesetzgebers, den Rahmen für die Anwendung der pränatalen Diagnostik zu schaffen. Besonders wichtig ist hierbei, dass Gesetze den medizinischen Fortschritt nicht behindern, einem möglichen Missbrauch der PND jedoch Einhalt gebieten. III. Muskeldystrophien Muskeldystrophie Duchenne Muskeldystrophie Duchenne ist eine X-chromosomal rezessiv vererbte Krankheit (betrifft überwiegend das männliche Geschlecht), die durch fortschreitende Atrophie quergestreifter Muskulatur gekennzeichnet ist. Betroffen sind vor allem Rumpf-, Schulter- und Beckengürtelmuskulatur. Der Krankheit liegt eine Mutation im Dystrophin-Gen zu Grunde, das auf dem kurzen Arm des XChromosoms lokalisiert ist. Das Protein Dystrophin ist Bestandteil des Cytoskeletts. Dystrophinmangel führt zu abgeschwächter Muskelkontraktion, Abbau von Muskelgewebe und Ersatz durch Bindegewebe. Symptome: - Zw. 1. und 2. Lebensjahr erschwertes Laufenlernen mit erhöhter Fallneigung (Zehenspitzgang mit Spitzfuß) - Zw. 5. und 10. Lebensjahr beginnende Schwächung der Muskeln und Gelenkversteifung, Probleme beim Aufrichten - Ab 12. Lebensjahr sind die meisten Patienten auf den Rollstuhl angewiesen - Steigerung des Muskelabbaus bis hin zur völligen Pflegebedürftigkeit - Skoliosen, Hyperlordosen und daraus resultierende Atembeschwerden - Scapula alata (abstehende Schulterblätter) - Verformungen des Thorax - Übergewicht - Geistige Retardierung und Sprachstörungen - Herzmuskelprobleme. Die meisten Patienten sterben vor Erreichen des 20. Lebensjahres. Ein Drittel der Erkrankungen sind auf spontane Mutationen zurückzuführen, in den übrigen Fällen ist die Mutter des Patienten Konduktorin oder selbst erkrankt. Der Überträgerstatus der Mutter lässt sich in 70% der Fälle anhand eines erhöhten Kreatinkinasespiegels im Blutserum nachweisen. Die Muskeldystrophie Duchenne ist nach der Mukoviszidose die zweithäufigste Erbkrankheit mit einer Häufigkeit von 1 auf 3500 Geburten. Muskeldystrophie Becker Der Verlauf der Krankheit bei dieser Form der Muskeldystrophie fällt weniger schwer als bei der o.g. Form aus. 3 Hauptsächlich betroffen sind Muskelpartien im Schulter- und Beckenbereich. Am schwerwiegendsten ist die Schwächung der Herzmuskulatur mit der daraus resultierenden Herzinsuffizienz, die letztendlich zum Tode führt. Therapie bei Muskeldystrophien: Da der Gendefekt selbst nicht behoben werden kann, muss versucht werden, die Muskelkraft möglichst lange zu erhalten. Bei Muskeldystrophie Duchenne ist eine Behandlung mit Kortikoiden angezeigt. Bei Muskeldystrophie Becker ist davon jedoch abzuraten, da daraus eine zusätzliche Schwächung der bereits geschädigten Herzmuskulatur resultieren kann. Therapeutisch von Bedeutung sind außerdem: - Vermeidung von Übergewicht - psychologische Betreuung - Krankengymnastik - Atemschulung - operative Behandlung von Skoliosen - regelmäßige EKG und EMG. Gentherapeutische Ansätze wurden erfolgreich an Mäusen getestet, zeigten beim Menschen jedoch bislang keine Wirkung. IV. Gelelektrophorese Ziel der Gelelektrophorese ist, Moleküle verschiedener Größe mit Hilfe eines elektrischen Feldes in einem Gel zu trennen. Nucleinsäuren liegen bei neutralem pH polyanionisch vor, d.h. viele Phosphatgruppen im Phosphodiesterrückgrat tragen negative Ladungen. Deshalb wandern die Moleküle im elektrischen Feld auf die Anode zu, wobei die Wanderungsgeschwindigkeit der Moleküle von der Molekülgröße abhängig ist. Für die Matrix werden verschiedene Gelarten verwendet: Agarose-Gel (Grundlage: Seetang) Polyacrylamidgel. Nach der Auftrennung werden die Nucleinsäuren mit Ethidiumbromid angefärbt und somit unter UV-Licht sichtbar. Die Größe unbekannter Fragmente lässt sich abschätzen, da die im Gel zurückgelegte Wegstrecke umgekehrt proportional zum dekadischen Logarithmus der Anzahl der Basenpaare ist. V. DNA-Sequenzierung Das Ziel der DNA-Sequenzierung ist es, für einen DNA-Strang die Abfolge der einzelnen Basen zu ermitteln. Hierzu lassen sich verschiedenen Verfahren anwenden. Chemische Sequenzierung nach Maxam-Gilbert Zunächst liegt eine Vielzahl identischer DNA-Einzelstränge vor, die nun am 5'-Ende radioaktiv markiert (P) werden. 4 Vier verschiedenen Ansätzen (ein Ansatz pro Base) wird jeweils ein anderes Reagens zugesetzt, das einen Basentyp modifizieren kann. Die modifizierten Basen lösen sich daraufhin vom Strang, während das verbleibende Zucker-Phosphat-Rückgrat durch Piperidin abgespalten wird. Die Konzentration des Reagens wird so gewählt, dass durchschnittlich eine Base pro Strang verändert wird. Da jede Base mit der gleichen Wahrscheinlichkeit modifiziert wird, wird bei einer genügend großen Anzahl an Einzelsträngen an jeder möglichen Position gespalten, was zu unterschiedlich langen Fragmenten führt. Diese werden mittels der Gelelektrophorese nach Länge sortiert. Nach Durchführung einer Autoradiographie kann aus der Länge eines Fragments Rückschlüsse von der Base auf eine bestimmte Position im Strang gezogen werden. DNA-Sequenzierung nach Sanger-Coulson Dieses Verfahren beruht auf einer enzymatischen Synthese von DNA-Strängen, die mit dem Einbau eines modifizierten Nucleotids abbricht. Mit Hilfe eines Primers und einer DNA-Polymerase wird eine Kopie einer als Einzelstrang vorliegenden DNA angefertigt. Den zur DNA-Synthese vorhandenen Nucleosidtriphosphaten werden in sehr geringer Konzentration Didesoxynucleosidtriphosphate beigemischt. Jede Kette, bei der ein Molekül dieser Didesoxynucleotide eingebaut wird, kann nicht weiter verlängert werden, da keine 3’-OH-Gruppe vorhanden ist. Die Ketten werden per Gelelektrophorese getrennt und durch Autoradiographie sichtbar gemacht. Auch hier kann man auf Grund der Länge des Fragments Rückschlüsse auf die Position der Base im Strang ziehen. Aus gesundheitlichen Gründen wird heute bei der DNA-Sequenzierung auf die Verwendung radioaktiver Stoffe weitgehend verzichtet. Man bedient sich stattdessen fluoreszierender Farbstoffe. VI. Hybridisierung und Blotting Unter Hybridisierung versteht man ein Verfahren, bei dem man aus einzelsträngiger DNA wieder doppelsträngige DNA herstellt. Fluoreszenz-in-situ-Hybridisierung (FISH) Es handelt sich um eine molekularzytogenetische Technik, bei der markierte DNA-Sonden direkt auf Chromosomen hybridisiert und durch Fluoreszenz sichtbar gemacht werden. Bei der in-situ-Hybridisierung ist die DNA in den Chromosomen (Metaphase) fixiert. Es erfolgt die DNA-Denaturierung durch Erhitzung. Beim langsamen Abkühlen kommt es zur Renaturierung des DNA-Doppelstranges. Als Hybridisierung bezeichnet man die Renaturierung einer DNA mit einem hinzugefügten DNAbzw. RNA-Stück (Sonde) anstatt des ursprünglichen Partnerstrangs. Eine DNA-Sonde ist ein kleines mit einem Fluoreszenzfarbstoff markiertes DNA-Fragment, das komplementär zu einer gesuchten Sequenz (z.B. Gen) ist. Durch die langsame Abkühlung lagert sich die Sonde an den DNA-Einzelstrang an und kann mit Hilfe eines Fluoreszenzmikroskops auf dem Chromosom lokalisiert werden. Mit Hilfe dieses Verfahrens kann ein DNA-Fingerprint zur Personenidentifikation für gerichtsmedizinische Zwecke erstellt werden. Blotting Unter Blotting versteht man die Übertragung von DNA oder anderer Makromoleküle aus einem Elektrophorese-Gel auf Papier, Nitrocellulose-Filter oder ähnliche Träger. 5 Southern-Blot: - Ein DNA-Gemisch wird durch Agarosegelelektrophorese aufgetrennt. - Die DNA wird auf einen Nitrocellulosefilter übertragen, wobei die Nitrozellulose die DNA bindet und fixiert. - Der Nachweis einer gesuchten Sequenz wird durch Hybridisierung des Blots in einer Lösung durchgeführt, die eine komplementäre Sequenz als radioaktiv markierte Sonde enthält. - Da die Sonde nur an komplementäre Sequenzen bindet, kann das Hybrid anhand der spezifischen Markierung auf der Nitrocellulosefolie nachgewiesen werden. Wird anstatt DNA RNA auf einem Nitrozellulosefilter fixiert und anschließend mit einer komplementären, markierten RNA- oder DNA-Sonde detektiert, so spricht man von Northern-Blot. Beim Western-Blot werden statt Nucleinsäuren Proteine im elektrischen Feld aufgetrennt und durch Antikörper nachgewiesen. Mit Hilfe des Western-Blot-Verfahrens werden z.B. HIV-Infektionen nachgewiesen. VII. Klonierung und Restriktionsenzyme Unter Restriktionsenzymen (=Restriktionsendonukleasen) versteht man Enzyme, die doppelsträngige DNA spezifisch, d.h. bei einer bestimmten Basenfolge (meist Palindromsequenzen) spalten können. Dabei entehen entweder sog. Sticky- oder Blunt-Ends (klebrige oder glatte Enden). Restriktionsenzyme sind für die Klonierung von DNA-Fragmenten von Bedeutung. Prinzipiell werden bei allen Klonierungstechniken DNA-Sequenzen (z.B. Resistenzfaktoren) in spezifische Vektoren (Plasmide, Viren) eingebaut und mit deren Hilfe in Wirtszellen vervielfältigt. Beispiel Plasmidklonierung: - Die Plasmide werden mit Hilfe von Restriktionsenzymen geschnitten. - Die Spender-DNA wird mit dem selben Restriktionsenzym geschnitten und enthält meist einen selektionierenden Faktor (z.B. Antibiotika-Resistenz). - Die Spender-DNA wird mit dem Vektor durch Ligasen verknüpft. - Die Vektoren werden in geeignete Wirtszellen übertragen. - Die Wirtszellen werden auf einem Nährboden kultiviert, der das selektierende Antibiotikum enthält. Auf diese Art überleben nur die Individuen, bei denen der entsprechende Vektor eingebaut wurde. Diese vermehren sich und enthalten dementsprechend abgesehen von Spontanmutationen alle das identische Erbgut (=Klon). Herstellung einer copyDNA (cDNA): - Ausgangspunkt ist eine isolierte mRNA des entsprechenden Gens. - Über die reverse Transkriptase (Enzym aus Retroviren) wird die RNA-Matrize in ein DNA-Molekül zurückgeschrieben. - Mit Hilfe der DNA-Polymerase wird aus dem Einzelstrang ein Doppelstrang hergestellt. Die Vorteile der cDNA liegen darin, keine Introns, sondern ausschließlich die das Genkodierenden Exons zu enthalten. 6