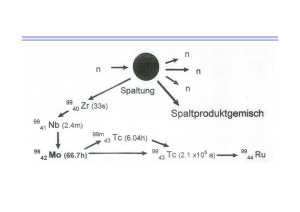
HumaSpect T-03
Werbung

ANHANG I ZUSAMMENFASSUNG DER ERZEUGNISMERKMALE 1 1. BEZEICHNUNG DES ARZNEIMITTELS HumaSPECT 10mg, Lyophilisat und Lösungsmittel zur Herstellung einer Injektionslösung 2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG Set für die Herstellung von mit 99mTc markiertem HumaSPECT. Der Wirkstoff, Votumumab, ist ein humaner monoklonaler Antikörper (MAb 88BV59). Der HumaSPECT-Kit enthält die nachfolgenden sterilen und pyrogenfreien Bestandteile: · eine Durchstechflasche lyophilisiertes Votumumab (12 mg); · eine Durchstechflasche lyophilisiertes Zinnreagens (0,275 mg); · eine Durchstechflasche Diethylentriaminpentaessigsäure-Lösung (DTPA-Lösung) (0,006 mMol, 3ml); · eine Durchstechflasche Wasser für Injektionen (5 ml); · eine sterile Zubereitungs-Durchstechflasche; · einen 0,45 µm Filter. 3. DARREICHUNGSFORM Lyophilisat und Lösungsmittel zur Herstellung einer Injektionslösung. 4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete Nach der Rekonstitution mit Natrium-Pertechnetat [99mTc]-Lösung ist HumaSPECT [99mTc] für die Durchführung szintigraphischer Bildgebung zum Nachweis von Rezidiven und/oder Metastasen bei Patienten mit histologisch nachgewiesenen kolorektalen Karzinomen indiziert. HumaSPECT [99mTc] wird bei der oben genannten Patientengruppe in den nachfolgenden Situationen zur Ergänzung nichtinvasiver bildgebender Standardverfahren, wie z.B. Ultraschalluntersuchung oder Computertomographie, eingesetzt: · Patienten mit nachgewiesenen rezidivierten und / oder metastasierten kolorektalen Karzinomen, die, z. B. vor einer chirurgischen Resektion und / oder einer anderen Therapie, hinsichtlich ihres Erkrankungs-Stadiums untersucht werden. · Patienten mit Verdacht auf rezidivierte und / oder metastasierte kolorektale Karzinome in Zusammenhang mit einem Anstieg von karzinoembryonalem Antigen (CEA) (okkulte Erkrankung). 4.2 Dosierung, Art und Dauer der Anwendung Präparation und Verabreichung von HumaSPECT sollten durch eine qualifizierte Person in einer dafür vorgesehenen klinischen Einrichtung durchgeführt werden. HumaSPECT wird vor der Anwendung mit Natrium-Pertechnetat [99mTc]-Lösung rekonstituiert. Die empfohlene HumaSPECT [99mTc] Dosierung für erwachsene Patienten mit einem Körpergewicht von 70 kg ist eine Einzeldosis von 10 mg mit 900 bis 1300 MBq Technetium [99mTc] markiertem Votumumab. Die meisten Daten zur Effektivität wurden mit einer Aktivität von ca. 1300 MBq erhoben. Die Dosis wird innerhalb von 5 Minuten intravenös verabreicht und soll während der Applikation mit keinem anderen Arzneimittel vermischt werden. Der empfohlene Aufnahmezeitpunkt ist 14-20 Stunden nach Injektion der Antikörper. Die Radioimmunszintigraphie kann bis zu 24 Stunden nach Injektion erfolgen. Für die Injektion ist keinerlei Vorbereitung erforderlich, und der Patient kann nach der Injektion wieder nach Hause gehen. Am nächsten Morgen wird dann die Bildgebung durchgeführt. Dabei muss der Patient während des Szintigraphie 1 - 2 Stunden lang ruhig auf einem Untersuchungsbett liegen. 2 Der Arzt kann die Untersuchung unter Umständen unterbrechen, um den Patienten die Blase entleeren zu lassen oder um einen Einlauf vorzunehmen, falls geringe Mengen Radioaktivität in der Blase oder im Darm die Aufnahmen behindern. Die wiederholte Anwendung wird im Abschnitt 4.4.10 erläutert. 4.3 · · · 4.4 Gegenanzeigen Patienten mit bekannter Überempfindlichkeit gegen einen der Bestandteile von HumaSPECT [99mTc] oder humane Proteine. Schwangerschaft. Stillzeit (siehe Punkt 4.6.3) Warnhinweise und Vorsichtsmassnahmen für die Anwendung 4.4.1 Verwendung von Radiopharmaka · Radiopharmaka dürfen nur von qualifiziertem Personal angewendet werden, das über eine entsprechende amtliche Genehmigung für die Verwendung, Zubereitung und Umgang mit Radionukliden verfügt. · Dieses Radiopharmakon darf nur von dazu ermächtigten Personen in speziell hierfür vorgesehenen klinischen Abteilungen entgegengenommen, verwendet und verabreicht werden. Die Entgegennahme, die Aufbewahrung, die Anwendung, der Transport und die Entsorgung dieses Radiopharmakons unterliegen den Bestimmungen und / oder den entsprechenden Genehmigungen der zuständigen lokalen Behörden. · Radiopharmaka sollen vom Anwender in einer Art und Weise zubereitet werden, die sowohl den Anforderungen im Hinblick auf die Strahlensicherheit als auch den Erfordernissen in bezug auf die pharmazeutische Qualität Rechnung trägt. Angemessene aseptische Vorkehrungen sind zu treffen. 4.4.2 Zubereitung Der Inhalt der einzelnen Durchstechflaschen wird vor der Verwendung rekonstituiert, um HumaSPECT [99mTc] zuzubereiten. Der Inhalt der Bestandteile des Sets (Durchstechflaschen) darf den Patienten nicht direkt verabreicht werden. 4.4.3 Empfohlenes Protokoll für das bildgebende Verfahren Zur Erzielung optimaler Resultate sollen HumaSPECT [99mTc]-Bilder unter Verwendung einer Large-field-of-view-Gammakamera aufgenommen werden, die entweder mit einem hochauflösenden Parallelloch-Kollimator oder mit einem Low-energy-all-purpose-Kollimator ausgestattet ist. Die Kamera sollte unter Verwendung des Photopeaks von 140 keV und eines 20% symmetrischen Fensters kalibriert werden. Es wird empfohlen, die Szintigraphie zwischen 14 und 20 Stunden nach der Injektion von HumaSPECT [99mTc] durchzuführen, dies ist aber auch bis nach 24 Stunden möglich. Um adäquate Zählstatistiken zu erhalten, sollten planare Bilder in ventraler und dorsaler Ansicht aufgenommen werden (mindestens 10 Minuten pro Bild). Um zusätzliche Informationen in Bezug auf die Lokalisierung der Erkrankung zu erhalten, sollten SPECT-Bilder ausgewählter Regionen hergestellt werden. Insbesondere eignet sich das SPECT-Verfahren, um die unspezifische Aufnahme von Regionen zu unterscheiden, die tatsächlich von Tumoren betroffen sind. Szintigramme können aufgrund der Anwesenheit von Radioaktivität im Stuhl eine Aktivität im Dickdarm anzeigen. Deshalb ist vor der Durchführung der Szintigraphie unter Umständen die Verabreichung eines Abführmittels erforderlich. 4.4.4 Tumorspezifität HumaSPECT ist nicht für kolorektale Karzinome spezifisch, da das Antigen, für das es spezifisch ist, auch bei anderen Karzinomen vorkommt. Dazu zählen verschiedene Karzinome des Verdauungstrakts (z. B. Tumore des Magens und des Kolons) und Lungen-, Brust-, Eierstock- und Prostatakarzinome. 3 4.4.5 Falsch positive Ergebnisse 15 (5%) von 294 Patienten mit mindestens einer histopathologisch bestätigten Stelle eines kolorektalen Karzinom-Rezidivs wurden als falsch positiv eingestuft. Bei 49 dieser 294 Patienten mit negativen oder nicht eindeutigen CT-Scans und ansteigenden CEAWerten wurden 5, d. h. 10%, als falsch positiv eingestuft. Falsch positiv waren: reaktive (3) oder normale (1) Lymphknoten, Leber (1)- und Ovarial (2) - Zysten, fokal noduläre Hyperplasien (1), Hämangiome (1), Leberzell-Nekrosen (1), Leber-Adenome (1), eine normale Gallenblase (1), Cholangitis (1), Adhäsionen des Dünndarmes (1), präsakrales Narbengewebe (1). Falsch positive Ergebnisse sind im Bereich der Blase bzw. der Nieren möglich. Zur Verringerung der Aktivität in der Blase empfiehlt sich Blasenentleerung unmittelbar vor den Aufnahmen. Die Durchführung von SPECT für Abdomen- und Beckenbereich wird empfohlen, um normale anatomische Strukturen von Orten rezidivierender Tumore zu unterscheiden. 4.4.6 Heisse und kalte Läsionen, Rim signs Lediglich heisse Läsionen oder Rims signs sollen als tumorpositiv eingestuft werden, ausser wenn weitere Belege die Interpretation einer kalten Läsion als tumorös unterstützen. Oft erscheinen grosse Läsionen wegen schlechter Durchblutung als kalt. Lebermetastasen erscheinen als kalte Läsionen. Das bedeutet, dass kalte Läsionen eine hohe Wahrscheinlichkeit haben, maligne zu sein. Sie sollten nur in Zusammenhang mit den Ergebnissen anderer Tests interpretiert werde. Es gab keine Patienten in diesen klinischen Studien, bei denen “Rim signs” oder gar heisse Leberläsionen beobachtet wurden. 4.4.7 Leistung der bildgebenden Darstellung mit HumaSPECT[99mTc] · Extrahepatisches Abdomen- und Beckenbereich: Bei Patienten, bei denen Belege für rezidivierende und/oder metastasierte kolorektale Karzinome vorliegen, reagiert HumaSPECT allein bedeutend besser als CT (80% gegenüber 62%). Sein positiver prädikativer Wert (PPV) liegt bei 97% und sein negativer prädikativer Wert (NPV) bei 40% bei einer Gesamtpräzision von 80%. Bei Patienten, bei denen Verdacht auf rezidivierende kolorektale Karzinoma im Zusammenhang mit einem ansteigenden Spiegel des karzinoembryonalen Antigens, (CEA) bestehen, beträgt die Sensitivität des HumaSPECT [99mTc] 66% bei einer Spezifizität von 94%. Der positive prädiktive Wert beträgt 97% und der negative prädiktive Wert 55% bei einer Gesamtpräzision von 75%. · Knochen und Gehirn: Zur Identifizierung einer möglichen Ausbreitung kolorektaler Karzinome in Knochen und Gehirn empfiehlt sich die Anwendung konventioneller Diagnosemethoden anstelle von HumaSPECT [99mTc]. 4.4.8 Überempfindlichkeit Bei Patienten, die monoklonale Antikörper erhalten, können allergische Reaktionen bis hin zur Anaphylaxie auftreten. Obgleich schwere Reaktionen dieses Typs in klinischen Versuchen mit HumaSPECT [99mTc] nicht beobachtet wurden, sind Arzneimittel für die Behandlung derartiger allergischer Reaktionen während der Verabreichung dieses Mittels bereit zu halten. 4.4.9 Humane Anti-Human-Antikörper (HAHA) Die Verabreichung von HumaSPECT [99mTc] könnte möglicherweise humane Antihumanantikörper (HAHA) induzieren. Allerdings wurde das Vorliegen von HAHA (> 100 ng/ml) in Serumproben von 353 Patienten, die zu Beginn und 3 – 6 Wochen nach entweder einer oder wiederholter Injektionen von HumaSPECT [99mTc] getestet wurden, nicht festgestellt. 4.4.10Wiederholte Anwendung Begrenzte Daten über die wiederholte Anwendung von HumaSPECT [99mTc] stehen bei Patienten mit rezidivierenden kolorektalen Karzinimen zur Verfügung. Neunundzwanzig (29) Patienten erhielten insgesamt 66 HumaSPECT [99mTc] Injektionen, die in Abständen von mindestens einem Monat zwischen jeder Injektion verabreicht wurden. Bis jetzt hat weder ein Patient, der wiederholte Injektionen erhielt, einen positiven HAHA Titer entwickelt, noch wurde im Vergleich mit Patienten die nur eine Injektion erhielten, über ein vermehrtes Auftreten oder ein erhöhte Schwergrad von 4 unerwünschten Arzneimittel-Wirkungen berichtet. Planar- und SPECT-Bilder wiesen, auch nach wiederholten Anwendungen, keine Änderungen der Bioverteilung auf. Die wiederholte Anwendung kann in Abständen von nicht weniger als einem Monat vorgenommen werden. In diesem Zusammenhang sollte die gesamte dem Patienten im Laufe der Zeit verabreichte Strahlendosis ebenfalls in Betracht gezogen werden. 4.4.11Patienten unter 18 Jahren Bei Patienten unter 18 Jahren wurden die Unbedenklichkeit und diagnostische Aussagekraft nicht getestet. 4.4.12 Nieren- oder Leber-Erkrankungen An Patienten mit eingeschränkter Leber und Nirenfunktion wurden keine regulären Studien durchgeführt. Aufgrund der niedrigen verabreichten Proteindosis und der kurzen Halbwertszeit des 99mTc ist eine Anpassung der Dosierung für diese Patientengruppe jedoch wahrscheinlich nicht erforderlich. 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Es wurden keine regulären Studien über Wechselwirkungen mit anderen Arzneimitteln durchgeführt. Allerdings wurde bisher über keine Wechselwirkungen mit anderen Arzneimitteln berichtet. Test-Kits für HIV 1 und 2, EBV, HCV, CEA und Ca19-9 wurden getestet, und die Erfahrungen haben gezeigt, dass die Gabe von HumaSPECT [99mTc] die Ergebnisse dieser Tests nicht verfälscht. 4.6 Anwendung während Schwangerschaft und Stillzeit 4.6.1 Patientinnen im gebährfähigen Alter Wenn die Verabreichung radioaktiver Arzneimittel an Patientinnen im gebährfähigen Alter erforderlich ist, sollte immer festgestellt werden, ob eine Schwangerschaft vorliegt. Jede Patientin, bei der eine Menstruation ausgeblieben ist, ist bis zum Nachweis des Gegenteils als schwanger zu betrachten. Im Fall von Unsicherheit hierüber ist es wichtig, dass die Strahlenbelastung auf das für den Erhalt der gewünschten klinischen Informationen erforderliche Minimum beschränkt wird. Der Einsatz alternativer Techniken, bei denen keine ionisierende Strahlung angewendet wird, ist in Erwägung zu ziehen. 4.6.2 Schwangerschaft HumaSPECT ist während der Schwangerschaft kontraindiziert. Die Anwendung von Verfahren mit Einbezug von Radionukliden bei schwangeren Patientinnen setzt auch den Fötus einer Strahlung aus. Die Applikation von 900 bis 1300 MBq HumaSPECT [99mTc] entspricht einer für den Embryo bzw. Fötus im Frühstadium geschätzten absorbierten Dosis von etwa 4,8 bis 6,9 mGy. 4.6.3 Stillzeit Vor der Verabreichung eines radioaktiven Arzneimittels an eine stillende Patientin ist zu überlegen, ob die Durchführung der Untersuchung nicht bis nach dem Ende der Stillzeit verschoben werden kann bzw. ob unter Berücksichtigung des Übertritts von Radioaktivität in die Muttermilch tatsächlich das optimale Radiopharmakon ausgewählt wurde. Wenn die Applikation als erforderlich betrachtet wird, sollte die Stillperiode unterbrochen und die Muttermilch verworfen werden. Üblicherweise wird zu einer Wiederaufnahme des Stillens geraten, wenn die Radioaktivität in der Muttermilch zu keiner Strahlenbelastung des Kindes mehr führt, die eine Dosis von über 1 mSv übersteigt. Aufgrund der kurzen Halbwertszeit des 99mTc, die nur sechs Stunden beträgt, ist zu erwarten, dass eine Dosis von weniger als 1 mSv in der Muttermilch 24 Stunden nach der Verabreichung von HumaSPECT [99mTc] erreicht ist. 5 4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen Auswirkungen sind nicht bekannt. 4.8 Nebenwirkungen Die häufigste Nebenwirkung, die als mit der Anwendung von HumaSPECT [99mTc] in Zusammenhang stehend betrachtet wurde, war Fieber, das bei < 1,6% der Patienten auftrat. Vorübergehendes Auftreten von Bluthochdruck, die als mit der Verabreichung von HumaSPECT [99mTc] in Zusammenhang stehend betrachtet werden, wurde in weniger als 1,5% der Patienten festgestellt. Eine leichte Tendenz zur Leukozytose wurde bei bis zu 18% der Patienten in der Woche nach der Gabe von HumaSPECT [99mTc] beobachtet. Der Zusammenhang mit der Gabe von HumaSPECT [99mTc] ist möglich, aber kann auch auf chirurgische Intervention zurückzuführen sein. Weitere Nebenwirkungen, die jeweils bei weniger als 1% der Patienten auftraten, sind im nachfolgenden nach abnehmender Häufigkeit genannt: Erhöhte Werte bei Leberfunktiontests, Hypotonie, Bradykardie, Hyperbilirubinämie, Übelkeit, Erbrechen und lokale Reaktionen an der Injektionsstelle. Die bei der wiederholten Anwendung von HumaSPECT [99mTc] beobachtete Gesamthäufigkeit der Nebenwirkungen ähnelt jener, die nach der Verabreichung einer Einzel- oder Initialdosis beobachtet wurde. Die Anwendung ionisierender Strahlung muss für jeden einzelnen Patienten auf Grund des zu erwartenden Nutzens gerechtfertigt werden können. Bei der Verabreichung von Radioaktivität ist zu berücksichtigen, dass die resultierende Strahlendosis so niedrig sein soll, wie dies sinnvollerweise in Hinblick auf die Notwendigkeit zur Erhaltung des angestrebten diagnostischen Ergebnisses möglich ist. Die Exposition gegenüber ionisierender Strahlung wird mit der Induktion von Karzinomen und der möglichen Entwicklung von Erbschäden in Verbindung gebracht. Für nuklearmedizinische Diagnoseverfahren legt der derzeitige Stand des Wissens nahe, dass unerwünschte Wirkungen aufgrund der niedrigen verwendeten Strahlendosen nur mit sehr geringer Häufigkeit auftreten werden. Bei den meisten nuklearmedizinischen Untersuchungsmethoden beträgt die Strahlendosis (Effektivdosis / EDE) weniger als 20 mSv. Höhere Dosen können unter bestimmten klinischen Umständen gerechtfertigt sein. 4.9 Überdosierung Bei der intravenösen Verabreichung von Votumumab in Dosen von bis zu 100 mg wurden keine schweren Nebenwirkungen beobachtet. Für den unwahrscheinlichen Fall der Verabreichung einer zu hohen Aktivität von HumaSPECT [99mTc] kann die absorbierte Dosis durch gesteigerte orale oder intravenöse Zufuhr von Flüssigkeit zur Förderung der Ausscheidung des Radiomarkers verringert werden. 5. PHARMAKOLOGISCHE EIGENSCHAFTEN 5.1 Pharmakodynamische Eigenschaften Pharmakotherapeutische Gruppe: Diagnostisches Radiopharmakon für die Identifizierung von Tumoren, ATC-Code: V09I A01. Der auch unter der Bezeichnung MAb 88BV59 bekannte Votumumab ist ein humaner monoklonaler Antikörper des IgG3-Isotyps (Kappa Leicht-Ketten). Er ist gegen einen tumorassoziierten Antigenkomplex gerichtet, der von differenzierten Adenokarzinomen exprimiert wird. Das von Votumumab erkannte Antigen ist als Komplex von Zytokeratin-Polypeptiden mit einem Molekulargewicht von 35-43 kD oder CTA #1 bekannt. Dieser Antigen-Komplex reagiert mit monoklonalen Antikörpern gegen Zytokeratin 8, 18 und 19, was anzeigt, dass Epitope dieser Zytokeratine in diesem Polypeptid-Komplex anwesend sind. 6 Votumumab [99mTc] scheint in den Konzentrationen und bei der Radioaktivität, die für diagnostische Verfahren zum Einsatz gelangen, keinerlei pharmakodynamische Wirkung auszuüben. Votumumab ist nicht für kolorektale Karzinome spezifisch, da das Antigen, das es erkennt, auch von anderen Karzinomen exprimiert wird (siehe Abschnitt 4.4.4). In immunohistologischen in vitroStudien wurde festgestellt, dass Votumumab mit über 90% der kolorektalen Adenokarzinome sowie der Mehrheit der Brust-, Prostata-, Lungen- und Magenkarzinome reagiert. Votumumab reagiert im allgemeinen nicht mit normalen menschlichen Geweben, doch wurden quantitative Unterschiede in bezug auf die Reaktivität mit normalem Drüsenepithel beobachtet. In klinischen Versuchen wurde eine Lokalisierung von HumaSPECT [99mTc] an Stellen rezidivierender, metastasierender und okkulter kolorektaler Karzinome beobachtet. In der Leber, in den Nieren sowie an von Abszessen und Entzündungen betroffenen Stellen kam es zu einer gewissen unspezifischen Aktivitätsakkumulation. Das Sichtbarwerden des Darms, des Blutes und der Harnblase fällt ebenfalls in den Bereich der normalen Abweichungen zwischen einzelnen Patienten. 5.2 Pharmakokinetische Eigenschaften Die Pharmakokinetik des mit Technetium [99mTc] radioaktiv markierten Votumumab ist durch ein biphasisches Eliminationsmuster mit einer Halbwertszeit der Distribution von t½α, 6 ± 4 h und einer relativ langen Eliminations-Halbwertszeit (t½ß, 35 ± 11 h) sowie einer ebenfalls relativ langen mittleren Verweildauer (MRT, 44 ± 13 h) gekennzeichnet. Die Serumclearancerate ist niedrig (Cl, 1,4 ± 0,5 ml / min), und das Verteilungsvolumen ist gering (Vss, 3,4 ± 0,9 l). Zwischen Patienten, die eine Einfachdosis erhielten, und Patienten, denen wiederholt Injektionen verabreicht wurden, wurden ebenso wie zwischen männlichen und weiblichen Patienten keine signifikanten pharmakokinetischen Unterschiede festgestellt. 5.3 Präklinische Daten zur Sicherheit Toxizitätsstudien , die an Tieren nach einmaliger und wiederholter Verabreichung durchgeführt wurden, wiesen auf keinerlei organtoxische Wirkung hin. Allerdings ist in diesem Zusammenhang anzumerken, dass im Rahmen dieser Studien keine Untersuchung karzinogener Effekte oder potentielle Wirkungen auf die Fortpflanzungsfähigkeit erfolgte. In in vitro Versuchen wurde Votumumab weder als mutagen noch karzinogen befunden. 5.4 Strahlungsdosimetrie Bei diesem Radiopharmakon beträgt die Effektivdosis, die sich aus der Applikation einer Radioaktivität von 900 bis 1300 MBq ergibt, für einen Patienten mit einem Körpergewicht von 70 kg typischerweise 8 bis 10,4 mSv. Metastabiles Technetium [99mTc] zerfällt unter Emission von Gammastrahlung mit einer Energie von 140 keV und einer Halbwertszeit von 6 Stunden zu Technetium [99Tc], das als praktisch stabil angesehen werden kann. Die Strahlungsdosimetrie für die einzelnen Organe wies auf ein allgemein niedriges Niveau der Strahlenexposition hin. Wie im Falle eines [99mTc] markierten Antikörpers zu erwarten ist, war die Aktivität in den Nieren und in der Harnblase am höchsten. Die Werte wurden in Übereinstimmung mit der Medical Internal Radiation Dosimetry (MIRD) errechnet. 7 Tabelle 1: Schätzwerte für die absorbierte Strahlendosis (µGy / MBq) für den gesamten Organismus und für einzelne Organe nach einmaliger und wiederholter intravenöser Injektion von HumaSPECT [99mTc]. Organdosis (µrGy/MBq) 1. Injektion (N=9) Organ 2. Injektion (N=8) Alle Injektionen (N=17) Mean SD Range Mean SD Range Mean SD Range Nebennieren 8 2 5-11 7 2 5-9 7 2 5-11 Gehirn 2 1 1-3 3 0 2-3 2 0 1-3 Brust 4 0 4-4 4 0 3-4 4 0 3-4 Gallenblasenwand 8 2 4-12 7 1 5-9 7 2 4-12 Wand des unteren Dickdarms 4 1 3-6 5 0 4-5 4 1 3-6 Dünndarm 5 1 4-5 5 0 4-5 5 1 4-5 Magen 5 1 4-6 5 1 4-6 5 1 4-6 Wand des oberen Dickdarm 5 1 4-6 5 1 4-5 5 1 4-6 Herzwand 17 3 15-22 18 3 15-23 18 3 15-23 Nieren 29 23 7-79 22 11 8-39 26 18 7-79 Leber 17 8 6-33 14 4 6-21 15 6 6-33 Lunge 13 2 10-17 13 3 11-18 13 3 10-18 4 1 3-4 4 0 3-4 4 0 3-4 Eierstöcke 5 0 5-6 5 0 5-5 5 0 5-6 Pankreas 7 2 5-10 7 1 5-9 7 2 5-10 Rotes Knochenmark 7 1 6-9 8 1 6-10 7 1 6-10 Knochenoberflächen 8 1 6-9 8 1 7-10 8 1 6-10 Haut 2 0 1-3 2 0 2-2 2 0 1-3 17 12 4-42 13 8 5-28 15 11 4-42 3 1 1-3 3 0 3-3 3 0 1-3 Thymus 5 1 4-6 6 1 5-7 5 1 4-7 Schilddrüse 3 1 1-4 3 0 3-3 3 0 1-4 Harnblasenwand 20 4 12-23 20 3 15-27 20 3 12-27 6 0 5-6 6 0 5-6 6 0 5-6 4 1 3-5 4 1 4-5 4 1 3-5 Muskeln a Milz Hoden b a Uterus Gesamter Organismus Effektivdosis 8 1 6-10 8 1 6-9 8 1 6-10 (µSv/MBq) a Durchschnittswerte beruhen auf der Anzahl der weiblichen Dosimetriepatienten, die die Injektion 1 (N = 4), die Injektion 2 (N = 4) oder sämtliche Injektionen (N = 8) erhalten haben. b Durchschnittswerte beruhen auf der Anzahl der männlichen Dosimetriepatienten, die die Injektion 1 (N = 5), die Injektion 2 (N = 4) oder sämtliche Injektionen (N = 9) erhalten haben. 8 6. PHARMAZEUTISCHE ANGABEN 6.1 Hilfsstoffe Bestandteil A, Durchstechflasche mit Zinnreagens: Zinnchloriddihydrat, D-GlucarsäureMonokaliumsalz und Natriumhydrogencarbonat. Bestandteil B, Durchstechflasche mit Votumumab: Antikörper 88BV59, Natriumchlorid, Natriumhydrogenphosphat-Monohydrat, Dinatriumdihydrogenphosphat-Heptahydrat, Laktose-Monohydrat. Bestandteil C, Durchstechflasche mit DTPA-Lösung: Diethylentriaminpentaessigsäure (DTPA), Natriumhydrogencarbonat, Natriumchlorid. Wasser für Injektionszwecke, Ph. Eur. 6.2 Inkompatibilitäten Keine bekannt. 6.3 Dauer der Haltbarkeit 18 Monate. Verwenden Sie das Produkt nach dem auf der Packung angegebenen Verfalldatum nicht mehr. Die nicht-radioaktiven Komponenten A und B des HumanSpect Sets sollen innerhalb von 4 Stunden für die Präparation von Technticum [99mTc] Votumumab verwendet werden. Die radioaktiv markierte HumaSPECT [99mTc]-Dosis sollte innerhalb eines Zeitraums von 1 Stunde nach der Markierung verwendet werden, um 900 bis 1300 MBq zu ergeben. 6.4 Besondere Lagerungshinweise Das HumaSPECT-Set bei 2 bis 8° C lagern. Nicht tiefkühlen. HumaSPECT[99mTc], (Technetium [99mTc]-Votumumab) bei 15 bis 30°C in einem adäquat abgeschirmten Behälter aufbewahren. 6.5 Art und Inhalt des Behältnisses Das HumaSPECT-Set umfasst vier Durchstechflaschen: 1. Bestandteil A: eine Glasdurchstechflasche, Typ I, mit lyophilisiertem Zinnreagens (0,275 mg), mit Gummistopfen und Flip-off-Siegel aus Aluminium verschlossen. 2. Bestandteil B: eine Glasdurchstechflasche, Typ I, mit lyophilisiertem gepufferten laktosehaltigen Votumumab (12 mg), mit Gummistopfen und Flip-off-Siegel aus Aluminium verschlossen. 3. Bestandteil C: eine Glasdurchstechflasche, Typ I, mit 3,2 ml einer wässrigen Lösung von 0,006 mM Diethylentriaminpentaessigsäure-Lösung (DTPA), mit Gummistopfen und Flipoff-Siegel aus Aluminium verschlossen. 4. Eine Durchstechflasche aus Flintglas mit 5 ml sterilisiertem Wasser für Injektionen, mit Gummistopfen und Flip-top-Crimpsiegel verschlossen. Der Inhalt jeder Durchstechflasche ist steril, pyrogenfrei und frei von Konservierungsstoffen. Jedes HumaSPECT- Set umfasst ferner einen sterilen 0,45µm Filter, eine leere sterile ZubereitungsDurchstechflasche, 2 Etiketten für die Zubereitungs-Durchstechflasche bzw. die Patientendosis, 2 Strahlensicherheitsschilder und eine Packungsbeilage für den Anwender. 6.6 Hinweise für die Anwendung, Handhabung und Entsorgung Lesen Sie die gesamte Anleitung aufmerksam durch, bevor Sie mit der Präparation beginnen. 9 Alle Arbeitsschritte sollten unter Anwendung adäquater aseptischer Techniken und Sicherheitsstandards für die Handhabung von Radionukliden durchgeführt werden. Der Inhalt des HumaSPECT-Sets ist nur für die Herstellung einer einzigen Dosis HumaSPECT [99mTc] geeignet. Der Inhalt der einzelnen Bestandteile des Sets darf dem Patienten nicht direkt verabreicht werden. Jede Veränderung der Menge der einzelnen verwendeten Bestandteile einschliesslich der empfohlenen Menge des für die Radiomarkierung verwendeten Technetium 99mTc kann die Ergebnisse der Szintigraphie beeinträchtigen und ist deshalb nicht zu empfehlen. 6.6.1 Verfahren für die Herstellung und Qualitätskontrolle 6.6.1.1 Verfahren für die Herstellung 1. Das gekühlte HumaSPECT-Set dreissig Minuten vor der Durchführung der Radiomarkierung auf Zimmertemperatur bringen. 2. Die Flip-off-Siegel entfernen und die Oberseite der Gummistopfen jeder Durchstechflasche mit Alkohol abtupfen. 3. Lösen Sie das Zinnreagens, das in der Durchstechflasche des Bestandteils A enthalten ist, mit 1,2 ml des sterilisierten Wassers für Injektionen mit Hilfe einer sterilen Einwegspritze und – nadel auf. Vorsichtig schwenken, um den Inhalt aufzulösen. 4. Überführen Sie nun 1 ml dieser Lösung in die Durchstechflasche, die Votumumab enthält (Bestandteil B). Vorsichtig schwenken, um den Inhalt aufzulösen. Nicht schütteln oder verwirbeln. Stellen Sie die Durchstechflasche in einen entsprechenden strahlenabschirmenden Schutzbehälter mit passendem Deckel. 5. 45 Minuten lang bei 37°C inkubieren. 6. Fügen Sie in die Durchstechflasche B mit einer neuen sterilen Spritze und Nadel steriles, pyrogenfreies Technetium 99mTc in weniger als 2 ml hinzu. Leicht schütteln, um die Komponenten zu vermengen. 1000 bis 1500 MBq müssen verwendet werden, um innerhalb einer einstündigen Herstellungszeit die empfohlene Aktivität HumaSPECT [99mTc] zu erhalten. 7. 5 Minuten lang bei 37°C inkubieren. 8. Die Durchstechflasche entnehmen und mit einer neuen sterilen Spritze und Nadel in die Durchstechflasche B 3 ml des Bestandteils C, d. h. also der DTPA-Lösung, hinzufügen. Leicht schütteln, um die Komponenten zu vermischen. 9. Fügen Sie eine ausreichende Menge steriler, pyrogenfreier 0,9%iger Kochsalzlösung (wird nicht mitgeliefert) hinzu, um ein Endvolumen von 6 ml zu erreichen. Vorsichtig schütteln, um die Komponenten zu vermengen. (Das Volumen der hinzuzufügenden Kochsalzlösung in Millilitern erhält man, wenn man das Volumen des gemäss Punkt 6 hinzugefügten Technetium 99mTc von 2 ml abzieht.) 10. Entnehmen Sie unter Verwendung einer abgeschirmten sterilen Spritze und Nadel (Volumen 10 ml) den gesamten Inhalt der Durchstechflasche B. Entfernen Sie die Nadel und setzen Sie den mitgelieferten 0,45 µm Filter sowie eine neue Nadel ein. Tupfen Sie den Gummistopfen der Zubereitungs-Durchstechflasche mit Alkohol ab. Filtrieren Sie den Inhalt durch den Filter in die ebenfalls im Set mitgelieferte Zubereitungs-Durchstechflasche. 11. Entnehmen Sie unter Verwendung einer abgeschirmten sterilen Spritze und Nadel (Volumen 10 ml) die gesamte HumaSPECT [99mTc]-Dosis. Entfernen Sie die Nadel und setzen Sie eine neue sterile Nadel in die Spritze ein. 12. Führen Sie eine Untersuchung der Spritze und ihres Inhalts in einem Dosiskalibrator durch. 13. Notieren Sie auf dem im Set mitgelieferten Identifizierungsetikett den Namen des Patienten, Datum und Uhrzeit der Untersuchung, Volumen und Radioaktivität in der Spritze sowie die Chargennummer des Sets. Befestigen Sie dieses Etikett an der Abschirmung der Spritze. 14. Berechnen Sie auf der Basis der Zerfallsfaktoren für Technetium 99mTc die Zeitspanne, innerhalb derer HumaSPECT [99mTc] dem Patienten verabreicht werden soll. 6.6.1.2 Qualitätskontrolle, Bestimmung der radiochemischen Reinheit mit dem ITLC-Verfahren Bestimmen Sie die radiochemische Reinheit mit Hilfe des ITLC-Verfahrens (DünnschichtChromatographie) auf einem mit Kieselgel imprägnierten Glasfaserstreifen (1 cm X 8 cm) unter Verwendung einer ITLC-Pufferlösung* (Natriumacetat, pH-Wert 5). Wenn der Rand des Lösungsmittels 0,5 cm oder weniger vom oberen Rand des Streifens entfernt ist, den Streifen 10 entnehmen. In zwei Teile in der Grösse von 1 X 3 cm (oberer Abschnitt) bzw. 1 X 5 cm (unterer Abschnitt) zerschneiden. Zählen Sie jeden Teil in einem Gammaszintillationszähler, in einem Dosiskalibrator oder einem Radioaktivitätsscanner. Berechnen Sie dann den prozentualen Anteil des an den Antikörper gebundenen Technetium 99mTc. Das radioaktiv markierte Produkt sollte nicht mehr als 10% freies Technetium enthalten. % 99 mTc an Antikörper gebunden = Counts im unteren Abschnitt Gesamte Counts ( oben + unten ) ´ 100 * Bereiten Sie die Lösung A zu, indem Sie zu 50 ml entionisiertem Wasser 0,3 ml Eisessig hinzufügen. Bereiten Sie die Lösung B vor, indem Sie zu 100 ml entionisiertem Wasser 0,8 g wasserfreies Natriumacetat hinzufügen. Vermengen Sie dann 30 ml der Lösung A mit 70 ml der Lösung B, um die ITLC-Pufferlösung zu erhalten. 6.6.2 Entsorgung Entsorgen Sie Durchstechflaschen, Nadeln und Spritzen in Übereinstimmung mit den lokal vorgeschriebenen Bestimmungen für die Entsorgung radioaktiver Abfälle. 7. PHARMAZEUTISCHER UNTERNEHMER KS Biomedix Limited 1 Occam Court Surrey Research Park Guildford Surrey GU2 7HJ Vereinigtes Königreich 8. NUMMER IM ARZNEIMITTELREGISTER DER EUROPÄISCHEN GEMEINSCHAFT EU/1/98/083/001 9. DATUM DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG 25/9/1998 10. STAND DER INFORMATION 11 ANHANG III ETIKETTIERUNG UND PACKUNGSBEILAGE 12 A. ETIKETTIERUNG 13 ANGABEN AUF DER ÄUSSEREN UMHÜLLUNG BZW. BEI DEREN FEHLEN AUF DEM BEHÄLTNIS HumaSPECT 10 mg Lyophilisat und Lösungsmittel zur Herstellung einer Injektionlösung, votumumab Set für die Herstellung von Technetium [99mTc]-Votumumab (humaner monoklonaler Antikörper 88BV59) in der Form eines Pulvers zwecks Lösung für die Injektion. Set für die Herstellung von HumaSPECT markiertem 99mTc. Der Wirkstoff von HumaSPECT ist Votumumab, ein humaner monoklonaler Antikörper, MAb 88BV59. Das HumaSPECT -Set enthält die nachfolgenden sterilen und pyrogenfreien Bestandteile: · eine Durchstechflasche lyophilisiertes Votumumab (12 mg); · eine Durchstechflasche lyophilisiertes Zinnreagens; · eine Durchstechflasche Diethylentriaminpentaessigsäure-Lösung (DTPA-Lösung); · eine Durchstechflasche steriles Wasser für Injektionen; · eine sterile Zubereitungs-Durchstechflasche; · einen 0,45 µm Filter. Bestandteil A, Durchstechflasche mit Zinnreagens: Zinnchloriddihydrat, DGlucarsäuremonokaliumsalz und Natriumbikarbonat. Bestandteil B, Durchstechflasche mit Votumumab: Antikörper 88BV59, Natriumchlorid, Natriumhydrogenphosphatmonohydrat, Dinatriumdihydrogenphosphatheptahydrat, Laktosemonohydrat. Bestandteil C, Durchstechflasche mit DTPA-Lösung: Diethylentriaminpentaessigsäure (DTPA), Natriumbikarbonat, Natriumchlorid. Wasser für Injektionszwecke, Ph. Eur. Ausschliesslich für intravenöse Applikation bestimmt Ausserhalb der Reichweite von Kindern aufbewahren Verfalldatum (Monat, Jahr) Bei 2 - 8°C lagern. Nicht tiefkühlen. Entsorgen Sie Durchstechflaschen, Nadeln und Spritzen in Übereinstimmung mit den lokal vorgeschriebenen Bestimmungen für die Entsorgung radioaktiver Abfallstoffe. KS Biomedix Limited 1 Occam Court Surrey Research Park Guildford Surrey GU2 7HJ Vereinigtes Königreich EU/1/98/083/001 Batch N°: Arzneimittel auf ärztliche Verschreibung. 14 MINDESTANGABEN AUF KLEINEN PRIMÄRVERPACKUNGEN HumaSPECT-A Komponente Lyophilisiertes Zinnreagens Zinnchloriddihydrat 0,275 mg Chargenummer: Verfalldatum: (Monat, Jahr) KS Biomedix Limited 1 Occam Court Surrey Research Park Guildford Surrey GU2 7HJ Vereinigtes Königreich Wiederauflösen mit 1,2 ml Wasser für Injektionen 15 HumaSPECT-B Komponente Votumumab Lyophilisat zur Herstellung einer Injektionlösung 12 mg Chargennummer: Verfalldatum (Monat, Jahr) KS Biomedix Limited 1 Occam Court Surrey Research Park Guildford Surrey GU2 7HJ Vereinigtes Königreich Rekonstituieren mit 1 ml des rekonstituierten Zinnreagens (A-Komponente) 16 HumaSPECT-C Komponente 0,006 mM DTPA-Lösung 3 ml Chargennummer: Verfalldatum (Monat, Jahr) KS Biomedix Limited 1 Occam Court Surrey Research Park Guildford Surrey GU2 7HJ Vereinigtes Königreich 17 HumaSPECT-Verdünner Wasser für Injektionen 5 ml Chargennummer Verfalldatum (Monat, Jahr) KS Biomedix Limited 1 Occam Court Surrey Research Park Guildford Surrey GU2 7HJ Vereinigtes Königreich Rekonstituieren mit dem Zinnreagens (A-Komponente) 18 ETIKETTE FÜR DIE STRILE ZUBEREITUNGS-DURCHSTECHFLASCHE HumaSPECT-TC Identität des Patienten:_____________ Set-Chargenummer: _______________ Tc 99m Aktivität:_________________ Volumen: _______________________ Zeitpunkt:_______________________ Datum: _________________________ Bei einer Raumtemperatur von 15 – 30°C lagern. VORSICHT: RADIOAKTIVES MATERIAL 19 B. PACKUNGSBEILAGE 20 Lesen Sie diese Packungsbeilage bitte aufmerksam durch. Sie enthält für Sie wichtige Informationen über HumaSPECT-Tc. Falls Sie weitere Fragen haben, wenden Sie sich bitte an Ihren Arzt oder Ihre Krankenschwester. Bewahren Sie diese Packungsbeilage an einem sicheren Ort auf, da Sie sie möglicherweise zu einem späteren Zeitpunkt nochmals brauchen werden. HumaSPECT® 10 mg Lyophilisat und Lösungsmittel zur Herstellung einer Injektionslösung. Votumumab. Zusammensetzung: Bestandteil A, Durchstechflasche mit Zinnreagens: Zinnchloriddihydrat, D-GlucarsäureMonokaliumsalz und Natriumhydrogencarbonat. Bestandteil B, Durchstechflasche mit Votumumab: Antikörper 88BV59, Natriumchlorid, Natriumhydrogenphosphatmonohydrat, Dinatriumdihydrogenphosphatheptahydrat, Laktosemonohydrat. Bestandteil C, Durchstechflasche mit DTPA-Lösung: Diethylentriaminpentaessigsäure (DTPA), Natriumhydrogencarbonat, Natriumchlorid. Wasser für Injektionszwecke, Ph. Eur. WAS IHR ARZNEIMITTEL ENTHÄLT. Der Wirkstoff von HumaSPECT ist Votumumab, ein humaner Antikörper. Ein Antikörper ist ein vom menschlichen Organismus gebildetes Protein, das sich an körperfremde Zellen, wie z. B. die Erreger von Infektionen oder an Tumorzellen, binden kann. Jeder Mensch produziert viele verschiedene Arten von Antikörpern. Manche Antikörper werden aus derselben Zellfamilie gebildet, um einen spezifischen “Eindringling” zu erkennen. In diesem Fall spricht man von “monoklonalen” Antikörpern. Votumumab, der Wirkstoff von HumaSPECT-Tc ist ein humaner monoklonaler Antikörper, MAb 88BV59, der sich an die Oberfläche bestimmter Arten von Tumorzellen bindet. Der monoklonale Antikörper wird im Krankenhaus von einem Pharmazeuten oder von anderem qualifizierten Fachpersonal mit einer radioaktiven Substanz, dem Technetium [99mTc], markiert. Wenn er mit dem radioaktiven Isotop Technetium [99mTc] verbunden und gespritzt wird, findet er bestimmte Tumore und bindet sich an sie. So kann Ihr Arzt seine Diagnose stellen und das Ausmass Ihrer Erkrankung mit Hilfe einer speziellen Kamera, welche die Zonen mit Radioaktivität anzeigt, ermitteln. WAS IST HumaSPECT ? Votumumab, das aktive Prinzip, ist ein Pulver zur Herstellung einer Lösung für die intravenöse Verabreichung. Das HumaSPECT-Tc-Set umfasst die nachfolgenden sterilen und pyrogenfreien Bestandteile: · eine Durchstechflasche lyophilisiertes Votumumab (12 mg); · eine Durchstechflasche lyophilisiertes Zinnreagens; · eine Durchstechflasche Diethylentriaminpentaessigsäure-Lösung (DTPA-Lösung); · eine Durchstechflasche sterilisiertes Wasser für Injektionen; · eine sterile Zubereitungs-Durchstechflasche; · einen 0,45 µm Filter. WARUM HumaSPECT ? HumaSPECT-Tc ist ein für nuklearmedizinische Verfahren eingesetztes Radiopharmakon. Es wird verwendet, um festzustellen, ob und wo im Körper auf Dickdarm oder Mastdarm zurückzuführende Tumore vorhanden sind. Kurz nach der Mischung von HumaSPECT mit dem radioaktiven Technetium-Isotop wird Ihnen der Arzt das Mittel intravenös verabreichen. 14 bis 20 Stunden später 21 werden von Ihnen auf einem speziellen Untersuchungsbett mit Hilfe von Standard-Gammakameras Aufnahmen gemacht, um festzustellen, wo der Tumor bzw. die Tumoren liegen. Vor der Durchführung der Untersuchung sollten Sie die Blase entleeren. WER VERTREIBT HumaSPECT ? KS Biomedix Limited 1 Occam Court Surrey Research Park Guildford Surrey GU2 7HJ Vereinigtes Königreich WER STELLT HumaSPECT HER ? Intracel Corp. 1330 Piccard Dr., Rockville, Maryland 20850, USA WANN SOLL HumaSPECT ANGEWENDET WERDEN ? HumaSPECT ist ein humaner monoklonaler Antikörper, der mit einer radioaktiven Substanz namens Technetium verbunden wird. HumaSPECT wird bei Patienten mit Tumoren des Dickdarms oder des Mastdarms angewendet, die nach einer Untersuchung mit dem Mikroskop diagnostiziert wurden. Der Antikörper kann sich an die Oberfläche bestimmter Arten von Tumoren, den sogenannten Adenokarzinomen, binden und wirkt dabei als Tumormarker. Wenn der radioaktive Antikörper sich an den Tumor bindet, kann Ihr Arzt feststellen, wo dieser Tumor liegt, indem er mit einer speziellen bildgebenden Kamera die Bereiche mit Radioaktivität sichtbar macht. Der Arzt kann auch feststellen, wie schwer die Erkrankung ist und ob sie sich auf andere Bereiche des Körpers ausgebreitet hat. Diese Informationen helfen dem Arzt bei seiner Entscheidung für eine Operation oder eine andere Art von Behandlung. WANN SOLL HumaSPECT NICHT ANGEWENDET WERDEN ? HumaSPECT soll nicht angewendet werden, wenn Sie bereits allergische Reaktionen auf humane Antikörper (Immunoglobuline) hatten, wenn Sie unter 18 Jahre alt sind, da das Mittel für diese Patientengruppe noch nicht untersucht wurde, oder wenn Sie schwanger sind oder stillen. Bisher wurden keinerlei Wechselwirkungen mit anderen medizinischen Produkten beschrieben. DARF HUMASPECT-TC WÄHREND DER SCHWANGERSCHAFT ODER DER STILLZEIT VERWENDET WERDEN ? Über die Anwendung von HumaSPECT während der Schwangerschaft stehen keine Informationen zur Verfügung. HumaSPECT darf während der Schwangerschaft oder in Erwartung einer Schwangerschaft nicht angewendet werden. Patientinnen im gebährfähigen Alter müssen adäquate Verhütungsmethoden anwenden oder einen negativen Schwangerschaftstest aufweisen, bevor sie HumaSPECT erhalten. Über die Anwendung von HumaSPECT bei Patientinnen, die stillen, stehen keine Informationen zur Verfügung. Es ist nicht bekannt, ob HumaSPECT-Tc in die Muttermilch übertritt. Sie sollten mit Ihrem Arzt über einen Abbruch der Stillperiode vor der Verabreichung von HumaSPECT sprechen. 22 DÜRFEN SIE NACH DER VERABREICHUNG VON HumaSPECT FAHRZEUGE LENKEN ODER MASCHINEN BEDIENEN ? Es liegen keine Hinweise vor, dass HumaSPECT die Fähigkeit zum Lenken eines Fahrzeugs oder zum Bedienen von Maschinen beeinträchtigt. DIE MENGE DES ARZNEIMITTELS, DIE IHNEN VERABREICHT WIRD. Sie werden eine einzelne Dosis von 10 mg HumaSPECT-Tc erhalten. Darin wird das radioaktive Isotop Technetium in einer Menge von 900 bis 1300 MBq enthalten sein. WIE HumaSPECT-TC VERWENDET WIRD. Ein im Umgang mit radioaktiven Substanzen erfahrener Arzt wird HumaSPECT und das radioaktive Isotop Technetium zubereiten. 10 mg HumaSPECT werden mit 900 bis 1300 MBq Technetium radioaktiv markiert. HumaSPECT wird mit Hilfe einer Nadel in Ihre Vene injiziert. Die Injektion wird etwa 5 Minuten lang dauern. Nach der Injektion werden Sie auf das Auftreten möglicher Nebenwirkungen beobachtet. Die Strahlendosis, die Ihnen verabreicht wird, entspricht in etwa jener, die Sie bei häufig angewendeten Untersuchungsmethoden wie z. B. Röntgenuntersuchungen der Brust erhalten würden. Diese geringe Menge an Radioaktivität stellt weder für Sie selbst noch für Personen, mit denen Sie in Kontakt kommen, eine Gefahr dar, und wird innerhalb von ca. 24 Stunden aus Ihrem Körper verschwunden sein. Für die Injektion ist keinerlei Vorbereitung erforderlich, und Sie können nach der Injektion wieder nach Hause gehen. Am nächsten Morgen wird dann die eigentliche Untersuchung durchgeführt. Dabei müssen Sie während der Untersuchung 1 - 2 Stunden lang ruhig auf einem Untersuchungsbett liegen. Der Arzt wird die Untersuchung unter Umständen unterbrechen, um Sie die Blase entleeren zu lassen oder um einen Einlauf vorzunehmen, falls geringe Mengen an Radioaktivität in der Blase oder im Darm die Aufnahmen behindern. WIE OFT WERDEN SIE HumaSPECT ERHALTEN. HumaSPECT wird für eine einzige Injektion zubereitet. Ihr Arzt kann beschliessen, Ihnen dieses Arzneimittel für eine wiederholte Untersuchung nach Ablauf mehrerer Wochen erneut zu verabreichen. MASSNAHMEN BEI ÜBERDOSIERUNG. Die intravenöse Verabreichung von intaktem Votumumab in therapeutischen Dosen von bis zu 100 mg hat keinerlei schwere Nebenwirkungen gezeigt. Für den unwahrscheinlichen Fall der Verabreichung einer Strahlenüberdosis mit HumaSPECT [99mTc] kann die absorbierte Dosis durch gesteigerte orale oder intravenöse Zufuhr von Flüssigkeiten zur Förderung der Ausscheidung des Radiomarkers verringert werden. KÖNNEN IRGENDWELCHE NEBENWIRKUNGEN AUFTRETEN ? Es besteht ein sehr geringes Risiko von Reaktionen des allergischer Art. Zu den am häufigsten auftretenden Symptomen zählen: · Atemnot · Anstieg oder Abfall des Blutdrucks · Hautausschläge · Ansteigen der Pulses · Fieber · Rückenschmerzen Während der Verabreichung von HumaSPECT wird sich ein Arzt oder eine Krankenschwester in Ihrer Nähe aufhalten, um diese unter Umständen auftretenden Nebenwirkungen festzustellen und zu behandeln. Zu den weniger häufig beobachteten Nebenwirkungen zählen Übelkeit, Erbrechen und die Erhöhung der Blutwerte bei Leberfunktionstests. 23 Unter Umständen können ein oder mehrere dieser Symptome bei Ihnen auftreten. Setzen Sie hiervon unbedingt Ihren Arzt in Kenntnis. Falls andere Nebenwirkungen auftreten sollten, die in dieser Packungsbeilage nicht beschrieben werden, wenden Sie sich bitte an Ihren Arzt. Obgleich der Antikörper einige normale Gewebe erkennt, besteht kein Hinweis darauf, dass das Risiko einer Entwicklung von mit dem Antikörper in Zusammenhang stehenden Organschäden bestünde. Es besteht ein sehr geringes Risiko, dass sich in Ihrem Körper Antikörper gegen HumaSPECT [99mTc] entwickeln und die Gefahr einer allergischen Reaktion sich vergrössert, wenn Ihnen in Zukunft noch einmal HumaSPECT [99mTc] verabreicht wird. Bei mehr als 470 Patienten, die einzelne oder wiederholte Gaben von HumaSPECT [99mTc] erhielten, wurde jedoch kein solcher Fall beobachtet. WIE LANGE HumaSPECT AUFBEWAHRT WERDEN KANN UND WIE ES ZU LAGERN IST ? HumaSPECT wird im Krankenhaus in einem Kühlschrank gelagert und Ihrem Arzt ausgehändigt, wenn er es benötigt. Das Krankenhaus kann dieses Arzneimittel bei Temperaturen von 2 - 8°C bis zu 18 Monate nach seiner Herstellung aufbewahren. Das Verfalldatum ist auf der Durchstechflasche angegeben. Das Produkt sollte nach diesem Datum nicht mehr verwendet werden. Sobald das Material aufgelöst und radioaktiv markiert ist, kann es bei Zimmertemperatur (15 - 30°C) aufbewahrt werden und muss innerhalb eines Zeitraums von 4 Stunden nach seiner Auflösung verwendet werden. STAND DER INFORMATION 24