schulaufgabenvorb_Q1..
Werbung

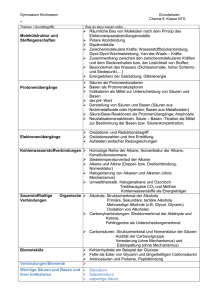
Schulaufgabenvorbereitung Q12 Chemie Grundwissen: – Ionenladungen kennen: Hauptgruppenelemente gemäß Oktettregel; z.B. Mg2+, S2– Nebengruppenelemente: Zn2+, Hg2+, Ag+, verschiedene Ox.zahlen: Fe2+, Fe3+; Cu2+ CuI2O – anorganische Säuren kennen: Formeln der Säuren und der korrespondierenden Basen z.B. H2SO4/HSO4–; HSO4–/SO42–; einige "Säuren" existieren nur in Form ihrer korr. Basen: Permanganat MnO4–, Manganat MnO42–; Chromat CrO42–, Dichromat Cr2O72– – Protonenübertragungen formulieren können S1 + B2 B1 + S2: wenn zwei Stoffe gegeben sind, die Protonenübertragung vollständig angeben können. – MWG aufstellen können; Sonderformen kennen: Formel für die Säurekonstante KS und die Basenkonstante; Ionenprodukt des Wassers; Löslichkeitsprodukt – Organische Verbindungen systematisch benennen können und Ox.zahlen anhand einer gegebenen Formel bestimmen können – Elektronenübertragungen formulieren (ausgleichen) können und die Begriffe Oxidation, Reduktion, e–-Donator (Reduktionsmittel), e–-Akzeptor (Oxidationsmittel) anwenden können. Aus der Angabe müssen dabei die korrespondierende Redoxpaare ablesbar sein. Gibbs-Helmholtzgleichung: Gleichung kennen Vorzeichen für H, S abschätzen können (in eindeutigen Fällen) und somit die Aussage treffen können, ob ein freiwilliger exergonischer (G<0) oder endergonischer Prozess vorliegt (G>0); Einfluss der Temperatur (wegen T · S) Das Vorzeichen von H zeigt sich anhand einer Wärmebilanz (exotherm/endotherm); Entropiezunahme (S>0) liegt vor, wenn die "Unordnung" zunimmt wegen: die Teilchenzahl zunimmt (→Zersetzungsreaktion), sich die Teilchen auf einem größeren Raum frei bewegen können (→Gas), homogene Mischungen entstehen, sich geordnete Strukturen auflösen (→Kristall schmilzt, löst sich). Sinngemäß Gegenteiliges weist auf eine Entropieabnahme hin. Säure-Basen-Gleichgewichte (Protolysegleichgewichte) Protonenübertragung nach Brönsted ersetzt ältere "Dissoziationstheorie" für Säuren und Basen ("HCl → H+ + Cl–"). Die Tatsache, dass saure und basische Lösungen Elektrolyte sind, wird von beiden Theorien erklärt. Allgemeines Reaktionsschema eines Protolysengleichgewichts kennen; korresp. S/B-Paare formulieren können. Ionenprodukt KW von H2O anhand der MWG-Formulierung für die Autoprotolyse angeben können. Zahlenwert kennen. pH und pOH: Definitionen kennen; wissen, dass wegen KW = 10–14 [mol2/l2] gilt: pH + pOH = 14 pH-Wert-Berechungen: Bei Lösungen starker Säuren und Basen den pH-Wert anhand gegebener Konzentrationen oder Massenangaben berechnen können (natürlich auch in "umgekehrter" Richtung: der pH einer Lösung ist 13 – Wie groß ist c(OH–) in dieser Lösung bzw. wie viel g NaOH mussten in einem Liter gelöst werden um diesen pH zu erzielen [pH 13 pOH = 1 c(OH–) = 0,1 mol/l n(OH–) = 0,1 mol; m = M n m = 40 g/mol 0,1 mol m(NaOH) = 4 g]) Anhand von pKS-Werten die Lage eines Protolysegleichgewichtes vorhersagen können; Gleichgewicht liegt auf der Seite der schwächer reagierenden Stoffe Titrationen: Äquivalenzpunktberechnungen (n1 = n2 c1 · v1 = c2 · v2) Titrationskurven auswerten können → Äquivalenzpunkt, bei schwacher Säure: außerdem Halbäquivalenzpunkt, Pufferbereich, Äquivalenzpunkt im schwach Basischen Titrationskurven zeichnen können, wenn charakteristische Werte gegeben sind (pKS-Wert, Äquivalenzpunkt) Puffer: Pufferphänomen erklären und anwenden können; Aufbau eines Puffergemischs; Puffergleichung nach Henderson und Hasselbalch kennen pH einer schwachen Säure im Pufferbereich, d.h. in der Nähe des Halbäquivalenzpunktes angeben können Indikatoren: Verschiebung des Indikatorgleichgewichtes durch Säure-/Basenzugabe, Umschlagsbereich (vgl. Puffer, Henderson-Hasselbalch-Gleichung), Ursachen des Farbwechsel (→ besprochene Beispiele: Bromthymolblau, 4-Nitrophenol) Hinweis auf Besonderheiten mehrprotoniger Säuren: wichtige Beispiele: H2SO4, H2CO3, H3PO4, Carbonsäuren mit mehreren Carboxylgruppen H2SO4 ist die einzige Säure die in H2O freiwillig beide Protonen abgibt, das Gleichgewicht H2SO4 + 2 H2O HSO4– + H3O+ + H2O SO42– + 2 H3O+ 2– liegt ganz auf der rechten Seite, SO4 hat praktisch keine basischen Eigenschaften Außer bei H2SO4 weisen die Titrationskurven mehrere Puffer- und Äquivalenzpunkte auf; z.B. bei H3PO4: erster Pufferpunkt bei pKS(H3PO4), zweiter Pufferpunkt bei pKS(H2PO4–) dritter Pufferpunkt bei pKS(HPO42–); die Titrationskurve der H3PO4 ist im Buch abgebildet Redoxgleichgewichte: Wissen, dass Redoxreaktionen im Unterschied zu Protolysen häufig hohe Aktivierungsenergien aufweisen Redoxreaktion mit Ladungsausgleich formulieren können einfache Redoxgleichgewichte (zwischen Metallen und Metallionen "Fe + Cu2+"; zwischen Metall und Nichtmetall "Zn + I2") beurteilen können: Beobachtungen auswerten, Lage des Gleichgewichtes angeben, Vorzeichen des Redoxpotentials angeben bzw. auswerten können; z.B. negatives Potential weist auf den stärkeren Donator hin