GLF
Werbung
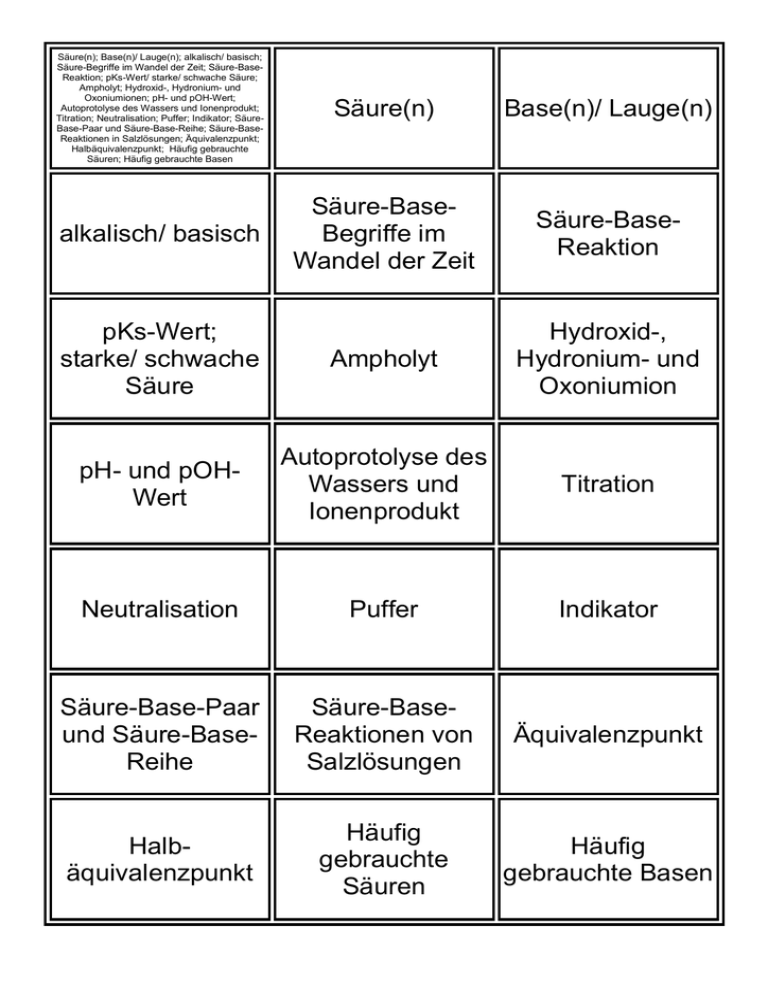
Säure(n); Base(n)/ Lauge(n); alkalisch/ basisch; Säure-Begriffe im Wandel der Zeit; Säure-BaseReaktion; pKs-Wert/ starke/ schwache Säure; Ampholyt; Hydroxid-, Hydronium- und Oxoniumionen; pH- und pOH-Wert; Autoprotolyse des Wassers und Ionenprodukt; Titration; Neutralisation; Puffer; Indikator; SäureBase-Paar und Säure-Base-Reihe; Säure-BaseReaktionen in Salzlösungen; Äquivalenzpunkt; Halbäquivalenzpunkt; Häufig gebrauchte Säuren; Häufig gebrauchte Basen Säure(n) Base(n)/ Lauge(n) alkalisch/ basisch Säure-BaseBegriffe im Wandel der Zeit Säure-BaseReaktion pKs-Wert; starke/ schwache Säure Ampholyt Hydroxid-, Hydronium- und Oxoniumion pH- und pOHWert Autoprotolyse des Wassers und Ionenprodukt Titration Neutralisation Puffer Indikator Säure-Base-Paar und Säure-BaseReihe Säure-BaseReaktionen von Salzlösungen Äquivalenzpunkt Halbäquivalenzpunkt Häufig gebrauchte Säuren Häufig gebrauchte Basen Teilchen, die Protonen aufnehmen können. Protonenakzeptoren. Aus der Säure entsteht die konjugierte Base. Laugen sind bestimmte basische Lösungen, die z.B. bei der Herstellung von Laugengebäck eingesetzt werden. Molekülverbindungen, die beim Lösen in Wasser in H+Ionen und Säurerest-Anionen zerfallen. ProtonenDonatoren. Aus der Säure entsteht die konjugierte Base. Chemie GLF Klasse 3 Block 3 Reaktion, bei der Protonen übertragen werden. Eine Säure braucht immer eine Base, um sauer reagieren zu können. S/BReaktionen können in wässriger Lösung oder in der Gasphase stattfinden. Lavoisier: Alle Säuren enthalten das sauer-machende (oxygene) Element Sauerstoff; Arrhenius: Alle Säuren zerfallen in Wasser in H+ und ein Säurerestanion. Brönstedt: Säuren sind Protonendonatoren. Lösungen, die OH- -Ionen enthalten, nennt man basisch. Alkalimetallhydroxide ergeben in Wasser alkalische Lösungen. Die Lösungen fühlen sich seifig an. Basische Lösungen enthalten das Hydroxidion (OH-). Saure Lösungen enthalten das Oxoniumion (H3O+), das hydratisiert als Hydroniumion bezeichnet wird. Ein Stoff, der sowohl als Säure, als auch als Base reagieren kann, wie z.B. Wasser Der pKs-Wert ist ein Maß für die stärke eine Säure. Starke Säuren (pKs < 0) geben gerne ein Proton ab, schwache (pKs Zwischen 0 und 14) weniger gerne. Methode zur Konzentrationsbestimmung saurer oder basischer Lösungen. Zu einer sauren Lösung unbekannter Konzentration wird eine basische Lösung getropft, bis der pH-Wert sprunghaft ansteigt Äquivalenzpunkt Wasser kann als Ampholyt eine Autoprotolyse eingehen. Zwei Wassermoleküle zerfallen in OHund H3O+. Die Konzentrationen beider Ionen sind sehr klein. [OH-] * [H3O+] = 10-14mol2/l2 = KW...Ionenprodukt des Wassers Maß, welches angibt, wie sauer bzw. basisch eine Löung ist. pH = -log[H3O+] pOH = -log[OH-] pH + pOH = 14 Ein Farbstoff, der durch seine Farbe anzeigt, ob eine saure, eine neutrale oder eine basische Lösung vorliegt (pHWert nur sehr grob). Ein Puffer fängt pHSchwankungen einer Lösung auf, indem er H3O+- und OH- Ionen abfängt. Er setzt sich aus einer schwachen Säure und ihrer konjugierten Base meist im Verhältnis 1:1 zusammen. Bei der Neutralisation gibt man gleiche Stoffmengen Säure und Base zusammen. Dabei entsteht meist Wasser und Salz. Der pH-Wert rückt näher an 7, ist aber quasi nie genau dort. Bei der Titration ist der Äquivalenzpunkt erreicht, wenn die gleiche Stoffmenge an Säure oder Basen hinzutitriert wurde, und so die Konzentration der Probelösung berechnet werden kann. Der Ä. ist selten bei pH=7. Disoziieren Salze in einer Lösung in ihre Ionen, so sind diese häufig in der Lage als schwache Säuren oder Basen den pH-Wert der Salzlösung zu beeinflussen. Gibt eine Säure ein Proton ab, so entsteht aus ihr ihre konjugierte Base. Beide zusammen bilden ein SäureBase-Paar. Die Paare können nach der Säurestärke in einer Reihe geordnet werden. Alkalimetallhydroxide...XOH, wie Natriumhydroxid...NaOH (als Lösung Natronlauge genannt); Erdalkalimetallhydroxide Y(OH)2; Ammoniak...NH3; Salze schwacher Säuren (z.B. Carbonate) Salzsäure...HCl; Ameisensäure...HCOOH Essigsäure...CH3COOH; Kohlensäure...H2CO3; Schwefelsäure...H2SO4; Salpetersäure...HNO3; Phosphorsäure...H3PO4; Am Halbäquivalenzpunkt ist das Konzentrationsverhältnis von Säure und konjugierter Base (oder umgekehrt) 1. Der Zahlenwert der pH-Wertes am HÄ. Entspricht dem pKs-Wert der Säure.