Zusammenfassung OC I
Werbung

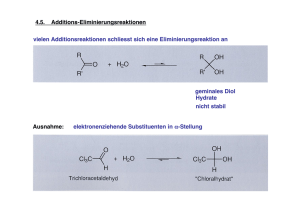
Zusammenfassung OC I Wertigkeit: 1 H,F,Cl,I,Br 2O 3N 4C 5 P,S b c d a e Doppelbindungsparameter: 1 x // + 2x /// + 1 x Ringe F = (2a + 2d + 3e – b)/2 Bem.: Atom + 1 tiefere Wertigkeit Atom – 1 höhere Wertigkeit Sextett statt Oktett: B,Al,C Oktetterweiterung: P,S,Cl (teilweise 10 e-) Formalladung = Valenzelektronen neutrales Atom – e- in einsamen Elektronenpaaren – ½ e- in Bingungselektronenpaaren 2 n: gerade Ketten, keine Verzweigungen o - = 1,2- ; m - = 1,3- ; p - = 1,4Cyclische KW: - Cyclo.....: mehrere Seitenketten an Kette od. 1 lange mit kleine Ring - ...cyclo...: mehrere Seitenketten an Ring od. 1 kleine an grosse Ring Radiofunktionelle Nomenklatur: – X in Säurederivaten R – CO – X, R – SO2 – X – CN \ C=O / – OH –O– / –O–O– –S– –F, – Cl, – Br, – I \ N– / Präfixe – Sufixe : Formel Carbonsäuren – COOH – COOH – SO3H – COOR – COOR – CONH2 – CONH2 Sulfonsäuren Carbonsäureester Carbonsäureaminde Amide Nitrile Aldehyde (Formylgr.) Ketone Alkohole Thiole Amine Imine Ether Sulfide (Thioether) Perioxide (Säure) – fluorid, – chlorid, – bromid, – iodid – cyanid – keton – alkohol – ether od. – oxid / – peroxid – sulfid – fluorid, – chlorid, – bromid, – iodid – amin Präfix Sufix CarboxySulfo...yloxycarbonyl... Carbamoyl- – CN – CN – CHO – CHO – CO – – OH – SH – NH2 = NH – OR – SR – O – OR CyanOxoFormylOxoHydroxyMercaptoAminoIminoAlkyl (Aryl) + -oxoAlkyl (Aryl) + -thioAlkyl (Aryl) + -dioxy- Hauptketten: Alkane / verzweigte : 1 ) längste Kette 2 ) Kette mit meisten Seitenketten 3 ) Kette mit niedrigsten lokannten für SK 4 ) Kette mit wenigsten verzweigten SK „a“-Term-Tabelle: O S N Oxa Thia Aza -säure -carbonsäure -sulfonsäure ...yl...oat ...yl...carboxylat -(säure)amid -carboxamid -carbonsäureamid -nitril -carbonitril -al -carbaldehyd -on -ol -thiol -amin -imin Alkene / Alkine 1 ) grösste Zahl an ═ und ≡ 2 ) grösste Zahl an C-Atomen 3 ) grösste Zahl an ═ 4 ) meisten Seitenketten enthalten 3 Güte („Energie“) von Grenzstrukturen: - je mehr Bindungen desto besser - Oktettkonfiguration an allen Zentren ist am besten - Je weniger Ladungstrennung desto besser - Negative Ladungen am elektronegativeren Atom sind besser als an weniger elektronegativen Atomen Reaktivität von Grenzstrukturen: Elektronen-Lücke : + elektrophilen Charakter Elektronen-Überschuss – nukleophilen Charakter Übertragung der Reaktivität eines Zentrums auf das übernächste: Vinylogie Aromatizität: (4n + 2) π-Elektronen : gezählt werden Elektronen in Doppelbindungen oder lone pairs, welche in einem π-Orbital liegen Armomatisch = cyclisch-konjugiertes System Stereochemie: Chirale Moleküle: Spiegelbild lässt sich durch Verschiebung und Drehung im Raum nicht mit Molekül zur Deckung bringen (siehe Hände) Lösungen von solchen Molekülen in optisch inaktiven Lösungsmitteln ist optisch aktiv drehen die Polarisationsebene von planar polarisiertem Licht Chiralitätszentrum = stereogenes Zentrum: Zentralatom ( C ) hat 4 verschiedene Liganden ( + ) - : rechtsdrehend : Drehrichtung der optischen Aktivität ( – ) - : linksdrehend : Drehrichtung der optischen Aktivität keine offensichtliche Beziehung zur absoluten Konfiguration (=Konstitution und Anordnung im Raum) racemische Gemische: Enantiomere 1 : 1 keine optische Aktivität/Drehung Racemat : ± 1 : 1 ; Konglomerat: entweder + oder – CIP absolute Konfiguration R: rectus = Uhrzeigersinn S: sinester = Gegenuhrzeigersinn höhere Ordungszahl hat Priorität Mesoform: interne Spiegelebene alle Chiralitätszentren in konstitutionell identischen Zentren umgekehrter absoluter Konfiguration überführen achirales Zentrum 4 Bestimmungsschlüssel: ( = nein) (► = ja) Stereochemische Beziehungen: Topozität: (zwei isomorphe Liganden im gleichen Molekül vergleichen) nicht Isomere Gleiche Summenformel? ▼ gleiche Verbundenheit? ▼ durch Drehung und Verschiebung im Raum zur Deckung zu bringen? ▼ identisch Konstitutionsisomere Stereo - = Konfigurationsisomere │ ↓ Spiegelbilder → Diastereomere ▼ Enatiomere gleich gebunden ▼ durch Cn verknüpft ↓ durch σ verknüpft ↓ diastereotop Re - konstitutop ► homotop ► enantiotop Si Fischerprojektion: L: links D: rechts -C-Atom mit höchster Oxidationsstufe (=Anzahl Bindungen mit Heteroatomen) ist oben Wenn nur OH letzte OH bestimmend ob D oder L Wenn NH2 NH2 bestimmend ob D oder L CHO HO--- | |---OH |---OH CH2OH CHO |---OH OH--- | OH---| CH2OH D – Arabinose L – Arabinose ▲ Perspektivische Keilstrichformel Anzahl Stereoisomere mit gleicher Konstitution : 2n ; n = Anzahl Chiralitätszentren Helizität: b a‘ \ / C=C / \ a b‘ E (trans) a‘ / a \ C=C / P: Rechtsschraube M: Linksschraube \ b‘ b Z (cis) Moleküldynamik – Konformationsanalyse: Konformation: 3D – Geometrie eines Moleküls mit festgelegten Drehwinkeln um Einfachbindungen Newman – Projektion: Gestaffelt: Energieminimum siehe Coulombgesetz 5 Pitzerspannung: durch die Abstossung zweier nicht direkt gebundenen Atomen verursachte Spannung Konformere: Konformatioen, die Energieminimum entsprechen ( nur gestaffelt) Abstossung: grosse Moleküle (Atome) stossen sich mehr ab als kleine oder grosse „gemischt“ mit kleinen grössere Abstossung höhere Energie enantiomorph: Energie gleich spiegelbildlich ; alle anderen Paare diastereomoph Cyclohexan und substituierte Cyclohexane: Konformer mit equatorialen Substituenten hat tiefere Energie als Konformer mit axialen. je grösser Substituenten, desto „lieber“ equatorial (kleine axial) : aufgrund der Energie stabilste Konformation: - gegebene Konformation umklappen axial ↔ equatorial - Umklappung mit gegebener Konformation vergleichen! Drehung um partielle Doppelbindung: ═─═ : Drehung um Einfachbindung s – trans (Hauptkonformer) ↔ s – cis (einzelne) Vorgang nach rechts braucht Energie (Ea) Organische Säuren und Basen Säure = Protonendonor Base = Protonenakzeptor Wasser als Base :pka = – logka ∆Gr° = – RTlnk Wasser als Säure :pkb = – logkb pka + pkb = 14 H3O+ : pka = – 1,7 ; H2O : pka = + 15.7 Konjugierte Säure zu OH- darüber oder darunter nicht mit H2O messbar (reagiert sofort zu H3O+ oder OH-), aber Zwischenprodukte der Reaktionen zu Teil sichtbar. [Bemerkung: magic acid: pka ca. -20 ; DMSO als Medium: pka ca. 40] Säure destabilisieren Base stabilisieren pka ↓ Säurestärke steigt Säure stabilisieren Base stabilisieren pka ↓ Säurestärke sinkt Säurestärkebeeinflussende Faktoren: | – Solvatation | – Atomgrösse | – Polarisierbarkeit | – Induktiver Effekt : σ – Akzeptor – Effekt zunehmende Elektronegativität des ▼ σ – Donor – Effekt Substituenten zunehmende nimmt mit zunemender Distanz rasch ab Säurestärke (bessere Stabilisierung der – Dipole verstärken Deprotonierung zusätzlich konjugierten Base) – Jede Säuredissoziation hinterlässt lone-pair (Ausnahme Doppelbindung) 6 M – Effekt : π – Akzeptor – Effekt π – Donor – Effekt Delokalisation in konjugierten Systemen von lone-pairs bzw. von Doppelbindungen (bessere Delokalisation stärkere Säure) Intramolekulare Wasserstoffbrücken: Basestärkebeeinflussende Faktoren: – Induktiver Effekt – M – Effekt Amide werden am Sauerstoff protoniert (konjugiertes System soll erhalten bleiben, da stabiler) Guanidine gehören zu den stärksten ungeladenen organischen Stickstoffbasen sp3 > sp2 > sp Hybridisirung des Stickstoffatoms: Je höher der s-Anteil am lone-pair des N, desto schwächer ist die Base CH-Säuren Ketone und Aldehyde sind saurer als Ester : weil immer π-Donoren (Akzeptoren) – und σ-Akzeptoren (Donoren) – Effekte berücksichtigen Tautomere: Tautomere: Konstitutionsisomere, welche durch intramolekularen Protonentransfer übergehen - Tautomere Säuren haben dieselbe konjugierte Base 7 Lewis-Acidität: – Lewis-Base: Teilchen mit lone-pair oder elektronenreicher Mehrfachbindung ▼ Bornsted-Base = Nukleophil – Lewis -Säuren: Teilchen, das Elektronenpaar unter Ausbildung einer Bindung aufnehmen kann Lewis-Säure ≠ Bornsted-Säure Säure = solvatisierte Protonen (gibt sie nicht ab) z.B. Mg 2+, Al 3+, BF3 Bemerkung: Es kann nicht von Basizität eines Reagens (pka in Wasser) auf dessen Nukleophile gegenüber anderen Elektrophilen als H+ geschlossen werden. Bsp.: Elektrophil: H+ Amine sind viel basischer als Phosphine Elektrophil: Me–Hg+ Phophine sind gegenüber Me–Hg+ viel nukleophiler als Amine. Kleine Kationen Harte Säuren (Elektrophile) z.B.: Li+, H+ Harte Basen (Nukleophile) z.B.: OH-,H2O Harte Säuren verbinden sich bevorzugt mit harten Basen. Weiche Säuren verbinden sich bevorzugt mit weichen Basen. diffuse, grosse Kationen Weiche Säuren (Elektrophile) Weiche Basen (Nukleophile)