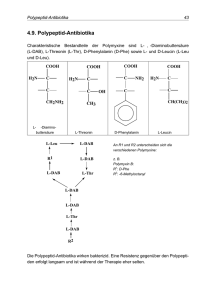
Untersuchungen zur Diagnostik und Prävalenz von Infektionen
Werbung

Literaturrecherche Beeinflussung der Wirksamkeit von Colistin in Futtermitteln Bei Betriebsbesuchen treten immer wieder Fälle auf, bei denen therapieresistente DurchfallErkrankungen festgestellt werden können, obwohl der Einsatz von Colistin durch Sektion und Antibiogramm empfohlen wurde. Die Anwendung des Medizinalfutters wurde jedoch korrekt durchgeführt. Auf meine Anfrage bei verschiedenen Pharmafirmen nach den möglichen Gründen für ein Therapieversagen und wie lange Colistin in Futtermitteln wirksam ist, habe ich folgende Antworten bekommen: Es ist leider sehr schwierig, Ihre Frage genau zu beantworten. Die Stabilität von den diversen Aktivsubstanzen hängt so stark von der Art der Futterbestandteilen ab, dass bis anhin, keine gängigen Untersuchungsmethoden etabliert wurden. Das gilt natürlich für alle MedizinalKonzentrate wie z.B. unser VSF-SK500. Aber besser als alle mögliche Untersuchungsmethoden gelten die täglichen Erfahrungen von unseren Kunden, die wir seit Jahren erhalten. Eine ungenügende Wirksamkeit dieses Produktes wurde bisher nie nach der Beimischung mit Alleinfutter festgestellt. Vom Institut für Pharmakologie am Tierspital Zürich wurden mir folgende: Zum Thema Colistin lässt sich leider nicht viel finden. Im Referenzwerk "Pharmakotherapie bei Haus- und Nutztieren" (Löscher und Ungemach) wird kurz auf Inkompatibilitäten hingewiesen: Colistin ist inkompatibel mit: Cephalosporinen, Erythromycin, Kanamycin, zweiwertige Kationen, ungesättigten Fettsäuren und Polyphosphaten. An sich eine breite Palette. Ich könnte mir vorstellen, dass Kationen, Fettsäuren und Phosphaten in gewissen Futtermitteln anzutreffen sind. Aus dem ängelsächsichen Raum existieren noch weniger Daten, da die Substanz in den USA keinen Einsatz findet. Folgende Literatur konnte mir vom Institut für Pharmakologie zur Verfügung gestellt werden: Polymyxin B Sulfate and Colistin: Old antibiotics for emerging multiresistant gram-negative bacteria M. E. Evans et al. The Annals of Pharmacotherapy 33, 1999, 960-967 Die Polymyxine wurden erstmals aus Bacillus spp. isoliert. Die Basisstruktur besteht aus einem polykationischen Peptidring, der aus 8-10 Aminosäuren zusammengesetzt ist. An den Peptidring gebunden ist eine Fettsäurekette. Diese Grundstruktur machen die erwähnten Wirkstoffe amphiphil und somit löslich in Blut, aber auch in Lipidmembranen. Polymyxin B wurde 1947 aus Bacillus polymyxa isoliert, Colistin (Polymyxin E) konnte 1950 aus Bacillus colistinus isoliert werden. Die Polymyxine wurden zuerst zusammen mit einem Lokalanästhetikum (Dibucaine HCl) als i.m. Injektionslösung zugelassen. In den späten 60er Jahren wurde eine neue Formulierung (Coly-Mycin M Parenteral) zur i.v. Anwendung zugelassen. Obwohl andere Agens mit der gleichen Grundstruktur wie Polymyxin B und Colistin aus Bacillus spp. gewonnen werden konnten, wurden diese jedoch nie für den klinischen Gebrauch aufbereitet. Nonapeptid-Derivate von Colistin und Polymyxin B wurden ebenfalls prepariert. Sie haben antiendotoxinogene Aktivität, aber ihre antimikrobielle Wirkung ist nur sehr gering. In niedrigen Konzentrationen wirken Polymyxine bakteriostatisch in höheren Konzentrationen bakterizid. Bei Konzentrationen von < 2 µg/mL sind beide Stoffe aktiv gegen die meisten E. coli Stämme, P. aeruginosa und alle Spezies der Enterobacterien, Salmonellen, Shigellen , Pasteurellen, Brucellen und Bordetellen. Proteus, Serratia, Providencia und Edwardsiella sind bis zu Konzentrationen von < 200 µg/mL oft resistent. Anaerobe Mitglieder der Familie Neisseria und alle gram-positiven aeroben Keime sind gegenüber Polymyxinen resistent. Es gibt nur wenige Daten über den Einsatz von Polymyxinen kombiniert mit anderen Antibiotika. Eine in vitro Studie zeigte eine synergistische Wirkung von Polymyxin B zusammen mit Rifampin gegen P. aeruginosa. Ein weiterer Bericht beschreibt die Effizienz der Behandlung einer PseudomonadenEndocarditis mit einer Kombination von Polymyxin B und Carbenicillin. Gemäss einem anderen Autor jedoch wurde die gleiche Therapie ohne Erfolg bei 21 weiteren Patienten angewendet. Das Nationale Komitee für klinische Laborstandards (USA) lieferte bisher keine Daten zur Sensitivität von Polymyxinen. Ersteller : Riccarda Ursprung Datum : 21.01.2005 Seite 1 von 3 Polymyxine verändern die Zellwand der gram-negativen Bakterien und führen so zu einem schnellen Wechsel der Permeabilität, was zum sofortigen Zelltod führt. Die Bindung des Antibiotikums an die Zellwand erfolgt über den polykationinschen Bereich von Polymyxin, welcher sich an die Stelle der Ca2+-und Mg2+-Brücken setzt, die sonst die Lipopolysaccharide (LPS) stabilisieren. Diese Bindung kann durch eine hohe Konzentration von divalenten Kationen antagonisiert werden. Eine zusätzliche Komplexbildung zwischen den LPS-Molekülen und dem Antibiotikum erfolgt über die hydrophobische Interaktion zwischen der Lipid A-Struktur der LPS und der Fettsäurekette der Polymyxine. Erhöhte Antibiotika-Konzentrationen führen zu einer verstärkten Zellwandpermeabilität und schliesslich zur Zelllyse. Mutationen oder Adaptationen können bei gram-negativen Bakterien zu Resistenzen führen. Mutationen sind erblich. Sie kommen bei zu niedrigen AB-Konzentrationen vor und es benötigt keine längere Präsenz von Antibiotika. Adaptationen sind nicht vererblich und werden durch zu hohe ABKonzentrationen bewirkt. Auf molekularer Ebene kann eine solche Resistenz ausgelöst werden, indem Bakterienstämme wiederholt ansteigenden AB-Konzentrationen ausgesetzt werden. Die Resistenz kann durch Veränderungen in der LPS-Zusammensetzung oder durch Ersatz von Mg 2+ durch das Protein H1 in der Aussenmembran erfolgen. Das H1 Protein erhöht die bakterielle Resistenz, weil es durch Polymyxin weniger gut von den LPS-Molekülen verdrängt werden kann als divalente Kationen. Normalerweise besteht eine vollständige Kreuzresistenz zwischen Polymyxin B und Colistin. Neben der antibakteriellen Wirkung können Polymyxine Endotoxine neutralisieren, was andere Antibiotika nicht können. In tierischen Modelversuchen konnte gezeigt werden, dass durch Polymyxin B LPS-induzierte intravaskuläre Koagulation und Leukopenie sowie durch gram-negative Bakterien ausgelöste Meningitiden und endotoxin bedingte Schocks verhindert werden können. Es gibt keine publizierten modernen Studien zur Pharmakokinetik von Polymyxinen. Die letzten veröffentlichten Arbeiten stammen aus den 60er und 70er Jahren. Es wird davon abgeraten, Polymyxin B i.m. zu verabreichen, da es schmerzhaft sein kann. Es wird zu 60% über die Nieren ausgeschieden, wie die restlichen 40% ausgeschieden werden, ist nicht bekannt. Polymyxin B erreicht keine klinisch wirksamen Konzentrationen in Gelenks- und Pleuralhöhlen und Cerebrospinalflüssigkeit. Colistin ist aufgrund seiner Toxizität nur für den oralen Einsatz zugelassen. Dabei kann die Anwendung von Colistin zu Tubulusnekrose führen und auch Neurotoxizität wurde beobachtet. Study of the stability of polymyxins B1, E1 and E2 in aqueous solution using liquid chromatography and mass spectrometry J. A. Orwa et al. Journal of Pharmaceutical and Biomedical Analysis 29, 2002, 203-212 In dieser Arbeit wurde der Abbau von Polymyxin B, E1 (Colistin A) und E2 (Colistin B) in wässrigen Lösungen mit unterschiedlichen pH-Werten (1.4, 3.4, 5.4 und 7.4) und Temperaturen (37, 50 und 60°C) untersucht. Dabei zeigte sich, dass der Abbau von Colistin bei pH-Werten über 5 verstärkt stattfindet und die Wirksamkeit bei sauren pH-Werten eher erhalten bleibt. Maximale Stabilität des Wirkstoffes konnte bei pH-Wert 3.4 nachgewiesen werden. Um die Temperaturabhängigkeit der Kinetik zu studieren, wurde der gleiche Vorgang mit pH-Werten von 1.4 und 7.4 bei 50 bzw. 60°C wiederholt. Dabei stellte sich heraus, dass die Halbwertszeit aller drei Polymyxine bei einem pH-Wert von 7.4 und der Temperatur von 60°C am kleinsten war, das heisst, dass die Polymyxine am schnellsten an Wirksamkeit einbüssten. Anhand der entstandenen Produkte wurde festgestellt, dass der Abbau über eine Razemisierung (Gleichgewichtseinstellung bei der zwei enatiomere Verbindungen ineinander übergeführt werden) abläuft. Wobei für das Colistin nicht dieselben Abbauprodukte in saurem Milieu wie in neutralem Milieu nachgewiesen wurden. Die Problematik von Kombinationspräparaten und Wirksamkeit von AB in Futtermitteln wird von der Swissmedic im Verlauf der AMV-Revision angegangen. Leider fehlen dazu immer noch gut dokumentierte Fälle: Therapieresistente Erkrankungen, Sektionen mit Antibiogramm, Behandlungsjournal, Rezept etc. Falls ihr auf solche Fälle stösst meldet die bitte direkt bei [email protected] Ersteller : Riccarda Ursprung Datum : 21.01.2005 Seite 2 von 3 Polymyxin B wurde erstmals aus Bacillus polymyxa isoliert, Colistin (Polymyxin E) konnte aus Bacillus colistinus isoliert werden. Polymyxine sind amphiphile Moleküle, welche mit den Lipopolisacchariden (LPS) der äusseren Bakterienmembran interagieren. Je nach Dosis wirken sie bakteriostatisch oder bakterizid. Zudem sind die Polymyxine die einzigen Antibiotika mit einer antiendotoxinogenen Wirkung. Polymyxine verändern die Zellwand der gram-negativen Bakterien und führen so zu einem schnellen Wechsel der Permeabilität, was zum sofortigen Zelltod führt. Für Nieren und Nervensystem können sie toxisch sein. Deshalb dürfen sie nie mit anderen potentiell nephro- und neurotoxischen Substanzen (Aminoglykoside (z. Bsp. Gentodiar Gel) und Bacitracin) kombiniert werden. Die Stabilität von Colistin in gelöstem Zustand ist bei sauren pH-Werten am besten. Colistin ist inkompatibel mit: Cephalosporinen, Erythromycin, Kanamycin, zweiwertige Kationen, ungesättigten Fettsäuren und Polyphosphaten. Mutation und Adaptation können bei gram-negativen Bakterien zur Bildung von Resistenzen führen. Mutationen entstehen bei zu geringer AB-Dosierung und können vererbt werden. Adaptationen bilden sich bei AB-Überdosierung und können nicht vererbt werden. Ersteller : Riccarda Ursprung Datum : 21.01.2005 Seite 3 von 3