Jobstvogt-Esser, Nils 24.11.04
Werbung

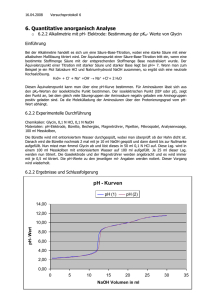
Jobstvogt-Esser, Nils Schwarz, Oliver Versuch 13 24.11.04 Gruppe 1 Titrimetrische Bestimmung 3er Säureproben mit 0,1 molarer Natronlauge Es sollen jeweils eine Salzsäure-, Essigsäure- und Phosphorsäureprobe titrimetrische mit 0,1 molarer Natronlauge bestimmt werden. Anhand der Titrationskurven sind die Säureproben voneinander zu unterscheiden. Zur Verfügung steht ein pH-Meter und Methylorange als Indikator für die Titration. Die Säureproben lassen dadurch unterscheiden, dass die Essigsäure als schwache Säure einen stärkeren Anfangsanstieg in der Titrationskurve aufweist, da sie zuerst schwach dissoziiert vorliegt und mit Zugabe an Natronlauge weiter dissoziiert und dass der Äquivalenzpunkt der Titration im alkalischen liegt. Dadurch kann man die Essigsäure von den anderen beiden Proben unterscheiden. CH3COOH + OH- CH3COO- + H2O Die Phosphorsäure kann man dadruch erkennen, dass die Phosphorsäure eine dreiprotonige Säure ist, d. h. man erhält theoretisch 3 Äquivalenzpunkte für die 3 abspaltbaren Protonen, wobei man mit 0,1 molarer Natronlauge als Maßlösung nur 2 Äquivalenzpunkt sehen kann, da das 3. Proton erst um pH 14 abgespalten wird und man mit 0,1 molarer Natronlauge maximal nur einen pHWert von 13 erreichen kann. Das 1. Proton wird im sauren- und das 2. Proton wird im alkalischen pH-Bereich abgespalten. H3PO4 + OH- H2PO4- + H2O H2PO4- + OH- HPO4- + H2O Salzsäure ist eine einprotonige starke Säure und hat ihren Äquivalenzpunkt im neutralen pHBereich. Von den 3 Säuren hat die Salzsäure den langsamsten pH-Anstieg am Anfang. H+ + CL- + OH- Cl- + H2O Zu der Ermittlung des Äquivalenzpunktes sei gesagt, dass der Äquivalenzpunkt der Punkt der Titrationskurve ist, wo die Kurve die größte Steigung hat. Um den Äquivalenzpunkt genauer auf einen Punkt festlegen zu können, schaut man sich die den pH-Sprung vor und nach dem größten Sprung an. Man entscheidet sich für den Punkt der näher an dem größeren der beiden Sprünge liegt. Säure Äquivalenzpunkt in pH Essigsäure 8,8 Salzsäure 8,45 Phosphorsäure 5,00 9,55 Verbrauch NaOH in L 0,0109 0,0126 0,01255 0,0259 Die Gehalte an Säure lassen sich wie folgt bestimmen m(x) = V * t * ceq * Meq * Faliq m(x) ist die Masse der zu bestimmenden Säure in g Molare Masse in g 60,05 36,46 98,00 V ist der Verbrauch an Natronlauge in L ceq ist die Äquivalentkonzentration der Natronlauge in mol/L Meq ist die äquivalente molare Masse an Säure in g/mol Faliq ist der aliquote Faktor den man berücksichtigen muss, da man nur einen Teil der Probelösung verwendet hat t ist der Titer der Lösung (Korrekturfaktor für die Maßlösung) Probe A (Essigsäure) m(x) = 0,0109 L * 1,02 * 0,1 mol/L * 60,05 g/mol * 5 = 0,3338g / 100mL Probe B (Salzsäure) m(x) = 0,0126 L * 1,02 * 0,1 mol/L * 36,46 g/mol * 5 = 0,2343g / 100mL Probe C (Phosphorsäure) 1. m(x) = 0,01255 L * 1,02 * 0,1 mol/L * 98,00 g/mol * 5 = 0,6272g / 100mL 2. m(x) = 0,0259 L * 1,02 * 0,1 mol/L * 98,00 / 2 g/mol * 5 = 0,6472g / 100mL Mittelwert = (0,6272g + 0,6472g) / 2 = 0,6372g / 100mL Die Dissoziationskonstanten der Säuren lassen sich ebenfalls über den Äquivalenzpunkt berechnen. Salzsäure ist eine starke Säure und dissoziiert vollständig, aber Essigsäure ist eine schwache- und Phosphorsäure eine mittelstarke Säure. Der pKs-Wert von schwächeren Säuren ist gleich dem pH-Wert der Säuren bei der Hälfte der zugegebenen Äquivalenzmenge an Maßlösung, d. h. der Verbrauch bis zum Äquivalenzpunkt ist zu halbieren und der dort vorliegende pH-Wert ist gleich dem pKs-Wert der Säure. Bei der Phosphorsäure ist zu beachten, dass man bei dem 2. Äquivalenzpunkt den Verbrauch angefangen beim 1. Äquivalenzpunkt bis zum 2. Äquivalenzpunkt nur berücksichtigt. pKs = pH (von ½ Verbrauch Äquivalenzmenge NaOH) Für die Essigsäure ergibt das den pKs-Wert 5,1 (theor. 4,75) Für die Phosphorsäure ergibt das für die 1. Protolysestufe den pKs-Wert 3,2 (theor. 2,1)und für die 2. Protolysestufe den pKs-Wert 7,4 (theor. 7,2) pKs = -lg Ks Ks = 10x(-pKs) daraus folgt Ks (Essigsäure) = 10x(-5,1) = 7,94 * 10-6 (theor. 1,76 * 10-5) Ks1 (Phosphorsäure) = 10x(-3,2) = 6,31 * 10-4 (theor. 7,52 * 10-3) Ks2 (Phosphorsäure) = 10x(-7,4) = 4 * 10-8 (theor. 6,23 * 10-8) Die Abweichungen von den Literaturwerten ist wahrscheinlich darauf zurückzuführen, dass Angleichungszeiten der einezelnen pH-Werte nicht genau eingehalten wurden, oder die Temperatur bei der titriert wurde oder die Zugabe an Wasser als Lösemittel, welches zur Probe gegeben wurde, damit die pH-Elektrode vollständig in die Probe eintauchen kann. Wahrscheinlich übt das Wasser den größten Einfluss auf den pH-Wert aus und darüber ist auch zu erklären, warum die Abweichungen im sauren Bereich größer sind als im alkalischen, da das verwendete Dest. Wasser leicht alkalisch war. Nicht bei allen 3 Titrationen hätte Methylorange als Indikator ausgereicht, da der Indikator einen Umschlagsbereich von pH 3,1 – 4,5 hat und nicht alle Äquivalenzpunkte der Titrationen in diesem Bereich liegen.