Ozon GFS
Werbung

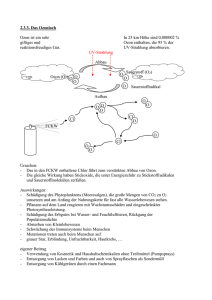
Ozon - GFS Von: Inna Wernick und Shirin Gatter Stammkurs: 12/5 Schuljahr: 12/2 Inhaltsverzeichnis 1.Definition ............................................................................................ 3 2. Bodennahes Ozon .............................................................................. 3 2.1 Die Entstehung.............................................................................. 3 2. 2 Gesundheitliche Auswirkungen .................................................. 5 2.3. was dagegen tun........................................................................... 5 3. Aufbau der Atmosphäre..................................................................... 6 4. Ozon in der Stratosphäre ................................................................... 6 4.1 Allgemeines .................................................................................. 6 4.2 Entstehung .................................................................................... 7 4.3 Wirkung ........................................................................................ 8 5.Ozonlöcher .......................................................................................... 8 5.1 Entdeckung ................................................................................... 8 5.2 Entstehung .................................................................................... 9 a) Chemisch ..................................................................................... 9 b) Meteorologisch .......................................................................... 13 5.3 Wirkung ...................................................................................... 15 5.4 Umweltschutzmaßnahmen ......................................................... 16 6. Fazit: ................................................................................................ 17 Quellen ................................................................................................. 19 2 1.Definition Das Ozonmolekül wurde von Christian Friedrich Schönbein im Jahr 1839 entdeckt und von Hartley 1881 in der Atmosphäre nachgewiesen. Das Wort Ozon stammt von dem griechischen Wort ozein, was riechen bedeutet, und wird somit als „das Riechende“ übersetzt. Andere Namen für Ozon sind auch Trisauerstoff oder „aktiver Sauerstoff“ .Es beschreibt ein Molekül, das sich aus drei miteinander verbundenen Sauerstoffmolekülen zusammensetzt, es hat deshalb die Summenformel O3, was Jacques-Louis Soret 1863 nachwies. Als Strukturformel sieht Ozon so aus: Die Ladung bewegt sich auf dem Molekül, deshalb ist es sehr reaktionsfreudig. Ozon ist als Leitsubstanz einer Gruppe von sehr reaktionsfähigen Substanzen bekannt, die sich unter dem Einfluss von Sonnenstrahlung bilden und schnell wieder zerfallen, den Photooxidantien (weiteres Beispiel für diese Gruppe!). Ozon ist ein blaues Gas, es ist giftig und brandfördernd. T Giftig O Brandfördernd Ozon kommt sowohl in der hoch gelegenen Stratosphäre, als auch in der bodennahen Troposphäre vor. 2. Bodennahes Ozon 2.1 Die Entstehung Die unterste Schicht der Atmosphäre der Erde, die Troposphäre, enthält 90% der Luft. Sie ist in den verschiedenen Zonen der Erde unterschiedlich dick, in unseren Breiten nur etwa 10 km. Sie besteht aus einem Gasgemisch aus Stickstoff, zu 78%, und aus Sauerstoff zu etwa 21%. Außerdem kommen das Edelgas Argon, Kohlendioxid und auch Ozon kommt natürlich in der Troposphäre vor, jedoch nur zu einer Konzentration zwischen 40 und 80 µg (Mikrogramm) pro Kubikmeter Luft (also 40 bis 80 Millionstel Gramm). 3 Diese Konzentration ist an sich nicht schädlich. Dennoch hören wir an besonders warmen Sommertagen von Ozonwarnungen. Zu der erhöhten Ozonkonzentration kommt es so: Bei der Verbrennung von Benzin entstehen Stickoxide. Diese (NO oder auch NO2) kommen auch in industriellen Schadstoffemissionen vor. Eine besonders wichtige Rolle spielt bei der Ozonentstehung Stickstoffdioxid(NO2). Schon durch die energiearme, langwellige UV-Strahlung zerfällt es zu Stickstoffmonoxid und atomarem Sauerstoff. NO2 (+UV-Strahlung) -> NO + O Der atomare Sauerstoff ist hochreaktiv und verbindet sich unter intensiver Sonneneinstrahlung rasch mit dem molekularen O2 in der Luft zu Ozon O2 + O -> O3 (Ozonmolekül) Folgende beiden Faktoren begünstigen also das Entstehen von Ozon in Bodennähe: 1.) Das Vorhandensein von Stickstoffoxiden und von Kohlenwasserstoffen aus Abgasen, 2.) UV-Strahlung der Sonne Deshalb steigen die Ozonwerte im Hochsommer besonders in der Umgebung von Ballungsgebieten mit viel Straßenverkehr und in Indusriegebieten. Dann spricht man auch von Sommer- oder Ozonsmog. Ozon kann aber auch in Bodennähe natürlich entstehen, z.B. bei Gewitterentladungen. 4 2. 2 Gesundheitliche Auswirkungen Die Wirkung auf uns Menschen Die starke Reaktionsfähigkeit des Ozons prägt auch die biologische Wirkung auf uns Menschen. Das Molekül wirkt hauptsächlich am Gewebe des Atemtraktes. Ozon ist kaum wasserlöslich und wird deswegen in den oberen Atemwegen fast nicht abgefangen. So dringt Ozon in die Lunge, wo es das Gewebe reizt. Vor allem für Asthmatiker und Allergiker ist Ozon problematisch. Da das bodennahe Ozon ein starkes Atemgift ist, können bei ozonempfindlichen Personen (etwa 10-30% der Bevölkerung) schon bei einer Ozonwerterhöhung auf über 100 µg/m3 Luft gesundheitsschädliche Folgen wie Kopfschmerzen, Schleimhautreizungen, Hustenreiz und/oder Atembeschwerden aufkommen Die Bevölkerung muss aber offiziell erst ab Werten über 180 µg/m_ Ozon in der Luft über die bestehende Gefahr informiert werden. Bei diesen Werten treten auch bei ozon-unempfindlichen Personen gesundheitliche Probleme auf. Deshalb wird vor anstrengenden Betätigungen im Freien gewarnt. Bei 360 µg/m3 besteht akute Ozongefahr. Bei diesen Werten ist die Lungenfunktion um etwa 50% reduziert, da z.B. das Volumen beim Ausatmen abnimmt und Einatmen schwer wird. Der Aufenthalt im Freien bei dieser Ozonkonzentration kann zu Erbgutund Lungenschäden, und einer Erkrankung der Atemwege führen. Zusätzlich werden die Schleimhäute angegriffen. Ozon ist außerdem seit 1995 als krebserregende Substanz klassifiziert. Es ist jedoch nicht nur für die Menschen gefährlich, sondern auch am Waldsterben beteiligt, gehört außerdem zu den Treibhausgasen und ist damit wie das Kohlendioxid und andere Schadstoffe für den Treibhauseffekt verantwortlich. 2.3. was dagegen tun Fahrzeuge mit Katalysator haben einen 10-mal geringeren Ausstoß an Stickoxiden als Fahrzeuge ohne Katalysator. Deshalb wurde die Regelung eingeführt, dass Autos mit hohem Schadstoffausstoß bei Sommersmog, also ab einem Stundenmittelwert von 240 µg/m3 Luft, nicht mehr fahren dürfen. Versuche bewiesen dass durch diese Fahrverbote die Ozonbelastung stark vermindert werden kann. Langfristig kann das Problem aber nur mit einer umweltbewussteren Verkehrspolitik, also dem Ausbau des öffentlichen Nahverkehrs, und verbrauchsärmeren Autos gelöst werden. 5 3. Aufbau der Atmosphäre Die Erdatmosphäre besteht aus unterschiedlichen Schichten. Die unterste, in der wir leben, ist die "Troposphäre" hier spielt sich auch z.B. das Wetter ab. Die dünne Schicht zwischen der “Troposphäre“ und der darüber liegenden Schicht nennt man "Tropopause". Über ihr befindet sich die “Stratosphäre“. Hier befindet sich die Ozonschicht. 4. Ozon in der Stratosphäre 4.1 Allgemeines Welche Menge an Ozon sich über einem Punkt der Erdoberfläche befindet wird in Dobson Einheiten(DU) ausgedrückt. Die Ozonschicht ist in den Tropen (entlang dem Äquator) mit 260DU am dünnsten, gegen die Pole hin wird sie dicker. Diese Werte schwanken jedoch mit den Jahreszeiten stark. Die Ozonschicht ist eigentlich keine Schicht, sondern eine art fein verteilter, zarter Schleier. Sie wird auch nach dem Schöpfer einer Publikation der grundlegenden photochemischen Ozonbildungs- und Abbaumechanismen (1930) „Chapman-Schicht“ genannt. 6 4.2 Entstehung Ozon wird gebildet, wenn die intensive ultraviolette Strahlung der Sonne auf die höheren Teile der Stratosphäre (15-50km) trifft. Dabei werden Sauerstoffmoleküle (02) in atomaren Sauerstoff (O) dissoziiert (aufgespaltet(=Protolyse)). Der atomare Sauerstoff verbindet sich dann mit einem Sauerstoffmolekül zu Ozon. O2 + hv-> O + O (1) oder auch: O2 + Licht -> O + O O + O2-> O3 (2) (wie bei bodennahem Ozon) (1/v = Wellenlänge = ca.240-320 nm(also große Energie)) Das entstandene Ozon wird durch die UV-Strahlung wieder aufgespaltet, verbindet sich dann jedoch bald wieder mit einem neuen Sauerstoffmolekül, so dass wieder gleichviel Ozon vorhanden ist. O3 + hv-> O2 + O (3) (1/v = Wellenlänge <900nm(also weniger Energie)) O + O2-> O3 (2) wie oben So wird Ozon ebenfalls zerstört: O + O3-> O2 + O2 (4) Diese Reaktionen (1)-(4) sind bekannt als "Chapman-Reaktionen" oder „ChapmanZyklus“. Mit zunehmender Höhe verlangsamt sich Reaktion (2), gleichzeitig wird Reaktion (3) schneller. So ergibt sich ein Gleichgewicht( da Nullreaktion 3 O2 -> 2 O3 und 2 O3 -> 3 O2 ), das über die Ozonkonzentration entscheidet. In der oberen Atmosphäre ist mehr atomarer Sauerstoff, weil dort die UV-Intensität hoch ist, (weshalb die Sauerstoffmoleküle schnell zerlegt werden?). Da mit abnehmender Höhe die Luft in der Stratosphäre dichter wird, werden mehr UV-Strahlen absorbiert(=?)(Sie bilden mit Sauerstoff Ozon (das nicht sofort zerlegt wird, weil die Strahlung nicht mehr soviel Energie enthält, was gut ist, da Ozon mit weniger Energie schon zerfällt).Bei ca. 20km ist die UV-Konzentration so am höchsten. Je näher man der Erdoberfläche kommt, desto geringer werden UV-Intensität (da von Ozonschicht abgefangen) und Ozon-Konzentration (da weniger Sauerstoffmoleküle durch geringere UV-Strahlung gespalten). Diese Aspekte sind die Voraussetzung für die Entstehung der Ozonschicht. 7 4.3 Wirkung Die Bildung der Ozonschicht war die Voraussetzung für die Entstehung von Leben auf unserem Planeten. In den hohen Schichten der Atmosphäre, der Stratosphäre bei 10 bis 30 Kilometern Höhe, hält das dort verdichtete Ozon etwa 95 – 97% der intensiven ultravioletten UV-B-Strahlung der Sonne ab. Diese kurzwelligen energiereichen Strahlen sind äußerst schädlich. Die noch energiereichere UV-CStrahlung wird bereits in der Mesosphäre vollständig abgeschirmt. 5.Ozonlöcher Als Ozonloch wird die geographisch abgegrenzte Abnahme der Ozonschicht bezeichnet. Einige Wissenschaftler sprechen von einem Ozonloch wenn der Ozongehalt über einem Punkt der Erdoberfläche unter 200DU gesunken ist, andere wenn die doppelte Menge der normalen UV-Strahlung die Erdoberfläche erreicht. 5.1 Entdeckung Das erste Ozonloch wurde Ende 1970 über der Südpolarregion gesichtet. Dieses ist 2005 rund doppelt so groß wie der Kontinent Europa, 2004 war es so groß wie Nordamerika (größtes Ausmaß das je Vorkam). 1992 wurde auch das erste mal über der Nordpolarregion ein Ozonloch beobachtet. Ozonlöcher können auch einmalig auf Grund von Änderung der Windströmungen auftreten. Über Südspanien, Frankreich und Deutschland wurden zum Beispiel solche entdeckt (in dem Fall fingerförmige so genannte Miniozonlöcher) Über Europa wurden aber auch Schwächen in der Ozonschicht gemessen, die wie über dem Himalayagebirge periodisch auftreten. 8 5.2 Entstehung a) Chemisch Hier die allgemeine Formel der Ozonzerstörung mit Katalysatoren. Sie spielt sich überall, über Europa und den Polen gleich ab. X + O3 -> XO + O2 XO + O3 -> X + O2 9 Ozonzerstörer mit Katalysatoren sind… 1.Die Halogenverbindungen Sie wurden als erstes als Zerstörer der Ozonschicht enttarnt und haben auch tatsächlich die größte Wirkung. M.J.(Mario Jose) Molina und F. S.(Sherwood Frank) Rowland erhielten für ihre Forschungen auf diesem Gebiet 1995 den Chemienobelpreis (mit Paul Crutzen). Molina Halogenverbindungen sind menschengemachte Chemikalien. Ein Beispiel sind FCKWs (Fluorchlorkohlenwasserstoffe). Kohlenwasserstoffe sind organische Verbindungen aus Kohlen- und Wasserstoff (z.B. Methan,…). Wenn man die Wasserstoffatome durch Halogenatome ersetzt, erhält man Halogenkohlenwasserstoffe. Ein Beispiel dafür ist Frigen (Dichlordifluormethan), das in Kühlschränken eingesetzt wurde. Cl | Cl — C — F | F Beispiel der ozonzerstörenden Reaktion (an Chlor): O3 + Licht -> O2 + O O3 + Cl -> O2 + ClO O + ClO -> O2 + Cl Die Reaktionen mit Brom oder Fluor laufen auf die gleiche Weise ab. Es wurden Regelungen getroffen, die den FCKW-Ausstoß verringerten. Bromverbindungen (wirken ja auf die gleiche Weise) haben aber bei dem Problem der Ozonzerstörung an Gewicht gewonnen. 10 2. . Stickoxide 1970 wies Paul Crutzen nach, dass auch die Stickoxide NO und NO2 Ozonmoleküle zerstören und somit zu einer Verringerung des Ozongehalts führen können. Bei dieser Reaktion wirken sie katalytisch und liegen danach wieder in ihrer ursprünglichen Form vor. NO + O3 => NO2 + O2 NO2 + O => NO + O2 O3 + hv => O + O2 O3 + UV-Licht => O2 + O2 Nettoergebnis: 2O3 => 3O2 NO und NO2 entstehen aus der Aufteilung von Stickstoffdioxid (N2O), das stabiler ist und durch Zersetzungsprozesse am Boden entsteht, dann aber über den Luftkreislauf in die Stratosphäre gerät. Aber auch Flugzeugabgase enthalten diese Verbindungen. Neuere Untersuchungen lassen aber vermuten, dass die Wirkung der Stickoxide durch Flugzeugabgase überschätzt wird. 3. OH (aus Methan) Das Methan kommt durch die natürliche Luftbewegung auch in die obere Atmosphäre. Dort wird es durch photochemischen Abbau zu Formaldehyd oxydiert. CH4 + O2 -> HCHO + H2O Das Formaldehyd wird durch das Licht in weiteren Schritten oxydiert. HCHO + h -> H + HCO H + O2 -> HO2 HCO + O2 ->HO2 + CO HO2 + O ->OH + O2 11 Neben der direkten Reaktion der Zwischenprodukte HO2 mit dem einfachen Sauerstoffatom O aus der Ozonspaltung, die das Gleichgewicht zwischen O 3 <-> O + O2 stört, entsteht auch das Hydoxylradikal OH, das als Katalysator X im Ozonabbaumechanismus. X + O3 -> XO + O2 XO + O3 -> X + O2 wirkt. OH + O3 => HO2 + O2 HO2 + O => OH + O2 Neben dem natürlichen Vorkommen von Methan in Erdgas oder beim Abbau von Pflanzenresten unter Luftabschluss erzeugt die Landwirtschaft z. B. beim Reisanbau Methan. Methan-Quellen (Angaben in Tg/a: 1 Teragramm = 1 Mill.Tonnen) natürliche Quellen ----- --- anthropogene Quellen fossile Energie (Erdöl, Erdgas) 100 --- ----- Biosphäre (Reisfelder, Rinderherden, Mülldeponien) 275 --- ------ --- 375 ------ --- 535 sämtliche anthropogenen 160 Quellen alle bekannten Quellen (Quelle: nach J.T.Houghton et.al.: Climate Change 1995. The Science of Climate Change. IPCC, Cambridge 1996, S.94) Nach dieser Quelle ist damit der vom Menschen erzeugte Anteil des Methans in der Atmosphäre größer als der natürliche. 12 b) Meteorologisch Warum sind die Ozonlöcher ausgerechnet über den Polen so groß? Wie bereits gesagt gibt nicht nur über den Polen Ozonlöcher. Diese Ozonlöcher über den Polen, vor allem der Antarktis, sind jedoch viel größer, obwohl die Reaktion überall die gleiche ist. Es muss also meteorologische Ursachen haben. Der Grund dafür liegt hauptsächlich in der Polarnacht. Während dieser Monate erreicht kein Sonnenlicht den Südpol, gleichzeitig entsteht ein starker zirkumpolarer Wind von der mittleren bis zur unteren Stratosphäre. Dieser als Polarwirbel bekannte Wind bewirkt eine Abschirmung der Luft über der Polarregion. Wegen dem fehlenden Sonnenlicht kühlt die Temperatur stark ab. Ungefähr ab einer Temperatur von unter minus 80o C bilden sich polare Stratosphärenwolken (englisch kurz PSC). 13 Sie sind keine Wolken wie wir sie unter diesem Begriff kennen. Diese Wolken bestehen nicht aus kondensierten Wassertröpfchen. Ihre genaue Zusammensetzung wird immer noch intensivst wissenschaftlich untersucht, bekannt ist aber, dass sie zum Großteil aus Salpetersäure-Trihydrat bestehen, das bei einem weiteren Absinken der Temperatur zum Teil zu größeren Tröpfchen von Wassereis mit darin gelöster Salpetersäure gefriert.. Die Salpetersäure enthält Stickstoffverbindungen, die normalerweise das Chlor abfangen. Weil in der Antarktis niedrigere Temperaturen erreicht werden als in der Arktis ist das Ozonloch über der Antarktis dementsprechend wesentlich größer. Innerhalb des Polarwirbels verwandeln heterogene Reaktionen die ozonzerstörenden Stoffe, die bisher noch in Verbindungen waren, in ihre molekularen Formen. Sobald Sonnenlicht die Polarregion wieder erreicht, werden die in den Wolken gebundenen Ozonzerstörer freigesetzt. Die Moleküle werden durch das Licht schnell in ihre aggressiven atomaren Formen zerlegt. Diese große Menge an „schlagartig“ auftretenden Ozonzerstörern ist der Grund für den plötzlichen Ozonverlust. Da dies in der Südhemisphäre im Frühjahr vonstatten geht, ist es bei uns Herbst, also ca. September und Oktober Erst wenn die Sonne die Wolken schmilzt, können die Stickoxide das Chlor wieder abfangen und die Ozonzerstörung verlangsamen. Für seine Forschungen auf diesem Gebiet erhielt Paul Crutzen 1995 (gemeinsam mit M. J. Molina und F. S. Rowland) den Nobelpreis). Wichtig ist noch zu erwähnen, dass das Ozonloch und die globale Erwärmung unterschiedliche Probleme mit unterschiedlichen Ursachen sind, obwohl Beides oft im gleichen Satz erwähnt wird. Es gibt jedoch tatsächlich eine Verbindung bei diesen Themenbereichen. Eine Folge der globalen Erderwärmung ist, dass es in der Troposphäre zwar wärmer wird, die Stratosphäre jedoch abkühlt. Deshalb gibt es dort größere PSCs, also eine größere Ozonzerstörung. So kommt wieder mehr Licht in die Stratosphäre, die dadurch noch mehr erwärmt wird. Durch diese Erwärmung erhöht sich in der Troposphäre der Wasserdampfgehalt, was zur Zerstörung der Ozonschicht ebenfalls beiträgt. Auch erhöhen die Treibhausgase wie Methan und Kohlendioxid den Transport von Wasserdampf in die Stratosphäre. 14 5.3 Wirkung Durch die Abnahme der Ozonschicht gelangt mehr UV-Strahlung auf die Erde. Diese Strahlung stellt für alle Lebewesen eine große Bedrohung dar: Stärkere Sonnenbrände und Hautkrebs (in Australien hat jeder 4. Krebs) Schädigung der Augen, fördert den Grauen Star und kann in wenigen Stunden bis zur Erblindung führen Schwächung des Immunsystems Schädigung der Erbsubstanz, möglicherweise werden die Menschen unfruchtbar Vermehrung von Missbildungen möglich Bodenbakterien abgetötet -> Boden unfruchtbar -> Ernteausfälle-> Hungersnöte Phytoplankton (einzellige Pflanzen) stirbt ab (wenig Sauerstoff mehr Kohlendioxid), Schadet Ökosystem im Meer Globale Erwärmung und Ozonloch verstärken sich gegenseitig Aufgrund des riesigen Ozonlochs in der südlichen Erdhalbkugel haben dort bereits die Hauterkrankungen und die Augenleiden drastisch zugenommen, da hier bis zu 30% mehr von der schädlichen UV-Strahlung durch die Atmosphäre gelangt. Es wird angenommen, dass wenn der Ozongehalt um 1% abnimmt die Anzahl der Hautkrebsfälle um 5% zunimmt. 15 5.4 Umweltschutzmaßnahmen Die Umweltorganisation Greenpeace forderte den FCKW (=Fluorchlorkohlenwasserstoff) freien Kühlschrank. Da dieses Vorhaben für die Hersteller zu teuer und außerdem weder nötig noch brauchbar war weigerten sie sich es umzusetzen. Das Unternehmen Foron aus Sachsen bewies auf Anfrage von Greenpeace, dass es auch ohne FCKW funktioniert. Kohlenwasserstoffe ohne Chlor, wie Propan und Isobutan, stellen eine Alternative dar, die die Umwelt nicht so sehr belastet. In der Stratosphäre können diese chlorfreien Kohlenwasserstoffe sehr schnell abgebaut werden, ohne die Ozonschicht zu beschädigen. Es handelt sich bei ihnen um Naturflüssiggase, die aufgrund ihrer physikalischen Eigenschaften als Kühlmittel genutzt werden können. 1987 erklärten sich die 49 Unterzeichnerstaaten des Protokolls von Montreal einverstanden die FCKW Produktion bis zum Ende des Jahrhunderts schrittweise einzustellen. Dem Abkommen traten weitere Staaten bei. Es hat zum Ziel, die staatenübergreifende Zusammenarbeit, den Informationsaustausch bei der Forschung über die Ozonschicht und die Kontrolle der Produktion von ozonschädigenden Stoffen zu verbessern. Außerdem soll die Ozonschicht systematisch überwacht werden. Vom Montreal-Protokoll erfasst werden Stoffe wie FCKWs, Methylchloroform, Methylbromid und Tetrachlorkohlenstoff. Inzwischen wurden die Kontrollvorschriften durch die vier Änderungsprotokolle von London (1990), Kopenhagen (1992), Wien (1995), Montreal (1997) und Beijing (1999) laufend angepasst und ergänzt. Seit dem Jahr 2000 ist die Produktion vieler Halogen-Kohlenstoffe praktisch auf der ganzen Welt eingestellt. Die Produktion soll jedoch bis 2030 kontrolliert werden. 1991 brachte die NASA außerdem einen Forschungssatelliten in die Erdumlaufbahn, um die Verminderung der Ozonschicht zu beobachten. Dieser misst unter anderem die Schwankungen des Ozongehalts. Im März 1993 begann die weltweit erste Produktion von FCKW freien Kühlschränken. Heute sind immer noch Kühlschränke, Feuerlöscher und Klimaanlagen mit FCKW als Wirkungsmittel in Betrieb, und auch in Asthmasprays sind sie noch in Gebrauch (letzteres dürfte wenig ausmachen). 16 6. Fazit: Es wurden einige Maßnahmen getroffen um das Problem des Ozonlochs zu lösen. Doch in letzter Zeit wurden sogar immer mehr Ozonlöcher über Europa gesichtet. Trotzdem sind die Wissenschaftler zuversichtlich. Zwar rechnen sie nicht mehr mit einer Erholung der Ozonschicht bis 2050, wie früher prognostiziert, doch sie glauben an eine Lösung des Problems. Nach jüngsten Ergebnissen eines Forscherteams der Geophysical Fluid Dynamics Laboratory in Princeton wird das Ozonloch bei gleicher „Erholungsrate“ frühestens in 50 bis 60 Jahren verschwunden sein, bzw. sich auf jene Werte vor 1980 einpendeln. Bei dem kleineren Ozonloch über der Arktis wird dies in etwa 25 Jahren der Fall sein. Das Ozonloch über der Antarktis war nach jüngsten Messungen 2005 24,3 Mio. Quadratkilometer groß und hatte seine größte Ausdehnung zwischen September und Oktober. Als positive Nachricht meinen die Forscher, sei die Tatsache zu werten, dass das Ozonloch um zwei Mio. Quadratkilometer kleiner sei als im Rekordjahr 1998. Allerdings ist es signifikant größer als 2004. Die Ozonforschungsabteilung der Europäischen Union kam zu dem Ergebnis, dass z.B. Mini-Ozonlöcher über Europa auch in Zukunft nicht abnehmen werden. Mit einer messbaren Erholung der Ozonschicht ist - trotz des Verbots von Ozon abbauenden Chemikalien - frühestens im Jahr 2010 zu rechnen. Immerhin: Im Vergleich zur Klimaänderung wäre diese Stabilisierung bis 2065 verhältnismäßig schnell. 17 Andere Forscher rechnen mit einer umfassenden Heilung der Ozonschicht erst in etwa hundert Jahren. Das hängt damit zusammen, dass der Aufstieg der in der Vergangenheit emittierten Schadstoffe in die Stratosphäre noch immer anhält. Flugzeuge maßen in der Atmosphäre immer noch große Mengen FCKW. Das Problem ist also noch nicht endgültig gelöst. Und immer wieder gibt es Meldungen, nach denen nicht nur Entwicklungsländer weiter fleißig FCKWs produzieren und nutzen, sondern auch Firmen in der ersten Welt unter klarer Verletzung der internationalen Abkommen in ihre Fabriken schmuggeln. Damit nicht genug. Hinzu kommt, dass ja auch andere Chemikalien wie die in Düngemitteln enthaltenen und bei Verbrennungsprozessen abfallenden Stickstoffoxide nicht nur den Treibhauseffekt und somit den Klimawandel verstärken, sondern auch die Ozonschicht angreifen. Zusätzlich werden große Mengen Methan ausgestoßen. Außerdem wird die Erholung der Ozonschicht wesentlich von der Temperatur der Stratosphäre beeinflusst. Im Falle einer Abkühlung (Treibhauseffekt) regeneriert sich die Ozonschicht sehr langsam, das Ozonloch bliebe noch viele Jahre gleich groß. Sollte die Stratosphäre jedoch wärmer werden, könnte die Dicke der Ozonschicht innerhalb weniger Jahre wieder auf normale Werte ansteigen. Doch bei der globalen Erwärmung ist keine Lösung in Sicht. Und das beeinträchtigt eben auch die Chancen, das Ozonloch zu schließen. 18 Quellen - - Wikipedia - Meyers großes Taschenlexikon (Buch) - Universität Cambridge - Was ist das Ozonloch.de - seilnacht.com/Lexikon/Ozon - Uni-Bielefeld.de - atmosphere.mpg.de - Kleiner Leitfaden Narurwissenschaften (Buch) - tu-harburg.de - andere Quellen im Internet - Zeitungsartikel 19