I Diskussion
Werbung

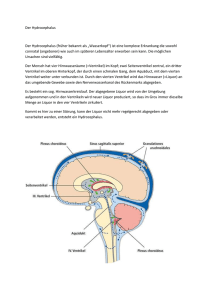
Diskussion Die Behandlung des Hydrocephalus ist auch heute noch mit relativ hohen Komplikationsraten verbunden, obwohl in den letzten Jahren große technische Fortschritte erzielt wurden. So wurden die Ventile immer resistenter gegen Störungen und genauer in der Durchflussmenge [5]. Ebenso wurden Implantationsmaterialien entwickelt, Besiedelungsmöglichkeiten geben oder sogar antibakteriell beschreiben eine 2,4-fache Reduktion der die Bakterien weniger sind [20]. Sciubba et al. Shuntinfektionsrate bei Anwendung antibiotikaimprägnierter Katheter [118]. Um die Behandlung weiter zu verbessern, müssen die Komplikationen immer wieder aufgezeigt und analysiert werden. Dabei ist eine Vielzahl von Faktoren zu berücksichtigen wie die kausale Ursache des Hydrocephalus, das Alter der Patienten, die Ableitungsart ventrikuloperitoneal oder ventrikuloatriale Ableitung -, die Art des Ventils, die Platzierung des Zentralkatheters und der Operateur. Weiterhin müssen der Zeitpunkt der OP, die initiale Ableitung (Rickham, externe Ableitung oder Shunt) wie auch die definitive Ableitung in die Analyse einfließen. 1. Allgemeine Daten Im untersuchten Kollektiv waren 61 Prozent der Kinder vor der 37. Schwangerschaftswoche und 27 Prozent vor der 29. Schwangerschaftswoche geboren worden. 42 Prozent hatten ein Geburtsgewicht unter 2000g. Unter 1000g wogen noch 15 Prozent. Mit 42 Prozent hatten die meisten Kinder einen posthämorrhagischen Hydrocephalus. Der Zusammenhang zwischen Frühgeburtlichkeit und posthämorrhagischem Hydrocephalus ist bekannt, ein hoher Anteil Frühgeborener bedingt ein Überwiegen des posthämorrhagischen Hydrocephalus. Vergleichbare Untersuchungen (Borgbjerg et al. 1995(n=884), Klapproth et al. 1998(n=455)) enthalten die gleichen Hauptdiagnosen, jedoch ist der Anteil frühgeborener Patienten ca.1015 Prozent geringer. Von der Hauptdiagnose war der Zeitpunkt der Erstanlage des definitiven Shuntsystems ebenso abhängig wie die Indikation zu einer der teils komplikationsträchtigen Zwischenlösungen. Alle Fälle mit Meningomyelocele wurden in der Neugeborenenperiode definitiv abgeleitet, da in diesen Fällen der Liquor „sauber“ war. Bei posthämorrhagischem Hydrocephalus internus wurden hingegen nur 7 Prozent primär definitiv abgeleitet. Erst im zweiten bis zum vierten Lebensmonat steht der posthämorrhagischen Hydrocephalus internus bezüglich der definitiven Versorgung im Vordergrund, da in diesen Fällen abgewartet werden muss, bis der Liquor frei von Blutresten und Eiweiß geworden ist. Diese unterschiedlichen Zeitfenster für die endgültige Shuntversorgung werden auch von Boop (2004) und Frim et al. (1998) als charakteristisch angegeben. Häufigkeit von Komplikation Für die weitere Erörterung ist der Begriff „Komplikation“ definiert als ein Ereignis, das einen chirurgischen Eingriff am Shuntsystem erfordert. Er beinhaltet mechanische Verschlüsse, Überdrainage und Shuntinfektionen, die eine Entfernung des Systems erfordern. Angaben zu Revisionen beziehen sich zunächst auf Revisionen pro Patient. Die Gesamt-Revisionsrate liegt in dieser Studie bei 63 Prozent der Patienten in einem Zeitraum von 1992 bis 2001 resp. in 351 Patienten-Jahren, was auf den ersten Blick im Vergleich zu anderen Studien hoch wirkt. Borgbjerg et al. berichten eine Revisionsrate von 51 Prozent bei ventrikuloatrialen und 38 Prozent bei ventrikuloperitonealen Shunts und geben bei Kindern unter einem Jahr eine Komplikationsrate von 69 Prozent, bei Kindern vom 1. bis 14. Lebensjahr von 51 Prozent an. Allerdings sind hier in der Gesamtberechnung auch Kinder älter als 14 Jahre mit einbezogen. In der eigenen Untersuchung war das älteste Kind bei der ersten Komplikation 8 Jahre alt, die Mehrzahl (69 Prozent) der Komplikationen ereignete sich innerhalb des ersten Lebensjahres. Studien mit jüngeren Kindern haben höhere Komplikationsraten als Studien, die ältere Kinder mitberücksichtigen (Mazza et al. 1980, Borgbjerg et al. 1995), wenn man es pro Patientenjahr ausdrückt. Bei fast zwei Dritteln (63 Prozent) aller evaluierten Patienten traten eine oder mehr Komplikationen auf, das heißt, dass nur 37 Prozent aller Patienten im Studienzeitraum von einer Komplikation verschont blieben. 56 Prozent der Kinder mit Komplikationen mussten häufiger als einmal operativ revidiert werden, 44 Prozent hatten nur eine Revision. Borgbjerg et al. bestätigten 1998 dieses Ergebnis [16], auch hier mussten innerhalb von fünf Jahren 63 Prozent der Shunts revidiert werden. Dies ist grundsätzlich erneut bedingt durch den hohen Anteil an Patienten mit posthämorrhagischem Hydrocephalus. 67 Prozent der Kinder mit einer Revision bei posthämorrhagischem Hydrocephalus hatten weitere Komplikationen. Die 2 Farbe des Liquors sollte bei diesen Patienten von teefarben nach xanthochrom gewechselt haben, sowie die Eiweißkonzentration maximal 300 bis 500mg% betragen [15,37]. Das Gewicht der Patienten ist ebenfall ein kritischer Faktor. So schlagen viele Autoren ein Mindestgewicht von 1500g für die definitive Shuntimplantation vor [15]. Am Boston Children´s Hospital ziehen die Neurochirurgen ein Mindestgewicht von 1750g vor. Studien zu entstehenden Problemen durch längeres Warten stehen noch aus [37]. In dieser Studie lag keine einzige gemessene Liquoreiweißkonzentration über 230mg%. Das Gewicht unserer Patienten war jedoch zum OP-Zeitpunkt niedriger, da 11 Patienten mit einem Geburtsgewicht unter 1000g zwischen dem 40. und 183. Lebenstag definitiv versorgt wurden. Erste Ansätze zu alternativen Methoden beschreiben Akisu et al. 2003 mit einer intraventrikulärer Applikation von rekombinantem Gewebeplasminogenaktivator bei drei Neugeborenen mit Hirnblutungen. Alle drei überlebten, und nur in einem Fall musste eine Shuntanlage erfolgen. Komplikationen in Bezug zur Primärdiagnose 42 Prozent der Komplikationen entfielen auf den posthämorrhagischen Hydrocephalus, gefolgt vom Hydrocephalus bei einer Meningomyelocele mit 21 Prozent. Das relative Komplikationsrisiko betrug 60 respektive 85 Prozent. Alle anderen Diagnosen hatten einen Anteil von 1-8% und ein relatives Risiko von 20-100%. Die höchste Komplikationsrate wurde mit 6 Eingriffen bei einem einzelnen Patienten mit posttraumatischem Hydrocephalus und Hirnparenchymdefekten festgestellt, die niedrigste beim Hydrocephalus externus mit 0,2 Komplikationen pro Patient. Diese subduroperitonealen Shuntsysteme wurden ohne Ventil eingesetzt. Diese Vorgehensweise wie auch die guten Ergebnisse werden von Litofsky et al. 1992 und Sakka et al. 1997 bestätigt [75,115]. Patienten mit einer Aquäduktstenose erlitten durchschnittlich 0,75 Komplikationen. Der posthämorrhagische Hydrocephalus lag bei 1,6 und der Hydrocephalus bei Meningomyelocele bei 1,8 Komplikationen pro Patient. Die Beobachtungszeiträume dieser Patientengruppen waren vergleichbar (4,4 Jahre und 4,5 Jahre). Die Komplikationsrate bei posthämorrhagischem Hydrocephalus internus liegt in der Literatur deutlich höher als bei anderen Hauptdiagnosen. Die Unreife der Neugeborenen in Kombination mit niedrigem Geburtsgewicht und weiteren neonatalen Erkrankungen erhöhen das Risiko für mechanische Verschlüsse und Shuntinfektionen bei diesen Patienten. So lag die Infektionsrate von Kindern, die in der Perinatalperiode Shunts erhielten, wegen des erhöhten 3 Anteils an posthämorrhagischen Hydrocephalus bei Cinalli et al. bei 13 Prozent im Vergleich zu einer Gesamtinfektionsrate von 3,7 Prozent [15]. Beim posthämorrhagischen Hydrocephalus ist eine Zunahme der Komplikationsursache von der Ableitung über das Ventil zum zentralen Katheter erkennbar. Eiweißbestandteile und Blutreste können den zentralen Katheter oder das Ventil beim posthämorrhagischen Hydrocephalus verstopfen. Shuntinfektionen traten gehäuft (69 Prozent aller Shuntinfektionen) bei posthämorrhagischem Hydrocephalus auf und machte eine externe Ableitung erforderlich, was erneut das Eindringen von Keimen ermöglicht [15]. Tuli et al. berichten 2003 bei Meningomyelocele von einer Shuntrevision in 64 Prozent im Median nach 303 Tagen post Geburt [132]. Der Hydrocephalus bei einer Meningomyelocele ist in dieser Analyse (85 Prozent Komplikationsrisiko, Median 79 Tage post Geburt) häufiger mit einer Komplikation behaftet. Diese Komplikationen haben ausschließlich mechanische Ursachen. Es wurde nur parietal implantiert und es wurden fast ausschließlich Ventile der ersten Generation mit niedriger Druckstufe verwendet. Deswegen kann es die Lösung zur Verringerung der Komplikationsraten beim Hydrocephalus bei Meningomyelocele sein, Ventile mit einer höheren Druckstufe einzusetzen sowie einen frontalen oder occipitalen Zugangsweg für den zentralen Katheter zu wählen. Vergleichsweise günstige Verläufe haben die Diagnosen Hydrocephalus bei Aquäduktstenose mit 60 Prozent und Hydrocephalus externus mit nur 20 Prozent Komplikationen. In diesen Fällen erfolgt der Eingriff elektiv und birgt geringe operative Risiken [75,115]. Komplikationsverteilung der Operateure Es ist davon auszugehen, dass der erfahrenste Operateur die Mehrzahl der schwierigen Fälle zu behandeln hatte. Das erklärt, dass es bei den 79 von Operateur 1 durchgeführten Eingriffen in 54 Fällen zu einer Komplikation (68 Prozent) kam. Hier beziehen sich die Angaben auf Revisionen pro Eingriff. Dieser Operateur hatte auch die mit Abstand größte absolute Zahl der Eingriffe. Bei den Shuntinfektionen lag er bei 6 Prozent und bei zentralem Katheterversagen bei 23 Prozent Komplikationsrate. Die Shuntinfektionssraten aller Operateure bewegten sich zwischen 5 und 9 Prozent, die Komplikationsraten durch Versagen des zentralen Katheters zwischen 14 und 4 28 Prozent. Smith et al. berichten 2004 von einer niedrigeren Mortalität der Patienten bei Chirurgen, die eine große Zahl Patienten pro Jahr operieren (Mortalität 0,1 Prozent pro Quartal bei über 65 Eingriffen/Jahr) als bei denen, die pro Jahr wenige Fälle mit Hydrocephalus operieren (Mortalität 0,8 Prozent pro Quartal bei unter 9 Eingriffen/Jahr). Ob dies auch Auswirkungen auf die Komplikationsrate hat ist offen. Feste Richtlinien bezüglich der Platzierung des zentralen Katheters und der Ventilauswahl zu implementieren könnte hilfreich sein. 2. Shuntauswahl und Dysfunktion Bei der Anlage eines Shuntsystems müssen der Implantations-Ort und die Länge des Ventrikelkatheters, das Ventil und die Druckstufe sowie der Ort der peripheren Ableitung ausgewählt werden. Die folgenden Zahlen beziehen sich auf die absolute Zahl der Komplikationen. Die Häufigkeit von Komplikationen nimmt von der ableitenden Komponente (20 Prozent) des Shuntsystems über das Ventil (27 Prozent) zum zentralen Katheter (37 Prozent) zu. Shuntinfektionen traten vergleichsweise selten auf (12 Prozent). Deutlich im Vordergrund stehen also mechanische Probleme wie die Dislokation des zentralen Katheters, die Diskonnektion des Systems, das Verstopfen des Systems oder die Über- bzw. die Unterdrainage. Zentraler Katheter Bei der zentralen Katheterplatzierung gab es in dieser Analyse klare Präferenzen. In 60 Prozent der Fälle wurde parietal implantiert, dies ist vor allem historisch bedingt und hängt vom persönlichen Training des jeweiligen Chirurgen ab. Dickerman et al. berichten 2005, dass das wichtigste Kriterium bei der Platzierung des zentralen Katheters ein möglichst großer Abstand vom Plexus chorioideus ist. Hierbei ist es grundsätzlich egal, ob ein parietaler, frontaler oder occipitaler Zugangsweg gewählt wird [27]. Die Autoren fanden z.B. keinen signifikanten Unterschied der Komplikationshäufigkeit zwischen der frontalen und der parietalen Katheterplatzierung Turner beschreibt 2002, dass die frontale im Vergleich zur occipitalen Platzierung keine Unterschiede in der Revisionshäufigkeit aufweist [111].Bezogen auf die Platzierung des 5 zentralen Katheters am Kopf des Patienten ergaben sich in dieser Analyse jedoch für parietale Shunts 28 Prozent, für frontale Shunts 15 Prozent und für occipitale Shunts 17 Prozent katheterbezogene Komplikationen. Um eine gute Lage des zentralen Katheters zu erreichen, erscheint in dieser Analyse der frontale oder occipitale Zugang deutlich besser geeignet als der parietale Zugang. Eine Obstruktion des zentralen Katheters kann durch die Verlegung des Katheters mit Blut oder Zellresten bzw. das Einwachsen des Plexus chorioideus in die Katheterspitze entstehen. Die isolierte Katheterobstruktion wird durch das alleinige Austauschen des zentralen Katheters beseitigt. Dabei kann eingewachsenes Gewebe ausreißen und eine Blutung verursachen, die dann ggf. den neuen Katheter bzw. das Ventil erneut obstruieren kann [18]. Es kann versucht werden, den obstruierten Katheter ohne Entfernung desselben durch Elektrokoagulation über einen Trokar wieder durchgängig zu bekommen [53]. Diese Technik kann bei schwierigen Katheterwechseln vorteilhaft sein, jedoch wurde die Erfolgsrate dieser Technik noch nicht überprüft [18]. Die freihändige Platzierung des zentralen Katheters spart Zeit und reduziert Kosten, jedoch orientiert sich die Platzierung dann an anatomischen Merkmalen, die exakte Lagekontrolle der Katheterspitze ist dem Operateur nur durch intraoperative Sonographie beim Säugling möglich, bei älteren Patienten durch Navigation oder Endoskopie. Der Vorteil bei der endoskopisch kontrollierten Anlage des zentralen Katheters liegt in der exakten Positionierung der Katheterspitze. Eine Studie zur endoskopischen Platzierung des Shunts belegt hingegen den Vorteil des Endoskops gegenüber der Freihandplatzierung nicht [63]. Ventil Bei der Auswahl der Ventilgeneration gab es im Untersuchungskollektiv klare Präferenzen. Es zeigt sich eine Dominanz der Ventile der ersten Generation gegenüber solchen der zweiten Generation in der Neugeborenenperiode (Verhältnis 2,3:1) und im zweiten Lebensmonat (Verhältnis 3,7:1). Ab der achten Woche ist das Verhältnis von Ventilen der ersten und zweiten Generation nahezu ausgeglichen. Ein Grund hierfür ist die Größe der Ventile. Bei den späteren Revisionen werden vermehrt Ventile der zweiten Generation eingesetzt. Dies liegt auch an der Verfügbarkeit der neuen Ventilgeneration in den späteren Jahren des Erhebungszeitraums. Im Vergleich schnitten Ventile der ersten Generation mit 70 Prozent 6 Komplikationsrate deutlich schlechter ab als die Systeme mit neueren Ventilen der zweiten Generation mit 45 Prozent. In der Literatur fehlen klare Aussagen. Ventilbedingt fielen in der ersten Generation 18 Prozent der Systeme, in der zweiten Generation 12 Prozent der Systeme aus. Die besten Ergebnisse zeigten das differentiale Kugel/Kegelventil (1. Generation) mit 6 Prozent und das Gravitationsventil (2. Generation) mit 9 Prozent ventilbedingtem Ausfall. Hierbei muss erwähnt werden, dass bei den Ventilen der zweiten Generation, die vermehrt in der zweiten Hälfte des Beobachtungszeitraums eingesetzt wurden, die Nachbeobachtungszeit kürzer war. Zur Ventilauswahl gibt es keine einheitlichen Richtlinien. Einerseits wäre es optimal, immer die modernsten Ventile einzusetzen wie z.B. ein Gravitationsventil oder ein Ventil mit AntiSiphon-Device, die eine niedrigere Komplikationsrate aufweisen [10]. Andererseits spielen auch wirtschaftliche Aspekte und die persönliche Erfahrung des jeweiligen Operateurs mit dem ihm vertrauten Ventil eine Rolle. Ein wichtiger Faktor zur Vermeidung von Shuntdysfunktionen ist der richtig gewählte Ventilöffnungsdruck. Bei Patienten mit einer primär niedrigen Ventilstufe waren die Revisionsraten wegen Verstopfung und Überdrainage bis zu viermal höher als bei Patienten mit einer mittleren oder hohen Druckstufe [111]. Die Auswahl der Druckstufe des Ventils hing in der vorliegenden Analyse deutlich vom Alter der Patienten bei Implantation ab. Es herrschte eine starke Dominanz der Stufe „low“ im Neugeborenenalter. Mit zunehmendem Lebensalter wurde diese durch die Stufe „medium“ ersetzt. Hierzu gibt es aktuell keine Daten in der Literatur. Aus den eigenen Erfahrungen sollten jedoch tendenziell höhere Druckstufen eingesetzt werden. Das Problem der Überdrainage und der damit verbundenen Slit-Ventrikel-Syndrome hat unter anderem Rekate 2004 untersucht. Der Autor empfiehlt, bei Überdrainagesyndromen die Ventile auszutauschen oder Anti-Siphon-Devices einzubauen [107]. Unabhängig vom eingesetzten Ventil empfehlen Browd et al. (2006) einige intraoperative Techniken, um möglichem Ventilausfall vorzubeugen. Der zentrale Katheter sollte nach dem Einsetzen erst mit Liquor durchspült werden, um Blut- oder Zellreste auszuschwemmen, bevor das Ventil angeschlossen wird. Weiterhin sei es empfehlenswert, beim Verbindungsvorgang des zentralen Katheters mit dem Ventil ständig Salzlösung über die Verbindungselemente laufen zu lassen, so dass Blut oder Zellreste keine Möglichkeit haben, in das System einzudringen [18]. 7 Ableitende Komponente Die Entscheidung bezüglich der peripheren Ableitung fällt heute regelhaft zugunsten des Peritonealraums, da dieser aufgrund seiner großen Resorptionsfläche und der leicht durchzuführenden Implantation ideal geeignet ist. Auch in dieser Analyse wurde in 85 Prozent der Fälle ein ventrikuloperitoneales Shuntsystem implantiert, dies empfehlen auch Browd SR et al. [18]. Beim ventrikuloperitonealen Shuntsystem fand sich eine Komplikationsrate von 56 Prozent, davon waren nur 14 Prozent durch den peritonealen Katheter bedingt. Beim ventrikuloatrialen Shuntsystem blieb nur ein einziger Fall ohne eine Folgekomplikation, dies ergibt eine Komplikationsrate von 96 Prozent, diese ist zu 38 Prozent durch den peripheren atrialen Katheter bedingt. Borgbjerg (1998) beobachtete eine Revisionsrate bei ventrikuloperitonealen Shunts von 38,5 Prozent, bei ventrikuloatrialen Shunts hingegen von 51 Prozent [16].Die Komplikationen verlaufen bei ventrikuloatrialen Shunts wesentlich gravierender als bei ventrikuloperitonealen Shunts [16,18]. Primär atriale Ableitungen sollten vermieden werden, da der atriale Katheter selbst die häufigste Versagensquelle dieser Ableitungsmethode darstellt (38 Prozent). Kontraindikationen für einen ventrikuloperitonealen Shunt sind dagegen nur schwere peritoneale Verklebungen sowie eine aktive peritoneale Entzündung [26]. Zusammenfassung Die Hauptursache für eine mechanische Obstruktion liegt in der Verstopfung des zentralen Katheters bei posthämorrhagischem Hydrocephalus. Das wichtigste Kriterium bei der Platzierung des zentralen Katheters ist ein möglichst großer Abstand vom Plexus chorioideus. Das erscheint aufgrund der eigenen Daten durch einen frontalen oder occipitalen Katheter leichter zu erreichen zu sein als durch einen parietalen Zugang. Als Ventile eignen sich das differentiale Kugel/Kegelventil der 1. Generation und das Gravitationsventil der 2. Generation am besten, tendenziell sollte eine höhere Druckstufe gewählt werden. Bei Überdrainage sollten Ventile höherer Druckstufen oder Anti-SiphonDevices eingesetzt werden [107]. 8 Der bevorzugte Ableitungsraum liegt intraperitoneal. Nur bei Verwachsungen im Bauchraum oder akuten entzündlichen Erkrankungen sollte nach atrial abgeleitet werden [11]. In der Literatur gibt es aktuell keine klaren Aussagen zu Ventilauswahl, Druckstufe und Platzierung des zentralen Katheters. 3. Shuntinfektion Infektionsraten In der Literatur findet man Angaben zur Häufigkeit der Shuntinfektionen zwischen fünf und zehn Prozent [65,22,82,38,92,99,108]. In einer retrospektiven Studie von 5179 Shuntoperationen beschreiben Walters et al. 1984 ein Infektionsrisiko von 5 Prozent pro Eingriff am Shuntsystem [141]. Enger und Mitarbeiter berichten 2003 eine Infektionsrate von 2,7 Prozent pro Eingriff am Shuntsystem bei 407 Eingriffen [29]. Kanev und Sheehan beschreiben 2003 eine Infektionsrate von 1,3 Prozent pro Eingriff bei 526 Eingriffen insgesamt [59]. Bei Neugeborenen findet man jedoch regelmäßig höhere Zahlen, vor allem, wenn gramnegative Keime beteiligt sind [104,92,99,141]. In dieser Analyse liegt die Shuntinfektionsrate bei 11,5 Prozent bezogen auf alle Komplikationen und bei 7 Prozent pro Eingriff. Bei den Operateuren liegen die Zahlen zwischen 5 und 10 Prozent pro Eingriff. Diese Quote ist hoch. Die meisten der Shuntinfektionen traten innerhalb des ersten Lebensjahres auf (69 Prozent), 77 Prozent innerhalb der ersten 90 Tage nach dem letzten Eingriff am Shuntsystem. Innerhalb des ersten halben Jahres sind es 85 Prozent. Dies deckt sich mit den Beobachtungen von Choux et al. aus dem Jahr 1992, hier wurden 90 Prozent der Infektionen innerhalb des ersten halben Jahres nach Eingriff am Shuntsystem diagnostiziert [22]. Nur ein einziger Fall von Spätinfektion kam in dieser Studie vor. 9 Erregerspektrum In 13 Fällen wurde aufgrund der klinischen Symptomatik der Patienten eine mikrobiologische Untersuchung des Liquors durchgeführt. In allen Fällen gelang ein Keimnachweis. 54 Prozent aller gefundenen Keime gehörten zur Familie der Staphylococcen. Hierbei gilt dem Hospitalkeim multiresistenter Staphylococcus aureus ein besonderes Augenmerk. In vier Fällen wurden Bakterien der Familie der Enterobacteriacae gefunden, darunter zweimal Escherichia coli und jeweils einmal Enterobacter cloacae und Morganella morgagnii. Diese Ergebnisse weisen auf eine Dominanz der Hautkeime hin. Behandlungsempfehlungen Die Behandlung von Shuntinfektionen wird in der Literatur sehr unterschiedlich beschrieben. Die konservative Therapie steht chirurgischen Maßnahmen gegenüber [104,79,82,36,71,57]. In der Literatur hat die alleinige medikamentöse Behandlung die schlechteste Heilungsrate sowie die höchste Mortalität [92,36,56]. Die chirurgische Therapie lässt mehrere Vorgehensweisen zu, die alle effektiver als die alleinige medikamentöse Therapie sind [82,92,141,134,56,120]. Eine deutliche abdominale Symptomatik sollte zur Entfernung des peritonealen Anteils des Shunts führen. McGirt et al. beschreiben allerdings eine signifikant höhere Komplikationsrate bei alleinigem Austausches des blockierten Teil des Shuntsystems im Gegensatz zum Komplettaustauschs des Shunts [81]. Zusätzlich sollte der Patient intravenöse und/oder intrathekale antibiotische Therapie erhalten [78]. Hierbei richtet sich die Länge der Behandlung nach den vorherrschenden Erregern. Keine Studie legt bis heute die optimale Behandlungsdauer mit Antibiotika fest. Die Minimierung des Klinikaufenthalts des Patienten steht hier der Gefahr der Reinfektion entgegen [7]. Bevor ein neuer Shunt eingepflanzt werden kann, müssen nach Absetzen der Antibiose zwei Kulturen, die mindestens zwei Tage auseinander liegen, negativ ausfallen [26]. 10 Allgemein kann man das Auftreten einer Shuntinfektion einer Vielzahl an Faktoren zuordnen, darunter dem Ableitungsort des Shunts, dem Alter des Kindes, dem Zustand der Haut, der Ursache des Hydrocephalus, einer Prophylaxe mit Antibiotika, der Zahl und dem Ort bereits erfolgter Shuntrevisionen, vor allem der Revision des Ventrikelkatheters, der Tatsache, dass vorher am Tag im Operationssaal bereits operiert wurde, sowie der Dauer der Operation und der Anzahl der Menschen im Operationssaal, einer begleitenden Infektion des Kindes sowie möglicher Wundheilungsstörungen [22,104,99,13,42,39,134]. Horgan und Piatt untersuchten 1997 das Rasieren des Kopfes vor der Operation hinsichtlich einer Shuntinfektion. 3,3 Prozent der nicht-rasierten Gruppe (n=141) und 6,9 Prozent der rasierten Gruppe (n=218) erlitten eine Shuntinfektion innerhalb eines Jahres. Sie empfehlen deshalb, die Kinder vor dem Eingriff nicht zu rasieren [52]. Kulkarni et al. beschreiben in einer prospektiven Studie aus dem Jahr 2003 die Risikofaktoren einer Shuntinfektion und kommen zu folgenden Ergebnissen: erstens sollte intraoperativ größtmögliche Sorgfalt zur Vermeidung eines Liquorlecks angewandt werden und zweitens sollte der Chirurg den manuellen Kontakt zum Shuntsystem möglichst minimieren sowie den Einsatz von zwei Paar Handschuhen in Erwägung ziehen [70]. Ähnlich argumentieren Kanev und Sheehan in ihren Reflections on shunt infection aus dem Jahr 2003 [59]. Sciubba et al. beschreiben eine 2,4-fache Reduzierung der Shuntinfektionsrate bei Anwendung eines antibiotikaimprägnierten Katheters [118]. Zusammenfassung Zusammenfassend sollten die Kinder vor dem Eingriff nicht am Kopf rasiert werden [52], weiterhin sollte intraoperativ größtmögliche Sorgfalt zur Vermeidung eines Liquorlecks angewandt werden. Gerade die hygienischen Maßnahmen sind es, die Shuntinfektion effektiv verhindern können. Deshalb sollte der Chirurg den manuellen Kontakt zum Shuntsystem möglichst minimieren sowie den Einsatz von zwei Paar Handschuhen in Erwägung ziehen [70]. Neue Ansätze zur Prophylaxe von Shuntinfektionen bieten antibiotikabeschichtete sowie antimikrobiell beschichtete Katheter. Die Preise für diese neuen Katheter sind jedoch noch hoch. Die ersten Ansätze sind viel versprechend. Die Effektivität dieser und weiterer neuer Technologien muss jedoch noch in weiteren Studien geprüft werden. 11 Zusammenfassung Fortschreitende Verbesserungen des Materials und der Operationstechniken haben die Komplikationsraten bei der chirurgischen Behandlung des Hydrocephalus zwar stetig gesenkt, die Systeme und Techniken, die heute verwendet werden, sind jedoch keineswegs perfekt. Es wurde eine retrospektive Analyse aller Shuntoperationen der Kinderchirurgischen Klinik der Klinik St. Hedwig im Krankenhaus Barmherzige Brüder Regensburg in den Jahren 1992 bis 2001 durchgeführt. Aus den Geburtenjahrgängen 1992-2001 wurden 71 Patienten erfasst. Bei 63 Prozent aller Patienten traten eine oder mehr Komplikationen auf. Die Mehrzahl (69 Prozent) der Komplikationen ereignete sich innerhalb des ersten Lebensjahres. 56 Prozent aller Kinder mit Komplikationen mussten häufiger als einmal operativ revidiert werden. 42 Prozent der Komplikationen entfielen auf den posthämorrhagischen Hydrocephalus, gefolgt vom Hydrocephalus bei einer Meningomyelocele mit 21 Prozent, bei einem relativen Komplikationsrisiko von 80 respektive 92 Prozent. Damit ist der Hydrocephalus bei einer Meningomyelocele in dieser Analyse relativ am häufigsten mit einer Komplikation behaftet. Vergleichsweise günstige Verläufe haben die Diagnosen Hydrocephalus bei Aquäduktstenose mit 60 Prozent und Hydrocephalus externus mit nur 20 Prozent Komplikationen. Bei den beiden häufigsten Diagnosen, dem posthämorragischen Hydrocephalus und dem Hydrocephalus bei Meningomyelocele, war die Komplikations-Häufigkeit mit 1,6 resp. 1,8 Komplikationen pro Patient am höchsten. Es wird eine Zunahme der Häufigkeit obstruktiver Komplikationen von der ableitenden Komponente (20 Prozent) des Shuntsystems über das Ventil (27 Prozent) zum zentralen Katheter (37 Prozent) deutlich. Mechanische Shunt-Probleme standen deutlich im Vordergrund. Die Hauptursache für eine mechanische Obstruktion liegt in der Verstopfung des zentralen Katheters bei posthämorrhagischem Hydrocephalus. Das wichtigste Kriterium bei der Platzierung des zentralen Katheters ist ein möglichst großer Abstand vom Plexus chorioideus. Ventilbedingt fielen in der ersten Generation 18 Prozent der Systeme, in der zweiten Generation 12 Prozent der Systeme aus. Die besten Ergebnisse zeigten das differentiale Kugel/Kegelventil (1. Generation) mit 6 Prozent und das Gravitationsventil (2. Generation) mit 9 Prozent Ausfall. Ebenfalls zeigten der frontale (15 Prozent) und occipitale Zugangsweg (17 Prozent) niedrigere Komplikationsraten als der parietale Zugang (28 Prozent). Bei 12 Überdrainage sollten Ventile anderer Bauart, anderer Druckstufen oder Anti-Siphon-Devices eingesetzt werden. Die erste oder einzige Komplikation und zweite Komplikation traten Ende des ersten Lebensjahres auf, so dass der Überwachung und Nachsorge im ersten Lebensjahr eine besondere Aufmerksamkeit zukommt. Der bevorzugte Ableitungsraum liegt intraperitoneal. Erst bei Verwachsungen im Bauchraum sollte nach atrial abgeleitet werden Beim ventrikuloperitonealen Shuntsystem lag eine Komplikationsrate von 56 Prozent vor, beim ventrikuloatrialen eine Komplikationsrate von 96 Prozent. Die Shuntinfektionsrate dieser Studie liegt bei 7 Prozent pro Eingriff und bei 12 Prozent pro Patient. 77 Prozent aller Shuntinfektionen traten innerhalb der ersten 90 Tage nach dem letzten Eingriff am Shuntsystem auf. Um Shuntinfektionen zu vermeiden, ist es zu empfehlen, die Kinder vor dem Eingriff nicht am Kopf zu rasieren, weiterhin sollte intraoperativ größtmögliche Sorgfalt zur Vermeidung eines Liquorlecks angewandt werden. Tritt eine Shuntinfektion auf, muss das gesamte System ausgetauscht werden. Ein Austausch nur einer einzelnen Komponente des Systems wird bei vorher erforderlicher externer Ableitung ausdrücklich nicht empfohlen. Zur Infektprophylaxe sollte der Chirurg den manuellen Kontakt zum Shuntsystem möglichst minimieren sowie den Einsatz von zwei Paar Handschuhen in Erwägung ziehen. Neue Ansätze zur Prophylaxe von Shuntinfektionen bieten antibiotikabeschichtete sowie antimikrobiell beschichtete Katheter.. Alternativen wie die intraventrikuläre Applikation von rekombinanten Gewebeplasminogenaktivator (Akisu et al. 2003) müssen noch weiter erforscht werden [N3]. 13 Literatur- und Abbildungsverzeichnis Literaturverzeichnis 1. Aarli JA (2000)Arne Thorkildsen and Thorkildsen´s surgery. Tidsskr Nor Laegeforen 120: 3726-3727 2. Acharya R, Ramachandran CS, Singh S (2001) Laparoscopic management of abdominal complications in ventriculoperitoneal shunt surgery. J Laparoendosc Adv Surg Tech A 11: 167-170 3. Akisu et al. (2003) Intraventricular administration of recombinant tissue activator for intraventricular hemorrhage in the newborn. Neurosurg Rev 26:266-268 4. Aksu F (2002) Neuropädiatrie – Diagnostik und Therapie neurologischer Erkrankungen im Kindes und Jugendalter. Uni-Med Verlag Bremen pp32-70 5. Arnell et al. (2006) The programmable adult Codman Hkim valve is useful even in very small children with hydrocephalus. A 7-year retrospective study with special focus on cost/benefit analysis. Eur J Pediatr Surg 16:1-7 6. Aronyk KE (1993) The history and classification of hydrocephalus. Neurosurg Clin North Am 4:599-610 7. Arthur et al. (2002) Duration of antibiotic therapy for the treatment of shunt infection : a surgeon and patient survey. Pediatr Neurosurg 36:256-259 8. Arze RS, Rashid H, Morley R, et al (1983) Shunt nephritis: report of two cases and review of the literature. Clin Nephrol 19: 48-53 9. Aschoff A (1999) The scientific history of hydrocephalus and its treatment. Neurosurg Rev 22:67-93 10. Aschoff A, Kremer P, Benesch C, Hashemi B, Schulte C, Leonhardt S, Kunze St (1997) The History of Valved Shunts. A Review on 160 Historical, recently available and prototype valves. Poster, accepted on the XXV Annual Congress International of the Society of Pediatric Neurosurgeons, Verona 11. AWMF online (2002) Leitliniendatenbank. http://awmf.org/ 12. Bavston R, Leung TSM, Wilkins BM, et al (1983) Bacteriological examination of removed cerebrospinal fluid shunts. J Clin Pathol 36: 987-990 13. Bierbrauer KS, Storrs BB, McLone DG, et al (1990) A prospective, randomized studyof shunt function and infections as a function of shunt placement. Pediatr Neurosurg 16: 287-291 14. Bondurant CP, Jimenez DF (1995) Epidemiology of cerebrospinal fluid shunting. Pediatr Neurosurg 23: 254-259 14 15. Boop F (2004) Posthemorrhagic Hydrocephalus of Prematurity. In: Cinalli G (2004) Pediatric Hydrocephalus. Springer Verlag Italia Milano: pp121-131 16. Borgbjerg BM, Gjerris F, Albeck MJ, Hauerberg J, Borgesen SV (1998)A comparison between ventriculo-peritoneal and ventriculo-atrial cerebrospinal fluid shunts in relation to rate of revision and durability. Acta Neurochir 140: 459-464 17. Brihaye J, Périer O (1956) Les complications du drainage ventriculo- mastoidien dans le traitement de l´hydrocéphalie. Acta Neurochirurg 4 :1-7 18. Browd SR et al. (2006) Failure of Cerebrospinal Fluid Shunts: Part I : Obstruction and Mechanical Failure. Pediatr Neurol 34:83-92 19. Browd SR et al. (2006) Failure of Cerebrospinal Fluid Shunts: Part II: Overdrainage, Loculation, and abdominal complications. Pediatr Neurol 34:171-176 20. Cagavi et al. (2004) Effect of hydrophilic coating on microorganism colonization in silicone tubing. Acta Neurochir 146:603-610 21. Carteri A, Longatti PL, Gerosa M, et al. Complications due to incongruous drainage of shunt operations. In: Grote W, Brock M, Clar HE, et al (1979) Surgery of cervical myelopathy, Infantile Hydrocephalus: long term results. Springer Berlin 199-203 22. Choux M, Genitori L, Long D, et al (1992) Shunt implantation: reducing the incidence of shunt infection. J Neurosurg 77: 875-880 23. Dammann N, Schubert W (1988) Complications of shunt drainage in pediatric hydrocephalus. Zentralbl Neurochir 49: 238-246 24. Dandy WE (1918) Ventriculography following the injection of air into the ventricles. Ann Surg 68:5-11 25. Dandy WE (1920) The diagnosis and treatment of hydrocephalus resulting from strictures of the aqueduct of Sylvius. Surg Gynecol Obste 31: 340-358 26. Detwiler PW Hydrocephalus - clinical features and management. In: Choux M (1999) Pediatric Neurosurgery. Churchill Livingston London pp253-271 27. Dickerman et al. (2005) Failure rate of frontal versus parietal approaches for proximal catheter placement in ventriculoperitoneal shunts: revisited. J Clin Neurosci 12:781783 28. El Khamlichi (1998) African neurosurgery. Part I: historical outline. Surg Neurol 49:222-227 29. Enger PO, Svendsen F, Wester K (2003) CSF shunt infections in children: experiences from a population-based study. Acta Neurochir (Wien) 145:243-248 30. Epstein F, Marlin AE, Wald A (1978) Chronic headache in the shunt-dependent adolescent with nearly normal ventricular volume: diagnosis and treatment. Neurosurgery 3: 351-355 15 31. Epstein F, Lapras C, Wisoff JH (1988) Slit-ventricle-syndrome: etiology and treatment. Pediatr Neurosci 14: 5-10 32. Fernell E, Hagberg B, Hagberg G, et al (1988) Epidemiology of infantile hydrocephalus in Sweden: A clinical follow-up study in children born at term. Neuropediatrics 19: 135-142 33. Fernell E, Hagberg B, Hagberg G, et al (1988) Epidemiology of infantile hydrocephalus in Sweden: Current aspects of the outcome of preterm infants. Neuropediatrics 19: 143-145 34. Fleischmann S (1896) Die Ergebnisse der Lumbalpunktion. Dtsch Zeitschr Nervenheilk 10: 342-367 35. Forrest DM, Cooper DGW (1968) Complications of ventriculo-atrial shunts. A review of 455 cases. J Neurosurg 29: 506-512 36. Frame PT, McLaurin RI (1984) Treatment of CSF shunt infections with intrashunt plus oral antibiotic theraphy. J Neurosurg 60: 354-360 37. Frim et al. (1998) Surgical management of neonatal hydrocephalus. Neurosurg Neonate 9: 105-110 38. Gardener BB, Gordon DS (1982) Postoperative infections in shunts for hydrocephalus: are prophylactic antibiotics necessary. BMJ 284: 1905-1915 39. Gardner P, Leipzig T, Phillips P (1985) Infection of central nervous system shunts. Med Clin North Am 69: 297-314 40. Gaskill SJ, Marlin AE (1989) Pseudocysts of the abdomen associated with ventriculoperitoneal shunts: a report of twelve cases and a review of the literature. Pediatr Neurosci 15: 23-27 41. Gaskill SJ (1993) Handbook of pediatric Neurology and Neurosurgery. Little, Brown and Company Boston pp57-71 42. George R, Leibrock L, Epstein M (1979) Long-term analysis of cerebrospinal fluid shunt infections. A 25-year experience. J Neurosurg 51: 804-811 43. Gjerris F, Snorrason E (1992) the history of hydrocephalus. J Hist Neurosci 1:285-312 44. Hahn YS, Engelhard H, McLone D (1985) Abdominal CSF pseudocyst. Clinical features and surgical management. Pediatr Neurosci 12: 75-79 45. Hakim S. Jiménez A, Rosas F (1956) Drainage of the cerebrospinal fluid into the spinal epidural space: a new technique for the treatment of hydrocephalus. Acta Neurochirurg 4: 224-227 46. Haynes IS (1913) congenital internal hydrocephalus: Treatment by drainage of the cisterna magna into the cranial sinuses. Ann Surg 57:449-484 16 47. Heile B (1914) Zur chirurgischen Behandlung des Hydrocephalus internus durch Ableitung der Cerebrospinalflüssigkeit nach der Bauchhöhle und der Pleurakuppe. Arch Klin Chir 105: 501-516 48. Heile B (1925) Über neue operative Wege zur Druckentlastung bei angeborenen Hydrocephalus (Ureter-Dura-Anastomose). Zentralblt Chir 52:2229-2236 49. Henle A (1896) Beitrag zur Pathologie und Therapie des Hydrocephalus. Mitteilungen aus dem Grenzgebiet Medizin und Chirurgie I:264-302 50. Hildebrand O (1923) Eine neue Operationsmethode zur Behandlung des Hydrocephalus internus chronicus der Kinder. Arch klein Chir 127:178 51. Holschneider AM, Bliesener JA, Abel M (1990) Brain stem dysfunction in ArnoldChiari II syndrome. Z Kinderchir 45: 67-71 52. Horgan MA, Piatt JH (1997) Shaving of the scalp may increase the rate of infection in CSF shunt surgery. Pediatr Neurosurg 26:180-184 53. Hudgins RJ, Boydson WR (1998) Shunt revision by coagulation with retention of the ventricular catheter. Pediatr Neurosurg 29:57-59 54. Hyde-Rowan MD, Rekate HL, Nulsen FE (1982) Reexpansion of previously collapsed ventricles: the slit-ventricle-syndrome. J Neurosurg 56: 536-539 55. Inui A, Kamikawa S, Miyake S, et al.Development of flexible ventriculoscope (Yamadori-type VII) and its application to experimental animals. J Neurosci Methods 75: 1-3 56. James HE, Walsh JW, Wilson HD, et al (1980) Prospective randomized study of therapy in cerebrospinal fluid shunt infection. Neurosurg 7: 459-463 57. James HE, Wilson HD, Connor JD, et al (1982) Intraventricular cerebrospinal fluid antibiotic concentration in patients with intraventricular infections. Neurosurg 10: 5054 58. Joon-Ki K, Il Woo L (1999) Long-term follow-up of shunting therapy. Child´s Nerv Syst 15: 711-717 59. Kanev PM, Sheehan JM (2003) Reflections on shunt infection. Pediatr Neurosurg 39:285-290 60. Kausch W (1908) Die Behandlung des Hydrocephalus der kleinen Kinder. Arch klin Chir 87: 709-796 61. Kazan et al. (2005) Hydrocephalus after intraventricular hemorrhage in preterm and low-birth weight infants: analysis of associated risk factors for ventriculoperitoneal shunting. Surg Neurol 64Suppl2:77-81 17 62. Kennedy CR, Ayers S, Campbell MJ, Elbourne D, Hope P, Johnson A (2001) Randomized, controlled trial of acetazolamide and furosemide in posthemorrhagic ventricular dilation in infancy: follow-up at 1 year. Pediatrics 108: 597-607 63. Kestle JRW et al. (2003) Lack of benefit of endoscopic ventriculoperitoneal shunt insertion: A multicenter randomized trial. J Neurosurg 98:284-290 64. Ketoff JA, Klein RL, Maukkassa KF (1997) Ventricular cholecystic shunts in children. J Pediatr Surg 32: 181-183 65. Keucher TR, Mealey J (1979) Long-term results after ventriculoatrial and ventriculoperitoneal shunting for infantile hydrocephalus. J Neurosurg 50: 179-186 66. Key EAH, Retzius MG (1875) Studien in der Anatomie des Nervensystems und des Bindegewebes. Samson and Wallin, Stockholm 67. Kim DK, Uttley D, Bell BA, Marsh HT, Moore AJ (1995) Comparison of rates of infection of two methods of emergency ventricular drainage. J Neurol Neurosurg Psychiatry 58: 444-446 68. Kirchler H (2003) Folsäuresubstitution bei Schwangeren und kindliche Neuralrohrdefekte. http://gin.uibk.ac.at/thema/folsaeuresubst/ 69. Klinik St. Hedwig Regensburg (2003). http://www.klinik-st-hedwig.de/ 70. Kulkarni AV, Drake JM, Lamberti-Pasculli M (2001) Cerebrospinal fluid shunt infection: a prospective study of risk factors.J Neurosurg 94:195-201 71. Lerman SJ (1981) Haemophilus influenzae infections of cerebrospinal fluid shunts: report of two cases. J Neurosurg 54: 261-263 72. Li V, Dias MS (1999) The results of a practice survey on the management of patients with shunted hydrocephalus. Pediatr Neurosurg 30: 288-295 73. Libenson MH, Kaye EM, Rosman NP, et al. (1999) Acetazolamide and furosemide for posthemorrhagic hydrocephalus of the newborn. Pediatr Neurol 20: 185-191 74. Liniger P, Marchand S, Kaiser GL (2003) Flow Control versus Antisiphon Valves: Late Results Concerning Slit Ventricles and Slit-Ventricle Syndrome. Eur J Pediatr Surg 13 Suppl 1:3-6 75. Litofsky et al. (1992) Management of symptomatic chronic extra-axial fluid collections in pediatric patients. Neurosurgery 31:445-450 76. Loeser JD, Sells CJ, Shurtleff DB (1978) The management of patients with cerebrospinal fluid shunts. J Fam Pract 6: 285-289 77. Luyendijk W, Noordijk Ja (1959) Surgical treatment of internal hydrocephalus in infants and children. Acta Neurochir 7: 483-500 18 78. Martins R, Ciquini Junior O, Matushita H, Cabral ND, Plese JP (1997) Infections of cerebrospinal fluid shunts in children. Review of 100 infections in 87 children. Arq Neuropsiquiatr 55: 75-81 79. Mates S, Glaser J, Shapiro K (1982) Treatment of cerebrospinal fluid infections with medical therapy alone. Neurosurgery 11: 781-783 80. Matson DD (1951) Ventriculo-ureterstomy. J Neurosurg 8: 398-404 81. McGirt MJ et al. (2003) Comparison of total versus partial revision of initial ventriculoperitoneal shunt failures. Pediatr Neurosurg 38:34-40 82. McLaurin RL (1973) Infected cerebrospinal fluid shunts. Surg Neurol 1: 191-195 83. Millner M (1998) Neuropädiatrie: Ursachen und Formen der Behinderung. Schattauer Verlag Stuttgart pp190- 201 84. Naturhistorisches Museum Wien (2002). http://www.nhm-wien.ac.at/D/ wissenswertes/schaedeloperation.html 85. Nelson JD (1984) Cerebrospinal fluid shunt infections. Pediatr Infect Dis J 3: 30-32 86. Neuhäuser G Entwicklung und Wachstum. In: Sitzmann CS (1999) Pädiatrie. Hippokrates Verlag Stuttgart pp29-44 87. Neuhäuser G Neuropädiatrie. In: Sitzmann CS (1999) Pädiatrie, Hippokrates Verlag Stuttgart pp705-765 88. Neumann CG, Richman H., Ardizone R (1959) Reconstructive surgery for hydrocephalus. Anastomosis of an isolated ileal segment to the lumbar subarachnoid space (Modified ileo-entectrophy). Surg Clin North Am 39: 491-500 89. Nosik WA (1950) Ventriculomastoidotomy: technique and observations. J Neurosurg 7: 236-239 90. Nulsen FE, Spitz EB (1952) Treatment of Hydrocephalus by direct shunt from ventricle to jugular vein. Surg Forum 2: 399-403 91. O´Brien MS, Harris ME (1993) Longterm results in the treatment of hydrocephalus. Neurosurg Cin North Am 4: 625-632 92. Odio C, McCracken GH Jr, Nelson JD (1984) CSF shunt infections in pediatrics. A seven year experience. Am J Dis Child 138: 1103-1108 93. Ommaya AK (1963) Subcutaneous reservoir and pump for sterile access to ventricular cerebrospinal fluid. Lancet 2: 983-984 94. Oppenheim H (1902) Lehrbuch der Nervenkrankheiten. Vol.II. Karger Berlin, pp12431262 19 95. Parkinson D, Jain KK (1961) Hydrocephalus: a shunt between the the ventricle and Steven´s duct. Can J Surg 4: 183-185 96. Payr E (1908) Drainage der Hirnventrikel mittels frei transplantierter Blutgefäße: Bemerkungen über Hydrocephalus. Arch Clin Chir 87:801-885 97. Payr E (1911) Über Ventrikeldrainage bei Hydrocephalus. Verh Dtsch Ges Chir 40: 515-535 98. Payr E (1919) Elfjähriger Dauererfolg einer Ventrikeldrainage bei Hydrocephalus. Med Klein 49:1247-1251 99. Pople IK, Bayston R, Hayward RD (1992) Infection of cerebrospinal fluid shunts in infants: a study of etiological factors. J Neurosurg 77: 29-36 100. Pudenz RH (1981) The surgical treatment of hydrocephalus – an historical review. Surg Neurol 15: 15-25 101. Raimondi AJ, Soare P (1974) Intellectual development in shunted hydrocephalic children. Am J Dis Child 127: 664-671 102. Raimondi AJ, Robinson JS, Kawanuera K (1977) Complications of ventriculoperitoneal shunting and a critical comparison of the three-piece and onepiece systems. Childs Brain 3: 321-342 103. Rames L, Wise B, Goodman JR, et al (1970) Renal disease with staphylococcus albus bakcteremia. A complication in ventriculoatrial shunts. JAMA 212: 1671-1677 104. Rekate HL, RuchT, Nulsen FE (1980) Diphteroid infections of cerebrospinal fluid shunts. The changing pattern of shunt infections in Cleveland. J Neurosurg 52: 553556 105. Rekate HL (1993) Classification of slit-ventricle-syndromes using intracranial pressure monitoring. Pediatr Neurosurg 19: 15-20 106. Rekate HL Treatment of hydrocephalus, in: Albright AL (1999) Principles and practice of pediatric neurosurgery. Thieme New York pp47-98 107. Rekate HL (2004) The slit ventricle syndrome: advances based on technology and understanding. Pediatr Neurosurg 40:259-263 108. Renier D, Lacombe J, Pierre-Kahn, et al (1984) Factors causing acute shunt infection. Computer analysis of 1174 operations. J Neurosurg 61 : 1072-1078 109. Richards GD, Anton SC (1991) Craniofacial configuration and postcranial development of a hydrocephalic child (ca 2500 BC – 500 AD): with a review of cases and comments on diagnostic criteria. Am J Phys Anthropol 85:185-200 110. Riechert T, Umbach W (1960) Die operative Behandlung des Hydrocephalus, In: Olivecrona, Tönnis W (eds) Handbuch der Neurochirurgie IV, Klinik und Behandlung 20 der raumbeengenden intrakraniellen Prozesse. Springer Berlin Göttingen Heidelberg, pp600-672 111. Robinson S, Kaufman BA, Park TS (2002) Outcome analysis of initial neonatal shunts: does the valve make a difference? Pediatr Neurosurg 37:287-294 112. Rolle U , Gräfe G (1999) About the rate of shunt complications in patients with hydrocephalus and myelomeningocele. Europ J Pediatr Surg 9: 51-52 113. Rosanelli K Erkrankungen in der Neugeburtsperiode. In: Sitzmann CS (1999) Pädiatrie. Hippokrates Verlag Stuttgart pp113-164 114. Rubin RC, Henderson ES, Ommaya AK, et al (1966) The production of cerebrospinal fluid in man and ist modification by acetazolamide . J Neurosurg 25:430-436 115. Sakka et al. (1997) Subduro-peritoneal shunting in children. Childs Nerv system 13:487 116. Salmon JH (1972) Adult hydrocephalus: Evaluation of shunt therapy in 80 patients. J Neurosurg 37: 423-428 117. Schoenbaum SC, Gardner P, Shillito J (1975) Infections of cerebrospinal fluid shunts: epidemiology, clinical manifestations, and therapy. J Infect Dis 131: 543-552 118. Sciubba et al. (2005) Effect of antibiotic –impregnated Shunt catheters in decreasing the incidence of shunt infection in the treatment of hydrocephalus. J Neurosurg 103:131-136 119. Scott M, Wycis HT, Murtagh F, et al (1955) Observations on ventricular and lumbar subarachnoid peritoneal shunts in hydrocephalus in infants. J Neurosurg 12: 165-175 120. Sells CJ, Shurtleff DB, Loeser JD (1977) Gram-negative cerebrospinal fluid shuntassociated infections. Pediatrics 59: 614-618 121. Sibanda EN, Levy LF, Makarawo S (1991) Infction after Harare valve VP shunt operations: a review of 92 cases. Cent Afr J Med 37: 397-403 122. Sokolowski MP (1929) Über die chirurgische Behandlung des Hydrocephalus. Zentralblt Chir 19:1104 123. Spetzler RF, Wilson CB, Grollmus JM (1975) Perkutaneous lumboperitoneal shunt. Technical note. J Neurosurg 43: 770-77 124. Stickler GB, Shin MH, Burke EC, et al (1968) Diffuse glomerulonephritis associated with infected ventriculoatrial shunts. N Engl J Med 279: 1077-1082 125. Stone DH, Womersley J, Sinclair T, et al (1989) Declining prevalence of hydrocephalus. Eur J Epidemiol 5: 398-399 126. Sulla I, Fagul'a J, Levkus P, Santa M, Kralik M, Adamova H (1990) Results of treatment of infantile hydrocephalus. Cesk Pediatr 45 :526-528 21 127. Sutor AH Hämatologische und onkologische Erkrankungen des Kindesalters. In: Sitzmann CS (1999) Pädiatrie. Hippokrates Verlag Stuttgart pp485-580 128. Torack RM (1982) Historical aspects of normal and abnormal brain fluids, I. Cerebrospinal fluid. Arch Neurol 39:197-201 129. Torack RM (1982) Historical aspects of normal and abnormal brain fluids, II. Hydrocephalus. Arch Neurol 39:276-279 130. Torkildsen A (1939) A new palliative procedure in cases of inoperable occlusion of the Sylvian Duct. Acta Chir Scand 82:177-185 131. Torres Lanzas J et al. (2002) Ventriculopleural shunt to treat hydrocephalus. Arch Bronconeumol 38:511-514 132. Tuli et al. (2003) Long-term outcome of hydrocephalus management in myelomeningoceles.Childs Nerv System 19:286-291 133. Vara-Thorbeck R (1990) Infektion der Ableitungssysteme beim Hydrozephalus. Zentralbl Chir 115:569-574 134. Venes JL (1989) Infections of CSF shunt and intracranial pressure monitoring devices. Infect Dis Clin North Am 3: 289-299 135. Vieten H (1952) Möglichkeiten und Gefahren der Röntgenbestrahlung des Hydrocephalus. Strahlentherapie 88: 377-283 136. Villavicencio AT et al. (2003) Comparison of revision rates following endoscopically versus nonendoscopically placed ventricular shunt catheters. Surg Neurol 59:375-380 137. Volpe JJ (1996) Brain injury in the premature infant: Current concepts. Biol. Neonate 69: 165-212 138. Volpe JJ (1997) Brain injury in the premature infant - from pathogenesis to prevention. Brain & Development 19: 519-534 139. Voth D. Henn M (1983) Historischer Überblick über die Behandlungsverfahren des Hydrocephalus im Kindesalter. In: Voth D, Gutjahr P, Glees P (eds) Hydrocephalus im frühen Kindesalter. Enke Stuttgart, pp 68-180 140. Walker ML (2001) History of ventriculostomy. Neurosurg Clin Am 12: 101-110 141. Walters BC, Hoffman HJ, Hendrick EB, et al (1984) Cerebrospinal fluid shunt infection. Influences on initial mangment and subsequent outcome. J Neurosurg 60: 1014-1021 142. Wyatt RJ, Walsh JW, Holland NH (1981) Shunt nephritis. Role of the complement system in its pathogenesis and management. J Neurosurg 55: 99-107 22 143. Yokoyama I, Aoki H, Takebayashi K, Hirai T, MatsumotoT, Fukushima T (1959) Ventriculolymphangiostomy. A shunting operation for hydrocephalus t o drain cerebrospinal fluid into the thoracic duct. Folia Psychiatr Neurol Japan 13: 305 144. Ziemnowicz S (1950) A new trial of operative treatment of hydrocephalus communicans progressivus. Zentralblt Neurochir 10: 11-17 Abbildungsverzeichnis B1. Foto von Hippokratesbüste (2002) Internetjournal der Praxis Dr. Maximilian Rosivatz http://rosivatz.net/hippokrates.jpg B2. Zeichnung von Galen (2001) http://folk.uio.no/klaush/galen.jpg B3. Zeichnung von Abul Qasim al-Zahrawi (2001) http://www.jamil.com/personalities/sPic036.jpg B4. Leonardo da Vinci, Anatomische Studie des Gehirns (1510) Sammlung des Schlossmuseums Weimar, aus: Aschoff A (1999) The scientific history of hydrocephalus and its treatment, Neurosurg Rev 22:67-93 B5. Zeichnung von Leonardo da Vinci (2001) http://nasaexplores.com/lessons/02-023/images/da-vinci.jpg B6. Zeichnung von Andreas Vesalius (2001) http://www.medlav.com/arifiles/vesalius.jpg B7. Zeichnung von Thomas Willis (2001) http://faculty.washington.edu/chudler/gif/willis.jpg B8. Zeichnung eines Liquorzirkulationskreislaufs (2003) http://cns.georgetown.edu/medneuro/lab1/ B9. Foto eines Schädels aus der Latenézeit (2001) Museum für Urgeschichte Asparn/Zaya Österreich, http://www.urgeschichte.com/images/MusSch.jpg B10. Zeichnung einer Lumbalpunktion aus: Quincke H (1891) Die Lumbalpunktion des Hydrocephalus. Berlin Klein Wschr 28: 929-933, 965-968 B11. Skizze des Ventils von Nulsen und Spitz aus dem Jahr 1949 aus: Nulsen FE, Spitz EB (1952) Treatment of Hydrocephalus by direct shunt from ventricle to jugular vein. Surg Forum 2: 399-403 B12. Operationsskizze von Nulsen und Spitz aus: Nulsen FE, Spitz EB (1952) Treatment of Hydrocephalus by direct shunt from ventricle to jugular vein. Surg Forum 2: 399-403 B13. Zeichnung von Holter mit seinem Sohn im Jahr 1956 nach einem Foto von La Fay (1957) aus: Aschoff A (1999) The scientific history of hydrocephalus and its treatment, Neurosurg Rev 22:67-93 B14. Zeichnung eines distalen Schlitzventils von Pudenz und Heyer aus dem Jahr 1955 aus: Aschoff A (1999) The scientific history of hydrocephalus and its treatment, Neurosurg Rev 22:67-93 B15. Photographie von De Humani Corporis Fabrica Libri Septem (2003) library.queensu.ca/webmus/ sc/datedandtreasures.htm B16. Zeichnung von Giovanni Battista Morgagni (2003) http://hsc.virginia.edu/hslibrary/historical/classics/Morgagni.html B17. Zeichnung von Albrecht von Haller (2003) http://hsc.virginia.edu/hs-library/historical/classics/haller.html B18. Zeichnung von Francois Magendie (2003) http://www.uic.edu/depts/mcne/founders/page0057.html 23