Chemie-Grundlagen
Werbung

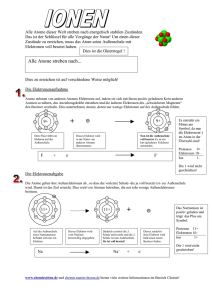
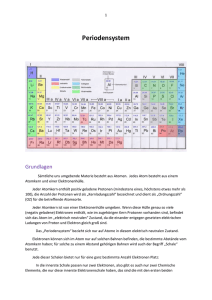
Chemie-Grundlagen Sitzung 3 Wintersemester 2009/10 Dr. Alexander Kohly Atombau und das Periodensystem der Elemente Lernziele Den grundsätzlichen Aufbau von Atomen verinnerlichen. Molekulare bzw. atomare Verbindungsarten kennen lernen. Das Periodensystem der Elemente (PSE) im Aufbau begreifen. Geschichtliches zu den Modellvorstellungen (Auswahl) Demokrit 460 – 371 v. Chr. Alle Stoffe bestehen aus kleinsten, nicht mehr teilbaren Teilchen: den Atomen (gr. “atomos“ unteilbar). John Dalton 1766 – 1844: genauere Beschreibung: - Alle Stoffe sind aus Atomen aufgebaut. - Atome haben Kugelform. Sie sind unteilbar und unzerstörbar. - Jedes Element besteht aus einer Atomsorte. - Alle Atome eines Elements sind gleich groß und gleich schwer. Ernest Rutherford 1871 – 1937: Er führte „Streuversuch“ durch. Er fand heraus: Atome bestehen fast aus „Nichts“. Er entwickelte das Kern-Hülle-Modell: - Atome enthalten einen positiven Kern. - Dieser beinhaltet (fast) die gesamte Masse eines Atoms. - Die positiven Ladungsträger im Kern sind die Protonen. - Um den Kern befindet sich eine „Hülle“, in der sich negativ geladene Elektronen bewegen. Niels Bohr 1885 – 1962: (Schüler von Rutherford) Er entwickelte das Atommodell weiter (Bohrsches Atommodell) -Elektronen bewegen sich auf ganz bestimmten festen Bahnen mit unterschiedlichem Energieniveau um den Kern. Weitere Modelle Aussagekräftiger ist allerdings das Kugelwolkenmodell. Noch weiter entwickelt ist das quantenmechanische Modell. Atome • • • • • Atome sind die kleinsten Partikel der Materie, die alle Eigenschaften des chemischen Elements verkörpern Ein Atom ist zusammen- gesetzt aus drei kleineren Teilchen, den Elementarteilchen, welche wiederum auch wieder aus noch kleineren Teilchen bestehen (Quarks und Leptonen). Diese haben auch wieder unterschiedliche zustände usw. Atome bestehen im Kern (Nukleus) aus Protonen und Neutronen Um den Kern herum, befinden sich die auf den Elektronenschalen die Elektronen Es gibt immer genau die Anzahl von Elektronen (-) wie Protonen (+) in einem Atom Elementarteilchen • • • • Elektronen Zeichen: e- , sind negativ geladen, Aufenthaltsort: Atomhülle besitzen kaum Masse (ca. 1/2000 eines Protons) • • • • Protonen Zeichen: p+ sind positiv geladen, Aufenthaltsort: Atomkern Sie besitzen Masse 1,67262158 · 10 hoch minus 24 g Masse: ca. 1u • • • • Neutronen Zeichen: n besitzen keine Ladung (neutral) Aufenthaltsort: Atomkern Sie besitzen Masse 1,67492716 · 10 hoch minus 24 g Masse: ca. 1u Atome Die Atome werden nach der Anzahl ihrer Protonen in das Periodensystem eingeordnet (Ordnungszahl). Elemente können in verschiedenen Kristallverbänden erscheinen, sog. Modifikationen. Modifikationen des Kohlenstoffs sind z.B. Diamant (links) oder Graphit (Mitte) oder Fullerene (rechts) Elektronenkonfiguration Bei allen chemischen Reaktionen wird die äußerste Elektronenschale der beteiligten Atome spezifisch verändert. Da auf der Außenschale die Elektronen weit vom Kern entfernt sind, können sie leichter abgegeben werden. Die Atomkerne bleiben dabei immer unverändert. Eine Außenschale enthält nie mehr als 8 Elektronen. Sie wird auch Valenzschale und ihre Elektronen als Valenzelektronen bezeichnet. Atome versuchen immer, ihre Valenzschalen auf 8 Elektronen aufzufüllen (Oktettregel). Valenzschalen mit vielen Elektronen ziehen weitere Elektronen an, Valenzschalen mit wenigen Elektronen geben Elektronen ab. Die Elektronegativität Einige Atome üben mehr Anziehungskräfte auf Elektronen aus als andere Atome. Dieses wird als Elektronegativität (EN) bezeichnet. Je mehr Protonen bei gleicher Schalenanzahl im Atom vorhanden sind, desto stärker werden die Elektronen angezogen. Das Periodensystem der Elemente (PSE) Um alle vorhandenen Atome zu ordnen, musste ein Ordnungssystem gefunden werden: Johann Wolfgang Döbereiner formulierte 1817 als erster ein Ordnungsprinzip, nach dem er ähnliche Elemente in sog. Triaden sortierte. dem russischen Chemiker Dimitri Mendelejew und dem deutschen Chemiker Lothar Meyer gelang es 1868 bzw. 1869 unabhängig voneinander, die damals bekannten Elemente in einem System zu ordnen. Henry G.J. Mosley bestimmte 1913 mit Hilfe von Röntgenstrahlen erstmalig die Anzahl an Protonen in Atomen. Er zeigte, dass die Kernladungszahl, also die Anzahl der Protonen, das eigentlich entscheidende Kriterium ist. Johann Wolfgang Döbereiner (1780-1849) Lothar Meyer (1830-1895) Dimitri Mendelejew (1834-1907) Henry GJ Moseley (1888-1915) Das PSE Die waagerechte Anordnung wird Periode genannt. Eine neue Periode beginnt, wenn Elektronen ein neues Energieniveau einnehmen. (auf die nächst höhere Schale wechseln) Die Nummer der Periode entspricht der Anzahl der besetzten Elektronenschalen. Elemente mit gleicher Elektronenschalenanzahl besetzen die selbe Periode. Die senkrechte Anordnung wird Gruppe genannt. Es gibt Hauptgruppen und Nebengruppen Die Nummer der Hauptgruppe entspricht der Anzahl der Außenelektronen. Die Namen der Hauptgruppen sind: I = Alkalimetalle II = Erdalkalimetalle III = Erdmetalle VI = Kohlenstoffgruppe V = Stickstoffgruppe VI = Sauerstoffgruppe VII= Halogene (Salzbildner) VIII= Edelgase Die Ordnungszahl bestimmt die Reihenfolge der Elemente. Die Ordnungszahl entspricht der Anzahl der Protonen im Atomkern eines Elements. Die Ordnungszahl gibt folglich auch die Anzahl der Elektronen vor. Die Anzahl der Neutronen kann schwanken Mit einem Merksatz fällt es leichter sich die Elemente der ersten drei Perioden und ihre Reihenfolge zu merken: Hallo Helmut, liebe Berta, bitte commt nicht ohne Fritz Neumann. Nach Mittag, Albert Simon paukt seine Classen Arbeit. Atome mit gleicher Anzahl an Elektronen auf der Außenschale zeigen bei chemischen Reaktionen ähnliches Verhalten (Gruppen). Die Reaktionsfähigkeit der Elemente nimmt von der Mitte des PSE aus nach beiden Seiten zu (Ausnahme: Edelgase mit „voller“ Außenschale) Je weiter Elemente im PSE voneinander entfernt sind, desto größer ist ihr Bestreben eine Verbindung miteinander einzugehen. Im PSE stehen links die Metalle und rechts die Nichtmetalle.