Praktikum: Säure-Base Reaktionen
Werbung

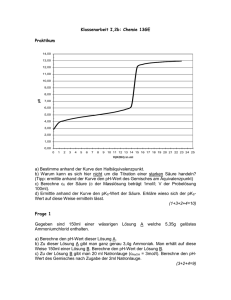
Praktikum: Säure-Base Reaktionen I) Verdünnungsreihen Aus 100ml einer 0,05 molaren (=mol/l) Salzsäurelösung soll durch Zugabe von Wasser eine 0,01 molare Lösung hergestellt werden. Aus 150ml einer Natriumhydroxidlösung (=0,4g/l) soll durch Verdünnen eine Konzentration von 0,006mol/L hergestellt werden. 50 ml einer Perchlorsäurelösung (c=0,3mol/l) soll so verdünnt werden,dass die Konzentration nur noch 15,075g/l beträgt Gib die jeweiligen Berechnungen an. Ermittle jeweils den Massenanteil der verdünnten Lösung (Annahme: ρ(verdünnte Ls) = 1,02g/ml). II) Stärke von Säuren und Basen Funktionsweise eines pH-Meters (vereinfacht) Der Chemiker Fritz Haber stellte fest, dass die Potenzialdifferenz (Spannung) zwischen einer Lösung und einer Glasoberfläche vom pH der Lösung abhängt. Die “Elektrode” des pH-Meters ist zusammengesetzt aus zwei Elektroden: einer Ableit- und einer Bezugselektrode. Die Spannung zwischen Ableit-und Bezugselektrode gibt Aufschluss über den pH-Wert der Lösung. Die Potenzialdifferenz steigt um ungefähr 0,059V pro pH-Einheit an. Der pH-Meter ist so eingestellt, dass nicht die Spannung zwischen den beiden Elektroden, sondern direkt der pH-Wert abgelesen werden kann. Die Messelektrode (Ableitelektrode) taucht in einer pH-konstanten Lösung welche sich in einem hauchdünnen Glasrohr begindet. Die Spitze dieses dünnen Glases taucht in die Lösung dessen pH-Wert zu bestimmen ist. Dieses Glasrohr ist umgeben von einem Gehäuse, welches die Bezugselektrode enthält. Diese taucht in eine gesättigte KCl-Lösung und steht mit einer porösen Wand (Diaphragma) in Kontakt mit der Lösung, dessen pH-Wert bestimmt werden soll. Ein pH-Meter muss vor jeder Benutzung mit Hilfe von Lösungen, dessen pH-Werte bekannt sind, geeicht werden. Versuch 1 und Versuch 2 Seite 136. Beschreibe deine Beobachtungen von Versuch 1 und Versuch 2. Was kannst du daraus schlussfolgern? III) pH-Werte von Salzlösungen Versuch Bestimme anhand von Indikatorstreifen den ungefähren pH-Wert folgender Salzlösungen. Vergleiche diesen pH-Wert mit dem theoretisch berechneten. Formuliere jeweils Lösungsgleichung und Protolysegleichung. Natriumformiat (c0 = 0,1mol/l) Lithiumchlorid (c0 = 0,1mol/l) Natriumsulfid (c0 = 0,1mol/l) Ammoniumnitrat (c0 = 0,1mol/l) Natriumcarbonat (c0 = 0,1mol/l) Aluminiumchlorid (c0 = 0,1mol/l) Natriumdihydrogenphosphat (keine pH-Berechnung!) Natriumhydrogencarbonat (keine pH-Berechnung!) Natriumhydrogensulfat (keine pH-Berechnung!) IV) Pufferlösungen Versuch 1 Seite 143. Bemerkung: es werden portionsweise 2ml HCl 1mol/l respektive NaOH 1mol/l dazugegeben (anhand einer Pipette; insgesamt 10ml HCl/NaOH). Nach jeder Zugabe wird der pH der Lösung anhand eines pH-Meters ermitelt. Die erhaltenen Werte sind graphisch festzuhalten: pH= f(V(HCl-Ls)) und pH = f(V(NaOH-Ls)) Die experimentell erhaltenen pH-Werte sollen durch genaue Berechnungen überprüft werden. V) Titrationen von Säuren durch eine starke Base Versuch 1 und 2 Seite 144. a) Ermittle jeweils anhand der Titrationskurve den pH-Wert des Gemisches am Äquivalenzpunkt. Erkläre diesen pH-Wert anhand einer entsprechenden Protolysegleichung. b) Welche Beziehung gilt immer am Äquivalenzpunkt? c) Berechne die Ausgangskonzentration der Säure. d) Ermittle anhand der Titrationskurve den pH-Wert der Säure. Vergleiche mit dem theoretisch berechneten. e) Nur für Titration Essigsäure: i) Ermittle den Halbäquivalenzpunkt anhand der Titrationskurve. ii) Vergleiche den pH-Wert des Gemisches mit dem pKS-Wert der Essigsäure. Was stellst du fest? Erkläre anhand der Henderson-Hasselbalch Gleichung. f) Ermittle für jede Titration den optimalen Indikator (Tabelle S. 146) VI) Titrationen von Basen durch eine starke Säure Gleiche Versuche wie unter V), nur anstelle von Salzsäure nimmt man eine Kaliumhydroxidlösung unbekannter Konzentration. Anstelle von Essigsäure eine Ammoniaklösung unbekannter Konzentration. Titriert wird jeweils mit einer Salzsäurelösung c0(HCl) = 1mol/l. a) Ermittle jeweils anhand der Titrationskurve den pH-Wert des Gemisches am Äquivalenzpunkt. Erkläre diesen pH-Wert anhand einer entsprechenden Protolysegleichung. b) Berechne die Ausgangskonzentration der Base. c) Ermittle anhand der Titrationskurve den pH-Wert der Base. Vergleiche mit dem theoretisch berechneten. d) Nur für Titration Ammoniaklösung: i) Ermittle den Halbäquivalenzpunkt anhand der Titrationskurve. ii) Vergleiche den pH-Wert des Gemisches mit dem pKS-Wert der korrespondierenden Säure von Ammoniak. Was stellst du fest? Erkläre anhand der Henderson-Hasselbalch Gleichung. e) Ermittle für jede Titration den optimalen Indikator (Tabelle S. 146) f) Löse Aufgabe 3 Seite 148. Praktikum: Elektrochemie I) Leitfähigkeitstitration (S.166-167) Versuch 1 a) Seite 167 a) Gib die Titrationsgleichung an. b) Wie lautet der pH- Wert des Reaktionsgemisches am Äquivalenzpzunkt? Erkläre. c) Welchen Indikator kann man benutzen, um den Äquivalenzpunkt zu bestimmen? Erkläre. d) Gib die konduktimetrische Titrationskurve an (Stromstärke I = f(VMasslösung)). e) Nach Zugabe von welchem Volumen Salzsäure ist der Äquivalenzpunkt erreicht? f) Berechne die Stoffmengenkonzentration der Probelösung. g) Erkläre den Verlauf der Titrationskurve. h) Warum liegt zwischen den Elektroden des Leitfähigkeitsmessers eine Wechselspannung an? II) Elektrolyse (1Stunde) Ein U-Rohr wird mit einer Kupfer(II)-chloridlösung gefüllt. In jeden Schenkel des URohres wird eine Graphitelektrode eingeführt und eine Gleichspannung von ca 10V angelegt. Nach einigen Minuten wird die Gleichspannungsquelle entfernt und durch einen Voltmeter ersetzt. Gleiche Vorgehensweise nur mit einer Zink(II)-bromidlösung (hier werden anstelle der Graphitelektroden Platinelektroden benutzt) Beim Anlegen einer Gleichspannung: Formuliere deine Beobachtungen. Welche Reaktionen laufen an der + respektive der – Elektrode ab? Nachdem die Gleichspannungsquelle durch den Voltmeter ersetzt wurde: Formuliere deine Beobachtungen. Wie lässt sich dieses Phänomen erklären? III) Korrosion und Korrosionsschutz (fakultativ) 100 ml NaCl-Lösung, 3 ml K3[Fe(CN)6]-Lösung und einige Tropfen Phenolphtalein mit ca. 1g Agar-Agar in einem Becherglas eindicken und auf einer Heizplatte unter ständigem Rühren bis zum vollständigen Lösen erwärmen. Drei abgeschmirgelte Eisennägel in jeweils eine Petrischale legen und mit der abgekühlten aber noch nicht erstarrten Agar-Agar Lösung übergiessen. Die Nägel sollten vorher abgeschmirgelt werden und mit Aceton nach dem Abschmirgeln reinigen. Einen Nagel in der Mitte fest mit Kupferdraht umwinkeln, den anderen in der Mitte fest mit Zinkdraht. Den dritten Nagel in die Brennerflamme halten und so lange erhitzen bis eine Oxidschicht sichtbar wird. Bemerkung: Kaliumhexacyanoferrat(III) reagiert mit Fe2+-Ionen zu einer blauen Verbindung (Berliner Blau). Was ist ein Lokalement? Formuliere deine Beobachtungen. Erkläre die Beobachtungen (Teilgleichungen angeben). Wie kann man Eisen vor Korrosion schützen? Warum verwendet man eine Natriumchloridlösung und kein Wasser zur Herstellung des Agar-Agar Gels? Du findest wichtige Informationen in deinem Buch S.182-184 und auf folgender Internetseite: http://iva.uni-ulm.de/CHEMIE/CHEMIEVORLESUNG/allg-chem/redox/korrosion.html Praktikum: Organik I) Alkane a) Die Löslichkeit einiger Alkane in Wasser (gefärbt) soll geprüft werden. Es werden hierfür jeweils ungefähr 2ml Alkan in Wasser gegeben. Beschreibe deine Beobachtungen und Schlussfolgerungen. b) In zwei Reagenzgläser gibt man jeweils 5ml 2-Methylbutan. Nun werden einige Tropfen Brom (Vorsicht!! Handschuhe tragen) dazugegeben. Das erste Reagenzglas wird mit Hilfe einer Lampe bestrahlt. Über die Öffnung dieses Reagenzglases hält man einen mit Ammoniaklösung getränkten Wattebausch. Das zweite Reagenzglas wird in Alufolie eingewickelt. i) Beschreibe deine Beobachtungen (bestrahltes und unbestrahltes Reagenzglas beachten). ii) Wo läuft eine chemische Reaktion ab? Erkläre, indem du den allgemeinen Reaktionsmechanismus angibst (man geht davon aus, dass nur Monobromalkane gebildet werden). Benenne alle möglich gebildeten Monobromalkane. iii) Welcher Kohlenwasserstoff kann bei dieser Reaktion ebenfalls entstehen? Erkläre indem du die möglichen Abbruchreaktionen angibst. iv) Warum wurde der Wattebausch in Ammoniaklösung getränkt? Welcher Stoff kann hierdurch nachgewiesen werden? Gib die Nachweisreaktionsgleichung an. II) Alkanole a) Folgende Alkohole (eine Tropfpipette) werden in destilliertes Wasser, anschliessend in Hexan gegeben: Ethanol; 1-Propanol; 1-Butanol und 1-Hexanol. i) Gib jeweils die Halbstrukturformeln der Alkanole an ii) Erkläre, warum die Hydroxilgruppe “hydrophil” ist. iii) Welche( r) der Alkohole ist wasserlöslich? Welche( r) der Alkohole ist hexanlöslich? Erkläre. b) Unter dem Abzug (Vorsicht!!!! Schutzbrille tragen) gibt man zu einem Erlenmeyer welcher etwas Ethanol enthält ein erbsengrosses Stück Natrium. Der Erlenmeyer wird mit einem Stopfen versehen mit einer ausgezogener Glasspitze verschlossen. Die erhaltene Flüssigkeit wird abgedampft. Zu dem Feststoff welcher man erhält gibt man vorsichtig etwas Wasser und einige Tropfen Phenolphtalein. i) Schildere für die Reaktion zwischen Natrium und dem Alkanol deine Beobachtungen. Gib die Reaktionsgleichung an. Benenne alle Stoffe. ii) Erkläre anhand einer Protolysegleichung, warum Phenolphtalein nach rosa umschlägt. c) Anhand der Boraxprobe lässt sich Ethanol von Methanol leicht unterscheiden (siehe Buch V2 S.300). In eine Porzelanschale wird etwas Methanol versetzt mit Borax gegeben. Der Stoff wird mittels eines Glimmspanes entzündet. Gleiche Vorgehensweise, nur anstelle von Methanol benutzt man Ethanol. Schildere deine Beobachtungen. III) Ester V1 Buch S.318 i) Gib jeweils die entsprechende Reaktionsgleichung an. ii) Welche Rolle spielt die Schwefelsäure? iii) Gib den Reaktionsmechanismus zwischen 1-Butanol und Ethansäure an.