Kristina Weber: Wie wird der Heteroaromaten Pyridin synthetisiert
Werbung
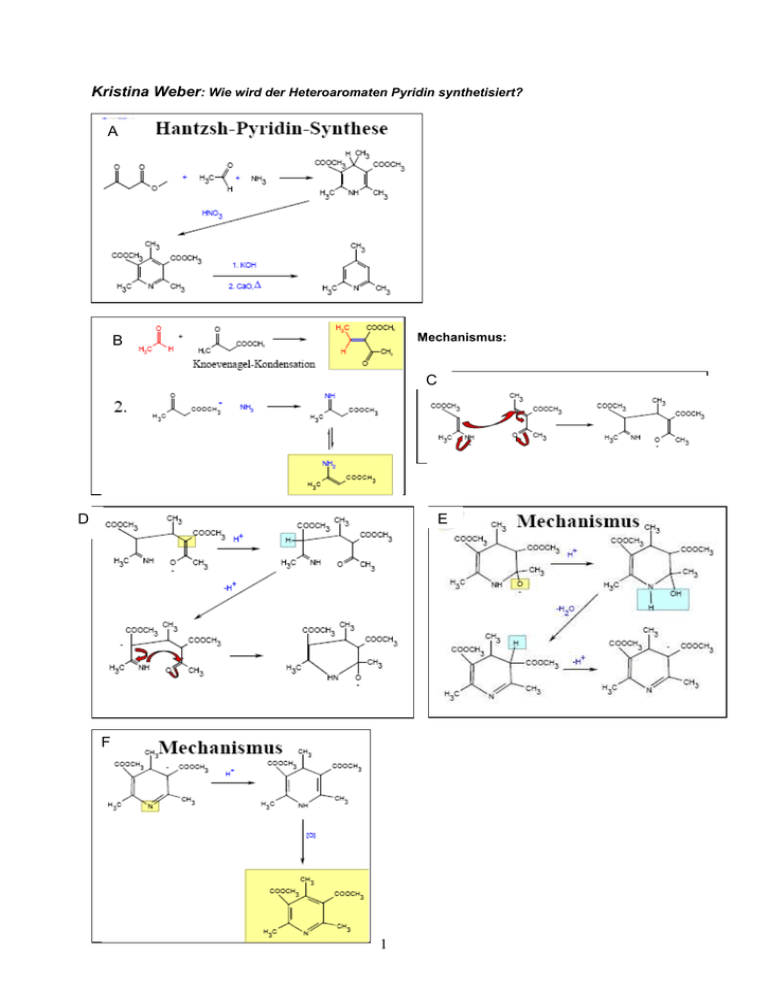
Kristina Weber: Wie wird der Heteroaromaten Pyridin synthetisiert? A Mechanismus: B C D E F 1 Hantzsch Synthese: A: β-Ketocarbonylverbindung + Aldehyd + Amin (Verhältnis 2:1:1) Oxidation mit Salpetersäure B: 1) Knoevenagel-Kondensation: H extrem azide, weil o extrem e- zieht, Bildung Carbanion nukleophiler Angriff auf C des Aldehyds ungesättigte Carbonylverbindung (H2O geht weg) 2) β-Ketocarbonylverbindung + Amin Imin (Schiff`sche Base/ C=N) Enamin (H2O geht weg) C: Michael-Addition: Enolat + Alken mit e- ziehenden Gruppen = Polymerisation! D: Wegen Enolat-GG Anlagerung von H+, Abgabe von H+ wegen Mesomerie-stabilisation Ringschluß E: extrem reaktives Edukt, Anlagerung von H+ Dehydratation (H2O geht weg) Deprotonierung, wegen Mesomeriestabilisation F: Protonierung am Stickstoff Oxidation mit Salpetersäure zu Pyridinderivat (H2 geht weg) (restliche Substituenten noch wegoxidieren, KOH zur Spaltung der Estergruppen, Erhitzen und CaO um CO2 raus zu treiben) Welche Eigenschaft macht den Pyridinring besonders geeignet für die Funktionen der Cofaktoren NAD/NADH und NADP/NADPH? Nicotinsäurenukleotide, z.B. NAD+/NADH Nicotinamidadenindinukleotid, eigentlich Nicotinsäureamid-Adenin-Dinucleotid (abgekürzt NAD oder genauer NAD+) ist ein Elektronen (genauer: Hydridionen) transportierendes Koenzym, das an zahlreichen Redoxreaktionen des Stoffwechsels der Zelle beteiligt ist. Dabei kann es reduziert werden und maximal zwei Elektronen aufnehmen (dann geschrieben als NADH + H+). NAD+ wirkt als Koenzym von Dehydrogenasen, z.B. der Alkoholdehydrogenase (ADH), zur Oxidation von Alkohol. Reaktivität von Pyridin: Weil Stickstoff elektronegativer als Kohlenstoff ist, zieht er induktiv und über Resonanz Elektronendichte aus dem Ring ab der Ring ist elektronenarm. Eine Elektrophile Substitution ist also nur unter sehr extremen Bedingungen möglich (am C3): Die Substitution erfolgt am C3, da dies die am wenigsten desaktivierte Ringposition ist. Bei Angriff auf C2 oder C4 entstehen intermediär Kationen, für die sich Resonanzstrukturen mit der positiven Ladung am elektronegativen Stickstoff zeichnen lassen. 2 Bei aktivierenden Substituenten sind mildere Reaktionsbedingungen möglich, oder die Reaktion verläuft mit besseren Ausbeuten Nukleophile Substitutionen sind hingegen im Vergleich zum Benzol erleichtert, weil der Pyridinring eben relativ elektronenarm ist. Es wird bevorzugt am C2 oder C4 substitutiert, (α bzw. γ zum Stickstoff), da hierbei Übergangszustände entstehen, bei denen die negative Ladung am Stickstoff liegt. 3 Nun auf die Bedeutung für NAD+ bezogen, das nukleophiler Angriff des Hydridions so problemlos geht: negative Ladung muss am N sein Betrachtung als Nicotinsäureamid Position an C3 ist einmal blockiert Statistisch nur noch ½ so wahrscheinlich, dass hier die Reaktion stattfindet. Carboxamidgruppe wirkt auch noch e--ziehend a) Ist Niacin wirklich ein Vitamin? Niacin (oder Vitamin B3) ist der veraltete Name für Nicotinsäure und ihr Aminderivat Nicotinamid. Biosynthese von Nicotinsäure ist auf zwei verschiedenen Wegen möglich: Glycerinaldehydphosphat Kann mit Asparaginsäure zu Nicotinsäure umgewandelt werden. Tryptophan (essentielle AS) wird über Kynurenin zu Nicotinsäure oxidiert. Niacin ist also der Definition nach kein Vitamin, da der menschliche Körper in der Lage ist es zu synthetisieren. b) Mit welcher Spezifität werden die Redoxreaktionen durchgeführt? Die zwei Seiten des Nicotinamidringes werden mit A und B bezeichnet, die zwei H-Atome an Position 4 mit HA (pro-R) und HB (pro-S). Enzyme die das pro-R H-Atom entfernen: Alkoholdehydrogenase, Malat-, Isocitrat-, Lactat-, DGlycerat-Dehydrogenase. Enzyme die das pro-S H-Atom entfernen: Glucose-6-Phosphat-DH, Glutamat-DH, 6-PhosphogluconatDH, 3-Phosphoglyeraldehyd-DH Man kann sagen, dass etwa 50 % der Enzymreaktionen mit dem pro-R-H-Atom, die anderen 50% mit dem pro-S-H-Atom statt finden. Es gibt mehrere Erklärungsversuche: Verantwortlich ist die Lage der Wasserstoffbrücken-Bindungen, welche die CONH2-Gruppe halten. Wenn syn-orientiert zum Riboserest, dann wird die A-Seite reagieren. Bei antiKonformation wird die B-Seite reagieren. 4 Man konnte aber nachweisen, dass diese Erklärung zu simple ist, da bei chemischer Veränderung der CONH2-Gruppe die Stereospezifität erhalten bleibt. Enzym stabilisiert selektiv eine Boot-Konformation und das axiale H reagiert dann. Unter Beachtung dieses Punktes, zusammen mit der Optimierung der katalytischen Rate, schlug Benner vor: The thermodynamically most easily reduced carbonyl compounds will react by enzymatic transfer of the hydride ion from the pro-R position of NADH, the most difficultly reduced carbonyl compounds will react by enzymatic transfer of the hydrid ion from the pro-S position. Ist aber auch sehr umstritten. Oder: Evolution ist verantwortlich. c) Welche Rolle spielt die Stereochemie bei den Redoxreaktionen? Wird bei einer Reaktion, das H-Atom an Position 4 von NADH bzw. NADPH, durch ein Enzym auf ein Aldehyd oder ein Keton übertragen um einen Alkaohol zu bekommen, ist die Position des H-Atoms im Alkohol auch stereospezifisch. Bsp: Lactatdehydrogenase: Pyruvat wird zu L-Lactat reduziert d) Welche chemischen Nebenreaktionen können Nicotinsäurenukleotide eingehen? Addition an NAD+ und NADH: Angriff nukleophiler Reagenzien an die Position 4 des Nicotinamidrings des NAD +/NADH Lagert sich eine OH--Gruppe an Position 2 des Nicotinamidrings des NAD+/NADH an, führt dies zur Ringöffnung (basenkatalysiert) Addition von Enolationen (basenkatalysiert) an Position 4. Bei diesen Produkten kommt es spontan zum Ringschluss und in Gegenwart von Sauerstoff entsteht ein fluoreszierender Stoff. 5 Modifikationen von NADH in Säure: NADH kann an Position 5 protoniert werden (oder Quecksilber (II)). Danach kann ein Nukleophil an Position 6 angreifen. Am Addukt können nun weitere Reaktionen stattfinden, zum Beispiel: Addition von H2O, Ringöffnung Andere Reaktionen: Hexacyanoferrat (III) oxidiert NAD+ und NADP+ zu 2-, 4- und 6-Pyridon. Sauerstoff entfernt bei neutralem pH ein Proton und führt dadurch zu einem Peroxidderivat von NADH Erhitzen unter alkalischen Bedingungen: NAD+ hydrolysiert zu Nicotinamid und AdenosinDiphosphat-Ribose Behandlung von NAD+ mit salpetriger Säure deaminiert den Adeninring 6