25 - Medi
Werbung

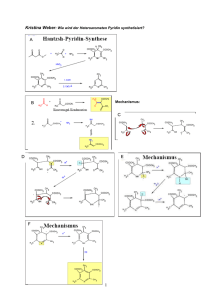
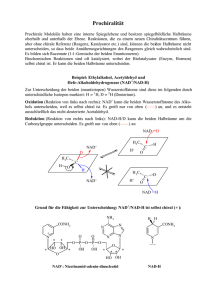
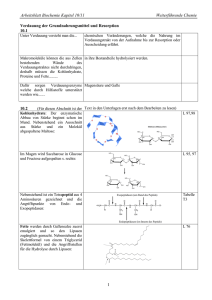
2.1.4 Gesamtablauf der PDH-Reaktion H C N Enzym O HS DihydroliponamidDehydrogenase 1 N 2 FADH2 H C NADH + H+ FAD HS 2 NAD+ Enzym O S S Abb. 28: Pyruvatdehydrogenasereaktion Teil 3 Eigentlich solltest du an dieser Stelle stutzen. FAD hat nämlich ein positiveres Redoxpotenzial (s. S. 10) als NAD+ und ist daher normalerweise NICHT in der Lage, NAD+ zu NADH und H+ zu reduzieren. Der Grund, warum es hier dennoch geht, ist das FAD-tragende Enzym selbst: Die Dihydroliponamid-Dehydrogenase hat ein negativeres Redoxpotenzial als das NAD+/NADH und kann folglich etwas, was die anderen FAD-Enzyme nicht können: Sie reduziert NAD+ mit FADH2. 2.1.4 Gesamtablauf der PDH-Reaktion Nach der Besprechung der Pyruvatdehydrogenasereaktion ­kommen ihre Reaktionen nun der besseren Übersicht zuliebe noch mal komplett zum Lernen: 1. Pyruvat wird an Thiaminpyrophosphat gebunden. 2. Es folgt eine Decarboxylierung. 3. Der C2-Körper wird an Liponsäure gebunden und dabei zu einem Acetyl-Rest ­oxidiert. 4. Der Acetyl-Rest wird an CoA gebunden. 5. Dihydroliponamid wird durch FAD oxidiert. 6. FADH2 wird durch NAD+ oxidiert. www.medi-learn.de medi-learn.de/6-bc1-28­ Folgende Fakten solltest du dir unbedingt merken: –– Pyruvat + CoA + NAD+ reagieren zu AcetylCoA + CO2 + NADH + H+. –– Thiaminpyrophosphat wird unbedingt gebraucht; beiVitamin B1-Mangel kommt es daher zu einer Störung der ­Pyruvatverwertung. –– CoA ist ebenfalls essenziell. –– FADH2 kann ausnahmsweise mit NAD+ regeneriert werden (es werden beide Coenzyme benötigt). –– Die Pyruvatdehydrogenasereaktion ist irreversibel. Die Pyruvatdehydrogenasereaktion hat noch einen Zweitnamen: Pyruvat ist eine α-Ketosäure und in dieser Reaktion finden eine Dehydrierung (Oxidation) und eine Decarboxylierung statt. Daher lautet der Zweitname: Oxidative Decarboxylierung von α-Ketosäuren, oder auch noch genauer: Dehydrierende Decarboxylierung von α-Ketosäuren. Dieser Begriff ist allgemeiner und umfasst z. B. auch die Decarboxylierung von α-Ketoglutarat, die im Citratzyklus eine wichtige Rolle spielt und die gleichen Coenzyme benötigt (s. 3.1.1, S. 29). 25