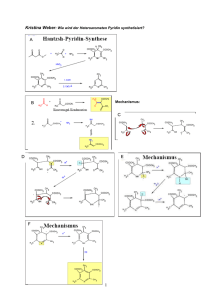
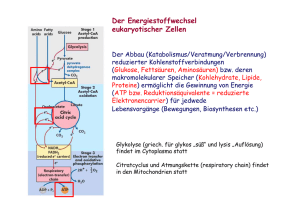
Enzyme
Werbung

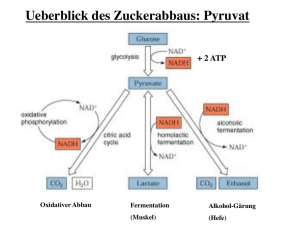
LDH Aktivitätsbestimmung der Laktatdehydrogenase rcsb.org Biol 115 Tierphysiologie Dr. Ina Kraus-Stojanowic Dr. Jessica Gewiese-Rabsch faes.de hisupplier.com chemieonline.de user.medunigraz.at Enzyme: Grundlegende Konzepte Enzyme sind Biokatalysatoren und… • sind meistens Proteine (Ausnahme: Ribozyme) • besitzen katalytische Aktivität • beschleunigen chemische Reaktionen um den Faktor 106 bis 1012 durch die Stabilisierung von Übergangszuständen • können Reaktionsgleichgewichte nicht verschieben • sind hochspezifisch: in Bezug auf die katalysierte Reaktion (Wirkungspezifität) und auf spezielle Moleküle/chemische Gruppen und deren sterische Andordnung (Substratspezifität) • können gehemmt / reguliert werden Prinzipien der Enzymkatalyse AB Aktivierungsenergie ΔG ΔG* ohne Enzym ΔG* ΔGkat mit Enzym ΔGkat A+B ΔG C+ D Reaktion: A+B→C+D benötigt eine hohe Aktivierungsenergie katalysierte Reaktion: Enzym setzt durch 1. Annäherung und Orientierung der Reaktanden 2. Ausschluss von Wasser 3. Stabilisierung des Übergangszustandes die Aktivierungsenergie herab Enzyme: Grundlegende Konzepte • Das Substrat wird im aktiven Zentrum des Enzyms gebunden • Die an der Substratumsetzung beteiligten Aminosäurereste nennt man katalytische Gruppen • Das aktive Zentrum stellt nur einen kleinen Teil des Gesamtenzyms dar • Das aktive Zentrum ist eine dreidimensionale Einheit • Substrate werden durch viele schwache Kräfte an das Enzym gebunden: - elektrostatische Bindungen - Wasserstoffbrücken - van-der-Waals-Kräfte - hydrophobe Wechselwirkungen Prinzipien der Enzymkatalyse Der Übergangszustand… • ist weder eine stabile Verbindung noch ein Reaktionszwischenprodukt • beschreibt den Moment, in dem Bindungsbruch Bindungsbildung Ladungszustand exakt den Punkt erreicht haben, an dem der Übergang zu Produkt oder Substrat gleich wahrscheinlich ist Prinzipien der Enzymaktivität Welche Faktoren beeinflussen die Aktivität von Enzymen? Amylase Enzymaktivität Pepsin Alkalische Phosphatase 2 3 4 5 6 pH-Wert 7 8 9 10 Prinzipien der Enzymaktivität Enzymaktivität Welche Faktoren beeinflussen die Aktivität von Enzymen? 7 14 21 28 35 50 60 Temperatur (°C) 70 95 Prinzipien der Enzymaktivität Viele Faktoren beeinflussen die Aktivität von Enzymen: • pH-Wert der Umgebung • Temperatur • Cofaktoren • Inhibitoren • Substrat • Enzym-Regulation Prinzipien der Enzymaktivität Einheiten von Enzymaktivität: • 1 U = 1 µmol Substrat pro Minute (µmol/min) • SI-Einheit: 1 kat = 1 mol/s • Volumenaktivität (U/ml) • spezifische Aktivität (U/mg Enzym) • die Wechselzahl gibt an, wieviele Substratmoleküle pro Sekunde umgesetzt werden (s-1) Enzyme und ihre Coenzyme Coenzyme: - prosthetische Gruppe: Coenzym ist kovalent an das Enzym gebunden - lösliche Coenzyme oder Co-Substrate: werden während der Reaktion wie Substrate an das Enzym gebunden, chemisch verändert und dann wieder freigesetzt - die Regeneration der CoSubstrate erfolgt über eine zweite, unabhängige Reaktion Apoenzym + Coenzym = Holoenzym Beispiele für Coenzyme Coenzym übertragene Gruppe Typ NAD(P)+/ NADPH Hydridion (2e-, 1H+) löslich FlavinCoenzyme Elektronen (2e-, 2H+) prosthetisch Liponamid Elektronen (2e-, 2H+) prosthetisch Coenzym A Acyl-Gruppen löslich Häm Elektronen (1e-) prosthetisch Biotin CO2 prosthetisch Michaelis-Menten-Kinetik k1 E + S k2 ES 1/2 Vmax k3 E + P Michaelis-Menten-Gleichung [S] V = Vmax [S] [S]+ KM V0 nähert sich mit steigender [S] asymptotisch Vmax = hyperbolisches Sättigungsverhalten à graphische Bestimmung der Werte schwierig, à deshalb Linearisierung durch Umformung der Michaelis-Menten-Gleichung Enzymkinetik: Lineweaver-Burk 1 # KM & 1 1 =% + ( ν 0 $Vmax ' [S] Vmax Steigung Vorgehensweise: • 1/V0 gegen 1/[S] auftragen • Lineare Regression • KM und Vmax den Achsenabschnitten entnehmen andere linearisierte Darstellungsweisen: • Eadie-Hofstee (V0 gegen V0/[S]) • Hanes-Woolf ([S]/V0 gegen [S]) • Cornish-Bowden (Vmax gegen -[S]) Stoffwechsel: aerobe Glykolyse HOCH2 H HO O H OH H H OH Glucose 2 ADP + 2 Pr 2 ATP OH H Glykolyse NAD+ NADH + H+ COOC COOO CH3 Pyruvat + C CH3 Pyruvat aerobe Bedingungen: Regeneration über Mitochondrien-Shuttle O Citrat-Cyklus Muskelstoffwechsel: anaerobe Glykolyse HOCH2 H HO O H OH H H OH Glucose 2 ADP + 2 Pr 2 ATP OH H Glykolyse NAD+ NADH + H+ COOC COO- + O CH3 C O CH3 Pyruvat Pyruvat anaerobe Bedingungen: Lactat-Dehydrogenase Lactat COO- H Reaktionstyp: Pyruvat wird reduziert NADH wird oxidiert C CH3 OH Cori-Zyklus Was passiert mit dem Lactat der Skelettmuskulatur? Glucose Leber Pyruvat LDH uf Blutkreisla Glucose Pyruvat NADH NADH LDH NAD+ NAD+ Lactat Blutkreislau f Lactat Skelettmuskel Lactat-Dehydrogenase: Versuchsprinzip NAD+ NADH + H+ NAD+ Pyruvat Lactat-Dehydrogenase NADH Lactat Absorptionsspektrum von NAD+ und NADH die Entstehung von NAD+ während der Reaktion lässt sich spektral-photometrisch nachweisen, indem man die Extinktion bei 340 nm misst: NADH → NAD+ ⇒ Extinktion E340nm nimmt ab • NADH absorbiert Licht im UV-Bereich bei 340nm • NAD absorbiert in diesem Bereich nicht Bestimmung der LDH-Aktivität E ΔE min Zeit t ^ Reaktionsgeschwindigkeit Extinktionsänderung pro Minute = Reaktionsgeschwindigkeit ^ = umgesetzte Substratmenge/Zeit heute: U/ml (1U=1µmol/min)