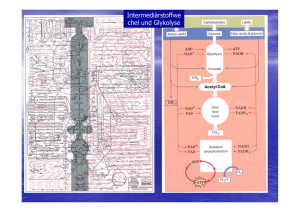
Ueberblick des Zuckerabbaus: Pyruvat!
Werbung
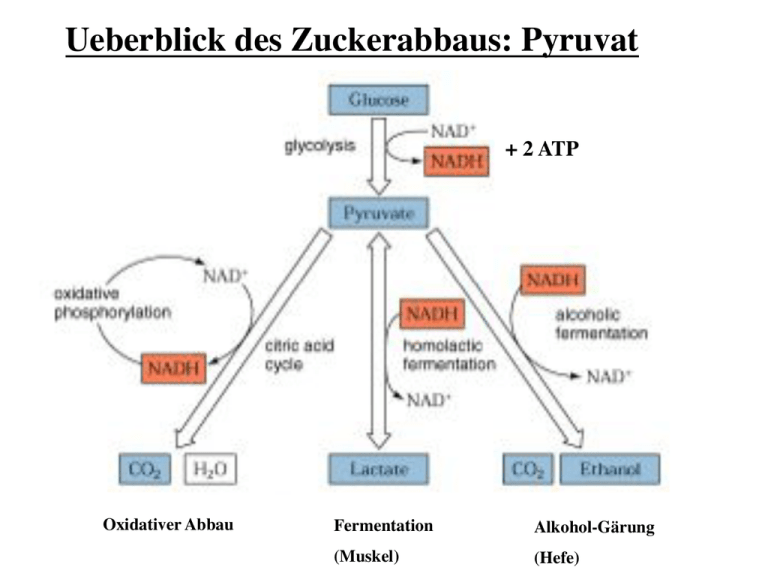
Ueberblick des Zuckerabbaus: Pyruvat! + 2 ATP! Oxidativer Abbau! Fermentation! Alkohol-Gärung! (Muskel)! (Hefe)! Alkoholische Gärung:! In Hefe wird unter aneroben Bedingungen NAD+! durch Umwandlung von Pyruvat in Ethanol und ! CO2 für die Glykolyse zurückgewonnen. Dieser ! Prozess wird von Alters her für die Herstellung ! von Bier, Wein und Spirituosen genutzt. ! Bäckerhefe - Saccharomyces cerevisiae! Milchsäuregärung: Lactat-Dehydrogenase (LDH)! Die Lactat-Dehydrogenase Reaktion ist ! vollständig reversibel, so dass die ! Konzentrationen an Pyruvat und Lactat im! Gleichgewicht stehen. ! Milchsäuregärung:! Im Muskel katalysiert - vor allem wenn bei ! hoher Aktivität ein grosser ATP-Bedarf ! besteht und die Sauerstoffversorgung knapp! ist - LDH die Reduktion von Pyruvat durch ! NADH unter Bildung von NAD+ und Lactat! (homofermentative Milchsäuregärung). ! ! ! ! ! ! Lactat kann entweder aus der Zelle heraustransportiert werden oder wieder! zu Pyruvat umgewandelt werden. Ein Grossteils des Lactats wird aus der ! Muskelzelle heraus und über das Blut zur Leber transportiert, wo es wieder zu ! Glucose umgesetzt wird. ! ! Muskelkater und Muskelermüdung wird aber nicht nur von ! Lactat erzeugt, sondern auch von der durch die Glycolyse erzeugten Säure.! Die Energiebilanz der Gärung:! Milchsäuregärung:! ! Glucose ---> 2 Lactat + 2H+ ! ! !ΔG0 = - 196 kJ mol -1! Alkoholische Gärung:! ! Glucose ---> 2 CO2 + 2 Ethanol ! !ΔG0 = - 235 kJ mol -1! Jede dieser Reaktionen ist an die Nettobildung von 2 ATP gekoppelt, wofür ! ΔG0 = + 61 kJ mol -1 pro verbrauchter Glucose erforderlich sind. Dadurch ergibt sich eine Effizienz von 31% respektive 26%. Der Rest geht als Wärme verloren, wodurch ! der Prozess irreversibel wird. ! ! Hefe benötigt zum anaeroben Wachstum sehr viel mehr Glucose als beim aeroben! Wachstum (2 vs. ca. 30 ATP pro Molekül Glucose). Das führt dazu, dass die Geschwindigkeit der anaeroben Glycolyse bis zu 100-fach höher ist als die der aeroben! Glycolyse.! ! Uebersicht zum oxidativen Stoffwechsel! Aus Kohlenhydraten, Amino-! säuren und Fettsäuren gebildete ! Acetylgruppen (CH3-CO-) treten ! in den Citratcyclus ein, wo sie zu ! CO2 oxidiert werden. ! Pyruvat-Dehydrogenase! Coenzyme A! Coenzyme A (CoA) wurde 1945 von Lippmann als hitze-! stabiler Cofaktor gefunden, der für enzym-katalysierte ! Acelylierungen gebraucht wird. Der für den Metabolismus ! wichtige Faktor wurde Cofactor A genannt, wobei A für ! acetylierung steht. ! ! ! Wichtige Trägermoleküle im Metabolismus ! Die meisten Uebertragungen von aktivierten Gruppen im Metabolismus werden von wenigen Trägermolekülen durchgeführt ! -> grundlegendes Prinzip der Biochemie! ! Die Pyruvat-Dehydrogenase ist ein Multi-enzymkomplex ! von drei Enzymen (E1, E2 und E3) ! Pyruvat-Dehydrogenase! EM des intakten Multienzym! Komplexes! Mass: 5 million Daltons! 60 polypeptide! ! --> grösser als Ribosom!! Model des ! Pyruvat-dehydrogenase Komplexes! (je 60 E1-/E2-Enzyme, 12 E3-Enzyme) ! Pyruvat-dehydrogenase: E1-enzym! Pyruvat-dehydrogenase benutzt Thyaminpyrophosphat (TPP) ! als Cofactor. ! Pyruvat-dehydrogenase: E1-enzym! Die Decarboxylierung von Pyruvat verläuft unter Bildung eines ! Hydroxyethyl-TPP-Intermediates! ! Diese Reaktion ist identisch zur Pyruvat-Decarboxylase Reaktion in Hefe! Pyruvat-dehydrogenase: E2-enzym! Liponamid besteht aus ! Liponsäure, die über ! eine Amidbindung! kovalent an die ! ε-Aminogruppe eines ! Lys-Restes gebunden ist.! ! ! Das reaktive Zentrum ist! ein zyklisches Disulfid,! das reversibel reduziert! werden kann.! Pyruvat-dehydrogenase: E2-enzym! Die aus dem Pyruvat stammende Hydroxyethylgruppe greift die Disulfidbindung ! im Liponamid an und TPP wird eliminiert. Hierbei wird das Hydroxyethyl-! carbanion zu einer Acetylgruppe oxidiert und das Liponamiddisulfid reduziert.! Pyruvat-dehydrogenase: E2-enzym! Anschliessend katalisiert E2 die Transacetylierungsreaktion, bei der die ! Acetylgruppe auf CoA unter Bildung von Acetyl-CoA und ! Dihydro-liponamid-E2 übertragen wird.! Pyruvat-dehydrogenase: E3-enzym! Regenerierung der Liponamidgruppe des E2. Dihydroliponamid wird durch das ! Dihydrolipolyl-Dehydrogenase (E3) oxidiert (Disulfidaustauchreaktion). Oxidiertes ! E3 enthält eine reaktive Cys-Cys-Disulfidgruppe und ein fest gebundenes FAD. ! Reoxidation des E3. Die Sulfhydrylgruppen werden durch FAD und das resultierende ! FADH2 durch NAD+ oxidiert, wobei reduziertes NADH gebildet wird.! Arsenvergiftung!! Arsenverbindungen sind giftig, da sie mit Sulfhydrylverbindungen zweizähnige! Addukte bilden. Vorallem betroffen sind davon die Pyruvat- und ! α-Ketoglutarat-Dehydrogenasen, was zum Atemstillstand führt.! Regulation ! der Pyruvat-dehydrogenase! Reaktion irreversibel, bei Säugetieren ist dies der ! einzige Weg für die Synthese on Acetyl-CoA aus! Pyruvat. ! ! ! -> Produkthemmung durch NADH, Acetyl-CoA und ATP! ! -> Phosphorylierung der Pyruvat-dehydrogenase! !inaktiviert den Enzymkomplex.! ! !Insulin aktiviert die Phosphatase ! !-> auf diese Weise erhöht Insulin als Antwort ! !von erhöhtem Blutzucker die Synthese von ! !Acetyl-CoA! Speicherung von Lipiden:! Im Cytoplasma von Zellen ! befinden sich Lipid-droplets. ! Diese Strukturen dienen als ! zelluläre Speicher von Fetten. ! Spezifische Fettzellen (Adipozyten) dienen als Fettspeicher.! Lipasen:! Der erste Schritt des Fett-Abbaus für die Energieproduktion ist die Hydrolyse von Triacylglycerol durch spezifische Lipasen. ! Lipasen werden durch Hormone (Adipokine) reguliert. ! Bindungsproteine für Fettsäuren! Fettsäuren sind normalerweise an spezifische Proteine gebunden. ! ! Struktur eines Fettsäure-Bindungsproteins mit Palmitat (gelb). Die Fettsäure ist ! im hyrophoben Zentrum des β-Barrels gebunden. ! Aktivierung von Fettsäuren durch Acyl-CoA-Synthase ! Die Bildung von Acyl-CoA verläuft über den gemischten Anhyrid Acyladenylat. ! Fatty acid oxidation! ! Acyl-CoA-! Dehydrogenase! (Oxidation)! β-Ketoacyl-CoA-! Thiolase! (Thiolysis)! Enoyl-CoA-! hydratase! (Hydration)! 3-L-Hydroxyacyl-CoA-! dehyrogenase! (Oxidation)! Glykolyse: cytoplasma! Citratcyklus: mitochondrium! Eine typische eukaryotische Zelle enthält ca. 2000 Mitochondrien. Die ! Mitochondrien varieren je nach Stoffwechselzustand in Grösse und Gestalt.! ! In Eukaryonten finden die oxidativen Processe im Mitochondrium statt. ! Mitochondrien enthalten neben Pyruvatdehydrogenase alle Enzyme des ! Citratcyclus, die Enzyme der Fettsäureoxidation, sowie Enzyme und Redox-! proteine, die am Elektronentransport und bei der oxidativen Phosphorylierung beteiligt sind. ! Mitochondrien, Kraftwerke der Zellen! Die äussere mitochondriale Membran enthält Porine, die die freie Diffusion ! von bis zu 10kDa grossen Molekülen erlauben. ! Die innere Membran ist nur für O2, CO2 und H2O frei permeabel, und ! enthält ausser den Proteinkomplexe der Atmungskette zahlreiche ! Transportproteine, die den Fluss der Metabolite wie ATP, ADP und ! Pyruvat durch die Membran kontrollieren. ! ! Transport von Acyl-CoA durch die Mitochondrienmembran! Die Aktivierung von Fettsäuren findet im Cytosol statt, der Abbau durch ! β-Oxidation aber in Mitochondrien. Carnitin dient dabei als Trägermolekül.! Der Transport benötigt eine Translocase. ! Ketonkörper:! Aceto-acetat! Beta-Hydroxybutyrat! ! Ketonkörper sind wichtige Energielieferanten für viele periphere ! Gewebe, besonders Hirn sowie Herz- und Skelettmuskelatur. ! In Hungerzeiten werden die kleinen, wasser-löslichen Ketonkörper ! daher zur Hauptenergiequelle des Gehirns.! ! Ketogenese! Ketonkörper:! Die Leber setzt Acetoacetat und beta-Hydroxybutyrat frei, ! die dann über die Blutbahn zu den peripheren Geweben gelangen. ! Abbau von Aminosäuren:! Uebersicht des Citratzyklus! Oxidative Decarboxylierungen ! (C6 -> C5 -> C4)! ! Succinat (C4) wird dann zu ! Oxalacetat (C4) regeneriert! ! ! Der Citratcyklus setzt! sich aus 8 Enzymen! zusammen. ! Citratsynthase! (C6)! (C4)! Kondensation von Acetyl-CoA und Oxalacetat. Diese Initial-! reaktion des Citratcyklus ist die Stelle, an welcher neue ! Kohlenstoffatome aus Kohlenhydraten, Fettsäuren und ! Aminosäuren in Form von Acetyl-CoA veratmet werden.! Aconitase! Aconitase kataylsiert die reversible Isomerisierung von ! Citrat zu Isocitrat, über das Intermediat cis-Aconitrat.! ! Isocitrat-Dehydrogenase! Isocitrat-dehydrogenase katalysiert die oxidative Decarboxylierung ! von Isocitrat zu α-Ketoglutarat. Diese Reaktion generiert das ! erste CO2 und das erste NADH des Citratcyclus. ! ! Manche Gewebe von Säugetieren enthalten ein Isoenzym der Isocitrat-! dehydrogenase, das NADP+ als Co-substrat verwendet. ! α-Ketoglutarat-Dehydrogenase! α-Ketoglutarat-Dehydrogenase katalysiert die oxidative Decarboxylierung! einer Ketosäure (α-Ketoglutarat) zu einem energiereichen Thioester ! (Succinyl-CoA). Diese Reaktion liefert CO2 und NADH.! Multienzymkomplex (E1, E2 und E3), ähnlich wie Pyruvat-dehydrogenase.! Succinyl-CoA-Synthetase! 1) Bildung eines energiereichen ! !Anhydrids! 2) Bildung eines energiereichen! ! Phosphoryl-His! 3) Uebertragung der ! !Phosphatgruppe auf! !GDP !! Zwei Dehydrogenase-reaktionen liefern FADH2 und ! NADH, und oxidieren Succinate zu Oxalacetat! Succinat-dehydrogenase! Succinat-dehydrogenase katalysiert die stereospezifische Dehydrierung von ! Succinat zu Fumarat. ! Enthält als prostetische Gruppe FAD, das über einen His-Rest kovalent an ! das Enzym gebunden ist. ! Im allgemeinen dient FAD dazu, Alkanstrukturen (wie Succinat) zu ! Alkenstruturen (wie Fumarat) zu oxidieren, während NAD+ ! bei der stärker exergonen Oxidation von Alkoholen oder Ketonen beteiligt ist. ! Fumarase! Fumarase (Fumarat-Hydratase) katalysiert die Hydratation der Doppel-! bindung von Fumarat unter Bildung von Malat. Die Hydratationsreaktion ! läuft über einen Carbanion-übergangszustand. ! Malat-dehydrogenase! Malat-dehydrogenase katalysiert die Regenerierung von Oxalacetat.! Die Hydroxylgruppe von Malat wird in einer NAD+-abhängigen Reaktion! oxidiert. Der Reaktionsmechanismus gleicht derjenigen der Lactat- und Alkohol-! Dehydrogenasen. ! ! ! Netreaktion des Citratcyclus:! ! Acetyl-CoA + 3 NAD+ + FAD + GDP + Pi + 2 H2O! ! ! !---> 2 CO2 + 3 NADH + FADH2 + GTP + 2 H+ + CoA! Abbau von Aminosäuren:! Anabolische Reaktionen des Citratcyklus:!