GLF
Werbung
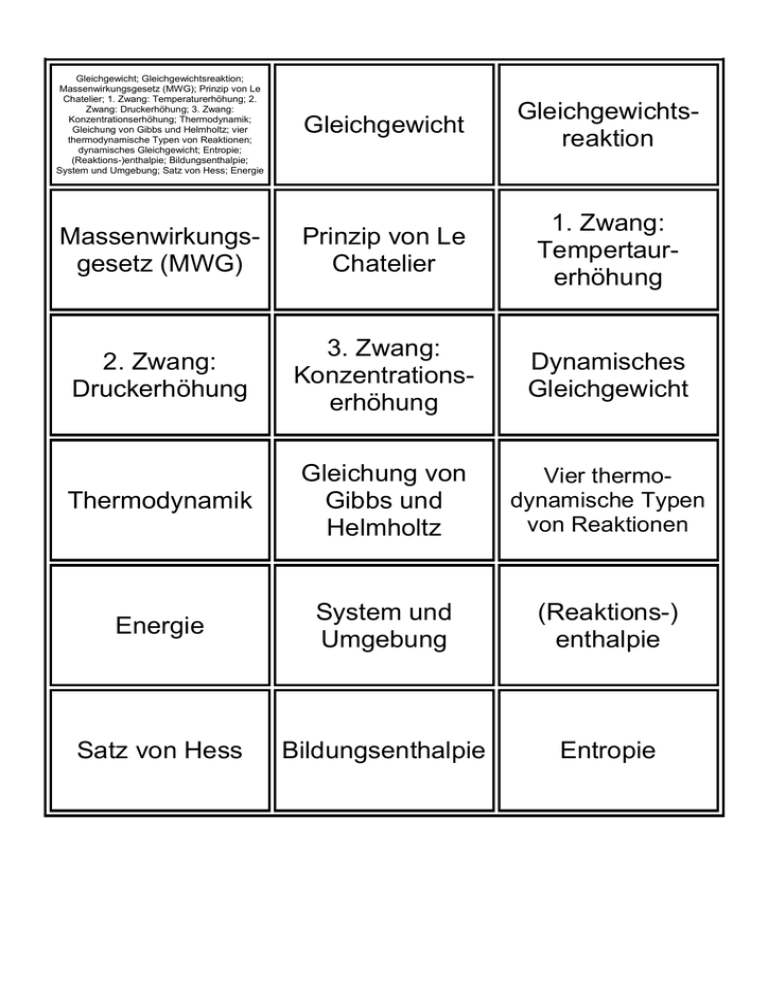
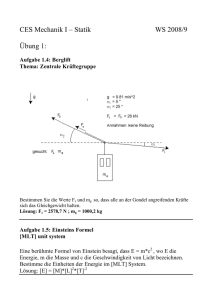
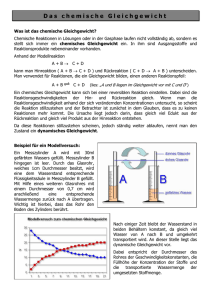
Gleichgewicht; Gleichgewichtsreaktion; Massenwirkungsgesetz (MWG); Prinzip von Le Chatelier; 1. Zwang: Temperaturerhöhung; 2. Zwang: Druckerhöhung; 3. Zwang: Konzentrationserhöhung; Thermodynamik; Gleichung von Gibbs und Helmholtz; vier thermodynamische Typen von Reaktionen; dynamisches Gleichgewicht; Entropie; (Reaktions-)enthalpie; Bildungsenthalpie; System und Umgebung; Satz von Hess; Energie Gleichgewicht Gleichgewichtsreaktion Massenwirkungsgesetz (MWG) Prinzip von Le Chatelier 1. Zwang: Tempertaurerhöhung 2. Zwang: Druckerhöhung 3. Zwang: Konzentrationserhöhung Dynamisches Gleichgewicht Thermodynamik Gleichung von Gibbs und Helmholtz Vier thermodynamische Typen von Reaktionen Energie System und Umgebung (Reaktions-) enthalpie Satz von Hess Bildungsenthalpie Entropie Wenn bei einer Reaktion nicht nur der Hinweg, sondern auch der Rückweg ablaufen kann, werden die Produkte nicht vollständig umgesetzt. Es bildet sich ein stabiler Gleichgewichtszustan der beteiligten Stoffe. Das chemische Gleichgewicht ist im Gegensatz zur Alltagsvorstellung kein statisches Gleichgewicht, sondern ein dynamisches. Stoffe bilden sich und zerfallen ständig. Ein chemisches Gleichgewicht Ein chemisches Gleichgewicht versucht stets einer Störung verschiebt sich bei entgegenzuwirken (z.B. Temperaturerhöhung auf die Veränderung von T, p oder c), endotherme Seite Senkung indem es sich in die der Temperatur entsprechende Richtung verschiebt. Ein dynamisches Gleichgewicht besteht dann, wenn sich der Zustand eines Sytems von außern betrachtet nicht ändert, wenn aber ständig Vorgänge in beide Richtungen ablaufen. Chemie GLF Klasse 3 Block 2 Reaktion: xA + yB zC MWG: K = [C]z / [A]x · [B]y MWG: Produkt der Konz. der Produkte geteilt durch das Produkt der Konz. der Edukte. Ein chemisches Gleichgewicht Ein chemisches Gleichgewicht verschiebt sich bei Erhöhung verschiebt sich bei der Konzentration eines Druckerhöhung auf die Seite, Reaktionspartners auf die auf der die Teilchen weniger Seite, auf der dieser Platz beanspruchen Abbau verbraucht wird. des Druckes H < 0, S > 0 G < 0: läuft immer von selbst ab H > 0, S < 0 G > 0: läuft nie von selbst ab H < 0, S < 0 G < 0: läuft bei tiefen Temperaturen H > 0, S > 0 G < 0: läuft bei hohen Temperaturen G = H – T · S G...Gibbssche freie Enthalpie H...freie Enthalpie S...Entropie Eine Reaktion läuft von selbst, wenn G < 0 (exergonisch ≠ endergonisch) Teilgebiet der Chemie und Physik, welche Aussagen zulässt, über den Ablauf chemischer Reaktionen in Abhängigkeit von Energie, Temperatur und Ordnungsgrad. Die Rekationsenthalpie H ist die, bei konstantem Druck aufgrund einer chemischen Reaktion umgesetzte Wärme. H < 0...exotherme Reaktion; H > 0...endotherme Reaktion Es gibt isolierte (i.), geschlossene (g.) und offene (o.) Systeme. Beim i. System kann weder Stoff noch Energie mit der Umgebung ausgetauscht werden. Beim g. System nur Wärme und beim o. System beides. Energie kann viele Formen einnehmen. Sie bleibt stets erhalten. Bei offenen Systemen kann chemische Energie als Wärme abgegeben werden, im geschlossenen System kann zuästzlich Hubarbeit geleistet werden. Die Entropie S ist ein Maß für die Unordnung. Jeder spontane Vorgang ist mit einer Zunahme der Entropie verbunden. Die molare StandardBildungsenthalpie Hf0 einer Verbindung ist die Reaktionsenthalpie, die bei der Bildung von 1 mol der Verbindung aus den Elemente bei Standardbedingungen umgesetzt wird. Gesetz der konstanden Wärmesummen. Die Reaktionsenthalpie eines bestimmten Vorganges wird nur duch den Anfangs- und den Endzustand des Systems bestimmt.