chemische reaktionen
Werbung
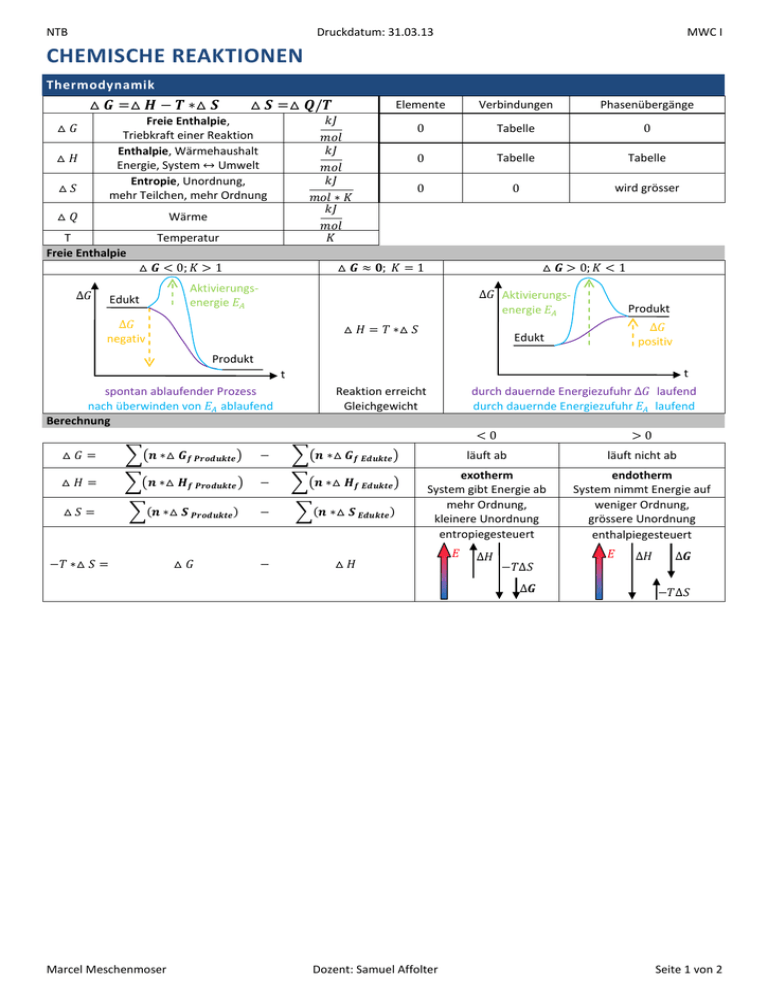
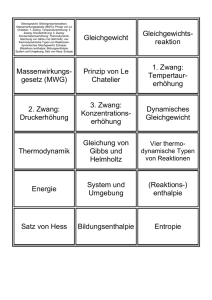
NTB Druckdatum: 31.03.13 MWC I CHEMISCHE REAKTIONEN Thermodynamik Elemente Freie Enthalpie, Triebkraft einer Reaktion Enthalpie, Wärmehaushalt Energie, System Umwelt Entropie, Unordnung, mehr Teilchen, mehr Ordnung Verbindungen Phasenübergänge Tabelle Tabelle Tabelle wird grösser Wärme T Freie Enthalpie Temperatur Edukt Aktivierungsenergie Aktivierungsenergie Produkt Edukt negativ positiv Produkt t t spontan ablaufender Prozess nach überwinden von ablaufend Berechnung Marcel Meschenmoser Reaktion erreicht Gleichgewicht durch dauernde Energiezufuhr durch dauernde Energiezufuhr laufend laufend läuft ab läuft nicht ab exotherm System gibt Energie ab mehr Ordnung, kleinere Unordnung entropiegesteuert endotherm System nimmt Energie auf weniger Ordnung, grössere Unordnung enthalpiegesteuert Dozent: Samuel Affolter Seite 1 von 2 NTB Druckdatum: 31.03.13 MWC I Kinetik Reaktionsgeschwindigkeit v 0. Ordnung 1. Ordnung 2. Ordnung 1.Typ t 2.Typ t Reduktion auf 1. Ordnung Abbau des Alkohols im Blut Zerfall radioaktiver Isotopen Additionen, Kondensationen Aktivierungsenergie Funktion Aufbrechen von chem. Verbindungen; Bildung von Zwischenprodukten nachhelfen Aktivierungsenergie selbstablaufend Geschwindigkeitskonstante Aktivierungsfaktor universelle Gaskonstante T Reaktionstemperatur pro Katalyse Katalysator beschleunigen die Reaktion, vermindert die Aktivierungsenergie, werden nicht verbraucht, verändert chem. Gleichgewicht nicht heterogene Katalyse homogene Katalyse min. 2-phasige Lösungen einphasige Lösungen Autoabgaskatalysator, Polymerisation Alkoholabbau im Körper doppelte Geschwindigkeit Inhibitor/Stabilisator verzögert die Reaktion erhöht die Aktivierungsenergie Chemisches Gleichgewicht (reversible(=umkehrbar) Reaktionen) Gleichgewicht Ein chemisches Gleichgewicht stellt sich ein! Dauer ist abhängig von: Reaktionsgeschwindigkeit Konzentrationen und Temperatur T und Druck p Gleichgewichtskonstante Änderungen Hinreaktion exotherm mehr Gasteilchen (Volumenteile) Massenwirkungsgesetz MWG allgemeine Reaktion Änderung Temperaturerhöhung Druckerhöhung Gleichgewicht verschiebt sich zu -> Edukte -> Edukte Konzentration von Feststoffen = 1 für Lösungen Gleichgewichtskonstante Gleichgewichtskonstante Konzentration für Gasmischungen Koeffizienten Partialdruck Zusammenhang von und Marcel Meschenmoser K bleibt K variiert Dozent: Samuel Affolter Konzentration Temperatur, Druck Seite 2 von 2