10 - ROFLBOA
Werbung

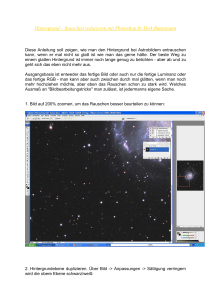
10 Definition Signal und Rauschen Jede analytische Messung besteht aus Signal (S) = Träger der erwünschten Information Rauschen („Noise“, N) = Träger unerwünschter Informationen Rauschen: → Rauschpegel (noise level) limitiert für viele Messungen deren Empfindlichkeit. Rauschen = Differenz des gemessenen und des idealisierten (messtechnisch nicht zugänglichen) Signals. → Rauschen kann die Aussagekraft von Daten (Signalen) beeinträchtigen. → meist durch die Standardabweichung s des Signals charakterisiert → angegeben wird Signal/Rausch-Verhältnis um ein Verfahren zu charakterisieren S/N = Mittelwert/Standardabweichung = xquer/s Da xquer/s = 1/RSD → S/N = 1/RSD 10.1 Ursachen von Rauschen (Quellen) 2 unterschiedliche Sorten von Rauschen a) chemisches Rauschen aufgrund unkontrollierbarer chemischer Faktoren (z.B.: Schwankung der Luftfeuchtigkeit, des pH-Wertes, Verunreinigungen, Zersetzung von Chemikalien etc) b) instrumentelles Rauschen verursacht durch alle (elektrischen/elektronischen) Komponenten des Messsystem, z.B. Lichtquelle, Detektor, Messumwandler, Signalverarbeitung, Signalausgabe. Thermisches Rauschen (thermal noise) Schrotrauschen (shot noise) Flackerrauschen (flicker noise) Umgebungsrauschen (environmental noise) Chemisches Rauschen: Sehr verbreitet in Chromatographie und Spektroskopie Instrumentelles Rauschen: Thermisches Rauschen (Johnson-Rauschen) Ursache: Bewegungen von Elektronen in leitenden Materialien. je höher die Temperatur, desto größer das Rauschen Elektronenbewegung zufällig und ungerichtet → Elektronen zwar verschoben, aber im Zeitmittel kein Stromfluss beobachtbar verschwindet nur im absoluten Nullpunkt der Temperatur Beschreibbar als Urms = √(4kTR∆f) [Rauschspannung im Frequenzintervall ∆f] Schrotrauschen Ursache: Bewegung von Elektronen über eine Potentialbarriere (Grenzfläche), z.B. in Halbleitern, Photozellen, Vakuumröhren etc. Mechanismus: Gesamtstromfluss setzt sich aus Bewegung einzelner Ladungsträger 1 zusammen. Jeder Ladungsträger für sich überquert Barriere → statistischer Prozess → gewisse Schwankungen des Stromflusses auch auf makroskopischer Ebene beobachtbar gemittelter Rauschstrom beschreibbar als Irms = √(2Ie∆f) [e…Elementarladung] Funkelrauschen, Flackerrauschen Ursache: nicht eindeutig erklärbar; tritt ubiquitär auf (vielleicht durch Fehlstellen in Halbleitern oder kosmische Strahlung) Charakteristika: Intensität nimmt mit 1/f ab: Irms = ∞1/f sehr wichtig bei sehr kleinen Gleichstromfrequenzen, praktisch unbedeutend bei f > 1 kHz reduzierbar durch Schirmung oder Lock-in-Verstärker Umgebungsrauschen Ursache: Umgebung sendet elektromagnetische Wellen aus oder erzeugt elektrische/magnetische Felder Charakteristika: Frequenzabhängig, je kleiner f, desto größer Rauschen „ruhige“ Bereiche vorhanden, werden messtechnisch genutz Ursachen kaum eliminierbar, Reduktion durch geeignete Messtechnik (Lock-in-Verstärker) 10.2 Verbesserung des SNR (3 ausgewählte detailiert) a) b) Hardware-Maßnahmen (instrumentell) Software-Maßnahmen Hardware-Maßnahmen: Erdung und Abschirmung gegen Umgebungsrauschen, wichtig bei hochohmigen Messgeräten (sehr geringer Strom fließt), z.B. pH-Elektrode Differenzverstärker Messsignal minus Referenzsignal, dann Verstärkung da beide Signale in Phase sein sollten → wesentlich weniger Rauschen im Differenzsignal 2 Analog-Filter Tiefpassfilter: Eliminierung von hochfrequentem Rauschen aus (konstantem oder nur langsam sich ändernden) Signal Hochpassfilter: Eliminierung von nierderfrequentem Rauschen (z.B. Drift, FlackerRauschen) aus einem (sich schnell änderndem Signal) Realisierung in Form von RC-Schaltkreisen Aus dem Skriptum nicht zuordnungsbar: Modulation Chopping Lock-In Verstärker Software-Maßnahmen Coaddition Verbesserung des Signal/RauschVerhältnisses durch Coaddition und Mittelung von einzelnen Datensätzen (Spektren) digital oder analog Da S ∞ n, aber N ∞ √n, resultiert daraus: S/N = n ∙ S/√n ∙ N = √n (S/N) Mit der Scanzahl erhöht sich das absolute Rauschen, aber nicht in demselben Maße wie das Signal → Verbesserung von S/N 3 Boxcar-Filterung Digitale Filter Rekursive Filter Fourier Filterung 4 7.1 Grundlagen der Elektrophorese Trennung von elektrisch geladenen Teilchen (in einer Lösung) aufgrund von unterschiedlichen Wanderungsgeschwindigkeiten im elektrischen Feld. → sehr wichtige Trennmethode, aber keine chromatographische → wirkende elektrische Kraft im Feld Fe = zi ∙ e0 ∙ E zi…Ladungszahl der Komponente i e0…Elementarladung [C] E…elektrische Feldstärke [V/cm] → in einem viskosen, wässrigen Medium wirkt Reibungskraft FR entgegen → Geschwindigkeit einer Komponente: η ...Viskosität der Lösung [Pa.s] vi ...Wanderungsgeschwindigkeit der Komponente i [cm/s] r ...hydrodynamischer Radius des hydratisierten Ions (≠ Ionenadius) → Stoffkonstante für Komponente i, elektrophoretische Mobilität → Nur Trennung geladener Analyten, beruht auf Unterschieden der Molekülgröße und Ladung → daher keine chromatographische Trennung, da keine Verteilung zwischen einer mobilen und stationären Phase 7.2 Realisierung von Elektrophorese Zahlreiche verschiedene Formen Absteigend auf einem Filterpapier oder Gel, oder Flachbett-Anordnung (Gel oder Papier) oder in Kapillare Kopplung mit anderen Trennmechanismen möglich Prinzip: Probe wird auf Trägermaterial aufgebracht (Papier-, Gelelektrophorese) oder in Kapillare injiziert (Kapillarelektrophorese [CE]) Anlegen einer hohen Spannung (20 – 50 kV in der CE) Kationen → Kathode, Anionen → Anode Wegen unterschiedlicher Mobilität → Auftrennung Neutralteilchen nicht aufgetrennt Verwendung von Pufferlösungen (konstanter pH, Elektrolyt) 5 Träger-Elektrophorese Verwendung eines Trägermaterials (Celluloseacetat; Papier) zur Trennung von Proteinen Wanderungsgeschwindigkeit v.a abhängig von der Ladung der Moleküle Trennung - Auftrennung auf Trägermaterial - Anfärbung der Substanzflecken (z.B. mit Amidoschwarz) - Entfärben (Entfernen des Farbstoffüberschusses) - Transparent machen des Trägers - Densitometrisch vermessen (UVScanner) Einsatzbereich vorwiegend in biochemischer und klinischer Analyse Gel-Elektrophorese Gel (z.B. Agarose; Polyacrylamid-Gele: PAGE) ist Träger- und Trennphase Trennung nach Ladung und auch Molekülgröße (Siebeffekt) Porosität der Gele steuerbar durch Konzentrationen der eingesetzten Stoffe Röhrchen- und Flachbettform Problem: Überlagung der Trennung nach Größe und Ladung → Ladung wird oft durch Zusatz von Tensiden abgeschirmt Gleichzeitig viele Analysen möglich (bis zu 60), Auftragung der Proben ebenfalls Entwicklung und Detektion: Proteine nach Auftrennung in Färbebändern fixiert und gefärbt, anschließend überschüssiger Farbstoff in Entfärbebändern entfernt Ergebnis: transparente Folie mit Blau gefärbten Proteinen Kapillar-Elektrophorese Instrumentierung: Hochspannungsversorgung bis 30 kV Meist unbeschichtete Quarz-(Fused-silica)-Kapillaren, auch Teflon Innendurchmesser 10 – 100 µm, Länge 20 – 100 cm UV/Vis-Detektoren (on column detection) 6 Joule’sche Wärme entsteht → kleine Kapillardurchmesser führen Wärme besser ab Elektroosmose → elektroosmotischer Fluss Viele Materialien bilden elektrochemische Doppelschicht bei Kontakt mit Elektrolytlösung Kapillareinnenseite negativ → Flüssigkeitssäule positiv Elektroosmose tritt auf, wenn elektrisches Feld an flüssiges Elektrolytsystem angelegt Flüssigkeitssäule bewegt sich zu Kathode, Fließprofil kastenförmig Kapillar-(Zonen-)Elektrophorese Trennung aufgrund von Mobilitätsunterschieden Gleiche Pufferreservoiren (Grundelektrolyt) → bestimmt Leitfähigkeit und pH in Kapillare aufgrund hoher Konzentration Trennungsoptimierung durch pH-Änderung (Pufferzusammensetzung) Beeinflussung des Dissoziationsgrad der Analyten/starke Mobilitätsänderung am pK des Analyten Charakteristika: Peakverbreiterung nur durch longitudinale Diffusion Scharfe Anfangszone bei Probenaufgabe wichtig (ca. 1 nL) Anwendung speziell in biochemischer und klinischer Analytik (Aminosäuren, Proteine, Nukleinsäuren) Vorteile (gegenüber klassischer Gelelektrophorese): 7 Hohe Trennstufenzahl, ca. 1000000 pro Meter Schnelle Trennungen Nachteil: Schwierige Detektion (Detektorvolumen < 0,5 nL) Isotachophorese Trennung von elektrisch geladenen Teilchen im elektrischen Feld, aber mit gleicher Wanderungsgeschwindigkeit Experimenteller Aufbau: Durchführung in Kapillarsäule (0,5-1 mm ID, bis 1 m Länge) Säule zu Beginn mit 2 Elektrolyten unterschiedlicher Ionenbeweglichkeit Probelösung (0,1 – 50 µl) an der Phasengrenzfläche aufgegeben Spannung → Anordnung der Ionen gemäß ihrer Ionenbeweglichkeit in scharfe Zonen zwischen Leading- und Terminal-electrolyte reservoir Wanderungsgeschwindigkeit konstant Detektion z.B. über Potetialgradienten-Detektor Detektion: Potentialgradienten-Detektor: Misst den Übergang zwischen zwei Elektrolyten mittels zweier Pt-Elektroden → Potentialsprung UV-Absorptionsdetektor: Alternative für UV-absorbierende Substanzen Charakteristika: Probenvolumina 0,1-100 µl, Ionische Lösungen mit pH 2-12 Erfassungsgrenze: ~10-9…10-10 mol/l Reproduzierbarkeit: ~2% RSD Anwendungen: Für organische und anorganische Ionen in der Biochemie (Proteine, Aminosäuren, Nucleotide,…) Pharmaindustrie (Antibiotika, Amine…) Lebensmittelindustrie (Zitronensäure, Milchsäure, …) 8.1 Grundlagen und Realisierung der Kapillarelektrophorese Siehe 7.2m Kapillar-, Kapillar-Zonen-Elektrophorese Probenaufgabe: Probe wird in Kapillare injiziert Detektion: UV/Vis Detektoren UV/Vis – Detektion → Messprinzip: Abschwächung eines monochromatischen Lichtstrahls durch selektive Absorption der Probe im, Strahlengang → Konzentration nach Lambert-Beer’schen Gesetz berechenbar → Messzelle: optische Weglänge 10 mm, Zellvolumen 8 – 32 µL → Messbereich: 190 – ca. 850 nm 8 Vergleich Kapillarelektrophorese und Ionenchromatographie Säule Analyten Typische Probenvolumina Nachweisgrenze Typische Trennzeit Reproduzierbarkeit Phasen 9.1 Ionenchromatog raphie ID: 1-4 mm, L: 10-25 cm Anorganische Ionen, kleine organische Ionen, Biomoleküle (Proteine) 10-50 µl Kapillarelektroph orese ID: 10-100 µm, L: 20-100 cm Ionen ohne Größenlimit, Proteine Isotachophorese (<)< 1µl 0,1 – 50 µl 10-7 - 10-10 mol 5-30 min 3-5% RSD Stationäre Phase, mobile Phase (NaOH oder NaCO3; HCl) bis 10-12 mol 5-15 min 5% RSD Keine Stationäre Phase; mobile Phase (Puffer) ~10-9…10-10 mol/l 5-15 min ~2% RSD 2 Elektrolyte Spannung wird angelegt Spannung wird angelegt Wanderungsgesch windigkeit der Analyten unterschiedlich UV/VisDetektion Wanderungsgesch windigkeit der Analyten konstant ID: 0,5-1mm, L: bis 100 cm Potentialgradiente n-Detektor Vergleich Flachbett-Elektrophorese und Kapillarelektrophorese Realisierung siehe auch 7.2 Flachbettelektrophorese: braucht einen Träger (Celluloseacetat; Papier; Gel), Detektion über UV-Scanner, Probenauftragung: viele Proben gleichzeitig. Nach Auftrennung Substanzflecken angefärbt, nach entfernen des Farbstoffüberschusses wird Träger transparent gemacht Siebeffekt bei Gel-Elektrophorese Anwendung vorwiegend in der biochemischen und klinischen Analytik (Proteine) Probleme: Überlagung der Trennung nach Größe und Ladung, Abschirmen der Ladung durch Zusatz von Tensiden 9 Kapillarelektrophorese Kapillare: Quarz-Kapillare… Probe wird in Kapillare injiziert. Hochspannung UV/Vis-Detektion Vorteile (gegenüber der klassischen Gelelektrophorese): hohe Trennstufenzahl, schnelle Trennungen Nachteil: schwierige Detektion 9.2 Skizzen Siehe auch 7.2 Flachbettelektrophorese 10