Organische Chemie Chemie der Kohlenwasserstoffverbindungen
Werbung

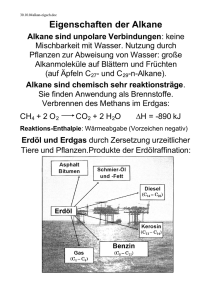
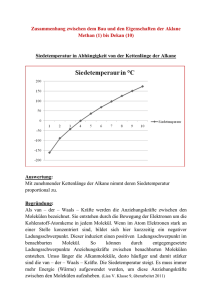
Organische Chemie Chemie der Kohlenwasserstoffverbindungen: Erste künstliche Organische Verbindung: Harnstoff (1828 von Friedrich Wöhler) Alle Organischen Verbindungen enthalten das Element Kohlenstoff. Außer Kohlenstoff sind enthalten: - Wasserstoff - Sauerstoff - seltener Stickstoff, Schwefel, Phosphor Eigenschaften Organischer Verbindungen: - Brennbarkeit bzw. Hitzeempfindlichkeit - Flüchtigkeit - geringe oder keine Wasserlöslichkeit Das C-Atom besitzt 6 Elektronen 1. Schale 2 2. Schale 4 Für das chem. Verhalten sind die Außenelektronen verantwortlich. C-Atome erreichen eine Edelgasschale durch Bildung gemeinsamer Elektronenpaare (Atombindung) Kohlenstoffatome können sich zu Ketten oder Ringen verbinden. Alkane haben die Endung: an gesättigt (Es sind Kettenförmige Kohlenwasserstoff Verbindungen) Homologe Reihe: Eine Gruppe von Verbindungen, deren aufeinander folgende Glieder sich nur durch eine CH2 Gruppe unterscheiden Wird einem Alkan ein Wasserstoffatom entzogen, entsteht ein Alkylrest Bsp: Methan -> Methyl Radikal: Ein Atom oder Atomgruppe mit einem einzelnen Elektron Bei 20 C (=Zimmertemperatur) sind folgende Alkane gasförmig C1-C4 flüssig C5-C16 fest ab C17 Die Siedepunkte der Alkane steigen mit zunehmender Kettenlänge Deutung: Zwischen den Einzelnen Molekülen Herrschen schwache Anziehungskräfte, die sog Van-der-Waalskräfte. Sie sind umso stärker je länger die Ketten werden. -> Es muss somit mehr Energie zugeführt werden, um die Anziehungskräfte zu überwinden. Lösungsverhalten der Alkane: Alkane in Wasser: unlöslich Alkane in Alkanen: Löslich Löslichkeitsrege: Ähnliches löst sich in Ähnlichem Lösungsmittel: Polares Lösungsmittel (z.B. Wasser) - wasserfreundlich (hydrophil) - fettfeindlich (lipophob) Unpolare Lösungsmittel (z.B. Benzin) - wasserfeindlich (hydrophob) - fettfreundlich (lipophil) Isomerie: Es gibt zwei verschiedene Strukturformeln von Butan Halbstrukturformel Vergleich von Schmelz- und Siedepunkt: Sie liegen beim i-Butan tiefer Erklärung: Wegen der kleineren Oberfläche herrschen zwischen den Molekülen des i-Butans geringere Zwischenmolekulare Kräfte. Isomerie: Erscheinung, das Verbindungen mit gleicher Summenformel aber verschiedenem Molekülbau exstieren. Es gibt 5 verschiedene Hexane: Substitution von Alkanen Alkane reagieren nicht ohne weiteres mit anderen Stoffen (Gesättigte Verbindungen) V: Heptan und Brom vermischt und dann belichtet Beobachtung: a) Entfärbung b) ein Gas entsteht Rotfärbung des Universalindikators Deutung: - Das Gas ist Bromwasserstoff (HBr) - Wasserstoff muss vom Heptan stammen Erklärung: Das energiereiche Licht spaltet die Brommoleküle: Es entstehen Bromradikale die mit dem Heptan reagieren Reaktionsgleichung: C7H16 + Br2 C7H15 Br + HBr Substitution: Ersatz von Atomen oder Atomgruppen durch gleichwertige andere Atome oder Atomgruppen Halogenderivate der Alkane: Durch Substitution von Alkanen mit Halogenen erhält man Halogenalkane. Diese Abkömmlinge (=Derivate) haben völlig andere Eigenschaften als die Alkane 1. DDT (Dichloridphenyltrichlorethan) ist ein Insektizid (Malariabekämpfung) Eigenschaften - chemisch stbil - lange Haltbarkeit 2. Bromtriflourmethan Eigenschaften: - gasförmig - nicht brennbar - ungiftig früher: Feuerlöscher heute: verboten (Ozonschicht) Chloroform - flüssig - süßlicher Geruch - nicht brennbar - Krebserregend früher: Narkotium heute: Lösungsmittel 3. Flourchlorkohlenwasserstoff (FCKW) Ozon: O3 (=Schutz vor UV-Strahlung) In 50km Höhe: Die Sonne spaltet die Chloratome aus den FCKW’s ab. Diese Atome zerstören Ozonmoleküle Verzicht auf FCKW’s Ein Beispiel für ein FCKW: Frigen Eigenschaften der Meisten FCKW’S: - bei Raumtemperatur flüssig - verdampfen sehr leicht - kein Geruch/Geschmack - nicht brennbar - ungiftig Erdöl: Eigenschaften: - zähe Flüssigkeit - unangenehmer Geruch - verschiedene Farben (bräunlich-schwarz) Erdöl ist ein Gemisch Entstehung: Vor 500Mio Jahren…große Meere und Kleinstlebewesen…sterben ab…sinken auf den Meeresboden…Faulschlamm entsteht…Flüsse schieben Sand und Geröll darüber…hoher Druck und hohe Temperaturen…Abbau des organischen Materials ohne Sauerstoff durch Bakterien…Erdöl entsteht Schritt für Schritt…wandert durch Erdschichten nach oben…sammelt sich unter einer undurchlässigen Schicht. Verarbeitung: Fraktionierte Destilation Der Rohöldampf steigt auf und strömt durch die Glockenböden. Dabei kühlt der Dampf ab. Die verschiedenen Stoffe Kondensieren sobald ihre Siedetemperaturen unterschritten werden Destilationsturm: Siedepunkt bei: >350 C Rückstand, Schmierstoffe (ab C21) 180-350 C Mitteldestilat: Diesel, Kerosin (C13-C20) 30-180 C Rohbenzin: Benzin (C5-C12) <30 C Gase: Heizgase Vom Rohbenzin zum Autobenzin Die Octanzahl (O.z.) ist ein Maß für die Klopffestigkeit n-Heptan O.z. = 0 sehr klopffreudig i-Heptan O.z. = 100 sehr klopffest Rohbenzin: v.a. unverzweigte Moleküle Verzweigte oder Ringförmige Kohlenwasserstoffe: Klopffest Reformieren: Umbau von unverzweigten Molekülen in verzweigte oder Ringförmige Raffination: Reinigungsprozess Erdölprodukte werden entschwefelt, sonst würde bei der Verbrennung das Schädliche SO2 entstehen. Der Rückstand: Der Rückstand besteht vor allem aus längerkettigen Kohlenwasserstoff Molekülen, zwischen denen größere Van-der-Waalskräfte bestehen. Durch verminderten Druck (VakuumDestilation) wird der Siedevorgang erleichtert, die Moleküle verdampfen unzersetzt und lassen sich wieder auftrennen Gewinnung von Heizöl und Schmieröl Cracken: Spaltung langketttiger Moleküle in Kurzkettige: Vorteile des Crackens: - höhere Ausbeute an kurzkettigen KW-Verbindungen (Benzin) - Gewinn von Ungesättigten Verbindungen (Ausgangsstoffe der Chemischen Industrie Bei der Vollständigen Verbrennung entsteht nur Co2 + H2O + E Bei der Unvollständigen Verbrennung entsteht Co2 + H2O + CO oder C + E Es muss bei beiden Reaktionen der Ursprüngliche Stoff + O2 gegeben sein Umweltprobleme durch Erdöl: 1. Gefahr bei Förderung und Transport - Tankerunfälle - 1L Öl verseucht 1 Mio Liter Wasser - Verschmutzung der Meere durch Bohrinseln - Gefährdung des Grundwassers durch Pipelineschäden 2. Bei der Verbrennung von Erdöl entstehen Schadstoffe - Rus, Co2, So2 und Stickstoff oxide (NO), Co2 (Treibhauseffekt) 3. - Gegenmaßnahmen umweltbewusstes Fahren Abgaskatalysator öl absorbierende Kunststoffe ab 2028 Öltanker mit doppeltem Rumpf Alkene: Herstellung: Dehydrierung einem Alkan wird Wasserstoff entzogen Dehydrierung: Abspaltung von Wasserstoffatomen Die Alkene bilden eine Homologe Reihe Alkene sind: ungesättigte, kettenförmige Kohlenwasserstoffverbindungen mit einer Doppelbindung. Eigenschaften: - Brennbarkeit - Schmelz- und Siedepunkte steigen mit zunehmender Kettenlänge - Löslichkeit V: Alken (Hexen) + Bromwasser: Entfärbung Addition: Anlagerung von Atomen oder Atomgruppen an ungesättigte Verbindungen. Hydrierung: Addition von Wasserstoff Aus Alkenen werden Alkane! Polimerisation: Vereinigung vieler ungesättigter Moleküle zu Makro Molekülen Funktionelle Gruppe: Atome oder Atomgruppen in einem Molekül, die für ganz Bestimmte Eigenschaften verantwortlich sind. Funktionelle Gruppe der Alkane: Doppelbindung