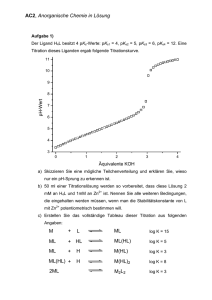
Analytik
7.24
en =
en
tot
- en an Ni gebunden
en tot 10-1
≈
≈
= 10-2.6
-1.6
α0
α0
10
Hen + = en •
-9
H3O+
≈ 10-2.6 • 10
= 10-1
-10.6
Ka1
10
H2en 2+ = en •
H3O+ 2
10-18
≈ 10-5.2 •
= 10-5.1
-10.6
-7.5
Ka1 • Ka2
10
• 10
Die Zusammensetzung der Lösung ist:
[H3O+] = 1.0 10-9 M, [OH-] = 1.0 10-5 M
[en] = 2.5 10-3 M, [Hen+] = 1.0 10-1 M, [H2en2+] = 7.9 10-6 M
[Ni2+] = 1.6 10-14 M, [Nien2+] = 2.0 10-9 M, [Ni(en)22+] =
1.3 10-5 M, [Ni(en)32+] = 1.0 10-3 M
7.6.
Einfluss der Komplexbildung auf die Säurestärke des Liganden
Bei der Komplexbildung des Metallions mit einem protonierten Liganden,
werden die Protonen am Liganden durch das Metallion verdrängt. Der Ligand ist scheinbar eine stärkere Säure. Die Säure/Base-Titrationskurve des
Liganden verschiebt sich daher gegen kleine pH-Werte. Die Verschiebung
ist abhängig von der Stabilität der Komplexe und der Menge an Metallion.
Dieser Effekt wird bei der Komplexbildung von H2EDTA2- mit Metallionen beobachtet. Der pH einer solchen Lösung kann leicht abgeschätzt werden, wenn die Komplexe sehr stabil sind. Unter diesen Bedingungen werden
die Protonen vollständig verdrängt. Der Ligand ist scheinbar eine starke Säure.
Beispiel:
Wie gross ist der pH einer 10-3 mol/l Na2H2EDTA2- Lösung,
welche:
a) kein Cu2+,
b) 10-4 mol/l Cu2+
c) 10-3 mol/l Cu2+
enthält.
pKa1(EDTA) = 10.2,
log Kc(Cu2+) = 18.8
pKa2(EDTA) = 6.2,
pKa3(EDTA) = 2.7,
Analytik
7.25
pKa4(EDTA) = 2.0,
Wird der Komplex gebildet, läuft in der Lösung die folgende Reaktion
ab:
Cu2+
a)
+
H2EDTA2-
CuEDTA2- +
2 H3O +
H2EDTA2- ist eine schwache Säure mit dem pKa2(EDTA) =
6.2
pH = 1 p Ka2 - log H2EDTA2- = 1 6.2 + 3 = 4.6
2
2
b) Hypothese: Der Cu2+-Komplex ist so stabil, dass das Gleichge
wicht fast vollständig auf der Seite des CuEDTA2- Komplexes liegt.
Pro Cu2+ das gebunden wird werden 2 Protonen freigesetzt.
pH = -log 2 * Cu2+ = 3.7
Es muss geprüft werden, ob die Hypothese richtig ist. Dazu wird die
konditionale Komplexbildungskonstante bei pH 3.7 berechnet.
log Kc (kond,3.7) =
log Kc - log 1 +
H3O+
H O+ 2
H3O+ 3
H3O+ 4
+ 3
+
+
=
Ka1
Ka1• Ka2 Ka1•Ka2•Ka3 Ka1•Ka2•Ka3•Ka4
-3.7
-7.4
-11.1
-14.8
= 18.8 - log 1 + 10
+ 10
+ 10
+ 10
10-10.2 10-16.4 10-19.1 10-21.1
≈ 18.8 - 9.0 = 9.8
log Kc(kond, 3.7) ist gross, das Gleichgewicht liegt auf der Seite der
Komplexe. Die Hypothese ist gerechtfertigt.
c) Hypothese: Das Gleichgewicht liegt auf der Seite der Komplexe.
Pro gebundenes Cu2+ werden zwei Protonen freigesetzt.
pH = -log 2 * Cu2+ = 2.7
Es muss geprüft werden, ob die Hypothese richtig ist. Dazu wird die
konditionale Komplexbildungskonstante bei pH 2.7 berechnet.
-2.7
-5.4
-8.1
-10.8
log Kcond(2.7) = 18.8 - log 1 + 10
+ 10
+ 10
+ 10
≈ 18.8 - 11.3 = 7.5
10-10.2 10-16.4 10-19.1 10-21.1
Analytik
7.26
log Kcond(2.7) ist gross, das Gleichgewicht liegt auf der Seite der
Komplexe. Die freie Cu2+- und EDTA-Konzentration kann abge
schätzt werden.
CuEDTA2Cu2+ • EDTA tot - CuEDTA2-
-3
≈ 10
= 107.5
2+ 2
Cu
log Cu2+ ≈ -5.25
Beim pH = 2.7 liegt die eine Hälfte des freien EDTA als H2EDTA2und die andere Hälfte als H3EDTA- vor.
_____________
Die Komplexbildung beeinflusst auch die Titrationskurve des protonierten
Liganden. Im pH Bereich, in dem die Komplexbildung eintritt, ist die Titationskurve flach. Es wird ein pH-Puffergebiet beobachtet, welches auf das
folgende Gleichgewicht zurückzuführen ist:
Mn+ + m H iLi+
MLm
+
m • i H 3O+
Der pH-Wert des Puffergebietes entspricht dem pH, bei dem die konditionale Komplexbildungskonstante 1 ist. Dieser kann daher relativ einfach abgeschätzt werden.
___________
Beispiel:
Titrationskurve von 100 ml Lösung, 10-2 mol l-1 NaH3EDTA
mit
verschiedenen Mengen Ca2+.
logcK(CaEDTA) = 10.7
EDTA: pcKa1 = 10.2, pcKa2 = 6.2, pcKa3 = 2.7, pcKa4 =
2.0.
Aus den pK-Werten von EDTA und der Komplexbildungskonstante kann
man abschätzen, dass die konditionale Komplexbildungskonstante bei pH
3.4 ca. 1 ist. Die Bildung von CaEDTA2- ist daher in der Gegend von pH =
3.4 zu erwarten. Bei diesem pH liegt EDTA vor allem als H2EDTA2- und
H3EDTA- (Verhältnis 1:1) vor. Die Komplexbildungsgleichung lautet daher:
Analytik
7.27
Ca2+ +
H2EDTA2-
Ca2+ +
H3EDTA-
a: kein Ca2+,
c: [Ca2+] = 5.10-3 mol/l
CaEDTA2- +
CaEDTA2- +
2 H3O+
3 H3O+
b: [Ca2+] = 10-3 mol/l
d: [Ca2+] = 10-2 mol/l
Die Titrationskurve a) ist die Titrationskurve von H3EDTA-. Die beiden
pH- Sprünge bei 10 ml NaOH und bei 20 ml, welche die Puffergebiete von
H3EDTA- (pKa3 = 2.7) und H2EDTA2- (pKa2 = 6.2), resp. H2EDTA2und HEDTA- (pKa1 = 10.2) trennen, können gut erkannt werden. Derjenige
bei 30 ml ist nicht so klar zu erkennen, da EDTA4- eine relativ starke Base
ist. In den Lösungen b) und c), welche weniger als 1 Äquivalent Ca2+ enthalten, bleibt die Lösung länger sauer, da die Protonen welche bei der Komplexbildung frei werden, neutralisert werden müssen. Die geschieht um pH
3.5. Nachdem die freigesetzten Protonen neutralisiert sind, beobachtet man
Analytik
7.28
die Titrationskurve des Überschusses EDTA. Die Lösung d) enthält ein
Äquivalent Ca2+. Hier wird nur das Puffergebiet der Komplexbildung beobachtet. Die Puffergebiete von EDTA fehlen ganz, da es kein freies EDTA
mehr in der Lösung gibt.
__________
Dieses Beispiel zeigt, dass aus der Säure/Base-Titrationskurve des Liganden
in einer Lösung, die Metallionen enthält, die Komplexbildungskonstante bestimmt werden kann. Dies ist jedoch nur möglich, wenn die Komplexe nicht
so stabil sind, dass die konditionalen Komplexbildungskonstanten auch in
stark sauren Lösungen noch sehr gross sind.
7.7.
Konkurenz zwischen zwei Metallionen um einen Liganden
Die Situation in diesem Falle ist sehr ähnlich wie für die Konkurenz zwischen Protonen und Metallionen. Das Metallion, welches die stabileren
Komplexe bildet, verdrängt dasjenige vom Liganden, welches schwächere
Komplexe bildet. Nur wenn der Ligand im Überschuss ist bezüglich des Metallions, welches den stärkeren Komplex bildet, wird das zweite Metallion
auch noch gebunden. Im folgenden soll als Beispiel die Konkurenz zwischen
den zwei Metallionen Mg2+ und Cu2+ um den Liganden EDTA diskutiert
werden.
In der Lösung sind die beiden Komplexbildungs-Gleichgewichte gekoppelt.
Die folgenden Gleichungen bestimmen die Konzentrationen der Teilchen in
einer Lösung aus Na2H2EDTA, Mg(NO3)2 und Cu(NO3)2.
Komplexbildung:
c K(CuEDTA)
=
c K(MgEDTA)
=
CuEDTA2Cu
2+
4-
• EDTA
MgEDTA22+
Mg
Protonierung von EDTA4-:
4-
• EDTA
= 1018.8
= 108.7
Analytik
7.29
c Ka,1(EDTA)
=
c Ka,2(EDTA)
=
H3O+ • EDTA43-
HEDTA
H3O+ • HEDTA3-
= 10-10.2
2-
= 10-6.2
H2EDTA
H3O+ • H2EDTA2c Ka,3(EDTA) =
= 10-2.7
H3EDTA
+
H
O
• H3EDTA3
c Ka,4(EDTA) =
= 10-2.0
H4EDTA
Ionenprodukt des Wasser:
c Kw =
H3O+ • OH-
Erhaltungsatz für Mg2+:
M g2+ tot = M g2+ + MgEDTA2-
Erhaltungssatz für Cu2+:
Cu2+ tot = Cu2+ + CuEDTA2-
Erhaltungssatz von EDTA:
EDTA tot = MgEDTA2- + CuEDTA2- + EDTA4- •
• 1+
H3O+
H3O+ 2
H3O+ 3
H3O+ 4
+
+
+
c Ka,1
c Ka,1 • c Ka,2
c Ka,1 • c Ka,2 • c Ka,3
c Ka,1 • c Ka,2 • c Ka,3 • c Ka,4
Elektroneutralität:
NO3- = 2 • M g2+ tot + 2 • Cu2+ tot
Na + = 2 • EDTA tot
H3O+ + 2 • M g2+ + 2 • Cu2+ + Na + =
= OH- + 4 • EDTA4- + 3 • HEDTA3- + 2 • H2EDTA2- + H3EDTA- +
+ 2 • CuEDTA2- + 2 • MgEDTA2- + NO3-
Wenn die Summe der Metallkonzentrationen [Mg2+]tot + [Cu2+]tot grösser
ist als [EDTA]tot und die beiden Metallionen stabile Komplexe bilden, ist
die Konzentration von EDTA, welches nicht komplexiert ist, sehr klein. Es
Analytik
7.30
ist daher naheliegend an Stelle der beiden Komplexbildungen, ein Metallaustausch-Gleichgewicht zu formulieren:
Cu2+ +
c Kexch
=
MgEDTA2-
Mg2+ +
M g2+ • CuEDTA2Cu2+ • MgEDTA2-
=
CuEDTA2-
c K(CuEDTA)
18.8
= 10
= 1010.1
c K(MgEDTA)
8.7
10
Das Metallaustausch-Gleichgewicht ist unabhängig vom pH, da der Einfluss
des pH's auf die Basizität des Liganden zurückzuführen ist.
Wird die Komplexbildung des einen Metallions, z.B. des Cu2+, in Gegenwart des anderen Metallions diskutiert, kann analog zur Konkurenz mit Protonen eine konditionale Komplexbildungskonstante formuliert werden. Diese ist abhängig von der Konzentration des zweiten Metallions. Die Komplexbildung in Gegenwart eines zweiten Metallions ist scheinbar schwächer.
Die konditionale Komplexbildungskonstante ist kleiner.
c Kkond(CuEDTA)
=
CuEDTA2Cu2+ • EDTA4-nicht an Cu gebunden
EDTA4-nicht an Cu gebunden = EDTA tot - CuEDTA2- = MgEDTA2- + EDTA4- =
= EDTA4- • 1 + c K(MgEDTA) • M g2+
c Kkond(CuEDTA)
=
=
CuEDTA2Cu2+ • EDTA4- • 1 + c K(MgEDTA) • M g2+
=
c K(CuEDTA)
1 + c K(MgEDTA) • M g2+
Für die Diskussion der Abhängigkeit der konditionalen Konstante von der
Konzentration von Mg2+ unterscheidet man zwei Bereiche.
1 >> cK(MgEDTA) • [Mg2+]:
Unter diesen Bedingungen ist cKkond(CuEDTA) ≈ cK(CuEDTA).
cK(MgEDTA) • [Mg2+] >> 1:
Unter diesen Bedingungen ist
c Kkond(CuEDTA)
≈
c K(CuEDTA)
c K(MgEDTA)
2+
• Mg
=
1018.8
10 • M g2+
8.7
Analytik
7.31
Diese Beziehung zeigt, dass die konditionale Konstante umgekehrt proportional zu
[Mg2+] ist. Es ist unmöglich, dass die Mg2+-Konzentration so gross wird, dass
Cu2+ verdrängt werden kann.
7.8.
Konkurenz zwischen zwei Liganden
Enthält die Lösung zwei Liganden, welche mit dem Metallion einen Komplex bilden können, sind die verschiedenen Komplexbildungsgleichgewichte
gekoppelt. Zur Vereinfachung wird im folgenden die Protonierung der Liganden vernachlässigt
Als Beispiel wird die Konkurenz von EDTA4- und en um Cu2+ diskutiert.
Die Bildung von gemischten Komplexen der Art Cu(en)(EDTA)2- wird zur
Vereinfachung vernachlässigt. In der Lösung stellen sich die folgenden
Komplexbildungsgleichgewichte ein:
Cu2+
EDTA4-
+
c K(EDTA)
Cu(EDTA)2-
=
Cu
Cu2+
c K1(en)
Cu2+
c β 2(en)
+
=
=
2+
4-
= 1018.8
• EDTA
Cu(en)2+
en
Cu(en) 2+
Cu
+
CuEDTA2-
2+
= 1010.6
• en
Cu(en)22+
2 en
Cu(en) 22+
Cu
2+
• en
2
= 1019.7
Da sowohl EDTA wie en stabile Komplexe mit Cu2+ bilden, ist die Konzentration von Cu2+aq in der Lösung sehr klein, wenn die Ligandkonzentrationen genügend gross sind, um alle Metallionen zu komplexieren. Unter der
Bedingung, dass [EDTA4-]tot > [Cu2+]tot, 2•[en]tot > [Cu2+]tot, sind daher
CuEDTA2- und Cu(en)22+ die dominierenden Teilchen in der Lösung. Das
Metallion wird zwischen den Liganden verteilt. Der Komplex des Liganden
Analytik
7.32
mit der grösseren Affinität wird gebildet. Es kann das folgende Ligandaustauschgleichgewicht formuliert werden:
CuEDTA2c K(exch)
=
+
Cu(en) 22+ + EDTA4-
2 en
Cu(EDTA)2- • en
Cu(en)
2+
2
4-
• EDTA
=
c β 2(en)
c K(EDTA)
= 10+0.9 = 7.94
Die Konstante für den Metallaustausch ist etwas kleiner als 1, das heisst,
dass Cu(en)22+ etwas stabiler ist als CuEDTA2-.
Über die allfällige Bildung von gemischten Komplexen [Cu(en)(EDTA)]2-,
man spricht auch von ternären Komplexen, kann auf Grund der Konstanten
K(EDTA) und K1(en), resp. β2(en) nichts gesagt werden. Ihre Bildung ist
jedoch in diesem Falle unwahrscheinlich, da der Chelateffekt von EDTA
gross ist. Das heisst, dass en durch die freien Bindungsstellen von teilweise
gebundenem EDTA aus der Koordinationssphäre des Cu2+ verdrängt wird.
Sowohl EDTA wie auch en sind auch Basen. Das heisst für beide Liganden
wird eine Konkurenz zwischen H+ und Cu2+ erwartet. Diese ist für die beiden Liganden verschieden, da deren Basizität verschieden ist. Die Austauschkonstante cK(exch) ist daher pH abhängig. Die pH-Abhängigkeit findet man am einfachsten, indem man die konditionalen Konstanten für die
Komplexbildung in den Ausdruck für cK(exch) einsetzt. So kann eine konditionale Austauschkonstante formuliert werden. Im besprochenen Beispiel
führt dies zu den folgenden Ausdrücken:
Kkond (exch) =
Kkond (EDTA)
β 2,kond (en)
=
K(EDTA) • α 0(en) 2
β 2(en) • α o(EDTA)
logKkond(exch) = log Kkond(EDTA) - logβ2,kond(en)
α 0(EDTA) = 1 +
+
H3O+
H3O+ 2
+
+
Ka,1(EDTA) Ka,1(EDTA) • Ka,2(EDTA)
H3O+ 3
+
Ka,1(EDTA) • Ka,2(EDTA) • Ka,3(EDTA)
+
H3O+ 4
Ka,1(EDTA) • Ka,2(EDTA) • Ka,3(EDTA) • Ka,4(EDTA)
α0(en) = 1 +
H3O+
H3O+ 2
+
Ka,1(en) Ka,1(en) • Ka,2(en)
Analytik
7.33
Die Säurekonstanten sind:
EDTA:
pKa,1 = 10.3, pKa,2 = 6.2, pKa,3 = 2.7, pKa,4 = 2.0
en:
pKa,1 = 10.6, pKa,2 = 7.5
Die Kurven logKkond(EDTA) v.s. pH und logβ2,kond(en) sind im folgenden Graphen dargestellt.
Aus dem Graphen kann man sehen, dass für pH > 10 Cu(en)22+ stabiler ist
als CuEDTA2-. Unter diesen Bedingungen wird Cu2+ bevorzugt von 2 en
komplexiert. Bei pH = 10 sind die beiden Komplexe gleich stabil. Für pH <
10 ist CuEDTA2- stabiler. Unter diesen Bedingungen ist Cu2+ bevorzugt
von EDTA4- komplexiert. Die pH-Abhängigkeit der Komplexbildung mit
en ist im pH-Bereich von 10.6 bis 2.0 ausgeprägter. Von pH 10.6 bis pH 7.5
werden bei der Bildung von Cu(en)22+ zwei Protonen freigesetzt, unter pH
7.5 gar 4 Protonen. Bei der Bildung von CuEDTA2- wird zwischen pH 10.3
und 6,2 ein Proton freigesetzt, zwischen 6.2 und 2.7 zwei Protonen, zwischen 2.7 und 2.0 drei Protonen und erst für pH < 2.0 vier Protonen. Bei pH
7 beobachtet man zum Beispiel das folgende Gleichgewicht für den Metallaustausch. H3O+ tritt auf der Seite der Produkte auf. Nach "Le Châtelier"
verschiebt sich das Gleichgewicht nach rechts, wenn die Lösung saurer wird.
Analytik
7.34
CuEDTA2- + 2 H3O +
2 H2en2+ +
Cu2+ +
Cu 2+
Cu(en)22+ + 4 H3O+
2 H2en2+ + CuEDTA2-
7.9.
H2EDTA2-
Cu(en)22+ + H2EDTA2- + 2 H3O+
Extraktion und Komplexbildung
In diesem System werden Verteilungsgleichgewichte und Komplexbildung
gekoppelt. Da HL und MLn keine Ladung tragen, ist es leicht möglich, dass
diese Teilchen hydrophob sind und sich daher besser in der organischen
Phase lösen. Die Verteilungskonstanten sind grösser als 1.
c KD(HL)
HL o
>> 1
HL w
=
c KD(ML n)
MLn o
>> 1
MLn w
=
Die geladenen Teilchen L- und Mn+ dagegen sind nur in der wässrigen Phase löslich.
w: wässrige Phase
c
Ka(HL)
n HLw
H3O+w
+
L -w
-
nLw +
c
c
ßc,n(MLn)
M n+w
(MLn) w
c
KD(HL)
n HLo
KD(MLn)
(MLn)o
o: organische Phase
Unter diesen Bedingungen ist die Gesamtreaktion in diesem heterogenen
System durch die folgende Gleichung beschrieben:
n HLo + Mn+ w
(MLn)o +
n H3O+w
Der pH-Wert der wässrigen Lösung kann leicht durch Zugabe von starker
Säure, resp. starker Base verändert werden. Dadurch kann die Verteilung der
Metallionen zwischen den beiden Phasen kontrolliert werden.
Der Verteilungskoeffizient für das Metallion ist durch den folgenden Ausdruck gegeben.
Analytik
7.35
D(M) =
M tot o
M Ln
≈
M tot w
Mn+
o
w
Der Verteilungkoeffizient ist unabhängig von der Metallkonzentration im
System, solange ein Überschuss Ligand vorhanden ist. Anstelle des Verteilungskoeffizienten D(M) wird oft auch der Bruchteil der extrahierten Metallionen E(M) gebraucht, um die Verteilung zu charakterisieren.
E(M) =
D(M)
D(M) + Vw
Vo
Wenn D(M) grösser als Vw/Vo ist, wird mehr als die Hälfte des Metalles in
die organische Phase extrahiert.
Durch Einsetzen des Säure/Base-Gleichgewichtes von HL und der Komplexierung von Mn+ kann man sehen, dass der Verteilungskoeffizient proportional dem pH und der Konzentration des protonierten Liganden in der organischen Phase ist.
D(M) =
c KD(ML n)
c KD(HL) n
• c β n(MLn) • c Ka(HL)
n
•
HL o n
HL o n
=
konst
•
H3O+ w
H3O+ w
HL 0 n
H3O+
E(M) =
HL 0 n Vw
konst •
+
Vo
H3O+
konst •
Bilden die Liganden mit dem Metallion sehr stabile Komplexe, wird das
Verteilungsverhältnis sehr gross. Es ist daher möglich, das Metallion aus einem grossen Volumen einer verdünnten wässrigen Lösung in ein kleiners
Volumen eines organischen Lösungsmittels zu extrahieren. Bei diesem Prozess wird das Metall angereichert. Diese Methode kann angewendet werden,
wenn sehr verdünnte Lösungen zu analysieren sind und es daher nötig ist
den Analyten vor der Analyse aufzukonzentrieren.
Es gibt viele Liganden, welche die Bedingung erfüllen, dass ihre protonierte
Form hydrophob ist, und die mit einer ganzen Reihe von Metallionen Neutralkomplexe bilden, die auch hydrophob sind. Diese Liganden und ihre
Komplexe sind oft auch verschieden und stark gefärbt, so dass die Extraktion von Auge beobachtet werden kann und die Konzentration des extrahier-
Analytik
7.36
ten Metallions direkt colorimetrisch gemessen werden kann. Zwei typische
Beispiele für solche Liganden, welche in der Analytik verwendet werden,
sind Hydroxychinolin und Dithizon (Diphenylthiocarbazon):
N
M
n+
+
+ n H3O+
M
n
N
O
n
OH
Hydroxychinolin
N
HN
Pb2+
+
NH
2
S
N
NH
Pb
S
+ 2 H3O+
N
N
N
2
Dithizon
grün
rot
Die Verteilungsverhältnisse für verschiedene Metallionen mit demselben
Liganden sind verschieden. Sie unterscheiden sich vor allem wegen der verschiedenen Komplexbildungskonstanten cßn(MLn). Die Verteilungskonstanten cKd(MLn) für die Komplexe sind ähnlich, da deren Oberfläche, nicht
stark von den Eigenschaften des Metallions beeinflusst wird. Die charakteristischen Eigenschaften des Metallions werden durch die Liganden abgeschirmt. Die unterschiedliche Verteilung bei demselben pH kann ausgenützt
werden, um die Metallionen zu trennen. In der Figur sind die Bruchteile
extrahierten Metallions für den Liganden Dithizon als Funktion des pH der
wässrigen Lösung aufgetragen. Die organische Lösung ist CCl4.
Analytik
7.37
Die Qualität der Trennung von zwei verschiedenen Metallionen wird durch
den Trennungsfaktor ß gegeben.
β=
c β n(ML n) • c KD(ML n)
c β n(ML n)
D(M)
=
≈
D(M') c β m(M'Lm) • c KD(M'L m) c β m(M'Lm)
Wie oben angetönt ist der Trennungsfaktor vor allem durch das Verhältnis
der Komplexbildungskonstanten bestimmt. Die Reihenfolge der Stabilität
der Komplexe wird nur wenig vom Liganden und der organischen Phase beeinflusst. Sie nimmt im allgemeinen in der folgenden Reihenfolge ab:
Pd2+>Cu2+>Ni2+>Pb2+>Co2+>Zn2+>Cd2+>Fe2+>Mn2+>Mg2+
Die Komplexe der 3+ geladenen Ionen sind im allgemeinen etwas stabiler.
7.10. Komplexbildung und Löslichkeit
Durch die Komplexierung wird die Konzentration des freien Metallions herabgesetzt. Als Folge davon geht mehr Niederschlag in Lösung. Auch hier
findet man gekoppelte Gleichgewichte, das Lösungsgleichgewicht, die
Komplexbildung und die Protonierung des freien Liganden.
Im Folgenden wird als Beispiel die Löslichkeit von {Fe(OH)3} als Funktion
des pH's diskutiert. In diesem System ist OH- gleichzeitig Gegenion im Niederschlag und Ligand. Die Gleichgewichte, welche die Löslichkeit von Eisen(III)hydroxid bestimmen, sind:
Analytik
7.38
Löslichkeitsprodukt von {Fe(OH)3}s
Fe3+ +
{Fe(OH)3}s
c Ksp
3 OH -
= Fe3+ • OH- 3 = 10-37.4
Hydroxokomplexbildung:
Fe3+ +
OH -
[FeOH]+
c K1
Fe3+ +
FeOH2+
3+
Fe
-
• OH
2 OHcβ2
Fe3+ +
=
[Fe(OH)2] +
Fe OH 2+
=
3+
Fe
-2
• OH
4 OH cβ4
= 1011.8
= 1022.3
[Fe(OH)4]Fe OH 4-
=
3+
Fe
-4
= 1034.4
• OH
Ionenprodukt des Wassers:
c Kw =
H3O+ • OH- = 10-14
[Fe3+] als Funktion des pH wird am einfachsten durch Umformen des Löslichkeitsprodukts und des Ionenprodukts des Wassers gefunden.
log c Ksp = log Fe3+ + 3 • log OH- = log Fe3+ + 3 • logc Kw + 3 • pH
log Fe3+ = - 37.4 - 3 • -14 - 3 • pH = 4.6 - 3 • pH
Die Konzentrationen der Hydroxokomplexe als Funktion des pH erhält man
durch Einsetzen von [Fe3+] und [OH-] in die Komplexbildung. Das Vorgehen ist im folgenden am Beispiel von [Fe(OH)2]+ gezeigt.
log Fe OH 2 + = log c β 2 + log Fe3+ + 2 • log OH- =
= log c β 2 + logc Ksp - 3 • log c Kw - 3 • pH + 2 • logc Kw + 2 • pH =
= 22.3 - 37.4 - 3 • -14 + 2 • -14 - pH = -1.1 - pH
Analytik
7.39
Die Konzentrationen der verschiedenen Teilchen, welche Fe3+ enthalten,
können einfach in einem Hägg-Diagramm dargestellt werden. Die Logarithmen der Konzentrationen sind lineare Funktionen des pH's.
Aus dem Hägg-Diagramm kann man direkt ablesen, dass die Löslichkeit von
Fe(OH)3 bei ca. pH 8 am kleinsten ist. Bei diesem pH ist [Fe3+]tot in Lösung ca. 10-9 M. Das Fe3+ in Lösung liegt zu gleichen Teilen als
[Fe(OH)2]+ und [Fe(OH)4]- vor. In saurerer Lösung wird Fe(OH)3 besser
löslich, da die Konzentration von OH- fällt. In stärker basischer Lösung ist
Fe(OH)3 besser löslich, da der Komplex [Fe(OH)4]- gebildet wird.
Je nach pH-Wert der Lösung ist es eine andere Spezies, in welcher das Fe3+
in Lösung vorliegt. [FeOH]2+ ist z.B. zwischen pH 2 und 3 die dominierende Fe3+-Spezies in Lösung. Bei der Charakterisierung einer Lösung, welche
Metallionen enthält, ist es daher wichtig neben der Konzentration des Ions
auch die Spezies zu kennen, in welcher das Metallion vorkommt. Es ist nicht
gesagt, dass die Wirkung, z.B. Giftigkeit, aller Teilchen gleich gross ist.
__________
Analytik
7.40
Beispiel:
Wie ist die Löslichkeit von CdS in einer EDTA Lösung
([EDTA]tot = 10-3 mol/l) abhängig vom pH.
In diesem System ist die Situation etwas komplexer, da sowohl S2- wie auch
EDTA4- protoniert werden können. Qualitativ ist zu erwarten, dass die Löslichkeit in stark saurer Lösung gross ist, da die Konzentration von S2- sehr
klein wird. EDTA4- ist protoniert und bildet keine Komplexe. Cd2+ ist unter
diesen Bedingungen die dominierende Cd-Spezies in Lösung. Mit steigendem pH nimmt die Löslichkeit ab, da [S2-] ansteigt. Die Löslichkeit läuft
durch ein Minimum.und steigt dann wieder an. Der CdEDTA-Komplex wird
gebildet. In stark basischer Lösung fällt die Löslichkeit wieder, da nun [S2-]
so gross wird, dass der EDTA-Komplex Cd nicht mehr in der Lösung halten
kann.
In diesem System sind die folgenden Gleichgewichte gekoppelt:
Löslichkeitsprodukt von CdS:
logcKsp(CdS) = -28.0
Komplexbildung zwischen Cd2+ und EDTA4-:
logcKc(CdEDTA) = 16.8
Protonierung von EDTA4-:
logcKa1 = 10.2, logcKa2 = 6.2, logcKa3 = 2.7, logcKa4 = 2.0
Protonierung von S2-:
logcKa1 = 15.0, logcKa2 = 14.0
Die Stöchiometrie der Lösungsreaktion verlangt, dass die totale CdKonzentration in der Lösung gleich gross ist wie die totale SchwefelKonzentration.
C d tot in Lösung = S
tot
in Lösung
C d tot in Lösung = C d2+ + CdEDTA2-
Die Konzentration von CdEDTA2- kann bei jedem pH mit Hilfe der konditionalen Komplexbildungskonstante berechnet werden.
Analytik
7.41
CdEDTA2- =
C d2+ • EDTA4- tot
α 0(EDTA)
C d2+ +
c Kc (CdEDTA)
C d tot in Lösung = C d2+ • 1 +
C d2+
EDTA4- tot
α 0(EDTA)
+
c Kc (CdEDTA)
[S]tot in Lösung ist durch die Säure/Base-Gleichgewichte mit [S2-]
verknüpft:
S
tot
in Lösung = S 2- + H S- + H2S = S 2- • α0(S)
[S2-] kann mit Hilfe des Löslichkeitsproduktes als Funktion von
[Cd2+] ausgedrückt werden.
S
tot
in Lösung = α 0(S) •
c Ksp(CdS)
C d2+
Setzt man die Ausdrücke für [Cd]tot in Lösung und [S]tot in Lösung in die
Lösungsgleichung ein, findet man einen Ausruck, der es erlaubt, einen Wert
für die freie Cadmium-Konzentration [Cd2+] für jeden pH zu berechnen.
Die Abhängigkeit vom pH wird durch die Funktionen α0(EDTA4-) und
α0(S2-) bestimmt.
C d2+ • 1 +
C d2+
c K (CdS)
EDTA4- tot
= α0(S) • sp
α 0(EDTA)
C d2+
+
c Kc (CdEDTA)
Die folgende Figur zeigt das Hägg-Diagramm für dieses Sytem. Zur Vereinfachung sind nur die Konzentrationen von Cd2+, CdEDTA2-, EDTA4- und
S2- gegeben.
Analytik
7.42
Das Diagramm bestätigt die qualitativen Voraussagen. Bis pH 2 ist Cd2+ die
dominierende Cd-Spezies in Lösung. Für pH Werte grösser als 2 ist CdEDTA2- die dominierende Spezies. In stark basischer Lösung nimmt die
Konzentration des gelösten Cd wieder ab.
__________
7.11. Komplexometrische Titration
Die Komplexometrie ist eine analytische Methode zur Bestimmung der
Konzentration von Metallionen in Lösung. Als Analysereaktion wird die
Komplexbildung mit EDTA4- (Ethylendiamintetraacetat) eingesetzt.
EDTA4- ist ein sechszähniger Ligand der mit den meisten Metallionen stabile Komplexe bildet. Eine Ausnahme bilden die Alkaliionen. Das Gleichgewicht der Komplexbildung liegt fast vollständig auf der Seite des Komplexes. Die freie Metallkonzentration Mn+aq in einer Lösung, welche einen
Ueberschuss EDTA4- enthält ist sehr klein.
Analytik
7.43
O
-
O
C
O
H2
C
H2
C
N
-
O
C
CH2
CH2
C
H2
C
O-
C
O-
N
C
H2
O
O
EDTA4Ethylendiamintetraacetat
Analysereaktion:
Mn+ + EDTA 4-
Tab. 7.1.:
Mn+
Fe3+
Th4+
Cr3+
Bi3+
Hg2+
Cu2+
Ni2+
MEDTA+n-4
Thermodynamische Komplexbildungskonstanten einiger EDTA
Komplexe
log TK
Mn+
log TK
Mn+
log TK
25.1
18.0
14.4
Pb2+
Fe2+
23.2
16.5
14.0
Cd2+
Mn2+
23.0
16.5
10.7
Zn2+
Ca2+
22.8
16.3
8.7
Co2+
Mg2+
21.8
16.1
8.6
Al3+
Sr2+
18.8
16.0
7.8
Ce3+
Ba2+
18.6
15.1
7.3
La3+
Ag+
Vorgehen bei der komplexometrischen Titration: Zur Probe, Lösung der Metallionen, wird aus der Bürette eine Masslösung von Komplexon-III,
Na2H2EDTA•2 H2O, gegeben. Um den pH während der Titration konstant
zu halten, muss die Probe gepuffert werden. Bei der Komplexbildung werden die beiden Protonen von Na2H2EDTA frei. Diese müssen vom Puffer
gebunden werden, damit die Lösung nicht sauer wird und die Komplexbildung wegen der Konkurenz mit den Protonen zu schwach ist.
Die Konzentrationen der Teilchen in Lösung als Funktion des Volumens zugegebener Komplexon-III-Lösung werden durch die folgenden Gleichungen
gegeben.
Analytik
7.44
Komplexbildung:
c Kkond
=
MEDTA+n-4
Mn+ • EDTA4-
Erhaltungssätze:
M tot = Mn+ + MEDTA+n-4 =
cM • VM
Vtot
EDTA4- tot = EDTA4- + MEDTA+n-4 =
cL • VL
Vtot
Vtot = VM + VL
f=
cK
cL • VL
cM • VM
kond:
cM :
VM:
cL :
V L:
Vtot:
f:
Konditonale Komplexbildungskonstante beim pH
der Lösung während der Titration
Konzentration von Mn+ in der Probe [mol/l]
Volumen der Probe [ml]
Konzentration von EDTA4- in der Masslösung
Volumen der zugegebenen Masslösung
Totalvolumen der Titrationslösung
Aequivalente EDTA4- zugegeben
Durch Kombination der Erhaltungssätze und Einsetzen der Komplexbildung
ergibt sich folgende Beziehungen, welche VL und [Mn+] resp. [EDTA4-]
verknüpfen:
cM • VM - c L • VL
= Mn+ Vtot
cM • VL - Mn+ cL • VL - EDTA4Vtot
Vtot
=
- EDTA4n+
4K• M
K • EDTA
(1 - f ) • c M • VM = Mn+
Vtot
cM • VM - Mn+ cL • VL - EDTA4Vtot
Vtot
=
- EDTA4n+
4K• M
K • EDTA
Je nach der Grösse von (1 - f) lassen sich 3 Regionen unterscheiden:
Analytik
7.45
vor dem Aequivalenzpunkt, 0 < (1 - f) < 1, f < 1, [Mn+]tot >
[EDTA4-]tot. [EDTA4-] ist sehr klein, da alles EDTA4- an Mn+
Region A:
gebunden ist. Das Gleichgewicht liegt auf der Seite des Komplexes.
Mn+ ≈ (1 - f ) • c M • VM
Vtot
(1 - f ) • c M • VM
Vtot
Region B:
EDTA4- ≈
f
(1 - f) • Kkond
Aequivalenzpunkt, (1 - f) = 0, f = 1, [Mn+]tot = [EDTA4-]tot,
cM • V M = cL • V L ,
Mn+
Region C:
cL • VL
Vtot
≈
Kkond • EDTA4- ,
VM
Vtot = 0
Kkond • Mn+
,
cM •
Mn+ ≈
cM • VM
Vtot ≈
Kkond
Mn+ tot
Kkond
nach dem Aequivalenzpunkt, (1 -f) < 0, f > 1,
[Mn+]tot < [EDTA4-]tot,
[Mn+] ist sehr klein, da alles Mn+ von EDTA4-, welches im
Überschuss vorliegt, gebunden ist.
VM
Vtot
(1 - f ) • c M • VM ≈ Vtot
Kkond • Mn+ ,
EDTA4- ≈ (f - 1) • c M • VM
Vtot
cM •
Mn+ ≈
1
(f - 1) • Kkond
____________
Beispiel:
Tirationskurve für die Titration von 50 ml 10-2 M Co2+ mit 0.1
M EDTA4-. log K = 16.3
Analytik
7.46
____________
Am Aequivalenzpunkt nimmt [Co2+] sprunghaft um ca. 12 Grössenordnungen ab. [EDTA4-] nimmt entsprechend sprunghaft zu. Der Konzentrationssprung von [Mn+] kann mit einem Metallindikator sichtbar gemacht werden.
Die Grösse des Sprunges wird durch die Grösse der konditionalen Komplexbildungskonstanten und der Konzentration des Metallions bestimmt. Er
ist ca. (log Kkond + log[Mn+] - 2). Um den Sprung gut sichtbar zu machen
sollte er ca. 5 - 6 Grössenordnungen sein. Das heisst log Kkond muss mindesten 7 sein, damit eine komplexometrische Titration durchgeführt werden
kann. Es sei auch auf die Ähnlichkeit der Kurve mit der Titrationskurve einer Säure hingewiesen. Bei einer Säure/Base-Titration fällt beim Aequivalenzpunkt die H+-Konzentration sprunghaft, resp. der pH nimmt zu. Ist die
Säure zu schwach, ist der pH-Sprung beim Aequivalenzpunkt zu klein und
kann nicht gut sichtbar gemacht werden.
Die Konzentrationen der verschiedenen Teilchen in der Lösung während der
Titration können auch durch ein Hägg-Diagramm dargestellt werden. Dabei
Analytik
7.47
werden die Logarithmen von [Mn+], [EDTA4-] und [MEDTAn-4] gegen
pEDTA = -log[EDTA4-] aufgetragen.
Die entsprechenden Gleichungen lauten:
Mn+ =
Mn+ tot
1 + Kkond • EDTA4-
log Mn+ = log Mn+ tot - log 1 + Kkond • EDTA4MEDTAn-4 =
Mn+ tot • Kkond • EDTA41 + Kkond • EDTA4-
log MEDTAn-4 = log Mn+ tot + log Kkond + log EDTA4- - log 1 + Kkond • EDTA4-
Es können die folgenden Vereinfachungen gemacht werden:
Für Kkond • [EDTA4-] >> 1, resp. [EDTA4-] >> Kkond-1:
log Mn+ = log Mn+ tot - logKkond - log EDTA4log MEDTAn-4 = log Mn+ tot
Für Kkond • [EDTA4-] = 1, resp. [EDTA4-] = Kkond-1:
log Mn+ = log MEDTAn-4 = log Mn+ tot - log 2
Für Kkond • [EDTA4-] << 1, resp. [EDTA4-] << Kkond-1:
log Mn+ = log Mn+ tot
log MEDTAn-4 = log Mn+ tot + log Kkond + log EDTA4-
__________
Analytik
Beispiel:
0.1
7.48
Hägg-Diagramm für die Titration von 50 ml 10-2 M Co2+ mit
M EDTA4-.
log Kkond = 16.3
7.12. Metallindikatoren
Als Metallindikatoren verwendet man Liganden, welche mit dem Metallion
schwächere Komplexe bilden als EDTA4-, die stark gefärbt sind und deren
Farbe sich ändert, wenn das Metallion gebunden wird. Die Konzentration
des Indikators in der Lösung ist viel kleiner als [Mn+]. EDTA4- und der Metallindikator konkurenzieren sich, das Metalllion zu binden.
Am Anfang der Titration (f = 0) enthält die Lösung freies Metallion und Metallion, welches vom Indikator komplexiert ist. Während der Titration, 0 < f
< 1, wird zuerst das freie Metallion durch EDTA4- gebunden. Die Lösung
enthält Indikatorkomplex. Erst wenn alle freien Metallionen von EDTA4-
Analytik
7.49
gebunden sind, entreisst EDTA4- auch dem Indikator das Metallion. Der Indikator wird frei gesetzt und die Farbe der Lösung ändert.
Einige wichtige Metallindikatoren sind:
HO
SO3 -
O
OH
NO2
Eriochromschwarz T (ERIO T)
H2
C
N
Na+-OOC
NH
N
O
Na+-OOC
N
HN
N
O
SO3 - Na+
H2
C
O- O
NH4 +
N
H
O
Murexid (MUR)
H2
C
C
H2
H2
C
N
COO-Na+
N
N
C
H2
HO
N
H
N
COO-Na+
OH
O
CH3
CH3
Pyridylazonaphtol (PAN)
Xylenolorange ( XYO)
Die Metallindikatoren sind nicht nur Liganden, sondern auch BrönstedtBasen. Der pH der Lösung beeinflusst daher nicht nur die Komplexbildung
mit EDTA4-, sondern auch die Komplexbildung mit den Indikatoren. In der
folgenden Tabelle sind die pKa-Werte und die Komplexbildungskonstanten
der Indikatoren mit einigen wichtigen Metallionen gegeben.
Tab. 8.2.: pKa und log TKc-Werte einiger Indikatoren:
pKa(1)
pKa(2)
pKa(3)
pKa(4)
pKa(5)
ERIO T
11.6
6.3
1.6
-
MUR
10.5
9.2
-
XYO
12.3
10.5
6.4
3.2
2.6
PAN
12.3
<2.0
-
EDTA410.2
6.2
2.7
2.0
-
Analytik
log K Ca2+
Co2+
Cu2+
Fe3+
Mg2+
Ni2+
Zn2+
7.50
5.4
7.0
13.5
5.0
17.9
11.3
-
5.7
6.2
>12.0
16.0
8.5
12.7
11.2
10.7
16.3
18.8
25.1
8.7
18.6
16.5
Die Farbe der Indikatoren hängt auch vom Protonierungsgrad ab. Eine Änderung des pH's während der Titration kann daher zu einer Farbänderung
führen. Es ist daher notwendig, dass der pH während der Titration konstant
bleibt, d.h. dass die Titrationslösung gepuffert ist.
__________
Beispiel:
Titration von Zn2+ mit EDTA, Indikator ErioT, pH = 9
[Zn2+]tot = 1.10-3 mol/l, [ErioT]tot = 1.10-5 mol/l
logcK(kond, ZnEDTA) = 15.3, logcK(kond, ZnErioT) = 10.9
Im Folgenden sind das Hägg-Diagramm und die Titrationskurve für diese
Titration gegeben. In der Titationskurve kann man den Unterschied zwischen Aequivalenzpunkt, f = 1, und dem Umschlagspunkt nicht erkennen.
Aus dem Hägg-Diagramm geht jedoch deutlich hervor, dass diese beiden
Punkte nicht zusammen fallen.
Analytik
A:
7.51
Aequivalenzpunkt
M: Zn2+
ML: ZnEDTA2L:
EDTA4-
B:
Umschlagspunkt des Indikators
MI:
I:
ZnErioT
ErioT
Die Konzentrationen der Teilchen am Umschlagspunkt können leicht mit
Hilfe des Metallaustausch-Gleichgewichtes abgeschätzt werden:
c Kexch(kond,
pH = 9) =
ZnErioT • EDTA
ZnEDTA2-
10.9
= 10
= 10-4.4
15.3
• ErioT
10
Am Umschlagspunkt ist [ErioT] = [ZnErioT]. Daher ist das Verhältnis
[EDTA] zu [ZnEDTA2-] = 10-4.4. Da [ZnEDTA2-] 1.10-3 mol/L ist, muss
[EDTA] 10-7.4 mol/l sein. Aus dem Komplexbildungs-Gleichgewicht ergibt
sich für [Zn2+] = 10-10.9 mol/l.
Analytik
c K(kond,
7.52
pH = 9, ZnEDTA) =
ZnEDTA2Zn2+
4.4
= 10
= 1015.3, Zn2+ = 10-10.9
2+
• EDTA
Zn
Die Zahl zugegebener Aequivalente EDTA am Umschlagspunkt ist daher:
f=
EDTA tot
Zn2+ tot
=
ZnEDTA2- + EDTA
Zn2+ tot
-3
-7.4
= 10 + 10
= 1.00004
10-3
Es wird daher ein systematischer Fehler von 0.004 % gemacht. Dieser ist in
den meisten Fällen vernachlässigbar.
________
7.13. Modifizierte Komplexometrische Analysenmethoden
I)
Rücktitration:
Zur Probe wird eine bekannte Menge EDTA-Masslösung gegeben, so dass
in der Lösung im Verhältnis zum Analyten ein Überschuss EDTA vorliegt.
Der Überschuss ETDA wird mit einer Metallmasslösung, meistens Zn2+ oder Mg2+ zurücktitriert. Diese Methode wird angewendet:
a) wenn die Geschwindigkeit der EDTA Komplexbildung so langsam
ist, dass eine direkte Titration nicht möglch ist. Die Lösung mit dem Überschuss EDTA kann längere Zeit stehen gelassen werden.
b) wenn das Metallion, welches bestimmt werden sollte, bei dem pH,
welcher bei der Titration eingehalten werden muss, einen Hydroxydniederschlag bildet, der sich während der Titration zu langsam auflöst.
Durch die Komplexierung mit dem Überschuss EDTA wird die Fällung verhindert.
c) wenn für ein Metallion kein geeigneter Indikator zur Verfügung
steht. Bei der Rücktitration wird ein Indikator für Zn2+ oder Mg2+ verwendet.
Diese Methode kann nur angewendet werden, wenn der EDTA-Komplex mit
dem Metallion, welches analysiert wird, stabiler ist, als der Komplex mit
dem Metallion in der Masslösung.
Analytik
7.53
II) Substitutionstitration:
Zur Probe gibt man eine bekannte Menge einer Masslösung MgEDTA2oder ZnEDTA2-. Metallionen in der Lösung, welche stabilere EDTAKomplexe bilden als Mg2+ resp. Zn2+, werden diese Metallionen aus der
Koordinationsspäre des EDTA verdrängen. Darauf wird das freie Mg2+
resp. Zn2+ in der Probe mit einer EDTA-Masslösung titriert. Diese Methode
kann in denselben Fällen angewendet werden, wie die Rücktitation.
III) Maskierung:
Enthält die Probelösung mehrere Metallionen, von denen nur eines bestimmt
werden soll, könne die Metallionen, welche nicht analysiert werden, mit einem Liganden, welcher stabilere Komplexe als EDTA bildet, maskiert werden. Die maskierten Metallionen können, dann nicht mehr von EDTA komplexiert werden. Ein Ligand, welcher zur Maskierung von eher weichen Metallionen verwendet wird, ist CN-. Bei der Maskierung ist zu berücksichtigen, dass die Stabilität der Komplexe mit EDTA und mit dem Maskierungsmittel vom pH verschieden beeinflusst werden.
IV) Rücktitration eines Metallüberschusses:
Diese Methode kann angewendet werden, um die Konzentration von Liganden, welche mit Metallionen starke Komplexe oder einen schwerlöslichen
Niederschlag bilden, komplexometrisch zu bestimmen. Zur Probe gibt man
einen Überschuss eines Metallions, welches mit dem Analyten reagiert.
Nachdem sich das Gleichgewicht eingestellt hat, wird der Überschuss Metallion zurücktitriert. In vielen Fällen ist es nicht einmal nötig, den Niederschlag abzutrennen.
Diese Beispiele zeigen, dass es bei geschicktem Einsatz von Gleichgewichten, welche mit der Bildung des EDTA-Komplex gekoppelten sind, möglich
ist, fast jede Analyse komplexometrisch durchzuführen. In den Laborvorschriften und in der Literatur, findet man noch viele weitere Beispiele.