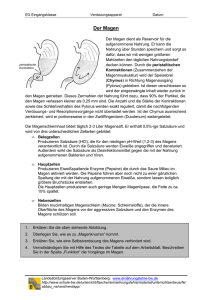
Protokoll ()
Werbung

Hinweis: Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule). Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende: http://online-media.uni-marburg.de/chemie/chids/veranstaltungen/uebungen_experimentalvortrag.html Philipps-Universität Marburg Fachbereich Chemie Sommersemester 2005 Seminar: Übungen im Experimentalvortag Leitung: U. Koert, U. Müller, B. Neumüller, P. Reiß Salzsäure Vorgetragen am 23.06.2005 Vorgelegt von: Thomas Niedenthal Hersfelder Str. 18 36151 Burghaun Inhalt 1. Darstellung von Salzsäure 1.1 Versuch 1: Darstellung von Chlorwasserstoff 1.2 Demonstration 1: Leitfähigkeitsmessung 1.3 Versuch 2: Nachweis der Ionen 4 5 6 2. Eigenschaften von Chlorwasserstoff Versuch 3: „Springbrunnenversuch“ 3. Salzsäure im Alltag 3.1 Demonstration 2: Reinigen einer Münze 3.2 Versuch 4: Säureaktivierte Peptidspaltung im Magen 7 10 11 4. Industrielle Verwendung von Salzsäure 4.1 Demonstration 3: Neutralisation von Spülmaschinenreiniger 13 4.2 Versuch 5: Elektrolyse von Salzsäure und Nachweis der Reaktionsprodukte 14 5. Schulrelevanz 17 6. Literatur 18 2 1. Darstellung von Salzsäure Bei Salzsäure handelt es sich um in Wasser gelöstem Chlorwasserstoff. Um Salzsäure industriell herzustellen, ist es daher notwendig, zuvor Chlorwasserstoff herzustellen. Industriell werden vor allem das ChloridSchwefelsäureverfahren (vgl. Versuch 1) sowie die Synthese aus den Elementen Chlor und Wasserstoff mittels Daniellschem Hahn eingesetzt. Hierbei werden die Gase getrennt in den Verbrennungsraum eingeleitet und dort entzündet. Mechanistisch betrachtet läuft diese Reaktion als radikalischer Kettenmechanismus ab. Kettenstart: Kettenreaktion: Kettenabbruch, z.B.: Cl2 2 Cl• Cl• + H2 HCl + H• H• + Cl2 HCl + Cl• Cl• + H• HCl Weiter entsteht Chlorwasserstoff als Nebenprodukt bei vielen großindustriell eingesetzten Syntheseverfahren, z.B. der Friedel-CraftsAlkylierung. H Cl + HCl AlCl3 Benzol Cumol 3 1.1 Versuch 1: Darstellung von Chlorwasserstoff Chemikalien: Schwefelsäure, konz., R 35, S 26-30-45, C ätzend Natriumchlorid entionisiertes Wasser Geräte: Erlenmeyerkolben 1000 mL mit Zweihalsaufsatz und Absaugstück, Tropftrichter mit Druckausgleich, Becherglas, Stativmaterial Durchführung: Ein Erlenmeyerkolben wird mit so viel Natriumchlorid befüllt, dass der Boden bedeckt ist. Anschließend werden aus dem Tropftrichter etwa 20 mL konzentrierte Schwefelsäure zugetropft. Das entstehende Gas wird durch das Absaugstück in ein mit entionisiertem Wasser gefülltes Becherglas geleitet. Beobachtung: Schon nach Zusatz weniger Tropfen der konzentrierten Schwefelsäure ist eine Gasentwicklung zu erkennen. Ergebnis: Bei dem entstehenden Gas handelt es sich um Chlorwasserstoff. Theoretischer Hintergrund: Der hier durchgeführte Versuch ist ein gängiges Verfahren, um im Labor Chlorwasserstoff darzustellen. Hierbei verdrängt die starke Säure die schwache Säure aus ihrem Salz. In groben Zügen entspricht es dem industriell eingesetzten Chlorid-Schwefelsäureverfahren: Stufe 1: bei 20 °C NaCl(s)+ H3O+(aq) HCl(g) ↑ + Na + (aq) + H2O 4 Stufe 2: bei 800 °C + 2 Na (aq) + - - HSO4 (aq) + Cl (aq) HCl(g) ↑ + 2 Na + (aq) + SO42-(aq) Gesamt: + 2 NaCl(s) + H3O - (aq) + HSO4 (aq) 2 HCl(g) ↑ + 2 Na + (aq) + SO4 2(aq) + H2O In diesem Versuch läuft die Bildung von Chlorwasserstoff nur nach Stufe 1 ab, da auf die Erwärmung (vgl .Stufe 2) verzichtet wurde. Entsorgung: Entstandene Natriumhydrogensulfatlösung kann neutral im Abguss entsorgt werden. 1.2 Demonstration 1: Leitfähigkeitsmessung Chemikalien: Becherglas mit der erhaltenen Lösung aus Versuch 1 entionisiertes Wasser Geräte: Transformator, Kabel, Glühbirne, 2 Graphitelektroden, Becherglas Durchführung: Es wird eine Apparatur zur Messung der Leitfähigkeit wie folgt aufgebaut. Eine Graphitelektrode wird direkt durch ein Kabel mit dem Transformator verbunden. Die andere Elektrode wird mit einer Glühbirne verbunden, welche selbst mit dem Transformator verbunden ist. Zunächst werden beide Elektroden in ein Becherglas mit entionisiertem Wasser gebracht. Die Elektroden dürfen sich hierbei nicht berühren. Nun wird eine Spannung (Gleichstrom) angelegt. Die Durchführung für die Leitfähigkeit der während Versuch 1 entstandenen Lösung erfolgt analog. 5 Beobachtung: Bei der Prüfung der Leitfähigkeit von entionisiertem Wasser leuchtet die Glühbirne nicht. Nach Anlegen einer Spannung an die Lösung aus Versuch 1, leuchtet die Glühbirne. Ergebnis: Entionisiertes Wasser leitet den elektrischen Strom nur schlecht. Die Lösung aus Versuch 1 leitet den Strom besser. Dadurch kann die Glühbirne zum Leuchten gebracht werden, d.h. diese Lösung enthält mehr Ionen als das entionisierte Wasser. Dieses enthält nur auf Grund der Eigendissoziation des Wassers Ionen. Entsorgung: Die Lösung kann neutral im Abguss entsorgt werden, falls diese nicht für Versuch 2 benötigt wird. 1.3 Versuch 2: Nachweis der Ionen Chemikalien: Becherglas mit der erhaltenen Lösung aus Versuch 1 Silbernitratlösung, R 34-50/53, S 26-45-60-61, C ätzend, N umweltgefährdend Universalindikatorpapier Durchführung: a) Man bringt einige Tropfen der verdünnten Salzsäure auf Indikatorpier b) In das Becherglas mit der verdünnten Salzsäure werden einige Tropfen Silbernitratlösung gegeben. Beobachtung: a) Das Indikatorpapier färbt sich rot. b) Im Becherglas ist ein weißer Niederschlag zu erkennen. Ergebnis: a) In der Lösung müssen Hydronium-Ionen vorhanden sein b) In der Lösung müssen Chloridionen vorhanden sein. 6 Entsorgung: Die Lösung wird den Silberabfällen zugeführt. Theoretischer Hintergrund: Wird Chlorwasserstoff in Wasser eingeleitet, so löst sich dieser gemäß + HCl(g) + H2O S1 B2 H3O S2 (aq) + - Cl (aq) B1 In Wasser gelöster Chlorwasserstoff wird als Salzsäure bezeichnet. Werden die entstandenen Hydroniumionen auf Universalindikatorpapier gebracht, so gilt: + HInd + H2O H3O + Ind - Gibt man nun einige Tropfen Silbernitratlösung in die zuvor hergestellte Salzsäure, so werden die vorhandenen Chloridionen als weißes Silberchlorid gefällt. + H3O - (aq) + Cl (aq) + Ag + - (aq) + NO3 (aq) + AgCl(s) ↓ + H3O - (aq) + NO3 (aq) 2. Eigenschaften von Chlorwasserstoff Chlorwasserstoff ist ein farbloses und stechend riechendes Gas. Der Schmelzpunkt von Chlorwasserstoff beträgt –114,22 °C, der Siedepunkt liegt bei – 85,05 °C. Weiter ist Chlorwasserstoff sehr gut in Wasser löslich. Diese gute Löslichkeit lässt sich durch den folgenden Versuch zeigen. Versuch 3: “Springbrunnenversuch” Chemikalien: Natriumchlorid Schwefelsäure, konz. Lösung von Bromkresolgrün in Ethanol, R 11, S 7-16-24/25, F leichtentzündlich Geräte: 7 Gasentwicklerapparatur gemäß Versuch 1,Woulffsche Flasche, Rundkolben 500 mL, Glasrohr mit einseitig ausgezogener Spitze, Stopfen, Winkelrohr, Schlauchstück mit Schlauchklemme, Stativmaterial Durchführung: Ein als Vorlagekolben dienender Rundkolben wird gemäß Versuch 1 mit Chlorwasserstoff gefüllt. Den Vorlagekolben verschließt man mit einem durchbohrten Gummistopfen, durch den der kurze mit einer Spitze versehene Teil eines Glasrohres führt. Der längere Teil dieses Glasrohres führt durch den Stopfen einer Woulffschen Flasche (gefüllt mit Wasser und Bromkresolgrünlösung) bis fast auf den Boden. In der zweiten Öffnung der Flasche befindet sich ein durchbohrter Gummistopfen, in dem ein Winkelrohr steckt. An diesem Winkelrohr befindet sich ein Schlauchstück mit einer Schlauchklemme. Bläst man Luft durch das Schlauchstück drückt man Wasser durch das Glasrohr in den Vorlagekolben. Weiteres Wasser wird hochgesogen Springbrunnen. Beobachtung: Fast das gesamte Wasser aus der Woulffschen Flasche wird durch Unterdruck in den Vorlagekolben gesogen. Der Indikator schlägt von blaugrün nach gelb um. Ergebnis: Salzsäure ist entstanden. Entsorgung: Sämtliche Produkte können neutral im Abguss entsorgt werden. Theoretischer Hintergrund: Für die Darstellung des Chlorwasserstoffes gilt der unter 1.1 beschriebene Sachverhalt. Für den eigentlichen „Springbrunnen“ ist die gute Löslichkeit von Chlorwasserstoff in Wasser maßgeblich. Es lösen sich bei 20 °C etwa 440 L Chlorwasserstoff in 1 L Wasser. Das heißt, sobald die ersten Tropfen Wasser in den Vorlagekolben gelangt sind, löst sich eine beträchtliche Menge an Chlorwasserstoffgas in dem eingebrachten 8 Wasser. Geht man bei der eingebrachten Wassermenge von dem Volumen 1 mL aus, so lösen sich darin 440 mL Chlorwasserstoff, also fast das gesamte Gas im Vorlagekolben. Dadurch entsteht ein Unterdruck im Vorlagekolben, weiteres Wasser wird noch oben in den Vorlagekolben gesogen. Daraus resultiert der „Springbrunnen“. Der Farbumschlag des Indikators zeigt die Bildung von Salzsäure gemäß: HCl(g) + H2O + H3 O - (aq) + Cl (aq) Im neutralen Medium (Wasser) hat der Indikator Bromkresolgrün eine blaugrüne Farbe. Bei einem pH-Wert von 3,8 – 5,4 schlägt die Farbe nach gelb um. Abb. 1: Strukturformeln und Umschlagbereich von Bromkresolgrün 3. Salzsäure im Alltag 9 Die Verwendungsmöglichkeiten von Salzsäure im Alltag sind vielfältig. Beispielhaft möchte ich hier das Ätzen von Metallen (z.B. Namensschild an der Klingel, Muster auf Vasen), Beseitigung von Kesselstein in Heizungskesseln oder das Reinigen von halbedlen Metallen wie z.B. Kupfer anführen (Demonstration 2). Eine Tatsache, die vielen nicht bewusst ist, ist das Vorkommen von Salzsäure im menschlichen Körper. Hier leistet Salzsäure bei der Aktivierung von Enzymen einen wichtigen Betrag zur Verdauung von Peptiden. Die einzelnen Vorgänge lassen sich auch im Reagenzglas nachstellen (Versuch 4). 3.1 Demonstration 2: Reinigen einer Münze Chemikalien: Salzsäure, 2 mol/L Kupfermünze, möglichst mit starken Gebrauchsspuren entionisiertes Wasser Gerät: Petrischale, Pipette Durchführung: Die Kupfermünze wird in die Petrischale gelegt und mittels Pipette ein Tropfen Salzsäure, 2 mol/L aufgebracht. Nach etwa einer Minute wird die Salzsäure mit entionisiertem Wasser abgespült. Beobachtung: An der mit Salzsäure behandelten Stelle erhält die Kupfermünze ihren typischen Kupferglanz zurück. 3.2 Versuch 4: Salzsäureaktivierte Peptidspaltung im Magen 10 Chemikalien: Pepsinogen Magerquark, handelsüblich Salzsäure, 1 mol/L entionisertes Wasser Geräte: Reagenzgläser, Becherglas 600 mL, Heizplatte mit Temperaturfühler Durchführung: In 20 mL entionisiertem Wasser wird 1 g Magerquark gelöst. Weiter werden 2 Spatelspitzen Pepsinogen in 6 mL Wasser gelöst. In 2 Reagenzgläser werden je 2 mL der Quarklösung gegeben, sowie 1 mL der Pepsinogenlösung. In eines der beiden Reagenzgläser gibt man noch zusätzlich 2-3 Tropfen Salzsäure. Beide Reagenzgläser stellt man nun für einige Minuten in ein Wasserbad, welches mittels Heizplatte auf 38 °C eingestellt wurde. Beobachtung: Die Lösung in dem Reagenzglas ohne Salzsäure ist unverändert trüb. Die Lösung, welche mit Salzsäure versetzt wurde, ist nun klar. Ergebnis: Polypeptide werden in wasserlösliche Oligopeptide aufgespalten. Entsorgung: Die Lösungen können neutral im Abguss entsorgt werden. 11 Theoretischer Hintergrund: Der menschliche Körper benötigt zu Verdauung der aufgenommenen Nährstoffe Enzyme. Eiweiße werden durch Proteasen, Kohlenhydrate durch Carbohydrasen und Fette durch Lipasen in kleinere Moleküle aufgespalten. Nur so können die Nährstoffe durch die Darmwände in das Blut diffundieren und im Körper verteilt werden. Bei dem hier eingesetzten Pepsin handelt es sich um eine im Magen produzierte Protease, welche Polypeptide in Oligopeptide spaltet. Als Schutz vor Selbstverdauung produzieren die Verdauungsdrüsen im Magen kein Pepsin, sondern das Proenzym Pepsinogen. Dieses wird von den Hauptzellen der Magendrüsen gebildet. Gelangt nun Nahrung in den Magen, so beginnen die Belegzellen der Magendrüsen mit der Produktion von Salzsäure. Abb. 2 Dieses wandelt das Proenzym Pepsinogen in enzymatisch aktives Pepsin um, welches nun die Polypeptide aufspaltet. Analog ergibt sich die Erklärung für den durchgeführten Versuch. Die Peptide aus dem Quark sind in Wasser nicht löslich und verursachen deshalb eine Trübung. Wird keine Salzsäure zugesetzt, kann kein Pepsinogen in Pepsin umgewandelt werden, die Trübung bleibt. Nur durch Zusatz von Salzsäure kann Pepsin gebildet werden. Dieses spaltet die Peptide auf, die Lösung wird klar. 4. Industrielle Verwendung Nachdem ich zuvor auf Vorkommen und Verwendung von Salzsäure im Alltag eingegangen bin, möchte ich hier auf die industrielle Verwendung von Salzsäure eingehen. Bedingt durch die Verwendung von alkalischen Reinigungsmitteln in Industrie und Haushalt ist es nicht verwunderlich, dass auch das entstehende Abwasser einen pH-Wert hat, der im alkalischen Bereich liegt. Hier werden in Kläranlagen große Mengen Salzsäure benötigt um das gereinigte Abwasser pH-neutral Gewässern zuleiten zu können (vgl. Demonstration 3). 12 Wie bereits zu Beginn angesprochen, entstehen Salzsäure und Chlorwasserstoff in großen Mengen als Nebenprodukt bei industriellen Prozessen – meist in so großen Mengen, dass diese nicht komplett verbraucht werden können. Deshalb wurde es nötig, diesen Überschuss zu entsorgen. Eine gängige Methode ist die Elektrolyse von Salzsäure. Die entstehenden Reaktionsprodukte Wasserstoff und Chlor sind hochrein und als wichtige Rohstoffe bei vielen Prozessen in der Industrie verwendbar (vgl. Versuch 5). 4.1 Demonstration 3: Neutralisation von Spülmaschinenreiniger Salzsäure als Neutralisationsmittel zur Abwasserbehandlung Chemikalien: Salzsäure, 2 mol/L ethanolische Phenolphthaleinlösung, R 11, S 7-16-24/25, F leichtentzündlich Spülmaschinentab, handelsüblich Geräte: Bürette, Becherglas 1000 mL, Magnetrührer mit Rührfisch Durchführung: In einem Becherglas wird ein Spülmaschinentab in etwa 700 mL Wasser unter Rühren gelöst. Anschließend wird ethanolische Phenolphthaleinlösung zugesetzt. Nun wird mit Salzsäure bis zum Farbumschlag des Indikators titriert. Beobachtung: Nach etwa 40 mL zugesetzter Salzsäure ist ein Farbumschlag des Indikators von violett nach farblos zu erkennen. Entsorgung: Alle Lösungen können neutral im Abguss entsorgt werden. 4.2 Versuch 5: Elektrolyse von Salzsäure und Nachweis der Reaktionsprodukte 13 Chemikalien: Salzsäure, konz., R 34-37, S 26-45, C ätzend Kaliumiod-Stärke-Lösung Natriumthiosulfat Geräte: Hoffmanscher Wasserzersetzungsapparat, Trafo, Demonstrativvielfachinstrument, Kabel, Platinelektrode, Graphitelektrode, Reagenzglas, Bunsenbrenner, Becherglas, PVCSchlauch mit Einleitungsrohr, Bunsenbrenner Durchführung: Ein Hoffmanscher Wasserzersetzungsapparat wird mit konzentrierter Salzsäure befüllt. Als Anode dient eine Graphitelektrode, als Kathode eine Platinelektrode. Nun wird eine Spannung angelegt (Gleichstrom). Die Spannung wird so lange erhöht, bis an beiden Elektroden eine Gasentwicklung zu erkennen ist. Die Spannung bleibt nun so lange angelegt, bis sich in den beiden Schenkeln des Apparates ausreichend Gas (etwa 15-20 mL) gebildet hat. Dann ist die Elektrolyse zu beenden. Das entstandene Gas im Schenkel über der Kathode wird nun in ein Reagenzglas geleitet (Öffnung des Reagenzglases nach unten). Anschließend wird das Reagenzglas mit der Öffnung in die Flamme eines Bunsenbrenners gebracht. Das Gas im Schenkel über der Anode wird in eine Kaliumiodid-StärkeLösung eingeleitet. Sicherheitshinweis: Da bei diesem Versuch eine nicht unbeträchtliche Menge an Chlorgas dargestellt wird, ist aus Gründen der Sicherheit eine ausreichende Menge an gesättigter Natriumthiosulfatlösung bereitzuhalten. Beobachtung: Wird das Reagenzglas, welches mit dem über der Kathode entstandene Gas befüllt wurde in die Bunsenbrennerflamme gebracht, so ist ein leiser Knall zu hören. Wird das andere Gas in die Kaliumiodid-Stärke-Lösung eingeleitet, so verfärbt sich diese blau-schwarz. Ergebnis: An der Kathode ist Wasserstoff entstanden, an der Anode Chlor. 14 Entsorgung: Verbliebenen Wasserstoff kann man im Abzug entweichen lassen. Verbliebenes Chlorgas wird in eine Natriumthiosulfatlösung eingeleitet, welche im Abguss entsorgt werden kann. Die restliche Salzsäure wird mit festem Natriumthiosulfat versetzt, neutralisiert und kann anschließend im Abguss entsorgt werden. Theoretischer Hintergrund: Bei der Elektrolyse laufen zwei Reaktionen ab, die Kathodenreaktion und die Anodenreaktion. Sie lassen sich folgendermaßen darstellen: Anode: - - 2 Cl (aq) + Kathode: 2 H3O - (aq) Cl2(g) + 2 e +2e - H2(g) + 2 H2O + Gesamt: 2 Cl (aq) + 2 H3O (aq) Cl2(g) + H2(g) + 2 H2O Nachweis der Reaktionsprodukte: Der Wasserstoffnachweis erfolgt als „Knallgasreaktion“. Bei der Reaktion handelt es sich um einen radikalischen Kettenmechnismus. Kettenstart: Kettenreaktion: H2 2 H• + O2 H2O2 •OH + H2 Kettenabbruch, z.B.: •OH + H• 2 H• H2O2 2 •OH H2O + H• H 2O Der Chlornachweis wird indirekt durch eine Iod-Stärke-Reaktion geführt. In die Lösung eingeleitetes Chlor wird durch vorhandene Iodidionen zu Chlorid reduziert, während Iodidionen zu Iod oxidiert werden. Die helixartig aufgewundene Stärke bildet mit dem entstandenen Iod eine blaue Einschlussverbindung, deren Aufbau und Zusammensetzung weitgehend durch räumliche Anordnung und nicht durch Bindungsverhältnisse bestimmt wird. Das Iod wird in Form von Polyiodidketten eingelagert, welche durch Bindungen miteinander verknüpft sind. Dadurch wird die Elektronendelokalisierung entlang der 15 Kette erleichtert. Hieraus lässt sich (Absorptionsmaximum 620 nm) erklären. die blau-schwarze Farbe Iod-Stärke-Komplex I2(aq) + I (aq) I3 (aq) Abb. 3 16 5. Schulrelevanz Die Themen Chlorwasserstoff und Salzsäure sind eine sehr gute Möglichkeit in den Themenkomplex der Säuren einzusteigen, insbesondere weil Salzsäure die einfachste einprotonige Säure ist. Ihre Herstellung ist im Schulalltag – im Vergleich zu Schwefelsäure oder Salpetersäure – einfach durchzuführen. Weiter ist es möglich den kompletten Vortrag als Unterrichtsreihe einzusetzen. Man beginnt – wie im Vortrag – mit der Darstellung. Hat man das Produkt dargestellt, untersucht und erarbeitet man die chemischen und physikalischen Eigenschaften. Hieran schließen sich dann Verwendung in Alltag und Industrie an, um auch den notwendigen Alltagsbezug herzustellen. Fächerübergreifend kann im Fach Biologie die durch Salzsäure aktivierte Wirkung von Enzymen bei der Verdauung behandelt werden. Im Detail schreibt das hessische Kultusministerium im „Lehrplan Chemie, Gymnasialer Bildungsgang“ unter 9.2 und 10.3 folgende Themen verbindlich vor: - Herstellung von Chlorwasserstoff bzw. Salzsäure - Eigenschaften und Verwendung von Salzsäure - Erarbeitung der Protolysereaktion am Beispiel von Chlorwasserstoff mit Wasser 17 6. Literatur Bücher: E. Gerstner, „Versuche zur Chemie der Nichtmetalle auf der Basis von „E. Fluck/C. Mahr, „Anorganisches Grundpraktikum“, VHC Verlagsgesellschaft mbH, Weinheim 1985“, Marburg 1987 Charles E. Mortimer, „Chemie – Das Basiswissen der Chemie“, Georg Thieme Verlag, Stuttgart 2001 Riedel, „Anorganische Chemie“, Walter de Gruyter, Berlin 1999 Stapf/Hradetzky „Chemische Schulversuche Teil 3: Organische Chemie“, Verlag Harri Deutsch, Frankfurt am Main 1975 Schuphan Knappe, „Chemie Buch“, Verlag Moritz Diesterweg GmbH & Co., Frankfurt am Main 1986 Horst Bayrhuber, Ulrich Kull (Hg), Linder Biologie, 20. Aufl., Stuttgart 1989 Neil A. Campbell, deutsche Übersetzung hrsg. von Jürgen Markl, Biologie, Berlin 1997 E. Bauer, „Humanbiologie“, Cornelsen-Velhagen & Klausing GmbH & Co., Berlin 1974, hieraus Abb. 2 entnommen Vorlesungen, Seminare: Prof. Dr. U. Koert, „Organische Chemie für Studierende der Chemie, des Lehramts, der Naturwissenschaften und der Pharmazie“, WS 2003/04 Dr. J. Knecht, „Chemische Technologie“, anorganischer Teil, SS 2005 Internet: www.uni-oldenburg.de http://www.uni-bayreuth.de/departments/didaktikchemie Abb. 1 und 3 entnommen von http://www.unipaderborn.de/lehrveranstaltungen 18