Reaktionen organischer Verbindungen - Stromberg
Werbung

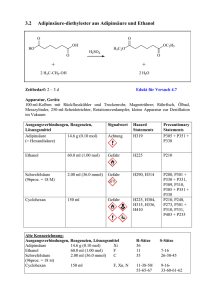
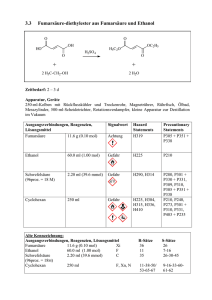
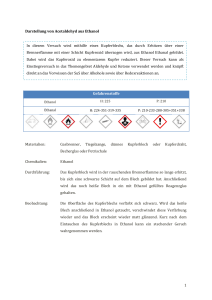
Chemie-Praktikum Versuch 13.1 Protokoll: Datum: Mitarbeiter: Reaktionen organischer Verbindungen 1.) Leitfähigkeitsuntersuchnungen Geräte: Apparatur zur Leitfähigkeitsprüfung mit Zubehör, weites Reagenzglas, Stativmaterial, Waschflaschen, Handgebläse, Trockenrohr mit CaCl2, Uhrglas Chemikalien: Absolutes Ethanol (Sparsam damit umgehen, es sollten sich mehrere Gruppen bei diesem Versuch zusammentun!), konzentrierte Lösung von NH3, konzentrierte Salzsäure, Natrium Aufgabe: Vergleiche bei einer Spannung von 20 V die Stromstärke in folgenden Proben: a) Absolutes Ethanol b) Lösung von Chlorwasserstoff in Ethanol c) Lösung von Ammoniak in Ethanol d) Lösung von Natriumethanolat Durchführung: Zunächst wird das für Versuch d) benötigte Natriumethanolat hergestellt. Ein kleines Stückchen Natrium wird abgeschnitten und auf ein Uhrglas gelegt. Jetzt wird auf das Uhrglas absolutes Ethanol gegeben. Beobachtung? Das Uhrglas wird jetzt in den Abzug (Einschalten!) gestellt und das Ende der Reaktion sowie das Verdunsten von überschüssigem Ethanol abgewartet. Nun kann mit den eigentlichen Aufgaben begonnen werden. Zunächst wird auf die übliche Weise die Leitfähigkeit von absolutem Ethanol bestimmt. (Weites Reagenzglas verwenden!) Um bei den Versuchen b) und c) die benötigten Gase einzuleiten, wird die folgende Apparatur aufgebaut: NH3 + bzw. HCl Leitfähigkeitsprüfer Gebläse (Einleitung von Luft) Trockenrohr (CaCl2) Konzentrierte Salzsäure bzw. NH3-Lösung Ethanol Wie ändert sich die Stromstärke (und damit die Leitfähigkeit) wenn HCl- bzw. NH3-Gas eingeleitet wird ? Inzwischen hat sich auf dem Uhrglas festes Natriumethanolat abgeschieden. Es wird mit einem sauberen Spatel abgekratzt und zu destilliertem Wasser gegeben. Stelle nun die Stromstärke fest. Auswertung: a) Welche Reaktion läuft bei der Herstellung von Natriumethanolat ab ? Reaktionsgleichung, Reaktionstyp. b) Worauf beruht bei den vier gemessenen Proben jeweils die elektrische Leitfähigkeit ? Wie sind jeweils die Unterschiede gegenüber der elektrischen Leitfähigkeit von absolutem Ethanol zu erklären ? Gib, falls sinnvoll, Reaktionsgleichungen dazu an. 2.) Synthese von Bromethan Chemikalien: Ethanol, KBr, Kochsalz, Eis, H2SO4 konz. Geräte: Siehe Skizze Bromethan Reaktionsgemisch Kältemischung (Eis, Kochsalz, Wasser) Vorsicht! Schutzbrille! Baue die Apparatur zusammen und erwärme das Reaktionsgemisch vorsichtig! Der Versuch muß sofort abgebrochen werden, wenn das Reaktionsgemisch sich schwarz zu färben beginnt. Vorsicht! Als Nebenreaktion tritt hier Etherbildung auf ! Bromethan ist eine ölige Flüssigkeit! Auswertung: a) Erläutere den Reaktionsablauf und formuliere den Reaktionsmechanismus. b) Warum hat Bromethan einen beträchtlich niedrigeren Siedepunkt als Ethanol ? 3.) Synthese von 2 Chlor-2 Methylpropan („Tertiäres Butylchlorid“) Durchführung: In einem Scheidetrichter werden gemischt: 30 ml 2 Methylpropanol(2) („Tertiäres Butanol“), 2 Spatellöffel ZnCl2 und 40 ml konz. Salzsäure. Nach vorsichtigem Umschütteln (Vorsicht: Eventuell Gasentwicklung !) bilden sich 2 Phasen. Wie kann man die organische Phase erkennen ? Die organische Phase wird abgetrennt und mit der Beilstein-Probe geprüft. (Im Abzug) Auswertung: a) Erläutere den Reaktionsablauf und formuliere den Reaktionsmechanismus. b) Was passiert bei der Beilstein-Probe ? 4.) Oxidation von Ethanol: Mit einer Wasserstrahlpumpe wird Ethanoldampf über ein polizeiübliches Alkoholteströhrchen geleitet. Beobachtung ? Auswertung: Formuliere die Reaktionsgleichung. Zu welcher Stoffklasse gehört das organische Reaktionsprodukt ? Wie heißt es ?