Husten_2
Werbung

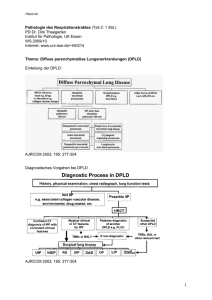
Weiterführende Diagnostik Diagnostik Röntgen-Thorax Lungenfunktion Sputum Fragestellung Neoplasma Infiltrat Bronchiektasen Atemwegsobstruktion Respiratorische Insuffizienz Bronchiale Hyperreaktivität Bakteriologie Indikationen persistierender Husten Bronchospastik Dyspnoe persistierender Husten putrider Auswurf bei gefährdeten Patienten Therapie des Lungenemphysems • Irreversibles Krankheitsbild, deshalb lediglich operative Verfahren zur Behandlung der krankheitsbedingten morphologischen Veränderungen: – Bullektomie (Dyspnoe, rez. Bullainfekt., rez. Pneumothorax, Perforation, Hämoptysen) – Lungenvolumenreduktion – Lungentransplantation • Präventive Maßnahmen: – Elemination der Inhalationsnoxe – a1-Antitrypsinsubstitution Interstitielle Lungenerkrankungen Klassifikation I Interstitielle Lungenerkrankungen Klassifikation II Interstitielle Lungenerkrankungen Klassifikation III Interstitielle Lungenerkrankungen Diagnostik Befund (Verdachts)Diagnose Interstitielle Lungenerkrankungen Lungenfunktion Interstitielle Lungenerkrankungen CT-Diagnostik Erkrankung HRCT-Befund Ideopathische Lungenfibrose • Majorkriterien – Ausschluß einer bekannten Ursache für interstitielle Lungenerkrankungen wie Medikamente, berufliche Noxen, Kollagenosen – Pathologische Lungenfunktion mit Restriktion und Gasaustauschstörung – Charakteristische chronische (>6 Monate), bilaterale, basale HRCTVeränderungen – Transbronchiale Biopsien und BAL ohne Hinweise auf andere Diagnose • Minorkriterien – Alter > 50 Jahre – Schleichende Entwicklung einer Belastungsdyspnoe – Dauer der Erkrankung 3 Monate – Bilaterales basales Knisterrasseln Sekundäre Lungenfibrose • • • • Strahlenpneumonitis Chronische Polyarthritis Progressive systemische Sklerodermie Pulmonale Vaskulitiden – Wegener-Granulomatose – Churg-Strauss-Syndrom – Mikroskopische Polyangiitis – Goodpasture-Syndrom • BOOP-Syndrom (Bronchiolitis obliterans mit organisierender Pneumonie) • Alveolarproteinose • Histeozytosis X Interstitielle Lungenerkrankungen Therapie Sarkoidose • Interstitielle Lungenerkrankung unbekannter Ätiologie • Häufigkeit – Inzidenz 12 / 100.000 – Prävalenz 44 / 100.000 • Lungen und Lymphknoten sind am häufigsten, aber alle Organe können betroffen sein • Symptome häufig unspezifisch • Meist schleichende Entwicklung • Verläufe akut, subakut und chronisch • Histologisch nichtverkäsende epitheloidzellige Granulome Sarkoidose: Differentialdiagnosen • • • • • • • • • Tuberkulose Aspergillose Exogen-allergische Alveolitis Interstitielle Lungenerkrankungen unbekannter Ätiologie Lymphatische Systemerkrankungen Bronchialkarzinom Arzneimitteltoxische Alveolitiden Pneumokoniosen Berylliose Sarkoidose: Einteilung • • • • • Einteilung Radiologische Charakteristika Typ 0 Typ I Typ II Typ III Typ IV Normalbefund (extrapulmonale Sarkoidose) Bihiläre Lymphadenopathie Bihiläre Lymphadenopathie mit Lungenbefall Lungenbefall ohne Lymphadenopathie Fibrose Sarkoidose: Symptome Akute Sarkoidose („Löfgren-Syndrom“) • Symptomreiches und mitunter schweres Krankheitsbild – Erythema nodosum – Fieber – allg. Entzündungszeichen – Schwellung der großen Gelenke – Uveitis – geschwollene periphere Lymphknoten – hohe Neigung zur Spontanremission Chronische Sarkoidose • Häufig radiologischer Zufallsbefund • unspezifische Allgemeinsymptome • Oft deutliche Diskrepanz zwischen ausgeprägten radiologischen Veränderungen und blander Klinik • Neigung zur Spontanremission geringer als bei der akuten Form Sarkoidose: Diagnostik • Histologie (Bronchoskopie, offene Lungenbiopsie): – typischer Befund der nichtverkäsenden epitheloidzelligen Granulome – Nachweis auch unabhängig vom röntgenologischen Stadium • BAL: – Erhöhung der Ratio CD4 : CD8 -Zellen (95%) – Bei Zunahme der Neutrophilen Gefahr der Progredienz (Aktivität) • Lungenfunktion: – Restriktive Ventilationsstörung, z.T. auch milde Obstruktion – Gasaustauschstörung (CO-Transfer, Oxyergometrie) Sarkoidose: Therapieindikation • • • • • • • • Schwere Allgemeinsymptome MyokardNierenZNS-Beteiligung Hypercalzurie Hypercalzämie Ikterus rascher Progress • Eine dokumentiere, aber symtomfreie Sarkoidose hat eine gute Prognose und stellt in der Regel keine Therapieindikation dar. Sarkoidose: Verlaufskontrolle • Klinische Symptomatik • Röntgen-Thorax und Lungenfunktion im längeren Verlauf (3,6 Monate) • Serologie: – (soluble) Interleukin-2-Rezeptor (sIL-2R) – Neopterin (Stoffwechselprodukt aktivierter Makrophagen und Monozyten) – Angiotensin-Converting-Enzyme (ACE) (Epitheloidzellen der Granulome) Keine primär diagnostische Bedeutung, sondern nur Verlaufsparameter Sarkoidose: Therapie • Meist symptomatische Analgetikatherapie gerechtfertigt • Kortikosteroide: – Startdosis 0,6 - 0,8 mg/kgKG/d für 4-8 Wochen – schrittweise Dosisreduktion mit Behandlungsdauer von 6 bis 12 Monaten • Steroidresistenz ca. 10 - 20% – Kombinationsversuche mit Cyclosporin A, Azathioprin, Cyclophosphamid Pneumonie Prädisponierende Faktoren (ambulant erworbene P.) • • • • • • • • • • Höheres Lebensalter (> 65 J.) Nikotinabusus Chronische Bronchitis Herzinsuffizienz Chronische (terminale) Nierenerkrankungen Chronische Lebererkrankungen Diabetes mellitus Immunsuppression Fehl- und Mangelernährung Alkoholismus Pneumonie Erreger (ambulant erworbene P.) • Bakterielle Erreger – Streptococcus pneumoniae 30% – Chlamydia spp. - 15% – Mycoplasma pneumoniae 10% – Hämophilus influenzae - 15% – Moxarella catarrhalis 2% – Staphylococcus aureus - 10% – Legionella spp. - 5% • Virale Erreger – Adenoviren, Influenzavirus A und B, Parainfluenzavirus, Enteroviren, Respiratory Syncytial Virus, Echo-Viren, Coxsackievirus Nosokomiale Pneumonie • Pneumonien werden als nosokomial klassifiziert, wenn sie später als 48 h nach einer stationären Aufnahme auftreten und nicht auf eine vor dem stationären Aufenthalt erfolgte Infektion zurückzuführen sind. • zweithäufigste im Krankenhaus erworbene Infektion • häufigste Infektion auf der Intensivstation • Inzidenz ca. 5-10 von 1000 stationär behandelten Patienten • altersabhängig: – Pat. < 35 Jahre 5/1000 stationär behandelten Patienten – Pat. > 65 Jahre 15/1000 Nosokomiale Pneumonie • Inzidenz steigt mit der Dauer des stationären Aufenthaltes und ist am höchsten bei maschinell beatmeten Patienten • Inzidenz auf der Intensivstation 1/1000 Patiententage • bei beatmeten Patienten 5-35/1000 Beatmungstage (entsprechend 1-3% pro Beatmungstag) • ca. 10-30% der beatmeten Patienten entwickeln eine nosokomiale Beatmungspneumonie • Risiko erhöht bei – allgemein schwerer Grunderkrankung – Bewußtseinstrübungen – kardiopulmonalen Grunderkrankungen – postoperative Patienten nach thorako-abdominalen Eingriffen • Letalität unter Beatmung beträgt 30-50% Nosokomiale Pneumonie • früh einsetzende (»early onset«) Pneumonie – ambulant erworbene Keime und leicht therapierbare Gram-negative Erreger • Streptococcus pneumoniae • Staphylococcus aureus • Haemophilus influenzae • Escherichia coli • »KES-(Klebsiella/Enterobacter/Serratia)«Gruppe • Proteus spp. • spät einsetzenden (»late onset«) Pneumonie. – meist komplizierte, ggf. auch multiresistente Erreger (resistente Staphylococcus aureus-Stämme (MRSA), Pseudomonas spp., Stenotrophomonas spp., Burkholderia spp., Acinetobacter spp.) Pneumonie: Diagnostik • Umfang und Invasivität der Diagnostik orientiert sich am Schweregrad der Erkrankung • Leichtere amb. erworbene Pneumonien ambulant empirisch behandeln (ohne aufwendige Diagnostik, lediglich Rö-Thorax!) • Schwerere Erkrankungsbilder / Risikofaktoren: Erregerdiagnostik, Laborchemie, BGA • Bei Behandlungsresistenz oder Immunsuppression: Bronchoskopie mit BAL • Ggf. Legionellenantigen im Urin • Ggf. Zusatzuntersuchungen (CT-Thorax, Sonographie) Pneumonie: Therapie • Risikostratifizierung: – Leichte ambulant erworbene Pneumonie ohne Störungen der Vitalfunktionen bei jüngeren Patienten ohne Komorbidität – ambulant erworbene Pneumonie bei Patienten mit Risikofaktoren – schwerer Verlauf einer ambulant erworbenen Pneumonie mit Störungen der Vitalfunktionen Pneumonie: Therapie Amb. Erworbene Pneumonie: Therapie Aus: Schölmerich 2003 Nosokomiale Pneumonie: Therapie Aus: Schölmerich 2003 Aspirationspneumonie • Ergebnis eines Eintritts von exogenen oder endogenen Substanzen in die unteren Atemwege – Beeinträchtigung der Schutzreflexe (insb. Hustenreflex, Glottisschluß) – Aspiration von Material mit toxischen Eigenschaften oder erregerhaltiges Material • Chemische Pneumonitis • Aspiration mit bakterieller Infektion • Aspiration mit Atemwegsobstruktion Aspirationspneumonie Aspirationspneumonie: Therapie • Unverzügliche Absaugung / Bronchoskopie – Entfernung von Fremdmaterial – Erregerasservation • Antibiotikatherapie – wahrscheinliches Erregerspektrum – gute pulmonale Gewebekonzentration – ggf. intravenöse/orale Sequenztherapie Bronchialcarzinom Epidemiologie • Inzidenz: Männer 90,3 /100.000, Frauen 19,9 /100.000 (1993) • Mortalität: 37147 Menschen, davon 77% Männer, 23% Frauen (1995) • Ursachen des BC: - Inhalatives Zigarettenrauchen 85% (20% aller Raucher erkranken) - Berufsbedingte Karzinogene 8% - Luftverschmutzung 5% - Andere Faktoren 2% • Gesamtausgaben für Tabak 1995 36,1 Mrd. DM (davon Steuern 20,7 Mrd. DM) • Sozialmedizinische Gesamtkosten nur durch BC allein ca. 4,5 Mrd. DM (Zahlen gelten nur für Deutschland) Bronchialcarzinom Ursachen Sonstige 2% Luftverschmutzung 5% Pulmotrope Karzinogene 8% Tabakrauch 85% Mukoziliare Clearence • • • • Reinigungsmechanismus Flimmerepithelien und Drüsenzellen ab Bronchiolen keine schleimproduzierenden Zellen mehr bei unzureichender Feuchtigkeit oder tox. Einwirkung Reduktion der Flimmerepithelien Bronchialcarzinom Diagnostischer Stufenplan • Obligatorische Basisdiagnostik zur Sicherung der histologischen Diagnose und zur Erfassung der kurativ therapierbaren Patienten • Ergänzende Diagnostik zur Stadieneinteilung • Diagnostik spezieller oder grenzwertiger Befunde • Operabilitätsdiagnostik Diagnostik • • • • • • • Anamnese und klinische Untersuchung Röntgen-Thorax Computertomographie Lungenfunktionsprüfung Bronchoskopie ggf. Thorakoskopie ggf. offene Lungenbiopsie Methoden der bronchoskopischen Probeentnahme • • • • • • Sekretabsaugung Broncho - Alveoläre - Lavage (BAL) Katheterabsaugung Bürstenabstrich Nadel-Saugbiopsie Zangenbiopsie (endo- / transbronchial) Bronchialcarzinom Endobronchiale Kleinraumbestrahlung Indikationen • Inoperable, kleinvolumige Tracheobronchialmalignome, zentral gelegen • Konsolidierungsbehandlung nach Laser- / Stenttherapie • Transkutan vorbestrahlte, sekundär zentral stenosierend wachsende Tumoren • Kombinierte Anwendung mit perkutaner Bestrahlung bei zentralen Tumoren 5 cm • Lokale Vollremission 0 - 20%, Teilremission 40 - 60%, kein Ansprechen 20 - 40% Bronchialcarzinom Endobronchiale Stentimplantation Indikationen • Zentrale extraluminale Atemwegsstenosen, bedingt durch • • • • komprimierend oder infiltrierend wachsende Karzinome Tracheomalazie Dynamischer, atemabhängiger Kollaps zentraler Atemwege Tracheobronchiale Strikturen Vorbereitung der Afterloading-Therapie • Wiedereröffnungsrate 80 - 90%, Wiedereröffnungsdauer 2 10 Monate Bronchialcarzinom TNM-Klassifikation des Bronchialkarzinoms (UlCC, 1997) T = Ausdehnung des Primärtumors Tx Primärtumor kann nicht sicher beurteilt werden, oder Nachweis von malignen Zellen im Sputum oder bei Bronchialspülungen, jedoch Tumor weder radiologisch noch bronchoskopisch sichtbar T0 kein Anhalt für Primärtumor Tis Carcinoma in situ T1 Tumor < 3 cm oder weniger in größter Ausdehnung, umgeben von Lungengewebe oder viszeraler Pleura, kein bronchoskopischer Nachweis einer Infiltration proximal eines Lappenbronchus (Hauptbronchus frei) T2 Tumor mit wenigstens einem der folgenden Kennzeichen hinsichtlich Größe oder Ausbreitung: - > 3 cm in größter Ausdehnung - Hauptbronchus befallen (> 2 cm distal der Carina) - Infiltration der viszeralen Pleura - assoziierte Atelektase oder obstruktive Entzündung bis zum Hilus, jedoch nicht der ganzen Lunge T3 - Tumor jeder Größe mit direkter Infiltration einer der folgenden Strukturen: Brustwand (einschließlich der Sulcus-superior-Tumoren); Zwerchfell, mediastinale Pleura, parietales Perikard - oder : Tumor im Hauptbronchus 2 cm distal der Carina, jedoch Carina selbst nicht befallen - oder : Tumor mit Atelektase oder obstruktiver Entzündung der ganzen Lunge T4 - Tumor jeder Größe mit Infiltration wenigstens einer der folgenden Strukturen: Mediastinum, Herz, große Gefäße, Trachea, Ösophagus, Wirbelkörper, Carina - oder : vom Primärtumor getrennte Tumorherde im gleichen Lappen - oder : Tumor mit malignem Pleuraerguß Bronchialcarzinom TNM-Klassifikation des Bronchialkarzinoms (UlCC, 1997) N = Befall der regionären Lymphknoten Nx regionäre Lymphknoten können nicht beurteilt werden N0 keine regionären Lymphknotenmetastasen N1 Metastase(n) in ipsilateralen peribronchialen und/oder ipsilateralen Hiluslymphknoten (einschließlich eines Befalls durch direkte Ausbreitung des Primärtumors in intrapulmonale Lymphknoten) N2 Metastasen in ipsilateralen mediastinalen und/oder subkarinalen Lymphknoten N3 Metastasen in kontralateralen mediastinalen, kontralateralen Hilus-, ipsi- oder kontralateralen Skalenus- oder supraklavikulären Lymphknoten M = Fernmetastasen Mx Fernmetastasen können nicht beurteilt werden M0 Keine Fernmetastasen M1 Fernmetastasen, einschließlich vom Primärtumor getrennte Tumorherde in einem anderen Lungenlappen (ipsi- oder kontralateral) Bronchialcarzinom Stadieneinteilung (UICC 1997) Okkultes Karzinom Stadium 0 Stadium IA Stadium IB Stadium IIA Stadium IIB Stadium IIIA Stadium IIIB Stadium IV Tx Tis T1 T2 T1 T2 T3 T3 T1 oder T2 T3 Jedes T T4 Jedes T N0 N0 N0 N0 N1 N1 N0 N1 N2 N2 N3 Jedes N Jedes N M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M1 Bronchialcarzinom Stadieneinteilung (Kleinzelliges BC) Very limited Disease (Stadium I): T1 oder T2 ohne ipsilaterale hiläre Lymphknotenmetastasen Limited Disease (Stadium I - III): Befall eines Hemithorax mit oder ohne • ipsilaterale hiläre Lymphknotenmetastasen • ipsi- oder kontralaterale mediastinale Lymphknotenmetastasen • Skalenus- oder supraclavikuläre Lymphknotenmetastasen • Pleuraerguß (auch bei positiver Zytologie) Extensive Disease (Stadium IV): Alle Patienten, die nicht limited Disease sind ED1: Lokal fortgeschritten, aber auf den Thorax beschränkt ED2: Mit Fernmetastasen einhergehender Tumor Bronchialcarzinom Indikationen zur kurativen Resektion Nicht-kleinzelliges Bronchialcarzinom: • Stadien I und II: Operation Therapie der Wahl • Stadium IIIa: 1) Primäre Operation mit mögl. radikaler Lymphadenektomie und Nachbestrahlung 2) Neoadjuvante Chemotherapie, bei Remission sek. Resektion und Radiatio Kleinzelliges Bronchialcarzinom: • Stadium I und II (optional) bei mediastinoskopisch ausgeschlossenem Lymphknotenbefall, anschließend übliche Chemotherapie Bronchialcarzinom Indikationen zur palliativen Operation • Tumorzerfall mit zentraler Nekrose und Aspirationsgefahr • Tumorblutung • Extrem große Tumoren mit Verdrängungserscheinungen oder Kompression von Trachea, Herz oder Ösophagus • Tumorbedingte Atelektase mit Retentionspneumonie oder Abzedierung • Schmerzen infolge Thoraxwandinfiltration • Palliative Operation durch interventionelle Bronchoskopie (Laser, Stent, Afterloading) zunehmend häufiger ersetzt Bronchialcarzinom Kriterien der Inoperabilität (kurativer Ansatz) • Gesicherte Fernmetastasen • Gesicherte Pleurametastasen • Gesicherter Tumorbefall der Hauptcarina (Entfernung weniger als 2 cm) • Ipsilaterale supraclaviculäre, kontralaterale hiläre oder mediastinale Lymphknotenmetastasen • Tumorbedingte Recurrensparese • Tumorbedingte Phrenicusparese Bronchialcarzinom Technische Inoperabilität Infiltationen • • • • des Ösophagus der Wirbelsäule des Herzens der Trachea Bronchialcarzinom Strahlentherapie (kleinzelliges BC) T1/2 N0 M0 Lobektomie (selektionierte Fälle) postop. lokoregionäre Radiotherapie nach Chemotherapie (50Gy) T1-4 N0-3 M0 Chemotherapie M1 Chemotherapie postchemotherapeutische lokoregionäre Radiotherapie (50 Gy), PCI (30 Gy) selektionierte Lokalisation (30Gy), optional half body irradiation (6Gy) Salazar et al. (1993) Bronchialcarzinom Strahlentherapie (nicht-kleinzelliges BC) Stadium I T1/2 N0 M0 radikale Operation keine Radiotherapie Stadium II T1/2 N1 M0 radikale Operation optional postop. Radiotherapie (50 Gy) Stadium IIIA T1/2 N2 M0 T3 N0-2 M0 Stadium IIIB jedes T M3 N0 T4 jedes N M0 Stadium IV jedes T, jedes N, M1 radikale Operation nur ausnahms weise OP postop. Radiotherapie (50-60 Gy) Radiotherapie (60 Gy) palliative Radiotherapie Salazar et al. (1993) Bronchialcarzinom Strahlentherapie (nicht-kleinzelliges BC) 5-Jahres-Überlebenswahrscheinlichkeit T1 M0 N0 T1/2 N0 M0 T1/2 N1 M0 T1-3 N0/1 M0 T3 N0/1 M0 42 - max. 60% Medianes Überleben (Monate) bis 40 6 - 32% ca. 12% 6 - 17% 10% bis 36 18 9 - 17 12 Wagner (1995) Bronchialcarzinom Adjuvante Strahlentherapie (kleinzelliges BC) Limited Disease: • Lokoregionales Rezidiv nach Chemotherapie ohne • • • • Nachbestrahlung 75-80%, mit Nachbestrahlung < 30% Erhöhung der 2-Jahres-Überlebenswahrscheinlichkeit von 20 (-25)% auf 40% durch komb. Radio-Chemotherapie Jedoch: Zunahme hämatologischer, pulmonaler und ösophagealer Komplikationen Konsolidierende Strahlentherapie: 50 Gy Mediastinum, Primärtumorvolumen, Lymphabflußgebiete, evtl. Boost 10 Gy bei Resttumor Kontraindikation: Deutlich reduzierter AZ, FEV1 < 1l/s Bronchialcarzinom Adjuvante Strahlentherapie (kleinzelliges BC) Extensive Disease: • • Verbesserung der lokalen Tumorkontrolle (15-40% komplette Remission) Keine relevante Verbesserung der Lebenserwartung Palliativmaßnahme, evtl. frühzeitiger Einsatz bei zu erwartenden Komplikationen (Einflußstauung, Bronchusoder Trachealobstruktion) Bronchialcarzinom Adjuvante Strahlentherapie (kleinzelliges BC) Elektive (prophylaktische) Hirnschädelbestrahlung (PCI) • Zerebrale Metastasierung bei kleinzelligem BC innerhalb von 2 Jahren ca. 45%, nach 5 Jahren ca. 80% • Senkung der Inzidenz von 45% auf 19% (2-JahresWahrscheinlichkeiten)* • Applikation von 30 Gy in 15 Fraktionen: Keine oder nur geringe bestrahlungsbedingte Neurotoxizität • Nur geringe Erhöhung der Überlebenswahrscheinlichkeit (21,5% auf 29% 2-Jahres-Überleben*), jedoch deutlicher Zugewinn an Lebensqualität *Arriagada (1995) Bronchialcarzinom Palliative Strahlentherapie (kleinzelliges BC) • • • • • Lokale Tumorprogression unter Chemotherapie Lokales Rezidiv (falls nicht vorbestrahlt) Symptomatische Metastasen v. a. des Skelettsystems Hirnmetastasen und spinale Metastasen Vena-cava-superior-Syndrom (nach primärer Chemotherapie) • Bronchusstenosen mit Retentionspneumonie (alternativ oder zusätzlich Afterloading, evtl. nach Lasertherapie) • Ablehnung einer Chemotherapie durch den Patienten Bronchialcarzinom Komplikationen der Strahlentherapie • • • • Mitbelastung gesunder Nachbargebiete: Strahlenpneumonitis, evtl. konsekutiv Lungenfibrose ab Dosen von 25 Gy Ösophagitis, meist reversibel, ab 30 - 35 Gy Myelopathie ab 30 - 40 Gy Belastung von Herzmuskel und Perikard mit funktioneller Beeinträchtigung Kombination Radio- und Chemotherapie: Folgen unübersichtlicher und schwerwiegender, zumal einige Zytostatika eine hohe Toxizität aufweisen Bronchialcarzinom Kleinzelliges BC Prognosekriterien: Überleben: • • • • • • • • • Limited Disease LDH normal guter Allgemeinzustand Alter < 70 Jahre weibliches Geschlecht ohne Therapie Chemotherapie Chemo / Radiatio Op / Chemotherapie 58 d 148 d 303 d 452 d Manegold et al. 1989 Bronchialcarzinom Komplikationen der Chemotherapie • • • • • • • Anorexie Nausea Erbrechen Myelosupression Pneumonitis und Lungenfibrose Myokardnekrosen und Perikarditis Gastrointestinale Komplikationen Bronchialcarzinom Allgemeinzustand von Tumorpatienten (WHO) Karnofsky-Index (%) 100 Normale Aktivität, keine Beschwerden, kein Hinweis für Tumorleiden 90 Geringfügig verminderte Aktivität und Belastbarkeit 80 Normale Aktivität nur mit Anstrengung, deutlich verringerte Aktivität 70 Unfähig zu normaler Aktivität, versorgt sich selbständig 60 Gelegentliche Hilfe, versorgt sich noch weitgehend selbst 50 Ständige Unterstützung und Pflege, häufige ärztliche Hilfe erforderlich 40 Überwiegend bettlägerig, spezielle Hilfe erforderlich 30 Dauernd bettlägerig, geschulte Pflegekraft notwendig, stationäre Behandlung indiziert 20 Schwerkrank, Hospitalisierung, aktive supportive Therapie 10 Moribund