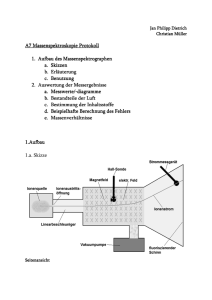
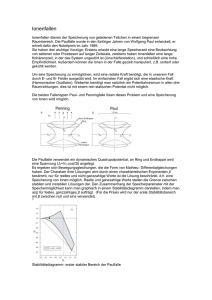
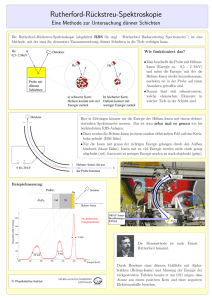
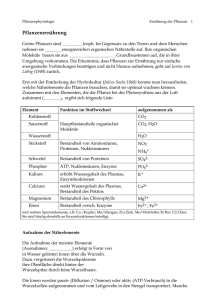
Document
Werbung

Vorlesungsversuch zur Temperaturabhängigkeit des Volumens eines Gases: 3 Luftballons He (g) N2 (l) Luft (g) (21% O2) CO2 (g) Siedepunkt N2: −195,79 °C Siedepunkt O2: −182,9 °C Siedepunkt He: −269 °C Sublimationstemperatur CO2: - 78,5 °C Siedediagramm für StickstoffSauerstoff-Gemische g Siede berei ch Phasendiagramm von CO2 = “Gasmolekül in unserer Saal-Luft“ Das Volumen eines Gases ist gleich dem Volumen des Behälters, in dem es sich befindet. Gase sind stark komprimierbar: Wenn auf ein Gas Druck ausgeübt wird, verkleinert sich sein Volumen. Im Gegensatz zu Gasen dehnen sich Feststoffe und Flüssigkeiten nicht aus, um ihre Behälter zu füllen, und Flüssigkeiten und Feststoffe sind kaum komprimierbar. Wurde unabhängig entdeckt von Robert Boyle (1662) und Edme Mariotte (1676). Entdeckt von Joseph Louis Gay-Lussac (1802). (1811) Amadeo Avogadro Allgemeine Zustandsgleichung idealer Gase pV=nRT R = 8,314472 J K-1mol-1 1 mol eines idealen Gases nimmt bei 101325 Pa und O°C = 273,15 K (Normalbedingungen) ein Volumen von 22,4 L ein. gedachte Trennwand (T=25°C) Aus: Chemie – die zentrale Wissenschaft von T.L. Brown, H.E. LeMay, B.E. Bursten, deutsche Bearbeitung von C. Robl, W. Weigand . Pearson Studium. 2007. EFFUSION Ausströmen eines Gases IN DEN LEEREN RAUM aus einem Behälter, der eine molekulare Öffnung besitzt. Dabei sollte der Durchmesser der molekularen Öffnungen klein sein im Vergleich zur mittleren freien Weglänge des effundierenden Moleküls Der Partikelstrom verläuft nur in eine Richtung (nach aussen) 1833 Thomas Graham Graham‘sches Gesetz: Die Effusionsgeschwindigkeiten zweier Gase verhalten sich umgekehrt wie die Quadratwurzeln ihrer Molekülmassen. (bei gleichem Druck) Natururan besteht zu etwa 99,3 % aus 238U und zu 0,7 % aus 235U m2 v1 v2 m1 UF6 sublimiert bei 56,6°C Fluor ist ein Reinelement , d.h. es existiert nur ein stabiles Isotop 19F Versuch: zwei Gase diffundieren in einem Glasrohr HCl (g) + NH3 (g) NH4 Cl (s) HCl 44,3 cm 65 cm mNH 3 vHCl d HCl 44,3 17,03 0,68 v NH 3 d NH 3 65 mHCl 36,46 NH3 .= durch Elektrolyse zerlegbare Stoffe Träger des elektrischen Stroms sind Ionen, im Gegensatz zu metallischen Leitern, wo der Stromtransport durch Elektronen erfolgt. •Elektrolyte bilden in wässrigen Lösungen bewegliche Ionen. •Dazu ist das Anlegen eines elektrischen Feldes nicht erforderlich. •Kristallisieren die Elektrolyte in Ionengittern, so ist auch die Schmelze elektrisch leitend, ebenso wie die wässrigen Lösungen. •Polare Molekülverbindungen, die im festen Zustand Nichtleiter sind, aber mit Wasser unter Bildung von Ionen reagieren, nennt man potentielle Elektrolyte. •Die positiv geladenen Ionen (Kationen) wandern im elektrischen Feld zur Kathode (negative Elektrode) •Die negativ geladenen Ionen (Anionen) zur Anode (positive Elektrode) •Die Ionenbeweglichkeiten verschiedener Ionenspezies sind verschieden, eine besonders große Ionenbeweglichkeit besitzen H3O+ Ionen und OH- Ionen, diese tragen besonders stark zur Leitfähigkeit bei. In der wässrigen Lösung einer Säure bzw. Base liegt ein chemisches Gleichgewicht zwischen den undissoziierten Molekülen des gelösten Stoffes und seinen Ionen vor. Starke Säuren und starke Basen sind in wässriger Lösung nahezu vollständig in Ionen dissoziiert, wobei H+ Ionen bei Säuren bzw. OH- Ionen bei Basen gebildet werden . Bei der Neutralisation starker Säuren mit starken Basen misst man als Reaktionswärme die Reaktionsenthalpie der Neutralisationsreaktion: H OH H 2O H 55,9 kJ mol Die Neutralisationsreaktion läuft extrem rasch ab und das Gleichgewicht liegt sehr weit rechts! Ist die Säure (bzw. Base) schwach, so dissoziieren die Säuremoleküle (bzw. Basenmoleküle) erst dann, wenn H+ Ionen (bzw. OH- Ionen) durch die Neutralisationsreaktion aus dem Gleichgewicht entfernt werden (= Verschiebung des Gleichgewichts). Die gemessene Reaktionsenthalpie ergibt sich aus der Reaktionsenthalpie der Neutralisationsreaktion in Kombination mit der Reaktionsenthalpie der Dissoziation der Säure (bzw. Base). z.B. Neutralisationsenthalpie von Blausäure: HCN H CN H OH H 2O 43,7 55,9 kJ mol kJ mol HCN OH CN H 2O 12,2 kJ mol AB A B A B K AB A a f A A 1mol L A für die ideale Lösung ist f=1 0 0 Ka Standardkonzentration a A a B a AB . Eine experimentelle Bestimmung ist nicht möglich. Säuren und Basen Die Begriffe „Säure“ und „Base“ wurden 1887 von Arrhenius und Ostwald erstmals definiert. Sie verstanden unter einer Säure einen sauer schmeckenden Stoff, der in wässriger Lösung unter Bildung von Wasserstoff-Ionen dissoziiert z.B. HCl = H+ + Clbzw. unter einer Base einen seifig schmeckenden Stoff, der in wässriger Lösung unter Bildung von Hydroxid-Ionen dissoziiert z.B. Ca(OH)2= Ca2+ + 2 OH- Versuch: Täuschung des Geschmacksinnes möglich! Die Ionen einer wässrigen Salzsäure entstammen jedoch nicht wie ursprünglich von Arrhenius angenommen einer Dissoziation des Chlorwasserstoffs HCl = H+ + Cl- sondern der (stark exothermen) Reaktion zwischen Chlorwasserstoff und Wasser HCl + H2O = H3O+ + Cl- Freie Protonen H+ existieren in Wasser nicht. Nach Brönsted und Lowry (1923) beruht die Säurewirkung eines Stoffes darauf, dass er an die Moleküle des Wassers Protonen abgibt, wobei Hydroxoniumionen entstehen. Viele protonenenfreie Stoffe wie Nichtmetalloxide oder Metallkationen (z.B. in Form der Metallhalogenide) verwandeln sich erst beim Auflösen durch Reaktion mit dem Wasser in Säuren z.B. SO3 + H2O = H2SO4 Al3+ + 6 H2O = [Al(H2O)6]3+ Nach Brönsted und Lowry beruht die BasenWirkung eines Stoffes darauf, dass er von Wassermolekülen Protonen aufnimmt, was zur Bildung von Hydroxid-Ionen führt , z.B. bei der Reaktion von Ammoniak mit Wasser NH3 + H2O = NH4+ + OHAuch Kationen oder Anionen können Brönsted Säuren oder Basen sein, z.B. ClO- + H2O = HClO + OH- Viele Hydroxidionen-freie Stoffe wie Metalloxide verwandeln sich erst beim Auflösen durch Reaktion mit dem Wasser in Basen z.B. Na2O + H2O = 2 Na+ + 2 OH- pH – Wert Der pH-Wert ist der negative dekadische Logarithmus der Wasserstoffionenaktivität (bei verdünnten Lösungen des Zahlenwerts der H+ Ionen Konzentration) Protolysegleichgewicht und Ionenprodukt des Wassers: H 2 O H 2 O H 3 O OH H O OH K 3 H 2 O2 H 2 O const 55,55mol L1 K W 1,0 10 14 mol 2 L 2 Die Autoprotolyse des Wassers ist der Grund dafür, dass auch chemisch reines Wasser eine (geringe) elektrische Leitfähigkeit besitzt: Spezifische elektrische Leitfähigkeit bei 18°C: Reinstwasser: 4x10-8 Ω-1cm-1 Kupfer: 6x105 Ω-1cm-1 d.h. 1 mm3 Reinstwasser besitzt den gleichen elektrischen Widerstand wie ein Kupferdraht von 1 mm2 Querschnitt und 15 Millionen km Länge (40 fache Entfernung zwischen Erde und Mond) Die Autoprotolyse des Wassers ist abhängig von Druck und Temperatur Das Ionenprodukt KW des Wassers beträgt (bei Normaldruck) (mol2/L2) bei 0 °C KW=0,13 · 10−14 Bei 50 °C KW=5,6 · 10−14 bei 100 °C KW=74 · 10−14 Dementsprechend ist auch der pH- Wert temperaturabhängig: reines Wasser bei 0 °C reines Wasser bei 25 °C reines Wasser bei 50 °C reines Wasser bei 100 °C pH=7,45 pH=7,0 pH=6,63 pH=6,07 (Daten aus Jander/Blasius, Lehrbuch der analytischen und präparativen anorganischen Chemie, Hirzel Verlag, Stuttgart) Bei 25°C gilt: HA H 2 O H 3O A KS H O A 3 HA pK S log K S A H 2 O HA OH KB HA OH A pK B log K B K S K B H 3O OH K W 10 14 pK S pK B 14 Der pH-Wert lässt sich ungefähr mittels pH-Indikatoren bestimmen. Es handelt sich um schwache Säuren, bei denen sich die Farbe der undissoziierten Säure von der des Säure-Anions unterscheidet. HInd H Ind H Ind K Ind HInd pH pK Ind Ind log HInd Phenolphtalein Methylorange Versuch: Rotkrautsaft als pH Universal-Indikator pH-Wert Farbe Farbstoff: Cyanidin 2 rot 4 lila 6 violett 8 blau 10 blaugrün in Abhängigkeit vom pH-Wert erfährt das Cyanidinsystem strukturelle Veränderungen 12 gelb Vorlesungsexperiment: Titration Bei der Titration (Volumetrie) erfolgt die portionsweise Zugabe einer Maßlösung eines Reagenz zur Lösung des Reaktionspartners, dessen Konzentration bestimmt werden soll, unter ständiger Kontrolle des Zugabevolumens bis zum vollständigen Umsatz (Äquivalenzpunkt) . Die Volumenmessung der Maßlösung erfolgt mit einer Bürette oder mit einem PC-gekoppelten Titrationsgerät. Der Äquivalenzpunkt kann z.B. mittels eines Farbindikators bestimmt werden.