3 Luftballons
Werbung
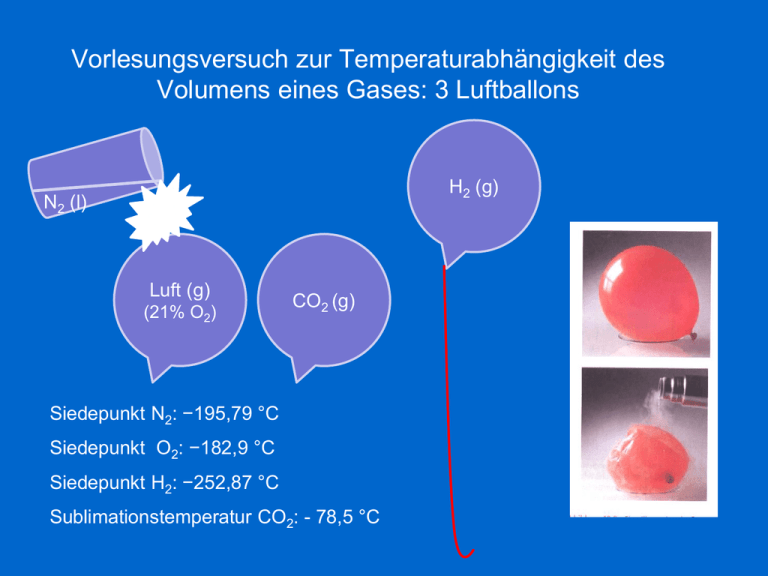
Vorlesungsversuch zur Temperaturabhängigkeit des Volumens eines Gases: 3 Luftballons H2 (g) N2 (l) Luft (g) (21% O2) CO2 (g) Siedepunkt N2: −195,79 °C Siedepunkt O2: −182,9 °C Siedepunkt H2: −252,87 °C Sublimationstemperatur CO2: - 78,5 °C Das Volumen eines Gases ist gleich dem Volumen des Behälters, in dem es sich befindet. Gase sind stark komprimierbar: Wenn auf ein Gas Druck ausgeübt wird, verkleinert sich sein Volumen. Im Gegensatz zu Gasen dehnen sich Feststoffe und Flüssigkeiten nicht aus, um ihre Behälter zu füllen, und Flüssigkeiten und Feststoffe sind kaum komprimierbar. Wurde unabhängig entdeckt von Robert Boyle (1662) und Edme Mariotte (1676). Entdeckt von Joseph Louis Gay-Lussac (1802). (1811) Amadeo Avogadro Allgemeine Zustandsgleichung idealer Gase pV=nRT R = 8,314472 J K-1mol-1 1 mol eines idealen Gases nimmt bei 101325 Pa und O°C = 273,15 K (Normalbedingungen) ein Volumen von 22,4 L ein. (T=25°C) Graham‘sches Gesetz: Die Effusionsgeschwindigkeiten zweier Gase verhalten sich umgekehrt wie die Quadratwurzeln ihrer Molekülmassen. m2 v1 v2 m1 UF6 sublimiert bei 56,6°C Fluor ist ein Reinelement , d.h. es existiert nur ein stabiles Isotop 19F Versuch: zwei Gase diffundieren in einem Glasrohr HCl (g) + NH3 (g) NH4 Cl (s) HCl 44,3 cm 65 cm mNH 3 vHCl d HCl 44,3 17,03 0,68 v NH 3 d NH 3 65 mHCl 36,46 NH3 Träger des elektrischen Stroms sind Ionen, im Gegensatz zu metallischen Leitern, wo der Stromtransport durch Elektronen erfolgt. In der wässrigen Lösung eines Elektrolyten (= Säure, Base oder Salz) liegt ein chemisches Gleichgewicht zwischen den undissoziierten Molekülen des gelösten Stoffes und seinen Ionen vor. Starke Säuren und starke Basen sind in wässriger Lösung nahezu vollständig in Ionen dissoziiert. Bei der Neutralisation starker Säuren mit starken Basen misst man als Reaktionswärme die Reaktionsenthalpie der Neutralisationsreaktion: H OH H 2O H 55,9 kJ mol Die Neutralisationsreaktion läuft extrem rasch ab und das Gleichgewicht liegt sehr weit rechts! Ist die Säure (bzw. Base) schwach, so dissoziieren die Säuremoleküle (bzw. Basenmoleküle) erst dann, wenn H+ Ionen (bzw. OH- Ionen) durch die Neutralisationsreaktion aus dem Gleichgewicht entfernt werden (= Verschiebung des Gleichgewichts). Die gemessene Reaktionsenthalpie ergibt sich aus der Reaktionsenthalpie der Neutralisationsreaktion in Kombination mit der Reaktionsenthalpie der Dissoziation der Säure (bzw. Base). z.B. Neutralisationsenthalpie von Blausäure: HCN H CN H OH H 2O 43,7 55,9 kJ mol kJ mol HCN OH CN H 2O 12,2 kJ mol AB A B A B K AB A a f A A 1mol L A für die ideale Lösung ist f=1 0 0 Ka Standardkonzentration a A a B a AB . Eine experimentelle Bestimmung ist nicht möglich. Brönsted Säuren und Basen Die Begriffe „Säure“ und „Base“ wurden 1887 von Arrhenius und Ostwald erstmals definiert. Sie verstanden unter einer Säure einen sauer schmeckenden Stoff, der in wässriger Lösung unter Bildung von Wasserstoff-Ionen dissoziiert z.B. HCl = H+ + Clbzw. unter einer Base einen seifig schmeckenden Stoff, der in wässriger Lösung unter Bildung von Hydroxid-Ionen dissoziiert z.B. Ca(OH)2= Ca2+ + 2 OHNach Brönsted und Lowry (1923) beruht die Säurewirkung eines Stoffes darauf, dass er an die Moleküle des Wassers Protonen abgibt, wobei Hydroxoniumionen entstehen : Hydroxoniumion Die Ionen einer wässrigen Salzsäure entstammen nicht wie ursprünglich von Arrhenius angenommen einer Dissoziation des Chlorwasserstoffs HCl = H+ + Clsondern der (stark exothermen) Reaktion zwischen Chlorwasserstoff und Wasser HCl + H2O = H3O+ + Cl- Freie Protonen H+ existieren in Wasser nicht. Nach Brönsted und Lowry ist eine Säure ein Stoff, der imstande ist, an Wasser Protonen abzugeben. Viele protonenenfreie Stoffe wie Nichtmetalloxide oder Metallkationen (z.B. in Form der Metallhalogenide) verwandeln sich erst beim Auflösen durch Reaktion mit dem Wasser in Säuren z.B. SO3 + H2O = H2SO4 Al3+ + 6 H2O = [Al(H2O)6]3+ Nach Brönsted und Lowry beruht die Basen-Wirkung eines Stoffes darauf, dass er von Wassermolekülen Protonen aufnimmt, was zur Bildung von HydroxidIonen führt , z.B. bei der Reaktion von Ammoniak mit Wasser NH3 + H2O = NH4+ + OHAuch Kationen oder Anionen können Brönsted Säuren oder Basen sein, z.B. NH4+ + H2O = NH3 + H3O+ HSO4- + H2O = SO42- + H3O+ [Al(H2O)6]3+ + H2O = [Al(H2O)5(OH)]2+ + H3O+ ClO- + H2O = HClO + OH- [Be(H2O)3(OH)]+ + H2O = [Be(H2O)4]2+ + OHViele Hydroxidionen-freie Stoffe wie Metalloxide verwandeln sich erst beim Auflösen durch Reaktion mit dem Wasser in Basen z.B. Na2O + H2O = 2 Na+ + 2 OH- pondus Hydrogenii Der pH-Wert ist der negative dekadische Logarithmus der Wasserstoffionenkonzentration Die pH-Wert Skala wurde 1909 von Sören Sörensen festgelegt. Die Autoprotolyse des Wassers ist der Grund dafür, dass auch chemisch reines Wasser eine (geringe) elektrische Leitfähigkeit besitzt: Spezifische elektrische Leitfähigkeit bei 18°C: Reinstwasser: 4x10-8 Ω-1cm-1 Kupfer: 6x105 Ω-1cm-1 d.h. 1 mm3 Reinstwasser besitzt den gleichen elektrischen Widerstand wie ein Kupferdraht von 1 mm2 Querschnitt und 15 Millionen km Länge (40 fache Entfernung zwischen Erde und Mond) Die Autoprotolyse des Wassers ist abhängig von Druck und Temperatur Das Ionenprodukt KW des Wassers beträgt (bei Normaldruck) (mol2/L2) bei 0 °C KW=0,13 · 10−14 Bei 50 °C KW=5,6 · 10−14 bei 100 °C KW=74 · 10−14 Dementsprechend ist auch der pH- Wert temperaturabhängig: reines Wasser bei 0 °C pH=7,45 reines Wasser bei 25 °C pH=7,0 reines Wasser bei 50 °C pH=6,63 reines Wasser bei 100 °C pH=6,07 (Daten aus Jander/Blasius, Lehrbuch der analytischen und präparativen anorganischen Chemie, Hirzel Verlag, Stuttgart) HA H 2O H A H A KS HA pK S log K S A H 2O HA OH KB HA OH A pK B log K B K S K B H OH KW 10 14 pK S pK B 14 i Der pH-Wert lässt sich ungefähr mittels pH-Indikatoren bestimmen. Es handelt sich um schwache Säuren, bei denen sich die Farbe der undissoziierten Säure von der des Säure-Anions unterscheidet. HInd H Ind H Ind K Ind HInd pH pK Ind Ind log HInd Phenolphtalein Methylorange Versuch: Rotkrautsaft als pH Universal-Indikator pH-Wert Farbe 2 rot 4 lila 6 violett 8 blau 10 blaugrün 12 gelb Vorlesungsexperiment: Titration Bei der Titration (Volumetrie) erfolgt die portionsweise Zugabe einer Maßlösung eines Reagenz zur Lösung des Reaktionspartners, dessen Konzentration bestimmt werden soll, unter ständiger Kontrolle des Zugabevolumens bis zum vollständigen Umsatz (Äquivalenzpunkt) . Die Volumenmessung der Maßlösung erfolgt mit einer Bürette oder mit einem PC-gekoppelten Titrationsgerät. Der Äquivalenzpunkt kann z.B. mittels eines Farbindikators bestimmt werden. Damit eine Titrationsmethode angewendet werden kann, müssen 2 Bedingungen erfüllt sein: 1. Die untersuchte chemische Reaktion muss praktisch vollständig ablaufen, d.h. das Gleichgewicht muss sehr weit rechts liegen. 2. Die untersuchte Reaktion muss schnell ablaufen, d.h. das Gleichgewicht muss sich rasch einstellen. Für die Neutralisationsreaktion sind beide Bedingungen erfüllt: H3O+ + OH- = 2 H2O K=1/KW=1014 Genaue Messung des pH-Werts mit der Glaselektrode: An der Glasmembran entsteht ein elektrisches Potential, sobald die H+ Konzentrationen zu beiden Seiten unterschiedlich sind. Mit einem Voltmeter sehr hohen Innenwiderstandes kann man das Potential messen. Es ändert sich bei 25°C um 59,1 mV pro pH-Stufe. Einstabmesskette Titrationskurven für Säure-Base Titrationen Der pH-Wert in Abhängigkeit von dem hinzugefügten Volumen an Maßlösung stellt eine Titrationskurve dar. Die Kurve ist sigmoid (sförmig) und man erkennt eine starke Veränderung des pH-Werts am Äquivalenzpunkt, wodurch sich dieser bestimmen lässt. Näherungsmethoden zur pH-Wert Berechnung HAc H Ac K S 10 4,75 pH einer Essigsäure-Lösung der Konzentration 0,1 mol L-1? Antwort: Es gilt das MWG mit folgenden Näherungen: H H Ac H H HAc 0,1 H 0,1 2 2 10 4,75 0,1 0,001333352 pH log H 2,875 ----------------------------------------------------------------------------------------pH einer Natriumacetatlösung der Konzentration 0,05 mol L-1? Antwort: Es gilt das MWG mit folgenden Näherungen: Ac H 2O HAc OH KW 10 14 HAc OH OH K Hydrolyse K S 10 4, 75 Ac 0,05 OH 10 9 , 25 OH OH 2 0,05 10 9, 25 0,05 pOH log OH 5,2755 pH 14 pOH 8,72 2 Puffer Unter Puffersystem versteht man die Mischung einer schwachen Säure und ihrer korrespondierenden Base oder einer schwachen Base und ihrer korrespondierenden Säure in wässriger Lösung. Es gilt (nur im Pufferbereich) die Puffergleichung (Henderson-Hasselbalch-Gleichung) HA H A H A H Salz KS HA pH pK S Säure A log HA Pufferkapazität des Essigsäure/Natriumcetat -Puffers pH-Puffer im Blut Für einen konstanten Blut-pH ist in erster Linie das KohlensäureHydrogencarbonat Puffersystem verantwortlich, gefolgt von den Puffereigenschaften des Hämoglobins und der Plasmaproteine sowie dem Phosphatpuffer. Die besondere Reaktionsfähigkeit der Puffersysteme des Blutes befähigt sie zu einer außerordentlich schnellen Regulation des Blut-pH auf Werte im Normalbereich. Normalwerte für den pH-Wert im Blut: 7,36-7,44 Das Kohlensäure/HydrogencarbonatSystem ist für die Schnellregulierung des pH im Blut sehr wichtig. Der pH kann durch Abatmen von CO2 in der Lunge kurzfristig reguliert werden („offenes Puffersystem“) NH 4 NH 3 H Hydrolyse NH 4 OH NH 3 H 2O Neutralisa tion Titration einer Lösung, welche HCl und NH4Cl in den Konzentrationen 0,1 mol/L enthält. Titriert wird mit NaOH-Maßlösung der Konzentration 0,1 mol/L pKB(NH3)=4,76 pH-Wert Berechnungen: pH einer HCl Lösung der Konzentration 0,1 mol L-1? Antwort: starke Säure, praktisch völlig dissoziiert, pH = -log[HCl] = -log[H+] = 1 ------------------------------------------pH einer AmmoniumchloridLösung der Konz. 0,05 mol L-1? -----------------------------------------pH einer Pufferlösung, Die Ammoniumchlorid und Ammoniak in gleicher Konzentration enthält? ------------------------------------------pH einer NH3-Lösung der Konz. 0,033 mol L-1? K B 10 4, 76 OH 2 0,033 NH 4 H 2O NH 3 H 3O K Hydrolyse H 14 KW 10 4, 76 K B 10 NH H H NH 0,05 2 3 4 10 9, 24 0,05 pH log H 5,27 NH 3 H 2O NH 4 OH K B 10 4 , 76 NH OH OH Salz Salz Base 4 NH 3 pOH pK B 4,76 pH 14 4,76 9,24 Base 1923 1923 Gilbert Newton Lewis Courtesy The Chemists' Club Der Säure-Base Begriff von Lewis ist unabhängig vom H+ Ion. Ein Teilchen (Molekül oder Ion) einer Lewis-Base verfügt über ein einsames Elektronenpaar, mit dem eine kovalente Bindung zu einer Lewis-Säure (=Atom, Molekül oder Ion mit einem unbesetzten Orbital) geknüpft werden kann. Lewis-Säure = Elektronenpaar-Akzeptor Lewis-Base = Elektronenpaar-Donator Beispiel: BF3 + NH3 BF3NH3 Bortrifluorid-Addukt: BF3-Ammoniak Harte und weiche Lewis-Säuren und –Basen Harte Säuren und Basen sind kaum, weiche sind leicht polarisierbar. HSAB-Prinzip von Pearson: Harte Säuren verbinden sich vorzugsweise mit harten Basen, weiche Säuren verbinden sich vorzugsweise mit weichen Basen. Säure Base hart H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+ F-, H2O, OHO2-, NH3, NO3- mittel Fe2+, Co2+, Ni2+, Cu2+ Cl-, Br-, N3- weich Cu+, Ag+, Au+, Pd2+, Pt2+, Cd2+, Hg2+ I-, S2-, CO CN-











