Nervenzellen
Werbung

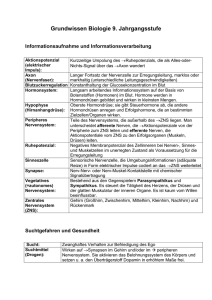
Nervenzellen Vorlesung Biologische Psychologie C. Kaernbach Literatur: Schandry, Kapitel 3-5 Vertiefung: – Kandel, Schwartz, Jessell: Principles of Neural Sciences – Wikipedia: empfohlen bzw. bei weiterführendem Interesse Aufbau einer Zelle • Zellmembran: Doppellipidschicht • Prokaryoten (gr. pro „vor“, karion „Kern“) – kein Zellkern, DNA schwimmt frei im Zytoplasma • Archaeen („Urbakterien“), oft extremophil, nicht pathogen • Bakterien – Unterschiede in den Ribosomen • Eukaryoten (gr. eu „gut“, „echt“) – Zellkern Doppelmembran: zwei Doppellipidschichten – Mitochondrien – weitere „Organellen“ (membranumgeben) Zellkern • Doppelmembran (Kernhülle) – äußere Membran: Ribosomen • geht über in das (raue) endoplasmatische Retikulum (ER) – innere Membran: „Formfaktor“ – dazwischen: perinukleärer Raum • in Verbindung mit Lumen des ER – ca. 2000 Kernporen • 8 Speichen, in der Mitte ein Plug • Transfer von rRNA, mRNA, ... • Kernkörperchen, Nucleoli – „Ribosomenfabrik“ • Chromosomen Mitose Meiose Zellzyklus Mitochondrien • „Kraftwerke“ der Zelle – Aufbau: Doppelmembran • innere Membran umschließt „Matrix“ – in der Matrix: Citratzyklus, vor allem Fettsäureabbau – auf innerer Membran: Atmungskette, Erzeugung von ATP • Zwischenmembranraum: Nukleotidphosphorylierung • Proteinkomplexe (Porin) als Poren – Ursprung: Endosymbiose mit Bakterien ähnlich Rickettsien (Fleckfieber) • innere Membran atypisch (Cardiolipin), Hülle vom Symbiont • eigene DNA (unvollständig), eigene Ribosomen, Sprossung – Vererbung ausschließlich über Zytoplasma der Mutter • bis auf eventuelle Mutationen ein Klon • Mitrochondriopathien andere Organellen • Golgi-Apparat – Stapel membranbegrenzter Hohlräume – Weiterverarbeitung von Proteinen, Zuckern, Lipiden: Sekretbildung, Hormone, Membranproteine & -lipide, • Lysosomen – vom Golgi-Apparat gebildet, enthalten Enzyme zur Verdauung von Fremdstoffen • andere Vesikel, z.B. mit Neurotransmittern Endoplasmatisches Retikulum • dynamisch sich veränderndes Labyrinth aus Zellmembran (Doppellipidschicht), ER-Lumen steht mit perinukleärem Raum in Verbindung – raues ER: mit Ribosomen besetzt, Proteinsynthese, Membransynthese – glattes ER: u. a. Synthese von Lipiden und Hormonen – Lumen: Calcium-Speicher (103mol/l, Cytosol: 107mol/l), wichtig für Signaltransduktion Signaltransduktion • Reaktion auf (aus Sicht der Zelle) äußere Reize: – Licht, mechanische Reizung (Hören), Geruch – Blutdruck, Hormone, Neurotransmitter – Immunreaktion, Muskelkontraktion, Morphogenese • Rezeptoren: Proteine – im Cytosol: für kleine oder lipophile Moleküle – membranständig: 4 oder 7 Transmembranproteine • Ionenkanäle: Membranpermeabilität ändert sich • „G-Protein-gekoppelt“: GTP-bindendes Protein zerfällt ... • Reiz: Ligand (dringt nicht ein), Spannung, Photon, ... – Second Messenger (z.B. Ca2+), Signalkaskade Zytoskelett • definiert Form der Zelle, ermöglich Motilität – Aktinfilamente • äußere Form, Motilität – Mikrotubuli • Tubulinpolymer – Hohlzylinder 25 nm • innere Stabilität, Motilität • innerzellulärer Transport von Vesikeln etc. entlang der Mikrotubuli – Intermediärfilamente • sehr stabil, Stützgerüst Endothelzellen. Blau: Zellkerne. Grün: Mikrotubuli. Rot: Aktinfilamente Nervenzelle • Auf Erregungsleitung spezialisierte Zelle – Soma: Synthese von Proteinen und Lipiden – Axon, entspringt am Axonhügel • oft myelinisiert – Schwannsche Zelle (Glia): Myelinscheide (Isolierung) – alle 1-2 mm Ranvierscher Schnürring: saltatorische Erregung – Leitungsgeschwindigkeit Faktor 10, bis zu 120 m/s • Mikrotubuli („Neurotubuli“) sichern Transport – z.B. Vesikel mit Neurotransmitter, Rücktransport • am Ende Verzweigungen, Synapsen – Dendriten • kürzer, stärker verzweigt, Dendritic Spines Neuronentypen • Klassifikationen nach – äußerer Form • Pyramidenzellen, Sternzellen, ... – Neurotransmitter • cholinerg, adrenerg, gabaerg, ... – Richtung • afferent, efferent – Funktion • sensorisch, motorisch, Interneuron Gliazellen • 10-50 mal häufiger als Neurone, kleiner – 50% der Gehirnmasse – behalten (anders als Nervenzellen) nach Entwicklung des Nervensystems Fähigkeit zur Zellteilung – Stützfunktion, Führungselemente beim Wachstum – Ionenmilieu um Neurone herstellen • Astrozyten: Blut-Hirn-Schranke – Endo-/Exozytose von Glutamat beeinflußt Neurone • Oligodrendrozyten: Myelinscheiden • Mikroglia: Abwehr- und Immunfunktion Myelinscheiden • Peripherie: Schwann-Zellen – jeweils nur eine Myelinscheide pro Zelle – Stützfunktion (ohne Scheide) auch für mehrere Zellen • ZNS: Oligodrendrozyten – weiße Substanz • Demyelinisierungserkrankung – Multiple Sklerose Diffusion durch Membranen • Flüssigkeiten: Osmose – Wasserpotential • Gase: Partialdruck selektivpermeable Membran • unterschiedliche Substanzgemische auf zwei Seiten einer Membran – Selektivpermeabilität – Durchmischung durch thermische Bewegung – angestrebt: Gleichheit der Osmolarität ? • wichtig: Teilchenzahl, nicht Teilchenart, -größe, -masse, ... • Gleichgewicht: Summe der osmotischen Drücke = hydrostatischer Druck Spezialfall Ionen • Biomembranen für Ionen impermeabel – für Protein-Ionen() impermeabel – aber: spezifische Ionenkanäle für Na+, K+, Ca2+, Cl • aktiviert durch Spannungen, Ionen, Proteine, mechanisch, aber auch in Ruhe – Beispiel passiver Kaliumkanal » K+ verliert an der einen Seite der Pore seine Hydrathülle, C=O Gruppen übernehmen innen H-Brücken auf der anderen Seite der Pore wieder hydriert • in Ruhe vor allem Kaliumkanal aktiv • aktiver Transport: K+ rein, Na+ raus – elektrische vs. osmotische Kräfte Aktiver Transport • Natrium-Kalium-Pumpe (auch: Na+/K+-ATPase) – Na+- & K+-Transport gekoppelt & energieabhängig: • 3 Na+ werden aus der Zelle hinaustransportiert Bilanz: außen positiv innen negativ • 2 K+ werden in die Zelle hineintransportiert • 1 ATP wird „verbraucht“: Phosphorylierung eines Aspartat-Restes führt zur Konfigurationsänderung – Diffusion: Na+ will rein (kann nicht), K+ will raus (ok) • K+ strömt aus, bis elektrisches Potential dem entgegenwirkt Membranpotential • existiert in allen Zellen (Steuerung von Ionenströmen) – für elektrisch erregbare Zellen: Ruhemembranpotential – Natrium-Kalium-Pumpe • 3 Na+ aus der Zelle , 2 K+ in die Zelle, K+-Ionen diffundieren teilweise wieder raus ⇨ negatives Potential • Nernst-Gleichung für Ionen E = (RT/zF) ln(c1/c2) 60 mV/z log10(c1/c2) • T: Temperatur, R: Gaskonstante, F: Faradaykonstante z: Wertigkeit des Ions, c1, c2: Konzentrationen • ergibt Potentialdifferenz pro Ionenart: diejenige Spannung, bei der keine Ionenwanderung stattfände • Membranpotential dominiert von K+-Ionen Membranpotential Ion Na+ K+ Ca2+ Cl Proteine cinnen mmol/l 7-11 120-155 105-104 4-7 155 caußen Verhältnis mmol/l 144 1:16 4-5 33:1 2 1:100000 120 1:20 5 31:1 Potential mV +72 -91 +150 -78 • Membranpotential dominiert von K+-Ionen – Natriumleckströme reduzieren das Membranpotential • Permeabilität für Na+ zwar gering, aber Membranpotential weit von Na+-Gleichgewichtspotential Lokale Änderung des Membranpotentials • Änderung an einer Stelle, z. B.: – Na+-Kanäle gehen auf • Na+ strömt ein • Potential wird positiver • „depolarisiert“ – weitere K+-Kanäle gehen auf • K+ strömt aus • Potential wird negativer • „hyperpolarisiert“ • Erregungsleitung – Elektrotonische Ausbreitung ⇨ • fast instantan, aber verlustreich, • Reichweite max. 0,1 mm – Aktionspotentiale... Aktionspotential bei elektrisch erregbaren Zellen • Negative Stimulation (Hyperpolarisation) – elektrotonische Leitung • Positive Stimulation (Depolarisation) – bis zu einer Schwelle elektrotonische Leitung – jenseits der Schwelle Aktionspotentiale gleicher Größe • Alles oder Nichts Aktionspotential bei elektrisch erregbaren Zellen • ab -40 mV öffnen spannungsabhängige Natriumkanäle – Depolarisation („Aufstrich“), Overshoot – nach ca. 1 ms wieder inaktiv • ebenfalls ab -40 mV öffnen spannungsabhängige Kaliumkanäle – langsamer – Repolarisation, Hyperpolarisation • und nachher? alles wieder in Ordnung? Kontinuierliche Erregungsleitung • Marklose Nervenfasern (nicht myelinisiert) – Aktionspotential an einer Stelle der Faser bewirkt per elektrotonischer Leitung Depolarisation in benachbarten Abschnitten über den Schwellwert • Übertragungsgeschwindigkeit langsam – 1-3 m/s, max. 30 m/s – steigt in etwa linear mit Durchmesser der Faser • ANS, Nozizeptoren – Schauer über den Rücken • erst Nacken, dann Rücken/Arme, dann Beine: spürbares Erlebnis der langsamen Weiterleitung im ANS Saltatorische Erregungsleitung • Markhaltige Nervenfaser (myelinisiert) – Markscheide aus Myelin isoliert die Zelle • verbessert elektrotonische Leitung: 0,1mm ⇨ 5 mm – alle 1-2 mm: Ranvierscher Schnürring • Aktionspotential erreicht am nächsten Schnürring Schwelle – 100-180 m/s – nicht pränatal Fragen • Kann eine Erregung (bei elektrotonischer oder saltatorischer Weiterleitung) rückwärts laufen? • Wie lange dauert ein Aktionspotential? • Wie lang ist die gleichzeitig von einem Aktionspotential betroffene Strecke bei einer Weiterleitungsgeschwindigkeit von – kontinuierlicher Weiterleitung = 1 m/s? – saltatorischer Weiterleitung = 100 m/s? • Wie viele Schnürringe betrifft das? Frequenzkodierung Axonhügel • Ursprungsstelle des Axons am Soma • Einsetzen spannungsabhängiger Na+-Kanäle • noch nicht von Myelin umhüllt Klassifikation von Nervenfasern • nach Durchmesser und Nervenleitgeschwindigkeit – nach Erlanger / Gasser (1937) • • • • • • A 10-20 µm A 7-15 µm A 4-8 µm A 2-5 µm B 1-3 µm C 0,5-1,5 µm 60-120 m/s 40-90 m/s 30-50 m/s 10-30 m/s 5-20 m/s 0,5-2 m/s L/H: I L/H: II L/H: III (marklos) L/H: IV – nach Lloyd / Hunt (1943) • • • • I 12-20 µm II 7-12 µm III 2-7 µm IV 0,5-1,5 µm 70-120 m/s 40-70 m/s 10-40 m/s 0,5-2 m/s (marklos) Spontanaktivität • Fast alle elektrisch erregbaren Zellen (also solche mit spannungsabhängigen Na+-Kanälen) weisen Spontanaktivität auf. – Inhibitorische Einflüsse vorgeschalteter Zellen können Spontanaktivität unterdrücken • ermöglicht bipolare Kodierung – Beispiel: Vasokonstriktor-Neurone – Gegenbeispiel: Piloerector-Neurone • Sonderfall: Sinusknoten im Herzen – Schrittmacherneuron „Elektrische“ Synapsen • Annäherung der Zellmembranen auf 2-4 nm • Gap junctions – Kennzeichen von Gewebetieren (Eumetazoa) – aufeinander gerichtete Membranporen • zwei Connexone aus je 6 Connexinen • zum Nährstoffstransport in wenig durchbluteten Gebieten • (unter anderem auch) Ionenaustausch Chemische Synapsen • Aktionspotential in präsynaptischer Endigung – Spannungsgesteuerte Ca2+-Kanäle öffnen sich, Ca2+ dringt ein – Vesikel mit Neurotransmittern ergießen sich in den synaptischen Spalt (20-50 nm) • oft mehrere Vesikelarten in einer Synapse für verschiedene Transmitter und Kotransmitter • Transmitter reagieren mit Rezeptoren an postsynaptischer Membran – z. B. Na+-Kanäle öffnen sich ⇨ Depol. – oder Cl--Kanäle öffnen sich ⇨ Hyperpol. • Autorezeptoren (präsynaptisch) regulieren Transmitterausschüttung • Transmitterabbau oder Wiederaufnahme (re-uptake) Rezeptoren • Typ-I-Rezeptor – ligandengesteuerter Ionenkanal – ionotroper (direkter) Rezeptor – schnell • Typ-II-Rezeptor – G-Protein-gekoppelter Ionenkanal – metabotroper (indirekter) Rezeptor – flexibel Neurotransmitter • 1000 Sorten – Acetylcholin – Katecholamine • Dopamin • Adrenalin • Noradrenalin Monoamine – Serotonin – Aminosäuren als Neurotransmitter • Glutamat • GABA • Glycin – Neuropeptide (Peptidhormone) • Neuropetid Y, ACTH, Substanz P, Endorphine, ... Acetylcholin • Esther von Essigsäure und Cholin – nikotinerger Rezeptor • ionotrop, depolarisierend • Muskelzellen, ZNS – muskarinerger Rezeptor • metabotrop, de- od. hyperpolarisierend • Vegetativum, ZNS – wird im synaptischen Spalt zerlegt, Cholin wird wieder aufgenommen – ACh-Gifte • Botulinumtoxin – behindert ACh-Freisetzung – 1 Molekül ruiniert 1 Synapse • E605, Sarin – behindern ACh-Abbau – Gegengift: Atropin (ACh-Antagonist) Loewi, 1921: „Vagusstoff“ Katecholamine • Katecholring • Biosynthese aus der proteinogenen Aminosäure Tyrosin – L-DOPA • nicht-proteinogene Aminosäure – Dopamin • Amin – Noradrenalin – Adrenalin • Wiederaufnahme, (Abbau) L-DOPA • Levodopa, L-DOPA, L-Dihydroxyphenylalanin – – – – ist selbst kein Neurotransmitter passiert Blut-Hirn-Schranke wird dort zu Dopamin metabolisiert Behandlung von • Parkinson • Restless-Legs-Syndrom • Encephalitis lethargica – Buch Awakenings von Oliver Sacks – Film mit Robert De Niro, Robin Williams » auch von O.S.: The man who took his wife for a hat – heute: Dopamin-Agonisten, rezeptorspezifisch, tiefe Hirnstimulation Dopamin • fünf Dopamin-Rezeptor Subtypen, D1-D5, metabotrop – unterschiedliche Verteilung / Funktion • D1, D5: Depolarisierung • D2, D3, D4: Hyperpolarisierung • D2-Rezeptor: auch Autorezeptor • Vorkommen – Mittelhirn • Substantia nigra, Tegmentum, u. a. • viele Funktionen, u. a. – Steuerung der Willkürmotorik – Suchtverhalten – Vegetativum • innere Organdurchblutung Noradrenalin • das „normale“ Adrenalin (Nebennierenhormon) – als Hormon • ausgeschüttet vom Nebennierenmark – als Neurotransmitter • Vegetativum – postganglionäre Synapsen des sympathischen Nervensystems • ZNS – produziert im Locus caeruleus („blauer Fleck“) der Medula • Rezeptoren siehe Adrenalin Adrenalin • Adrenozeptoren (Adrenalin und Noradrenalin) – metabotrop, 3 Familien mit 3-4 Subtypen • • • • 1: ZNS, Sympathikus, Urogenitaltrakt, Blutgefäße 2: prä- und postsynaptisch, peripher und zentral : Herz, glatte Muskulatur (Bronchien) unterschiedliche Affinitäten für Adrenalin/Noradrenalin – Noradrenalin bindet insgesamt schwächer, und kaum an -Rezeptor – als Hormon • ausgeschüttet vom Nebennierenmark – als Neurotransmitter: kaum (Hirnstamm) Serotonin • Biosynthese aus proteinogener Aminosäure Tryptophan • Gewebshormon – Vorkommen in Blutplättchen und Mastzellen • 19 verschiedene Rezeptoren bekannt (7 Familien) – – – – – Herz-Kreislauf-System Blutgerinnung Kontraktion und Relaxation von Blutgefäßen gastrointestinale Motilität LSD (Lysergsäurediethylamid) Einschub: Monoaminooxidase (MAO) • Mitchondrales Enzym • beteiligt am intrazellulären Abbau der Monoamintransmitter (nach re-uptake) – – – – Dopamin Noradrenalin Adrenalin Serotonin • Medikament: MAO-Hemmer – verstärken den Effekt von Monoamintransmittern Glutamat • Anion der proteinogenen Aminosäure Glutaminsäure • Aminosäurentransmitter allgemein: häufig – Konzentration im Gehirn Faktor 1000 höher als bei Monoamintransmittern • Rezeptoren: ionotrop und metabotrop – NMDA-Rezeptor • NMDA = (N-Methyl-D-Aspartat) = synthetischer Agonist von Glutamat • spannungs- und ligandengesteuert GABA • Aminosäure -Amino-Buttersäure (GABA) • wichtigster hemmender Transmitter des ZNS – bis zu 50% der hemmenden Synapsen des ZNS – re-uptake • GABAA und GABAC-Rezeptoren: ionotrop (Cl) • GABAB: metabotrop, – präsynaptisch: reduziert Ca2+-Eintrom – postsynaptisch: reduziert K+-Einstrom? • GABAA-Agonisten – Benzodiazepine, Barbiturate (Tranquilizer) Glycin • • • • • einfachste proteinogene Aminosäure inhibitorisch, re-uptake Rückenmark (Motoneurone) und Hirnstamm ionotroper Rezeptor (Cl-Kanal) Glycinantagonisten – Strychnin: Rezeptorblockade • überschießende Erregung der Muskulatur, Atmungsfunktion gestört – Tetanus: verhindert Freisetzung von GABA & Glycin • „Wundstarrkrampf“ Neuropeptide • Aminosäurenketten – Hormone – Kotransmitter • über 100 Peptide bekannt – CRH, ACTH – Neuropetid Y • Hunger, Angst, Magen-Darm-Motorik • 6 Rezeptoren Y1 – Y6 – Substanz P (Schmerzrezeptoren) – Endorphine (endogenes Morphin) Neurotransmitter • 1000 Sorten • jeder Transmitter kann mehrere Rezeptoren haben – die spezifischen Rezeptoren sind an unterschiedlichen Stellen im ZNS aktiv – die einzelnen Rezeptoren können unterschiedlich wirken, z. B. • prä- oder postsynaptisch (D2-Rezeptor bei Dopamin) • de- oder hyperpolarisierend (Muskarin-Rezeptor für ACh) • spannungs- und/oder ligandengesteuert (NMDA-Rezeptor) Neuronale Integration von Information • elektrotonische Weiterleitung des (inhibitorischen / exzitatorischen) postsynaptischen Potentials zum Axonhügel • räumliche Addition / Subtraktion (Konvergenz) ⇨ Aktionspotential? • zeitliche Summation (Potenzierung) – – – – an der Präsynapse (Ca2+ ) an der Postsynapse (echte „zeitliche Summation“)? „tetanische Potenzierung“ posttetanische Potenzierung: erhöhte Reizbarkeit Hemmung • präsynaptische Hemmung • laterale Hemmung zur Kontrastverschärfung