13. Thermodynamik der Transportvorgänge
Werbung

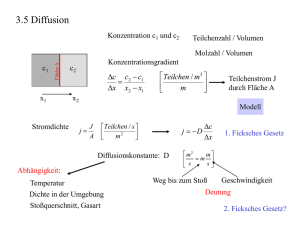
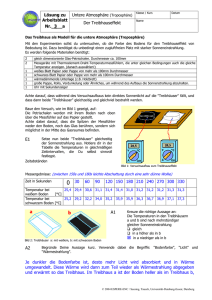
Thermodynamik der Transportvorgänge Péter Maróti Professor für Biophysik, Universität von Szeged, Ungarn. Lehrbücher: Biophysik für Mediziner (Herausgeber S. Damjanovich, J. Fidy und J. Szöllősi) Medicina, Budapest, 2008. Adam G., Läuger P., Stark G. Physikalische Chemie und Biophysik, Springer-Verlag, Berlin 1988. Fercher A.F. Medizinische Physik, Springer, Wien, New York 1992. Haas U. Physik für Pharmazeuten und Mediziner; Wissenschaftliche Verlagsgesellschaft mbH. Suttgart 2002. Jerrentrup A. Physik für Mediziner, Original-Prüfungsfragen mit Kommentar, Schwarze Reihe, 19. Auflage, Thieme Verlag Stuttgart 2009. Maróti P., Laczkó G.: Bevezetés a biofizikába, JATEPress, Szeged 1998 (Ungarisch) P. Maróti, L. Berkes, F. Tölgyesi: Biophysics Problems. A Textbook with Answers. Akadémiai Kiadó, Budapest 1998 (Englisch). Thermodynamik entwickelte sich zur Wärmelehre der Physik Wissenschaft der Gleichgewichte und Prozesse im System deren Teile in mehrseitigen energetischen Wechselwirkungen stehen. Die Hauptaufgaben der Thermodynamik - die thermodynamische Kräfte die durch die Wechselwirkungen entstehen und verschiedene Flüsse (Transport Prozesse) treiben, - die Sorte und Richtungen der Flüsse (Strömungen) thermodynamischer Grössen, - die Änderungen die durch die Wechselwirkungen entstehen zu beschreiben. Die Thermodynamik ist axiomatisch aufgebaut und ist anwendbar in sehr weiten Gebieten der Wissenschaft. Mit den 3 Grundgesetzen kann man das Verhalten sehr verschiedener (wie biologischen, gesellschaftlichen, ökonomischen, finanziellen usw.) Systeme beschreiben. System ändert sich nicht nach der Zeit im Gleichgewicht klassische Thermodynamik im stationären Zustand ändert sich nach der Zeit im Nichtgleichgewicht Transportpozesse im reaktieven Zustand Reaktionskinetik Diffusion Wärmeleitung Transport des Impulses usw. Diese Vorlesung diskutiert die Transportprozesse (makroskopische Waermeübergabe und mikroskopisches Membrantransport) und untersucht was sind (z.B. Kräfte, Flüsse) hinter der Szenen, was für eine Thermodynamik die Transporte in Bewegung setzt und hält. Die wichtigsten Potentialfunktionen der Thermodynamik Potentialfunktion Innere Energie Enthalpie Entropie Definition thermische Energie + chemische 1 U f kBT EBindung Bindungsenergie 2 H U p V dS dQrev T dS kB ln w Gibbs Energie (freie Enthalpie) Chemisches Potential Bemerkungen G H T S G nF Gesamtenergie eines System, das mit der Umwelt in mechanischer Wechselwirkung steht (isobar). Phenomenologische Definition (Clausius) Statistische Definition (Boltzmann) Maß für die „Unordnung”. Die maximale Energie, die dem System zur Verfügung stehen kann. Gesamtenergie (H) minus gebundene Energie (T·S). Die auf 1 mol bezogene Gibbs Energie (gemessen in volt). f: Freiheitsgrad, kB: Boltzmann-Konstante, Qrev: Wärmemenge aufgenommen aus einem Reservoir der Temperatur T durch einen reversiblen Prozess, w: thermodynamische Wahrscheinlichkeit, n: Molzahl, F Faraday-Konstante (zur Konversion Energie (joule) zu Potential (volt)) . Transportvorgänge Sir Isac Newton Jean Baptisto Joseph Fourier (1642-1727) (1768-1830) Adolf Egon Fick Lars Onsager (1829-1901) (1903-1976) Transportvorgang: extensive Zustandsgrößen (Substanz, Energie, Impuls, elektrische Ladung usw.) werden von einem Ort zum anderen gelangen. Die Träger Teilchen (Atome, Moleküle, Ionen) die Materie, Energie, Ladungen und Impuls mitbringen können Elektronen die Energie, Ladungen und Impuls mitbringen können Photonen die Energie tragen Jeder Transportvorgang wird von einer Inhomogenität ausgelöst und der Transport selbst soll einen homogenen Zustand erzielen. Transportvorgang: Prozesse für Ausgleichung Triebskräfte: Bestrebung zum Gleichgewicht Kraft der intensiven Größe zum Beispiel Physikalische Größe Gradient der Konzentration: dc/dx Konzentration: c Fluß der extensiven Größe zum Beispiel Stromstärke: I = dn/dt Stromdichte: J = dn/dt/dA Teilchenzahl: n Stromdichte des Komponents [mol/m2/s] Einheiten: Stromdichte der Energie [J/m2/s] Stromdichte des Impulses [kg/m/s2] Stromdichte der elektrischen Ladung [Coulomb/m2/s] Klassifizierung der Transportvorgänge Wechselwirkung materielle (chemische) Extensive Zustandsgröße, Was strömt? Stoffmenge Intensive Zustandsgröße Thermodynamische Kraft, X Stromdichte, J = L ·X Chemisches Potential, Konzentration Gradient des chemischen Potentials, Gradient der Konzentration J D dc dx dT dx thermische Wärmemenge Energie Temperatur Gradient der Temperatur J mechanische Volumen Druck Gradient des Druckes R 2 dp J 8 dx mechanische Impuls Strömungsgeschwindigkeit Gradient der Strömungsgeschwindigkeit J Elektrisches Potential Gradient des elektrischen Potentials J elektrische Elektrische Ladung Gesetz Fick Fourier HagenPoiseuille dv dx Newton 1 dU dx Ohm Verschiedene Type des (Wärme)Transports Konvektiver Transport der Stoffe (Wärme): Gemeinsame Bewegung des Haufens der Moleküle Konduktiver Transport der Stoffe (Wärme): Bewegung der Moleküle im ruhenden Medium Transport durch Leitung Grenzfläche Transport durch Übergabe Wärmetransport durch Wärmeleitung Die Wärmeleitung ist die Übertragung von Wärme durch molekulare Anregung innerhalb eines Materials ohne jegliche Bewegung des Materials als Gesamtkörper. Sie ist die Hauptart von Wärmeübertragung in Feststoffen. Wenn die Temperatur eines Festkörpers an verschiedenen Stellen unterschiedlich ist, wird Wärme von Stellen mit höherer Temperatur an Stellen mit niedrigerer Temperatur übertragen. Die Wärmestromdichte ist proportional dem Temperaturgefälle und folgt seiner Richtung: Stationäre Wärmeleitung J = - λ·dT/dx T λ : Wärmeleitfähigkeit in W/(m·K) x Hohe λ: guter Wärmeleiter Geringe λ: schlechter Wärmeleiter Nichtstationäre Wärmeleitung Fourier‘sches Gesetz der Wärmeleitung: J ∂T/∂t = -a·∂2T/∂x2 Dabei ist a = λ/ρc die Temperaturleitfähigkeit in m2/s. Sie ist eine Stoffkonstante und stellt ein Maß für die Geschwindigkeit des Temperaturausgleichs dar. Wärmetransport durch Konvektion Konvektionsrohr Die Konvektion ist die Wärmeübertragung durch bewegte Flüssigkeiten oder Gase. Sie ist die Hauptart von Wärmeübertragung zwischen Feststoffflächen und angrenzenden Flüssigkeiten (Gasen). Die Teilchen der Flüssigkeit oder Gase wirken als Träger thermischer Energie. warme Luft Wärmetransport durch Wärmestrahlung Die Wärmestrahlung ist die Wärmeübertragung durch elektromagnetische Wellen. Im Gegensatz zu Wärmeleitung und Konvektion erfordert die Wärmestrahlung kein Medium, da sich elektromagnetische Wellen auch im Vakuum fortbewegen können. Das Gesamtemissionsvermögen wird durch das Stefan-Boltzmann’sche Gesetz beschrieben: P ist die ausgestrahlte Leistung (Wärmeenergie/Zeit) des Körpers mit Oberfläche A und Temperature T, ε ist der Absorptionsgrad, ε = 1 für einen perfekten schwarzen Körper, sonst kleiner, Strahlendes Haus Strahlender Körper Wärmestrahlung Aus der Planckschen Strahlungsformel folgt: 1. Die Wärmestrahlung umfaßt ein breites Spektrum von Wellenlängen. 2. Strahlungsintensität: a) die gesamte Wärmestrahlung eines schwarzen Körpers bei der Temperatur T ist proportional zur vierten Potenz der Temperatur: Jgesamt = σ·T 4. b) Die Strahlungsintensität beim Maximum ist proportional zur fünften Potenz der Temperatur: Jmax = σ’·T 5 (σ’ ist eine Konstante). 3. Wiensche Verschiebungsgesetz: Das Produkt aus der Wellenlänge λmax des Maximums und der Temperatur T des schwarzen Körpers ist eine Konstante: λmax·T = 2898 μm·K 4. Die dominierende Wellenlänge der Wärmestrahlung des menschlichen Körpers ist λmax = 2889 μm·K / 310 K = 9,35 μm ≈ 10 μm Der Mensch strahlt (schwarz idealisiert) mit 2.5 m2 Oberfläche bei T = 32 oC an einem Frosttag T = 0 oC 440 W ab. Kleidung vor allem helle Kleidung vermindere ε von 100% auf 50%, dann sind es nur noch 220 W. Diese Leistung gehört zum Grundumsatz und muss auch bei absoluter Arbeitsfaulheit vom Körper aufgebracht werden. Infrarot- Thermographie Die Temperaturzustände des menschlichen Körpers lassen sich mit Infrarot-Thermographie genau untersuchen. Das menschliche Wärmestrahlung (Wärmefeld) wird mit extrem feinen Temperaturmessungen in Bildern dargestellt. Strukturveränderungen und Funktions-störungen verändern die lokale Stoffwechsel-situation und damit die Durchblutung. Bei der überwiegenden Mehrzahl der Fälle von Brustkrebs treten gleichzeitig Änderungen des Wärmemusters in der Brust auf. Gefäßneubildungen können in der weiblichen Brust in einem frühen Stadium der Tumorentstehung beobachtet werden. Eine verstärkte oder eine eingeschränkte Durchblutung ergibt ein typisches thermisches Muster. Bei Gefäßveränderung (wie Arterienverkalkung) werden die Schlagadern zunehmend enger und steifer, das Blut kann nicht mehr optimal transportiert werden. Verengungen der Halsschlagader im Wärmebild kann man früh erkennen. Als frühes Warnzeichen der Arteriosklerose gelten die Veränderungen der Halsschlagader. Transportarten: Wärmeleitung, Wärmeströmung und Wärmestrahlung treten gemeinsam auf Vereinigte Gleichung: J = Λ·ΔT Λ: verallgemeinerte Wärmeleitfähigkeit ΔT = T - TU Bei allen Wärmetransportarten ist die Wärmestromdichte (J) proportional zu der Temperaturdifferenz zwischen des Körpers (T) und der Umgebung (TU). J ~ ΔT J ~ ΔT J ~ ΔT Nach StefanBoltzmann’sches Gesetz: J ~ T 4 TU4 T 2 TU2 T 2 TU2 T TU T TU T 2 TU2 ~ T wenn T ist sehr nah zum TU (T≈TU), dann die zweite und dritte Glieder des Produktes kann man als Konstante annehmen (4·TU3), was nicht von T abhängt. Newton’sches Abkühlungsgesetz Nichtstationäre Wärmeleitung. Wir interessieren uns für den zeitlichen Verlauf der Temperatur T eines Körpers mit Masse m und spezifischer Wärmekapazität c, der mit der Umgebung in wärmeleitendem Kontakt (Leitung, Konvektion und Strahlung) steht. Der Körper habe anfangs die Temperature T0, die Umgebung hat die konstante Temperatur TU. Es wird eine Wärme(Energie)menge ΔQ innerhalb Zeitinterval Δt von dem Körperfläche A in die Umgebung stattfinden, was den Körper ΔT abkühlt: (Q J A t ) A (T TU ) t c m T Der vom Körper abgegebene Wärmestrom ist proportional zur Temperaturdifferenz zwischen Körper und Umgebung. Bei konstanter Wärmekapazität gilt dies auch für die Abkühlgeschwindigkeit: T TU (T0 TU ) e k t T A (T TU ) t cm dT A (T TU ) dt cm =k Die Temperatur des Körpers T nähert sich asymptotisch der Umgebungstemperatur TU. Nach der Zeitspanne 1/k ist die Temperaturdifferenz zur Umgebung auf den Bruchteil (T0-TU)/e ≈ 0.37· (T0-TU) abgesunken. 1/k heißt deshalb thermische Relaxationszeit was vom Verhältnis V/A (Volumen zu Fläche) des Körpers abhängt. Beispiel: Bestimmung des Todeszeitpunktes Annahmen: Leichnam wird zum Zeitpunkt t = 0 gefunden und seine Temperatur wird gemessen: T0 = (273 + 29,4) K die Temperatur der Umgebung ist konstant: T = (273 + 20) K die Körpertemperatur zu Todeszeitpunkt beträgt Td = (273 + 37) K die Temperature der Leiche nach t1 = 2h ist T1 = (273 + 23,3) K 1. Abkühlungsrate (Wärmekoeffizienten) bestimmen: k 1 T1 T ln t1 T0 T k 1 23,3 20 ln 0,523 h 1 2 h 29,4 20 2. Zeitpunkt des Todes bestimmen 1 T T td ln d k T0 T td 1 37 20 ln h 1,129 h 0,523 29,4 20 Somit wissen wir, dass der Mensch vor 1h 8‘ gestorben ist. Entwärmung des Körpers Der Körper muss die jeweils anfallende, chemisch und physikalisch produzierte Wärme abgeben. Der Körper kann sich entwärmen: 1. durch Strahlung Der Wärmetausch erfolgt in der Natur hauptsächlich durch Strahlung. Bei der üblichen Raumtemperatur von 20-22°C entwärmt sich der Körper überwiegend durch Strahlung (~ 50%) und (trotz der Kleidung) in Richtung kalter Mauern und von außen gekühlter Fenster. Die Entwärmung durch Strahlung wirkt sympathikoton, verhindert insbesonders die Entspannung der glatten Gefäßmuskulatur und steigert den Blutdruck gegenüber der konvektiven Entwärmung. Die strahlende Entwärmung hemmt überdies den Abbau der Transmitterstoffe. 2. durch Konvektion und Leitung (kurz: konvektive Entwärmung) 3. durch Verdunstung und Schweiß (kurz: feuchte Entwärmung) Entwärmung des Körpers durch Verdunstung und Schweiß Bei der Verdunstung von 1 g Wasser werden 580 Kalorien (2,42 kJ) verbraucht. Bei üblichen Raumtemperaturen verdunstet täglich der Körper über Haut und Schleimhäute in Ruhe etwa 500 g Wasser, bei Arbeit auch das Vielfache. Die für die Verdunstung erforderliche Wärme wird zum Teil vom Körper aufgenommen. Bei vermehrter Perspiratio insensibilis entsteht unter der Kleidung ein höherer Dampfdruck, der die Verdunstung hemmt und dann Wärmeregulation und Kreislauf belastet. Bei Hitze ist zur Entwärmung eine 20fache Steigerung des Hautdurchflusses nötig und auch möglich, da der Muskeldurchfluss möglichst klein gehalten wird (Sauna). Hitze schädigt die Gefäße und die Enzyme. Die Äquivalenttemperatur 49 °C ist ein allgemein gültiger Grenzwert der Behaglichkeit, sie errechnet sich aus der Lufttemperatur plus 2mal Dampfdruck (geeicht zu Temperatur). Wärmehaushalt des Menschens An der Steuerung des Wärmehaushalts des Menschen sind Thermorezeptoren in zwei verschiedenen Körperbereichen beteiligt: Kaltrezeptoren in der gesamten Haut und Warmrezeptoren im Temperaturregelzentrum im vorderen Stammhirn. Thermische Behaglichkeit stellt sich ein, wenn weder die Hauttemperatur unter etwa 34 oC noch die Kerntemperatur über rund 37 oC liegt. Tätigkeit Leitung und Verdampfung Konvektion Respiration Strahlung Lesen (bei 21 oC) 68% 10% 2% 20% Sonnenbad (32 oC) 10% 80% 2% 8% Wandern (-18 oC) 50% 2% 40% 8% Durchschnittswerte der relativen Wärmeabgabe beim Menschen (nach J.A. Pope, 1984) Beispiele zur Steuerung des Wärmehaushalts des Menschen 1. Die Verdampfungsenthalpie des Wasserdampfs in der ausgeatmeten Luft is Δm / Δt ≈ 10 g pro Stunde und bedeutet Wärmeabgabe. Die hierdurch bedingte mittlere, auf die Zeit bezogene Wärmeabgabe ΔQ / Δt beträgt ΔQ / Δt = 10 g·2400 kJ/kg /3600 s = 6,7 W 2. Die Lufttemperatur in einer Sauna liegt in der Regel über der Körpertemperatur. Wärmeabgabe ist dann nur durch Verdampfen von Wasser durch Schwitzen und durch die Atmung möglich. Zum Abtransport der im Körper durch den Grundumsatz von P = 100 W innerhalb Δt = 1 Stunde erzeugten Wärmemenge erforderliche Flüssigkeitsmasse ist m = 0,15 kg. In Wirklichkeit muß erheblich mehr Wärme abgeführt werden, weil das Schwitzen dem Kreislauf eine ganz erhebliche Leistungssteigerung weit über den Grundumsatz hinaus abverlangt. Hinzu kommt noch die dem Körper von der heißen Luft übertragene Wärmemenge. Entsprechend größer ist auch der Flüssigkeitsverlust. 3. Die Wirkung der Bekleidung beruft darauf, daß in den Textilien und Pelzen kleine Lufträume eingeschlossen sind. Dadurch kann Wärme vom Körper im Idealfall nur per Wärmeleitung über die schlecht leitende Luft bzw. Textilstoffe abfließen. Konvektion und Wärmestrahlung werden weitgehend blockiert. Behaglichkeit: Temperatur-Feuchte-Diagramm Die Verdampfungsrate dm/dt des Wassers und damit die Geschwindigkeit des Wärmetransports dQ/dt, also der Kühleffekt, sind indirekt proportional zur Luftfeuchtigkeit. So kann der Mensch bei 0% relativer Luftfeuchtigkeit Lufttemperaturen bis 120 oC ertragen, vorausgesetzt, er kann durch genügende Flüssigkeitsaufnahme hinreichend schwitzen und dieser Vorgang wird nicht durch die Kleidung behindert. Im Gegensatz hierzu kann man schon eine Temperatur von 48 oC bei 100% relativer Luftfeuchtigkeit nur wenige Minuten lang überleben. Empirische Grenzen der Behaglichkeit, Schwüle (Wärmebelastung), ohne Berücksichtigung des Windes. Cytoplasma Extrazellulärer Raum Biologische Membranen Singer-Nicolson Modell (1972): mosaikartig aus Lipiden und Proteinen zusammengesetzte Doppelschicht (Film). Die Proteine können entweder an die Jede Zelle ist einer etwa 10 nm dicken Oberfläche der Membran gebunden (periphere Membran, der Plasmamembran, Proteine) oder in die Lipiddoppelschicht eingelagert umgeben, die im Elektronenmikroskop dargestellt werden kann. Die Funktion der sein (integrale Proteine). Die integrale Membranproteine dringen die Membran ganz durch, wobei der Plasmamembran: zentrale Teil des Proteins hydrophob, die äußeren - passives Barrier, Teile aber hydrophil sind. - eingebaute Transportsysteme und - räumliche (asymmetrische) Orientierung Lipid-draft Modell. Manche Proteine sind mit dem Cytoskelett verbunden und daher nicht frei diffusibel. der funktionellen Moleküle. Thermodynamik des Transports der Substanze durch Membranen Gibbs (freie) Energie (G) von 1 mol Stoffmenge bzw. elektrochemisches Potential (μ) des Teilchens (Ions) in wäßriger Lösung: Einheiten: G G R T ln a p V Z F g h Joule (J) RT pV gh ln a Z F F F Volt (V) Wasserpotential Membranpotential Osmose Standard 0 Entropie (Konzentration) 0 G0 Standard Gibbs Energie, R universelle Gaskonstante, T temperatur, a (=γ∙c) Aktivität des Teilchens (c Konzentration, γ = 1 für verdünnte Lösung (c < 10 mM) und γ → 0 für konzentrierte Lösung (c > 100 mM)), p Druck, V (spezifisches) Volumen von 1 mol Stoffmenge, Z Wertigkeit des Ions, F Faraday-Konstante, φ elektrisches Potential, g Erdbeschleunigung, h Höhe relative zur Bezugsebene (z.B. Erdoberfläche). Thermodynamik des Transports durch Membranen: Energetische Bedingung des aktiven bzw. passiven Transports Entscheidend ist die Größe der Differenz ΔG = Gaus – Gein, welche den Aufwand an Gibbs-Energie beim Transport von Lösung „aus” nach Lösung „ein” angibt. (G)Transport Gaus Gein RT aaus ln Z (aus ein ) F aein Aktiver Transport einer Substanz entgegen dem Gefälle der Gibbs-Energie Vom Vorzeichen von ΔG hängt es ab, ob es sich bei einem gegebenen Transportprozess um einen aktiven oder passiven Transport handelt. Da wir vereinbarungsgemäß einen Fluß positiv zählen, wenn er von „aus” nach „ein” gerichtet ist, gilt J (G)Transport 0 aktiver Transport J (G)Transport 0 passiver Transport Gaus RT G ln aaus Zaus F 0 Gein RT G ln aein Zein F 0 Bei verdünnten Lösungen kann die Aktivität a durch die Konzentration c ersetzt werden. Beispiel:Cotransport von Glucose und Na+ in Epithelzellen des Dünndarms Der aktive Transport ist definiert als Transport von kleiner auf große Aktivität (Konzentration). Für sich allein genommen wäre ein solcher Prozeß thermodynamisch unmöglich. Er kann nur dann ablaufen, wenn der Transport an einen zweiten, energieliefernden Prozeß gekoppelt werden kann, so daß der Gesamtvorgang mit einer Abnahme der Gibbs (freien) Energie verbunden ist. Als ein einfaches Beispiel wird der Cotransport von Na+ mit Glucose presentiert. Die Epithelzellen des Dünndarms akkumulieren Glucose aus dem Darmlumen entgegen einem Konzentrationsgradienten. Dieser Glucosetransport ist an einen Na+-Transport vom Lumen ins Zellinnere gekoppelt. Na+ geht dabei von hohem auf niedriges elektrochemisches Potential über; die dabei zur Verfügung gestellte Gibbs (freie) Energie wird für die Glucoseakkumulation ausgenützt. Cotransport von Glucose und Na+ in Epithelzellen des Dünndarms Da der Gesamtvorgang spontan abläuft: JG GG J Na GNa 0 Unter der Annahme, daß die Kopplung vollständig ist und daß pro Glucosemolekül ein (1) Na+-Ion transportiert wird, gilt: JG J Na 0 so daß sich die erste Gleichung reduziert auf: GG GNa 0 Bezeichnet man die Außenphase mit dem Index a, die Innenphase mit dem Index i, so erhalten wir die Form: a i a i GG GG (GNa GNa ) Ersetzt man näherungsweise die Aktivitäten RT [G]a RT [ Na]a durch die Konzentrationen und ln ln (a i) berücksichtigt, daß das Glucosemolekül F [G]i F [ Na]i neutral (Z = 0) ist, so ergibt: und weiter, da ln x > ln y gleichbedeutend mit x > y ist: [G]i [ Na]a e [G]a [ Na]i F (i a ) RT Cotransport von Glucose und Na+ in Epithelzellen des Dünndarms F (i a ) [ Na]a RT e [G]i [G]a [ Na]i Die Gleichung gibt das bei gegebenen Na+-Konzentrationen und gegebenem Membranpotential maximal mögliche Anreicherungsverhältnis für Glucose an. Beispiel: Bei [Na+]a/[Na+]i = 10 und φi – φa = -60 mV kann Glucose bis zu einem Konzentrationsverhältnis von maximal im Zellinnern angereichert werden. Bei nicht vollständiger [G ]i 100 Kopplung wird dieser Wert unterschritten. [G ] a Ein möglicher Transportmechanismus besteht in einem Carrier (C), der je eine Bindungsstelle für Na+ und für Glucose (G) besitzt. Eine Kopplung zwischen Glucose- und Na+-Fluß kann dadurch zustande kommen, daß der Carrier nur dann mit Glucose durch die Membran treten kann, wenn er gleichzeitig auch Na+ gebunden hat. Die einheitliche Beschreibung der Transportvorgänge: die lineare Beziehung von Onsager Bei manchen irreversiblen Prozessen besteht zwischen der Stromdichte der fließenden extensiven Zustandsgröße (J) und der thermodynamischen Kraft (X) ein linearer Zusammenhang: Kraft: der Gradient der (zu der J L X gegebenen extensiven Zustandsgröße gehörenden) intensiven Zustandsgröße, welche den Strom verursacht. wo L der sog. Leitfaktor ist. Treten zwei Flüsse und zwei Kräfte auf, so beobachtet man überlagerte Erscheinungen oder einen Kreuzeffekt: J1 L11 X1 L12 X 2 J 2 L21 X1 L22 X 2 Wenn es mehrere Flüsse Ji gibt, die durch die Kräfte Xi ausgelöst werden, und diese Flüsse sind unabhängig voneinander, so lassen sich die Phänomene durch eine Anzahl von linear Gleichungen beschreiben: J L X L X ... L X 1 11 1 12 2 1n n J 2 L21 X1 L22 X 2 ... L2 n X n J n Ln1 X1 Ln 2 X 2 ... Lnn X n Reziprozitätsprinzip von Onsager J1 L11 X1 L12 X 2 ... L1n X n J 2 L21 X1 L22 X 2 ... L2 n X n J n Ln1 X1 Ln 2 X 2 ... Lnn X n Die Koeffizienten (Leitfaktore) Lij beschreiben die Kopplung oder die Wechselwirkung zwischen den Prozessen. Lineare Koeffizienten L11, L22, ..., Lnn verbinden die einander entsprechenden Zustandsgrößen (J1 und X1, J2 und X2, ..., Jn und Xn) Kreuzkoeffizienten L12, L21,... verbinden die nicht zusammengehörigen Zustandsgrößen (J1 und X2, J2 und X1,...) Falls die verallgemeinerten Kräfte so gewählt werden, dass die Beziehung T dSi J1 X1 J 2 X 2 ... J n X n dt erfüllt ist, d.h., die Summe der aus den jeweiligen Flüssen Ji und Kräfte Xi gebildeten Produkte muß gleich dem Produkt aus der absoluten Temperatur T und der Entropieproduktion dSi/dt sein, dann gilt das Reziprozitätsprinzip von Onsager: L i j L ji Die reziproken Beziehungen basieren auf dem Prinzip der mikroskopischen Reversibilität, was besagt, dass im Gleichgewicht der chemischen Reaktionen von jeder Molekülart genausoviel gebildet wird wie verschwindet. Beispiel: Anwendung der Onsager Beziehungen; gekoppelte Reaktion des Elektrontransports und der Phosphorylation in Synthesis/Hydrolysis von ATP Die Bedingungen für thermodynamisches Gleichgewicht sind in chemischen Reaktionen der biologischen Zellen oder Organismen nie völlig erfüllt, weil die Prozesse (stark oder leicht) gekoppelt sind. Das Produkt einer Reaktion wird die Reaktant der folgenden Reaktion. Wenn wir immer in der Nähe des Gleichgewichts bleiben, dann die Onsager linear Gleichungen sind gültig für die irreversiblen Prozesse. Die verallgemeinerte Kraft wird der negative Wert der entsprechenden Gibbs Energie: Xi ≡ -ΔGi. Benutzen wir die phenomenologischen Gleichungen zur thermodynamischen Beschreibung der gekoppelten Reaktionen des Transfers der Elektronen (e) und der oxidativen Phosphorylation (p) in Mitochondria! J e Le Ge Lep G p J p L pe Ge L p G p Die Gültigkeit der Linearität und der Reziprozität ist bei oxidativen Phosphorylation experimentell bewiesen. Protontransfer ΔGproton pH ~ 5 ΔGelektron Elektrontransfer Elektrochemisches Membranpotential des Protons Rotierende ATP-Synthase in Mitochondria pH ~ 7 ΔGphosphorylation ADP + Pi ATP Phosphorylation Anwendung der Onsager Beziehungen: gekoppelte Reaktion des Elektrontransports und der Phosphorylation in Synthesis/Hydrolysis von ATP Zwei spezielle Bedingungen kann man einstellen: - Strömung in der selben Höhe („level flow”): ΔGp = 0 (kein Gegendruck durch ΔGp) (großer Gegendruck durch ΔGp) Zwei nützliche Definitionen: q Lep Le L p Das System ist völlig gekoppelt, wenn q = 1 und gar nicht gekoppelt, wenn q = 0. Die phenomenologische Stoichiometrie: Je L pe Le Lp Ge G p L pe - Hydrostatischer Fall („static head”): Jp = 0 Die Kopplung in System der zwei Flüsse: Jp Z Lp Le Die zwei speziellen Bedingungen kann man mit diesen neuen physikalischen Größen umformen: „level flow”: ΔGp = 0 „static head”: Jp = 0 Jp Je qZ Ge Z G p q Im allgemeinen Fall (d.h., zwischen den beiden Grenzfällen (level flow und static flow)) Jp Je qZ Z 1 qZ G p Ge G p Ge Praktische numerische Werte: Z ist die Stoichiometrie der ATP Synthese bei voller Kopplung (q = 1). In Mitochondria mit NAD-koppelten Substrat, Z ≈ 3. Hausaufgaben 1) Die Verdamfpungsenthalpy des Wasserdampfs in der ausgeatmeten Luft (Δm/ Δt etwa 10 g pro Stunde) bedeutet Wärmeabgabe. Wie groß ist die hierdurch mittlere, auf die Zeit bezogene Leistung der Wärmeabgabe ΔQ/ Δt (in Watt)? 2) Auch der menschliche Körper gibt Wärme in Form von Wärmestrahlung ab. Was ist die Wellenlänge dieser Strahlung? 3) Um welchen Faktor nimmt die Intensität des Strahlungsmaximums der vom Körper abgestrahlten Wärmestrahlung bei einer Temperatursteigerung von 36 oC auf 37 oC zu? 4) Die unmerkliche Wasserverdunstung macht in unseren Breiten etwa 300 g pro Tag aus. Berechnen Sie die hiermit verbundene Wärmeabgabeleistung ΔQ/ Δt. 5) Berechnen Sie den Flüssigkeitverlust je 1 km beim langsamen Gehen (Wärmeleistung etwa 200 W) bei 37 oC Umgebungstemperatur. 6) Bestimmen Sie den vom unbekleideten menschlichen Körper (Oberfläche 1,5 m2) abgestrahlten Wärmestrom ΔQ/ Δt bei Umgebungstemperatur 20 oC. Bei den infrage kommenden Wellenlängen um 10 μm ist die Körperoberfläche praktisch schwarz. Hausaufgaben 7) Der Hausherr holt eine Flasche Bier aus seinem 7 Grad Kühlschrank, in dem sie schon zwei Tage steht. Er hat sie noch nicht geöffnet, da stürzt ein Gast ins Haus und verstrickt ihn ganze 90 Minuten lang in eine hitzige Diskussion. All das spielt sich in dem Wohnzimmer ab, das der energiebewusste Hausherr auf der heroischen Temperatur von 19 Grad hält. Den Hausherrn schwant, dass sein vereinsamtes Bier zu warm werden wird. Kaum hat der Gast die Haustür zugeschlagen, misst der Hausherr die Temperatur des Gerstensaftes und stellt eine betrübliche Überhitzung desselben auf 15 Grad fest. Da er, wie jeder passionierter Biertrinker, das Newtonsche Abkühlungsgesetz kennt, schließt er daraus, dass er dieses Bier etwa 3 Stunden lang in einem Kühlschrank stellen muss, um es auf annehmbare 8 Grad zu bringen. Hat er recht? 8) Wann ist der Kaffee kühler? 1. Der Kaffee kühlt zunächst 10 Minuten ab und die Milch wird dann hinzugeben, oder 2. Die Milch wird sofort in den Kaffee geschüttet und die Mischung kühlt dann 10 Minuten ab. Die Temperatur der Milch ist geringer als die Zimmertemperatur (=Umgebungstemperatur).