Vorlesung 16
Werbung

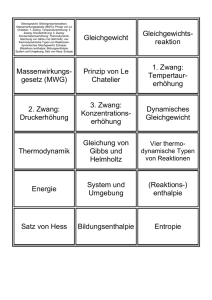
Einführung in die Physik I Wärmelehre/Thermodynamik Wintersemester 2007 Vladimir Dyakonov #16 am 02.02.2007 Folien im PDF Format unter: http://www.physik.uni-wuerzburg.de/EP6/teaching.html Raum E143, Tel. 888-5875, eMail: [email protected] 10.11 Wärmestrahlung Strahlungsleistung des schwarzen Körpers Emission des schwarzen Körpers kann durch spektrale Energiedichte ρ(ν,T)dν beschrieben werden. (Energie des Strahlungsfeldes pro Volumen und pro Frequenzintervall) 6000 K ρ (υ , T )dυ = 8πhυ 3 / c 3 1 e hυ / kT −1 dυ Planck’sches Strahlungsgesetz 5000 K 4000 K 3000 K h ist das Planck´sche Wirkungsquantum h = 6.626 10-34 Js . . 1014 Hz 1 10.11 Wärmestrahlung Strahlungsleistung des schwarzen Körpers Fragen: 1.Wie viel Licht wird bei einer bestimmten Frequenz emittiert ? 2. Wie viel Lichtenergie wird insgesamt abgestrahlt? Man betrachte einen kubusförmigen Hohlraum des Volumens V, welcher EMHohlraumstrahlung im thermischen Gleichgewicht enthält. Es können sich nur stehende Wellen ausbilden (d.h. zwischen 2 gegenüberliegende Hohlraumflächen passt jeweils eine ganzzahlige Anzahl von Halbwellen). 10.11 Wärmestrahlung Strahlungsleistung des schwarzen Körpers Welche Eigenmoden besitzt der Resonator ? je kürzer die Wellenlänge umso höher die Frequenz (Energie) Farbe des Lichtes ändert sich von rot über gelb, grün nach blau 2 10.11 Wärmestrahlung Strahlungsleistung des schwarzen Körpers Es sind also nur bestimmte diskrete Schwingungszustände (=Moden) erlaubt; die gesamte Hohlraumstrahlung setzt sich aus diesen stehenden Wellen zusammen. Im Frequenzintervall zwischen ν und ν + dν gibt es insgesamt 8πν 2 Vdν c3 erlaubte Schwingungszustände. 10.11 Wärmestrahlung Strahlungsleistung des schwarzen Körpers Die Anzahl erlaubter Schwingungszustände nimmt bei höheren Frequenzen zu, weil es für Wellen mit kürzerer Wellenlänge mehr Möglichkeiten gibt, sich so in den Hohlraum einzupassen. Die Zustandsdichte, das heißt die Anzahl erlaubter Schwingungszustände im Frequenzintervall zwischen ν und ν + dν und pro Volumeneinheit, ist 8πν 2 dν c3 Nach dem Gleichverteilungssatz der klassischen Thermodynamik zu erwarten, dass im thermischen Gleichgewicht bei der Temperatur T im Mittel jeder dieser Oszillatoren die kinetische Energie kT/2 und die potentielle Energie kT/2, also insgesamt die Energie kT trägt. Die Energiedichte der Hohlraumstrahlung im Frequenzintervall zwischen ν und ν + dν wäre demnach ρ (v, T )dv = 8πν 2 kTdν c3 Dies ist das Strahlungsgesetz nach Rayleigh-Jeans. 3 10.11 Wärmestrahlung Strahlungsleistung des schwarzen Körpers Nach der von Planck eingeführten Quantenhypothese kann ein Oszillator der Frequenz ν jedoch nur ganzzahlige Vielfache der Energie hν aufnehmen Schwingungszustände, deren Mindestenergie hν deutlich über der thermisch zur Verfügung gestellten Energie kT liegen, können nicht angeregt werden Schwingungszustände, deren Mindestenergie wenig über kT liegt, können mit gewisser Wahrscheinlichkeit angeregt werden, so dass von ihnen ein bestimmter Bruchteil zur gesamten Hohlraumstrahlung beiträgt. Lediglich Schwingungszustände mit niedriger Mindestenergie hν, also kleineren Frequenzen, können die angebotene thermische Energie vollständig aufnehmen und werden (im Mittel) mit Sicherheit angeregt. Die statistische Thermodynamik zeigt, dass unter diesen Bedingungen ein Schwingungszustand der Frequenz ν im Mittel die Energie hν e trägt. hv ( ) kT −1 10.11 Wärmetransport Grenzfälle des Planck‘schen Strahlungsgesetzes ρ (υ , T )dυ = 8πhυ 3 / c 3 1 e hυ / kT −1 dυ Planck’sches Strahlungsgesetz 1. Grenzfall: hν << kT: e x ≈1+ x, (x << 1) 2. Grenzfall: hν >> kT: ex >> 1 hν 8πν 2 ρ (ν ) dν ≈ 3 kT dν c 8π hν 3 − kT ρ (ν ) dν ≈ ⋅e dν c3 Bei kleinen Frequenzen ist das Plancksche Strahlungsgesetz gut genähert durch das Rayleigh-Jeans-Gesetz Bei hohen Frequenzen nimmt die Energiedichte exponentiell mit der Frequenz ab 4 10.11 Wärmestrahlung Emissionsmaximum Das Maximum der emittierten Strahlung verschiebt sich mit steigender Temperatur zu höheren Frequenzen (zu kürzeren Wellenlängen). Berechnung des Frequenzmaximums liefert das Wiensche Verschiebungsgesetz ν max = 5.88 ⋅ 1010 Hz ⋅T K Verschiebung 6000 K 5000 K 4000 K Wilhelm Wien (1864–1928) 3000 K 1900 – 1920: Professor für Physik, Würzburg, Nobelpreis 1911 1014 Hz 10.11 Wärmestrahlung Gesamtemission des „Schwarzen Strahlers“ Mit steigender Temperatur wächst die Fläche unter der Kurve im Planckschen Strahlungsgesetz stark an. Integration über alle Frequenzen liefert die emittierte Gesamtleistungsdichte: ⎡ W ⎤ ⎢ m 2 ⎥; ⎣ ⎦ σ = 5 . 670 51 ⋅ 10 − 8 P = σ T Stefan-Boltzmann-Gesetz: 4 [ m W 2 K 4 ] Abgestrahlte Leistung nimmt mit der 4. Potenz der Temperatur zu. 6000 K 3000 K 3000 K 1014 Hz 1014 Hz 5 10.11 Wärmestrahlung Strahlungsleistung des schwarzen Körpers Emission des schwarzen Körpers kann durch spektrale Energiedichte ρ(ν,T)dν beschrieben werden. (Energie des Strahlungsfeldes pro Volumen und pro Frequenzintervall) 6000 K ρ (υ , T )dυ = 8πhυ 3 / c 3 1 e hυ / kT −1 dυ Planck’sches Strahlungsgesetz 5000 K 4000 K 3000 K h ist das Planck´sche Wirkungsquantum h = 6.626 10-34 Js . . 1014 Hz 10.11 Wärmestrahlung Infrarotthermographie Infrarotbereich 6 10.11 Wärmestrahlung Versuch: Messung der Wärmestrahlung mit der Thermosäule • Bei der Thermosäule wird über eine Absorberfläche Strahlung in Wärme umgewandelt. • In unmittelbarem Kontakt zur Absorberfläche sind Thermoelementepaare angeordnet. • Die Erwärmung des Absorber führt zur Ausgabe einer Thermospannung. • Der Absorber sollte geringen thermischen Widerstand haben, um die Wärme ohne Verluste weiter zu leiten. (Wärmeleistung) 10.12 Thermodynamische Potentiale Thermodynamisches Gleichgewicht Ein System ist im Gleichgewicht, wenn sich zeitlich nichts mehr ändert. Def: Ein abgeschlossenes System ist im thermodynamischen Gleichgewicht, wenn seine Entropie maximal ist. Das System befindet sich in seinem wahrscheinlichsten Zustand. Abgesehen von Fluktuationen geht das System nicht von alleine in einen sehr viel unwahrscheinlicheren Zustand (wäre eine Abnahme der Entropie). Zwei in Verbindung stehende Systeme: S1 S2 Die Entropie des Gesamtsystems ist: S = S1 + S 2 7 Beide System sind im Gleichgewicht miteinander, wenn d S = d S1 + d S 2 = 0 Im Maximum ist die Änderung Null Solange kein Gleichgewicht herrscht laufen Prozesse von selbst ab, bei denen d S = d S1 + d S 2 ≥ 0 Prozesse in Richtung Maximum der Entropie Mit dem 1. Hauptsatz dU = δ Q + δ W erhält man dU − T d S = δ W Das ist die maximale Arbeit, die ein System um Ungleichgewicht leisten kann. Man definiert die Freie Energie F =U −T S 71 Die Freie Energie ist ein s.g. Thermodynamisches Potential man definiert weitere Potentiale: Enthalpie: H = U + pV Gibbs-freie Enthalpie: G = U + pV − T S Auch die Innere Energie U ist ein thermodynamisches Potential. Mit diesen Definitionen lassen sich Gleichgewichtsbedingungen unter verschiedenen Bedingungen angeben: 72 8 T = const, V = const. Gleichgewicht herrscht, wenn: d F = dU − T d S = 0 Minimum der freien Energie T = const, p = const. Gleichgewicht herrscht, wenn dG = dU + p dV − T d S = 0 Minimum der Gibbs freien Enthalpie p = const und adiabatisch. Gleichgewicht herrscht, wenn d H = dU + p dV = 0 Minimum der Enthalpie V = const und adiabatisch. Gleichgewicht herrscht, wenn dU = 0 Minimum der inneren Energie Diese Bedingungen haben weitreichende Aussagekraft: Chemische Reaktionen laufen z.B. spontan ab wenn dG > 0 (freie Reaktionsenthalpie) chemisches Gleichgewicht herrscht dann, wenn dG = 0 73 Jedes System strebt zwei „Zielen“ entgegen: 1.) Minimum der Energie 2.) Maximum der Entropie Minimum der pot. Energie Maximum der Entropie Tatsächliche Verteilung: Minimum der Freien Energie Dem Wettstreit zwischen beiden Bestrebungen trägt die Freie Energie Rechnung (bei konstanter Temperatur und konstantem Volumen). F =U −TS Wenn F minimal ist, sind beide Bestrebungen ausgewogen gut erfüllt. Bei niedriger Temperatur spielt die Energie die Hauptrolle, mit zunehmender Temperatur wird die Entropie immer wichtiger. 74 9 Solange ein System noch nicht im Gleichgewicht ist laufen Prozesse ab, bei denen sich die Entropie erhöht. Für reversible Prozesse gilt: T dS = δ Q Für irreversible Prozesse gilt: T dS ≥ δ Q Mit der Definition der Freien Energie folgt: d F ≤ dU −δ Q Und mit dem ersten Hauptsatz: d F ≤ dU − δ Q = δ W Wenn δW negativ ist, d.h. das System Arbeit leistet, ergibt sich: − δ W ≤ −d F Bei reversiblen Vorgängen leistet das System genau die Arbeit δW = dF bei irreversiblen Vorgängen leistet das System weniger Arbeit. 75 10