Sepsis und Endokarditis
Werbung

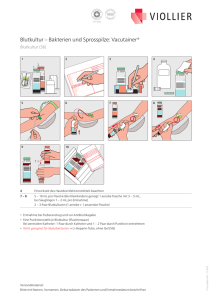
PIRO- Konzept der Sepsis • Prädisposition: – genetisch, Vorkrankheiten – aktuelle Grundkrankheit – permanente oder transiente Flora Mariana Bridi Die Ärzte in ihrem Heimatstaat Espírito Santo diagnostizierten zunächst Nierensteine. Später wurde dann ein Harnwegsinfekt festgestellt. Die Bakterien breiteten sich rasch aus. • Infektion: – externe Mikroorganismen – interne Flora • Reaktion: Weil nicht mehr genug Sauerstoff in die Extremitäten transportiert wurde, sahen sich die Ärzte gezwungen, zunächst die Füße und wenige Tage später auch noch die Hände zu amputieren, um ihr Leben zu retten. – Systemische Inflammation durch massive Zytokin-Expression – Fehlregulation von Abwehrprozessen • Organversagen: – – – – beginnt meist mit Ödemen Gerinnungsstörungen Septische Enzephalopathie u.a.m. Am 3. Januar wurde das Model wegen eines septischen Schocks ins Krankenhaus eingeliefert. Mariana Bridi starb an einer Urosepsis durch Pseudomomas aerugionosa Der Erreger erwies sich gegen die eingesetzten Antibiotika resistent. Spiegel-online 26. Jan. 2009 Systemische Entzündungsreaktion • Fieber ≥ 38°C oder Hypothermie ≤ 36°C (rectal gemessen!) • Tachykardie ≥ 90/min. • Tachypnoe ≥ 20/min oder Hyperventilation • Leukozytose oder Leukopenie oder mehr als 10 % unreife neutrophile Granulozyten. • Systemische Entzündungsreaktion kann auch nicht infektiöse Ursache haben, z. B. Trauma, Verbrennung. Ursachen des Fiebers • Exogene Pyrogene (~ 25 %): Mikroorganismen (Viren, Bakterien, Pilze, Parasiten) Mikrobielle Produkte (LPS, Peptidoglycan, DNA, Pilzantigene, Exotoxine) • Endogene Pyrogene Wirtsprodukte (Antigen-Antikörper-Komplexe, Komplementfaktoren) Zytokine (IL1, TNFα, Interferone, IL6, Prostaglandine) • • • • • • Malignome (~ 10-15 %) Nichtinfektiöse Vaskulitiden und Kollagenosen Rheumatologische Erkrankungen Granulomatosen und Autoimmunerkrankungen Endokrine und metabolische Störungen Primär neurologische Erkrankungen • Medikamente • Andere Ursachen (~ 20-30 %) (~ 40 %) Sepsis: 1. Nachweis einer mikrobiellen Infektion durch Blutkulturen oder andere Verfahren des direkten Erregernachweises 2. + zwei Kriterien der systemischen Entzündungsreaktion 3. Ist die Diagnose einer Infektion nur klinisch, nicht aber mikrobiologisch möglich, sind alle vier Kriterien der systemischen Entzündungsreaktion für die Definition der Sepsis erforderlich. • Die klinische Diagnose kann durch Laborparameter wie CRP, PCT u. a. gestützt werden. Schwere Sepsis • Sepsis und eine akute Organdysfunktion • akute Organdysfuktionen: – akute Enzephalopathie, eingeschränkte Vigilanz, Desorientiertheit – relative oder absolute Thrombopenie (z.B. bei DIC) – arterielle Hypoxaemie (akut) – venöse Dysfunktion – kapilläre Dysfunktion Ödem – metabolische Azidose Sepsis-Inzidenz Vergleich mit anderen Erkrankungen * * SepNet-Studie des BMBF-Kompetenznetzwerkes Sepsis Was wird zur Primärdiagnose der Sepsis benötigt? • • • • • Augen Ohren Anamnese Uhr Stethoskop • Verstand Ursachen der Sepsis ambulant erworben: nosokomial: Pneumonie Harnwegsinfektion Cholezystitis Wundinfektion Otitis media Meningitis Osteomyelitis Endokarditis Zentralvenenkatheter Langzeitbeatmung Polytrauma Peritonitis Urethralkatheter Immunosuppression/Neutropenie onkologische Grundkrankheit Diabetes mellitus Besiedelung der Nasenschleimhaut mit Staphylococcus aureus: 80-85% der Stämme aus Blutkulturen sind klonal identisch mit denen, die zuvor aus der Nase isoliert wurden! (C. v. Eiff et al. New Engl. J. Med. 344 (2001) 11-16) Sepsisherde bei Patienten aus der operativen ITS (%) internistischen ITS (%) Peritonitis 74 Pneumonie 27 HWI 9 Venenkatheter 6 andere 7 HWI Gastrointestinaltrakt Venenkatheter Pneumonie Haut Endokard Knochen andere * D-Streptokokken, Enterokokken in BK: Nach Colon-Ca suchen! 22 21* 16 12 8 2 1 16 Ambulant erworbene Pneumonie (CAP) Infektion wichtigste Erreger mikrob. Untersuchung (Lobärpneumonie) ambulante Bakterien (80 – 90 %) Pneumonie Streptococcus pneumoniae Haemophilus influenzae (5 %) Staphylococcus aureus (5 %) cave MRSA Anaerobe Mischflora (Aspirationspneumonie) Mikroskopie, Kultur aus Sputum (Leukozyten!) BAL, Blutkultur! Resistenzbestimmung s. o. s. o. Sputum ungeeignet, gezielte Biopsie, anaerober Materialtransport Im Krankenhaus erworbene Pneumonie (HAP) Nosokomiale Pneumonie häufig im Zusammenhang mit künstlicher Beatmung oder Aspiration! Enterobakterien (z.B. E. coli; Klebsiella spp.) Blutkultur, Resistenztestung! BAL, quantitativ! Pseudomonas aeruginosa s.o. Aspergillus spp. (meist A. fumigatus ) BAL, quantitativ Galactomanan-Nachweis im Blut Blutkultur Candida spp. Cave! Kontamination des Untersuchungsmaterials aus dem Respirationstrakt Staphylococcus epidermidis • Normalflora der Haut • pathogen durch extrazelluläre Schleimsubstanz Adhäsion an Geweben Adhäsion an polymeren Oberflächen Phagozytosehemmung • Stämme in Krankenhäusern meist multiresistent Penizillin 90%, Oxazillin 60% Medizinisch bedeutsame Biofilmproduzenten • • • • • • • • z.B.: Staphylococcus epidermidis Staphylococcus aureus Streptokokken ohne Gruppenantigen Enterobakterien Pseudomonas aeruginosa Candida albicans u.a.m. Chronischen Infektionen werden zu 65% bis 80 % durch Biofilm produzierende Mikroorganismen versursacht. PEG-Blutkulturstudie 2006/07 Infektlokalisationen in verschiedenen Altersgruppen (Fallzahl) 150 Harnwege Abdominalorgane 100 tiefe Atemwege 50 0 -18 19-39 40-59 60-69 70-79 80+ Jahre Empfehlungen für Abnahme einer Blutkultur Eine Blutentnahme - ein Flaschenpaar (aerob/anaerob) Sensitivität in nicht vorbehandelten Fällen: 1 BK: 80%, 2 (-3) BK: 99% Blutentnahme vor Behandlungsbeginn oder in Therapiepause, Ausnahme: Verdacht auf Fungämie Blutentnahme im Fieberanstieg keine Punktion entzündeter Hautareale arterielles Blut bringt keine Vorteile keine Entnahme aus Venenkathetern Wechsel der Kanüle bei Fehlpunktion hohe Kontaminationsrate Blutkultur - Hauptfehler Kontamination - Entnahme aus einem Venenkatheter (Kontaminationsrate > 9%!) - unsterile Handschuhe - kein Mundschutz - unzureichende Desinfektion (Haut, Flaschenstopfen) Falsch negatives Ergebnis - laufende Antibiotika-Therapie - lange Zwischenlagerung (auch bei 37°C) - kalte Flasche (Entnahme und Transport) 40 35 30 25 % 20 negative Blutkultur ? PEG 1983-85 PEG 1991-92 PEG 2000-01 PEG 2006-07 ARS 2008-09 •15 Der Nachweis einer Bakteriämie oder Fungämie mit Hilfe 10 der Blutkultur ist in weniger als 25 – 30 % der Fälle mit 5 klinischer Sepsis erfolgreich, bei ICU-Patienten weniger! 0 • Gründe: – vorherige oder laufende Therapie mit Antibiotika, – nicht anzüchtbare Erreger, – Fehler bei der Abnahme oder dem Transport. • Unter Antibiotikatherapie werden u.U. nur Kontaminanten angezüchtet. • Neuere Methoden zum Erregernachweis beziehen sich auf den Nachweis mikrobieller DNA. – DNA-Nachweis bedeutet nicht Nachweis lebender Erreger Nicht oder schwer anzüchtbare Sepsis-/Endokarditiserreger • Bakterien unter einer Antibiotika-Therapie • small colony variants von Staphylococcus aureus • Brucella melitensis, Brucella abortus • Legionella pneumophila • Bartonella henselae, Bartonella quintana • Borrelia burgdorferi sensu lato • Leptospira interrogans • atypische Mykobakterien (MOTT) • Tropheryma whippelii • Coxiella burnetii • Ehrlichia chaffeensis • Chlamydia psittaci, Chlamydia pneumoniae Bei der Sepsis besteht ein Zeitproblem! Es muss innerhalb der ersten Stunde nach klinischer Diagnose eine für den verursachenden Erreger passende Therapie begonnen werden. Ansonsten steigt die Sterblichkeit pro Stunde um 7%. Dilemma: • Gezielte Therapie erfordert Ergebnis der Resistenzbestimmung des Isolates aus der Blutkultur – Zeitbedarf der mikrobiologischen Blutkultur-Diagnostik etwa 4-5 Tage! • Kalkulierte Therapie erfordert Kenntnis der lokalen Resistenzsituation in der Klinik oder Station bei den in Frage kommenden Bakterien. – Kein direkter Bezug zum Patienten. Bei Sepsis entscheidet der Zeitpunkt des Beginns der Antibiotikatherapie ! A. Kumar et al. Crit. Care Med. 34 (2006) 1589-1596: Retrospektive Studie an 2731 Patienten mit septischem Schock Erregernachweis bei kulturnegativer Endokarditis * universelle PCR für Eubakterien (16s rRNA-Gen) universelle PCR für Eubakterien (5,8s rRNA-Gen, 25s rRNA-Gen) Streptococcus sp. Sraphylococcus epidermidis Staphylococcus aureus Enterobacter sp 3 1 1 1 Borrelia burgdorferi Tropheryma whippelii 1 1 Candida sp Aspergillus sp 1 2 negativ 2 * M.Grijalva et al. Heart 89 (2003) 263-268 Reduktion der Letalität der Sepsis durch eine adäquate Antibiotikatherapie adäquate Therapie Rello et al.: Am J Respir Crit Care Med 1997;156:196–200 inadäquate Therapie Alvarez-Lerma: Intensive Care Med 1996;22:387–394 Ibrahim et al.: Chest 2000;118:146–155 Luna et al.: Chest 1997;111:676–685 Garnacho-Montero et al.: Crit Care Med 2003;31:2742–2751 Vallés et al.: Chest 2003;123:1615–1624 0 20 40 60 Mortalität [%] 80 100 Vergleich BK - PCR 35 216 192 50% grampos. 42% gramneg. 8% Pilze 189,5 30 Tag 8 168 Tag 7 25 32,9 144 Stunden Tag 6 20 120 % Tag 5 96 15 Tag 4 74% grampos. 13% gramneg. 13% Pilze 14,2 72 Tag 3 48 Tag 2 24 10 24,7 5 Tag 1 0 0 Blutkultur VYOO durchschnittlicher Zeitbedarf (von der Blutabnahme bis zum Befund am Patienten) Blutkultur VYOO Detektionsrate Die Sensitivität der Blutkultur liegt theroretisch bei 110 lebenden Bakterien pro ml Blut. Diese Sensitivität wird durch die klassische PCR nicht erreicht. Höhere Sensitivitäten als die klassische PCR erreichen isothermale DNA-Amplifikationsverfahren. Mittels DNA-Amplifikationsverfahren lassen sich auch nicht kultivierbare Mikroorganismen nachweisen.