Sepsis
Werbung

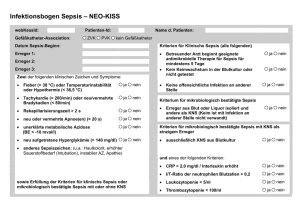
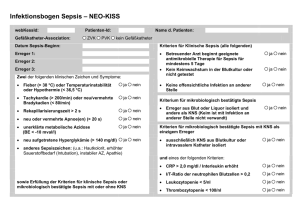
Sepsis Klassische Definition (Veraltet!) Eine Sepsis liegt dann vor, wenn sich innerhalb des Körpers ein infektiöser Herd gebildet hat, von dem aus Erreger streuen und so in peripheren Organen eine systemische Wirkung verursachen. Schottmüller‘sche Trias: Herd – Streuung – Systemischer Effekt H. Schottmüller, Verhandl. d. 31. Deutschen Kongresses für Innere Medizin 1914; XXXI:257-280 Neue Einteilung: SIRS: (Systemic Inflammatory Response Syndrom): • Fieber ≥ 38 oC oder Hypothermie ≤ 36°C (rektal gemessen!) • Tachykardie ≥ 90/min. • Tachypnoe ≥ 20/min oder Hyperventilation • Leukozytose oder Leukopenie oder mehr als 10 % unreife neutrophile Granulozyten. • SIRS kann auch nicht infektiöse Ursache haben, z. B. Trauma, Verbrennung. Sepsis: 1. Nachweis einer mikrobiellen Infektion durch Blutkulturen oder andere Verfahren des direkten Erregernachweises 2. + zwei SIRS-Kriterien 3. Ist die Diagnose einer Infektion nur klinisch, nicht aber mikrobiologisch möglich, sind alle vier SIRS-Kriterien für die Definition der Sepsis erforderlich. • Die klinische Diagnose kann durch Laborparameter wie CRP, PCT u. a. gestützt werden. Schwere Sepsis • Sepsis und eine akute Organdysfunktion • akute Organdysfuktionen: – akute Enzephalopathie, eingeschränkte Vigilanz, Desorientiertheit – relative oder absolute Thrombopenie (DIC) – arterielle Hypoxaemie (akut) – venale Dysfunktion – metabolische Azidose Was wird zur Primärdiagnose der Sepsis benötigt? • • • • • Augen Ohren Anamnese Uhr Stethoskop • Verstand Ursachen der Sepsis ambulant erworben: nosokomial: Pneumonie Harnwegsinfektion Cholezystitis Wundinfektion Otitis media Meningitis Osteomyelitis Zentralvenenkatheter Langzeitbeatmung Polytrauma Immunosuppression/Neutropenie onkologische Grundkrankheit Diabetes mellitus Besiedelung der Nasenschleimhaut mit Staphylococcus aureus: 80-85% der Stämme aus Blutkulturen sind klonal identisch mit denen, die zuvor aus der Nase isoliert wurden! (C. v. Eiff et al. New Engl. J. Med. 344 (2001) 11-16) Sepsisherde bei Patienten aus der operativen ITS (%) internistischen ITS (%) Peritonitis Pneumonie HWI Venenkatheter andere HWI Gastrointestinaltrakt Venenkatheter Pneumonie Haut Endokard Knochen andere 74 27 9 6 7 22 21 16 12 8 2 1 16 Sepsis-Inzidenz Vergleich mit anderen Erkrankungen Brustkrebs Kolonkarzinom 50 / 100.000 Einw.1 AIDS 17 / 100.000 Einw.1 schwere Sepsis Sepsis 1 2 110 / 100.000 Einw.1 Angus DC et al; Crit Care Med 2001; 29: 1303-1310 Martin GS et al, N Engl J Med 2003;348:1546-54 300 / 100.000 Einw.1 240 / 100.000 Einw.2 Empfehlungen für Abnahme einer Blutkultur Eine Blutentnahme - ein Flaschenpaar (aerob/anaerob) Sensitivität in nicht vorbehandelten Fällen: 1 BK: 80%, 2 (-3) BK: 99% Blutentnahme im Fieberanstieg Blutentnahme vor Behandlungsbeginn oder in Therapiepause, Ausnahme: Verdacht auf Fungämie keine Punktion entzündeter Hautareale arterielles Blut bringt keine Vorteile keine Entnahme aus Venenkathetern Wechsel der Kanüle bei Fehlpunktion hohe Kontaminationsrate Blutkultur - Hauptfehler Kontamination - Entnahme aus einem Venenkatheter (Kontaminationsrate > 9%!) - unsterile Handschuhe - kein Mundschutz - unzureichende Desinfektion (Haut, Flaschenstopfen) Falsch negatives Ergebnis - laufende Antibiotika-Therapie - lange Zwischenlagerung (auch bei 37°C) - kalte Flasche (Entnahme und Transport) Blutkulturen 2002 14,24 % Innere Medizin Anzahl: 8 517 Patienten: 1 334 10,16 % Anästhesiologische ITS Anzahl: 1 132 Patienten: 225 negative Blutkultur • Der Nachweis einer Bakteriämie oder Fungämie mit Hilfe der Blutkultur ist nur in etwa 25 – 30 % der Fälle mit klinischer Sepsis erfolgreich. • Gründe: – vorherige oder laufende Therapie mit Antibiotika, – nicht anzüchtbare Erreger, – Fehler bei der Abnahme oder dem Transport. • Neuere Methoden zum Erregernachweis beziehen sich auf den Nachweis mikrobieller DNA. – DNA-Nachweis bedeutet nicht Nachweis lebender Erreger Nicht oder schwer anzüchtbare Sepsis-/Endokarditiserreger • small colony variants von Staphylococcus aureus • Brucella melitensis, Brucella abortus • Legionella pneumophila • Bartonella henselae, Bartonella quintana • Borrelia burgdorferi sensu lato • Leptospira interrogans • atypische Mykobakterien (MOTT) • Tropheryma whippelii • Coxiella burnetii • Ehrlichia chaffeensis • Chlamydia psittaci, Chlamydia pneumoniae Erregernachweis bei kulturnegativer Endokarditis * universelle PCR für Eubakterien (16s rRNA-Gen) universelle PCR für Eubakterien (5,8s rRNA-Gen, 25s rRNA-Gen) Streptococcus sp. Sraphylococcus epidermidis Staphylococcus aureus Enterobacter sp 3 1 1 1 Borrelia burgdorferi Tropheryma whippelii 1 1 Candida sp Aspergillus sp 1 2 negativ 2 * M.Grijalva et al. Heart 89 (2003) 263-268 Bei der Sepsis besteht ein Zeitproblem! Es muss innerhalb der ersten Stunde nach klinischer Diagnose eine für den verursachenden Erreger passende Therapie begonnen werden. Ansonsten steigt die Sterblichkeit pro Stunde um 5%. Dilemma: • Gezielte Therapie erfordert Ergebnis der Resistenzbestimmung des Isolates aus der Blutkultur – Zeitbedarf der mikrobiologischen Blutkultur-Diagnostik etwa 4-5 Tage! • Kalkulierte Therapie erfordert Kenntnis der lokalen Resistenzsituation in der Klinik oder Station bei den in Frage kommenden Bakterien. – Kein direkter Bezug zum Patienten. Bei Sepsis entscheidet der Zeitpunkt des Beginns der Antibiotikatherapie ! A. Kumar et al. Crit. Care Med. 34 (2006) 1589-1596: Retrospektive Studie an 2731 Patienten mit septischem Schock Inadäquate Antibiotikatherapie ist ein Risikofaktor für die Krankenhausletalität Krankenhausletalität (%) 60 p <0.001 p <0.001 50 40 30 20 10 0 alle Ursachen Sepsis Inadäquate Antibiotikatherapie, n=169 Adäquate Antibiotikatherapie, n=486 Kollef MH et al. Chest; 1999 115:462-474 Harnwegsinfektion Ziele der bakteriologischen Urinuntersuchung: Nachweis eines relevanten Erregers Bestimmung der Keimzahl Bestimmung der Art, Spezies, (ggf. Serotyp) Bestimmung der Antibiotika-Resistenz Nachweis von Hemmstoffen Die physiologische Flora der Harnröhre enthält: Staphylococcus epidermidis u.a. koagulaseneg. Staphylokokken vergrünende Streptokokken Enterokokken Korynebakterien (Diphtheroide) Propionibakterien anaerobe Kokken Bacteroides sp. Mycoplasma sp. Enterobakterien in geringer Keimzahl! Quantitative bakteriologische Untersuchungen Mittelstrahlurin (Entnahmetechnik beachten!): Grenzwert nach KASS: 105 Bakterien einer Art pro ml Urin > 105 Bakterien / ml = signifikante Bakteriurie Bronchoalveoläre Lavage (BAL): Grenzwert nicht vereinbart Mittelstrahlurin ? Material: sterile Baumwolltupfer Seifenlösung warmes Leitungswasser steriles Einweggefäß Entnahme bei der Frau (evtl.mit Hilfsperson): 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Unterkörper völlig frei machen Hände sorgfältig waschen, mit Einweghandtuch trocknen mit einer Hand die Labien spreizen, geöffnet halten Vulva mit feuchtem Tupfer (Seifenwasser) von vorn nach hinten reinigen mit nassem Tupfer (Wasser) abspülen Orificium urethrae mit sterilem Tupfer trocknen trockenen Tupfer in den Introitus vaginae einlegen Harnstrahl laufen lassen Urinprobe aus dem laufenden Harnstrahl in sterilem Gefäß auffangen Probengefäß verschließen und beschriften Katheterurin keine Katheterisierung nur zur Uringewinnung! Urinentnahme aus dem laufenden Urinstrahl, Dauerkatheter: Punktion des desinfizierten Katheterschaftes, Blasenpunktion wenn Urinprobe anders nicht kontaminationsfrei gewonnen werden kann, bei fraglichen Befunden, z.B. wiederholten Mischkulturen Klebebeutel bei Säuglingen keine kontaminationsfreie Uringewinnung möglich! Konduit, Darmersatzblase (meist stark bakteriell besiedelt) Entnahme des frei tropfenden Urins nach Spülung mit Kochsalzlösung möglich, Eimalkatheter bei kontinentem Konduit (Blutkultur) Häufige Erreger von Harnwegsinfektionen akute, unkomplizierte Cystitis: Escherichia coli Proteus mirabilis Klebsiella sp. Stapylococcus saprophyticus komplizierte oder nosokomiale HWI: Escherichia coli Proteus mirabilis Proteus vulgaris Morganella morganii Providencia sp. Klebsiella sp. Enterobacter sp. Pseudomonas aeruginosa Enterococcus faecalis Nativurin Probentransport: 2 Stunden, gekühlt bis 24 Stunden, Konservierungsmittel verfälschen meist den Befund Vorteile: Makroskopische und mikroskopische Beurteilung möglich, Hemmstofftest möglich Nachteile: begrenzte Transportzeit, Aufbewahrung sinnlos Urintauchkultur Vorteile: längere Transportzeit wir toleriert, Keimzahl durch Transport nicht beeinflußt, Nachteile: Makroskopische und mikroskopische Beurteilung nicht möglich, Hemmstofftest nicht möglich, falsch negativer Befund durch Hemmstoffe, Keimzahlbestimmung ungenau, unsicher bei anspruchsvollen Bakterien, Erregerspektrum der katheterassoziierten Harnwegsinfektion Kurzzeitkatheter 24 8 6 9 Escherichia coli Klebsialla spp. Proteus spp. Pseudomonas aeruginosa Providencia stuartii Morganella morganii andere Gram negative Bakterien Enterococcus spp. Koagulase-neg. Staphylokokken andere Gram positive Bakterien Hefen 7 7 8 4 26 Langzeitkatheter 14 4 15 12 24 7 6 11 3 4 Unsinnige Methoden / ungeeignete Materialien bei der bakteriologischen Urindiagnostik • Kultur aus zentrifugiertem Urinsediment • anaerobe Kultur • Resistenzbestimmung auf Eintauchkultursystemen • Harnröhrenabstriche (indiziert nur bei Urethritis!) • Harnwegskatheter-Spitzen • in Nährbouillon aufgenommene Urinproben • Urinproben, deren Transportzeit (2h) überschritten ist